Перейти к:
Такой непростой “простой” пациент с хронической сердечной недостаточностью: констриктивный перикардит. Клинический случай
https://doi.org/10.15829/1728-8800-2025-4231
EDN: SUXOAG
Аннотация
Констриктивный перикардит (КП) — редкое заболевание, имеющее различные причины развития. В конце XX века этиология этого заболевания часто ассоциировалась с туберкулезом, однако в последнее время в развитых странах возросла роль кардиохирургических вмешательств. КП трудно диагностировать из-за отсутствия специфических проявлений. Заболевание характеризуется симптомами венозного застоя по большому кругу кровообращения вследствие нарушения диастолического наполнения. При сердечной недостаточности кальцификация перикарда часто не выявляется на рентгенограмме грудной клетки, и верификация диагноза в клинической практике осуществляется по данным допплеровской эхокардиографии.
Клиническое наблюдение. Мужчина 60 лет госпитализирован в больницу в ноябре 2020г с жалобами на прогрессирующие одышку, отеки нижних конечностей и передней стенки живота, поясницы, увеличение живота в объеме. В 2012г выполнено аортокоронарное шунтирование по поводу многососудистого поражения коронарных артерий. С 2018г появились вышеуказанные жалобы. Клинические проявления расценены как развитие хронической сердечной недостаточности на фоне ишемической кардиомиопатии. Назначенная комплексная терапия не дала эффекта, а состояние пациента ухудшалось: продолжала прогрессировать одышка, отечно-асцитический синдром. Встал вопрос о необходимости уточнения причины нарастания застойных явлений по большому кругу кровообращения. С учетом данных анамнеза и объективного обследования в круг диагностического поиска были включены тромбоэмболия легочной артерии, пороки сердца, перикардит, а также экстракардиальная патология с развитием отечно-асцитического синдрома. Диагноз КП был установлен на основании клинической картины, данных эхокардиографии и компьютерной томографии органов грудной клетки. В апреле 2021г пациенту выполнена перикардэктомия. В дальнейшем отмечена положительная динамика клинико-инструментальных показателей с исчезновением одышки, отеков, повышение сократительной способности миокарда.
Заключение. Редкая встречаемость заболевания, длительный период отсутствия проявлений после кардиохирургического вмешательства, неспецифическая симптоматика и наличие сопутствующих заболеваний привели к отсроченной диагностике КП. Клинической особенностью данного заболевания представляется сложность диагностики и использование единственного метода лечения (перикардэктомия), позволяющего улучшить прогноз пациента.
Для цитирования:
Ванхин В.В., Ильина Ю.В., Рыбакова М.К., Федорова Т.А., Тазина С.Я., Сотникова Т.И., Семененко Н.А., Лощиц Н.В., Павлов Ч.С. Такой непростой “простой” пациент с хронической сердечной недостаточностью: констриктивный перикардит. Клинический случай. Кардиоваскулярная терапия и профилактика. 2025;24(2):4231. https://doi.org/10.15829/1728-8800-2025-4231. EDN: SUXOAG
For citation:
Vankhin V.V., Ilyina Yu.V., Rybakova M.K., Fedorova T.A., Tazina S.Ya., Sotnikova T.I., Semenenko N.V., Loshchits N.V., Pavlov Ch.S. Such an unsimple "simple" patient with heart failure: constrictive pericarditis: case report. Cardiovascular Therapy and Prevention. 2025;24(2):4231. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4231. EDN: SUXOAG
Введение
Хроническая сердечная недостаточность (ХСН) продолжает оставаться серьезной проблемой в современной медицине, несмотря на последние успехи в разработке эффективных медикаментозных и хирургических методов лечения пациентов. Заболеваемость и смертность от данного заболевания остаются высокими, а прогноз — неблагоприятным [1]. В структуре причин, приводящих к развитию ХСН, лидирующее место занимают ишемическая болезнь сердца (ИБС), артериальная гипертония и их сочетание. Не следует забывать и о других причинах развития ХСН, а также о сочетании нескольких патологий, способствующих развитию и прогрессированию сердечной недостаточности.
Констриктивный перикардит (КП), как причина развития ХСН, представляется редким и одним из диагностически сложных заболеваний. Истинная распространенность КП неизвестна. По данным литературы, у 0,2-0,4% пациентов, перенесших операции на сердце, после травмы, развивается воспаление перикарда различной этиологии. В странах с низким доходом населения наиболее частой причиной КП является туберкулезная инфекция, в то время как в странах с более высоким уровнем дохода все большее количество случаев обусловлено ятрогенными причинами (последствия лучевой терапии, перенесенные кардиохирургические вмешательства, электрофизиологические процедуры, чрескожные вмешательства (ЧКВ) в анамнезе) [2]. КП может явиться исходом посткардиотомного синдрома, который развивается у 15-30% пациентов, перенесших оперативное вмешательство на сердце, и ассоциирован с более тяжелыми исходами [3]. Точный патогенез данного осложнения до сих пор до конца не изучен. Среди возможных причин рассматривают: аутоиммунный процесс, а также непосредственно механическое воздействие на перикард, наличие крови и сгустков в перикарде во время операции и в послеоперационном периоде, возможное воздействие на серозную оболочку перикарда антисептиков [4-6]. Симптомы заболевания могут проявиться как в первый месяц после оперативного вмешательства, так и через несколько лет [7][8]. Диагноз КП часто упускается из виду, и пациенты проходят многочисленные исследования, поскольку симптоматика имитирует ряд заболеваний сердечно-сосудистой системы, легких, печени, сопровождающихся развитием отечно-асцитического синдрома. В результате, диагноз нередко определяется с большой задержкой или не ставится вовсе.
Включение КП в дифференциальный диагноз у пациентов с выраженными признаками правожелудочковой недостаточности имеет важное значение, поскольку своевременное лечение, включая тотальную перикардэктомию, улучшает качество жизни и обеспечивает долгосрочную выживаемость пациента.
В работе представлено клиническое наблюдение пациента с КП, развившимся спустя несколько лет после перенесенного аортокоронарного шунтирования (АКШ).
Клинический случай
Информация о пациенте
Мужчина 60 лет госпитализирован в больницу 11.2020г с жалобами на прогрессирующую одышку, нарастающие отеки нижних конечностей, передней стенки живота, поясницы, увеличение живота в объеме, чувство тяжести в правом подреберье (рисунок 1).
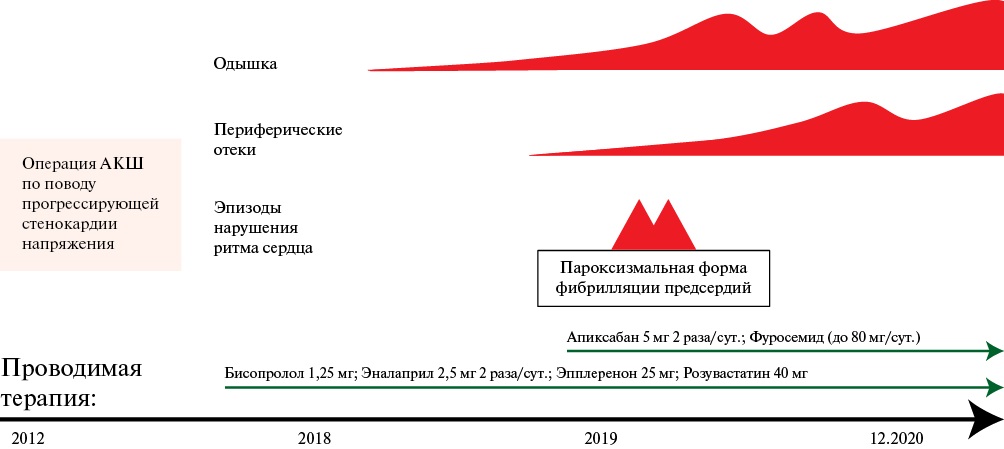
Рис. 1 Временнáя шкала развития КП.
Примечание: АКШ — аортокоронарное шунтирование, КП — констриктивный перикардит.
Результаты физикального осмотра
Состояние пациента тяжелое. Температура тела нормальная. Кожные покровы бледные. Мягкие отеки голеней, стоп, нижней трети бедер, передней стенки живота, поясницы. Дыхание везикулярное, резко ослаблено билатерально ниже 4 ребра. Частота дыхательных движений 24/мин. Тоны сердца приглушены, ритм правильный, шум не выслушивается. Частота сердечных сокращений 62 уд./мин, артериальное давление 105/65 мм рт.ст. Положительный симптом Куссмауля. Живот увеличен в размерах за счет асцита. Печень пальпируется на 5-6 см ниже правого края реберной дуги, плотноэластической консистенции, при пальпации безболезненна.
Известно, что пациент длительно страдает гипертонической болезнью. Стенокардия беспокоила с 2011г. В ноябре 2012г выполнено плановое АКШ по поводу многососудистого поражения коронарных артерий, пери- и послеоперационных осложнений зафиксировано не было. С 2018г появились жалобы на появление и прогрессирование одышки, отеков нижних конечностей, передней брюшной стенки, увеличение живота в объеме. В связи с данными симптомами неоднократно проводилось стационарное обследование. Состояние расценивалось как ХСН на фоне ишемической кардиомиопатии. В 2019г зарегистрирована пароксизмальная форма фибрилляции предсердий.
Предварительный диагноз
Жалобы пациента и данные клинического осмотра указывали на декомпенсацию ХСН. Обращали на себя внимание признаки преимущественного застоя по большому кругу кровообращения: массивные периферические отеки, положительный венный пульс. В связи с этим обсуждали диагнозы тромбоэмболии легочной артерии (ТЭЛА), легочную гипертензию, связанную с патологией легких, клапанную патологию, заболевания перикарда и миокарда, а также исключались другие заболевания, которые сопровождаются отечно-асцитическим синдромом (цирроз печени, тромбоз воротной вены).
Диагностическая оценка
При поступлении клинический анализ крови без отклонений. В биохимическом анализе отмечалась гипопротеинемия (40 г/л) и гипоальбуминемия (20 г/л). Печеночные ферменты, С-реактивный белок — в пределах нормы. В коагулограмме снижение протромбина (69%). Других отклонений от нормы не выявлено.
По шкале Wells у пациента имелся низкий риск ТЭЛА, по шкале Geneva — 0 баллов, в связи с чем диагноз ТЭЛА маловероятен.
На рентгенограмме органов грудной клетки выявлены признаки правостороннего гидроторакса, без признаков инфильтративных изменений и кальцификации перикарда (рисунок 2).
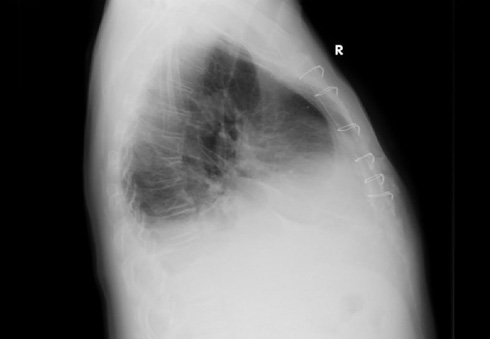
Рис. 2 Рентгенограмма органов грудной клетки (прямая проекция и правый бок).
Больному выполнена плевральная пункция, при которой получено 1750 мл желтой серозной жидкости (белок 4 г/л, фибрин отсутствует). При цитологическом анализе плевральной жидкости данных за атипичные клетки, кислотоустойчивые микроорганизмы не получено.
При ультразвуковом исследовании органов брюшной полости выявлена умеренная гепатомегалия (эхогенность паренхимы печени повышена, текстура крупнозернистая). Воротная вена не расширена. Выявлено ~500 мл свободной жидкости в брюшной полости.
Электрокардиография (ЭКГ): Вертикальное положение электрической оси сердца. Синусовая брадикардия с частотой сердечных сокращений 50 уд./мин. Снижение вольтажа. Межпредсердная блокада I ст.
Проведена эхокардиография (ЭхоКГ) экспертного уровня. При исследовании отмечена дилатация левого (ЛП =44×50 мм) и правого предсердий (46×51 мм). Полости желудочков уменьшены — правый желудочек (ПЖ) 19 мм; левый желудочек (ЛЖ) 42 мм. Створки клапанов не изменены. Систолическая функция желудочков умеренно снижена: фракция выброса (ФВ) ЛЖ 38% по Симпсону. ФВ ПЖ — 32% по Симпсону. Зоны нарушения локальной сократимости не выявлены. Умеренная митральная и умеренная трикуспидальная регургитация. Зависимость скорости кровотока на трикуспидальном клапане от акта дыхания умеренная. Значительная легочная гипертензия. Систолическое давление в легочной артерии — 46-51 мм рт.ст. Нарушение диастолической функции желудочков 2 тип — отношение пиковой скорости раннего диастолического трансмитрального потока к пиковой скорости раннего диастолического движения латеральной части митрального фиброзного кольца (Е/е) =18. Зависимость скорости кровотока от акта дыхания на митральном клапане незначительная — ~15%, на трикуспидальном клапане умеренная — ~20%. Реципрокность скоростей кровотока в левых и правых камерах. Деформация миокарда ЛЖ снижена =-14% (в норме ≥-18%). Пиковая скорость кровотока (пик s) со стороны левого фиброзного кольца снижена до 0,05 и 0,06 м/сек, соответственно, в точках исследования медиального и латерального края т.е. <0,07 м/сек (в норме); пик s со стороны правого фиброзного кольца снижена до 0,05 м/сек, соответственно, в точке исследования бокового края т.е. <0,15 м/сек (в норме). Выявлены следующие признаки КП: плевроперикардиальные спайки по боковой стенке ЛЖ, "хаотические" движения межжелудочковой перегородки (МЖП), листки перикарда утолщены, сращены между собой (рисунок 3). Кальцификация и сращение листков перикарда была более выражена преимущественно за боковой стенкой ПЖ (правожелудочковая форма поражения) (рисунок 4). В плевральных полостях содержалось большое количество жидкости, как и в брюшной полости на фоне синдрома сдавления полых вен (рисунок 5).
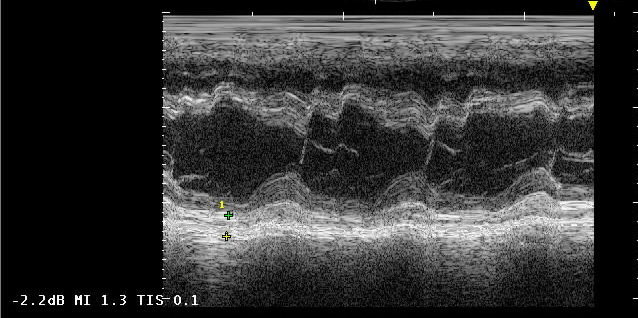
Рис. 3 М-режим ЭхоКГ. Утолщение и сращение листков перикарда по задней стенке ЛЖ и их однонаправленное движение. Хаотическое движение МЖП, типичное для КП.
Примечание: КП — констриктивный перикардит, ЛЖ — левый желудочек, МЖП — межжелудочковая перегородка, ЭхоКГ — эхокардиография.
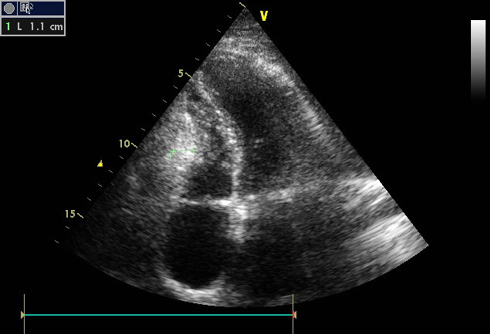
Рис. 4 В-режим ЭхоКГ. Апикальная 4-камерная позиция. Полости желудочков уменьшены в объеме, кальциноз и сращение листков перикарда преимущественно по боковой стенке ПЖ.
Примечание: ПЖ — правый желудочек, ЭхоКГ — эхокардиография.
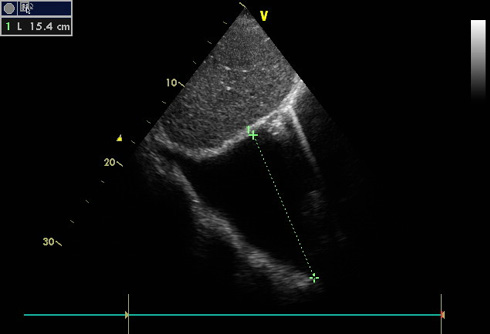
Рис. 5 В-режим ЭхоКГ. Большое количество жидкости в правой плевральной полости ~1500 мл.
Примечание: ЭхоКГ — эхокардиография.
Таким образом, полученные данные соответствовали ЭхоКГ-критериям КП (таблица 1).
Таблица 1
Признаки КП по данным ЭхоКГ
|
М-режим |
В-режим |
|
• Уплотнение и утолщение париетального листка перикарда (в норме толщина париетального листка перикарда не превышает 5 мм). Уплотнение и утолщение висцерального листка перикарда. Срастание листков перикарда и их однонаправленное движение в систолу и в диастолу • Увеличение глубины волны А при движении задней створки легочного клапана • Преждевременное диастолическое открытие легочного клапана • Быстрое раннее и горизонтальное среднедиастолическое движение задней стенки ЛЖ • Быстрое раннее и горизонтальное среднедиастолическое движение створок аортального клапана и корня аорты • Движение МПП назад в систолу. МПП движется вперед или назад в раннюю диастолу (патологическое движение МПП) и в систолу |
• Уплотнение обоих листков перикарда, их кальцификация, спайки и сращение его листков. Их однонаправленное движение в систолу и диастолу • Организация жидкости между листками перикарда и наличие трехслойного плотного перикарда • Незначительная дилатация предсердий при нормальном или уменьшенном размере желудочков. Частое выбухание МПП в сторону ЛП • Дилатация нижней полой вены и печеночных вен и эффект спонтанного контрастирования (стагнация крови) • Парадоксальное движение межжелудочковой и МПП влево на вдохе и ее "хаотическое дрожание" |
Примечание: КП — констриктивный перикардит, ЛЖ — левый желудочек, ЛП — левое предсердие, МПП — межпредсердная перегородка, ЭхоКГ — эхокардиография.
Для уточнения наличия констрикции выполнена компьютерная томография (КТ) органов грудной клетки: сердце в размерах не увеличено, в области передненижних отделов полости перикарда определяется отграниченное скопление жидкости (94×95×33 мм) с включениями кальцинатов в полости и в листках перикарда (рисунки 6, 7). Отмечены участки кальцификации миокарда в области ПЖ.
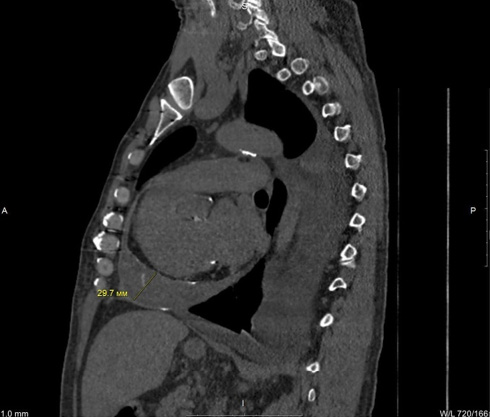
Рис. 6 КТ в режиме мягкие ткани (сагиттальный срез). Выделено отграниченное скопление жидкости с включениями кальцинатов в перикарде.
Примечание: КТ — компьютерная томография.
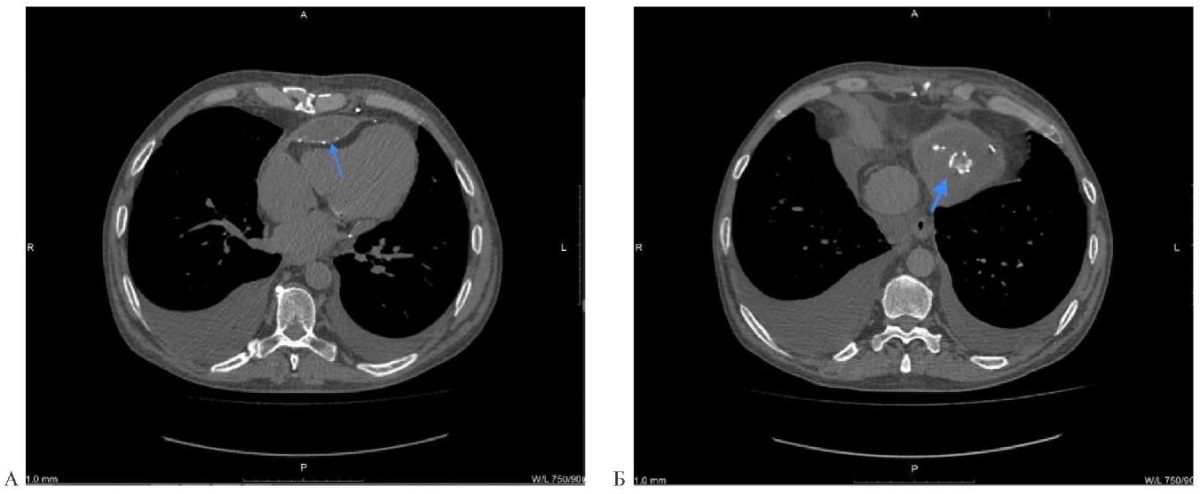
Рис. 7 (А и Б) КТ в режиме мягкие ткани (аксиальный срез). Стрелкой выделены участки кальцификации миокарда в области ПЖ.
Примечание: КТ — компьютерная томография, ПЖ — правый желудочек.
Выявленные констриктивные изменения в перикарде потребовали дообследования пациента для уточнения причины. Туберкулезная природа заболевания была исключена на основании отрицательного диаскин-теста, отрицательного анализа на микобактерии туберкулеза в плевральной жидкости и квантиферонового теста, а также отсутствия типичных изменений легочной ткани по результатам КТ органов грудной клетки. Маркеры аутоиммунного воспаления были также отрицательные, что позволило исключить перикардит как проявление системного заболевания соединительной ткани.
В лабораторно-инструментальных исследованиях отсутствовали показатели воспалительного процесса, в связи с чем от противовоспалительной и антибактериальной терапии было решено воздержаться.
Клинический диагноз
Таким образом, на основании анамнеза, клинических данных и проведенного обследования был установлен диагноз: 1. Хронический послеоперационный КП. 2. ИБС. Атеросклероз коронарных артерий. Маммарокоронарное шунтирование (МКШ) левая внутренняя грудная артерия — 2 маммарные артерии, АКШ — правая внутренняя грудная артерия — диагональная артерия, аутовенозное АКШ — передняя межжелудочковая ветвь от 2012г. Коронарная ангиография от 2018г: шунты проходимы, стеноз огибающей артерии 70% в проксимальной трети, 55% в средней трети. Пароксизмальная форма фибрилляции предсердий. Риск тромбоэмболических осложнений 3 балла по шкале оценки риска инсульта CHA2DS2-VASC (Congestive heart failure, Hypertension, Age (2 ball), Diabetes mellitus, Stroke (2 ball), Vascular disease, Age, Sex category).
Фоновое заболевание. Гипертоническая болезнь III стадии. Контролируемая артериальная гипертония. Изолированная гиперхолестеринемия. ИБС. ХСН. Риск сердечно-сосудистых осложнений очень высокий. Целевое артериальное давление <130/<80 мм рт.ст.
Осложнения: ХСН со сниженной ФВ (38%) II Б, III функциональный класс по NYHA (New York Heart Association).
Медицинские вмешательства
Учитывая тот факт, что пациент поступил в стационар с явлениями декомпенсации ХСН, для более объективной оценки рисков проведения операции перикардэктомии была назначена консервативная терапия. Проводились повторные плевральные пункции. На фоне лечения была отмечена положительная динамика: уменьшились одышка, периферические отеки, повысилась толерантность к физическим нагрузкам. На ЭхоКГ отмечено повышение ФВ ЛЖ до 43%, ФВ ПЖ 38% по Симпсону. В правой плевральной полости ~1100-1200 мл однородной жидкости, слева ~400 мл. В рамках подготовки к оперативному вмешательству выполнена коронарошунтография. Тип кровоснабжения: левый. Ствол левой коронарной артерии с неровными контурами. Передняя нисходящая артерия — окклюзия от устья, заполняется по маммарно-коронарному шунту (МКШ). Огибающая артерия — стеноз до 70% в проксимальном отделе, протяженный стеноз в среднем отделе до 60-70%. Правая коронарная артерия слаборазвита, проходима. МКШ передней нисходящей артерии, артериовенозные шунты к диагональной ветви (АВШ-ДВ) и к ветви тупого края (АВШ-ВТК) проходимы.
После компенсации явлений сердечной недостаточности пациенту была выполнена перикардэктомия. Через 4 нед. после операции состояние пациента с выраженной положительной динамикой: больного перестала беспокоить одышка, отеки нижних конечностей и асцит отсутствовали, сохранялся незначительный гидроторакс.
Динамика и исходы
Спустя 4 мес. после оперативного лечения при проведении ЭхоКГ: незначительная дилатация ЛП и правого предсердия, полости желудочков нормальные в объеме. Систолическая функция желудочков удовлетворительная. Зоны нарушения локальной сократимости не выявлены. Характерное движение МЖП на фоне внутрижелудочковой блокады и АКШ в анамнезе. В базальном отделе задней стенки ЛЖ сохранен участок констрикции. В правой плевральной полости ~380-400 мл неоднородной жидкости и немного жидкости выше по междолевой плевре сзади, слева жидкости нет. Нижняя полая вена (НПВ) 25 мм в диаметре, на вдох реагирует на 50%. Асцита нет. Незначительная митральная регургитация и умеренная трикуспидальная регургитация — норма. Незначительная легочная гипертензия. Систолическое давление в легочной артерии — 37 мм рт.ст. На фоне лечения диастолическая функция ЛЖ и ПЖ улучшилась по сравнению с констриктивной фазой — 2-ой тип нарушения перешел в 1-ый тип нарушения диастолической функции. На фоне улучшения систолической функции ЛЖ и ПЖ после оперативного лечения увеличились скорости пиков s движения левого и правого фиброзных колец до нормы (тканевой режим) (рисунок 8 А, Б).
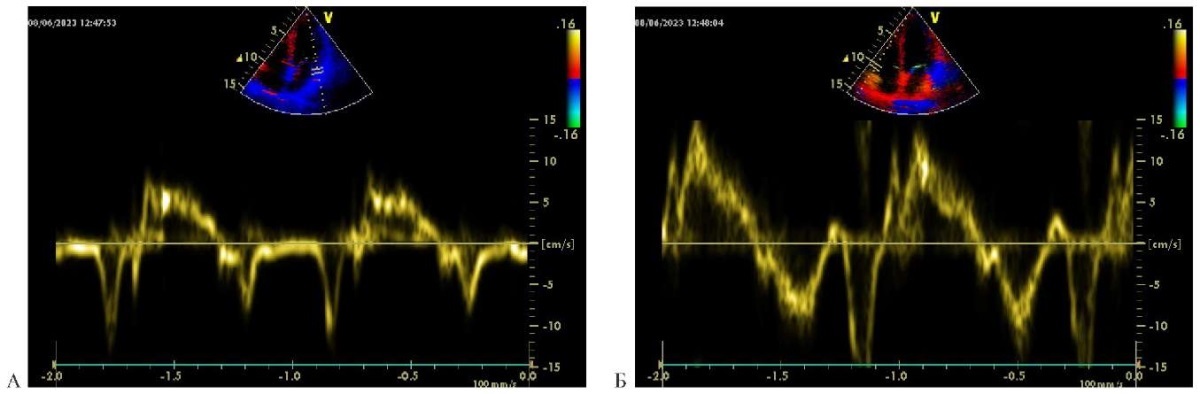
Рис. 8 Тканевой импульсно-волновой допплер: А) график движения бокового края левого фиброзного кольца. Скорость пика s 0,8 см/сек — норма; Б) график движения бокового края правого фиброзного кольца. Скорость пика s 0,15 см/сек — норма.
Примечание: цветное изображение доступно в электронной версии журнала.
При ЭхоКГ исследовании в динамике через 11 мес. после оперативного лечения отмечается значительное улучшение сократительной способности сердца: ФВ ЛЖ 52% по Симпсону, ФВ ПЖ 56%. Уменьшились размеры камер сердца — ПЖ 22 мм, ЛП 38×58 мм, ЛЖ 47 мм. Характерные движения МЖП на фоне внутрижелудочковой блокады и АКШ в анамнезе. В базальном отделе задней стенки ЛЖ сохранен участок констрикции. В правой плевральной полости ~1200 мл однородной жидкости, слева жидкости нет. Спайки в правой плевральной полости. Незначительная митральная и умеренная трикуспидальная регургитация. Признаков легочной гипертензии нет. Асцита нет. При дальнейшем контроле количество жидкости в плевральной полости постепенно уменьшалось без проведения плевральных пункций.
Обсуждение
КП — редкое и прогностически неблагоприятное заболевание, не имеющее специфической клинической картины.
Вследствие развития констрикции висцеральный и париетальный листки перикарда утолщаются, происходит их облитерация. Перикард превращается в толстый фиброзный, часто кальцифицированный, слой, что приводит к нарушению диастолы. Результатом данных гемодинамических изменений является появление сначала тахикардии и слабости, а со временем — одышки и отечного синдрома, что и наблюдалось у нашего пациента. Вследствие ограничения венозного возврата к правым и левым камерам сердца, в клинической картине преобладает застой по большому кругу кровообращения. Возникают отеки, бендопноэ (одышка при наклонах), характерно наличие асцита и рецидивирующего плеврального выпота. Застой в малом круге и ортопноэ нехарактерны, однако в случае развития у больного КП на фоне другой кардиальной патологии, возможно сочетание застойных явлений в малом и большом кругах кровообращения. В нашем случае именно это и послужило причиной отсроченной диагностики КП, т.к. причиной ХСН у пациента предполагалась систолическая дисфункция ЛЖ вследствие ишемической кардиомиопатии.
Дифференциальный диагноз необходимо проводить, прежде всего, с другими причинами ХСН с нормальной сократимостью ЛЖ, сопровождающимися застоем по большому кругу кровообращения: правожелудочковая недостаточность различной природы, трикуспидальная недостаточность, тампонада сердца, а также с рядом заболеваний других органов. Диагноз КП практическому врачу помогает поставить ЭхоКГ исследование, которое уже на начальном этапе позволяет выявить диссоциацию внутригрудного и внутрисердечного давления и может быть достаточным для постановки диагноза. Нарушения гемодинамики при КП аналогичны таковым при тампонаде сердца. За счет срастания листков перикарда между собой, сдавления камер сердца и резкого нарушения систолической функции желудочков существует своеобразная "конкуренция" между ПЖ и ЛЖ. Это приводит к росту объема ПЖ на вдохе за счет смещения МЖП в сторону ЛЖ. Объем ПЖ увеличивается и реципрокно ему падает объем ЛЖ на вдохе. При ЭхоКГ на вдохе видно увеличение ПЖ и открытие трикуспидального клапана, уменьшение объема ЛЖ и открытие митрального и аортального клапанов. На выдохе увеличиваются объем ЛЖ и открытие створок митрального и аортального клапанов и уменьшаются объем ПЖ и открытие трикуспидального и легочного клапанов. Допплер-ЭхоКГ подтверждает эти изменения. Основным буфером, изгоняющим кровь из желудочков в магистральные сосуды, является МЖП, которая движется хаотически. При КП выражена зависимость скорости кровотока на клапане от фазы дыхания.
Тканевой импульсный допплер при КП позволяет косвенно оценить степень нарушения систолической и диастолической функций желудочков. Снижение скорости пика s, часто увеличение скорости пика е по отношению к малому пику а, т.е. нарушение диастолической функции желудочков по 2-му типу по классической классификации, эти изменения регистрировались при обследовании нашего пациента. Однако в ряде случаев сохраняется 1-ый тип нарушения диастолы по классической классификации, иначе говоря, происходит значимое снижение систолической функции желудочков и значимое нарушение диастолической функции желудочков.
Следует отметить, что ЭхоКГ не является единственным и решающим методом верификации диагноза. Нередко может потребоваться КТ или магнитно-резонансная томография сердца, что также нами было выполнено для уточнения наличия кальцификации.
В большинстве случаев КП имеет хроническое прогрессирующее течение. Проводимая диуретическая терапия носит симптоматический характер, что и наблюдалось у нашего пациента. Единственным радикальным и эффективным методом лечения является хирургическая перикардэктомия [9], в ходе которой удаляется как можно больший объем перикарда, включая диафрагмальный и заднебоковой перикард. Неполная резекция связана с повышенным риском рецидива КП и снижением выживаемости.
Хотя КП встречается нечасто, его следует учитывать при появлении необъяснимой одышки после АКШ. Считается, что это заболевание может развиться спустя длительный срок после операции [8], поэтому важно проявлять клиническую настороженность для его раннего выявления. В нашем случае от начала заболевания до постановки диагноза прошло около трёх лет.
Представленное наблюдение подчеркивает необходимость высокой степени клинической настороженности при прогрессирующем отёчно-асцитическом синдроме, рефрактерном к медикаментозной терапии. Однако, как было продемонстрировано у нашего больного, еще более сложным представляется дифференциальный диагноз, когда КП сопровождается снижением сократительной функции ЛЖ.
Это заболевание следует включать в спектр диагностического поиска при развитии ХСН с преобладанием симптоматики застоя по большому кругу кровообращения.
Заключение
Своевременное выявление КП в реальной клинической практике представляет определенные сложности, что обусловлено, в первую очередь, наличием схожей симптоматики с рядом других заболеваний (кардиальной патологией, сопровождающейся развитием ХСН, ТЭЛА, а также экстракардиальной патологией) и требует проведения дифференциальной диагностики для их исключения. В настоящее время существенно возросло число больных КП, развившимся в результате кардиохирургических вмешательств. Кроме того, трудности могут быть обусловлены наличием у больного сопутствующей ХСН из-за других причин и при наличии одновременно констрикции и рестрикции (как, например, при лучевом поражении сердца). ЭхоКГ является важным методом диагностики КП. Единственным методом, улучшающим прогноз больных, является перикардэктомия. Больные, перенесшие перикардэктомию, должны находиться под диспансерным наблюдением, учитывая возможность рецидива.
Информированное согласие
От пациента получено письменное добровольное информированное согласие на публикацию описания клинического случая (дата подписания 10/06/2024).
Разрешения на перепубликацию, лицензирование
Каждый представленный в рукописи графический объект являются авторскими и не заимствованы из других источников.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Поляков Д. С., Фомин И. В., Беленков Ю. Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
2. Adler Y, Charron P. The 2015 ESC Guidelines on the diagnosis and management of pericardial diseases. Eur Heart J. 2015; 36:2874. doi:10.1093/eurheartj/ehv318.
3. Maranta F, Cianfanelli L, Grippo R, et al. Post-pericardiotomy syndrome: insights into neglected postoperative issues. Eur J Cardiothorac Surg. 2022;61:505-14. doi:10.1093/ejcts/ezab449.
4. Engle MA, Zabriskie JB, Senterfit LB. Heart-reactive antibody, viral illness, and the postpericardiotomy syndrome. Correlates of a triple-blind, prospective study. Trans Am Clin Climatol Assoc. 1976;87:147-60.
5. Engle MA, Zabriskie JB, Senterfit LB, et al. Immunologic and virologic studies in the postpericardiotomy syndrome. J Pediatr. 1975; 87(6 Pt 2):1103-8. doi:10.1016/s0022-3476(75)80122-3.
6. Engle MA, McCabe JC, Ebert PA, et al. The Postpericardiotomy syndrome and antiheart antibodies. Circulation. 1974;49(3):401-6. doi:10.1161/01.cir.49.3.401.
7. Dardas P, Tsikaderis D, Ioannides E, et al. Constrictive pericarditis after coronary artery bypass surgery as a cause of unexplained dyspnea: a report of five cases. Clin Cardiol. 1998;21(9):691-4. doi:10.1002/clc.4960210917.
8. Killian MD, Furiasse JG, Scanlon PJ, et al. Constrictive pencarditis after cardiac surgery. Am Heart J. 1989;118(3):563-8. doi:10.1016/0002-8703(89)90273-1.
9. Арутюнов Г. П., Палеев Ф. Н., Тарловская Е. И. и др. Перикардиты. Клинические рекомендации 2022. Российский кардиологический журнал. 2023;28(3): 5398. doi:10.15829/1560-4071-2023-5398.
Об авторах
В. В. ВанхинРоссия
Вера Владимировна Ванхин — аспирант кафедры терапии, врач терапевтического отделения № 2
Москва
Ю. В. Ильина
Россия
Юлия Валентиновна Ильина — к.м.н., доцент кафедры терапии ИПО; преподаватель Учебного центра
Москва
М. К. Рыбакова
Россия
Марина Константиновна Рыбакова — д.м.н., профессор кафедры ультразвуковой диагностики
Москва
Т. А. Федорова
Россия
Татьяна Алексеевна Федорова — д.м.н., профессор кафедры терапии ИПО
Москва
С. Я. Тазина
Россия
Серафима Яковлевна Тазина — д.м.н., профессор кафедры терапии ИПО
Москва
Т. И. Сотникова
Россия
Татьяна Ивановна Сотникова — к.м.н., доцент кафедры терапии;, врач-ревматолог
Москва
Н. А. Семененко
Россия
Наталья Александровна Семененко — к.м.н., доцент кафедры терапии ИПО; преподаватель Учебного центра
Москва
Н. В. Лощиц
Россия
Наталья Вячеславовна Лощиц — зав. терапевтическим отделением № 2
Москва
Ч. С. Павлов
Россия
Чавдар Савов Павлов — д.м.н., профессор, зав. кафедрой терапии ИПО, в.н.с.
Москва
Дополнительные файлы
- Диагноз констриктивного перикардита требует высокой степени клинической настороженности, т.к. клиническая картина этого заболевания схожа с проявлениями других заболеваний.
- Представлен случай 60-летнего пациента, у которого симптомы правожелудочковой недостаточности объяснялись врачами клиникой хронической сердечной недостаточности, развившейся вследствие ишемической болезни сердца.
- При обследовании больных с хронической сердечной недостаточностью, имеющих в анамнезе кардиохирургические вмешательства, следует включать констриктивный перикардит в круг диагностического поиска причин сердечной недостаточности.
Рецензия
Для цитирования:
Ванхин В.В., Ильина Ю.В., Рыбакова М.К., Федорова Т.А., Тазина С.Я., Сотникова Т.И., Семененко Н.А., Лощиц Н.В., Павлов Ч.С. Такой непростой “простой” пациент с хронической сердечной недостаточностью: констриктивный перикардит. Клинический случай. Кардиоваскулярная терапия и профилактика. 2025;24(2):4231. https://doi.org/10.15829/1728-8800-2025-4231. EDN: SUXOAG
For citation:
Vankhin V.V., Ilyina Yu.V., Rybakova M.K., Fedorova T.A., Tazina S.Ya., Sotnikova T.I., Semenenko N.V., Loshchits N.V., Pavlov Ch.S. Such an unsimple "simple" patient with heart failure: constrictive pericarditis: case report. Cardiovascular Therapy and Prevention. 2025;24(2):4231. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4231. EDN: SUXOAG
JATS XML

























































