Перейти к:
Висцеральная жировая ткань по данным магнитно-резонансной томографии как фактор, ассоциированный с лептинорезистентностью при стабильной ишемической болезни сердца
https://doi.org/10.15829/1728-8800-2025-4236
EDN: RZJTRF
Аннотация
Цель. Оценить количественные и радиомические характеристики абдоминальной висцеральной жировой ткани (ВЖТ) методом магнитно-резонансной томографии, их взаимосвязь с показателями липидного, углеводного обмена, воспаления у пациентов с ишемической болезнью сердца (ИБС), а также ассоциацию этих факторов с наличием или отсутствием лептинорезистентности (ЛР).
Материал и методы. В исследование включены 46 пациентов со стабильной ИБС. Для определения объема (см3) абдоминальной жировой ткани выполняли магнитно-резонансную томографию. В сыворотке крови определяли уровень глюкозы и инсулина, липидный профиль, уровень провоспалительных маркеров и адипокинов. Для количественной оценки наличия ЛР рассчитывали индекс свободного лептина (ИСЛ) (при ИСЛ >25 — наличие ЛР).
Результаты. Выявлено, что в группе с ЛР статистически значимо были выше значения индекса массы тела и индекса НОМА-IR (Homeostasis model assessment of insulin resistance), уровень инсулина, адипонектина, лептина и выше ИСЛ, тогда как соотношение адипонектин/лептин и уровень рецепторов к лептину в крови были ниже, чем в группе пациентов без ЛР. Межгрупповых различий по объему абдоминальных жировых депо выявлено не было. Группа с ЛР характеризовалась статистически значимо меньшим значением таких радиомических характеристик, как Entropy (Энтропия) и Variance (Дисперсия). В модель многофакторного логистического регрессионного анализа были включены следующие факторы, которые ассоциировались с наличием ЛР: возраст (OR — odds ratio (отношение шансов) 1,24, 95% доверительный интервал (confidence interval, CI): 1,05-1,47), уровень базальной глюкозы (OR 2,50, 95% CI: 0,73-8,62), уровень растворимых рецепторов лептина (OR 0,65, 95% CI: 0,47-0,91), курение (OR 0,43, 95% CI: 0,065-2,89) и радиомический показатель Entropy (OR 2,44, 95% CI: 0,13-46,5). Чувствительность и специфичность модели составляют 90,6 и 57,1%, соответственно.
Заключение. Выявлены значимые факторы, ассоциированные с наличием ЛР у пациентов со стабильной ИБС — радиомический показатель Entropy, старший возраст, высокий уровень базальной глюкозы, курение и низкое содержание растворимых рецепторов к лептину.
Ключевые слова
Для цитирования:
Рюмшина Н.И., Кошельская О.А., Нарыжная Н.В., Харитонова О.А., Кравченко Е.С., Завадовский К.В. Висцеральная жировая ткань по данным магнитно-резонансной томографии как фактор, ассоциированный с лептинорезистентностью при стабильной ишемической болезни сердца. Кардиоваскулярная терапия и профилактика. 2025;24(1):4236. https://doi.org/10.15829/1728-8800-2025-4236. EDN: RZJTRF
For citation:
Ryumshina N.I., Koshelskaya О.A., Naryzhnaya N.V., Kharitonova O.A., Kravchenko E.S., Zavadovsky K.V. Visceral adipose tissue according to magnetic resonance imaging as a factor associated with leptin resistance in stable coronary artery disease. Cardiovascular Therapy and Prevention. 2025;24(1):4236. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4236. EDN: RZJTRF
Введение
Лептинорезистентность (ЛР) определяется как состояние, при котором наблюдается повышенная концентрация лептина в сыворотке крови при снижении или отсутствии его анорексигенного эффекта [1]. Синдром ЛР активно изучается в качестве одного из метаболических факторов риска развития сердечно-сосудистых заболеваний (ССЗ) [2]. Четких критериев определения ЛР до сих пор не разработано. На практике ЛР может диагностироваться как при однократно выявленном повышении уровня сывороточного лептина, так и при продолжительной гиперлептинемии [3]. Все бóльшую диагностическую ценность приобретает определение индекса свободного лептина (ИСЛ), однако референсный диапазон этого показателя на настоящий момент не установлен. Именно отсутствие стандартизации в определении ЛР обусловливает сложности в трактовке и согласованности результатов исследований, изучающих вклад ЛР в развитие ССЗ и метаболических нарушений. При этом важность ранней диагностики ЛР обусловлена многообразием метаболических эффектов лептина на хроническое субклиническое воспаление, атерогенез и обмен веществ [4]. Механизмы, способствующие развитию резистентности к лептину, изучаются с момента его открытия. Неудивительно, что в нескольких исследованиях, посвященных оценке жировых отложений с использованием компьютерной томографии и магнитно-резонансной томографии (МРТ), сообщалось о связи между висцеральной (ВЖТ) жировой тканью (ЖТ) и ЛР [5, 6]. Однако результаты этих исследований весьма противоречивы, что подчеркивает значимость индивидуальных различий в распределении ЖТ. Мультиспиральная компьютерная томография и МРТ являются доступными методиками для прямой визуализации и количественной оценки жировых отложений, и позволяют избежать противоречий, возникающих из-за метаболических различий между этническими группами. Количественные измерения ВЖТ обычно применяются в клинической практике для оценки метаболических рисков [7, 8]. Радиомический анализ признаков — это новый метод обработки данных, который позволяет извлекать текстурную информацию из томографических изображений для создания наборов данных, содержащих сотни параметров [9]. Однако данные о вкладе в неинвазивную диагностику ЛР текстуры ВЖТ, определяемой радиомическим анализом, отсутствуют. Связь различных жировых депо с лептином, а также с ЛР остается дискуссионной, как и способы диагностики ЛР.
Цель исследования — оценить количественные и радиомические характеристики абдоминальной ВЖТ, определенные методом МРТ, их взаимосвязь с показателями липидного, углеводного обмена, воспаления у пациентов с ишемической болезнью сердца (ИБС), а также ассоциацию этих факторов с наличием или отсутствием ЛР.
Материал и методы
Пациенты и дизайн исследования. Исследование носит одноцентровый ретроспективный когортный характер. Набор пациентов проводился с 01.2017 по 01.2020гг выборочным методом согласно критериям включения. Пациенты были направлены из кардиологического диспансера на плановую госпитализацию в кардиологическое отделение стационара для проведения диагностического обследования — селективной рентгеноконтрастной коронароангиографии, по результатам которой в 34 случаях была выполнена высокотехнологическая медицинская помощь в виде аортокоронарного шунтирования (32 человека) или протезирования аортального клапана (2 человека).
Проведенное исследование соответствует этическим принципам, изложенным в Хельсинкской декларации Всемирной медицинской ассоциации "Этические принципы проведения научных медицинских исследований с участием человека" с поправками 2000г и выполнено с учетом "Правил клинической практики в Российской Федерации", утвержденных Приказом Минздрава РФ от 19.06.2003г № 2661. Исследование было одобрено локальным этическим комитетом (протокол № 210 от 18.02.2021г).
Критерии включения: стабильная ИБС, возраст 18-80 лет, выполненная МРТ.
Критерии невключения: неполная информация по клинико-лабораторным данным, плохое качество МРТ изображений.
Всем включенным в исследование пациентам во время госпитализации были выполнены селективная коронароангиография для подтверждения и оценки выраженности коронарного атеросклероза (по Gensini Score, GS); МРТ абдоминальной области с определением объёма ВЖТ и подкожной ЖТ (ПЖТ), а также с проведением текстурного анализа ВЖТ; биохимическая оценка уровня лептина, адипонектина, глюкозы, инсулина, липидного профиля, а также маркеров воспаления — интерлейкинов (ИЛ) 1, 6 и 10, фактора некроза опухоли α (ФНО-α) и С-реактивного белка, определенного высокочувствительным методом (вчСРБ). Помимо этого, у всех включенных в исследование пациентов собирали анамнез, а также проводили комплекс лабораторных и инструментальных исследований, включающий измерение роста (м), массы тела (кг) с определением индекса массы тела (ИМТ) (отношение массы тела (кг) к росту (м2)) (кг/м2), измерение окружности талии (ОТ).
МРТ. Извлечение и выбор радиомических признаков. МРТ проводили на томографе (Titan Vantage, Toshiba) с индукцией магнитного поля 1,5 Т. Область сканирования включала расстояние от купола диафрагмы до крыльев подвздошных костей. Объем ПЖТ и ВЖТ (см3) измеряли на аксиальных изображениях, взвешенных по Т2 (TSE) на уровне межпозвоночного диска L4-L5 с использованием пакета программ 3D Slicer 4.9.0 и 5.2.2. Далее рассчитывали соотношение объемов ВЖТ/ПЖТ.
Радиомические характеристики ВЖТ были извлечены из зон интереса с помощью набора инструментов модуля Radiomics (version aa418a5). В данной работе был проведен анализ радиомических показателей первого порядка, основанных на гистограмме интенсивности, которые описывают форму распределения интенсивности пикселей в области интереса. Энергия (Energy) — это мера величины значений вокселей в изображении. Бóльшие значения подразумевают бóльшую сумму квадратов этих значений. Энтропия (Entropy) определяет неопределенность/случайность значений изображения. Она измеряет средний объем информации, необходимый для кодирования значений изображения. Эксцесс (Kurtosis) — это мера "пикообразности" распределения значений в области интереса изображения. Более высокий эксцесс подразумевает, что масса распределения сосредоточена в направлении хвоста(-ов), а не в направлении среднего значения. Более низкий эксцесс подразумевает обратное: что масса распределения сосредоточена в направлении пика вблизи среднего значения. Асимметрия (Skewness) измеряет асимметрию распределения значений относительно среднего значения. В зависимости от того, где вытянут хвост и сосредоточена масса распределения, это значение может быть положительным или отрицательным. Общая энергия (Total Energy) — это значение характеристики энергии, масштабированное по объему воксела в мм3. Однородность (Uniformity) — это мера суммы квадратов каждого значения интенсивности. Это мера однородности массива изображения, где бóльшая однородность подразумевает бóльшую однородность или меньший диапазон дискретных значений интенсивности. Дисперсия (Variance) — это среднее квадратов расстояний каждого значения интенсивности от среднего значения, мера разброса распределения вокруг среднего значения2.
Коронароангиография. Селективная коронарная ангиография проводилась на ангиографическом комплексе Cardioscop-V и компьютерной системе Digitron-3NAC, Siemens (Германия). Тяжесть коронарного атеросклероза оценивали по шкале GS: умеренное поражение коронарного русла (21-70%) при <35 баллах, выраженное поражение коронарного русла (≥71%) при ≥35 баллах [10].
Лабораторные анализы. Сыворотку крови пациентов получали из венозной крови, взятой утром натощак. В сыворотке крови методом твердофазного иммуноферментного анализа определяли содержание лептина (нг/мл) (DBC, Канада), адипонектина (мкг/мл) (Assaypro, США), растворимых рецепторов лептина (нг/мл) (BioVendor, Чехия) и инсулина (мкМЕ/мл) (Monobind, США). Гексокиназным методом оценивали содержание глюкозы (ммоль/л) натощак. Резистентность к инсулину оценивали по гомеостатической модели (Homeostasis model assessment of insulin resistance, НОМА-IR) согласно формуле: HOMA-IR = глюкоза натощак (ммоль/л) × инсулин натощак (мкМЕ/мл) / 22,5. Содержание общего холестерина (ХС) (ммоль/л), триглицеридов (ТГ) (ммоль/л), ХС липопротеинов высокой плотности (ЛВП) (ммоль/л) определяли в сыворотке крови энзиматическим колориметрическим методом с использованием автоматического биохимического анализатора Cobas 6000 c 501 (Roche Diagnosctics, Япония). Сывороточное содержание ИЛ-1, -6 и -10 (пг/мл), ФНО-α (пг/мл) и вчСРБ (пг/мл) определяли методом иммуноферментного анализа наборами фирмы Вектор-Бест (Новосибирск, Россия).
Рассчитывали ИСЛ по формуле:
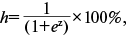
(лептин сыворотки (нг/мл)/рецептор лептина (нг/мл)) × 100. ЛР устанавливали при ИСЛ >25 [11].
Статистический анализ. Принципы расчета размера выборки: расчет размера выборки не требовался. Статистический анализ выполнялся с использованием пакета программы Jamovi 2.3.28 (The Jamovi project, 2022). Согласие с нормальным законом распределения признаков проверяли по критерию Колмогорова-Смирнова с поправкой Лили-Форса. Категориальные переменные представлены абсолютными (n) и относительными (%) частотами. Непрерывные переменные при нормальном распределении представлены как M±SD, где М — среднее арифметическое, SD — стандартное отклонение показателя, а при распределении, отличном от нормального, — в виде медианы и интерквартильного размаха: Me (Q25; Q75). Для устранения влияния пола на интересующие показатели была проведена их нормализация по полу. Для выявления различий числовых характеристик в независимых группах использовали критерий Манна-Уитни, т.к. большинство анализируемых признаков не подчинялось нормальному закону распределения. Достоверность различий качественных признаков в двух независимых группах оценивали по точному критерию Фишера. Для оценки взаимосвязи признаков использовался ранговый коэффициент корреляции Спирмена (rs). Для поиска значимых предикторов ЛР был выполнен однофакторный и многофакторный логистический регрессионный анализ МРТ данных: рассчитаны отношения шансов (OR — odds ratio) и 95% доверительный интервал (CI — confidence interval). Для критического уровня значимости "p" всех процедур статистического анализа использовали значение 0,05.
Результаты
Результаты сравнительной оценки пациентов с ЛР. В анализ были включены 46 пациентов (28 мужчин и 18 женщин), средний возраст которых составил 61,5±7,6 лет. Базовую терапию ИБС составили следующие группы препаратов: ингибиторы ангиотензинпревращающего фермента (n=22), антагонисты рецепторов ангиотензина (n=17), блокаторы кальциевых каналов (n=24), β-адреноблокаторы (n=38), диуретики (n=9), статины (n=43). В зависимости от наличия ЛР все обследованные были разделены на 2 группы. Подробная клиническая характеристика пациентов представлена в таблице 1. Группа без ЛР представлена мужчинами; в ней было больше курильщиков. Группа с ЛР представлена более возрастными пациентами с высоким ИМТ (p=0,007), среди которых чаще встречался сахарный диабет 2 типа (СД2) (p=0,026) и был значимо выше НОМА-IR (p=0,015). Межгрупповых различий по содержанию липидов, а также маркерам воспаления выявлено не было. С высокой статистической значимостью группы различались по адипокиновому профилю.
Результаты анализа объема и радиомических характеристик абдоминальной ВЖТ по данным МРТ. Результаты сравнительного межгруппового анализа радиомических характеристик ВЖТ представлены в таблице 2. Различий по объему жировых депо у пациентов с наличием и отсутствием ЛР не выявлено. При этом по анализируемым радиомическим характеристикам группа с ЛР характеризовалась значимо меньшими значениями показателей Entropy и Variance по сравнению с пациентами без ЛР.
Корреляционный анализ объемов ВЖТ, ПЖТ, а также радиомических переменных с показателями углеводного обмена, липидного спектра, системными маркерами воспаления и адипокинами выявил ряд закономерностей.
В группе без ЛР объем ПЖТ коррелировал только с ОТ (r=0,604, p=0,022), в то время как объем ВЖТ — с ИМТ (r=0,761, p=0,002), с индексом GS (r=0,747, p=0,002), глюкозой (r=0,546, p=0,044), ИЛ-6 (r=0,648, p=0,012), вчСРБ (r=0,725, p=0,003) и соотношением уровней адипонектина и лептина (А/Л) (r=-0,564, p=0,036). Отношение ВЖТ/ПЖТ коррелировало с базальной глюкозой (r=0,733, p=0,003), общим ХС (r=0,613, p=0,022) и ИЛ-10 (r=-0,543, p=0,048). Корреляционных взаимосвязей радиомических параметров с исследуемыми биохимическими показателями выявлено не было.
В группе с наличием ЛР объем ПЖТ отрицательно коррелировал с возрастом (r=-0,369, p=0,013), систолическим артериальным давлением артериальным давлением (r=-0,360, p=0,030) и А/Л (r=-0,575, p<0,001), положительно — с ИМТ (r=0,731, p<0,001), ОТ (r=0,622, p<0,001), с уровнем сывороточного лептина (r=0,528, p=0,003) и ИСЛ (r=0,522, p=0,004). Объем ВЖТ показал положительные корреляционные связи с ИМТ (r=0,649, p<0,001), ОТ (r=0,806, p<0,001), с уровнем ТГ (r=0,417, p=0,025) и отрицательную корреляцию с уровнем адипонектина (r= -0,446, p=0,016). Отношение ВЖТ/ПЖТ коррелировало с уровнем сывороточного адипонектина (r= -0,418, p=0,042) и имело тенденцию к корреляции с сывороточным лептином (r=-0,393, p=0,051). Радиомические показатели продемонстрировали следующие корреляции: Kurtosis с уровнем ТГ (r=0,389, p=0,028), Variance с уровнем ИЛ-10 (r=0,354, p=0,047), Entropy с рецепторами лептина (r=0,397, p=0,025), а также отрицательную корреляционную связь Kurtosis с адипонектином (r=-0,478, p=0,006) и Uniformity с рецепторами лептина (r=-0,388, p=0,029).
Поскольку при делении нашей выборки на группы по наличию ЛР, группа без ЛР оказалась представлена исключительно мужчинами, мы провели дополнительный анализ, чтобы выявить вероятные различия по полу. Установили, что по интересующим нас МРТ параметрам (объем ЖТ, радиомические характеристики) межгрупповых различий по полу нет. Различия по полу выявлены по сывороточным уровням базальной глюкозы, ХС ЛВП, адипонектина, лептина, но не было выявлено различий по уровню растворимого рецептора лептина.
Результаты регрессионного анализа. Для определения МРТ-признаков и радиомических признаков, способных улучшить прогностическую модель выявления ЛР, был выполнен однофакторный логистический регрессионный анализ (таблица 3), по данным которого установлены статистически значимые ассоциации факторов с ЛР, среди которых следующие количественные и качественные признаки: мужской пол, курение, возраст, ИМТ, уровень сывороточного лептина и рецептора лептина, соотношение А/Л, а также такие радиомические показатели, как Entropy и Uniformity. В модель многофакторного логистического регрессионного анализа были включены следующие факторы, которые ассоциировались с наличием ЛР: возраст (OR 1,24, CI: 1,05-1,47; p=0,011), базальный уровень глюкозы (OR 2,50, CI: 0,73-8,62; p=0,147), уровень растворимых рецепторов лептина (OR 0,65, CI: 0,47-0,91; p=0,012), курение (OR 0,43, CI: 0,065-2,89; p=0,386) и радиомический показатель Entropy (OR 2,44, CI: 0,13-46,5; p=0,553). Хотя наиболее сильными предикторами в данной модели являются возраст и уровень рецепторов к лептину, характеристика текстуры ВЖТ первого порядка Entropy, базальный уровень глюкозы и курение также оказались независимыми, но менее значимыми, по сравнению с предыдущими, предикторами ЛР (омнибусный тест отношения правдоподобия р=0,017, р=0,028, р=0,004, соответственно). Функциональная связь показателей модели находится в допустимых пределах (коэффициент псевдо-рандомизации Найджелкерка R2N=0,624; статистики коллинеарности — для всех факторов VIF <4,5, толерантность >0,25). Согласно полученным данным ROC-анализа данная модель логистической регрессии имеет диагностическую точность 80,4%, чувствительность 90,6%, специфичность 57,1%, площадь под кривой (AUC)=0,900.
Таблица 1
Клиническая характеристика пациентов, включенных в исследование
Показатель | Значение | р | |
Наличие ЛР (n=32) | Отсутствие ЛР (n=14) | ||
Клинико-демографические показатели | |||
Мужской пол, n (%) | 14 (44) | 14 (100) | <0,001 |
Метаболический синдром, n (%) | 28 (87) | 7 (50) | 0,057 |
СД2, n (%) | 14 (44) | 2 (14) | 0,026 |
Курение, n (%) | 10 (31) | 10 (71) | 0,036 |
Возраст, лет, M±SD | 64,2±6,6 | 57±8,7 | 0,014 |
ИМТ, кг/м2, Me (Q25; Q75) | 31,6 (28,9; 38,4) | 27,6 (26,4; 29,9) | 0,007 |
ОТ, см, M±SD | 111,8±15,2 | 103,1±7,8 | 0,068 |
САД, мм рт.ст., M±SD | 134,0±15,9 | 125,9±13,9 | 0,107 |
ДАД, мм рт.ст., M±SD | 74,3±9,4 | 75,4±9,4 | 0,542 |
Данные КАГ | |||
Стенозы КА ≥70%, n (%) | 23 (72) | 11 (78) | 0,634 |
Gensini Score, баллы, Me (Q25; Q75) | 26,8 (17,1; 52,1) | 25 (14,8; 47,8) | 0,402 |
Биохимические маркеры, Me (Q25; Q75) | |||
Глюкоза плазмы натощак, ммоль/л | 6,5 (5,3; 7,1) | 5,6 (5,4; 6,1) | 0,136 |
Инсулин натощак, мкМЕ/мл | 5,3 (3,9; 6,5) | 3,8 (2,4; 5,4) | 0,086 |
НОМА-IR | 1,5 (1,1; 1,8) | 0,9 (0,6; 1,4) | 0,015 |
Общий ХС, ммоль/л | 3,8 (3,3; 4,9) | 4,1 (3,5; 4,8) | 0,583 |
Триглицериды, ммоль/л | 1,5 (1,3; 1,4) | 1,4 (1,1; 1,9) | 0,358 |
ХС ЛВП, ммоль/л | 1,1 (0,9; 1,4) | 1,2 (1,0; 1,3) | 0,720 |
ИЛ-1, пг/мл | 0,9 (0,7; 1,1) | 0,7 (0,6; 1,4) | 0,821 |
ИЛ-6, пг/мл | 1,5 (0,9; 2,2) | 1,04 (0,7; 1,8) | 0,176 |
ФНО-α, пг/мл | 0,9 (0,8; 2,4) | 0,9 (0,8; 2,3) | 0,839 |
ИЛ-10, пг/мл | 2,2 (1,7; 3,4) | 1,9 (1,6; 2,4) | 0,431 |
вчСРБ, мг/л | 3,2 (2,1; 5,2) | 1,8 (1,0; 2,9) | 0,118 |
Адипонектин, мкг/мл | 6,7 (4,7; 9,3) | 4,2 (2,9; 6,1) | 0,017 |
Лептин, нг/мл | 43,8 (11,9; 142,4) | 8,7 (2,7; 4,3) | <0,001 |
Адипонектин/Лептин | 0,19 (0,06; 0,49) | 1,12 (0,73; 1,9) | <0,001 |
Рецептор лептина, нг/мл | 17,2 (13,1; 20,1) | 20,2 (18,7; 23,4) | 0,003 |
ИСЛ | 261 (82,3; 934) | 18,0 (13,8; 23,1) | <0,001 |
Примечание: данные представлены как M±SD, где М — среднее арифметическое, SD — стандартное отклонение при нормальном распределении показателя, как Me (Q25; Q753) — медиана и интерквартильный размах интервал при распределении, отличном от нормального; вчСРБ — С-реактивный белок, определенный высокочувствительным методом, ДАД — диастолическое артериальное давление, ИЛ — интерлейкин, ИМТ — индекс массы тела, ИСЛ — индекс свободного лептина, КА — коронарные артерии, КАГ — коронароангиография, ЛВП — липопротеины высокой плотности, ЛР — лептинорезистентность, ОТ — окружность талии, САД — артериальное давление, СД2 — сахарный диабет 2 типа, ФНО-α — фактор некроза опухоли, ХС — холестерин, НОМА-IR — Homeostasis model assessment of insulin resistance (гомеостатическая модель инсулинорезистентности).
Таблица 2
Характеристика объемных и радиомических показателей абдоминальной ЖТ в исследуемых группах
Показатель | Наличие ЛР (n=32) | Отсутствие ЛР (n=14) | р |
Данные МРТ, Me (Q25; Q75) | |||
Объем ПЖТ, см3 | 240 (205; 337) | 209 (143; 286) | 0,104 |
Объем ВЖТ, см3 | 152 (113; 213) | 118 (90; 133) | 0,081 |
ВЖТ/ПЖТ | 0,59 (0,45; 0,83) | 0,59 (0,44; 0,66) | 0,697 |
Радиомические показатели | |||
Energy, M±SD | 1,02e+12±3,75e+11 | 8,90e+11±3,74e+11 | 0,102 |
Entropy, M±SD | 6,3±0,36 | 6,6±0,33 | 0,007 |
Kurtosis, M±SD | 2,9±0,45 | 2,7±0,47 | 0,428 |
Skewness, M±SD | -0,0253±0,3 | 0,1258±0,3 | 0,804 |
Total Energy, M±SD | 3,69e+12±1,43e+12 | 3,23e+12±1,57e+12 | 0,222 |
Uniformity, Me (Q25; Q75) | 0,01 (0,012; 0,017) | 0,01 (0,01; 0,014) | 0,026 |
Variance, Me (Q25; Q75) | 241108 (178587; 354533) | 351720 (242464; 437242) | 0,011 |
Примечание: данные представлены как M±sd, где М — среднее арифметическое, SD — стандартное отклонение при нормальном распределении показателя, как Me (Q1; Q3) медиана и межквартильный интервал при отсутствии нормального распределения. ВЖТ — висцеральная жировая ткань, ЖТ — жировая ткань, ЛР — лептинорезистентность, МРТ — магнитно-резонансная томография, ПЖТ — подкожная жировая ткань.
Таблица 3
Результаты однофакторного регрессионного анализа
Однофакторный анализ | |||
Фактор | OR | 95% CI | р |
Мужской пол | 0,12 | 0,257-0,743 | <0,001 |
СД2 | 4,67 | 0,89-24,3 | 0,068 |
Курение | 0,182 | 0,05-0,72 | 0,015 |
Возраст | 1,14 | 1,03-1,26 | 0,010 |
ИМТ | 1,23 | 1,03-1,46 | 0,022 |
ОТ | 1,06 | 0,99-1,12 | 0,059 |
Индекс Gensini Score | 1,00 | 0,98-1,02 | 0,981 |
Глюкоза натощак | 1,57 | 0,84-2,97 | 0,160 |
Инсулин натощак | 1,25 | 0,93-1,69 | 0,133 |
Общий ХС | 0,97 | 0,57-1,63 | 0,901 |
Триглицериды | 1,60 | 0,54-4,74 | 0,393 |
ХС ЛВП | 0,99 | 0,10-9,77 | 0,99 |
ИЛ-6 | 1,68 | 0,67-4,21 | 0,270 |
вчСРБ | 0,98 | 0,86-1,12 | 0,783 |
ФНО-α | 1,09 | 0,58-2,05 | 0,785 |
Адипонектин | 1,32 | 0,99-1,75 | 0,504 |
Лептин | 5,45 | 0,96-30,78 | 0,055 |
А/Л | 0,51 | 0,19-0,14 | 0,014 |
Рецептор лептина | 0,803 | 0,68-0,95 | 0,009 |
Объем ПЖТ | 1,01 | 0,99-1,01 | 0,119 |
Объем ВЖТ | 1,01 | 0,99-1,02 | 0,068 |
ВЖТ/ПЖТ | 1,53 | 0,24-9,95 | 0,654 |
Energy | 1,00 | 0,9-1,1 | 0,301 |
Entropy | 0,069 | 0,008-0,72 | 0,025 |
Kurtosis | 1,78 | 0,43-7,31 | 0,421 |
Skewness | 0,57 | 0,08-4,22 | 0,583 |
Uniformity | 2,43 | 1,16-50,6 | 0,046 |
Variance | 1,01 | 0,99-1,01 | 0,123 |
Примечание: А/Л — соотношение адипонектина и лептина, ВЖТ — висцеральная жировая ткань, вчСРБ — С-реактивный белок, определенный высокочувствительным способом, ИЛ — интерлейкин, ИМТ — индекс массы тела, ИСЛ — индекс свободного лептина, ЛВП — липопротеины высокой плотности, ОТ — окружность талии, ПЖТ — подкожная жировая ткань, СД2 — сахарный диабет 2 типа, ФНО-α — фактор некроза опухоли α, ХС — холестерин, CI — confidence interval (доверительный интервал), OR — odds ratio (отношение шансов).
Обсуждение
В настоящей работе впервые приведены результаты анализа взаимосвязи характеристик объема и радиомических переменных первого порядка абдоминальной ВЖТ по данным МРТ с особенностями системных метаболических нарушений и выраженностью низкоинтенсивного воспаления у пациентов с ИБС в зависимости от наличия ЛР. К основным результатам данной работы можно отнести следующие моменты. Независимыми факторами, статистически значимо ассоциирующимися с ЛР, являются возраст пациента, уровень растворимых рецепторов лептина, базальный уровень глюкозы, курение и радиомический показатель структуры абдоминальной ВЖТ — Entropy, определенный по данным МРТ.
В группе с ЛР выявлены положительные ассоциации объема ПЖТ с уровнем сывороточного лептина и индексом свободного лептина. Установлена положительная связь ВЖТ с уровнем ТГ крови и отрицательная связь с уровнем адипонектина. В настоящей работе впервые определена значимость МР-томографических радиомических характеристик первого порядка ВЖТ в оценке ЛР у пациентов со стабильной ИБС.
Полученные результаты демонстрируют, что текстурный анализ абдоминальной ВЖТ имеет перспективы в диагностике ЛР у лиц ИБС.
Проведен анализ межгрупповых различий в группе с ЛР в зависимости от пола. В исследуемой выборке не выявлено различий объема жировых депо, а также текстуры ВЖТ между мужчинами и женщинами.
Важность своевременной диагностики ЛР у лиц с ИБС обусловлена снижением концентрации растворимых рецепторов лептина в сыворотке крови при прогрессировании абдоминального ожирения, что ассоциируется с более агрессивным развитием атеросклероза и поддержанием системного воспалительного процесса [12]. Было показано, что ИБС в контексте статуса эпикардиальных адипоцитов может быть охарактеризована как "метаболическое воспаление", что позволяет предположить прямое участие адипоцитов в патогенезе ИБС и ЛР через развитие адипокинового дисбаланса и активацию провоспалительных процессов [13]. В обследованной нами выборке группа с ЛР отличается более высоким уровнем сывороточного лептина, но меньшим содержанием рецепторов к лептину, и как следствие более высоким ИСЛ, что согласуется с данными Поляковой Е. А. (2021). Повышение ИСЛ отражает нарушение связей в системе "лептин-рецептор" и запускает механизмы компенсации для преодоления резистентности периферических тканей к лептину, что подтверждается заметной отрицательной связью между уровнями лептина и его растворимых рецепторов в сыворотке крови больных ИБС [14]. Кроме того, лептин влияет на гипоталамические центры голода и насыщения, подавляет аппетит, увеличивает расход энергии, способствует возникновению чувства насыщения. Некоторые исследования подтвердили положительную связь между курением и гиперлептинемией, т.е. у курящего человека уровень лептина несколько повышается. При прекращении курения уровень лептина снижается, что должно приводить к снижению расхода энергии и усилению аппетита. Однако при избыточном накоплении ЖТ нормальный механизм работы лептина нарушается, рецепторы к лептину у тучных людей становятся к нему невосприимчивыми и формируется ЛР [15]. Это согласуется с выявленной нами обратной связью курения с наличием ЛР.
Гормональный статус ЖТ при артериальной гипертензии, ИБС и других ССЗ, ассоциированных с ожирением, характеризуется более высоким уровнем лептина и резистина у женщин по сравнению с мужчинами [16]. С учетом имеющихся данных о физиологических гендерных различиях чувствительности к лептину, мы сравнили количественные и текстурные характеристики ВЖТ в группе с ЛР в зависимости от пола, но в исследуемой выборке значения этих параметров у мужчин и женщин значимо не различались.
Секретируемые ЖТ адипокины участвуют в регуляции массы тела (лептин и адипонектин), местного воспаления (ФНО-α, ИЛ-6 и ИЛ-1β), сосудистой функции (резистин, эндотелин-1) [17]. При увеличении массы ЖТ происходит ее инфильтрация активированными макрофагами, усиленно продуцирующими воспалительные цитокины (ФНО-α, ИЛ-6), которые выходят в кровоток и начинают действовать за пределами ЖТ [18]. Полученные нами корреляции объема ВЖТ с НОМА-IR, уровнями ТГ и ХС ЛВП у пациентов с ИБС согласуются с анализом среди пациентов с СД2 [19]. Имеются данные о взаимосвязи объема ПЖТ с диаметром абдоминальной аорты, в т.ч. за счет продукции большого числа медиаторов воспаления и повреждения сосудистой стенки [20]. В работе Genske F, et al. (2018) объем ПЖТ оказался единственным показателем, который независимо от ИМТ коррелировал с уровнем лептина [21]. Связь объема ВЖТ с адипонектином, лептином и резистентностью к инсулину, а также с ХС ЛВП и ТГ в сыворотке аналогична анализу роли абдоминального ожирения при ИБС [22]. Однако в отличие от прогностической роли объема ВЖТ, приведенной статье Худяковой А. Д. и др. (2024), в настоящей работе объемы абдоминальных жировых депо не имели диагностической значимости в выявлении ЛР у лиц с ИБС, но ассоциировались с содержанием в крови биомаркеров воспаления и показателями углеводного и липидного обменов.
Проведен анализ новых неинвазивных маркеров ЛР у лиц с ИБС. В литературе представлены единичные публикации, посвященные радиомике ЖТ в кардиологии. В ряде работ показаны потенциальные возможности текстурного анализа периваскулярного жира в диагностике нестабильности атеросклеротических бляшек [23][24] и как потенциального биомаркера гиперхолестеринемии [25], в выявлении воспаления при остром инфаркте миокарда за счет наличия специфического радиомического фенотипа [26]. Сообщается, что текстурный анализ периатриальной ЖТ может рассматриваться в качестве перспективного неинвазивного метода прогнозирования неблагоприятных исходов катетерного лечения идиопатической фибрилляции предсердий [27]. В отличие от этих работ, мы оценивали радиомические характеристики первого порядка абдоминальной ВЖТ. Показатель Entropy, как вероятный дополнительный предиктор ЛР, имеет некоторые особенности, от которых зависит ее значение. Entropy отражает гетерогенность ткани, характеризует случайность в уровнях серого, а не в распределении уровней серого в интересующей области. Важно отметить, что Entropy подвержена изменениям при обработке и получении изображения. Поскольку Entropy зависит от площади, любая область интереса, охватывающая <200 пикселей, может привести к неточной оценке связи Entropy с любой переменной [28]. Отметим, что в настоящей работе зона интереса превышала 2000 пикселей, что исключает влияние его технического ограничения на результаты. В отсутствие гистологического анализа образцов абдоминальной ВЖТ, сложно однозначно утверждать о ее неоднородности. Впрочем, повышенные значения Entropy могут быть обусловлены сочетанием гипертрофии/гиперплазии адипоцитов и увеличением межклеточного пространства за счет фиброзной ткани и сети капилляров. Действительно, избыточная аккумуляция дисфункциональной ВЖТ характеризуется развитием гипертрофии адипоцитов без соответствующего ангиогенного ответа, что ведет к локальной тканевой гипоксии, которая рассматривается патофизиологами, как один из инициирующих факторов воспаления в ЖТ. Быстрое увеличение объема адипоцитов приводит к их нестабильности и разрушению, в результате чего высвобождаются молекулы, ассоциированные с повреждением тканей, усиливается выработка провоспалительных факторов, инфильтрация ЖТ макрофагами, активация процессов окислительного стресса c последующим развитием ремоделирования внеклеточного матрикса [29][30]. Согласно нашим результатам, текстурные МРТ-характеристики абдоминальной ВЖТ достигают превосходной прогностической эффективности, что в перспективе позволит быстро (анализ одного среза L4-L5), неинвазивно, без лучевой нагрузки и, теоретически, более экономично, фенотипировать пациентов с ИБС, имеющих повышенный риск развития ЛР.
Ограничения исследования. К ограничениям исследования можно отнести его ретроспективный характер, небольшой размер выборки, преобладание в выборке мужчин.
Заключение
В настоящей работе выявлены значимые факторы, ассоциирующиеся с наличием ЛР у пациентов со стабильной ИБС — радиомический показатель Entropy, определенный методом МРТ, старший возраст, высокий базальный уровень глюкозы, курение и низкое содержание растворимых рецепторов к лептину.
Отношения и деятельность. Исследование выполнено в рамках Государственного задания по теме ФНИ № 122020300043-1.
1 https://normativ.kontur.ru/document?moduleId=1&documentId= 61950.
2 https://pyradiomics.readthedocs.io/en/latest/features.html# radiomics.ngtdm.RadiomicsNGTDM.
Список литературы
1. Бородкина Д. А., Груздева О. В., Акбашева О. Е. и др. Лептинорезистентность, нерешенные вопросы диагностики. Проблемы эндокринологии. 2018;64(1):62-6. doi:10.14341/probl8740.
2. Dedov II, Mokrysheva NG, Mel’nichenko GA, et al. Obesity. Clinical guidelines. Consilium Medicum. 2021;23(4):311-25. (In Russ.) Дедов И. И., Мокрышева Н. Г., Мельниченко Г. А. и др. Ожирение. Клинические рекомендации. Consilium Medicum. 2021;23(4):311-25. doi:10.26442/20751753.2021.4.200832.
3. Zhao Sh, Kusminski CM, Elmquist JK, et al. Leptin: Less Is More. Diabetes. 2020;69(5):823-9. doi:10.2337/dbi19-0018.
4. Izquierdo AG, Crujeiras AB, Casanueva FF, et al. Leptin, obesity, and leptin resistance: Where are we 25 years later? Nutrients. 2019;11(11):2704. doi:10.3390/nu11112704.
5. Machann J, Stefan N, Wagner R, et al. Normalized Indices Derived from Visceral Adipose Mass Assessed by Magnetic Resonance Imaging and Their Correlation with Markers for Insulin Resistance and Prediabetes. Nutrients. 2020;12(7):2064. doi:10.3390/nu12072064.
6. Vita E, Stefani A, Piro G, et al. Leptin-mediated meta-inflammation may provide survival benefit in patients receiving maintenance immunotherapy for extensive-stage small cell lung cancer (ES-SCLC). Cancer Immunol Immunother. 2023;72(11): 3803-12. doi:10.1007/s00262-023-03533-0.
7. Подзолков В. И., Брагина А. Е., Родионова Ю. Н. и др. Эктопическая жировая ткань: частота и клинические характеристики фенотипов ожирения у пациентов. Кардиоваскулярная терапия и профилактика. 2024;23(6):3980. doi:10.15829/1728-8800-2024-3980.
8. Зюбанова И. В., Рюмшина Н. И., Мордовин В. Ф. и др. Взаимосвязи размеров абдоминальных и паранефральных жировых депо с маркерами метавоспаления и повреждения почек у пациентов с резистентной артериальной гипертензией. Артериальная гипертензия. 2024;30(2):207-23. doi:10.18705/1607-419X-2024-2318.
9. Tharmaseelan H, Froelich MF, Nörenberg D, et al. Influence of local aortic calcification on periaortic adipose tissue radiomics texture features-a primary analysis on PCCT. Int J Cardiovasc Imaging. 2022;38(11):2459-67. doi:10.1007/s10554-022-02656-2.
10. Гаврилова Н. Е., Метельская В. А., Перова Н. В. и др. Выбор метода количественной оценки поражения коронарных артерий на основе сравнительного анализа ангиографических шкал. Российский кардиологический журнал. 2014;(6):24-9.
11. Горбатовская Е. Е., Дылева Ю. А., Белик Е. В. и др. Выявление лептинорезистентности у пациентов с ишемической болезнью сердца и пороками сердца. Российский кардиологический журнал. 2023;28(8):5455. doi:10.15829/1560-4071-2023-5455.
12. Brown RJ, Meehan CA, Gorden P. Leptin does not mediate hypertension associated with human obesity. Cell. 2015;162(3): 465-6. doi:10.1016/j.cell.2015.07.007.
13. Gruzdeva O, Uchasova E, Dyleva Y, et al. Adipocytes Directly Affect Coronary Artery Disease Pathogenesis via Induction of Adipokine and Cytokine Imbalances. Front Immunol. 2019; 10:2163. doi:10.3389/fimmu.2019.02163.
14. Полякова Е. А. Роль растворимых рецепторов лептина в патогенезе ишемической болезни сердца. Регионарное кровообращение и микроциркуляция. 2021;20(3):34-45. doi:10.24884/1682-6655-2021-20-3-34-45.
15. Драпкина О. М. Курение и ассоциированные с ним проблемы в практике кардиолога. Артериальная гипертензия. 2010;16(2):164-9.
16. Хуссейн Ю. Х. Х. Лептин и половые особенности метаболических нарушений при ожирении. Juvenis Scientia. 2022;8(1):19-31. doi:10.32415/jscientia_2022_8_1_19-31.
17. Груздева О. В., Белик Е. В., Дылева Ю. А. и др. Взаимосвязь экспрессии генов адипоцитокинов и кальцификации коронарных артерий у пациентов с ишемической болезнью сердца. Сибирский журнал клинической и экспериментальной медицины. 2021;36(3):68-77. doi:10.29001/2073-8552-2021-36-3-68-77.
18. Kern L, Mittenbühler MJ, Vesting AJ, et al. Obesity-induced TNFα and IL-6 signaling: The missing link between obesity and inflammation-driven liver and colorectal cancers. Cancers (Basel). 2018;11(1):24-45. doi:10.3390/cancers11010024.
19. Wang M, Luo Y, Cai H, et al. Prediction of type 2 diabetes mellitus using noninvasive MRI quantitation of visceral abdominal adiposity tissue volume. Quant Imaging Med Surg. 2019;9(6):1076-86. doi:10.21037/qims.2019.06.01.
20. Рюмшина Н. И., Кошельская О. А., Кологривова И. В. и др. Магнитно-резонансная томографическая оценка абдоминальной жировой ткани и состояние брюшной аорты у пациентов с ишемической болезнью сердца: связь с нарушениями метаболизма. Бюллетень сибирской медицины. 2021;20(3):95-104. doi:10.20538/1682-0363-2021-3-95-104.
21. Genske F, Kühn JP, Pietzner M, et al. Abdominal fat deposits determined by magnetic resonance imaging in relation to leptin and vaspin levels as well as insulin resistance in the general adult population. Int J Obes. 2018;42:183-9. doi:10.1038/ijo.2017.187.
22. Худякова А. Д., Полонская Я. В., Щербакова Л. В. и др. Ассоциации циркулирующих адипокинов и ишемической болезни сердца у лиц молодого возраста. Кардиоваскулярная терапия и профилактика. 2024;23(5):3965. doi:10.15829/1728-8800-2024-3965.
23. Hu GQ, Ge YQ, Hu XK, et al. Predicting coronary artery calcified plaques using perivascular fat CT radiomics features and clinical risk factors. BMC Med Imaging. 2022;22(1):134. doi:10.1186/s12880-022-00858-7.
24. Mundt P, Tharmaseelan H, Hertel A, et al. Periaortic adipose radiomics texture features associated with increased coronary calcium score-first results on a photon-counting-CT. BMC Med Imaging. 2023;23(1):97. doi:10.1186/s12880-023-01058-7.
25. Kahmann J, Tharmaseelan H, Riffel P, et al. Pericoronary radiomics texture features associated with hypercholesterolemia on a photon-counting-CT. Front Cardiovasc Med. 2023;10:1223035. doi:10.3389/fcvm.2023.1223035.
26. Lin A, Kolossváry M, Yuvaraj J, et al. Myocardial Infarction Associates With a Distinct Pericoronary Adipose Tissue Radiomic Phenotype: A Prospective Case-Control Study. JACC Cardiovasc Imaging. 2020;13(11):2371-83. doi:10.1016/j.jcmg.2020.06.033.
27. Ильюшенкова Ю. Н., Сазонова С. И., Попов Е. В. и др. Радиомический фенотип периатриальной жировой ткани в прогнозе позднего постабляционного рецидива идиопатической фибрилляции предсердий. Современные технологии в медицине. 2023;15(2):48-58. doi:10.17691/stm2023.15.2.05.
28. Saleh M, Virarkar M, Mahmoud HS, et al. Radiomics analysis with three-dimensional and two-dimensional segmentation to predict survival outcomes in pancreatic cancer. World J Radiol. 2023;15(11):304-14. doi:10.4329/wjr.v15.i11.304.
29. Lee MJ, Kim J. The pathophysiology of visceral adipose tissues in cardiometabolic diseases. Biochem Pharmacol. 2024;222: 116116. doi:10.1016/j.bcp.2024.116116.
30. Chen HJ, Yan XY, Sun A, et al. Adipose extracellular matrix deposition is an indicator of obesity and metabolic disorders. J Nutr Biochem. 2023;111:109159. doi:10.1016/j.jnutbio.2022.109159.
Об авторах
Н. И. РюмшинаРоссия
Рюмшина Надежда Игоревна — к.м.н., н.с. отделения рентгеновских и томографических методов диагностики, НИИ кардиологии
Томск
О. А. Кошельская
Россия
Кошельская Ольга Анатольевна — д.м.н., профессор, в.н.с. отделения атеросклероза и хронической ишемической болезни сердца
Томск
Н. В. Нарыжная
Россия
Нарыжная Наталья Владимировна — д.м.н., в.н.с. лаборатории экспериментальной кардиологии
Томск
О. А. Харитонова
Россия
Харитонова Ольга Анатольевна — м.н.с. отделения атеросклероза и хронической ишемической болезни сердца
Томск
Е. С. Кравченко
Россия
Кравченко Елена Сергеевна — м.н.с. отделения клинической лабораторной диагностики
Томск
К. В. Завадовский
Россия
Завадовский Константин Валерьевич — д.м.н., руководитель отдела лучевой диагностики
Томск
Дополнительные файлы
Что известно о предмете исследования?
- Резистентность к лептину активно изучается в качестве одного из метаболических факторов риска развития сердечно-сосудистых заболеваний.
- Сообщается о связи между висцеральной жировой тканью и лептинорезистентностью.
- Радиомический анализ признаков — это новый метод обработки данных, который позволяет извлекать текстурную информацию о жировых депо из томографических изображений.
Что добавляют результаты исследования?
- Проведение радиомического анализа магнитно-резонансных изображений абдоминальной жировой ткани позволяет получить информацию о ее составе и текстуре.
- Выявлены значимые факторы, ассоциирующиеся с наличием лептинорезистентности у пациентов со стабильной ишемической болезнью сердца — радиомический показатель Entropy, определенный методом магнитно-резонансной томографии, старший возраст, высокий уровень базальной глюкозы, курение и низкое содержание растворимых рецепторов к лептину.
Рецензия
Для цитирования:
Рюмшина Н.И., Кошельская О.А., Нарыжная Н.В., Харитонова О.А., Кравченко Е.С., Завадовский К.В. Висцеральная жировая ткань по данным магнитно-резонансной томографии как фактор, ассоциированный с лептинорезистентностью при стабильной ишемической болезни сердца. Кардиоваскулярная терапия и профилактика. 2025;24(1):4236. https://doi.org/10.15829/1728-8800-2025-4236. EDN: RZJTRF
For citation:
Ryumshina N.I., Koshelskaya О.A., Naryzhnaya N.V., Kharitonova O.A., Kravchenko E.S., Zavadovsky K.V. Visceral adipose tissue according to magnetic resonance imaging as a factor associated with leptin resistance in stable coronary artery disease. Cardiovascular Therapy and Prevention. 2025;24(1):4236. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4236. EDN: RZJTRF

























































