Перейти к:
Взаимосвязь дилатации правого предсердия с пароксизмальной формой фибрилляции предсердий у пациентов артериальной гипертензией и хронической обструктивной болезнью легких
https://doi.org/10.15829/1728-8800-2025-4252
EDN: FMXHGB
Аннотация
Цель. Оценить взаимосвязь дилатации правого предсердия (ПП) с пароксизмальной формой фибрилляции предсердий (ФП) у больных артериальной гипертензией (АГ) и хронической обструктивной болезнью легких (ХОБЛ).
Материал и методы. В ретроспективное одномоментное исследование было включено 369 пациентов с АГ и ХОБЛ, которые были разделены на 2 группы: I группу составили 68 (18,42%) пациентов с АГ и ХОБЛ и пароксизмальной формой ФП; II группу (группу сравнения) — 301 (81,57%) больных c АГ и ХОБЛ без аритмии.
Результаты. У пациентов I группы было обнаружено достоверно более высокие значения площади ПП и индексированного объема левого предсердия (ЛП), чем у больных II группы. При проведении многофакторного регрессионного анализа было выявлено, что площадь ПП и индексированный объем ЛП ассоциированы с пароксизмальной формой ФП у коморбидных пациентов с АГ и ХОБЛ. Для оценки взаимосвязи между размерами предсердий и пароксизмальной формой ФП у пациентов с АГ и ХОБЛ нами была разработана математическая модель, описанная уравнением р=
1/(1+e-z)*100%, z=-12,51+0,130*XЛП+0,408*XПП, где р — вероятность наличия пароксизмальной формы ФП (%), XПП — площадь ПП (см²); XЛП — индексированный объем ЛП, рассчитанный на площадь поверхности тела (мл/м²). Значение р≥24% свидетельствует о высокой вероятности наличия пароксизмальной формы ФП (AUC (площадь под ROC-кривой) =0,89, чувствительность — 80%, специфичность — 77%).
Заключение. Дилатация площади ПП ассоциирована с пароксизмальной формой ФП у больных с АГ и ХОБЛ — отношение шансов (OR — odds ratio) 1,50; 95% доверительный интервал: 1,27-1,79.
Ключевые слова
Для цитирования:
Тарзиманова А.И., Казанцева Е.В., Иванников А.А., Зискина Н.К., Подзолков В.И. Взаимосвязь дилатации правого предсердия с пароксизмальной формой фибрилляции предсердий у пациентов артериальной гипертензией и хронической обструктивной болезнью легких. Кардиоваскулярная терапия и профилактика. 2025;24(2):4252. https://doi.org/10.15829/1728-8800-2025-4252. EDN: FMXHGB
For citation:
Tarzimanova A.I., Kazantseva E.V., Ivannikov A.A., Ziskina N.K., Podzolkov V.I. Relationship between right atrial dilation and paroxysmal atrial fibrillation in patients with hypertension and chronic obstructive pulmonary disease. Cardiovascular Therapy and Prevention. 2025;24(2):4252. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4252. EDN: FMXHGB
Введение
Фибрилляция предсердий (ФП) — одно из наиболее распространенных нарушений сердечного ритма, ее частота в общей популяции достигает 2-4% и продолжает увеличиваться. Несмотря на то, что ФП не представляет непосредственной опасности для жизни, она прогностически неблагоприятна. Смертность среди больных ФП в 2 раза выше, чем у пациентов с синусовым ритмом и взаимосвязана с большим количеством тромбоэмболических осложнений [1].
Артериальная гипертензия (АГ) является одной из наиболее частых причин возникновения ФП [2], что было подтверждено в исследованиях CAPP (Captopril Prevention Project), LIFE (Losartan Intervention For Endpoint reduction in hypertension) [3][4]. Распространенность аритмий значительно выше среди коморбидных пациентов и достигает 15% при одновременном сочетании АГ с хронической обструктивой болезнью легких (ХОБЛ) [2]. В патогенезе развития ФП у пациентов с ХОБЛ имеют значение снижение оксигенации, гиперкапния, лёгочная гипертензия, воспаление, а также использование респираторных препаратов для лечения ХОБЛ.
В исследовании COPENGAGEN City Heart Study установлена четкая зависимость между выраженностью бронхиальной обструкции и возникновением ФП [5]. У пациентов с тяжелой степенью ХОБЛ наблюдалось более частое прогрессирование ФП от пароксизмальной к постоянной форме. В исследовании Shibata Y, et al. показатель объема форсированного выдоха был независимым фактором риска развития ФП, причем ее распространенность в группе пациентов с ХОБЛ оказалась выше, чем у пациентов с гипертрофией левого желудочка (ЛЖ) (14,3 vs 4,4%) [6].
Сочетание АГ и ХОБЛ приводит к быстрому ремоделированию сердечно-сосудистой системы с увеличением как левого (ЛП), так и правого предсердий (ПП). Кроме того, возникающая гипоксия и активация системного воспаления способствуют активной пролиферации фибробластов, что инициирует появление значимого фиброза миокарда предсердий и в несколько раз увеличивает риск развития аритмий [7].
Роль дилатации ПП в развитии ФП остается предметом дискуссий, в то время как увеличение объема ЛП является общеизвестным фактором риска данной аритмии. В мировой и отечественной литературе единое мнение о механизмах возникновения ФП у пациентов с АГ и ХОБЛ отсутствует. Выявление простых и общедоступных маркеров ФП, которые могли бы иметь применение в рутинной клинической практике, позволит улучшить не только клинический статус пациентов, но и их прогноз.
Цель исследования — оценить взаимосвязь дилатации ПП с пароксизмальной формой ФП у больных АГ и ХОБЛ.
Материал и методы
В ретроспективное одномоментное исследование было включено 369 пациентов с АГ и ХОБЛ, госпитализированных в клинику факультетской терапии №2 Университетской клинической больницы №4 ФГАОУ ВО Первого МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет). В зависимости от наличия пароксизмальной формы ФП пациенты были разделены на 2 группы: I группу составили 68 (18,42%) пациентов с АГ и ХОБЛ и пароксизмальной формой ФП; II группу (группу сравнения) — 301 (81,57%) больных АГ и ХОБЛ без аритмии.
Критерием включения пациентов в основную группу было наличие у больных АГ и ХОБЛ пароксизмальной формы ФП, подтвержденной при электрокардиографическом (ЭКГ) исследовании или мониторировании ЭКГ по Холтеру.
Критериями невключения были: симптоматическая АГ, ишемическая болезнь сердца, воспалительные заболевания сердца, пороки сердца, хроническая сердечная недостаточность (ХСН) со сниженной фракцией выброса (ФВ) ЛЖ <50%), бронхиальная астма, тяжелая патология почек или печени, анемии, заболевания щитовидной железы, онкологические заболевания, беременность, психические заболевания, злоупотребление алкоголем. Клиническая характеристика пациентов представлена в таблице 1.
Таблица 1
Клиническая характеристика пациентов
|
Показатель |
I группа |
II группа |
p |
|
Возраст, лет, Me [Q25; Q75] |
69 [ 64,8; 75] |
66 [ 58; 71] |
<0,001 |
|
Мужчины, n (%) |
52 (76,47) |
233 (77,41) |
0,868 |
|
Женщины, n (%) |
16 (23,53) |
68 (22,59) |
0,868 |
|
АГ, n (%) — 1 ст. — 2 ст. — 3 ст. |
5 (7,35) 6 (8,28) 57 (83,82) |
75 (24,92) 72 (23,92) 154 (51,16) |
0,002 0,004 <0,001 |
|
Длительность АГ, лет, Me [Q25; Q75] |
30 [ 19; 35] |
15 [ 8; 25] |
<0,001 |
|
ХОБЛ, ст. бронхообструкции — легкая, n (%) — средняя, n (%) — тяжелая, n (%) — крайне тяжелая, n (%) |
2 (2,94) 11 (16,18) 35 (51,47) 14 (20,59) |
16 (5,31) 77 (25,58) 126 (41,86) 57 (18,94) |
0,406 0,101 0,149 0,756 |
|
Длительность ХОБЛ, лет, Me [Q25; Q75] |
6,0 [ 3,8; 10,0] |
5,0 [ 2,0; 9,0] |
0,043 |
|
Индекс курильщика, пачка/лет, Me [Q25; Q75] |
40 [ 25; 50] |
40 [ 27,5; 50] |
0,901 |
|
Сатурация кислорода на воздухе, %, Me [Q25; Q75] |
91 [ 89; 93] |
92 [ 89; 94] |
0,019 |
|
С-реактивный белок, мг/л, Me [Q25; Q75] |
18,3 [ 3,8; 30,2] |
14,4 [ 1,8; 21,1] |
0,003 |
|
ОФВ1, %, Me [Q25; Q75] |
53,4 [ 23,7; 79,1] |
58,1 [ 32,3; 80,5] |
0,894 |
|
ИМТ, кг/м², Me [Q25; Q75] |
30,7 [ 22,7; 34,8] |
26,9 [ 23,3; 30,7] |
0,004 |
|
ХСН, n (%) |
67 (98,53) |
239 (79,40) |
<0,001 |
Примечание: АГ — артериальная гипертензия, ИМТ — индекс массы тела, ст. — степень, ОФВ1 — объем форсированного выдоха за первую секунду, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность.
Настоящее исследование было одобрено локальным этическим комитетом ФГАОУ ВО Первый Московский государственный медицинский университет им. И. М. Сеченова Минздрава России (Сеченовский Университет), протокол заседания №19-23 от 26.10.2023г.
Всем больным было проведено комплексное клинико-лабораторное и инструментальное обследование, включающее общий и биохимический анализ крови, коагулограмму, определение воспалительных лабораторных маркёров, определение сатурации кислорода пульсоксиметром на воздухе, ЭКГ, эхокардиографическое исследование, суточное мониторирование ЭКГ по Холтеру, суточное мониторирование артериального давления (АД) (СМАД), оценку жесткости сосудистой стенки, компьютерную томографию органов грудной клетки, функцию внешнего дыхания.
Пациенты получали медикаментозную терапию АГ и ХОБЛ в соответствии с современными клиническими рекомендациям [8][9].
Статистическая обработка полученных данных включала методы описательной, сравнительной статистики и регрессионный анализ. Описание количественных переменных проводилось с помощью указания среднего арифметического и стандартного отклонения (M±SD) в случае нормально распределенных данных, либо медианы и интерквартильного размаха (Me [Q25; Q75]), если распределение количественных данных отличалось от нормального. Для построения прогностической модели использован метод биноминальной логистической регрессии с расчетом отношения шансов (OR — odds ratio) и 95% доверительного интервала для каждого выявленного предиктора. Определение порогового значения, чувствительности, специфичности и диагностической эффективности полученной модели проводили с помощью ROC-анализа. При рассчитанном значении p≤0,05, результат считался статистически значимым.
Результаты
Пациенты с пароксизмальной формой ФП имели достоверно более высокую степень АГ и более тяжелую степень бронхообструкции (p<0,001), чем больные без аритмии. Пациенты I группы были несколько старше, имели более высокий индекс массы тела (ИМТ) и частоту развития ХСН, чем во II группе (р<0,001).
При анализе результатов СМАД было выявлено, что в I группе средние значения систолического АД в дневные часы были достоверно выше, чем во II группе и составили 140 [ 133; 144] и 123 [ 117; 136] мм рт.ст. (р=0,002) соответственно (рисунок 1), средние значения диастолического АД достоверно не различались — 74,0 [ 69,0; 82,5] и 76,5 [ 64,8; 86,0] мм рт.ст. (р>0,05).
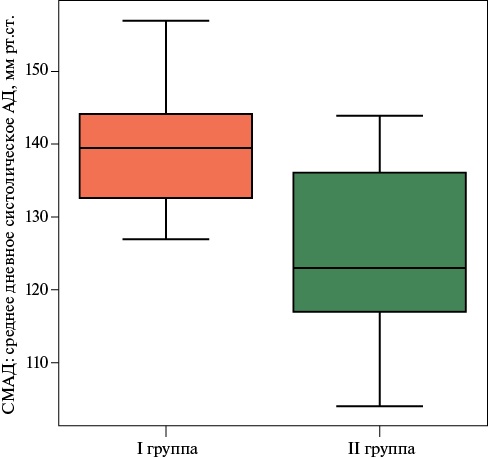
Рис. 1 Средние значения систолического АД у пациентов I и II группы.
Примечание: АД — артериальное давление, СМАД — суточное мониторирование АД.
Для оценки параметров жесткости сосудистой стенки пациентам I и II групп определялся сердечно-лодыжечный сосудистый индекс (CAVI) и лодыжечно-плечевой индекс (ABI). У больных I группы среднее значение индекса CAVI было достоверно выше, чем у пациентов II группы — 9,45 [ 8,57; 10,46] vs 7,89 [ 7,01; 8,49] (p<0,007). По средним значениям индекса ABI достоверных различий между группами не выявлено — 1,03 [ 0,98; 1,24] vs 0,94 [ 0,92; 1,09] (p=0,114).
У всех больных, включенных в исследование, ФВ ЛЖ составила >50%, достоверных различий между группами не было. Пациенты c пароксизмальной формой ФП имели достоверно бóльшие размеры ЛП и ПП, толщины межжелудочковой перегородки (МЖП) и задней стенки левого желудочка (ТЗСЛЖ), чем пациенты без аритмии. Систолическое давление в легочной артерии было достоверно выше у пациентов I группы — 45,2 [ 33,0; 53,0] мм рт.ст., чем во II группе — 39,0 [ 30,0; 46,0] мм рт.ст. (таблица 2).
Таблица 2
Результаты эхокардиографии в исследуемых группах
|
Показатель, Me [Q1; Q3] |
I группа |
II группа |
p |
|
ФВ ЛЖ, % |
60,5 [ 56; 62] |
61,0 [ 59; 63] |
0,125 |
|
КДР ЛЖ, см |
4,50 [ 4,30; 5,00] |
4,45 [ 4,30; 4,90] |
0,533 |
|
КСР ЛЖ, см |
3,10 [ 3,00; 3,32] |
3,00 [ 2,90; 3,30] |
0,219 |
|
КСО ЛЖ, мл |
43 [ 38,5; 51,5] |
43 [ 34,0; 47,8] |
0,149 |
|
КДО ЛЖ, мл |
112 [ 102; 122] |
110 [ 98; 121] |
0,480 |
|
Толщина МЖП, см |
1,30 [ 0,96; 1,20] |
1,00 [ 0,90; 1,10] |
0,013 |
|
Толщина ЗСЛЖ, см |
1,20 [ 0,98; 1,10] |
1,00 [ 0,80; 1,0] |
0,006 |
|
Масса миокарда ЛЖ, г |
196 [ 160; 254] |
169 [ 123; 216] |
0,009 |
|
Размер ЛП, см |
3,9 [ 3,45; 4,1] |
3,5 [ 3,4; 3,8] |
0,009 |
|
Объем ЛП, мл |
58,0 [ 54,0; 71,0] |
54,0 [ 46,5; 62,0] |
0,001 |
|
Индексированный объем ЛП, мл/м² |
31,6 [ 28,4; 40,1] |
28,8 [ 24,8; 31,7] |
0,001 |
|
Площадь ПП, см² |
20,0 [ 18,1; 21,0] |
16,0 [ 14,0; 20,0] |
<0,001 |
|
Базальный диаметр ПЖ, см |
3,90 [ 3,80; 4,30] |
3,70 [ 3,60; 3,90] |
0,013 |
|
СДЛА, мм рт.ст. |
45,2 [ 33,0; 53,0] |
39,0 [ 30,0; 46,0] |
0,049 |
Примечание: ЗСЛЖ — задняя стенка левого желудочка, КДО — конечный диастолический объем, КСО — конечный систолический объем, КДР — конечный диастолический размер, КСР — конечный систолический размер, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, Ме — медиана, ПЖ — правый желудочек, ПП — правое предсердие, СДЛА — систолическое давление в легочной артерии, ФВ — фракция выброса.
При сопоставлении результатов СМАД с параметрами эхокардиографии была выявлена корреляционная зависимость умеренной силы между средним значением систолического АД в дневное время и индексированным объемом ЛП у больных I группы (r=0,35, р<0,05, рисунок 2).
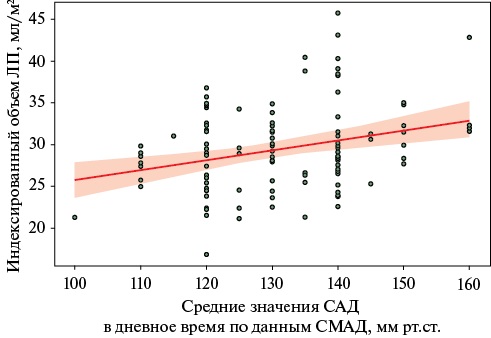
Рис. 2 Корреляционная зависимость между средним значением САД в дневное время и индексированным объемом ЛП у больных I группы.
Примечание: САД — систолическое артериальное давление, СМАД — суточное мониторирование артериального давления, ЛП — левое предсердие.
При проведении многофакторного регрессионного анализа было выявлено, что площадь ПП и индексированный объем ЛП являются потенциальными маркерами пароксизмальной формы ФП у коморбидных пациентов с АГ и ХОБЛ (таблица 3). Для оценки взаимосвязи между размерами предсердий и пароксизмальной формой ФП у пациентов с АГ и ХОБЛ была разработана математическая модель. Наблюдаемая зависимость описывается уравнением:
р = 1 / (1 + e-z) × 100%,
z = -12,51 + 0,130 × XЛП + 0,408 × XПП,
где р — вероятность наличия пароксизмальной формы ФП (%), XПП — площадь ПП (см²); XЛП — индексированный объем ЛП, рассчитанный на площадь поверхности тела (мл/м²).
Таблица 3
Эхокардиографические маркеры пароксизмальной формы ФП у пациентов с АГ и ХОБЛ
|
Показатель |
OR; 95% ДИ |
p |
|
Площадь ПП, см² |
1,50; 1,27-1,79 |
<0,001 |
|
Индексированный объем ЛП, мл/м² |
1,14; 1,03-1,26 |
0,014 |
Примечание: АД — артериальная гипертензия, ДИ — доверительный интервал, ЛП — левое предсердие, ПП — правое предсердие, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, OR — odds ratio (отношение шансов).
Пороговое значение логистической функции р составило 24%: при значениях р≥24% определялась высокая вероятность наличия пароксизмальной формы ФП, при значениях р<24% — низкая вероятность аритмии. Чувствительность и специфичность модели при данном пороговом значении составили 80 и 77%, соответственно, AUC (площадь под ROC-кривой) — 0,89 (рисунок 3). Полученная регрессионная модель является статистически значимой (p<0,001).
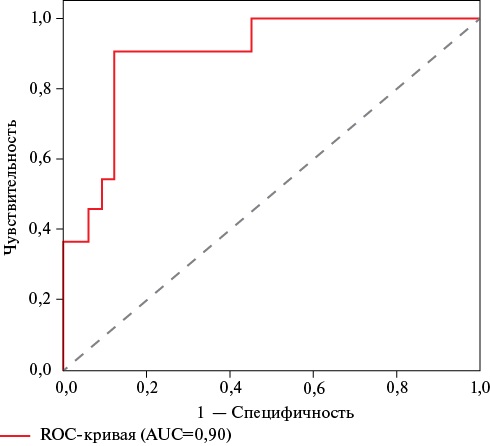
Рис. 3 ROC-кривая для определения чувствительности и специфичности математической модели для оценки взаимосвязи между размерами предсердий и пароксизмальной формой ФП у пациентов с АГ и ХОБЛ.
Примечание: АГ — артериальная гипертензия, ХОБЛ — хроническая обструктивная болезнь легких, ФП — фибрилляция предсердий, AUC — Area Under The ROC Curve (площадь под ROC-кривой).
Обсуждение
В настоящем исследовании было показано, что увеличение индексированного объема ЛП и площади ПП у пациентов с АГ и ХОБЛ являются потенциальными маркерами пароксизмальной формы ФП. Пациенты I группы имели более длительный анамнез АГ и ХОБЛ, более высокие значения систолического АД, тяжелую степень бронхообструкции и гипоксии, что приводило к поражению как левых, так и правых отделов сердца.
Известно, что увеличение размера ЛП, оцененное с помощью рутинной трансторакальной эхокардиографии, позволяет прогнозировать риск развития ФП в общей популяции у широкого круга пациентов [1]. Увеличение размера ЛП можно считать интегральным показателем аритмогенного и гипертонического ремоделирования миокарда и предполагает не только выраженную дилатацию ЛП, но и развитие гипертрофии кардиомиоцитов, пролиферацию фибробластов и сложные изменения внеклеточного матрикса, приводящие к фиброзу предсердий. В большинстве случаев возникновение дилатации ЛП наблюдается у пациентов с АГ и обусловлено увеличением жесткости сосудистой стенки, повышением нагрузки на ЛЖ и развитием гипертрофии ЛЖ [10]. Известно, что при увеличении индекса массы миокарда ЛЖ на каждые 40 г/м² частота ФП повышается в 1,45 раза [2].
В настоящей работе при обследовании коморбидных пациентов с АГ и ХОБЛ наряду с изменениями левых отделов сердца в виде гипертрофии ЛЖ и увеличения объема ЛП, было отмечено значительное ремоделирование правых отделов сердца. Бронхообстуктивный синдром, хроническая гипоксия и гиперкапния, возникающие у пациентов с тяжелой стадией ХОБЛ, приводят к увеличению общего сосудистого сопротивления в малом круге кровообращения, легочной гипертензии и повышению нагрузки на правый желудочек (ПЖ). Дилатация ПЖ приводит к повышению давления и последующей быстрой дилатации ПП. Появление в ПП участков фиброза способствует возникновению зон эктопической активности, что обеспечивает развитие и поддержание предсердных аритмий [11].
В исследовании MESA (Multi-Ethnic Study of Atherosclerosis) при обследовании большой выборки пациентов было показано, что индексы максимального и минимального объема ПП, измеренные с помощью магнитно-резонансной томографии сердца, имели высокое прогностическое значение для возникновения ФП по сравнению с обычными факторами риска сердечно-сосудистых заболеваний и размерами ЛП. Авторы сделали вывод, что оценка размера ПП является значимым предиктором развития ФП [12]. В работе Bai Y, et al. [13] при обследовании пациентов с хроническим заболеваниями легких было показано, что увеличение размера как ЛП, так и ПП значительно повышало риск рецидива ФП после абляции.
В исследовании Mourik MJW, et al. было показано, что заболевания сердечно-сосудистой и бронхолегочной систем способствуют прогрессирующему процессу ремоделирования не только ЛП, но и ПП, что сочетается со структурными, электрическими и функциональными изменениями предсердной ткани и неизбежно приводит к появлению ФП [14].
Увеличение объема ЛП широко используется в качестве предиктора высокого риска ФП. В настоящей работе продемонстрировано, что увеличение площади ПП, ассоциировано с пароксизмальной формой ФП у пациентов с АГ и ХОБЛ.
Таким образом, результаты данного исследования доказывают взаимосвязь между дилатацией ЛП и ПП с пароксизмальной формой ФП у пациентов АГ и ХОБЛ.
Ограничения исследования: проведен ретроспективный анализ историй болезни, на основании которого была выявлена взаимосвязь между дилатацией ПП и пароксизмальной формой ФП, для выявления прогностического значения дилатации ПП в развитии новых случаев ФП необходимо проведение проспективного наблюдения.
Заключение
Увеличение площади ПП (OR 1,50; ДИ: 1,27-1,79) ассоциировано с пароксизмальной формой ФП у больных с АГ и ХОБЛ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. doi:10.15829/1560-4071-2021-4594.
2. Чазова И. Е., Голицын С. П., Жернакова Ю. В. и др. Ведение пациентов с артериальной гипертонией и фибрилляцией предсердий. Системные гипертензии. 2021;18(3):105-28. doi:10.26442/2075082X. 2021.3.201077.
3. Hansson L, Lindholm LH, Niskanen L, et al. Effect of angiotensin-converting-enzyme inhibition compared with conventional therapy on cardiovascular morbidity and mortality in hypertension: the Captopril Prevention Project (CAPPP) randomised trial. Lancet. 1999;353(9153):611-6. doi:10.1016/S0140-6736(98)05012-0.
4. Dahlöf B, Devereux RB, Kjeldsen SE, et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): A randomised trial against atenolol. Lancet. 2002;359(9311):995-1003. doi:10.1016/S0140-6736(02)08089-3.
5. Buch P, Friberg J, Scharling H, et al. Reduced lung function and risk of atrial fibrillation in the Copenhagen City Heart Study. Eur Respir J. 2003;21(6):1012-6. doi:10.1183/09031936.03.00051502.
6. Shibata Y, Watanabe T, Osaka D, et al. Impairment of pulmonary function is an independent risk factor for atrial fibrillation: the Takahata study. Int J Med Sci. 2011;8(7):514-22. doi:10.7150/ijms.8.514.
7. Хидирова Л. Д., Яхонтов Д. А., Зенин С. А. и др. Влияние хронической обструктивной болезни легких и артериальной гипертензии на развитие и прогрессирование фибрилляции предсердий. Кардиоваскулярная терапия и профилактика. 2019;18(5):138-44. doi:10.15829/1728-8800-2019-5-138-144.
8. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(9):6117. doi:10.15829/1560-4071-2024-6117.
9. Чучалин А. Г., Авдеев С. Н., Айсанов З. Р. и др. Хроническая обструктивная болезнь легких: федеральные клинические рекомендации по диагностике и лечению. Пульмонология. 2022;32(3):356-92. doi:10.18093/0869-0189-2022-32-3-356-392.
10. Подзолков В. И., Тарзиманова А. И. Современные предикторы прогрессирования фибрилляции предсердий. Рациональная фармакотерапия в кардиологии. 2019;15(2):149-58. doi:10.20996/1819-6446-2019-15-2-14-158.
11. Глова С. Е., Разумовский И. В. Хроническая обструктивная болезнь легких и фибрилляция предсердий. Южно-Российский журнал терапевтической практики. 2021;2(4):22-9. doi:10.21886/2712-8156-2021-2-4-22-29.
12. Xie E, Yu R, Ambale-Venkatesh B, et al. Association of right atrial structure with incident atrial fibrillation: a longitudinal cohort cardiovascular magnetic resonance study from the Multi-Ethnic Study of Atherosclerosis (MESA). J Cardiovasc Magn Reson. 2020;22(1):36. doi:10.1186/s12968-020-00631-1.
13. Bai Y, Zhao Y, Li J, et al. Association of peak atrial longitudinal strain with atrial fibrillation recurrence in patients with chronic lung diseases following radiofrequency ablation. Intern Med J. 2018;48:851-9. doi:10.1111/imj.13768.
14. Mourik MJW, Artola Arita V, Lyon A, et al. Association between comorbidities and left and right atrial dysfunction in patients with paroxysmal atrial fibrillation: Analysis of AF-RISK. Int J Cardiol. 2022;360:29-35. doi:10.1016/j.ijcard.2022.05.044.
Об авторах
А. И. ТарзимановаРоссия
Аида Ильгизовна Тарзиманова — д.м.н., профессор кафедры факультетской терапии № 2 ИКМ им. Н. В. Склифосовского
Москва
Е. В. Казанцева
Россия
Евгения Вадимовна Казанцева — аспирант кафедры факультетской терапии № 2 ИКМ им. Н. В. Склифосовского
Москва
А. А. Иванников
Россия
Александр Александрович Иванников — аспирант кафедры факультетской терапии № 2 ИКМ им. Н. В. Склифосовского
Москва
Н. К. Зискина
Россия
Надежда Константиновна Зискина — клинический ординатор кафедры факультетской терапии № 2 ИКМ им. Н. В. Склифосовского
Москва
В. И. Подзолков
Россия
Валерий Иванович Подзолков — д.м.н., профессор, зав. кафедрой факультетской терапии № 2, директор клиники факультетской терапии № 2 ИКМ им. Н. В. Склифосовского
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Дилатация полости левого предсердия ассоциирована с увеличением риска развития фибрилляции предсердий (ФП).
- Распространенность ФП значительно выше у коморбидных пациентов с артериальной гипертензией (АГ) и хронической обструктивной болезнью легких (ХОБЛ), чем в общей популяции.
Что добавляют результаты исследования?
- У коморбидных пациентов с АГ и ХОБЛ дилатация не только левого, но и правого предсердия взаимосвязана с пароксизмальной формой ФП.
- Разработана математическая модель для оценки вероятности наличия пароксизмальной формы ФП у пациентов с АГ и ХОБЛ по основании проведения трансторакальной эхокардиографии.
Рецензия
Для цитирования:
Тарзиманова А.И., Казанцева Е.В., Иванников А.А., Зискина Н.К., Подзолков В.И. Взаимосвязь дилатации правого предсердия с пароксизмальной формой фибрилляции предсердий у пациентов артериальной гипертензией и хронической обструктивной болезнью легких. Кардиоваскулярная терапия и профилактика. 2025;24(2):4252. https://doi.org/10.15829/1728-8800-2025-4252. EDN: FMXHGB
For citation:
Tarzimanova A.I., Kazantseva E.V., Ivannikov A.A., Ziskina N.K., Podzolkov V.I. Relationship between right atrial dilation and paroxysmal atrial fibrillation in patients with hypertension and chronic obstructive pulmonary disease. Cardiovascular Therapy and Prevention. 2025;24(2):4252. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4252. EDN: FMXHGB

























































