Перейти к:
Связь эпикардиального и висцерального ожирения с характером ремоделирования миокарда у пациентов с приобретенным пороком митрального клапана
https://doi.org/10.15829/1728-8800-2025-4301
EDN: OCMQUJ
Аннотация
Цель. Изучить связь эпикардиального и висцерального ожирения (ВО) с характером ремоделирования сердца у пациентов с приобретенным пороком митрального клапана (МК), имеющих показания для хирургической коррекции порока.
Материал и методы. В исследование включены 49 пациентов, госпитализированных для коррекции приобретенного порока МК неинфекционного генеза. Пациенты были разделены на группы согласно результатам мультиспиральной компьютерной томографии: 1 группа с ВО: висцеральная жировая ткань ≥130 см² (n=28), и 2 группа без ВО (n=21).
Результаты. В группе пациентов с ВО имело место более выраженное нарушение глобальной продольной деформации левого желудочка (ЛЖ) по сравнению с группой без ВО (-15,65 [-18,8; -11,6] vs -19,4 [-21,3; -16,9]%, р=0,020). Фракция выброса правого желудочка (3Д-эхокардиография) в 1-й группе была ниже по сравнению с пациентами группы 2: медиана 46 [40,6; 48,9] vs 53 [45,8; 54,2]% (p=0,042). Выявлено, что увеличение объема эпикардиальной жировой ткани (ЭЖТ) на 1 см³ по данным мультиспиральной компьютерной томографии ассоциировано с увеличением левого предсердия на В-коэффициент 0,009 (р=0,001), конечного систолического объема ЛЖ на В-коэффициент =0,1224 (р=0,046). Индекс висцеральная жировая ткань/подкожная жировая ткань >0,4 связан с увеличением индекса массы миокарда ЛЖ на В-коэффициент =44,7 (р=0,001). По данным ROC-анализа объем ЭЖТ >115,1 см³ ассоциирован с наличием нарушений ритма сердца по типу фибрилляции предсердий — AUC (площадь под ROC-кривой)=0,714 (р=0,003).
Заключение. Наличие ВО ассоциировано с более выраженным структурно-функциональным нарушением желудочков сердца, а значение ЭЖТ >115,1 см³ ассоциировано с наличием фибрилляции предсердий у пациента до коррекции порока МК.
Ключевые слова
Для цитирования:
Дрень Е.В., Ляпина И.Н., Стасев А.Н., Мамчур И.Н., Брель Н.К., Кареева А.И., Барбараш О.Л. Связь эпикардиального и висцерального ожирения с характером ремоделирования миокарда у пациентов с приобретенным пороком митрального клапана. Кардиоваскулярная терапия и профилактика. 2025;24(2):4301. https://doi.org/10.15829/1728-8800-2025-4301. EDN: OCMQUJ
For citation:
Dren' E.V., Lyapina I.N., Stasev A.N., Mamchur I.N., Brel N.K., Kareeva A.I., Barbarash O.L. Relationship between epicardial/visceral obesity and features of myocardial remodeling in patients with acquired mitral valve disease. Cardiovascular Therapy and Prevention. 2025;24(2):4301. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4301. EDN: OCMQUJ
Введение
Ремоделирование сердца представляет собой динамический обратимый процесс, протекающий на клеточном (отдельные кардиомиоциты), межклеточном (изменения в интерстиции миокарда) и органном (изменение геометрии сердца) уровнях, отражающийся в изменении размеров, формы, структурно-функциональных особенностей камер сердца [1].
У пациентов с приобретенными пороками сердца (ППС) процессы ремоделирования миокарда зависят не только от типа и генеза порока, выраженности нарушений внутрисердечной гемодинамики и гемодинамики малого круга кровообращения, но и от характера и тяжести коморбидной патологии [2]. В рамках коморбидной патологии одной из наиболее частых является ожирение, встречающееся у 19% пациентов с ППС [3].
В ряде исследований выявлен весомый вклад ожирения в процесс ремоделирования миокарда [4]. Доказано, что ожирение, наряду с такими факторами, как возраст, артериальная гипертензия, сахарный диабет (СД) 2 типа является фактором риска кальциноза клапанного аппарата [5].
Накопленные к настоящему времени данные о влиянии висцеральной жировой ткани (ВЖТ) на структурно-функциональные особенности камер сердца получены в основном у пациентов с коронарной патологией [6][7]. Влияние компонентов висцерального ожирения (ВО) на клапанный аппарат сердца оценено преимущественно в экспериментальных исследованиях. Это определяет актуальность дальнейших клинических исследований, направленных на изучение различных составляющих ожирения и их влияние на характер ремоделирования сердца при ППС [4][8].
Цель настоящего исследования — изучение связи эпикардиального ожирения и ВО с характером ремоделирования сердца у пациентов с приобретенным пороком митрального клапана (МК), имеющих показания для хирургической коррекции порока.
Материал и методы
В одномоментное исследование были включены 49 пациентов (медиана (Ме) возраста 65 [ 57,5; 63,3], женщин — 53%), подвергнутых кардиохирургической коррекции приобретенного порока МК в условиях искусственного кровообращения в период с сентября по декабрь 2024г. Настоящая публикация отражает результаты дооперационной оценки пациентов.
Критерии включения: возраст пациента 35-75 лет; изолированная коррекция приобретенного порока МК или в сочетании с коррекцией порока аортального клапана/трикуспидального клапана неинфекционного генеза; подписанное письменное согласие на участие в исследовании. Критерии невключения: генез порока МК, связанный с инфекционным эндокардитом; масса тела >120 кг; нарушения ритма и проводимости сердца: частая желудочковая экстрасистолия; стойкая синусовая тахикардия (>120 уд./мин); тахиформа фибрилляции предсердий (ФП)/трепетания предсердий (ТП); абсолютные противопоказания к проведению мультиспиральной компьютерной томографии (МСКТ) сердца, гемодинамически значимые стенозы коронарных и периферических артерий, требующие реваскуляризации; выраженная дыхательная недостаточность II-III ст.; беременность; лактация; тяжелые нарушения функции печени (>9 баллов по шкале Чайлд-Пью, класс С); тяжелые нарушения функции почек (скорость клубочковой фильтрации <30 мл/мин/1,73 м²); потребность в гемодиализе.
Исследование проведено на базе НИИ комплексных проблем сердечно-сосудистых заболеваний при поддержке гранта Российского научного фонда № 24-75-10031. Исследование проведено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practive) и принципами Хельсинкской Декларации. Протокол исследования одобрен локальным этическим комитетом Научного исследовательского института комплексных проблем сердечно-сосудистых заболеваний (заседание локального этического комитета № 7 от 16.09.2024).
Помимо стандартного клинико-инструментального обследования выполнена трансторакальная эхокардиография (ЭхоКГ) (ультразвуковой прибор экспертного класса Vivid E9 (GE Healthcare, США) с оценкой деформации желудочков сердца (strain), систолической функции правого желудочка (ПЖ) по данным 2-мерной ЭхоКГ (датчик M5S-D) (систолическая экскурсия кольца трикуспидального клапана (TAPSE — tricuspid annular plane systolic excursion), фракционное изменение площади ПЖ) и 3-мерной ЭхоКГ (датчик 4V-D) с оценкой фракции выброса (ФВ) ПЖ, с последующим переносом изображений с прибора на рабочую станцию EchoPac PC (GE Healthcare, США) для обработки. Глобальная продольная деформация миокарда левого желудочка (ЛЖ) для пациентов с синусовым ритмом оценивалась в 17 сегментах ЛЖ в режиме 2D speckle-tracking из апикальных позиций (4-камерной, 2-камерной и по длинной оси ЛЖ), для ПЖ глобальная продольная деформация оценивалась в трех сегментах свободной стенки в 4-камерной позиции. Для пациентов с ФП глобальная продольная деформация для ЛЖ и ПЖ оценивалась в тех же позициях в циклах одинаковой продолжительности (цикл отличался не более, чем на 10 уд./мин). В протоколе фиксировалось среднее значение из 5 измерений.
МСКТ органов брюшной полости (64-срезовый компьютерный томограф Siemens Somatom 64 (Siemens, Германия)) использовали для измерения площади ВЖТ и подкожной жировой ткани (ПЖТ). Критерием наличия ВО считалась площадь ВЖТ ≥130 см² (рисунки 1, 2) [7]. Выполнена МСКТ сердца с ЭКГ-синхронизацией на 64-срезовом компьютерном томографе GE LightSpeed VC XT с целью измерения объема эпикардиальной жировой ткани (ЭЖТ).
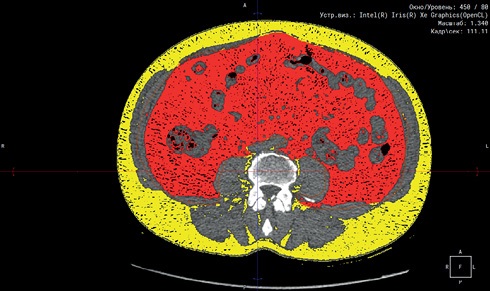
Рис. 1 МСКТ на уровне L3-L5 для расчета площади ВЖТ: красным цветом — ВЖТ; желтым цветом — ПЖТ.
Примечание: ВЖТ — висцеральная жировая ткань, МСКТ — мультиспиральная компьютерная томография, ПЖТ — подкожная жировая ткань. Цветное изображение доступно в электронной версии журнала.
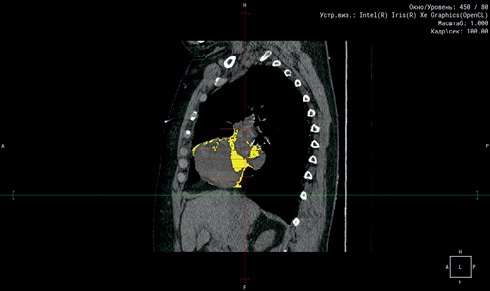
Рис. 2 МСКТ сердца для расчета объема ЭЖТ: желтым цветом — ЭЖТ.
Примечание: МСКТ — мультиспиральная компьютерная томография, ЭЖТ — эпикардиальная жировая ткань. Цветное изображение доступно в электронной версии журнала.
Статистический анализ данных проводился с помощью стандартных непараметрических методов посредством программы MedCalc. Распределение данных отличалось от нормального. Количественные переменные представлены в виде медианы и интерквартильного размаха (Ме [Q25; Q75]), качественные — в виде процентного соотношения. При оценке различий количественных показателей использовались непараметрический критерий Манна-Уитни. Для оценки различий качественных показателей применялся критерий χ² Пирсона. Динамика показателей внутри группы оценивалась с помощью критерия Вилкоксона. Результаты логистического регрессионного анализа представлены в виде отношения шансов (OR — odds ratio). Результаты линейного регрессионного анализа представлены как B-коэффициент. Receive Operative Curve (ROC)-кривые использовались для расчета порогового значения для показателей, сочетание оптимальных значений специфичности и чувствительности выбирались для представленных значимых показателей. Модель считалась хорошего/среднего качества при р<0,05 и площади под ROC-кривой — AUC (Area Under The ROC Curve) >0,6. Критическим уровнем статистической значимости принималась величина p<0,05.
Результаты
Генез порока у пациентов был обусловлен синдромом соединительнотканной дисплазии (n=20, 40,8%), ревматической болезнью сердца (n=19, 38,8%), дегенеративный генез порока выявлялся у 10 (20,4%) пациентов. Характер поражения МК был представлен следующим образом: стеноз МК — n=2 (4,1%), недостаточность МК — n=28 (57,1%), сочетанный порок МК — n=19 (38,8%).
Избыточную массу тела/ожирение (индекс массы тела (ИМТ) ≥25 кг/м²) имели 26 пациентов (53%).
По данным проведенной до оперативного вмешательства МСКТ органов брюшной полости на уровне L3-L5 пациенты (n=49) были разделены на две группы: с ВО (1 группа; n=28), у которых площадь ВЖТ была ≥130 см², и группа без ВО (2 группа; n=21).
Медиана возраста в группе с ВО составила 65 [ 57,5; 66,5] лет, в группе без ВО — 63 [ 51; 69,8] года (р=0,800). В группе с ВО превалировали лица женского пола — n=19 (67,8%), по сравнению с группой без ВО — n=7 (33,3%) (р=0,018). Характер поражения клапанного аппарата, функциональный статус пациентов и коморбидный фон представлены в таблице 1. Пациенты групп с ВО и без ВО были сопоставимы по типу порока и функциональному статусу и по тяжести сердечной недостаточности.
Таблица 1
Характеристика пациентов с приобретенным пороком МК в зависимости от наличия ВО
Показатель | Группа | p | |
I (с наличием ВО) | II (с отсутствием ВО) | ||
Пол, женщины, n (%) | 19 (67,9) | 7 (33,3) | 0,01 |
Возраст, лет, Ме [Q25; Q75] | 65,0 [ 57,5; 66,5] | 63,0 [ 51; 69,8] | 0,8 |
Курение, n (%) | 13 (46,4) | 9 (45) | 0,92 |
Этиология порока МК, n (%): — Дегенеративные изменения — Ревматическая болезнь сердца — Соединительнотканная дисплазия | 5 (17,9) 13 (46,4) 11 (39,3) | 5 (23,8) 7 (33,3) 9 (42,9) | 0,61 0,36 0,8 |
Тип порока МК, n (%): — стеноз МК — недостаточность МК — сочетанный порок МК | 0 15 (53,6) 13 (46,4) | 2 (9,5) 13 (61,9) 6 (28,6) | 0,09 0,56 0,2 |
Комбинированный порок, n (%): — c недостаточностью/стенозом аортального клапана — с недостаточностью трикуспидального клапана | 4 (14,3) 4 (14,3) | 4 (19,0) 7 (33,3) | 0,66 0,12 |
Характеристика ритма сердца, n (%): — синусовый — ФП: • Пароксизмальная • Персистирующая • Постоянная — желудочковая экстрасистолия (IVа-V градации по Lown) | 13 (46,4) 15 (53,6) 4 (15,4) 7 (26,9) 4 (15,4) 8 | 12 (57,1) 9 (42,9) 3 (14,3) 2 (9,5) 4 (19) 0 | 0,46 0,91 0,13 0,74 0,008 |
ИМТ, кг/м², Ме [Q25; Q75] | 28,7 [ 25,9; 33,9] | 22,6 [ 21,0; 24,1] | <0,001 |
Стадии ХСН, n (%): — предстадия — I — II | 2 (7,1) 26 (92,9) 0 | 1 (4,8%) 20 (95,2) 0 | 0,73 0,73
|
ФК ХСН по NYHA, n (%): — I — II — III — IV | 0 14 (50) 12 (42,9) 2 (7,1) | 0 14 (66,7) 7 (33,3) 0 | 0,25 0,5 0,22 |
Дистанция теста 6-минутной ходьбы, м, Me [Q25; Q75] | 315,0 [ 261,0; 415,0] | 366,0 [ 258,0; 428,0] | 0,57 |
ИБС, не требующая реваскуляризации, n (%): | 10 (35,7) | 7 (33,3) | 0,86 |
СКФ по CKD EPI, мл/мин/1,73 м², Me [Q25; Q75] | 64,5 [ 55,2; 87,0] | 73,4 [ 60,0; 92,0] | 0,33 |
ХБП 3А-5 стадии, n (%) | 10 (35,7) | 3 (14,3) | 0,11 |
СД 2 типа, n (%) | 7 (25) | 2 (9,5) | 0,17 |
АГ, n (%) | 21 (75) | 12 (57,1) | 0,19 |
Бронхиальная астма, n (%) | 1 | 0 | 0,38 |
Патология щитовидной железы, n (%) | 4 (14,3) | 2 (9,5) | 0,49 |
ОНМК, n (%) | 4 | 2 (9,5) | 0,61 |
Онкопатология, n (%) | 3 | 0 | 0,12 |
Примечание: АГ — артериальная гипертензия, ВО — висцеральное ожирение, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, МК — митральный клапан, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, ОНМК — острое нарушение мозгового кровообращения, ФК — функциональный класс, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность, Me [Q25; Q75] — медиана [интерквартильный размах], NYHA — New York Heart Association.
У лиц с ВО отмечалась бóльшая окружность талии по сравнению с лицами без ВО (102 [ 96; 109,2] vs 87,5 [ 79,4; 91,7] см, р=0,001).
Из сопутствующей патологии бóльшая часть пациентов обеих групп имели артериальную гипертензию, также было распространено нарушение ритма сердца по типу ФП/ТП, СД 2 типа, однако без значимых различий между группами. Стоит отметить, что пациенты с ВО значимо чаще имели желудочковую экстрасистолию IVа — V градаций по Lown (р=0,008) (таблица 1).
При оценке принимаемой медикаментозной терапии, отмечено, что β-адреноблокаторы до операции принимало значимо большее количество пациентов в группе с ВО (n=25, 89,3%) по сравнению с группой без ВО (n=13, 61,9%), р=0,035. Вероятно, это обусловлено наличием в группе с ВО значимо большего числа лиц с высокой градацией желудочковой экстрасистолии. При сравнении характера принимаемой терапии в двух группах пациентов других значимых различий более выявлено не было (таблица 2).
Таблица 2
Сравнительная характеристика медикаментозного лечения пациентов с приобретенным пороком МК в зависимости от наличия ВО
Группа препаратов, n (%) | Группа | p | |
I (с наличием ВО) | II (с отсутствием ВО) | ||
β-адреноблокаторы | 25 (89,3) | 13 (61,9) | 0,035 |
Блокаторы кальциевых каналов | 1 (3,6) | 1 (4,8) | 0,765 |
Cтатины | 16 (57,1) | 10 (47,6) | 0,456 |
Ацетилсалициловая кислота | 8 (28,6) | 5 (23,8) | 0,543 |
Ингибиторы ангиотензинпревращающего фермента | 9 (32,1) | 7 (33,0) | 0,765 |
Блокаторы рецептора ангиотензина-II | 9 (32,1) | 4 (19,0) | 0,451 |
Антикоагулянты | 15 (53,6) | 9 (42,9) | 0,324 |
Диуретики | 22 (78,6) | 11 (52,4) | 0,075 |
Антиаритмические препараты | 1 (3,6) | 2 (9,5) | 0,435 |
Антагонисты альдостерона | 17 (60,7) | 9 (42,9) | 0,238 |
Дапаглифлозин | 7 (25,0) | 5 (23,0) | 0,765 |
Примечание: ВО — висцеральное ожирение, МК — митральный клапан.
При оценке особенностей структурно-функциональных нарушений желудочков сердца по данным трансторакальной ЭхоКГ выявлено, что в группе пациентов с ППС МК и ВО имело место значимо более выраженное нарушение глобальной продольной деформации ЛЖ — GLS LV (global longitudinal strain left ventricle), по сравнению с группой без ВО — -15,65 [ -18,8; -11,6] vs -19,4 [ -21,3; -16,9]% (р=0,020), соответственно (таблица 3).
Таблица 3
Параметры ремоделирования сердца пациентов с приобретенным пороком МК в зависимости от наличия ВО
Показатель, Me [Q25; Q75] | Группа | p | |
I (с наличием ВО) | II (с отсутствием ВО) | ||
GLS LV, % | -15,65 [ -18,8; -11,6] | -19,4 [-21,3; -16,9] | 0,020 |
GLS LV, % у лиц с ФП/ТП | -15,7 [ 18,3; 10,35] | -18,95 [-21,25; -13,9] | 0,206 |
GLS LV, % у лиц с синусовым ритмом | -15,2 [ -19,5; 12,2] | -19,4 [-22,6; -17,35] | 0,096 |
GLPS RV, % | -18 [ -23,1; 13,7] | -20,1 [-27,2; 16,4] | 0,098 |
GLPS RV, % у лиц с ФП/ТП | -18,1 [ -22,47; -13,22] | -19,75 [-25,3; -15,0] | 0,433 |
GLPS RV, % у лиц c синусовым ритмом | -17,5 [ -22,9; -14,35] | -20,1 [-27,3; -17,05] | 0,141 |
КДР ЛЖ, см | 5,8 [ 5,4; 6,2] | 5,9 [ 5,3; 6,7] | 0,739 |
КСР ЛЖ, см | 3,8 [ 3,5; 4] | 3,9 [ 3,2; 4,1] | 0,800 |
КСО ЛЖ, мл | 47 [ 41,7; 51,6] | 43 [ 36,5; 58] | 0,762 |
КДО ЛЖ, мл | 134 [ 105,1; 147,9] | 131,5 [ 104,2; 169,2] | 0,707 |
Ударный объем ЛЖ, мл | 79 [ 56; 89,3] | 78,5 [ 66,3; 98,5] | 0,601 |
ФВ ЛЖ, % | 63 [ 61; 65,3] | 63,5 [ 58,3; 66] | 0,769 |
Масса миокарда, г | 254,5 [ 207; 296,3] | 215 [ 175,6; 309,5] | 0,671 |
Индекс массы миокарда, г/м² | 129 [ 112,5; 145,6] | 131 [ 112,5; 166,4] | 0,642 |
ЛП, см | 5,3 [ 5,2; 5,7] | 5,2 [ 4,9; 5,8] | 0,605 |
Индексированный объем ЛП, мл/м² | 60 [ 54; 68,6] | 74 [ 61,4; 84,9] | 0,135 |
Площадь ПП, см² | 21,1 [ 17,1; 27,3] | 20 [ 15,9; 26,8] | 0,728 |
Индексированный объем ПП, мл/м² | 39 [ 33; 46,6] | 37 [ 32; 62,4] | 0,952 |
Базальный размер ПЖ, см | 3,6 [ 3,3; 4] | 3,5 [ 3,2; 4] | 0,911 |
КДО ПЖ, мл | 98 [ 73; 116,8] | 95 [ 74,1; 114,7] | 0,957 |
КСО ПЖ, мл | 52 [ 39,7; 64,3] | 53 [ 44,5; 61] | 0,850 |
Ударный объем ПЖ, мл | 42 [ 35,7; 53,9] | 42 [ 37,8; 57,4] | 0,560 |
Фракционное изменение площади ПЖ, % | 38 [ 33,6; 45,4] | 45 [ 39,1; 49,2] | 0,121 |
Систолическая экскурсия кольца трикуспидального клапана, см | 1,5 [ 1,2; 1,8] | 1,8 [ 1,5; 2,2] | 0,075 |
ФВ ПЖ, % | 46 [ 40,6; 48,9] | 53 [ 45,8; 54,2] | 0,0429 |
Систолическое давление в легочной артерии, мм рт.ст. | 50 [ 36,8; 57,3] | 44 [ 32,1; 57,2] | 0,544 |
Степень трикуспидальной регургитации | 1 [ 1; 2] | 1 [ 1; 2,4] | 0,498 |
Примечание: ВО — висцеральное ожирение, КДО — конечный диастолический объем, КДР — конечный диастолический размер, КСО — конечный систолический объем, КСР — конченый систолический размер, ЛЖ — левый желудочек, ЛП — левое предсердие, МК — митральный клапан, ПЖ — правый желудочек, ПП — правое предсердие, ФВ — фракция выброса, ФП/ТП — фибрилляция предсердий/трепетание предсердий, Me [Q25; Q75] — медиана [интерквартильный размах], GLS LV — global longitudinal strain left ventricle, GLPS RV — global longitudinal peak strain right ventricle.
Оценивая связь различных составляющих ожирения и характера ремоделирования сердца, согласно результатам однофакторного линейного регрессионного анализа отмечено, что увеличение объема ЭЖТ на 1 см³ ассоциировано с увеличением левого предсердия (ЛП) на В-коэффициент 0,009 (р=0,001) и конечного систолического объема (КСО) ЛЖ на В-коэффициент 0,1224 (р=0,046).
Как известно, индекс площади ВЖТ/ПЖТ >0,4 является отражением высокого кардиометаболического риска [9]. В настоящем исследовании продемонстрировано, что индекс ВЖТ/ПЖТ >0,4 ассоциируется с увеличением индекса массы миокарда ЛЖ на В-коэффициент 44,7 (р=0,001), а также с увеличением конечного диастолического размера (КДР) ЛЖ и конечного систолического размера (КСР) ЛЖ на В-коэффициент 0,7 (р=0,017) и на В-коэффициент 0,4957 (р=0,012), соответственно.
По данным логистического регрессионного анализа наличие ВО (согласно данным МСКТ) ассоциируется с 5-кратным увеличением шансов выявления нарушенной продольной деформации ЛЖ (GLS LV >-18%) [10], OR 5,0, 95% доверительный интервал (ДИ): 1,34-18,55 (р=0,012). Помимо ВО наличие нарушенной продольной деформации миокарда ЛЖ (GLS LV >-18%) [10] связано с такой сопутствующей патологией, как хроническая болезнь почек (ХБП) ≥3А стадии (р=0,017) и СД 2 типа (p=0,006) (рисунок 3).

Рис. 3 Предикторы нарушенной продольной деформации ЛЖ по данным логистического регрессионного анализа.
Примечание: ДИ — доверительный интервал, СД — сахарный диабет, ХБП — хроническая болезнь почек, МСКТ — мультиспиральная компьютерная томография, OR — odds ratio (отношение шансов).
ВО ассоциируется с изменением не только структурно-функциональных особенностей левых камер сердца, но и с систолической функцией ПЖ. При проведении 3-мерной ЭхоКГ отмечено, что величина ФВ ПЖ у лиц, имеющих ВО, была значимо ниже по сравнению с лицами без ВО: Ме ФВ ПЖ 46 [ 40,6; 48,9] vs 53 [ 45,8; 54,2]%, (p=0,042). При этом увеличение площади ВЖТ на 1 см² ассоциируется с уменьшением ФВ ПЖ (по данным 3D ЭхоКГ) на В-коэффициент -0,050 (р=0,006).
По результатам проведенного ROC-анализа установлено, что величина ФВ ПЖ ≤52% до хирургической коррекции ППС МК (чувствительность 85,7% и специфичность 52,6%, AUC=0,688, 95% ДИ: 0,52-0,83, p=0,028) ассоциирована с наличием ВО (рисунок 4). При этом увеличение объема ЭЖТ на 1 см³ ассоциируется с уменьшением TAPSE на В-коэффициент -0,003, р=0,037.
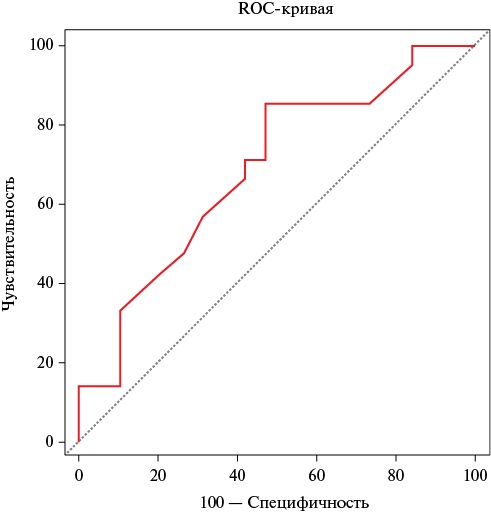
Рис. 4 ROC-кривая связи величины ФВ ПЖ до операции с наличием ВО у пациентов с приобретенным пороком МК (AUC=0,688, p=0,028).
Примечание: ВО — висцеральное ожирение, МК — митральный клапан, ПЖ — правый желудочек, ФВ — фракция выброса, AUC — Area Under The ROC Curve (площадь под ROC-кривой).
Ассоциации между выраженностью ВО и нарушением продольной деформации ПЖ выявлено не было. В свою очередь, с нарушением продольной деформации миокарда ПЖ (global longitudinal peak strain >-20% [11]) до операции связано наличие следующих факторов: наличие ишемической болезни сердца (ИБС) (р=0,004), ХБП ≥3А стадии (р=0,026), систолическое давление в легочной артерии ≥37 мм рт.ст. по данным ЭхоКГ (р=0,031) (рисунок 5).
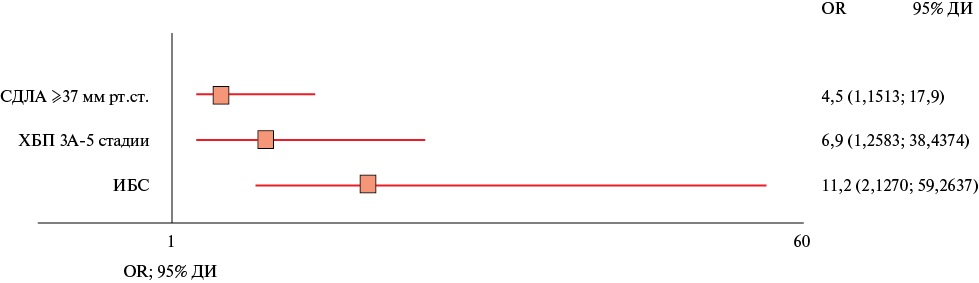
Рис. 5 Предикторы нарушения продольной деформации ПЖ по данным логистического регрессионного анализа.
Примечание: ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, СДЛА — систолическое давление в легочной артерии, ХБП — хроническая болезнь почек, OR — odds ratio (отношение шансов).
По результатам проведенного ROC-анализа объем ЭЖТ >115,1 см³ с чувствительностью 52% и специфичностью 84,6% ассоциирован с наличием до хирургической коррекции ППС МК нарушений ритма сердца по типу ФП/ТП (AUC=0,714, 95% ДИ: 0,57-0,83, р=0,003) (рисунок 6).
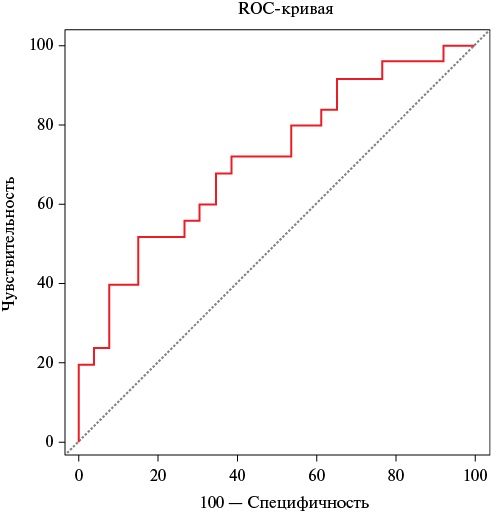
Рис. 6 ROC-кривая связи показателя объема ЭЖТ и наличия ФП/ТП у пациентов с приобретенным пороком МК до операции (AUC=0,714, р=0,003).
Примечание: МК — митральный клапан, ТП — трепетание предсердий, ФП — фибрилляция предсердий, ЭЖТ — эпикардиальная жировая ткань, AUC — Area Under The ROC Curve (площадь под ROC-кривой).
Обсуждение
Ремоделирование миокарда является фактором неблагоприятного прогноза у пациентов с ППС, однако этот фактор можно модифицировать. Характер структурно-функциональных нарушений желудочков сердца до операции, как и эффективное обратное ремоделирование миокарда у пациентов после кардиохирургической коррекции порока сердца, является отражением успеха кардиохирургического вмешательства.
На ранних стадиях заболевания, когда еще не развилась яркая клиническая картина ППС, признаки ремоделирования и дисфункции сердца по данным стандартного протокола ЭхоКГ выявить не удается, поскольку они развиваются на более поздней стадии ППС, когда, вероятно, уже произошло необратимое повреждение миокарда. При этом проведение биопсии ЛЖ у бессимптомных пациентов позволяет идентифицировать даже на ранней стадии ППС уже имеющиеся изменения в виде миокардиального фиброза [12]. Однако данный инвазивный метод в рутинной клинической практике для диагностики и оценки тяжести пациентов с ППС не применяется. Поэтому необходимо использовать не только стандартные методы оценки структурно-функциональных показателей ремоделирования сердца, но и расширять спектр оцениваемых показателей, включая визуализирующие методики, такие как ЭхоКГ и/или магнитно-резонансная томография сердца с оценкой деформации миокарда еще на ранней стадии заболевания с целью стратификации риска [13].
Настоящее исследование в качестве модели для изучения факторов, влияющих на ремоделирование миокарда при ППС, включало пациентов с пороком МК, имеющих показания для кардиохирургического вмешательства. При этом в качестве маркеров ремоделирования миокарда использовали как стандартные параметры трансторакальной ЭхоКГ, такие как размеры и объемы камер сердца, так и более расширенный протокол с оценкой деформации миокарда желудочков сердца (strain), систолической функции ПЖ по данным 2-мерной и 3-мерной ЭхоКГ.
Известно, что ожирение вносит свой вклад в процесс миокардиального ремоделирования, что подтверждается данными фундаментальных и прикладных исследований [14][15]. За последние десятилетия количество больных с ожирением увеличилось на 75%. Согласно данным Всемирной организации здравоохранения >1,9 млрд человек имеют избыточную массу тела, из которых >600 млн страдают ожирением1. По данным исследований, ожирение сопряжено с систолической и диастолической дисфункцией ЛЖ [14]. Однако избыточное количество ВЖТ является главным предиктором в развитии ремоделирования и гипертрофии ЛЖ, в то время как связь величины ИМТ с характером ремоделирования во многих работах отсутствует [15].
Значимость результатов настоящего исследования связана с тем, что в качестве маркеров ожирения были использованы площадь ВЖТ и объем ЭЖТ (оцененные с помощью МСКТ), которые обладают более высокой диагностической ценностью по сравнению с такими традиционными показателями, как окружность талии и ИМТ. Одним из главных результатов нашего исследования явилось подтверждение более выраженного ремоделирования левых камер сердца у лиц с ППС и ВО до оперативного вмешательства. Так, группа пациентов с ВО характеризовалась значимо более выраженным нарушением GLS LV (-15,65 [ -18,8; -11,6]%) по сравнению с группой ППС без ВО (-19,4 [ -21,3; -16,9]%), (р=0,020), в т.ч. увеличение индекса ВЖТ/ПЖТ >0,4 у пациентов с ППС МК до операции ассоциировалось с увеличением индекса массы миокарда, КДР и КСР ЛЖ.
В исследовании Гриценко О. В. и др. (2017) [4] также была продемонстрирована ассоциация размера ВЖТ с концентрическим ремоделированием ЛЖ, снижением сердечного выброса. Однако исследование ВЖТ в работе данного автора проводилось с использованием метода магнитно-резонансной томографии, и результаты были получены на когорте пациентов с ИБС. Стоит отметить, что имеющиеся публикации, посвященные изучению структурно-функциональных особенностей камер сердца у лиц с ВО, анализируют в основном категорию пациентов с ИБС и пациентов с хронической сердечной недостаточностью с сохраненной ФВ ЛЖ [16-18].
В качестве связующего звена между ожирением и процессами кардиоваскулярного ремоделирования в настоящее время рассматривается и ЭЖТ [8][19]. ЭЖТ, располагающаяся между миокардом и висцеральным перикардом, является активным эндокринным органом, продуцирующим ряд важнейших биологически активных веществ, а при ожирении, способствующем развитию структурно-функциональных нарушений камер сердца [4][20]. Увеличение объема ЭЖТ связано с нарушением метаболизма свободных жирных кислот, формированием воспалительного инфильтрата, электромеханическим изменениям в тканях, что, согласно данным ряда исследований, приводит к фиброзу, гипертрофии миокарда, увеличению камер сердца, дисфункции ЛЖ [20-22], ремоделированию ЛП и возникновению ФП [16], а также желудочковых нарушений ритма сердца [23].
В настоящем исследовании для пациентов с ППС МК, подвергающихся кардиохирургической коррекции порока, продемонстрирована связь увеличения объема ЭЖТ с увеличением размера ЛП, а также с наличием ФП/ТП до операции.
Полученные нами данные схожи с результатами исследований других авторов, показавших, что увеличение толщины ЭЖТ сочетается с бóльшим объемом ЛП (р<0,01) [24], а также с фиброзом ЛП, и превосходит по сравнению с ИМТ роль в развитии ФП [25]. Необходимо отметить, что подобные закономерности были ранее описаны именно для пациентов с различными составляющими метаболического синдрома [24-26]. В работе Ионина В. А. у пациентов с метаболическим синдромом и толщиной ЭЖТ >3,5 мм риск развития ФП в ~4 раза выше, чем у лиц с меньшим значением данного показателя [26]. Данные результаты еще раз подтверждают вклад ЭЖТ в структурное и функциональное ремоделирование камер сердца, отражением которого и являются нарушения ритма сердца. Предполагается, что причиной проаритмогенного действия ЭЖТ является жировая инфильтрация предсердий, ведущая к развитию фиброза [27].
Важно отметить, что данные о прогностической роли толщины ЭЖТ получены в основном для когорты кардиохирургических пациентов со сложной коронарной патологией [6][7], в то время как для когорты пациентов с ППС данные ограничиваются ассоциацией толщины ЭЖТ с наличием/выраженностью кальциноза клапанов левых камер сердца [4][28]. Поэтому следует еще раз подчеркнуть новизну результатов нашего исследования, в котором изучена связь компонентов ВО, в т.ч. толщины ЭЖТ, с характером ремоделирования камер сердца именно у кардиохирургических пациентов с ППС.
В рамках комплексного анализа компонентов ВО важно оценить их влияние на ремоделирование не только левых камер сердца, но и структурно-функциональные нарушения ПЖ, особенности внутрисердечной гемодинамики у пациентов приобретенными пороками клапанов сердца, что на настоящий момент изучено недостаточно.
В настоящем исследовании впервые продемонстрирована ассоциация различных компонентов ВО с нарушением систолической функции ПЖ у кардиохирургических пациентов с ППС МК. По данным 3-мерной ЭхоКГ лица с ППС МК и ВО характеризовались более выраженным снижением ФВ ПЖ 46 [ 40,6; 48,9]% до коррекции порока по сравнению с пациентами без ВО 53 [ 45,8; 54,2]%, (p=0,042). При этом, отмечено, что увеличение объема ЭЖТ ассоциируется с уменьшением систолической функции ПЖ по данным 2-мерной ЭхоКГ (TAPSE).
Имеющиеся в литературе данные, описывающие связь компонентов ВО и функции ПЖ, касаются в основном двух категорий пациентов: 1) c СД 2 типа и 2) с легочной артериальной гипертензией (ЛАГ). Так, у пациентов с СД 2 типа при толщине ЭЖТ ≥5 мм наблюдалось более выраженное ухудшение систолической и диастолической функции ПЖ по сравнению с пациентами с толщиной ЭЖТ <5 мм [29]. В пилотном исследовании, посвященном изучению роли ЭЖТ и систолической функции ПЖ у пациентов с ЛАГ, была продемонстрирована U-образная ассоциация толщины ЭЖТ с функцией ПЖ, а также с уровнем N-терминального фрагмента предшественника мозгового натрийуретического пептида [30].
Дефицит научных данных о висцеральном, в т.ч. эпикардиальном ожирении у категории пациентов с ППС подразумевает важность последующего изучения вклада ВО в периоперационное течение заболевания у пациентов с ППС, подвергающихся кардиохирургической коррекции порока. Это обусловлено тем, что характер структурно-функциональных нарушений камер сердца и периоперационное обратное ремоделирование миокарда является зеркалом функционального статуса, качества жизни и прогноза кардиохирургических пациентов с приобретенным пороком МК [31][32]. Идентификация новых маркеров ремоделирования миокарда и прогноза пациентов с ППС позволит своевременно модифицировать факторы, способные оказать негативное влияние на характер течения заболевания и исходы пациентов, еще до выполнения вмешательства на открытом сердце, что в свою очередь может повлиять на эффективность лечения и исходы операции.
Заключение
Таким образом, выявлена связь ВО с процессами структурного и функционального ремоделирования миокарда у пациентов с приобретенными пороками МК. Наличие ВО ассоциировано с увеличением объемов и размеров полостей сердца, ухудшением деформации миокарда ЛЖ, систолической функции ПЖ. В свою очередь, увеличение объема ЭЖТ >115,1 см³ ассоциировано с наличием до оперативного лечения порока МК нарушений ритма сердца по типу ФП/ТП. Своевременная оценка характера ожирения, в т.ч. его висцерального проявления до операции, и более строгая модификация образа жизни пациента потенциально позволит уменьшить периоперационные риски и улучшить прогноз течения заболевания.
Отношения и деятельность. Исследование проведено на базе НИИ комплексных проблем сердечно-сосудистых заболеваний при поддержке Гранта Российского научного фонда № 24-75-10031 "Эпикардиальное и висцеральное ожирение как фактор, влияющий на ремоделирование миокарда и сосудов легких после хирургической коррекции приобретенных пороков клапанов сердца".
1. Всемирная организация здравоохранения. Ожирение и избыточная масса тела. 1 марта 2024. http://www.who.int/mediacentre/factsheets/fs311/ru/ (01 September 2024).
Список литературы
1. Mihl C, Dassen WR, Kuipers H. Cardiac remodelling: concentric versus eccentric hypertrophy in strength and endurance athletes. Neth Heart J. 2008;16(4):129-33. doi:10.1007/BF03086131.
2. D'Elia N, D'hooge J, Marwick TH. Association Between Myocardial Mechanics and Ischemic LV Remodeling. JACC Cardiovasc Imaging. 2015;8(12):1430-43. doi:10.1016/j.jcmg.2015. 10.005.
3. Семенова Е. И., Железнев С. И., Семенов И. И. и др. Протезирование клапанов сердца у больных пожилого возраста. Факторы риска: ассоциированные заболевания. Сибирский журнал клинической и экспериментальной медицины. 2007;22(3):97-100.
4. Гриценко О. В., Чумакова Г. А., Ельчанинова С. А. и др. Липотоксическое поражение миокарда при ожирении. CardioСоматика. 2017;8(4):36-40. doi:10.26442/CS45386.
5. Guler S, Varol E. The relation between echocardiographic epicardial fat thickness and mitral annular calcification. Afr Health Sci. 2019;19(1):1657-64. doi:10.4314/ahs.v19i1.41.
6. Брель Н. К., Груздева О. В., Коков А. Н. и др. Взаимосвязь висцерального ожирения и коронарного кальциноза при ишемической болезни сердца. Терапевтический архив. 2021; 93(12):1428-34. doi:10.26442/00403660.2021.12.201277.
7. Брель Н. К., Груздева О. В., Коков А. Н. и др. Взаимосвязь кальциноза коронарных артерий и локальных жировых депо у пациентов с ишемической болезнью сердца Комплексные проблемы сердечно-сосудистых заболеваний. 2022;11(3):51-63. doi:10.17802/2306-1278-2022-11-3-51-63.
8. Van der Heijden CAJ, Verheule S, Olsthoorn J, et al. Postoperative atrial fibrillation and atrial epicardial fat: Is there a link? Int J Cardiol Heart Vasc. 2022;39:100976. doi:10.1016/j.ijcha.2022. 100976.
9. Varghese B, Swamy S, Srilakshmi MA, et al. Visceral adiposity in young patients with coronary artery diseasea case control study. Indian Heart J. 2012;64(3):284-9. doi:10.1016/S0019-4832(12)60088-1.
10. Galderisi M, Cosyns B, Edvardsen T, et al. Standardization of adult transthoracic echocardiography reporting in agreement with recent chamber quantification, diastolic function, and heart valve disease recommendations: an expert consensus document of the European Association of Cardiovascular Imaging. Eur Heart J-Cardiovasc Imaging. 2017;18(12):1301-10. doi:10.1093/ehjci/jex244.
11. Исламова М. Р., Сафарова А. Ф., Кобалава Ж. Д. и др. Прогностическое значение дисфункции правого желудочка у пациентов с декомпенсацией хронической сердечной недостаточности. Кардиология. 2023;63(3):13-20. doi:10.18087/cardio.2023.3.n2071.
12. Fragasso G, Sanvito F, Monaca G, et al. Myocardial fibrosis in asymptomatic patients undergoing surgery for mitral and aortic valve regurgitation. J Cardiovasc Med. 2022;23(8):505-12. doi:10.2459/JCM.0000000000001347.
13. Marsan NA, Delgado V, J Shah D, et al. Valvular heart disease: shifting the focus to the myocardium. Eur Heart J. 2023;44(1): 28-40. doi:10.1093/eurheartj/ehac504.
14. Wong CY, O'Moore-Sullivan T, Leano R. Association of subclinical right ventricular dysfunction with obesity. J Am Coll Cardiol. 2006;4(3):611-6. doi:10.1016/j.jacc.2005.11.015.
15. Nazare JA, Smith J, Borel A-L, et al. Usefulness of measuring both body mass index and waist circumference for the estimation of visceral adiposity and related cardiometabolic risk profile (from the INSPIRE ME IAA study). Am J Cardiol. 2015;115(3):307-15. doi:10.1016/j.amjcard.2014.10.039.
16. Дружилов М. А., Бетелева Ю. Е., Дружилова О. Ю. и др. Роль эпикардиального ожирения в развитии структурно-функционального ремоделирования сердца. Российский кардиологический журнал. 2017;(4):35-9. doi:10.15829/1560-4071-2017-4-35-39.
17. Zain S, Shamshad T, Kabir A, et al. Epicardial Adipose Tissue and Development of Atrial Fibrillation (AFIB) and Heart Failure With Preserved Ejection Fraction (HFpEF). Cureus. 2023;15(9):46153. doi:10.7759/cureus.46153.
18. Джиоева О. Н., Тимофеев Ю. С., Метельская В. А. и др. Роль эпикардиальной жировой ткани в патогенезе хронического воспаления при сердечной недостаточности с сохраненной фракцией выброса. Кардиоваскулярная терапия и профилактика. 2024;23(3):3928. doi:10.15829/1728-8800-2024-3928.
19. Чумакова Г. А., Веселовская Н. Г. Методы оценки висцерального ожирения в клинической практике. Российский кардиологический журнал. 2016;(4):89-96. doi:10.15829/1560-4071-2016-4-89-96.
20. Синицкий М. Ю., Понасенко А. В., Груздева О. В. Генетический профиль и секретом адипоцитов висцеральной и подкожной жировой ткани у пациентов с сердечно-сосудистыми заболеваниями. Комплексные проблемы сердечно-сосудистых заболеваний. 2017;6(3):155-65. doi:10.17802/2306-1278-2017-6-3-155-165.
21. Чумакова Г. А., Гриценко О. В., Груздева О. В. и др. Прогнозирование риска развития диастолической дисфункции левого желудочка при ожирении. Российский кардиологический журнал. 2022;27(4):4811. doi:10.15829/1560-4071-2022-4811.
22. Дрень Е. В., Ляпина И. Н., Печерина Т. Б. и др. Фенотип современного пациента с приобретёнными пороками клапанов сердца: обзор литературы. CardioСоматика. 2023;14(4):269-82. doi:10.17816/CS601825.
23. Гёчер К., Озтюрк Б., Канийолу М., Чалышган Э., Текиналп М., Алтынсой М. Толщина эпикардиальной жировой ткани как предиктор желудочковой экстрасистолии. Кардиология. 2024;64(6):65-71. doi:10.18087/cardio.2024.6.n2540.
24. Druzhilov MA, Kuznetsova TYu. Epicardial fat thickness as a tool for predicting complicated obesity. J Biomed Technol. 2015;2:49-58. doi:10.15393/j6.art.2015.3261.
25. Миклишанская С. В., Мазур Н. А., Чапурных А. В. и др. Значение эпикардиальной жировой ткани в развитии фибрилляции предсердий у больных артериальной гипертонией: пилотное исследование. Российский кардиологический журнал. 2024;29(5):5659. doi:10.15829/1560-4071-2024-5659.
26. Ионин В. А., Листопад О. В., Нифонтов С. Е. и др. Роль галектина-3 и эпикардиального жира в развитии фибрилляции предсердий у пациентов при метаболическом синдроме. Ученые записки СПбГМУ имени академика И. П. Павлова. 2015;22(1):43-6. doi:10.24884/1607-4181-2015-22-1-43-46.
27. Haemers P, Hamdi H, Guedj K, et al. Atrial fibrillation is associated with the fibrotic remodelling of adipose tissue in the subepicardium of human and sheep atria. Eur Heart J. 2017;38(1): 53-61. doi:10.1093/eurheartj/ehv625.21.
28. Coisne A, Ninni S, Ortmans S, et al. Epicardial fat amount is associated with the magnitude of left ventricular remodeling in aortic stenosis. Int J Cardiovasc Imaging. 2019;35(2):267-73. doi:10.1007/s10554-018-1477-z.
29. Song XT, Zhang PY, Fan L, et al. Epicardial adipose tissue and right ventricular function in type 2 diabetes mellitus using two-dimensional speckle tracking echocardiography. Diab Vasc Dis Res. 2022;19(4):14791641221118622. doi:10.1177/14791641221118622.
30. Chen Y, Li J, Li F, et al. Impact of Epicardial Adipose Tissue on Right Cardiac Function and Prognosis in Pulmonary Arterial Hypertension. Chest. 2024;165(5):1211-23. doi:10.1016/j.chest.2023.11.039.
31. Вавилов А. В., Скопин И. И. Патогенез, диагностика и хирургическое лечение ишемической недостаточности митрального клапана. Грудная и сердечно-сосудистая хирургия. 2018;60(3):185-93. doi:10.24022/0236-2791-2018-60-3-185-193.
32. Аверина И. И., Мироненко М. Ю., Бокерия Л. А. Прогностическая ценность глобальной продольной деформации левого предсердия в развитии сердечной недостаточности у пациентов с клапанными пороками сердца. Креативная кардиология. 2021; 15(4):510-23. doi:10.24022/1997-3187-2021-15-4-510-523.
Об авторах
Е. В. ДреньРоссия
Елена Владимировна Дрень — аспирант, м.н.с. лаборатории реабилитации
Кемерово
И. Н. Ляпина
Россия
Ирина Николаевна Ляпина — к.м.н., с.н.с. лаборатории реабилитации отдела клинической кардиологии, врач-кардиолог центра легочной артериальной гипертензии
Кемерово
А. Н. Стасев
Россия
Александр Николаевич Стасев — к.м.н., с.н.с. лаборатории пороков сердца отдела хирургии сердца и сосудов, врач сердечно-сосудистый хирург
Кемерово
И. Н. Мамчур
Россия
Ирина Николаевна Мамчур — к.м.н., врач отделения функциональной и ультразвуковой диагностики
Кемерово
Н. К. Брель
Россия
Наталья Кирилловна Брель — к.м.н., врач 1 категории, врач-рентгенолог, зав. отделением лучевой диагностики
Москва
А. И. Кареева
Россия
Анастасия Ильясовна Кареева — м.н.с. лаборатории лучевых методов диагностики
Кемерово
О. Л. Барбараш
Россия
Ольга Леонидовна Барбараш — д.м.н., профессор, академик РАН, директор
Кемерово
Дополнительные файлы
Что известно о предмете исследования?
- Существующие данные о связи висцеральной жировой ткани со структурно-функциональными особенностями камер сердца изучены в основном у пациентов с ишемической болезнью сердца и у лиц с хронической сердечной недостаточностью и сохраненной фракцией выброса левого желудочка.
Что добавляют результаты исследования?
- В исследовании продемонстрировано, что наличие висцерального ожирения ассоциировано с более выраженным структурно-функциональным ремоделированием сердца, влияя на объемы и размеры полостей, ухудшая деформацию миокарда левого желудочка и систолическую функцию правого желудочка у пациентов с приобретенным пороком митрального клапана. Выявлено, что значение эпикардиальной жировой ткани >115,1 см3ассоциировано с наличием фибрилляции предсердий у пациентов до коррекции порока митрального клапана.
Рецензия
Для цитирования:
Дрень Е.В., Ляпина И.Н., Стасев А.Н., Мамчур И.Н., Брель Н.К., Кареева А.И., Барбараш О.Л. Связь эпикардиального и висцерального ожирения с характером ремоделирования миокарда у пациентов с приобретенным пороком митрального клапана. Кардиоваскулярная терапия и профилактика. 2025;24(2):4301. https://doi.org/10.15829/1728-8800-2025-4301. EDN: OCMQUJ
For citation:
Dren' E.V., Lyapina I.N., Stasev A.N., Mamchur I.N., Brel N.K., Kareeva A.I., Barbarash O.L. Relationship between epicardial/visceral obesity and features of myocardial remodeling in patients with acquired mitral valve disease. Cardiovascular Therapy and Prevention. 2025;24(2):4301. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4301. EDN: OCMQUJ

























































