Перейти к:
Персонифицированный подход к терапии пациентов с артериальной гипертензией: фокус на агонисты имидазолиновых рецепторов. Мнение по проблеме
https://doi.org/10.15829/1728-8800-2025-4342
EDN: LCNWNX
Аннотация
Артериальная гипертензия (АГ) остается одной из наиболее актуальных проблем современного здравоохранения. Ассоциированные с АГ заболеваемость и смертность продолжают расти, несмотря на широкий спектр доступных антигипертензивных препаратов и регулярное обновление клинических рекомендаций по лечению и диагностике этого заболевания. В октябре 2024 года состоялся ежегодный форум спикеров, посвященный обсуждению оптимизации подходов к лечению больных АГ. В ходе дискуссии особое внимание было уделено персонифицированной терапии пациентов, которая должна быть основана на современных представлениях о патогенезе заболевания и индивидуальных факторах риска. Кроме того, обсуждалась обоснованность назначения в определенных клинических ситуациях, наряду с основными пятью классами антигипертензивных препаратов, агонистов имидазолиновых рецепторов, относящихся к дополнительным средствам, снижающим артериальное давление. В рутинной практике для контроля АГ в составе комбинированной терапии рекомендуется рассмотреть применение препаратов центрального действия, в частности моксонидина (препарат Физиотенз®). Высокий уровень блокады симпатической нервной системы при ее гиперактивности на фоне терапии моксонидином обеспечивает контроль уровня АД и обладает плейотропными эффектами, среди которых наибольшее значение имеет повышение чувствительности тканей к инсулину, что особенно важно для лечения АГ у пациентов с ожирением, метаболическим синдромом, предиабетом, сахарным диабетом 2 типа, у пациентов с различными метаболическими нарушениями (гипергликемией, дислипидемией, гиперурикемией) и у женщин в пери- и постменопаузальном периоде.
Ключевые слова
Для цитирования:
Баранова Е.И., Ионин В.А., Ротарь О.П. Персонифицированный подход к терапии пациентов с артериальной гипертензией: фокус на агонисты имидазолиновых рецепторов. Мнение по проблеме. Кардиоваскулярная терапия и профилактика. 2025;24(2):4342. https://doi.org/10.15829/1728-8800-2025-4342. EDN: LCNWNX
For citation:
Baranova E.I., Ionin V., Rotar O.P. Personalized approach to the treatment of patients with arterial hypertension: focus on imidazoline receptor agonists. Opinion on the problem. Cardiovascular Therapy and Prevention. 2025;24(2):4342. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4342. EDN: LCNWNX
Введение
Артериальная гипертензия (АГ) — состояние, характеризующееся повышенным артериальным давлением (АД), и в большинстве случаев причина АГ — эссенциальная гипертоническая болезнь (ГБ). Согласно современным представлениям, ГБ является мультифакторным заболеванием, вклад в развитие которого вносят генетические, средовые и поведенческие факторы. Распространенность ГБ остается высокой, а число больных АГ, достигающих целевого уровня АД и контролирующих АГ, невелико, несмотря на значительный прогресс в понимании патофизиологических основ заболевания и появление новых подходов к терапии [1-3].
В октябре 2024г в г. Москве прошел ежегодный форум специалистов, посвященный актуальным вопросам терапии больных АГ. Во время мероприятия проводился интерактивный опрос среди присутствовавших врачей-кардиологов и терапевтов из разных регионов России с большим клиническим опытом. В ходе активной дискуссии между ведущими мероприятия и его участниками обсуждались актуальные вопросы персонифицированного подхода к лечению пациентов, учитывающего сопутствующие заболевания и состояния, а также эффективность и переносимость антигипертензивной терапии (АГТ).
Большинство (68%) участников форума согласились с тем, что для более эффективного контроля АГ недостаточно использования основных классов антигипертензивных препаратов (АГП), важна персонифицированная терапия. Рекомендации и стандарты — это стратегия, а тактика — персонифицированная терапия. 16% участников изначально выразили сомнение, что всех пациентов с АГ можно успешно лечить с помощью 5 основных классов АГП. Одним из вариантов индивидуализированного подхода к лечению больных АГ на ранних этапах терапии может стать препарат центрального действия — агонист имидазолиновых рецепторов моксонидин.
Распространенность АГ в России и мире: есть ли положительная динамика?
В 2024г проблема лечения больных АГ несомненно сохраняет актуальность, несмотря на регулярное обновление клинических рекомендаций по профилактике и лечению этого заболевания, а также появление новых препаратов для медикаментозной терапии. По данным Всемирной организации здравоохранения за период 1999-2019гг в странах Европы и Америки число больных АГ увеличилось на 41% и составило ~427 млн человек, а в странах Юго-Восточной Азии и Западного Тихоокеанского региона распространенность АГ увеличилась на 144% и составила 640 млн человек [4].
Результаты первого масштабного эпидемиологического исследования ЭССЕ-РФ 2012-2013гг (Эпидемиология сердечно-сосудистых заболеваний в регионах Российской Федерации) демонстрируют, что в России >50% взрослого населения имели повышенное АД: АГ диагностирована у 51,1% мужчин и у 49,7% женщин. Важно подчеркнуть, что при использовании диагностических критериев АГ американских клинических рекомендаций ее распространенность среди участников исследования оказалась значительно выше, составив 72,1% [5].
В более позднем исследовании ЭССЕ-РФ-3 (третье исследование) при обследовании представительной выборки населения в возрасте 35-74 лет в 15 регионах РФ в период пандемии COVID-19 (COrona VIrus Disease 2019) установлено, что АГ наблюдалась у 56,0% мужчин и 52,1% женщин. В то же самое время, эффективность АГТ составляла лишь 44,0% [6].
Таким образом, при растущей распространенности АГ нерешенной проблемой остается недостаточная эффективность контроля АД, что нередко обусловлено низкой приверженностью к лечению и побочными явлениями терапии основными классами АГП. Исходя из этого, несомненно, существует необходимость повышения осведомленности населения о негативных последствиях АГ и формирования более эффективных стратегий лечения больных АГ с учетом индивидуальных особенностей пациентов.
Патогенез АГ: каковы современные представления о механизмах развития заболевания?
В настоящее время известно, что патофизиологические изменения, приводящие к развитию АГ, являются результатом старения организма и комплексных нарушений функционирования различных органов и систем вследствие сложных взаимодействий между генетическими, средовыми и поведенческими факторами. Согласно современным представлениям, выделяют несколько ключевых механизмов развития АГ, включая повышение активности симпатической нервной системы (СНС), активацию ренин-ангиотензин-альдостероновой системы (РААС), дисфункцию почек, нарушение чувствительности барорецепторов, дисфункцию эндотелия, увеличение жесткости крупных сосудов, хроническое субклиническое иммунное воспаление и изменение состава микробиоты [1-3]. Существенный вклад в развитие АГ вносят ожирение, инсулинорезистентность и гиперинсулинемия [1-3].
Гиперактивность СНС — важнейший фактор в патогенезе и прогрессировании АГ. Повышение активности СНС приводит к функциональным и структурным изменениям сердечно-сосудистой системы, таким как эндотелиальная дисфункция, ремоделирование артериол и увеличение сосудистой жесткости крупных артерий, что, в свою очередь, способствует повышению АД и развитию АГ. Кроме того, повышенная симпатическая активность может быть причиной неэффективности АГТ, препятствующей достижению целевых уровней АД [7].
Важным аспектом патогенеза АГ является взаимосвязь между СНС и РААС [8]. Эти две системы настолько неразделимы в своих физиологических эффектах, что их взаимодействие можно представить в виде двух составляющих единого процесса регуляции кровообращения. При повышенном тонусе СНС импульсы из симпатических нервов способствуют высвобождению ренина из юкстагломерулярного аппарата почек и активации всего каскада РААС. Ангиотензин II и альдостерон оказывают мощное профиброгенное действие на сосуды и сердечную мышцу. Кроме того, ангиотензин II стимулирует СНС на уровне центров головного мозга, а его периферическое вазоконстрикторное действие связано с прямой активацией вазомоторных центров центральной нервной системы [8].
Дисфункция почек в сочетании с гиперактивацией РААС также ассоциирована с АГ. Кардиоренальные взаимоотношения играют ключевую роль в поддержании гомеостаза и регуляции АД. При нарушении функции почек, в т.ч. при хронической болезни почек (ХБП), может наблюдаться повышение реабсорбции натрия и воды, что приводит к увеличению объема циркулирующей крови и, как следствие, к повышению АД и АГ. Активация РААС стимулирует продукцию ренина, ангиотензина II и альдостерона, что приводит к вазоконстрикции и задержке натрия, усугубляя как сердечную, так и почечную недостаточность, нередко наблюдающуюся при АГ [7].
Несомненно, весомый вклад в развитие АГ вносят неблагоприятные факторы окружающей среды (воздействие шума, загрязнение воздуха, климат) и образ жизни (высококалорийное питание с избыточным потреблением поваренной соли и низким содержанием калия, злоупотребление алкоголем, курение, низкий уровень физической активности, низкое качество сна), которые способствуют повышению активности СНС и, как следствие, развитию АГ. Немаловажную роль в формировании АГ играют социо-экономические и психосоциальные факторы, к которым относятся хронический стресс, низкий доход, социальные ограничения и дискриминация, недостаточно развитая система здравоохранения [1][2][9].
В последние годы, помимо хорошо изученных механизмов развития АГ, особое внимание уделяют изменениям состава кишечной микробиоты и высокой активности иммунной системы [10-13]. Доказано, что накопление иммунных клеток в резистентных сосудах способствует вазоконстрикции, повышению жесткости вследствие повышения синтеза коллагена с последующим развитием фиброза. Инфильтрация сердца иммунными клетками приводит к гипертрофии и фиброзу миокарда. В почках повышенная активность иммунной системы вызывает задержку воды и натрия, альбуминурию и ремоделирование почечных сосудов. На уровне головного мозга инфильтрация иммунными клетками способствует повышению симпатической активности, в т.ч. за счет модулирования функции ростровентролатерального отдела. Все вышеперечисленные механизмы в совокупности приводят к развитию АГ [10][11].
Неотъемлемую часть в обсуждении механизмов развития АГ занимает роль двунаправленной оси "кишечник — головной мозг". На сегодняшний день известно, что состав кишечной микробиоты значительно меняется при различных состояниях и заболеваниях, в т.ч. при наличии избыточной массы тела, ожирения, метаболического синдрома или инсулинорезистентности. Изменения микрофлоры провоцируют такие факторы как неполноценная диета с низким содержанием клетчатки и пищевых волокон, низкий уровень физической активности, что характерно для современного населения в целом. Нарушения состава микробиоты способствуют развитию хронического воспалительного процесса, что, в свою очередь, приводит к повышенной активации СНС — предиктору АГ [12][13].
Клинические рекомендации по лечению АГ: что нового?
Критерии повышенного АД и диагноза АГ корректируются с учетом последних научных и клинических данных.
Согласно рекомендациям Европейского общества кардиологов (European Society of Cardiology, ESC) 2024г, критерии АГ не изменились — АД 140 мм рт.ст. и/или 90 мм рт.ст. и выше. Вместе с тем, европейские эксперты выделяют три категории АД: неповышенное систолическое АД (САД) (<120 мм рт.ст.), повышенное САД (120-139 мм рт.ст.) и систолическая АГ (≥140 мм рт.ст.) [2].
В актуальных российских клинических рекомендациях 2024г классификация АД и степеней АГ представлена более подробно [3]:
- Оптимальное АД: САД <120 мм рт.ст. и диастолическое АД (ДАД) <80 мм рт.ст.;
- Нормальное АД: САД 120-129 мм рт.ст. и/или ДАД 80-84 мм рт.ст.;
- Высокое нормальное АД: САД 130-139 мм рт.ст. и/или ДАД 85-89 мм рт.ст.;
- АГ 1-й ст.: САД 140-159 мм рт.ст. и/или ДАД 90-99 мм рт.ст.;
- АГ 2-й ст.: САД 160-179 мм рт.ст. и/или ДАД 100-109 мм рт.ст.;
- АГ 3-й ст.: САД ≥180 мм рт.ст. и/или ДАД ≥110 мм рт.ст.
По мнению европейских экспертов, целевое САД для большинства пациентов должно находиться в диапазоне 120-129 мм рт.ст., оптимальное САД — 120 мм рт.ст. при хорошей переносимости. Однако для очень пожилых и "хрупких" пациентов, пациентов с ортостатической гипотензией и пациентов с небольшой предполагаемой продолжительностью жизни целевые значения АД могут быть менее строгими, поскольку рациональная терапия АГ должна быть направлена на поддержание качества жизни пациента в целом, а не только на снижение АД [2].
Согласно российским рекомендациям, целевой уровень АД независимо от возраста и сердечно-сосудистого риска составляет <140/90 мм рт.ст., а при хорошей переносимости — ≤130/80 мм рт.ст. Пациентам ≤65 лет рекомендуется снижать САД до 120-129 мм рт.ст. Пациентам ≥80 лет с изолированной систолической АГ рекомендуется снижать САД первоначально до 140-150 мм рт.ст., а при хорошей переносимости до 130-139 мм рт.ст. (с осторожностью при исходном ДАД <70 мм рт.ст.) [3].
Вместе с тем эксперты отмечают, что с целью наиболее точной оценки сердечно-сосудистого риска (ССР) необходимо учитывать не только показатели АД, измеренные в медицинском учреждении, но и рекомендовать пациенту самоконтроль АД в домашних условиях или на рабочем месте для анализа вариабельности АД и повышения эффективности АГТ. В особых клинических ситуациях необходимо выполнить суточное мониторирование АД [4][14].
Высокий уровень АД требует своевременной адекватной коррекции для снижения ССР. Современные клинические рекомендации акцентируют внимание на важном аспекте терапии больных АГ — персонифицированном подходе. Достижение максимально низких (в целевом диапазоне) и хорошо переносимых показателей АД должно проводиться с учетом индивидуальных характеристик пациентов, особую осторожность следует проявить у хрупких, наиболее уязвимых пациентов. Стратегия ведения больных с АГ, наряду с учетом степени повышенного АД, должна учитывать и оценку индивидуальных факторов ССР, таких как возраст, пол, сопутствующие заболевания и образ жизни пациента, поскольку данные особенности могут значительно влиять на выбор препаратов, эффективность и безопасность проводимого лечения. Лечение больных АГ должно включать выбор оптимальной, как правило, комбинированной АГТ. При этом следует учитывать тот факт, что стандартизированные схемы терапии АГ не могут быть всегда эффективными у всех категорий пациентов [1-3].
Терапия АГ: возможно ли успешное лечение всех пациентов с помощью пяти основных классов АГП?
Согласно российским клиническим рекомендациям "Артериальная гипертензия у взрослых" 2024г в основе АГТ для снижения АД и уменьшения ССР лежит применение пяти классов препаратов, к которым относятся: ингибиторы ангиотензин-превращающего фермента, блокаторы рецепторов ангиотензина-II, β-адреноблокаторы, блокаторы кальциевых каналов (БКК), тиазидные и тиазидоподобные диуретики [3]. В связи с этим возникает вопрос — возможна ли эффективная терапия и достижение целевых уровней АД при использовании лишь традиционных АГП?
По мнению экспертов, недостаточный контроль АГ в популяции в какой-то степени обусловлен тем, что применение многих АГП ограничено наличием противопоказаний к их применению или развитием нежелательных эффектов на фоне терапии. Абсолютные противопоказания и ограничения к применению антигипертензивных средств перечислены в рекомендациях Европейского общества по АГ 2023г [1] и Российских клинических рекомендациях [3].
В реальной практике нередко встречаются пациенты, которые помимо АГ имеют сопутствующие состояния и заболевания: абдоминальное ожирение, сахарный диабет (СД) 2 типа, гиперурикемию и другие метаболические нарушения, что ограничивает применение некоторых классов антигипертензивных средств и создает условия для недостаточного контроля АГ. Кроме того, значительную часть больных АГ составляют лица женского пола, в т.ч. в пери- или постменопаузе [15], для которых характерен повышенный риск недостаточной эффективности АГТ или нежелательных явлений вследствие изменений фармакодинамики и фармакокинетики лекарственных препаратов, возникающих на фоне гормональных изменений (гипоэстрогения, относительная гиперандрогения) и метаболических нарушений [16].
Большинству пациентов на первой и второй ступени лечения показана комбинированная терапия, в состав которой входят блокаторы РААС и тиазидовые/тиазидоподобные диуретики и/или блокаторы медленных кальциевых каналов [3].
На фоне лечения диуретиками нередко возникают гипокалиемия и гипонатриемия (особенно часто у женщин), гиперурикемия или подагра (более свойственная мужчинам) [17]. У мужчин, получающих тиазидные диуретики, также нередко возникает эректильная дисфункция (ЭД) [18].
Дигидропиридиновые БКК не имеют абсолютных противопоказаний, но за счет мощного вазодилатирующего эффекта, присущего этим препаратам, могут вызывать головную боль, головокружение, покраснение лица и отеки стоп и голеней. Все эти нежелательные эффекты чаще встречаются у женщин [19].
β-адреноблокаторы, относящиеся к основным классам АГП, применяются у больных АГ при наличии определенных показаний (ишемическая болезнь сердца, хроническая сердечная недостаточность, фибрилляция предсердий, другие аритмии) [1][3]. При наличии гиперсимпатикотонии и склонности к тахикардии, нередко присущей пациентам с АГ в сочетании с ожирением, не следует применять β-блокаторы без прямых показаний, т.к. эти препараты способствуют увеличению веса, и, как и тиазидовые диуретики, увеличивают риск развития СД 2 типа у предрасположенных больных и усугубляют атерогенную дислипидемию, могут вызвать слабость, а у мужчин и ЭД [17][20].
Несмотря на применение 2- или 3-компонентной стандартной АГТ, у больных с ожирением, СД 2 типа, у женщин в пери- и в постменопаузе, при ХБП зачастую не удается достичь целевых уровней АД, и лечение оказывается недостаточно эффективным. С учетом вышеперечисленных факторов, связанных с особенностями патогенеза АГ у некоторых категорий пациентов, недостаточной эффективностью или низкой приверженностью к традиционной гипотензивной терапии, пациентам, помимо пяти основных классов, могут быть назначены и другие АГП. В частности, к таким средствам относится препарат центрального действия — агонист имидазолиновых рецепторов — моксонидин (препарат Физиотенз®). Моксонидин может быть назначен не только в качестве препарата "скорой помощи" при резком повышении АД, но и для длительной терапии [3].
Центральный уровень блокады СНС с помощью моксонидина: есть ли преимущества для АГТ?
Механизм действия моксонидина связан со снижением активации СНС посредством селективной стимуляции имидазолиновых рецепторов первого типа, расположенных в вентролатеральном отделе продолговатого мозга. Основным непосредственным эффектом препарата является снижение общего периферического сосудистого сопротивления и, следовательно, повышенного уровня АД.
Каковы основные преимущества центрального механизма действия моксонидина? Помимо непосредственного влияния на показатели АД, в клинических исследованиях продемонстрировано, что данный препарат повышает чувствительность тканей к инсулину у пациентов с увеличенной массой тела, инсулинорезистентностью, нарушениями углеводного обмена. По сравнению с другими классами АГП для моксонидина отмечается наиболее выраженное положительное влияние на чувствительность к инсулину. Добавление моксонидина в схемы АГТ у пациентов с метаболическими нарушениями и АГ ассоциировалось с лучшим контролем не только показателей АД, но и метаболических параметров [21][22]. Следует подчеркнуть, что применение моксонидина приводит к снижению веса у пациентов с ожирением и избыточной массой тела [23].
Центральный уровень блокады гиперактивации СНС обеспечивает плейотропное и органопротективное действие моксонидина. В клинических исследованиях продемонстрировано, что на фоне применения моксонидина улучшается эластичность сосудистой стенки [24], уменьшается выраженность гипертрофии левого желудочка и улучшается его диастолическая функция [25][26], замедляется прогрессирование ХБП [27], уменьшается степень микроальбуминурии [28], улучшаются когнитивные функции [29], замедляется репликативное клеточное старение и улучшается костный метаболизм за счет повышения плотности костной ткани [30].
С учетом снижения инсулинорезистентности, положительного влияния моксонидина на параметры метаболизма, органопротективных и плейотропных свойств, данный препарат был рекомендован Евразийской ассоциацией кардиологов в составе тройной комбинированной терапии у пациентов с СД, предиабетом и ожирением. Для снижения ССР при отсутствии контроля АД рекомендуется рассмотреть терапию блокатором РААС, моксонидином и БКК или диуретиком [31]. Позиция более раннего назначения моксонидина была также неоднократно поддержана рядом российских и международных экспертов для терапии пациентов с АГ и сопутствующими метаболическими нарушениями, женщин в пери-/постменопаузальном периоде, пациентов с ХБП [15][32-35].
У каких пациентов применение моксонидина принесет наибольшую пользу?
Ожирение, СД 2 типа нередко ассоциированы с недостаточным антигипертензивным эффектом основных классов АГП. Учитывая благоприятное влияние моксонидина на чувствительность периферических тканей к инсулину и многие метаболические параметры, данный препарат имеет преимущество при лечении больных АГ с избыточной массой тела, ожирением, метаболическим синдромом, СД 2 типа [36]. В обзоре Schlaich MP, et al. (2024), указывается, что моксонидин не только снижает повышенную симпатическую активность у больных АГ, но и уменьшает избыточный вес, инсулинорезистентность [33], что имеет положительное значение для больных АГ. АГ, СД 2 типа и ожирение — основные факторы риска развития ХБП.
ХБП — серьезная коморбидная патология, которая часто встречается у пациентов с АГ и может быть не только причиной, но и следствием АГ. При ХБП ухудшение функции почек может вызывать повышение симпатического тонуса, что способствует повышению АД посредством афферентной передачи сигналов. Grassi G, et al. (2021) доказали существование тесных взаимоотношений между ухудшением функции почек и повышением активности СНС [37]. При ХБП происходит активация РААС, что приводит к увеличению реабсорбции натрия и воды. Кроме того, возникает солечувствительность, что ухудшает контроль АД [37]. Наличие ожирения ухудшает течение сочетанной патологии — почечной дисфункции и АГ посредством нескольких патогенетических механизмов, которые включают: механическую компрессию почек висцеральной жировой тканью, активацию СНС посредством системы лептин/проопиомеланокортин, активацию РААС и минералокортикоидных рецепторов [38].
Повышение симпатической активности приводит к сужению почечных артериол, активации РААС и повышенной продукции ренина, что в свою очередь, способствует не только развитию АГ, но и ухудшению функции почек [39][40]. В последние годы все чаще используется такое понятие как "кардио-рено-метаболический синдром" — комплекс нарушений, который обусловлен взаимосвязями между ожирением, СД, ХБП и сердечно-сосудистыми заболеваниями [41].
Эксперты Европейского общества по АГ (2023) рекомендуют применять препараты центрального действия на третьей ступени лечения у больных с почечной дисфункцией, в т.ч. при ХБП 4-5 стадии [1]. В данной когорте пациентов можно рассмотреть применение моксонидина не только на терминальных стадиях ХБП и при гемодиализе, когда применение традиционных АГП может быть ограничено из-за противопоказаний и побочных эффектов, но и на более ранних стадиях в качестве профилактики почечной дисфункции, поскольку гиперактивность СНС играет значительную роль в прогрессировании ХБП.
Эффективность препаратов симпатолитического действия при АГ в сочетании с ХБП не доказана в крупных рандомизированных клинических исследованиях, нет данных о том, что эти препараты замедляют прогрессию дисфункции почек. Вместе с тем, моксонидин может быть использован при ХБП и неконтролируемой АГ, т.к. этот препарат в дозе 0,3 мг/сут. столь же эффективен, что и дигидропиридиновый БКК нитрендипин в дозе 20 мг в комбинации с блокатором РААС при далеко зашедшей ХБП [42]. В этом исследовании повышение уровня креатинина сыворотки было более значимым на фоне терапии нитрендипином, чем на фоне лечения моксонидином.
Особого внимания при назначении АГТ заслуживает учет гендерных различий у пациентов с АГ. Несмотря на то, что в российской популяции женщины лучше осведомлены о наличии у них АГ, чаще измеряют АД и лучше контролируют заболевание [6][43], они могут быть более уязвимыми из-за гендерных особенностей фармакодинамики и повышенного риска метаболических нарушений в период пери- или постменопаузы [16]. Кроме того, для женщин более характерно наличие психоэмоционального стресса по сравнению с мужчинами — одного из важных факторов риска АГ [6]. У пациенток женского пола может быть рассмотрено добавление моксонидина к схемам при отсутствии контроля АД на фоне применения АГП из пяти основных классов [15].
У мужчин также существуют гендерные особенности, в частности, важно отметить, что ЭД может быть своеобразным маркером ССР, т.к. часто — на 2-5 лет — предшествует сердечно-сосудистому событию и является маркером сосудистой патологии [44]. Сердечно-сосудистые заболевания и ЭД имеют общие факторы риска и патофизиологические механизмы, такие как эндотелиальная дисфункция, воспаление и низкий уровень тестостерона в плазме крови. Более того, ЭД является основным фактором, способствующим прекращению или нарушению приверженности терапии сердечно-сосудистых заболеваний. Сердечно-сосудистые препараты оказывают разное воздействие на ЭД, причем диуретики и β-блокаторы оказывают наиболее неблагоприятное действие, а ингибиторы РААС лишены этого негативного влияния [44]. В связи с этим можно полагать, что применение препарата центрального действия моксонидина имеет ряд преимуществ, в т.ч. перед периферической блокадой СНС.
Эксперты предлагают рассмотреть моксонидин как предпочтительный выбор для лечения АГ у пациентов с избыточной массой тела, абдоминальным ожирением, СД 2 типа или предиабетом, метаболическим синдромом и при наличии отдельных его компонентов, у больных с нарушением функции почек, а также у женщин в период пери- или постменопаузы. Моксонидин может быть назначен больным АГ на раннем этапе лечения и при непереносимости одного или нескольких классов препаратов из пяти основных для лечения АГ или при наличии противопоказаний к последним. По мнению экспертов, когорта пациентов, у которых может быть с успехом использован моксонидин, значительно обширнее, что определяется не только высокой гипотензивной эффективностью препарата, сопоставимой с действием лекарств основных антигипертензивных классов, но и наличием плейотропных и органопротективных свойств данного препарата. Вместе с тем назначение моксонидина на ранних этапах АГТ должно быть обосновано в истории болезни/амбулаторной карте пациента.
Применение моксонидина в реальной клинической практике: результаты опроса российских медицинских специалистов
В ходе ежегодного форума спикеров среди присутствовавших медицинских специалистов проводился интерактивный опрос, который позволил оценить аспекты применения моксонидина (препарат Физиотенз®) в российской клинической практике.
Результаты опроса аудитории сравнили с данными международного поперечного исследования STRAIGHT (Selective imidazoline receptor agonists Treatment Recommendation and Action In Global management of HyperTension), которое проводилось в ноябре 2018г в 7 странах с высокой частотой назначения агонистов имидазолиновых рецепторов. Среди российских специалистов в области здравоохранения в исследовании приняло участие 125 врачей [45].
Участники мероприятия были врачами различных специальностей из разных регионов России с большим клиническим опытом: у большинства респондентов (69,23%) стаж работы составлял >20 лет, у 26,92% — 11-20 лет, у 3,85% — 6-10 лет.
Согласно результатам опроса STRAIGHT, большинство медицинских специалистов в своей клинической практике опирается на российские рекомендации по лечению АГ (80,77%), реже на европейские (7,69%), американские (3,85%) или другие (7,69%) руководства. Участники исследования также отдавали предпочтение использованию национальных клинических рекомендаций [45].
В ходе обсуждения актуальных вопросов, касающихся применения моксонидина в клинической практике, участники отметили существующие стереотипы, связанные с использованием этого препарата исключительно в качестве неотложной медицинской помощи. Обсуждение выявило, что большинство врачей — 96,3% рассматривают моксонидин как универсальный препарат: для длительной ежедневной (плановой) терапии и неотложной медицинской помощи при резких внезапных подъемах АД, без поражения органов-мишеней. При этом лишь незначительное количество практикующих врачей не рассматривают моксонидин как препарат для плановой терапии, что, возможно, связано с недостаточной осведомленностью о клинических исследованиях и потенциальных преимуществах препарата в контексте АГТ (рисунок 1).

Рис. 1 Результаты опроса: "В каких клинических ситуациях Вы назначаете моксонидин?".
Примечание: АД — артериальное давление.
Медицинские специалисты отмечали, что решающими факторами при выборе терапии препаратом Физиотенз® были дополнительные положительные метаболические эффекты (35,29%), возможность сочетания со всеми классами АГП (35,29%), воздействие на гиперреактивность СНС (23,53%), хороший профиль безопасности (17,65%), скорость снижения АД (11,76%), возможность назначения при ХБП (11,76%), органопротективные свойства (5,88%). В исследовании STRAIGHT преобладающими причинами назначения агонистов имидазолиновых рецепторов в России были эффективность (90,0%), дополнительные метаболические эффекты (79,0%), антигипертензивный эффект при резистентной АГ (77,0%) и влияние на гиперактивность СНС (74,0%) [44]. В данном исследовании врачи отмечали особое преимущество и наибольшую пользу агонистов имидазолиновых рецепторов у пациентов с индексом массы тела >25 кг/м² (95% опрошенных), у пациентов с СД, метаболическим синдромом или нарушением толерантности к глюкозе (92%), а также у пациентов с гипертоническим кризом (86%) [45].
Большинство специалистов предпочитали назначение моксонидина во второй или третьей линии АГТ (рисунок 2). Результаты опроса соответствовали данным исследования STRAIGHT: российские участники исследования также отдавали предпочтение назначению агонистов имидазолиновых рецепторов в третьей (65,0%) и второй (48,0%) линии терапии [45].
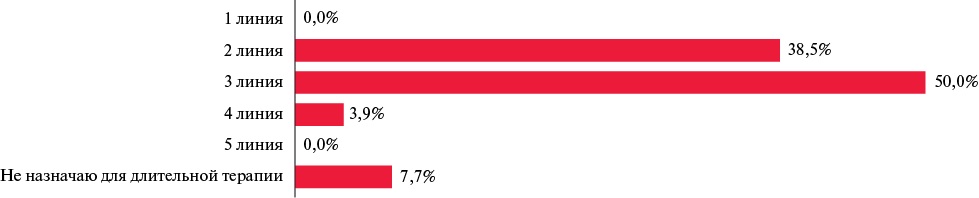
Рис. 2 Результаты опроса: "В какой линии при длительной антигипертензивной терапии Вы рассматриваете назначение моксонидина?".
Для обоснования назначения моксонидина на ранних этапах терапии АГ в историю болезни/амбулаторную карту большинство участников (64%) выразили согласие с предложенным алгоритмом (рисунок 3).
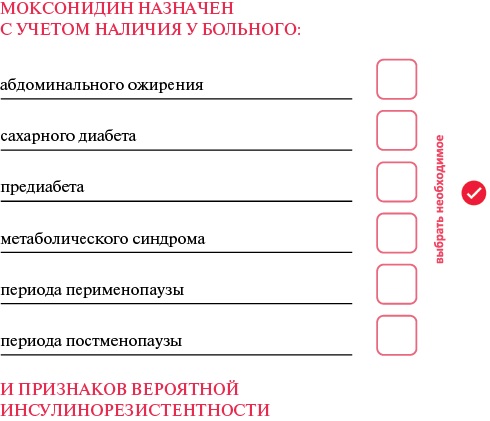
Рис. 3 Предложенный алгоритм назначения моксонидина.
Участники мероприятия также отметили, что для достижения поставленных целей АГТ отдают предпочтение назначению оригинального моксонидина (препарат Физиотенз®), а не дженериков. Больше половины участников (65,38%) в своей практике наблюдали различия в эффективности; 23,08% опрошенных предпочитали не назначать дженерики препарата Физиотенз®, 11,54% не наблюдали различий в эффективности. Результаты опроса согласуются и с данными исследований профессора Руксина В. В и др. (2015); Скибицкого В. В. и др. (2024). У пациентов с резкими внезапными подъемами АД без поражения органов-мишеней оригинальный моксонидин приводил к более быстрому снижению АД на 42% по сравнению с дженериком. Число пациентов, достигших достаточного антигипертензивного эффекта, в группе оригинального моксонидина было на 25% выше по сравнению с двумя дженериками [46][47]. При назначении препарата Физиотенз® преимущественно в составе тройной антигипертензивной комбинации с блокаторами РААС и антагонистами кальция/тиазидными или тиазидоподобными диуретиками в течение 24 нед. отмечена более высокая эффективность этого препарата по сравнению с тремя дженериками, причем, различие отмечалось с первого месяца лечения [48].
По результатам опроса, при неконтролируемой АГ врачи начинали терапию препаратом Физиотенз® чаще всего сразу с более высокой дозы — 0,4 мг/сут. при сопутствующем СД 2 типа и АГ 2-3 ст., также у пациентов с поражением органов-мишеней и длительностью АГ >10 лет (рисунок 4).
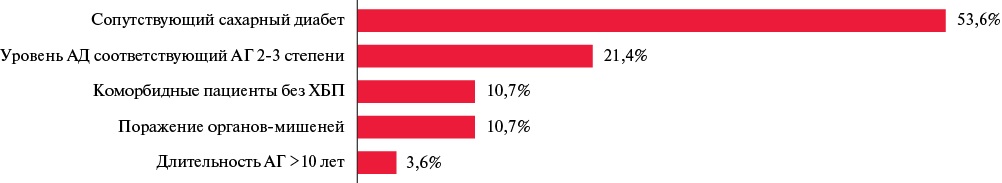
Рис. 4 Результаты опроса: "У пациентов с неконтролируемой АГ и какими сопутствующими заболеваниями Вы бы предпочли начать терапию препаратом Физиотенз® сразу с дозы 0,4 мг/сут.?".
Примечание: АГ — артериальная гипертензия, АД — артериальное давление, ХБП — хроническая болезнь почек.
В ходе дискуссии эксперты и участники мероприятия пришли к консенсусу, что моксонидин может рассматриваться как предпочтительный препарат для лечения АГ на ранних этапах терапии, особенно у пациентов с избыточной массой тела или ожирением, наличием инсулинорезистентности, предиабета, СД 2 типа или метаболических нарушений в анамнезе, у женщин в пери- или постменопаузе, для которых характерны метаболические нарушения, ассоциированные с инсулинорезистентностью. Включение моксонидина в схемы терапии у таких пациентов позволит не только эффективно снижать АД, но и улучшить чувствительность тканей к инсулину, метаболические параметры, создавая условия для контроля не только АГ, но и сопутствующих состояний, снижая общий ССР.
Заключение
АГ остается серьезной проблемой здравоохранения, требующей комплексного и индивидуализированного подхода к лечению больных с этой патологией. Персонализация терапии АГ позволит значительно улучшить приверженность лечению путем снижения количества побочных эффектов и повышения эффективности лечения, что, в свою очередь, повлияет на качество жизни и прогноз пациентов.
Изучение патофизиологических механизмов АГ имеет большое значение для более глубокого понимания механизмов развития АГ и необходимо для дальнейшей разработки новых эффективных стратегий лечения, учитывающих индивидуальные особенности пациентов.
Важным является необходимость внедрения регламентирующих схем и систем поддержки принятия решений в рутинной клинической практике. Условия ограниченного времени приема врача диктуют необходимость работать по шаблонам и алгоритмам. В связи с этим целесообразно разработать и внедрить электронные системы в медицинских учреждениях в помощь специалисту для более точного назначения АГП на основе индивидуальных данных пациента.
Препараты центрального действия — агонисты имидазолиновых рецепторов, в частности моксонидин (препарат Физиотенз®), имеют потенциал для более широкого применения в клинической практике на ранних этапах терапии АГ в качестве персонифицированного подхода у пациентов с абдоминальным ожирением, СД 2 типа, метаболическим синдромом и его компонентами, нарушением толерантности к глюкозе, ХБП, а также у женщин в пери- и постменопаузе, у которых достаточно часто встречаются метаболические нарушения и инсулинорезистентность. Назначение моксонидина на ранних этапах должно быть обосновано. Безусловное достоинство моксонидина состоит в том, что препарат может безопасно сочетаться с другими классами антигипертензивных средств и использоваться в составе комбинированной терапии. Моксонидин может применяться как в рамках длительного лечения АГ, так и в случае резких внезапных эпизодов повышения АД без поражения органов-мишеней. Эффективность оригинального моксонидина превосходит препараты-дженерики.
Таким образом, учитывая приведенные данные, можно говорить о необходимости уточнения позиции персонифицированной терапии больных АГ и перспектив дальнейшего изучения этой проблемы с учетом накопленного российского опыта.
Авторы выражают благодарность всем участникам, чьи обсуждения и активное участие послужили основой для подготовки данной статьи:
Аветисян Роман Араевич (г. Краснодар), Антонова Александра Алексеевна (г. Липецк), Веденская Светлана Сергеевна (г. Екатеринбург), Герцен Ксения Анатольевна (г. Ижевск), Горячева Анна Александровна (г. Смоленск), Грехова Людмила Викторовна (г. Киров), Дашкова Юлия Витальевна (г. Брянск), Донирова Оюна Сергеевна (г. Улан-Удэ), Ерощенко Евгения Алексеевна (г. Вологда), Жевагина Инна Анатольевна (г. Тюмень), Качковский Михаил Аркадьевич (г. Самара), Келарь Жанна Игоревна (г. Минеральные Воды), Киракозов Дмитрий Анатольевич (г. Волгоград), Коцоева Оланна Таймуразовна (г. Владикавказ), Липатова Татьяна Евгеньевна (г. Саратов), Липницкая Елена Анатольевна (г. Астрахань), Майстровская Юлия Витальевна (г. Владивосток), Марицкая Екатерина Александровна (г. Томск, Северск), Мельник Мария Валерьевна (г. Москва), Мешков Алексей Николаевич (г. Москва), Назарова Лилия Семеновна (г. Томск), Найдич Анна Михайловна (г. Екатеринбург), Осетрова Наталья Борисовна (г. Красноярск), Подольная Светлана Павловна (г. Омск), Починка Илья Григорьевич (г. Н. Новгород), Руяткин Дмитрий Сергеевич (г. Новосибирск), Саласюк Алла Сергеевна (г. Волгоград), Скуратова Мария Алексеевна (г. Самара), Твердохлиб Наталья Владимировна (г. Оренбург), Фейсханова Люция Исхаковна (г. Казань), Храмцова Наталья Анатольевна (г. Иркутск), Чернышёва Елена Николаевна (г. Астрахань), Яковлева София Васильевна (г. Челябинск).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Mancia G, Kreutz R, Brunström M, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension. J Hypertens. 2023;41(12):1874-2071. doi:10.1097/HJH.0000000000003480
2. McEvoy JW, McCarthy CP, Bruno RM, et al. 2024 ESC Guidelines for the management of elevated blood pressure and hypertension. Eur Heart J. 2024;45(38):3912-4018. doi:10.1093/eurheartj/ehae178
3. Клинические рекомендации. Артериальная гипертензия у взрослых.
4. Kario K, Okura A, Hoshide S, Mogi M. The WHO Global report 2023 on hypertension warning the emerging hypertension burden in globe and its treatment strategy. Hypertension Research. 2024;47(5):1099-1102. doi:10.1038/s41440-024-01622-w
5. Ерина А.М., Ротарь О.П., Солнцев В.Н., и др. Эпидемиология артериальной гипертензии в Российской Федерации – важность выбора критериев диагностики. Кардиология. 2019;59(6):5-11. doi:10.18087/cardio.2019.6.2595
6. Баланова Ю.А., Драпкина О.М., Куценко В.А., и др. Артериальная гипертония в российской популяции в период пандемии COVID-19: гендерные различия в распространённости, лечении и его эффективности. Данные исследования ЭССЕ-РФ3. Кардиоваскулярная терапия и профилактика. 2023;22(8S):3785. doi:10.15829/1728-8800-2023-3785
7. Grassi G, Drager LF. Sympathetic overactivity, hypertension and cardiovascular disease: state of the art. Curr Med Res Opin. 2024;40(sup1):5-13. doi:10.1080/03007995.2024.2305248
8. Конради А.О. Взаимодействие между симпатической нервной системой и ренин-ангиотензиновой системой. роль в повышении артериального давления. Артериальная гипертензия. 2012;18(6):577-583. doi:10.18705/1607-419X-2012-18-6-577-583
9. Chaturvedi A, Zhu A, Gadela NV, et al. Social Determinants of Health and Disparities in Hypertension and Cardiovascular Diseases. Hypertension. 2024;81(3):387-399. doi:10.1161/HYPERTENSIONAHA.123.21354
10. Norlander AE, Madhur MS, Harrison DG. The immunology of hypertension. J Exp Med. 2018;215(1):21-33. doi:10.1084/jem.20171773
11. Harrison DG, Patrick DM. Immune Mechanisms in Hypertension. Hypertension. 2024;81(8):1659-1674. doi:10.1161/HYPERTENSIONAHA.124.21355
12. Ge Y, Wang J, Wu L, Wu J. Gut microbiota: a potential new regulator of hypertension. Front Cardiovasc Med. 2024;11. doi:10.3389/fcvm.2024.1333005
13. Cui X, Zhang T, Xie T, et al. Research Progress on the Correlation Between Hypertension and Gut Microbiota. J Multidiscip Healthc. 2024;Volume 17:2371-2387. doi:10.2147/JMDH.S463880
14. Kario K, Tomitani N, Wang TD, et al. Home blood pressure-centered approach – from digital health to medical practice: HOPE Asia Network consensus statement 2023. Hypertension Research. 2023;46(12):2561-2574. doi:10.1038/s41440-023-01397-6
15. Баранова Е.И., Кацап А.А., Колесник О.С., Лебедева Е.В. Гипертоническая болезнь у женщин в пери- и постменопаузе – патофизиологические механизмы и подходы к лечению. Российский кардиологический журнал. 2023;28(5):99-107. doi:10.15829/1560-4071-2023-5
16. Li S, Tan I, Atkins E, et al. The Pathophysiology, Prognosis and Treatment of Hypertension in Females from Pregnancy to Post-menopause: A Review. Curr Heart Fail Rep. 2024;21(4):322-336. doi:10.1007/s11897-024-00672-y
17. Bager JE, Manhem K, Andersson T, et al. Hypertension: sex-related differences in drug treatment, prevalence and blood pressure control in primary care. J Hum Hypertens. 2023;37(8):662-670. doi:10.1038/s41371-023-00801-5
18. Handler J. Managing Erectile Dysfunction in Hypertensive Patients. J Clin Hypertens. 2011;13(6):450-454. doi:10.1111/j.1751-7176.2011.00465.x
19. Kajiwara A, Saruwatari J, Kita A, et al. Younger Females Are at Greater Risk of Vasodilation-Related Adverse Symptoms Caused by Dihydropyridine Calcium Channel Blockers: Results of a Study of 11,918 Japanese Patients. Clin Drug Investig. 2014;34(6):431-435. doi:10.1007/s40261-014-0191-4
20. Stimpel M, Koch B, Oparil S. Antihypertensive Treatment in Postmenopausal Women: Results from a Prospective, Randomized, Double-Blind, Controlled Study Comparing an ACE Inhibitor (Moexipril) with a Diuretic (Hydrochlorothiazide). Cardiology. 1998;89(4):271-276. doi:10.1159/000006799
21. Chazova I, Schlaich MP. Improved Hypertension Control with the Imidazoline Agonist Moxonidine in a Multinational Metabolic Syndrome Population: Principal Results of the MERSY Study. Int J Hypertens. 2013;2013:541689. doi:10.1155/2013/541689
22. Rayner B. Selective imidazoline agonist moxonidine plus the ACE inhibitor ramipril in hypertensive patients with impaired insulin sensitivity: partners in a successful MARRIAGE? Curr Med Res Opin. 2004;20(3):359-367. doi:10.1185/030079904125002991
23. Sharma AM, Wagner T, Marsalek P. Moxonidine in the treatment of overweight and obese patients with the metabolic syndrome: a postmarketing surveillance study. J Hum Hypertens. 2004;18(9):669-675. doi:10.1038/sj.jhh.1001676
24. Скибицкий В.В., Гутова С.Р., Фендрикова А.В., Скибицкий А.В. Антигипертензивные и вазопротективные эффекты комбинированной фармакотерапии у пациентов с артериальной гипертензией и предиабетом. Кардиология. 2020;60(4):10-17. doi:10.18087/cardio.2020.4.n1112
25. Чубенко Е.А., Беляева О.Д., Баженова Е.А., и др. Плейотропные эффекты моксонидина. Артериальная гипертензия. 2010;16(4):351-355. doi:10.18705/1607-419X-2010-16-4-351-355
26. Haczynski J, Flasinski J, Przewlocka-Kosmala M, Spring A. Effect of moxonidine on left ventricular hypertrophy in hypertensive patients. J Clin Basic Cardiol. 2001;4(1):61-65.
27. Littlewood KJ, Greiner W, Baum D, Zoellner Y. Adjunctive treatment with moxonidine versus nitrendipine for hypertensive patients with advanced renal failure: a cost-effectiveness analysis. BMC Nephrol. 2007;8(1):9. doi:10.1186/1471-2369-8-9
28. Krespi PG, Makris TK, Hatzizacharias AN, et al. Moxonidine Effect on Microalbuminuria, Thrombomodulin, and Plasminogen Activator Inhibitor-1 Levels in Patients with Essential Hypertension. Cardiovasc Drugs Ther. 1998;12(5):463-467. doi:10.1023/A:1007702132210
29. Мартынов А.И., Остроумова О.Д. Возможности моксонидина (физиотенза) в лечении артериальной гипертонии у пожилых больных. Клиническая геронтология. 2005;11:77-83.
30. Дудинская Е.Н., Ткачева О.Н., Базаева Е.В., и др. Новые возможности использования моксонидина в контроле артериального давления у пациенток с остеопенией. Кардиология. 2018;17(S7):36-45. doi:10.18087/cardio.2508
31. Чазова И.Е., Жернакова Ю.В., Блинова Н.В., и др. Евразийские клинические рекомендации по профилактике и лечению сердечно-сосудистых заболеваний у больных с ожирением (2022). Евразийский Кардиологический Журнал. 2022;(3):6-56. doi:10.38109/2225-1685-2022-3-6-56
32. Шляхто Е.В., Конради А.О., Звартау Н.Э., и др. Воздействие на автономную регуляцию сердечно-сосудистой системы как стратегическое направление лечения артериальной гипертензии, нарушений ритма и сердечной недостаточности. Российский кардиологический журнал. 2022;27(9):5195. doi:10.15829/1560-4071-2022-5195
33. Schlaich MP, Tsioufis K, Taddei S, et al. Targeting the sympathetic nervous system with the selective imidazoline receptor agonist moxonidine for the management of hypertension: an international position statement. J Hypertens. 2024;42(12):2025-2040. doi:10.1097/HJH.0000000000003769
34. Полякова Е.А., Конради А.О., Баранова Е.И. Артериальная гипертензия у женщин в пери- и постменопаузальный период: особенности патогенеза, лечения, наблюдения. Российский кардиологический журнал. 2024;29(1):5729.
35. Полякова Е.А., Конради А.О., Баранова Е.И., и др. Актуальные подходы к терапии пациентов с артериальной гипертензией в свете современных рекомендаций. Кардиоваскулярная терапия и профилактика. 2024;23(8):4140. doi:10.15829/1728-8800-2024-4140
36. Жернакова Ю.В. Современные представления о последствиях гиперактивации симпатоадреналовой системы у больных артериальной гипертонией с метаболическими нарушениями: возможности модуляции. Российский кардиологический журнал. 2023;28(12):5681. doi:10.15829/1560-4071-2023-5681
37. Grassi G, Biffi A, Seravalle G, et al. Sympathetic nerve traffic overactivity in chronic kidney disease: a systematic review and meta-analysis. J Hypertens. 2021;39(3):408-416. doi:10.1097/HJH.0000000000002661
38. Hall JE, do Carmo JM, da Silva AA, et al. Obesity-Induced Hypertension: interaction of neurohumoral and renal mechanisms. Circ Res. 2015;116(6):991-1006. doi:10.1161/CIRCRESAHA.116.305697
39. Valensi P. Autonomic nervous system activity changes in patients with hypertension and overweight: role and therapeutic implications. Cardiovasc Diabetol. 2021;20(1):170. doi:10.1186/s12933-021-01356-w
40. Rump L. The Role of Sympathetic Nervous Activity in Chronic Renal Failure. J Clin Basic Cardiol. 2001;4(3):179-182.
41. Ndumele CE, Rangaswami J, Chow SL, et al. Cardiovascular-Kidney-Metabolic Health: A Presidential Advisory From the American Heart Association. Circulation. 2023;148(20):1606-1635. doi:10.1161/CIR.0000000000001184
42. Vonend O, Marsalek P, Russ H, et al. Moxonidine treatment of hypertensive patients with advanced renal failure. J Hypertens. 2003;21(9):1709-1717. doi:10.1097/00004872-200309000-00021
43. Ротарь О.В, Ильянова И, Бояринова М, et al. Результаты Всероссийского скрининга артериальной гипертензии 2023. Российский кардиологический журнал. 2024;29(5):5931. doi:10.15829/1560-4071-2024-5931
44. Terentes-Printzios D, Ioakeimidis N, Rokkas K, Vlachopoulos C. Interactions between erectile dysfunction, cardiovascular disease and cardiovascular drugs. Nat Rev Cardiol. 2022;19(1):59-74. doi:10.1038/s41569-021-00593-6
45. Конради А.О., Звартау Н.Э., Чазова И.Е., и др. Особенности антигипертензивной терапии и практика назначения селективных агонистов имидазолиновых рецепторов в России по сравнению с другими странами: анализ данных исследования STRAIGHT. Терапевтический архив. 2021;93(4):440-448. doi:10.26442/00403660.2021.04.200818
46. Руксин В.В., Гришин О.В., Сямтомов А.С. Скорая медицинская помощь при повышении артериального давления – оригинальный препарат или дженерик? Скорая медицинская помощь. 2015;3:16-20.
47. Руксин В.В., Гришин О.В., Онучин М.В. Сравнение эффективности препаратов, содержащих моксонидин, при проведении неотложной антигипертензивной терапии. Системные гипертензии. 2015;12(2):8-12.
48. Скибицкий В.В., Фендрикова А.В., Скибицкий А.В., и др. Оригинальный моксонидин и генерики: где проходит грань отличий? Кардиология. 2024;64(8):24-31. doi:10.18087/cardio.2024.8.n2731
Об авторах
Е. И. БарановаРоссия
Елена Ивановна Баранова — д.м.н., профессор кафедры терапии факультетской с курсом эндокринологии, кардиологии с клиникой им. Г.Ф. Ланга, директор
Санкт-Петербург
В. А. Ионин
Россия
Валерий Александрович Ионин — д.м.н., доцент кафедры терапии факультетской с курсом эндокринологии, кардиологии с клиникой клиникой им. Г.Ф. Ланга
Санкт-Петербург
О. П. Ротарь
Россия
Оксана Петровна Ротарь — д.м.н., зав. научно-исследовательской лабораторией популяционной генетики НИО "Кардиометаболических нарушений и персонифицированной профилактики" НЦМУ "Центр персонализированной медицины"
Санкт-Петербург
Что известно о предмете исследования?
- Гиперактивность симпатической нервной системы — важнейший фактор патогенеза артериальной гипертензии.
- Моксонидин блокирует симпатическую нервную систему на центральном уровне, снижает инсулинорезистентность, что имеет особое значение для лечения артериальной гипертензии у пациентов с ожирением, метаболическим синдромом, предиабетом, сахарным диабетом 2 типа и у женщин в пери- и в постменопаузе.
Что добавляют результаты исследования?
- По результатам опроса врачей эффективность оригинального моксонидина и дженериков в реальной клинической практике различается, что подтверждают результаты российского сравнительного исследования оригинального моксонидина и трех дженериков.
Рецензия
Для цитирования:
Баранова Е.И., Ионин В.А., Ротарь О.П. Персонифицированный подход к терапии пациентов с артериальной гипертензией: фокус на агонисты имидазолиновых рецепторов. Мнение по проблеме. Кардиоваскулярная терапия и профилактика. 2025;24(2):4342. https://doi.org/10.15829/1728-8800-2025-4342. EDN: LCNWNX
For citation:
Baranova E.I., Ionin V., Rotar O.P. Personalized approach to the treatment of patients with arterial hypertension: focus on imidazoline receptor agonists. Opinion on the problem. Cardiovascular Therapy and Prevention. 2025;24(2):4342. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4342. EDN: LCNWNX

























































