Перейти к:
Роль сиртуина 6 в развитии раннего сосудистого старения у больных ишемической болезнью сердца молодого и среднего возраста (обзор литературы)
https://doi.org/10.15829/1728-8800-2025-4370
EDN: OCWUBS
Аннотация
Ишемическая болезнь сердца (ИБС) остается лидирующей причиной инвалидизации и высокой смертности, в т.ч. среди лиц трудоспособного возраста. Одной из наиболее частых причин развития ИБС в молодом возрасте является синдром раннего сосудистого старения (СРСС). В аспекте этой проблемы, изучение регулирующей роли сиртуина 6 в развитии СРСС представляется актуальной. Целью обзора стал анализ данных литературы, касающихся возможности влияния сиртуина 6 на развитие СРСС у больных ИБС молодого и среднего возраста. Для этого был проведен поиск в международных базах данных PubMed, Scopus, Web of Science и Cochrane Library, а также в российских базах, включая eLIBRARY и Кибер Ленинка. Особое внимание уделялось работам, опубликованным за последние 15 лет, с акцентом на исследования, проведенные в течение последних 5 лет. На основании литературного анализа было показано, что сиртуин 6, эпигенетически модулируя транскрипцию генов и изменяя функцию белка, участвует в основных механизмах старения и связанных с ним сердечно-сосудистых заболеваний. Таким образом, изучение эффектов сиртуина 6 позволит получить более детальное понимание сложного механизма взаимодействия между ним, системными факторами и развитием сердечно-сосудистой патологии.
Для цитирования:
Останина Ю.О., Яхонтов Д.А., Уфилина Д.А. Роль сиртуина 6 в развитии раннего сосудистого старения у больных ишемической болезнью сердца молодого и среднего возраста (обзор литературы). Кардиоваскулярная терапия и профилактика. 2025;24(8):4370. https://doi.org/10.15829/1728-8800-2025-4370. EDN: OCWUBS
For citation:
Ostanina Yu.O., Yakhontov D.A., Ufilina D.A. Role of sirtuin 6 in early vascular aging in young and middle-aged patients with coronary artery disease (literature review). Cardiovascular Therapy and Prevention. 2025;24(8):4370. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4370. EDN: OCWUBS
Введение
Ишемическая болезнь сердца (ИБС) сохраняет лидирующие позиции в структуре сердечно-сосудистой заболеваемости и смертности как в России, так и во всем мире, в т.ч. у лиц молодого возраста. В этом патологическом процессе задействованы многочисленные сигнальные пути, функционирование которых определяется сигнальными молекулами.
Среди таких соединений следует остановиться на сиртуинах (silent information regulator, sirtuin) — семействе сигнальных белков, участвующих в регуляции обмена веществ. Сиртуин 6 принадлежит к семейству НАД+ (никотинамидадениндинуклеотид)-зависимых деацетилаз и играет важную роль в контроле гомеостаза организма и продолжительности жизни, модулируя стабильность генома, длину теломер, транскрипцию и репарацию дезоксирибонуклеиновой кислоты (ДНК); в то же время снижение его продукции (уровня) сопряжено с развитием ряда патологических состояний, включая хроническое низкоинтенсивное воспаление, ожирение и др. [1].
Показана ведущая роль сиртуинов и хемокинов в развитии эндотелиальной дисфункции, наблюдаемой при естественном и индуцированном старении. Ускоренное старение эндотелиоцитов сопровождалось более выраженным уменьшением синтеза ряда сиртуинов по сравнению с репликативным старением клеток этого типа, что может являться одним из патогенетических звеньев развития ассоциированных с возрастом сердечно-сосудистых заболеваний (ССЗ) [1]. В экспериментах на животных моделях сиртуин 6 продемонстрировал свое влияние на регуляцию биологического гомеостаза, метаболизм глюкозы и липидов, воспаление и геномную стабильность, а также продолжительность жизни и развитие ряда заболеваний, в т.ч. и ССЗ [2]. Известно, что у лиц молодого возраста ИБС чаще манифестирует острым коронарным синдромом, при этом частота необструктивного поражения коронарных артерий (КА) выше, чем у лиц старших возрастных групп [3]. Одной из наиболее частых причин развития ИБС в молодом возрасте является синдром раннего сосудистого старения (СРСС), частота которого может достигать 73% всех случаев развития ИБС у молодых [4]. С учетом большой социальной и экономической значимости ИБС, особенно у лиц молодого возраста, изучение дополнительных механизмов ее раннего развития представляется весьма перспективным.
Цель — провести анализ данных литературы, касающихся роли сиртуина 6 в развитии раннего сосудистого старения у больных ИБС молодого и среднего возраста.
Методология исследования
В рамках анализа данных о возможности использования сиртуина 6 как маркера развития СРСС у больных ИБС молодого и среднего возраста был осуществлен многоэтапный подход к сбору и изучению как отечественных, так и зарубежных источников литературы. Поиск информации проводился в международных базах данных, таких как PubMed, Scopus, Web of Science и Cochrane Library, а также в российских базах, включая eLIBRARY и Кибер Ленинка, для учета всех актуальных и значимых публикаций. В ходе поиска использовались ключевые слова и сочетания, такие как "сиртуин 6", "ишемическая болезнь сердца", "синдром раннего сосудистого старения" и их аналоги на английском языке. Особое внимание уделялось работам, опубликованным за последние 15 лет, с акцентом на исследования, проведенные в течение последних 5 лет, чтобы всесторонне представить имеющеюся информацию по данной проблеме.
Результаты
Сиртуин представляет собой НАД+-зависимый белок гистондеацетилазу, который оставался высоко консервативным в ходе эволюции от бактерий к млекопитающим [5]. Посредством фермент-зависимых или независимых влияний сиртуины могут эпигенетически модулировать транскрипцию генов и изменять функцию белка, осуществляя посттрансляционную регуляцию. Иными словами, сиртуины изменяют уровень экспрессии и активность белков, в основном ферментов, и факторов транскрипции [6]. Среди сиртуинов сиртуин 6 известен благодаря его защитным свойствам в отношении развития атеросклероза, сердечно-сосудистого ремоделирования и сердечной недостаточности; он также был идентифицирован как возможная цель вмешательства при развитии ССЗ, что ставит его в центр клинического интереса [2].
СРСС
Синдром раннего сосудистого старения (СРСС, EVA — early vascular aging), предложенный шведским ученым Nilsson PM (2008), часто встречается у пациентов с артериальной гипертензией и повышенным бременем факторов сердечно-сосудистого риска (ССР). Одним из аспектов сосудистого старения является ригидность артерий, определяемая по увеличению скорости пульсовой волны или индекса аугментации и центрального давления. Известно, что процесс сосудистого старения начинается в раннем возрасте, а функция артерий и их старение могут быть запрограммированы еще внутриутробно или на них могут влиять неблагоприятные факторы роста в раннем детском возрасте. Это подтверждают результаты эпидемиологических наблюдений о наличии обратной связи между массой тела при рождении, скорректированной с учетом гестационного возраста, и повышением систолического артериального давления в детском, подростковом и взрослом возрасте, сопровождающимся повышением ССР [7].
В исследовании Ротарь О. П. и др. (2021) были показаны ассоциации факторов ССР с различными фенотипами сосудистого старения в российской популяции по данным исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний в регионах Российской Федерации). Распространенность фенотипа супернормального сосудистого старения (Super Normal Vascular Aging, SUPERNOVA) составила 9,7%, фенотипа преждевременного сосудистого старения (EVA) — 18,8% и фенотипа нормального сосудистого старения (normal vascular aging) — 71,5%. У пациентов с фенотипом преждевременного (раннего) сосудистого старения чаще регистрировалась артериальная гипертензия, ожирение, дислипидемия и реже — высокая физическая нагрузка. При субанализе подгруппы молодых участников с фенотипом EVA выявлены относительно высокая распространенность сахарного диабета (СД), чрезмерного употребления алкоголя и курения [8].
По данным Недогоды С. В. и др. (2021) риск СРСС у пациентов с метаболическим синдромом увеличивался при наличии СД 2 типа, клинических признаков инсулинорезистентности, увеличении индекса HOMA (Homeostasis Model Assessment) и уровня С-реактивного белка (определенного высокочувствительным методом) с каждым годом увеличения паспортного возраста, а также с повышением диастолического артериального давления и уровня мочевой кислоты [9].
Таким образом, с учетом данных о влиянии уровня сиртуина 6 на стабильность генома, длину теломер, транскрипцию и репарацию ДНК, а также активность хронического низкоинтенсивного воспаления, наличие ожирения, состояние сосудистой стенки и др. [1], изучение влияние сиртуина 6 в аспекте СРСС представляется весьма перспективным.
Сиртуин 6
Сиртуины — семейство сигнальных белков, включающее в себя сиртуины 1-7. Они участвуют в поддержании целостности генома, реакции на повреждение ДНК и его восстановление, модулировании окислительного стресса, старения, воспаления и энергетического обмена благодаря их НАД-зависимой деацетилазной активности и эпигенетической функции подавления транскрипции генов [5]. Среди группы сиртуинов 1-7 существуют ядерные сиртуины, это сиртуины 1, 6 и 7, в то же время имеются данные о том, что сиртуин 2 и сиртуин 3 могут мигрировать между органеллами. Их функция состоит в определении начала старения клетки, кроме того, они играют решающую роль в регуляции воспаления и участвуют в развитии и прогрессировании атеросклероза [10].
Известно, что сиртуин 6 вовлечен в функционирование многих регуляторных путей старения и связан с развитием возраст-ассоциированных заболеваний, а также может выступать в качестве специфического биомаркера старения [11][12]. Основные мишени сиртуина 6 в патогенезе развития ССЗ представлены на рисунке 1. Являясь эпигенетическим регулятором генов, связанных со старением, воспалением и метаболизмом, сиртуин 6 участвует в передаче сигналов о восстановлении повреждений ДНК [13], а его способность восстанавливать двухцепочечные разрывы ДНК напрямую связана с продолжительностью жизни [14].
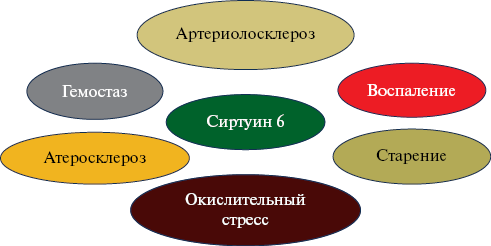
Рис. 1 Основные точки приложения сиртуина 6 с позиции развития ССЗ.
Старение в значительной степени связано с развитием теломерных нарушений и геномной нестабильностью [15], а истощение теломер и накопление коротких теломер происходит параллельно с процессами старения человека и, возможно, является ведущей причиной заболеваний, связанных со старением [16-19]. Между тем, влияние сиртуина 6 на репарацию ДНК и поддержание целостности генома сегодня активно изучается в аспекте старения и связанных с ним заболеваний [19][20].
В исследовании Zhao Y, et al. (2021) изучался уровень сиртуина 6 в сыворотке крови в различных возрастных группах. Было показано, что его уровень был значительно ниже у лиц среднего и пожилого возраста по сравнению с молодыми [11]. Кроме того, в данном исследовании были продемонстрированы гендерные различия в уровне сиртуина 6 в сыворотке крови в зависимости от возраста. Так, у женщин молодого и среднего возраста наблюдались более высокие значения уровня сиртуин 6 по сравнению с мужчинами той же возрастной группы. Однако существенных различий в уровне сиртуина 6 между мужчинами различных возрастных групп обнаружено не было, а деацетилазная активность сиртуина 6 в сыворотке крови у мужчин с увеличением возраста постепенно снижалась. У женщин пожилого возраста также наблюдалось снижение деацетилазной активности сиртуина 6, в то время как значимой разницы между группами среднего и молодого возраста не было. Параллельная оценка активности теломеразы показала ее снижение с возрастом, но гендерных различий не наблюдалось [11].
Атеросклероз, старение и сиртуин 6
Окислительный стресс играет важную роль в развитии атеросклероза и старения. Белки сиртуины способствуют клеточной толерантности к окислительному стрессу, регулируя активность многих генов и связанных с ними сигнальных путей. Активируемая аденозинмонофосфатом (АМФ) протеинкиназа (AMP-activated protein kinase, AMPK) является основным регулятором метаболического гомеостаза и часто активируется в условиях ишемии и гипоксии. Семейство сиртуинов, в частности сиртуин 1 и 6 способствует экспрессии AMPK, тем самым повышая экспрессию генов, кодирующих ферменты антиоксидантной защиты — Mn-зависимую изоформу супероксиддисмутазы и каталазу, тем самым, подавляя окислительный стресс [21][22]. Тем не менее, необходимы дополнительные исследования для лучшего понимания взаимосвязи между сиртуином 6 и AMPK в условиях окислительного стресса с целью изучения потенциальных протективных возможностей сиртуина 6.
Старение имеет схожую патофизиологию с ожирением, а также связано с развитием хронического низкоинтенсивного воспаления в жировой ткани [23]. Убедительные клинические данные свидетельствуют об увеличении риска ожирения с возрастом [24][25], что указывает на связь ожирения не только с метаболическими заболеваниями, присущими старению, но и со старением как таковым [26]. Тем не менее, молекулярный механизм, с помощью которого ожирение ускоряет процесс старения или наоборот, не совсем понятен. В ряде исследований показано, что экспрессия сиртуина 6 индуцируется в жировой ткани диетой с ограничением калорий или при потере веса [27], в то время как у лиц с избыточным весом его экспрессия подавляется [28]. В экспериментах на мышах с дефицитом сиртуина 6 наблюдался ряд изменений, связанных со старением, которые в конечном итоге привели к преждевременной смерти животных [29]. Напротив, сверхэкспрессия сиртуина 6 на фоне диеты с ограничением калорий у самцов трансгенных мышей значительно увеличивала продолжительность жизни по сравнению с мышами дикого типа, причем эффект сохранялся и у более старых животных [30].
Имеющиеся экспериментальные данные указывают на важность сиртуина 6 как регулятора воспаления жировой ткани, запускающего секрецию противовоспалительных адипоцитокинов и транскрипционную регуляцию созревания иммунных клеток. He Y, et al. (2021) обнаружено, что повышение уровня фактора некроза опухоли альфа (ФНО-α) значительно снижало экспрессию сиртуина 6 и увеличивало экспрессию провоспалительных цитокинов, участвующих в развитии атеросклероза и дестабилизации атеросклеротической бляшки: моноцитарного хемотаксического белка 1 (MCP-1), интерлейкинов (ИЛ)-6 и ИЛ-1β. Однако, сверхэкспрессия сиртуина 6 ингибировала вызванную ФНО-α экспрессию MCP-1, ИЛ-6 и ИЛ-1β [31].
Показана защитная роль сиртуина 6 в развитии эндотелиальной дисфункции, сосудистого старения и атеросклероза. Антиатерогенный эффект в условиях окисления липопротеинов низкой плотности он реализует путем подавления образования пенистых клеток через индукцию аутофагии макрофагов и обратного транспорта холестерина из макрофагов с участием липопротеинов высокой плотности, а также и снижения уровня микро-РНК-33 (рибонуклеиновой кислоты) [2].
В исследованиях in vivo установлено, что сверхэкспрессия сиртуина 6 снижает захват окисленных липопротеинов низкой плотности макрофагами, а уменьшение экспрессии сиртуина 6 усиливает его и увеличивает экспрессию скэвенджер-рецепторов макрофагов 1 [32, 33]. Кроме того, сиртуин 6 играет существенную роль в уменьшении повреждения миокарда, связанного с хронической ишемией и инфарктом, за счет влияния на окислительный стресс и апоптоз [2]. Тем не менее, молекулярные механизмы, лежащие в основе этих процессов, нуждаются в дальнейшем изучении.
Сиртуин 6 частично подавляет воспаление в стареющих гладкомышечных клетках (ГМК) сосудов, являющихся основным компонентом медиального слоя артерий и обуславливающих жесткость сосудистой стенки [34]. Известно, что стареющие ГМК сосудов способствуют развитию атеросклероза за счет усиления регуляции воспалительных цитокинов как части секреторного фенотипа, связанного со старением [35][36]. Протективное влияние сиртуина 6 на ГМК в отношении старения и уменьшения проявлений атеросклероза показано Grootaert MOJ, et al. (2021). Сиртуин 6 оказывает противовоспалительное действие, подавляя экспрессию генов воспаления, зависимую от ядерного фактора-êB, а снижение уровня сиртуина 6, наоборот, вызывает зависимое от ядерного фактора-êB старение клеток линии HeLa. В исследовании на мышах сверхэкспрессия сиртуина 6 ассоциировалась со снижением уровня маркеров воспаления и старения, а также значительным образом влияла на площадь атеросклеротической бляшки и ее стабильность. При этом противовоспалительный эффект сиртуина 6 связан с влиянием на экспрессию ряда микро-РНК, ИЛ-1α, ИЛ-6 и MCP-1, что частично подавляет воспаление, задерживая старение ГМК сосудов [33].
Гипертрофия левого желудочка (ГЛЖ) и сиртуин 6
Описана связь сиртуина 6 и ГЛЖ. На животных моделях было показано, что снижение экспрессии сиртуина 6 сопровождалось развитием ГЛЖ и сердечной недостаточности, тогда как его повышенная экспрессия уменьшала выраженность ГЛЖ. Повышенная экспрессия сиртуина 6 в кардиомиоцитах снижала эффекты ангиотензина II, который, в свою очередь, играет ведущую роль в развитии ГЛЖ [37].
Система гемостаза и сиртуин 6
Нарушения системы гемостаза играют важную роль в развитии ИБС, в т.ч. ее острых форм, однако роль сиртуина 6 в патогенезе артериального тромбоза остается мало изученной. В культивируемых эндотелиальных клетках аорты человека подавление экспрессии сиртуина 6 активировало экспрессию тканевого фактора — центрального триггера каскада свертывания. В экспериментах на животных моделях эндотелий-специфическая делеция в гене сиртуина 6 (4-6 экзоны) способствовала развитию артериального тромбоза [38].
Таким образом, сиртуин 6 оказывает влияние на множество биологических процессов, что позволяет рассматривать его в качестве значимой молекулы в развитии старения в целом, и EVA, в частности. Кроме того, активно обсуждается возможность использования сиртуина 6 в качестве потенциальной терапевтической мишени. Однако необходимо лучше понять терапевтическую роль специфичных для сиртуина 6 модуляторов (активаторов и ингибиторов) при ССЗ, метаболических заболеваниях, включая ожирение и СД. К настоящему времени идентифицировано несколько соединений, способных влиять на уровень экспрессии сиртуина 6; это, в частности ламин А, свободные жирные кислоты, кверцетин, лютеолин, флувастатин, трихостатин А, а также диета с дефицитом калорий, о которой уже упоминалось выше [37]. В то же время известно, что сверхэкспрессия сиртуина 6 может неоднозначно влиять на риск развития рака. С одной стороны, активно обсуждается роль сиртуина 6 в качестве супрессора ряда опухолей, а с другой — показана связь сверхэкспрессии сиртуина 6 с развитием как сóлидных, так и гематологических типов рака человека [39], что, безусловно, требует взвешенного подхода к потенциальной возможности его терапевтического применения. Вероятно, для повышения терапевтической эффективности модуляторов сиртуина 6 и минимизации их побочных эффектов должна быть изучена возможность использования тканеспецифических препаратов или генной терапии.
Заключение
Несмотря на большой объем публикаций об эффектах сиртуина 6 в аспекте развития старения и ССЗ, большинство из проанализированных работ носит экспериментальный характер. Необходимо аккумулировать больше данных об уровне сиртуина 6 у пациентов разных возрастных групп и при различной сердечно-сосудистой патологии, в т.ч. артериальной гипертензии, ИБС, сердечной недостаточности, нарушениях ритма. Это позволит получить более детальное понимание сложного механизма взаимодействия между сиртуином 6, системными факторами и развитием сердечно-сосудистой патологии. Кроме того, использование данного белка может иметь перспективы для разработки инновационных терапевтических подходов, направленных на управление старением и заболеваниями сердечно-сосудистой системы.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Савицкий Д.В., Линькова Н. С., Кожевникова Е.О. и др. Сиртуины и хемокины — маркеры репликативного и индуцированного старения эндотелиоцитов человека. Acta Biomed Sci. 2022;7(5-2):12-20. doi:10.29413/ABS.2022-7.5-2.2.
2. Айтбаев К.А., Муркамилов И.Т., Муркамилова Ж.А. и др. Эпигенетические механизмы кардиопротекции: в фокусе — активация сиртуинов. Архивъ внутренней медицины. 2021;11(6):424-32. doi:10.20514/2226-6704-2021-11-6-424-432.
3. Сафонова Е.А., Сукманова И.А. Инфаркт миокарда без обструктивного поражения коронарных артерий (MINOCA). Клиническая медицина. 2020;98(2):89-97. doi:10.30629/0023-2149-2020-98-2-89-97.
4. Яхонтов Д.А., Останина Ю.О. Синдром раннего сосудистого старения у больных артериальной гипертонией в сочетании с ишемической болезнью сердца молодого и среднего возраста. Медицинский алфавит. 2018;1(3):33-6.
5. Самойлова Е.М., Романов С.Е., Чудакова Д.А. и др. Роль сиртуинов в эпигенетической регуляции и контроле старения. Вавиловский журнал генетики и селекции. 2024;28(2):215-27. doi:10.18699/vjgb-24-26.
6. Айтбаев К. А., Муркамилов И. Т., Муркамилова Ж. А. и др. Регуляция иммунной системы при старении: в фокусе — эпигенетические механизмы. Архивъ внутренней медицины. 2022;12(1):35-44. doi:10.20514/2226-6704-2022-12-1-35-44.
7. Nilsson PM, Lurbe E, Laurent S.The early life origins of vascular ageing and cardiovascular risk: the EVA syndrome. J Hypertens. 2008;26(6):1049-57. doi:10.1097/HJH.0b013e3282f82c3e.
8. Ротарь О.П., Бояринова М.А., Толкунова К.М. и др. Фенотипы сосудистого старения в российской популяции — биологические и социально-поведенческие детерминанты. Кардиоваскулярная терапия и профилактика. 2021;20(5):2970. doi:10.15829/1728-8800-2021-2970.
9. Недогода С.В., Саласюк А.С., Барыкина И.Н. и др. Синдром раннего сосудистого старения у пациентов с метаболическим синдромом: особенности течения и диагностики. Южно-Российский журнал терапевтической практики. 2021;2(1):50-62. doi:10.21886/2712-8156-2021-2-1-50-62.
10. Ziętara P, Dziewięcka M, Augustyniak M.Why Is Longevity Still a Scientific Mystery? Sirtuins-Past, Present and Future. Int J Mol Sci. 2022;24(1):728. doi:10.3390/ijms24010728.
11. Zhao Y, Bai X, Jia X, et al. Age-related changes of human serum Sirtuin6 in adults. BMC Geriatr. 2021;21(1):452. doi:10.1186/s12877-021-02399-0.
12. Чепурнова Н. С., Ющук В. Н., Козаева О.А. и др. Генетические предикторы сосудистого старения. Современные проблемы науки и образования. 2022;(6- 2):3. doi:10.17513/spno.32111.
13. Onn L, Portillo M, Ilic S, et al. SIRT6 is a DNA double-strand break sensor. Elife. 2020;9:e51636. doi:10.7554/eLife.51636.
14. Tian X, Firsanov D, Zhang Z, et al. SIRT6 is responsible for more efficient DNA double-strand break repair in long-lived species. Cell. 2019;177:622-38.e22. doi:10.1016/j.cell.2019.03.043.
15. Салахов Р.Р., Понасенко А.В. Длина теломер и сердечно-сосудистые заболевания. Комплексные проблемы сердечно-сосудистых заболеваний. 2018;7(4S):101-7. doi:10.17802/2306-1278-2018-7-4S-101-107.
16. Останина Ю.О., Яхонтов Д.А. Длина теломер у больных ишемической болезнью сердца разных возрастных групп. Вестник современной клинической медицины. 2018;11(1):44-9. doi:10.20969/VSKM.2018.11(1).44-49.
17. Асанов М.А., Поддубняк А.О., Понасенко А.В. Связь длины теломер с маркерами метаболизма и воспаления в пре- и послеоперационном периоде у пациентов с ишемической болезнью сердца. Комплексные проблемы сердечно-сосудистых заболеваний. 2024;13(3):28-36. doi:10.17802/2306-1278-2024-13-3-28-36.
18. Дорощук Н.А., Ланкин В.З., Тихазе А.К. и др. Длина теломеров как биомаркер риска сердечно-сосудистых осложнений у больных ишемической болезнью сердца. Терапевтический архив. 2021;93(1):20-4. doi:10.26442/00403660.2021.01.200588.
19. Пухальская А.Э., Кветной И.М., Линькова Н.С. и др. Сиртуины и старение. Успехи физиологических наук. 2022;53(1):16-27. doi:10.31857/S0301179821040056.
20. Аронов Д. М., Драпкина О. М., Бубнова М. Г. Роль генетических факторов (биологии теломер хромосом) в кардиореабилитации. Кардиоваскулярная терапия и профилактика. 2022; 21(6):3272. doi:10.15829/1728-8800-2022-3272.
21. Wu QJ, Zhang TN, Chen HH, et al. The sirtuin family in health and disease. Signal Transduct Target Ther. 2022;7(1):402. doi:10.1038/s41392-022-01257-8.
22. Зенков Н.К., Кожин П.М., Чечушков А.В. и др. Окислительный стресс при старении. Успехи геронтологии. 2020;33:10-22. doi:10.34922/AE.2020.33.1.001.
23. Метельская В.А., Тимофеев Ю.С., Нешкова Е.А. и др. Воспалительное старение. Часть 2. Есть ли доступные диагностические биомаркеры. Профилактическая медицина. 2025;28(1):89-95. doi:10.17116/profmed20252801189.
24. Кривошапова К.Е., Масенко В.Л., Баздырев Е.Д. и др. Остеосаркопеническое ожирение у пациентов с сердечно-сосудистыми заболеваниями. Спорные и нерешенные вопросы. Кардиоваскулярная терапия и профилактика. 2021;20(6):2787. doi:10.15829/1728-8800-2021-2787.
25. Маматов А.У., Полупанов А.Г., Какеев Б.А. и др. Половые и возрастные факторы, ассоциированные с развитием ожирения. The Scientific Heritage. 2021;(68-2(68):46-56. doi:10.24412/9215-0365-2021-68-2-46-56.
26. Santos AL, Sinha S. Obesity and aging: molecular mechanisms and therapeutic approaches. Ageing Res Rev. 2021;67:101268. doi:10.1016/j.arr.2021.101268.
27. Kuang J, Zhang Y, Liu Q, et al. Fat-specific Sirt6 ablation sensitizes mice to high-fat diet-induced obesity and insulin resistance by inhibiting lipolysis. Diabetes. 2017;66:1159-71. doi:10.2337/db16-1225.
28. Martinez-Jimenez V, Cortez-Espinosa N, Rodriguez-Varela E, et al. Altered levels of sirtuin genes (SIRT1, SIRT2, SIRT3 and SIRT6) and their target genes in adipose tissue from individual with obesity. Diabetes Metab Syndr. 2019;13:582-9. doi:10.1016/j.dsx.2018.11.011.
29. Mostoslavsky R, Chua KF, Lombard DB, et al. Genomic instability and aging-like phenotype in the absence of mammalian SIRT6. Cell. 2006;124:315-29. doi:10.1016/j.cell.2005.11.044.
30. Wei Z, Yang B, Wang H, et al. Caloric restriction, Sirtuins, and cardiovascular diseases. Chin Med J (Engl). 2024;137(8):921-35. doi:10.1097/CM9.0000000000003056.
31. He Y, Yang G, Sun L, et al. SIRT6 inhibits inflammatory response through regulation of NRF2 in vascular endothelial cells. Int Immunopharmacol. 2021;99:107926. doi:10.1016/j.intimp.2021.107926.
32. Arsiwala T, Pahla J, van Tits LJ, et al. Sirt6 deletion in bone marrow-derived cells increases atherosclerosis — Central role of macrophage scavenger receptor 1. J Mol Cell Cardiol. 2020;139: 24-32. doi:10.1016/j.yjmcc.2020.01.002.
33. Finigan A, Figg NL, Uryga AK, et al. SIRT6 protects smooth muscle cells from senescence and reduces atherosclerosis. Circ Res. 2021;128:474-91. doi:10.1161/CIRCRESAHA.120.318353.
34. Shi J, Yang Y, Cheng A, et al. Metabolism of vascular smooth muscle cells in vascular diseases. Am J Physiol Heart Circ Physiol. 2020;319(3):H613-31. doi:10.1152/ajpheart.00220.2020.
35. Савицкий Д.В., Линькова Н.С., Кожевникова Е.О. и др. SASP эндотелия и гладкомышечных клеток сосудов: роль в патогенезе и терапии атеросклероза. Молекулярная медицина. 2022;(4):9-15. doi:10.29296/24999490-2022-04-02.
36. Синицкий М.Ю., Синицкая А.В., Шишкова Д.К. и др. Оценка экспрессии провоспалительных цитокинов в гладкомышечных клетках коронарной артерии, экспонированных мутагеном алкилирующего механизма действия. Комплексные проблемы сердечно-сосудистых заболеваний. 2022;11(4):158-66. doi:10.17802/2306-1278-2022-11-4-158-166.
37. Raj S, Dsouza LA, Singh SP, et al. Sirt6 deacetylase: a potential key regulator in the prevention of obesity, diabetes and neurodegenerative disease. Front Pharmacol. 2020;11:598326. doi:10.3389/fphar.2020.598326.
38. Gaul DS, Calatayud N, Pahla J, et al. Endothelial SIRT6 deficiency promotes arterial thrombosis in mice. J Mol Cell Cardiol. 2023;174:56-62. doi:10.1016/j.yjmcc.2022.11.005.
39. Fiorentino F, Carafa V, Favale G, et al. The two-faced role of SIRT6 in cancer. Cancers (Basel) 2021;13:1156. doi:10.3390/cancers13051156.
Об авторах
Ю. О. ОстанинаРоссия
Останина Юлия Олеговна — д.м.н., доцент кафедры фармакологии, клинической фармакологии и доказательной медицины
Новосибирск
Д. А. Яхонтов
Россия
Яхонтов Давыд Александрович — д.м.н., профессор кафедры фармакологии, клинической фармакологии и доказательной медицины
Новосибирск
Д. А. Уфилина
Россия
Уфилина Дарья Алексеевна — аспирант кафедры фармакологии, клинической фармакологии и доказательной медицины
Новосибирск
Дополнительные файлы
Что известно о предмете исследования?
- Синдром раннего сосудистого старения (СРСС) является одной из ведущих причин развития ишемической болезни сердца у лиц молодого возраста.
- К основным характеристикам СРСС относятся повышенная сосудистая жесткость и укорочение длины теломер.
Что добавляют результаты исследования?
- Сиртуин 6, участвующий в регуляции воспаления, окислительного стресса, развитии атеросклероза и ряда других процессов, связанных со старением и возникновением сердечно-сосудистых заболеваний, может стать перспективной терапевтической мишенью при СРСС.
Рецензия
Для цитирования:
Останина Ю.О., Яхонтов Д.А., Уфилина Д.А. Роль сиртуина 6 в развитии раннего сосудистого старения у больных ишемической болезнью сердца молодого и среднего возраста (обзор литературы). Кардиоваскулярная терапия и профилактика. 2025;24(8):4370. https://doi.org/10.15829/1728-8800-2025-4370. EDN: OCWUBS
For citation:
Ostanina Yu.O., Yakhontov D.A., Ufilina D.A. Role of sirtuin 6 in early vascular aging in young and middle-aged patients with coronary artery disease (literature review). Cardiovascular Therapy and Prevention. 2025;24(8):4370. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4370. EDN: OCWUBS
JATS XML

























































