Перейти к:
Возможности акустического анализа голоса в диагностике хронических неинфекционных заболеваний: систематический обзор и метаанализ
https://doi.org/10.15829/1728-8800-20254407
EDN: QEOUOE
Аннотация
Цель. Определение возможностей использования параметров акустического анализа голоса в диагностике хронических неинфекционных заболеваний (ХНИЗ).
Материал и методы. Поиск информации проводился согласно требованиям и положениям PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) в базах данных PubMed, Google Scholar, Clinical Trials, Киберленинка и eLibrary. В окончательный анализ полнотекстовых статей было отобрано 4 публикации, включающие 6 исследований. В этих исследованиях проводился акустический анализ голоса при сахарном диабете 1 и 2 типа, бронхиальной астме, хронической обструктивной болезни легких, пневмонии. В метаанализе проводилась оценка изменений частоты основного тона (Jitter) и амплитуды сигнала голоса (Shimmer) у пациентов с ХНИЗ в сравнении со здоровыми добровольцами.
Результаты. В метаанализ на основе Jitter и Shimmer включены 203 пациента с ХНИЗ и 132 здоровых добровольца. Jitter у пациентов с ХНИЗ оказался статистически значимо бóльшим, по сравнению с пациентами без заболеваний (стандартизованная разность средних 2,23, 0,83-3,62, I2=97,03%, р=0,002). Shimmer у пациентов с исследуемыми заболеваниями также оказался статистически значимо бóльшим по сравнению с пациентами без заболеваний (стандартизованная разность средних 0,81, 0,11-1,52, I2=91,06%, р=0,024).
Заключение. Текущий систематический обзор и метаанализ продемонстрировали возможность применения акустического анализа голоса в диагностике ХНИЗ.
Для цитирования:
Гаранин А.А., Айдумова О.Ю., Рубаненко А.О., Хуморова А.Р., Колсанов А.В. Возможности акустического анализа голоса в диагностике хронических неинфекционных заболеваний: систематический обзор и метаанализ. Кардиоваскулярная терапия и профилактика. 2025;24(7):4407. https://doi.org/10.15829/1728-8800-20254407. EDN: QEOUOE
For citation:
Garanin A.A., Aidumova O.Yu., Rubanenko A.O., Khumorova A.R., Kolsanov A.V. Potential of acoustic voice analysis in diagnostics of noncommunicable diseases: a systematic review and meta-analysis. Cardiovascular Therapy and Prevention. 2025;24(7):4407. (In Russ.) https://doi.org/10.15829/1728-8800-20254407. EDN: QEOUOE
Введение
Изучение механизмов голосообразования берет свое начало с середины XIXв, когда стало возможным проведение физиологических и акустических методов исследования. Одной из основных теорий образования голоса считается миоэластическая теория фонации, которая впервые была представлена Ferrein в 1741г. Согласно данной теории, голосовые связки пассивно движутся под влиянием проходящего между сомкнутыми краями потока воздуха. Частота колебания голосовых связок определяется их эластическими свойствами. По Ferrein, ключевыми факторами голосообразования являются создающий давление под голосовыми связками поток воздуха и напряжение мышц гортани. При этом воздушный поток через дыхательные мышцы контролируется со стороны центральной нервной системы для создания определенного напряжения мышц гортани и эффекта резонанса в полостях выше и ниже голосовой щели для создания того или иного звука. Еще одной теорией голосообразования является нейрохронаксическая теория Husson (1950). Согласно этой теории, голосовые связки колеблются не пассивно, а активно сокращаются и расслабляются под влиянием нервной регуляции по нижнегортанному нерву. Активность голосовых связок была установлена авторами эмпирически. В эксперименте оказалось, что частота нервных импульсов, идущих к гортанной мышце по возвратному нерву, совпадает с частотой колебания голосовых связок. Теория Husson вызвала много споров, но до сих пор в научном обществе существуют обе эти теории [1].
Сложность механизма голосообразования, включающего влияние работы центральной нервной системы, периферического голосового аппарата, дыхательных мышц и необходимого потока воздуха для нормального голосообразования, открывает большие перспективы в диагностике множества разнородных, но схожих по механизмам влияния на процесс голосообразования, заболеваний. При помощи акустического анализа голоса возможны диагностика и контроль за ведением пациентов с нейродегенеративными заболеваниями, такими как болезнь Паркинсона или болезнь Альцгеймера [2-4]. Также акустические параметры голоса изменяются при заболеваниях с нарушением непрерывности потока воздуха над голосовыми связками — сердечная недостаточность, хроническая обструктивная болезнь легких (ХОБЛ), бронхиальная астма и др. [5-7]. Еще одной группой заболеваний, влияющих на акустические параметры голоса, являются заболевания, связанные непосредственно с изменением морфологии голосовых связок (ушиб гортани, новообразования гортани и т.д.) [8][9].
Основными параметрами, определяемыми при акустическом анализе голоса, являются частота основного тона вибрации, частотный диапазон, соотношение сигнал/шум (HNR — harmonic-to-noise ratio), Jitter и Shimmer. Частота основного тона представляет собой число периодов (вибрационных циклов голосовых связок) в секунду и измеряется в герцах. Частотный диапазон — это разница между максимальной и минимальной частотами основного тона. HNR рассчитывается как отношение периодических волн к апериодическим (случайным, определяемым как шум). Jitter — это мера частотной вариабельности к частоте основного тона, отражает отклонение следующих друг за другом голосовых циклов по частоте. Shimmer — показатель вариабельности амплитуды голосовых нот, отражает отклонение по интенсивности смежных голосовых циклов [10].
В последние годы количество публикаций, посвященных изучению голосовых биомаркеров неуклонно возрастает, однако возможность и целесообразность их использования в диагностике хронических неинфекционных заболеваний (ХНИЗ) остаются недостаточно изученными.
Цель исследования — определение возможностей использования параметров акустического анализа голоса в диагностике ХНИЗ.
Материал и методы
Поиск информации проводился согласно требованиям и положениям PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) [11] в поисковых системах PubMed, Google Scholar, Clinical Trials, Киберленинка и eLibrary. Выбор исследований проходил при использовании поисковых запросов, ключевых слов и логических операторов. В обзор включались исследования, опубликованные в период с 2015 по 2025гг. В данный систематический обзор не включены доклады конференций, диссертации, описания клинических случаев, книги, метаанализы, систематические обзоры, нарративные и описательные обзоры, письма читателям, рекомендации, исследования на животных. В качестве основного языка литературы были выбраны английский и русский языки. При поиске литературы использовались следующие ключевые слова: "акустический анализ голоса" ("acoustic voice analysis"), "акустический анализ речи" ("acoustic speech analysis"), "заболевания" ("diseases"). Поиск источников проводился двумя независимыми исследователями, достигшими консенсуса.
Риск систематической ошибки. Оценку риска систематической ошибки индивидуальных исследований, включенных в систематический обзор, проводили с помощью опросника Robins-I tool для нерандомизированных исследований1. Общий риск систематической ошибки оценивали по 8 доменам: ошибка конфаундинга (Bias due to confounding, D1), ошибка отбора участников исследования (Bias due to selection of participants, D2), ошибка классификации воздействий (Bias classification of interventions, D3), ошибка, связанная с отклонением от намеченного вмешательства (Bias due to deviations from intended interventions, D4), ошибка пропуска данных (Bias due to missing data, D5), ошибка измерения результатов (Bias in measurement of outcomes, D6), ошибка представления результатов (Risk of bias in selection of the reported result, D7) и общая оценка (Overall risk of bias, D8).
Статистический анализ. Статистическая обработка данных выполнялась в программе MedCalc, версия 20.104 (MedCalc Software Ltd.). По модели случайных эффектов, с применением метода обратной дисперсии проведен метаанализ. Результаты метаанализа представлялись в виде логограммы. Оценка статистической гетерогенности выполнялась с использованием критерия согласия Пирсона χ2, а также индекса гетерогенности I2>40%, р<0,10. Метаанализ абсолютных значений показателя в исследуемой и контрольной группах выполнялся по данным о среднем арифметическом значении и стандартном отклонении с учетом числа исследуемых в сравниваемых группах. Оценивали возможность диагностики ХНИЗ с помощью голосовых биомаркеров, используя стандартизованную разность средних (Standardized Mean Difference, SMD) с 95% доверительным интервалом (ДИ).
Результаты
При литературном поиске по указанным ранее отдельным и комбинированным ключевым словам и базам данных получено суммарно 909 публикаций первичного поиска, из которых 277 публикации найдены в PubMed, 250 работ проанализировано в базе Google Scholar, 92 работы в Киберленинке, 282 публикации в базе данных eLibrary и 8 — в Clinical Trials. Из данного перечня работ было удалено 59 дублирующих публикаций и к дальнейшей оценке результатов поиска литературы допущено 850 работ.
Из полученного количества публикаций были исключены 362 работы, не отвечающих критериям отбора исследований, такие как постерные доклады, диссертации, систематические обзоры, метаанализы, описания клинических случаев и прочее. Из доступных анализу работ 488 исследования имели полнотекстовый вариант. При оценке текста статей из анализа были исключены 484 работы по причине отклонения от параметров дизайна исследования. В результате к окончательному анализу допущены 4 полнотекстовых исследования (рисунок 1). При анализе каждой публикации учитывались показатели количества пациентов в каждой группе, применение метода акустического анализа голоса, а также изучаемые параметры голоса испытуемых.
В исследовании, проведенном Gölaç H, et al., оценивались изменения параметров акустического анализа голоса у пациентов с сахарным диабетом (СД) 2 типа. В исследование включили 91 пациента (51 с сахарным СД 2 типа и 40 здоровых волонтеров). Оценивали по группам следующие параметры — частоту основного тона, Jitter и Shimmer (как абсолютные, так и локальные), а также HNR с использованием программного обеспечения Praat. Статистически значимые различия были выявлены только для абсолютных значений Jitter у пациентов с СД, по сравнению со здоровыми добровольцами [12]. Влияние СД на акустические параметры голоса также было исследовано Kara E, et al. Исследователи включили 64 пациента, из которых 32 пациента составили группу пациентов с СД 1 типа и 32 пациента — группу здоровых лиц. Оценивали также Jitter, Shimmer, а также основную частоту и HNR. При оценке параметров голоса по группам статистически значимых различий по Jitter и Shimmer у пациентов с СД, по сравнению со здоровыми добровольцами выявлено не было [13].
Saeed A, et al. исследовали изменения параметров акустического анализа голоса у пациентов с бронхолегочными заболеваниями. В исследование было включено 30 пациентов с бронхиальной астмой и 30 пациентов с ХОБЛ. Тяжесть заболевания оценивалась по данным спирометрии. Параметры акустического анализа голоса этих пациентов сравнивались с нормальными показателями. В группе с ХОБЛ субъективная оценка слухового восприятия голоса выявила нарушения голосообразования у 30% пациентов, в группе бронхиальной астмы — 16,7%. Отклонения же параметров акустического анализа голоса (HNR, Jitter, Shimmer) наблюдалось у 100% пациентов в обеих группах. При этом изменения голоса имели прямую корреляцию с тяжестью заболевания, а также приемом флутиказона пропионата (в группе пациентов с бронхиальной астмой) и ипратропия бромида (в группе пациентов с ХОБЛ) [14]. Особенностям изменения параметров акустического анализа голоса при бронхолегочных заболеваниях также посвящена работа Neili Z, et al.2 Учеными было исследовано 30 пациентов с пневмонией и 30 пациентов с ХОБЛ. Группу сравнения составили 30 здоровых добровольцев. Оценивали HNR, Shimmer и Jittter у пациентов с заболеваниями в сравнении со здоровыми людьми. Статистически значимые различия по сравнению со здоровыми людьми у пациентов как с ХОБЛ, так и с пневмонией были выявлены только по показателю интенсивности и абсолютному значению Jitter.
Результаты проведенного систематического обзора суммированы в таблице 1.
Учитывая, что по данным оцениваемых исследований наибольшее диагностическое значение среди параметров акустического анализа речи при ХНИЗ имели Jitter и Shimmer, нами было принято решение проводить метаанализ в отношении именно этих показателей.
Таким образом, в метаанализ при оценке возможности диагностики ХНИЗ на основе Jitter вошли 6 исследований, включающих пациентов с СД (1 и 2 типов), ХОБЛ, пневмонией и бронхиальной астмой. Общее количество пациентов составило 203 человека, здоровых добровольцев — 132 человека.
На рисунке 2 приведена воронкообразная диаграмма рассеяния значений исследуемого параметра при данных заболеваниях. Обращает на себя внимание отсутствие исследований с отрицательным результатом, а также значительный разброс размера эффектов для одного из включенных исследований относительно оси центральной тенденции. Таким образом, в данном случае риск публикационного смещения высокий.
Так, по результатам проведенного метаанализа у пациентов с ХНИЗ (СД, ХОБЛ, бронхиальная астма, пневмония) Jitter оказался статистически значимо бóльшим по сравнению с пациентами без заболеваний: SMD 2,23, 0,83-3,62, I2=97,03%, р=0,002) (рисунок 3).
Вышеуказанные исследования также вошли в проведенный метаанализ возможности диагностики ХНИЗ по Shimmer. Рисунок 4 отражает воронкообразную диаграмму рассеяния значений исследуемого параметра при данных заболеваниях. Обращает на себя внимание отсутствие исследований с отрицательным результатом, а также значительный разброс размера эффектов для двух включенных исследований относительно оси центральной тенденции. Таким образом, в данном случае риск публикационного смещения также высокий.
По результатам проведенного метаанализа у пациентов с ХНИЗ (СД, ХОБЛ, бронхиальная астма, пневмония) Shimmer оказался статистически значимо бóльшим, по сравнению с пациентами без заболеваний: SMD 0,81, 0,11-1,52, I2=91,06%, р=0,024). Данные представлены на рисунке 5.
Оценка рисков систематической ошибки. Результаты оценки риска систематической ошибки представлены на рисунках 6 и 7. Во всех исследованиях был определенный риск конфаундинга (D1), также во всех исследованиях отсутствовала информация о пропущенных значениях (D5). Таким образом, оценка включенных исследований показала, что все работы имеют средний риск систематических ошибок.
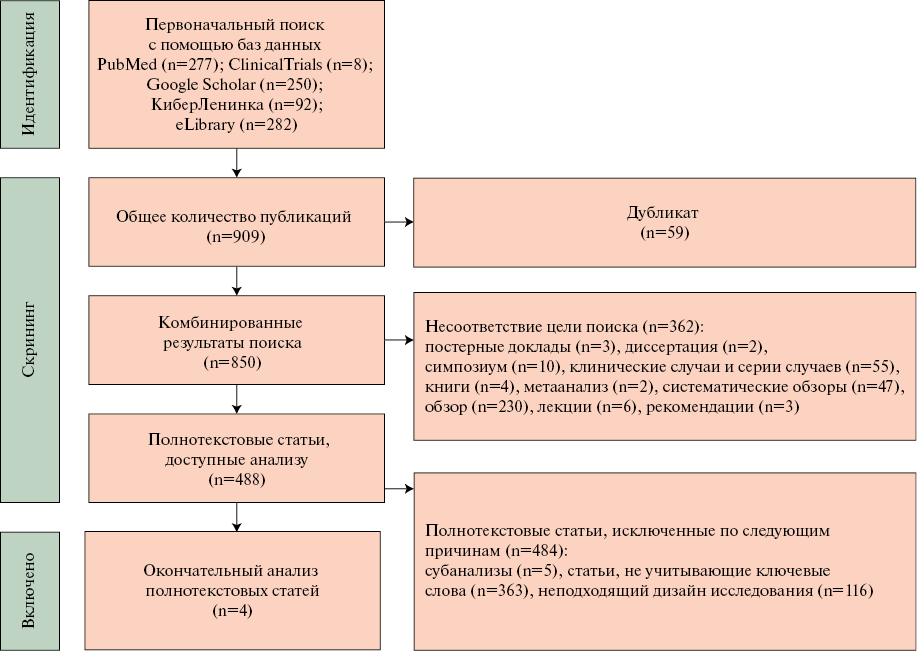
Рис. 1 Диаграмма PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) выбора исследований для проведения анализа.
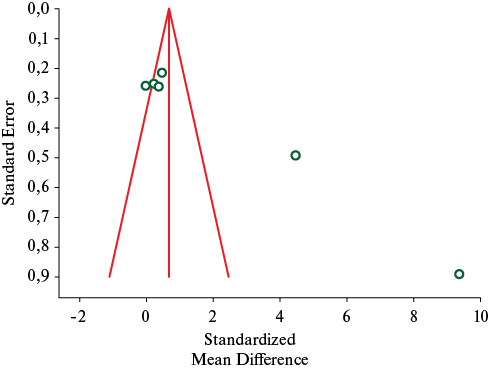
Рис. 2 Риск публикационного смещения оценки значения Jitter при исследуемых заболеваниях.
Таблица 1
Результаты систематического обзора литературных источников
|
Исследование |
Размер выборки (n) |
Группы сравнения (n) |
Группа вмешательства, Jitter |
Группа контроля, Jitter |
Группа вмешательства, Shimmer |
Группа контроля, Shimmer |
Краткое заключение |
|
Gölaç H, 2021 [12] |
91 |
СД (n=51) Здоровые добровольцы (n=40) |
1,1629±2,1818 |
0,3484±0,5152 |
5,9287±10,8098 |
3,2411±4,3829 |
Статистические значимые различия были выявлены только для абсолютных значений Jitter у пациентов с СД, по сравнению со здоровыми добровольцами |
|
Kara I, 2022 [13] |
64 |
СД (n=32) Здоровые добровольцы (n=32) |
0,3452±0,1358 |
0,3158±0,0947 |
1,6337±0,5479 |
1,5592±0,0947 |
Статистически значимых различий по Jitter и Shimmer у пациентов с СД, по сравнению со здоровыми добровольцами выявлено не было |
|
Neili Z, 20182 |
60 |
ХОБЛ (n=30) Здоровые добровольцы (n=30) |
3,16±2,21 |
3,15±1,46 |
19,39±6,91 |
18,21±7,76 |
Статистически значимые различия у пациентов с ХОБЛ, по сравнению со здоровыми людьми были выявлены только по показателю интенсивности и абсолютному значению Jitter |
|
Neili Z, 20182 |
60 |
Пневмония (n=30) Здоровые добровольцы (n=30) |
3,89±2,25 |
3,15±1,46 |
19,8±8,4 |
18,21±7,76 |
Статистически значимые различия у пациентов с пневмонией, по сравнению со здоровыми людьми были выявлены только по показателю интенсивности и абсолютному значению Jitter |
|
Saeed A, 2018 [14] |
60 |
Бронхиальная астма (n=30) Нормальные показатели |
0,97±0,13 |
0,34±0,15 |
0,95±0,12 |
0,52±0,26 |
Выявлены статистически значимые различия в Jitter и Shimmer у пациентов с бронхиальной астмой, по сравнению со здоровыми людьми |
|
Saeed A, 2018 [14] |
60 |
ХОБЛ (n=30) Нормальные показатели |
2,02±0,2 |
0,34±0,15 |
1,06±0,24 |
0,52±0,26 |
Выявлены статистически значимые различия в Jitter и Shimmer у пациентов с ХОБЛ, по сравнению со здоровыми людьми |
Примечание: СД — сахарный диабет, ХНИЗ — хронические неинфекционные заболевания, ХОБЛ — хроническая обструктивная болезнь легких, Jitter — изменения частоты основного тона, Shimmer — изменения амплитуды сигнала.
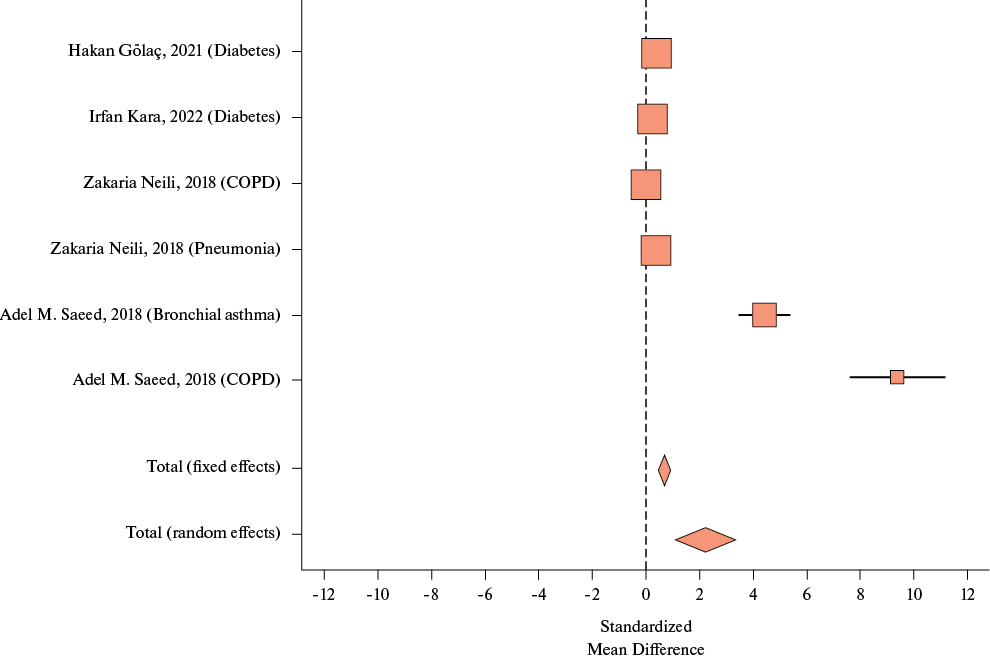
Рис. 3 Модель случайных эффектов при оценке величины Jitter при исследуемых заболеваниях.
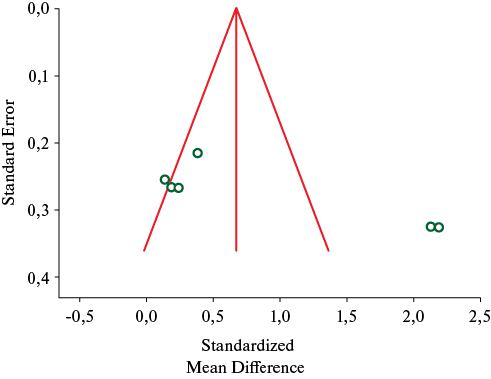
Рис. 4 Риск публикационного смещения оценки значения Shimmer при исследуемых заболеваниях.
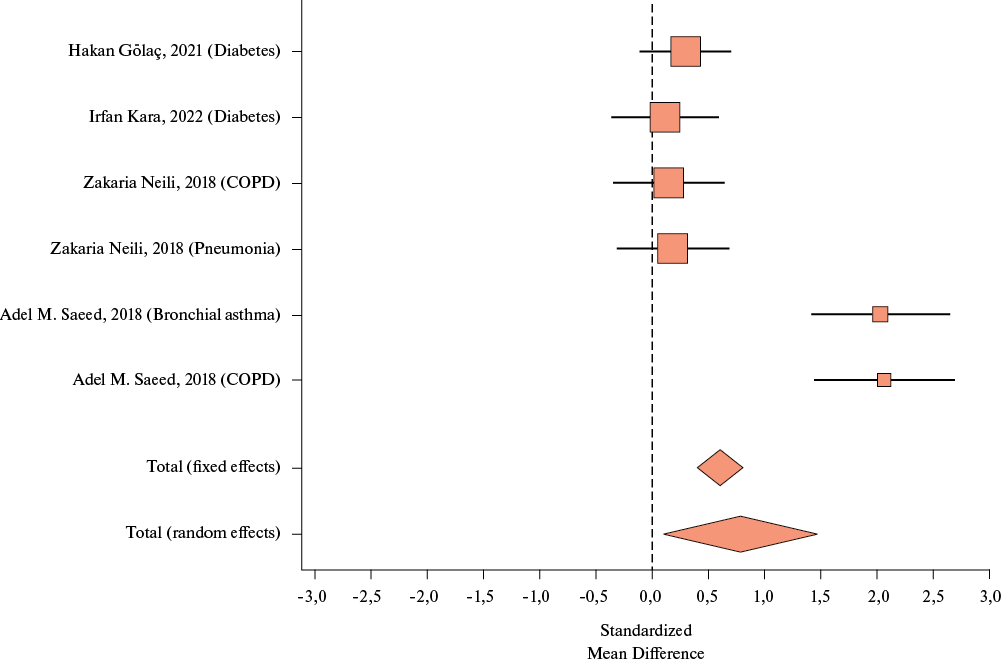
Рис. 5 Модель случайных эффектов при оценке величины Shimmer при исследуемых заболеваниях.

Рис. 6 Анализ риска систематической ошибки. Результат о каждом элементе риска систематической ошибки для каждого включенного исследования.
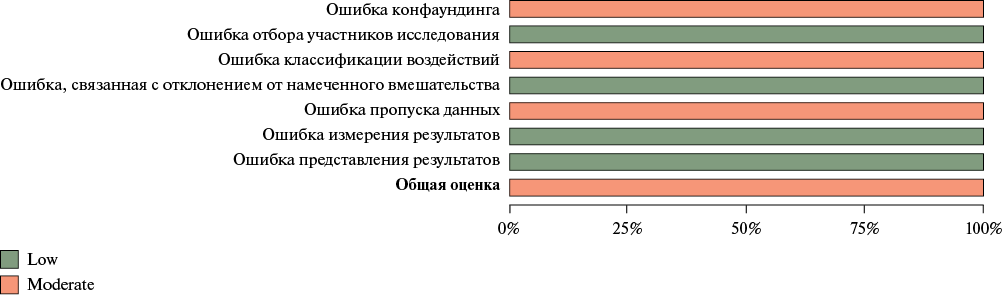
Рис. 7 Анализ рисков систематической ошибки включенных исследований. Представлены результаты о каждом элементе риска систематической ошибки по всем включенным исследованиям.
Обсуждение
В целом данный метаанализ продемонстрировал возможность использования таких показателей акустического анализа речи, как Jitter и Shimmer в диагностике ХНИЗ (СД 1 и 2 типов, ХОБЛ, пневмонии и бронхиальной астмы). В то же время, анализ источников литературы обнаружил противоречивые данные. Так, метаанализ оценки изменения акустических параметров речи у пациентов с СД по сравнению со здоровыми людьми, включивший 321 пациента с СД 2 типа и 171 здорового добровольца не выявил статистически значимых различий по группам по следующим показателям: Jitter, Shimmer, HNR, частота основного тона [15]. Возможно, причина данного противоречия заключается в устойчивости голосовых связок к неблагоприятному воздействию СД. Так, в своем исследовании Gölaç H. указывал, что изменение голосовых параметров характерно для пациентов со стажем СД 2 типа >10 лет [12]. Таким образом, данные о целесообразности проведения акустического анализа голоса для диагностики СД противоречивы. Необходимы дальнейшие исследования и анализ накопленных данных. Однако акустический анализ голоса может использоваться в оценке тяжести и длительности течения СД.
В настоящее время респираторные заболевания представляют собой серьёзную глобальную проблему, требующую эффективных методов диагностики для своевременного вмешательства. Целесообразность применения акустического анализа голоса не вызывает сомнений для диагностики заболеваний бронхолегочной системы, что еще раз подтверждают данные настоящего метаанализа. Также возможно использования метода в диагностике COVID-19 (COrona VIrus Disease 2019) [16]. При этом большое значение имеет возможность дистанционного бесконтактного проведения обследования.
Применение акустического анализа голоса при других бронхолегочных заболеваниях является также обоснованным по данным литературы. По сообщениям различных исследователей цифровые биомаркеры, основанные на акустических сигналах голоса, на сегодняшний день стали ценными индикаторами функционирования дыхательной системы. Последние достижения в области алгоритмов машинного обучения открывают многообещающие перспективы для выявления и диагностики респираторных заболеваний с помощью анализа и обработки таких биомаркеров на основе аудиосигнала. В постоянно растущем числе исследований используются методы машинного обучения для извлечения значимой информации из аудиобиомаркеров [17]. Отмечается, что на тенденции в исследованиях повлияла пандемия: наблюдается всплеск исследований в области диагностики COVID-19, сбора данных с мобильных устройств и систем удалённой диагностики.
Заключение
Текущий систематический обзор и метаанализ продемонстрировали возможность использования акустического анализа голоса в диагностике ХНИЗ. Однако при оценке полученных данных необходимо также учитывать тяжесть заболевания и его длительность. Возможная ниша применения акустического анализа голоса в большей степени находится в области контроля течения заболевания, динамике состояния пациента, чем в первичной диагностике. Безусловным преимуществом данной методики является возможность дистанционной диагностики, что особенной актуально в период постпандемии при проведении телемедицинских консультаций и телемониторинга. Полагаем, что увеличение числа рандомизированных контролируемых исследований, посвященных акустическому анализу голоса при различных хронических заболеваниях, поможет определить область возможного применения данного метода.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 ROBINS-I tool (Risk of Bias In Non-randomized Studies) https://www.riskofbias.info/welcome/home (03.05.2025).
2 Neili Z, Fezari M, Abdeghani R. Analysis of Acoustic Parameters from Respiratory Signal in COPD and Pneumonia patients. 2018 International Conference on Signal, Image, Vision and their Applications (SIVA). 2018;1-4. doi:10.1109/SIVA.2018.8661111.
Список литературы
1. Ермакова И. И. Коррекция речи и голоса у детей и подростков. 2-е изд.: М.: Просвещение: АО "Учебная литература", 1996. 143 с.
2. Ngo QC, Motin MA, Pah ND, et al. Computerized analysis of speech and voice for Parkinson's disease: A systematic review. Comput Methods Programs Biomed. 2022;226:107133. doi:10.1016/j.cmpb.2022.107133.
3. Saeedi S, Hetjens S, Grimm MOW, et al. Acoustic Speech Analysis in Alzheimer's Disease: A Systematic Review and Meta-Analysis. J Prev Alzheimers Dis. 2024;11(6):1789-97. doi:10.14283/jpad.2024.132.
4. Chiaramonte R, Bonfiglio M. Acoustic analysis of voice in bulbar amyotrophic lateral sclerosis: a systematic review and metaanalysis of studies. Logoped Phoniatr Vocol. 2020;45(4):151-63. do i:10.1080/14015439.2019.1687748.
5. Amir O, Abraham WT, Azzam ZS, et al. Remote Speech Analysis in the Evaluation of Hospitalized Patients With Acute Decompensated Heart Failure. JACC: HEART FAILURE. 2022;10(1):41-9. doi:10.1016/j.jchf.2021.08.008.
6. Bringel KA, Leone DCMG, João Vitor L, et al. Voice Analysis and Neural Networks as a Clinical Decision Support System for Patients With Lung Diseases. Mayo Clin Proc Digital Health. 2024;2(3):36774. doi:10.1016/j.mcpdig.2024.06.006.
7. Saghiri MA, Vakhnovetsky J, Amanabi M, et al. Exploring the impact of type II diabetes mellitus on voice quality. Eur Arch Oto-RhinoLaryngol. 2024;281:2707-16. doi:10.1007/s00405-024-08485-4.
8. Ocal B, Tatar EC, Topta G, et al. Evaluation of Voice Quality in Patients With Vocal Fold Polyps: The Size of a Polyp Matters or Does it? J Voice. 2020;34(2):294-9. doi:10.1016/j.jvoice.2019.04.009.
9. Ho GY, Leonhard M, Denk-Linnert DM, et al. Pre- and intraoperative acoustic and functional assessment of the novel APrevent®
10. VOIS implant during routine medialization thyroplasty. Eur Arch Oto-Rhino-Laryngol. 2020;277:809-17. doi:10.1007/s00405-01905756-3.
11. Богомильский М. Р., Радциг Е. Ю., Дегтярева Д. В. Особенности акустического анализа голоса у детей. Вестник РГМУ. 2013;3(11):48-51.
12. Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate healthcare interventions: explanation and elaboration. BMJ. 2009;339:b2700. doi:10.1136/bmj.b2700.
13. Gölaç H, Atalik G, Türkcan AK, et al. Disease related changes in vocal parameters of patients with type 2 diabetes mellitus. Logoped Phoniatr Vocol. 2022;47(3):202-8. doi:10.1080/14015439.2021.1917653.
14. Kara I, Temiz F, Doganer A, et al. The efect of type 1 diabetes mellitus on voice in pediatric patients. Eur Arch Oto-RhinoLaryngol. 2023;280:269-75. doi:10.1007/s00405-022-07543-z.
15. Saeed AM, Riad NM, Osman NM, et al. Study of voice disorders in patients with bronchial asthma and chronic obstructive pulmonary disease. Egypt J Bronchol. 2018;12:20-6. doi:10.4103/ejb.ejb_34_17.
16. Hamdan AL, Daou CAZ, Hosri J, et al. Effect of Diabetes Mellitus Type 2 on Voice: A Systematic Review and Meta-Analysis. Folia Phoniatr Logop. 2024;76(3):219-231. doi:10.1159/000534271.
17. González CE, Batalla FN, Iglesias PM, et al. Dysphonia and other voice alterations associated with COVID-19: Systematic review. Acta Otorrinolaringol Esp (Engl Ed). 2024;75(4):252-9. doi:10.1016/j.otoeng.2024.02.005.
18. Kapetanidis P, Kalioras F, Tsakonas C, et al. Respiratory Diseases Diagnosis Using Audio Analysis and Artificial Intelligence: A Systematic Review. Sensors (Basel). 2024;24(4):1173. doi:10.3390/s24041173.
Об авторах
А. А. ГаранинРоссия
Андрей Александрович Гаранин — к.м.н., директор научно-практического центра дистанционной медицины.
Самара
О. Ю. Айдумова
Россия
Олеся Юрьевна Айдумова — к.м.н., доцент кафедры пропедевтической терапии с курсом кардиологии.
Самара
А. О. Рубаненко
Россия
Анатолий Олегович Рубаненко — к.м.н., доцент, доцент кафедры пропедевтической терапии с курсом кардиологии.
Самара
А. Р. Хуморова
Россия
Алия Руслановна Хуморова — врач по медицинской профилактике научно-практического центра дистанционной медицины.
Самара
А. В. Колсанов
Россия
Александр Владимирович Колсанов — д.м.н., профессор РАН, ректор, зав. кафедрой оперативной хирургии и топографической анатомии.
Самара
Дополнительные файлы
Что известно о предмете исследования?
- Акустические параметры голоса изменяются при хронических неинфекционных заболеваниях.
- Имеющиеся литературные данные по данной проблеме немногочисленны и противоречивы.
Что добавляют результаты исследования?
- По данным проведенного метаанализа у пациентов с хроническими неинфекционными заболеваниями изменения частоты основного тона (Jitter) и изменения амплитуды сигнала (Shimmer) оказались статистически значимо бóльшими, по сравнению с пациентами без заболеваний.
Рецензия
Для цитирования:
Гаранин А.А., Айдумова О.Ю., Рубаненко А.О., Хуморова А.Р., Колсанов А.В. Возможности акустического анализа голоса в диагностике хронических неинфекционных заболеваний: систематический обзор и метаанализ. Кардиоваскулярная терапия и профилактика. 2025;24(7):4407. https://doi.org/10.15829/1728-8800-20254407. EDN: QEOUOE
For citation:
Garanin A.A., Aidumova O.Yu., Rubanenko A.O., Khumorova A.R., Kolsanov A.V. Potential of acoustic voice analysis in diagnostics of noncommunicable diseases: a systematic review and meta-analysis. Cardiovascular Therapy and Prevention. 2025;24(7):4407. (In Russ.) https://doi.org/10.15829/1728-8800-20254407. EDN: QEOUOE
JATS XML

























































