Перейти к:
Роль "новых" индексов системного воспаления в развитии рецидива фибрилляции предсердий после криобаллонной изоляции устьев легочных вен
https://doi.org/10.15829/1728-8800-2025-4417
EDN: BIRNEH
Аннотация
Цель. Оценка прогностической роли уровня "новых" биомаркеров системного воспаления в прогнозировании рецидива фибрилляции предсердий (ФП) после первичной процедуры криобаллонной изоляции легочных вен (ЛВ).
Материал и методы. В исследование включены 239 человек, средний возраст 61 год, которым проводилась первичная процедура криобаллонной изоляции ЛВ. Средний период наблюдения составил 20 мес. Первичная конечная точка — развитие рецидива ФП в отдалённом периоде. Были изучены исходные уровни маркеров системного воспаления.
Результаты. Оставались под наблюдением >1 года 167 пациентов, что составило 70% от первоначального количества отобранных пациентов. Из них первичная конечная точка обнаруживалась у 63 пациентов, без рецидива оставались 104 пациента. Между группами с рецидивом аритмии и без рецидива наблюдались статистически значимые различия по уровням изучаемых маркеров SIRI (Systemic Inflammation Response Index, индекс системного воспалительного ответа), SII (Systemic Inflammation Index, индекс системного воспаления), NLR (Neutrophils Lymphocytes Ratio, нейтрофилолимфоцитарное отношение): для SIRI — 0,91 (0,67; 1,1) vs 0,76 (0,55; 1,05), p=0,018; для SII — 410,5 (309,6; 565,1) vs 350,95 (257,1; 462,8), p=0,008; для NLR — 1,8 (1,5; 2,5) vs 1,6 (1,3; 2), p=0,002. По данным ROC-анализа были получены пороговые значения маркеров, ассоциированные с развитием рецидива ФП: SIRI >0,841, SII >365,83, NLR >1,6. В многофакторной регрессионной модели Кокса SII и NLR оставались значимыми предикторами рецидива.
Заключение. Индексы SIRI, SII и NLR обладают предикторной значимостью для рецидива фибрилляции ФП после интервенционного лечения и могут быть использованы для повышения эффективности криоаблации ЛВ.
Ключевые слова
Для цитирования:
Басиева М.А., Шварц В.А., Сокольская М.А., Донаканян С.А., Филатов А.Г., Аванесян Г.А., Испирян А.Ю. Роль "новых" индексов системного воспаления в развитии рецидива фибрилляции предсердий после криобаллонной изоляции устьев легочных вен. Кардиоваскулярная терапия и профилактика. 2025;24(7):4417. https://doi.org/10.15829/1728-8800-2025-4417. EDN: BIRNEH
For citation:
Basieva M.A., Shvarts V.A., Sokolskaya M.A., Donakanyan S.A., Filatov A.G., Avanesyan G.A., Ispiryan A.Yu. Role of novel indices of systemic inflammation in atrial fibrillation recurrence after cryoballoon pulmonary vein isolation. Cardiovascular Therapy and Prevention. 2025;24(7):4417. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4417. EDN: BIRNEH
Введение
Фибрилляция предсердий (ФП) — самый распространённый вид нарушения сердечного ритма, характеризующийся высокой частотой возникновения серьёзных осложнений, таких как тромбоэмболия сосудов головного мозга и сердечная недостаточность, что влечет за собой увеличение инвалидизации и смертности населения [1][2]. Хотя этиология и патогенез ФП включают в себя множество факторов, результаты многочисленных исследований демонстрируют важную роль хронического воспалительного процесса в возникновении и прогрессировании ФП [3][4].
Субстрат ФП является поликомпонентным и сложным, включая в себя воспалительную реакцию, приводящую к изменениям предсердной ткани, таким как фиброз, лейкоцитарная инфильтрация и окислительное повреждение, которые, в свою очередь, способствуют электрическому и структурному ремоделированию миокарда [5-7]. В то же время длительные эпизоды ФП могут способствовать прогрессированию фиброза предсердий, таким образом, создавая порочный круг, получивший название предсердная аритмогенная кардиомиопатия [8].
Неоднократно авторы исследований выявляли более высокие значения маркеров воспаления, таких как С-реактивный белок, определенный высокочувствительным методом, интерлейкин-6, интерлейкин-8, фактор некроза опухоли др., у пациентов с ФП по сравнению с пациентами с синусовым ритмом [9][10]. Однако рутинное определение уровня вышеописанных цитокинов в условиях реальной клинической практики затруднено.
В последнее время в научной литературе всё чаще встречаются результаты исследований, которые привлекли внимание к различным показателям воспаления в периферической крови, таким как индекс системного воспаления (SII — Systemic Inflammation Index), индекс системного воспалительного ответа (SIRI — Systemic Inflammation Response Index), совокупный индекс системного воспаления (AISI — Aggregate Inflammation Systemic Index), нейтрофило-лимфоцитарное отношение (NLR — Neutrophils Lymphocytes Ratio), тромбоцито-лимфоцитарное отношение (PLR — Platelets Lymphocytes Ratio) и моноцито-лимфоцитарное отношение (MLR — Monocytes Lymphocytes Ratio). Прогностическая ценность данных маркеров изучается как в отношении сердечно-сосудистых, так и некардиальных заболеваний [11-13]. Их преимущество заключается в отсутствии необходимости использования сложных лабораторных реактивов, доступности и простоте определения без дополнительных финансовых затрат.
Одной из основных целей лечения ФП является поддержание синусового ритма и уменьшение клинических проявлений аритмии. Криобаллонная изоляция легочных вен (ЛВ) — это интервенционный метод лечения пациентов с симптомной и резистентной к антиаритмической терапии ФП, заключающийся в создании циркулярного трансмурального повреждения миокарда левого предсердия (ЛП) низкими температурами [14-16].
Прогностическая роль "новых" маркеров воспаления при криоаблации была оценена на настоящий момент пока в единственном исследовании [17]. Kaplan E, et al. продемонстрировали роль SII в развитии рецидива ФП после первичной криоизоляции ЛВ. Для уточнения роли данных биомаркеров в прогнозировании рецидива ФП, необходимы дальнейшие исследования.
Цель исследования — оценить прогностическую роль уровня "новых" биомаркеров системного воспаления в прогнозировании рецидива ФП после первичной процедуры криобаллонной изоляции ЛВ.
Материал и методы
Дизайн исследования. Исследуемая когорта
Данное когортное исследование имело ретроспективный характер с проспективной оценкой исходов. Из медицинской информационной системы "MedWork" были отобраны и проанализированы все данные историй болезни пациентов с диагнозом ФП, которым в период с 2021 по 2023гг была выполнена первичная криобаллонная изоляция ЛВ.
В исследование были включены пациенты в возрасте от 40 до 80 лет, получившие интервенционное лечение ФП с использованием данной методики, проведенной в соответствии со стандартами. Включение только пациентов после криоаблации было выбрано с целью создания наиболее гомогенной группы пациентов для большей чистоты исследования, т.к. методика проведения данной процедуры отличается от методики радиочастотной аблации. От каждого пациента перед операцией получено письменное информированное добровольное согласие на проведение оперативных вмешательств и участие в научно-исследовательских работах учреждения.
Критериями невключения в исследование были следующие состояния/заболевания: сопутствующая патология сердечно-сосудистой системы, требующая хирургического лечения, любая онкология в анамнезе, аутоиммунные заболевания, хронические заболевания печени, прием глюкокортикостероидов в течение последнего месяца, предшествующие "открытые" операции на сердце, предшествующие любые операции в течение последнего года, умеренная или тяжелая почечная недостаточность (скорость клубочковой фильтрации <45 мл/мин/1,73 м2, инфекционный эндокардит в анамнезе.
Первичной конечной точкой исследования являлось возникновение рецидива ФП в отдаленном послеоперационном периоде. Оценка отдаленных результатов осуществлялась не ранее 12 мес. со дня проведения операции. Первые 3 мес. после криоаблации считались "слепым" периодом: развитие каких-либо нарушений ритма сердца в этот период не учитывалось. Наличие/отсутствие изучаемого исхода в течение последующего наблюдения оценивалось с помощью телефонного обзвона, опроса, сбора информации о регистрации электрокардиограммы (ЭКГ) (скорая помощь, стационарные записи), суточного мониторирования ЭКГ по Холтеру, сбора информации о госпитализации и т.д.
Определения
Изучаемые индексы системного воспаления были рассчитаны по следующим формулам:
- SIRI = количество нейтрофилов × количество моноцитов ÷ количество лимфоцитов;
- SII = количество нейтрофилов × количество тромбоцитов ÷ количество лимфоцитов;
- AISI = количество нейтрофилов × количество моноцитов × количество тромбоцитов ÷ количество лимфоцитов;
- NLR = количество нейтрофилов ÷ количество лимфоцитов;
- PLR = количество тромбоцитов ÷ количество лимфоцитов;
- MLR = количество моноцитов ÷ количество лимфоцитов.
Статистический анализ
Статистический анализ проводился с помощью программ STATISTICA® Statsoft (США) и MedCalc (MedCalc Software Ltd., Бельгия). Количественные параметры представлены в виде медианы (Me) и интерквартильного размаха (Q25; Q75), поскольку распределение данных не описывалось законом нормального распределения (оценено критерием Шапиро-Уилка). Категориальные параметры представлены в виде абсолютного числа (n) и доли в изучаемой когорте (%).
Для сравнения двух независимых выборок использовали U-критерий Манна-Уитни для количественных переменных и критерий χ2 Пирсона для категориальных переменных. ROC-анализ был использован для определения пороговых значений изучаемых маркеров воспаления, ассоциированных с рецидивом ФП. Кроме того, для сравнения частоты изучаемых событий с течением времени использовали Logrank test с построением кривых выживаемости Каплана-Мейера. Для оценки влияния различных факторов на вероятность возникновения рецидива ФП в течение отдаленного периода использовали регрессионную модель Кокса. Различия между группами считались статистически значимыми при р<0,05.
Результаты
Всего в исследование было включено 239 человек, средний возраст 61 (54; 67) лет, из них 126 (53%) мужчин. Период наблюдения составил 20 (17; 24) мес. Под наблюдением в отдаленном периоде оставалось 167 пациентов, что составило 70% от первоначального количества отобранных пациентов. Из них первичная конечная точка (рецидив аритмии) обнаруживалась у 63 пациентов, без рецидива оставались 104 пациента.
Результаты сравнения этих двух групп пациентов по клиническим, лабораторным, инструментальным, операционным данным и медикаментозной терапии представлены в таблице 1.
По исходным параметрам группы статистически значимо различались частоте выявления атеросклероза коронарных артерий (КА) и по длительности существования ФП: 20 vs 7% (p=0,008), и 60 (48; 84) vs 36 (12; 84) мес. (p<0,001), соответственно. В то же время группы не различались по долям форм ФП: пароксизмальная и персистирующая формы ФП не имели отличий по частоте выявления между группами.
По лабораторным данным имелись значимые различия по уровню SIRI (p=0,018), SII (p=0,008) и NLR (p=0,002). У пациентов с рецидивом аритмии эти параметры были значимо выше, чем в группе без рецидива. Статистически значимых различий по индексам полостей сердца, фракции выброса (ФВ) левого желудочка (ЛЖ) обнаружено не было, кроме параметра — индекса объема ЛП: он был выше в группе с рецидивом: 61 (54; 69) vs 56 (45; 64) мл (p=0,021).
Анализ медикаментозной терапии в послеоперационном периоде значимых различий между группами не выявил, за исключением приема антиаритмических препаратов 3 класса: 63% пациентов в группе рецидива ФП vs 46% пациентов в группе без рецидива (p=0,034) (таблица 2).
На рисунке 1 представлены результаты ROC-анализа, где были определены пороговые значения "новых" маркеров воспаления SIRI, SII и NLR, ассоциированные с развитием рецидива ФП в послеоперационном периоде.
В соответствии с полученными пороговыми значениями этих маркеров мы разделили пациентов на две группы (выше и ниже порога повышенного риска) и сравнили кривые выживаемости Каплана-Майера по частоте развития первичной конечной точки (рисунок 2).
В таблицах 3.1 — 3.3 представлены регрессионные модели Кокса, учитывающие все значимые предикторы риска рецидива ФП, полученные нами выше. В каждой из них поочередно использовали разные маркеры воспаления: SIRI (таблица 3.1), SII (таблица 3.2), NLR (таблица 3.3).
Таблица 1
Сравнительная исходная клиническая характеристика пациентов с рецидивом ФП и без рецидива
|
Показатель |
Значение у пациентов с рецидивом ФП (n=63) |
Значение у пациентов без рецидива ФП (n=104) |
p |
|
Клинические данные |
|||
|
Возраст, лет, Me (Q25; Q75) |
63 (56; 67) |
59,5 (53,5; 66,5) |
0,139 |
|
Мужчины, n (%) |
27 (43) |
60 (58) |
0,064 |
|
BSA, м2, Me (Q25; Q75) |
2 (1,7; 2,2) |
2,1 (1,96; 2,23) |
0,056 |
|
ИМТ, кг/м2, Me (Q25; Q75) |
28,4 (26,2; 31,6) |
29,9 (27,2; 32,5) |
0,109 |
|
Длительность ФП, мес., Me (Q25; Q75) |
60 (48; 84) |
36 (12; 84) |
<0,001* |
|
CHA2DS2VASc, баллы, Me (Q25; Q75) |
2 (1; 3) |
2 (1; 3) |
0,450 |
|
HAS-BLED, баллы, Me (Q25; Q75) |
1 (1; 2) |
1 (0; 2) |
0,401 |
|
Сахарный диабет, n (%) |
10 (16) |
10 (10) |
0,229 |
|
Атеросклероз КА, n (%) |
13 (20) |
7 (7) |
0,008* |
|
ХОБЛ, n (%) |
3 (5) |
1 (1) |
0,122 |
|
АГ, n (%) |
49 (78) |
77 (74) |
0,588 |
|
ОНМК, n (%) |
1 (1,8) |
4 (4) |
0,411 |
|
Курение, n (%) |
12 (19) |
18 (17) |
0,779 |
|
Лабораторные данные |
|||
|
Гемоглобин, г/л, Me (Q25; Q75) |
135 (128; 148) |
140 (127; 150,4) |
0,350 |
|
Гематокрит, %, Me (Q25; Q75) |
41,4 (39; 44,4) |
432 (40,3; 46) |
0,146 |
|
SIRI, Me (Q25; Q75) |
0,91 (0,67; 1,1) |
0,76 (0,55; 1,05) |
0,018* |
|
SII, Me (Q25; Q75) |
410,5 (309,6; 565,1) |
350,95 (257,1; 462,8) |
0,008* |
|
AISI, Me (Q25; Q75) |
193,1 (139,8; 285,8) |
166,9 (116,5; 241,9) |
0,061 |
|
NLR, Me (Q25; Q75) |
1,8 (1,5; 2,5) |
1,6 (1,3; 2) |
0,002* |
|
PLR, Me (Q25; Q75) |
111,9 (83,7; 130) |
107,5 (86,1; 132) |
0,805 |
|
MLR, Me (Q25; Q75) |
0,22 (0,17; 0,27) |
0,2 (0,2; 0,3) |
0,737 |
|
Креатинин, мкмоль/л, Me (Q25; Q75) |
76,2 (68,4; 94,7) |
78,4 (69; 90,7) |
0,881 |
|
Глюкоза, ммоль/л, Me (Q25; Q75) |
5,1 (5; 5,9) |
5,2 (4,7; 5,7) |
0,349 |
|
АСТ, Ед/л, Me (Q25; Q75) |
21 (16; 25) |
19 (16; 23) |
0,390 |
|
АЛТ, Ед/л, Me (Q25; Q75) |
20 (15; 28) |
22 (15,5; 27) |
0,702 |
|
Калий, ммоль/л, Me (Q25; Q75) |
4,3 (4; 4,5) |
4,4 (4,1; 4,7) |
0,241 |
|
Натрий, ммоль/л, Me (Q25; Q75) |
140 (139; 142) |
141 (139; 142) |
0,535 |
|
Инструментальные данные |
|||
|
ФВ ЛЖ, %, Me (Q25; Q75) |
60 (56; 53,7) |
61,7 (58; 65,1) |
0,092 |
|
иКСО, мл, Me (Q25; Q75) |
20 (17; 24) |
21 (17; 24) |
0,839 |
|
иКДО, мл, Me (Q25; Q75) |
52 (45; 60) |
54 (48; 61) |
0,137 |
|
иЛП, мл3, Me (Q25; Q75) |
61 (54; 69) |
56 (45; 64) |
0,021* |
Примечание: * — статистически значимая разница между группами (p<0,05). АГ — артериальная гипертензия, АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, иКСО — индексированный конечно-систолический объем левого желудочка, иКДО — индексированный конечно-диастолический объем левого желудочка, иЛП — индексированный объем левого предсердия, ИМТ — индекс массы тела, КА — коронарные артерии, Me (Q25; Q75) — медиана (интерквартильный интервал), ОНМК — острое нарушение мозгового кровообращения, ФВ ЛЖ — фракция выброса левого желудочка, ХОБЛ — хроническая обструктивная болезнь легких, AISI — совокупный индекс системного воспаления, BSA — площадь поверхности тела, MLR — моноцито-лимфоцитарное отношение, NLR — нейтрофило-лимфоцитарное отношение, PLR — тромбоцито-лимфоцитарное отношение, SII — индекс системного воспаления, SIRI — индекс системного воспалительного ответа, CHA2DS2VASc — C — застойная сердечная недостаточность (Congestive heart failure), H — артериальная гипертензия (Hypertension), A₂ — возраст ≥75 лет (Age ≥75 years), D — сахарный диабет (Diabetes mellitus), S₂ — инсульт/ТИА/тромбоэмболия в анамнезе (Stroke/TIA/thromboembolism), V — сосудистые заболевания (Vascular disease), A — возраст 65-74 года (Age 65-74 years), Sc — женский пол (Sex category — female), HAS-BLED — H — артериальная гипертензия (Hypertension), A — нарушение функции почек или печени (Abnormal renal/liver function), S — инсульт в анамнезе (Stroke), B — кровотечения в анамнезе или предрасположенность к кровотечениям (Bleeding history or predisposition), L — лабильное МНО (Labile INR), E — возраст >65 лет (Elderly), D — приём препаратов, повышающих риск кровотечения (Drugs or alcohol concomitantly) был выше у пациентов с рецидивом ФП.
Таблица 2
Медикаментозная терапия в послеоперационном периоде, n (%)
|
Группа препаратов |
Значение у пациентов с рецидивом ФП (n=63) |
Значение у пациентов без рецидива ФП (n=104) |
p |
|
ААП 1A |
0 (0) |
0 (0) |
– |
|
ААП 1B |
0 (0) |
0 (0) |
– |
|
ААП 1C |
22 (35) |
34 (33) |
0,771 |
|
ААП 2 |
20 (32) |
35 (34) |
0,808 |
|
ААП 3 |
40 (63) |
47 (46) |
0,034* |
|
ААП 4 |
1 (1) |
4 (4) |
0,415 |
|
НОАК |
55 (87) |
82 (79) |
0,175 |
|
Варфарин |
0 (0) |
4 (4) |
0,128 |
|
БМКК |
10 (16) |
24 (23) |
0,253 |
|
Диуретики |
21 (33) |
29 (28) |
0,469 |
|
АСК |
0 (0) |
0 (0) |
– |
|
Статины |
39 (62) |
48 (46) |
0,051 |
Примечание: * — статистически значимая разница между группами (p<0,05). ААП — антиаритмические препараты, АСК — ацетилсалициловая кислота, БМКК — блокаторы медленных кальциевых каналов, НОАК — непрямые оральные антикоагулянты, ФП — фибрилляция предсердий.
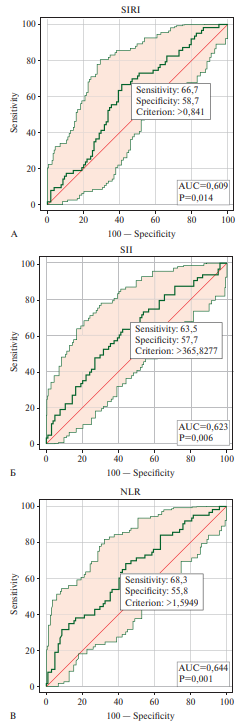
Рис. 1 ROC-кривые определения пороговых значений уровней "новых" маркеров воспаления: А) SIRI, Б) SII и В) NLR, ассоциированных с развитием рецидива ФП в послеоперационном периоде.
Примечание: ФП — фибрилляция предсердий, NLR — нейтрофило-лимфоцитарное соотношение, SII — индекс системного воспаления, SIRI — индекс системного воспалительного ответа.

Рис. 2 Сравнение кривых Каплана-Майера развития рецидива ФП после процедуры криоаблации ЛВ в группах: А) SIRI >0,841 vs SIRI <0,841, Б) SII >365,83 vs SII <365,83, В) NLR >1,6 vs NLR <1,6.
Примечание: ЛВ — легочные вены, ФП — фибрилляция предсердий, NLR — нейтрофило-лимфоцитарное соотношение, SII — индекс системного воспаления, SIRI — индекс системного воспалительного ответа.
Таблица 3.1
Клиническая характеристика регрессионной модели Кокса для оценки риска развития рецидива ФП у больных после аблации ЛВ (с учетом уровня SII (χ2=22,827; p=0,0004))
|
Показатель |
Коэффициент регрессии β |
Стандартная ошибка (SE) |
Критерий Вальда (Wald) |
p |
Hazard ratio (HR) |
95% ДИ |
|
Длительность ФП |
0,005 |
0,002 |
6,083 |
0,014* |
1,005 |
1,001-1,010 |
|
SII |
0,001 |
<0,001 |
5,931 |
0,015* |
1,001 |
1,000-1,002 |
|
Атеросклероз КА |
0,829 |
0,356 |
5,430 |
0,020* |
2,290 |
1,141-4,598 |
|
иЛП |
0,017 |
0,009 |
3,832 |
0,050 |
1,017 |
1,000-1,034 |
|
ААП 3 кл |
0,273 |
0,260 |
1,107 |
0,293 |
1,314 |
0,790-2,187 |
Примечание: * — статистически значимая разница между группами (p<0,05). ДИ — доверительный интервал, ААП 3 кл — антиаритмические препараты 3 класса, иЛП — индексированный объем левого предсердия, КА — коронарные артерии, ЛВ — легочные вены, ФП — фибрилляция предсердий, SII — индекс системного воспаления.
Таблица 3.2
Клиническая характеристика регрессионной модели Кокса для оценки риска развития рецидива ФП у больных после аблации ЛВ (с учетом уровня SIRI (χ2=19,788; p=0,0014))
|
Параметр |
Коэффициент регрессии β |
Стандартная ошибка (SE) |
Критерий Вальда (Wald) |
p |
Hazard ratio (HR) |
95% ДИ |
|
Длительность ФП |
0,005 |
0,002 |
5,550 |
0,019* |
1,005 |
1,001-1,009 |
|
Атеросклероз КА |
0,769 |
0,352 |
4,757 |
0,029* |
2,157 |
1,081-4,303 |
|
иЛП |
0,017 |
0,009 |
3,785 |
0,052 |
1,017 |
0,100-1,034 |
|
SIRI |
0,313 |
0,207 |
2,276 |
0,131 |
1,367 |
0,911-2,052 |
|
ААП 3 кл |
0,331 |
0,253 |
1,706 |
0,192 |
1,392 |
0,847-2,287 |
Примечание: * — статистически значимая разница между группами (p<0,05). ДИ — доверительный интервал, ААП 3 кл — антиаритмические препараты 3 класса, иЛП — индексированный объем левого предсердия, КА — коронарные артерии, ЛВ — легочные вены, ФП — фибрилляция предсердий, SIRI — индекс системного воспалительного ответа.
Таблица 3.3
Клиническая характеристика регрессионной модели Кокса для оценки риска развития рецидива ФП у больных после аблации ЛВ (с учетом уровня NLR (χ2=24,839; p=0,0001))
|
Параметр |
Коэффициент регрессии β |
Стандартная ошибка (SE) |
Критерий Вальда (Wald) |
p |
Hazard ratio (HR) |
95% ДИ |
|
NLR |
0,350 |
0,121 |
8,379 |
0,004* |
1,418 |
1,120-1,797 |
|
Длительность ФП |
0,006 |
0,002 |
6,412 |
0,011* |
1,006 |
1,001-1,010 |
|
Атеросклероз КА |
0,840 |
0,355 |
5,598 |
0,018* |
2,315 |
1,155-4,641 |
|
иЛП |
0,016 |
0,009 |
3,479 |
0,062 |
1,016 |
0,999-1,034 |
|
ААП 3 кл |
0,297 |
0,257 |
1,334 |
0,248 |
1,345 |
0,813-2,226 |
Примечание: * — статистически значимая разница между группами (p<0,05). ДИ — доверительный интервал, ААП 3 кл — антиаритмические препараты 3 класса, иЛП — индексированный объем левого предсердия, КА — коронарные артерии, ЛВ — легочные вены, ФП — фибрилляция предсердий, NLR — нейтрофило-лимфоцитарное соотношение.
Обсуждение
В возникновение и поддержание ФП вовлечено множество взаимодействующих механизмов, в т.ч. хроническое воспаление. Катетерная аблация в настоящее время является распространённым методом лечения пациентов с симптоматической ФП, для которых антиаритмическая терапия оказывается неэффективной. Однако, несмотря на постоянное совершенствование интервенционных технологий, у части оперированных пациентов по-прежнему наблюдается рецидив аритмии, что требует проведения повторных процедур аблации.
Роль системного воспаления в отношении ФП активно изучается в научной сфере уже многие годы, но тем не менее, остается актуальным вопросом современной кардиологии [18][19]. Кроме того, результаты исследований подтверждают идею о том, что воспаление способствует повышению риска рецидива аритмии после катетерной абляции [20]. Открытым остается вопрос, приводит ли наличие системного воспалительного статуса к ФП или ФП способствует инициации воспалительного процесса.
Период наблюдения после операции составил ≥12 мес. Пациенты были разделены на две группы: в первую вошли пациенты с рецидивом ФП после операции, во вторую — пациенты без рецидива аритмии. При сравнении двух групп были обнаружены статистически значимые различия по следующим показателям: частоте атеросклероза КА, длительности анамнеза аритмии, по уровням SII, SIRI, NLR, индексированному объему ЛП и приему антиаритмических препаратов 3 класса.
В группе пациентов с рецидивом ФП частота выявления атеросклероза КА была статистически значимо выше, это можно объяснить тем, что в развитии атеросклероза центральным звеном является воспалительная реакция, что и объясняет повышение вероятности развития рецидива аритмии. Также выявлена очевидная разница в длительности течения данного заболевания — пациенты, не удержавшие синусовый ритм после операции, имели более длительный анамнез ФП. Различия наблюдались и по индексированному объему ЛП по данным компьютерной томографии: показатель был выше у пациентов группы рецидива.
Что касается изучаемых нами биомаркеров системного воспаления, при сравнении двух групп пациентов выявлены статистически значимые различия по уровням SII, SIRI, NLR, исходные значения которых были выше у пациентов с рецидивом аритмии. Затем мы провели анализ и построили ROC-кривые для каждого из вышеперечисленных маркеров, определили пороговые значения, представленные в качестве предикторов развития рецидива ФП после криоаблации. Для SIRI полученное значение >0,841 (AUC (площадь под кривой) 0,609 (0,530-0,683), p=0,014) со специфичностью 58,7 и чувствительностью 66,7% ассоциировалось с рецидивом ФП после операции. Пороговое значение для исходного уровня SII >365,83 (AUC 0,623 (0,545-0,697), p=0,006) со специфичностью 57,7 и чувствительностью 63,5% предсказывает развитие рецидива. И пороговое значения для уровня NLR >1,59 (AUC 0,644 (0,566-0,716), p=0,001) ассоциировано с рецидивом ФП после операции со специфичностью 55,8 и чувствительностью 68,3%.
Затем согласно полученным пороговым значениям маркеров, мы разделили выборку на две группы (выше и ниже порога повышенного риска) и сравнили кривые выживаемости Каплана-Майера по частоте развития первичной конечной точки. При сравнении двух групп пациентов с учетом отдаленных событий по уровню SII (Logrank test, p=0,017), SII (Logrank test, p=0,015) и NLR (Logrank test, p=0,008) была выявлена статистическая значимость.
Был проведен регрессионный анализ Кокса и построены 3 модели (таблица 3), учитывающие все факторы, играющие предикторную роль в развитии рецидива ФП, полученные нами при сравнении клинических параметров двух групп пациентов. В каждой из них поочередно использованы маркеры воспаления (SIRI, SII, NLR). Были получены следующие данные: наряду с атеросклерозом КА и длительностью анамнеза аритмии, SII и NLR оставались значимыми предикторами рецидива в многофакторной модели, в то время как SIRI статистическую значимость не продемонстрировал, как и индексированный объем ЛП и прием антиаритмических препаратов 3 класса.
Ранее было проведено несколько исследований, посвящённых изучению роли воспаления в развитии рецидива ФП после криоаблации ЛВ, однако в настоящее время имеется лишь несколько работ, схожих с нашей, в которых изучалась роль "новых" биомаркеров в отношении данного исхода [17][21-23].
В 2023г Kaplan E, et al. [17] опубликовали исследование, в котором приняли участие 370 пациентов, среднего возраста 56,1±12,3 лет, с симптоматической ФП, которым была проведена первичная криоизоляция ЛВ. После средней продолжительности наблюдения 25,0±6,7 мес. ранний рецидив произошел у 36 (9,7%) пациентов, в то время как рецидив после "слепого" периода, составляющего 3 мес. после операции, наблюдался у 77 (20,8%) пациентов. При сравнении двух групп было выявлено, что у пациентов группы рецидива частота гипертонической болезни и ишемической болезни сердца, средний балл по шкале CHA2DS2VASc (C — застойная сердечная недостаточность (Congestive heart failure), H — артериальная гипертензия (Hypertension), A₂ — возраст ≥75 лет (Age ≥75 years), D — сахарный диабет (Diabetes mellitus), S₂ — инсульт/ТИА/тромбоэмболия в анамнезе (Stroke/TIA/thromboembolism), V — сосудистые заболевания (Vascular disease), A — возраст 65-74 года (Age 65-74 years), Sc — женский пол (Sex category — female) и степень EHRA (Европейская ассоциация сердечного ритма (European Heart Rhythm Association) выше, диаметр ЛП больше, среднее значение ФВ ниже, уровни С-реактивного белка и SII перед операцией выше (p<0,05). В результате проведения многофакторного регрессионного анализа Кокса, авторами были получены данные о том, что уровень SII до аблации (отношение рисков (hazard ratio, HR): 2,32; 95% доверительный интервал (ДИ): 1,35-3,98; p=0,002) является независимым предиктором рецидива ФП после криоаблации. По данным ROC-анализа пороговое значение SII >532 ассоциировалось с рецидивом ФП после операции с чувствительностью 71,4 и специфичностью 67,9% (AUC 0,88; 95% ДИ: 0,67-0,80; p<0,001).
В исследовании Gu P, et al. [21] изучалась ценность различных иммунных индексов в прогнозировании рецидива ФП после криоаблации ЛВ. В исследовании приняли участие 307 пациентов с ФП, из них у 65 (21,1%) пациентов рецидив случился в течение года. В качестве показателей использовались 4 маркера воспаления, а именно: SII, NLR, PLR, и индекс PIV (pan-immune-inflammation value), который определялся по следующей формуле: количество тромбоцитов × количество нейтрофилов × количество моноцитов ÷ количество лимфоцитов. По сравнению с группой синусового ритма пациенты из группы рецидива чаще были мужчинами, имели персистирующую форму ФП, больший диаметр ЛП, более высокий уровень креатинина. Все 4 показателя воспаления были статистически значимо выше в группе рецидива по сравнению с контрольной группой. При проведении однофакторного регрессионного анализа Кокса получено, что SII, NLR, PLR и PIV являются факторами риска рецидива ФП. В многофакторной модели PIV оставался независимым предиктором послеоперационного рецидива. Анализ ROC-кривой показал, что индекс PIV имеет более высокую прогностическую ценность для рецидива ФП (AUC 0,768, 95% ДИ: 0,696-0,840, p<0,01), чем индексы SII и NLR. Обращает на себя внимание, что в данной работе индекс PIV рассчитывается по той же методике, как в нашем исследовании индекс AISI.
В сентябре 2024г Kalenderoglu K, et al. опубликовали данные исследования [22], в котором приняли участие 399 пациентов с ФП и выполненной криоаблацией ЛВ. Авторами получены следующие данные: UAR (соотношение мочевой кислоты и альбумина), SII и CAR (соотношение С-реактивного белка и альбумина) независимо связаны с риском рецидива у пациентов с ФП после криоаблации. При этом по результатам анализа ROC-кривой CAR имел большую площадь под кривой (AUC 0,73), чем SII (AUC 0,68) или UAR (AUC 0,64).
В работе, опубликованной Aimaitijiang M, et al. [23], изучалась прогностическая ценность воспалительных факторов, связанных с моноцитами, в т.ч. MHR (соотношение моноцитов к холестерину липопротеинов высокой плотности) и MLR, для прогнозирования рецидива ФП после криоаблации. Всего в исследовании приняли участие 570 пациентов, которых распределили на две группы в зависимости от результатов последующего наблюдения: с рецидивом ФП (n=113) и без рецидива (n=457). У пациентов с рецидивом ФП были более высокие значения MHR (0,37±0,14 vs 0,33±0,14; p=0,004) и более высокие значения MLR (0,49±0,32 vs 0,18±0,07; p<0,001) по сравнению с пациентами без рецидива.
Таким образом, полученные нами результаты согласуются с данными зарубежных коллег, что в очередной раз подтверждает роль воспаления в развитии рецидива ФП после криобаллонной изоляции ЛВ и указывает на необходимость дальнейшего изучения роли "новых" биомаркеров воспаления и внедрение их применения в рутинную клиническую практику.
Ограничения исследования. В связи с тем, что настоящее исследование носит ретроспективный характер, имеются некоторые ограничения, которые присущи всем исследованиям с данным дизайном. В первую очередь, все исходные данные, включенные в статистический анализ, взяты из общей электронной базы данных нашего центра "Medwork", что не исключает частичной потери данных. Во-вторых, в связи с тем, что сбор информации касательно отдаленных событий проводится спустя определенный временной интервал, составляющий минимально 12 мес., не исключена неполнота объема полученных данных, а также потеря связи с исследуемыми пациентами.
Заключение
Повышенные уровни "новых" биомаркеров системного воспаления, рассчитанные на основе анализа периферической крови перед операцией, могут рассматриваться как потенциальные предикторы развития рецидива ФП после проведенного интервенционного лечения. Такие маркеры, как SIRI, SII и NLR показали в настоящем исследовании свою предикторную значимость в отношении развития рецидива ФП после криоаблации. Пороговые уровни, ассоциированные с рецидивом аритмии, были: для SIRI >0,841, для SII >365,83, для NLR >1,59. Таким образом, возможно использование данных индексов для улучшения отдаленных результатов криоаблации ЛВ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Юркулиева Г. А., Донаканян С. А., Бокерия Л. А. Патофизиологические аспекты развития и сохранения фибрилляции предсердий. Анналы аритмологии. 2023;20(2):113-8. doi:10.15275/annaritmol.2023.2.6.
2. Bizhanov KA, Аbzaliyev KB, Baimbetov AK, et al. Atrial fibrillation: Epidemiology, pathophysiology, and clinical complications (literature review). J Cardiovasc Electrophysiol. 2023;34(1):153-65. doi:10.1111/jce.15759.
3. Басиева М. А., Казанова П. В., Шварц В. А. Роль хронического воспаления в развитии рецидива фибрилляции предсердий после интервенционного лечения. Анналы аритмологии. 2024;21(1):39-48. doi:10.15275/annaritmol.2024.1.5.
4. Шалов Р. З., Филатов А. Г. Коморбидная патология и факторы риска у пациентов с фибрилляцией предсердий. Анналы аритмологии. 2023;20(1):43-51. doi:10.15275/annaritmol.2023.1.5.
5. Абгарян А. А., Бердибеков Б. Ш., Александрова С. А. и др. Прогностическая роль оценки фиброзалевого предсердия по данным магнитнорезонансной томографии у пациентов с фибрилляцией предсердий, перенесших катетерную изоляцию легочных вен. Креативнаякардиология. 2024;18(1):92-103. doi:10.24022/1997-3187-2024-18-1-92-103.
6. Harada M, Nattel S. Implications of Inflammation and Fibrosis in Atrial Fibrillation Pathophysiology. Card Electrophysiol Clin. 2021;13(1):25-35. doi:10.1016/j.ccep.2020.11.002.
7. Bi X, Zhang S, Jiang, et al. Mechanistic Insights Into Inflam mation-Induced Arrhythmias: A Simulation Study. Front Physiol. 2022;13:843292. doi:10.3389/fphys.2022.843292.
8. Фомина Д. С., Филатов А. Г., Шалов Р. З. Влияние анатомии левого предсердия и легочных вен на фибрилляцию предсердий. Анналы аритмологии. 2024;21(3):184-9. doi:10.15275/annaritmol.2024.3.6.
9. Hu Z, Ding L, Yao Y. Atrial fibrillation: mechanism and clinical management. Chin Med J (Engl). 2023;136(22):2668-76. doi:10.1097/CM9.0000000000002906.
10. Акилджонов Ф. Р., Бузиашвили Ю. И., Асымбекова Э. У. Биомаркеры при фибрилляции предсердий. Клиническая физиология кровообращения. 2020;17(3):195202. doi:10.24022/1814-6910-2020-17-3-195-202.
11. Zhang F, Li L, Wu X, et al. Pan-immune-inflammation value is associated with poor prognosis in patients undergoing peritoneal dialysis. Ren Fail. 2023;45(1):2158103. doi:10.1080/0886022X.2022.2158103.
12. Lin KB, Fan FH, Cai MQ, et al. Systemic immune inflammation index and system inflammation response index are potential biomarkers of atrial fibrillation among the patients presenting with ischemic stroke. Eur J Med Res. 2022;27(1):106. doi:10.1186/s40001-022-00733-9.
13. Lee LE, Ahn SS, Pyo JY, et al. Pan-immuneinflammation value at diagnosis independently predicts all-cause mortality in patients with antineutrophil cytoplasmic antibodyassociated vasculitis. Clin Exp Rheumatol. 2021;39 Suppl 129(2):88-93. doi:10.55563/clinexprheumatol/m46d0v.
14. Hindricks G, Potpara T, Dagres N, et al., ESC Scientific Document Group (2021). 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. doi:10.1093/eurheartj/ehaa612.
15. Аванесян Г. А., Филатов А. Г., Шалов Р. З. Анатомо-функциональное ремоделирование левого предсердия у пациентов с пароксизмальной и персистирующей формой фибрилляции предсердий после выполнения криобаллонной изоляции устьев легочных вен. Креативная кардиология. 2024;18(1):59-72. doi:10.24022/1997-3187-2024-18-1-59-72.
16. Горячев В. А., Гукепшева З. Р., Алациев Т. Д. и др. Успешное интервенционное лечение молодого пациента с длительно-персистирующей формой фибрилляции предсердий методом криоаблации устьев легочных вен. Анналы аритмологии. 2022;19(2):86-9. doi:10.15275/annaritmol.2022.2.3.
17. Kaplan E, Ekızler FA, Saribaş H, et al. Effectiveness of the systemic immune inflammation index to predict atrial fibrillation recur rence after cryoablation. Biomark Med. 2023;17(2):101-9. doi:10.2217/bmm-2022-0515.
18. Mukai Y. Inflammation and atrial fibrillation. J Arrhythm. 2024; 40(1):26-7. doi:10.1002/joa3.12984.
19. Ihara K, Sasano T. Role of Inflammation in the Pathogenesis of Atrial Fibrillation. Front Physiol. 2022;13:862164. doi:10.3389/fphys.2022.862164.
20. Ионин В. А., Заславская Е. Л., Барашкова Е. И. и др. Предикторы рецидива фибрилляции предсердий у пациентов с метаболическим синдромом после радиочастотной изоляции устьев легочных вен. Российский кардиологический журнал. 2022;27(3S):5184. doi:10.15829/1560-4071-2022-5184.
21. Gu P, Xu P, Chen Y, et al. The predictive value of pan-immune inflammatory index for early recurrence of atrial fibrillation after cryoablation. BMC Cardiovasc Disord. 2024;24(1):669. doi:10.1186/s12872-024-04329-5.
22. Kalenderoglu K, Hayiroglu MI, Cinar T, et al. Comparison of inflammatory markers for the prediction of atrial fibrillation recurrence following cryoablation. Biomark Med. 2024;18(17-18):717-25. doi:10.1080/17520363.2024.2395236.
23. Aimaitijiang M, Gulisitan A, Zhai Z, et al. The predictive value of monocyte-related inflammatory factors for recurrence of atrial fibrillation after cryoablation. Cryobiology. 2024;116:104945. doi:10.1016/j.cryobiol.2024.104945.ISSN 1728-8800 (Print) ISSN 2619-0125 (Online)
Об авторах
М. А. БасиеваРоссия
Аспирант кафедры кардиологии, функциональной и ультразвуковой диагностики с курсом детской кардиологии, врач-кардиолог.
Москва
В. А. Шварц
Россия
д.м.н., профессор кафедры сердечно-сосудистой хирургии с курсом аритмологии и клинической электрофизиологии, зав. отделением хирургического лечения интерактивной патологии.
Москва
М. А. Сокольская
Россия
к.м.н., н.с. отделения хирургического лечения интерактивной патологии.
Москва
С. А. Донаканян
Россия
Донаканян С. А. — д.м.н., профессор кафедры сердечно-сосудистой хирургии с курсом аритмологии и клинической электрофизиологии, зав. отделением хирургического лечения интерактивной патологии.
Москва
А. Г. Филатов
Россия
д.м.н., профессор кафедры сердечно
Москва
Г. А. Аванесян
Россия
к.м.н., врач сердечно- сосудистый хирург, н.с. отделения рентгенхирургической и интраоперационной диагностики и лечения аритмии.
Москва
А. Ю. Испирян
Россия
к.м.н., с.н.с. отделения хирургического лечения интерактивной патологии.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Фибрилляция предсердий (ФП) является наиболее распространённым видом тахиаритмий. Доказано, что она ассоциируется с развитием инсульта, увеличивая риск развития сердечно-сосудистых осложнений, инвалидизации и смерти.
- Воспаление, приводящее к ремоделированию миокарда предсердий посредством различных механизмов, имеет важное значение в возникновении и прогрессировании ФП.
- "Новые" маркеры SII, SIRI, AISI активно изучаются во всех областях медицины, поскольку ранее продемонстрировали свою потенциальную роль в прогнозировании клинических исходов при сердечно-сосудистых заболеваниях.
Что добавляют результаты исследования?
- Определены статистически значимые пороговые уровни "новых" маркеров воспаления, ассоциированные с рецидивом ФП после хирургического лечения.
- Полученные результаты в дальнейшем позволят выделять группу высокого риска развития рецидива после катетерной аблации легочных вен.
Рецензия
Для цитирования:
Басиева М.А., Шварц В.А., Сокольская М.А., Донаканян С.А., Филатов А.Г., Аванесян Г.А., Испирян А.Ю. Роль "новых" индексов системного воспаления в развитии рецидива фибрилляции предсердий после криобаллонной изоляции устьев легочных вен. Кардиоваскулярная терапия и профилактика. 2025;24(7):4417. https://doi.org/10.15829/1728-8800-2025-4417. EDN: BIRNEH
For citation:
Basieva M.A., Shvarts V.A., Sokolskaya M.A., Donakanyan S.A., Filatov A.G., Avanesyan G.A., Ispiryan A.Yu. Role of novel indices of systemic inflammation in atrial fibrillation recurrence after cryoballoon pulmonary vein isolation. Cardiovascular Therapy and Prevention. 2025;24(7):4417. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4417. EDN: BIRNEH
JATS XML

























































