Перейти к:
Результаты 12-месячного наблюдения после имплантации центрифугального устройства механической поддержки левого желудочка
https://doi.org/10.15829/1728-88002025-4420
EDN: UPEAHQ
Аннотация
Цель. Изучить изменения гемодинамики по данным трансторакальной эхокардиографии, течение хронической сердечной недостаточности (ХСН), качество жизни (КЖ) пациентов, осложнения и летальность в течение 12 мес. после имплантации устройства механической поддержки левого желудочка (LVAD).
Материал и методы. В исследование включено 53 пациента с терминальной ХСН, соответствующих критериям имплантации LVAD. Группу 1 составили 23 пациента, которым проведена имплантация, в группу 2 вошли 30 пациентов, отказавшихся от операции. Исходно, перед выпиской, через 3, 6, 12 мес. проводились: трансторакальная эхокардиография, тест 6-минутной ходьбы, оценка функционального класса (ФК) ХСН, КЖ, концентрации N-концевого промозгового натрийуретического пептида, количества госпитализаций, осложнений и летальных исходов.
Результаты. Летальность в группе 1 составила 30,4%, в группе 2 — 30,0%. Были зарегистрированы следующие осложнения имплантации LVAD: правожелудочковая недостаточность — 13, желудочно-кишечное кровотечение — 3, желудочковая тахикардия — 4, LVAD-ассоциированная инфекция — 14 случаев. В отличие от группы 2 в группе 1 уменьшились конечно-диастолический размер левого желудочка с 7,4 [7,1; 8,0] до 6,4 [5,7; 6,9] см (р<0,001), митральная регургитация с 2,2±0,54 до 1,44±0,4 ст. (р<0,001), концентрация N-концевого фрагмента предшественника мозгового натрийуретического пептида с 2239 [1623; 4057] до 740 [438,5; 1273] пг/мл (р<0,001), улучшился ФК ХСН (p<0,001), зарегистрировано меньшее количество госпитализаций — 23 vs 37 (р=0,014).
Заключение. В настоящем исследовании имплантация LVAD привела к улучшению внутрисердечной гемодинамики, ФК ХСН, КЖ, уменьшению количества госпитализаций, декомпенсаций ХСН, но не снижению летальности.
Для цитирования:
Шахраманова Ж.А., Нарусов О.Ю., Саидова М.А., Осмоловская Ю.Ф., Ганаев К.Г., Ширяев А.А., Меркулова И.А., Певзнер Д.В., Терещенко С.Н. Результаты 12-месячного наблюдения после имплантации центрифугального устройства механической поддержки левого желудочка. Кардиоваскулярная терапия и профилактика. 2025;24(8):4420. https://doi.org/10.15829/1728-88002025-4420. EDN: UPEAHQ
For citation:
Shakhramanova Zh.A., Narusov O.Yu., Saidova M.A., Osmolovskaya Yu.F., Ganaev K.G., Shiryaev A.A., Merkulova I.A., Pevsner D.V., Tereschenko S.N. Twelve-month follow-up after implantation of a centrifugal-flow left ventricular assist device. Cardiovascular Therapy and Prevention. 2025;24(8):4420. (In Russ.) https://doi.org/10.15829/1728-88002025-4420. EDN: UPEAHQ
Введение
Распространенность хронической сердечной недостаточности (ХСН) III-IV функционального класса (ФК) составляет 3,1% [1] и, несмотря на новые возможности фармакотерапии, прогноз пациентов остается неблагоприятным со смертностью 10,2%/год [1]. У пациентов с терминальной ХСН годовая смертность без трансплантации сердца или имплантации устройства механической поддержки левого желудочка (LVAD, left ventricular assist device) достигает 25-75% [2, 3]. С учетом таких ограничений к трансплантации сердца (ТС), как дефицит донорских органов и наличие ряда противопоказаний, применение LVAD приобретает все большую актуальность [4, 5]. Только в США ежегодно имплантируют ~3000 устройств, а в Германии >1100 [6-8]. Осевые насосы, которые активно использовали 10-15 лет назад, приводили к большому проценту тромботических осложнений, в связи с чем в большинстве случаев устройство имплантировалось на короткие сроки в рамках моста к ТС [6]. HeartMate3 (HM3) — устройство для механической поддержки левого желудочка 3-го поколения с магнитно-левитирующим насосом, большим пространством для тока крови, феноменом искусственной пульсации, что в совокупности улучшило его гемосовместимость и значимо уменьшило количество тромботических осложнений [9]. В исследовании Momentum-3 центрифужные устройства превзошли осевые в отношении выживаемости пациентов без инвалидизирующего острого нарушения мозгового кровообращения (ОНМК), а также без развития вторичных конечных точек, и в дальнейшем практически вытеснили из практики устройства предыдущих поколений [10]. Согласно отчету регистра INTERMACS (Interagency Registry for Mechanically Assisted Circulatory Support) 2023г 99,8% имплантируемых устройств были полностью магнитно-левитационными, что привело к улучшению выживаемости и уменьшению количества нежелательных явлений [8]. Двухлетняя выживаемость после имплантации HM3 приближается к таковой после ТС [6]. Если раньше имплантация LVAD проводилась, в основном, в качестве моста к ТС, в настоящее время >82% имплантаций проводятся в рамках стратегии целевой терапии [8]. Увеличение продолжительности использования LVAD закономерно ассоциировано с ростом количества осложнений и изменением их спектра, что требует дальнейших исследований. В Российской Федерации имплантация LVAD является относительно новым методом лечения, а применение его в качестве целевой терапии началось только с 2022г, в связи с чем важен анализ полученного опыта. Результаты 6-месячного наблюдения уже были опубликованы нами ранее [11], в настоящей статье будут представлены итоги 12-мес. наблюдения.
Цель исследования — изучить изменения гемодинамики по данным трансторакальной эхокардиографии (ТТЭхоКГ), клиническое течение ХСН, качество жизни (КЖ), отдаленные осложнения и летальность в течение 12 мес. после имплантации LVAD.
Материал и методы
Имплантации LVAD HM3 проводились в 2022-2023гг в рамках клинической апробации. Критериями включения в исследование считались ХСН с фракцией выброса левого желудочка (ЛЖ) <30%, ФК сердечной недостаточности III-IV, профиль INTERMACS III-V, необходимость в инотропной поддержке или сердечный индекс <2,2 л/мин/м2 без инотропной поддержки. Кроме того, пациент должен был соответствовать одному из следующих условий: находиться на оптимальной медикаментозной терапии в течение как минимум 45 дней из последних 60 с отсутствием эффекта от нее, или иметь тяжелую сердечную недостаточность в течение не <14 дней и зависеть от внутриаортальной баллонной контрпульсации не <7 дней. Критериями невключения в исследование служили: отказ пациента от участия, обструктивная гипертрофическая кардиомиопатия, перикардит, амилоидоз, рестриктивная кардиомиопатия, наличие искусственного аортального клапана, наличие трансплантированных органов в анамнезе, активная инфекция, тромбоцитопения, психические расстройства, а также наличие выраженных нарушений функций жизненно важных органов. В исследование включены 53 пациента. Группу 1 составили 23 пациента с имплантированным LVAD. В группу контроля (группа 2) вошли 30 пациентов, отказавшихся от хирургического лечения. Период наблюдения составил один год. В рамках данного исследования оценивались следующие показатели: ФК сердечной недостаточности, толерантность к физическим нагрузкам с помощью теста 6-минутной ходьбы (Т6-мх), КЖ по данным опросника EQ-5D (EuroQol 5 Dimensions), общее количество госпитализаций, в т.ч. вызванных декомпенсацией ХСН, концентрация N-концевого промозгового натрийуретического пептида (NT-proBNP), показатели летальности, а также послеоперационные осложнения. ТТЭхоКГ проводилась согласно современным рекомендациям по оценке камер сердца из парастернальной, апикальной и субкостальной позиций с одномоментной электрокардиографической синхронизацией с учетом особенностей визуализации у пациентов с LVAD. Все исследования проводились исходно, перед выпиской из стационара, а также через 3, 6 и 12 мес. после имплантации LVAD или выписки. Статистический анализ данных осуществлялся с помощью пакета прикладных программ Excel 2010 и статистических программ SPSS 17.0.5. Категориальные данные описывались с указанием абсолютных значений и процентных долей. Описательная статистика количественных переменных после анализа на нормальность распределения с помощью критерия Шапиро-Уилка представлена в виде среднего значения (M) со стандартным отклонением (SD) при нормальном распределении и в виде медианы с интерквартильным размахом (Ме, [Q25; Q75]) при распределении, отличном от нормального. Сравнение двух групп по количественному признаку в случае нормального распределения при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. При распределении, отличном от нормального, — с помощью U-критерия Манна-Уитни. Анализ номинальных данных выполнен при помощи критерия χ2, точного критерия Фишера. Уровень статистической значимости установлен на уровне p<0,05 для всех тестов.
Результаты
Клинико-демографическая характеристика пациентов, включенных в исследование, представлена в таблице 1. Пациенты были сопоставимы по функциональному статусу ХСН, основным коморбидным фоновым заболеваниям и параметрам гемодинамики, но статистически значимо различались по полу.
Все пациенты получали максимально возможную терапию, которая включала базовую терапию ХСН, а также диуретики и дигоксин (таблица 2).
В группе 2 терапия не менялась в течение 12 мес., т.к. титрация доз препаратов не представлялась возможной. Имплантация LVAD в группе 1 позволила эскалировать терапию ХСН. У части пациентов для достижения целевого среднего артериального давления (<80 мм рт.ст.) к максимальной дозе валсартана+сакубитрила требовалось добавление амлодипина (таблица 3).
Проведение ТТЭхоКГ у пациентов с имплантированным LVAD имеет особенности в связи с плохой визуализацией и невозможностью измерения ряда показателей ввиду работы устройства. Из-за отсутствия четкого разграничения систолы и диастолы недостоверной является оценка фракции выброса ЛЖ, в связи с чем эффективность работы LVAD в основном определяется по динамике конечного диастолического размера (КДР) ЛЖ, степени митральной регургитации, положению межжелудочковой перегородки (МЖП), частоте открытия аортального клапана (АК). Динамика показателей ТТЭхоКГ отражена в таблице 4.
Через 12 мес. наблюдения имплантация LVAD привела к статистически значимому уменьшению КДР ЛЖ, а у 10 (62,5%) пациентов (здесь и далее % указан от количества пациентов, достигших 12-мес. точку) этот показатель уменьшился на >15%. При этом у 13 (81,25%) пациентов не развились ни клинические ни эхокардиографические признаки дисфункции правых отделов сердца. В группе 2 размеры ЛЖ не изменились. В группе 1 за период наблюдения отмечалось статистически значимое уменьшение митральной регургитации с 2,2±0,54 до 1,4±0,4 (p <0,001), и не отмечалось динамики в группе 2 (p=0,830) (рисунок 1).
Через 12 мес. в группе 1 у 15 (93,8%) пациентов наблюдалось целевое нейтральное положение МЖП, у 8 (50%) пациентов определялось оптимальное открытие АК (1:2; 1:3). У 3 пациентов регистрировались единичные открытия АК (1:6; 1:8), еще у 4 АК открывался каждый цикл, АК не функционировал у 1 пациента. Спустя 12 мес. у пациентов с LVAD ожидаемо отмечалось значимое увеличение аортальной регургитации (p=0,044), чего не регистрировалось в группе 2 (р=0,519). Однако несмотря на прогрессирование аортальной регургитации ни у одного пациента с LVAD не развилась тяжелая аортальная недостаточность, требующая лечения.
Имплантация LVAD привела к улучшению функционального статуса пациентов, статистически значимому увеличению дистанции Т6-мх (р<0,001) (рисунок 2) и улучшению ФК ХСН (р<0,001) (рисунок 3). В группе 2 отмечалась тенденция к увеличению дистанции Т6-мх, однако различия не достигли статической значимости (р=0,05), и, в отличие от группы 1, улучшение происходило только во время госпитализации, что привело к достоверной разнице между группами через 12 мес. наблюдения (р<0,001) (рисунок 2).
В качестве лабораторного маркера течения ХСН оценивалось изменение концентрации NT-proBNP. Клиническое улучшение пациентов с LVAD нашло свое подтверждение в статистически значимом снижении уровня NT-proBNP при отсутствии динамики в группе 2, что проявилось достоверным различием между группами через 1 год (рисунок 4). КЖ в большей степени улучшалось в группе 1 (увеличение с 30 до 67,5 vs с 32,5 до 45 баллов по опроснику EQ-5D). Через 12 мес. группы стали статистически значимо различаться по этому признаку (р<0,001).
При оценке безопасности имплантации LVAD в качестве долгосрочной терапии учитывалось количество и структура осложнений, частота повторных госпитализаций, в т.ч. по причине декомпенсации ХСН, и летальность. Структура осложнений отражена в таблице 5. Подробный анализ госпитальных и произошедших в первые 6 мес. осложнений был проведен нами ранее [11, 12]. После 6 мес. наблюдения превалирующим осложнением оказалась кабель-ассоциированная инфекция: всего 14 случаев за 1 год у 6 пациентов. Кроме этого, был зарегистрирован 1 случай желудочковой тахикардии, приведший к летальному исходу.
В группе 1 частота повторных госпитализаций по любой причине составила 1 случай на 1 пациента (всего 23 госпитализации), при этом среди пациентов без инфекции кабеля — 0,4 на 1 пациента, в т.ч. всего 4 случая в связи с декомпенсацией ХСН. В группе 2 зарегистрировано статистически значимо большее количество повторных госпитализаций — 37 случаев (р=0,014), в 100% — по причине декомпенсации ХСН (р<0,001), что составило 1,23 госпитализации на 1 пациента.
Общая летальность среди пациентов с LVAD за 1 год наблюдения составила 30,4% (7 пациентов). Большинство событий произошло в первые 6 мес. и были обусловлены в 1 случае острой неокклюзионной мезентериальной ишемией [13], в 1 случае — правожелудочковой недостаточностью (ПЖН), в 2 — желудочно-кишечным кровотечением (ЖКК), еще в 1 — ОНМК и 1 сепсисом. После прохождения 6-мес. точки наблюдения был зарегистрирован только 1 летальный исход по причине желудочковой тахикардии. В группе 2 летальность составила 30,0% (9 пациентов), все случаи были обусловлены сердечно-сосудистыми причинами (3 — внезапной сердечной смертью, 6 — в связи с прогрессированием ХСН).
Таблица 1
Исходная клинико-демографическая характеристика пациентов обеих групп
|
Показатель |
Группа 1 |
Группа 2 |
p |
|
Возраст, лет, Me [Q25; Q75] |
62 [ 54; 65] |
59 [ 52,75; 71] |
0,957 |
|
Пол: Мужчины, n (%) Женщины, n (%) |
23 (100) |
25 (83,3) 5(16,7) |
0,042 |
|
Этиология ХСН: ИБС: ПИКС, n (%) ДКМП, n (%) |
13 (56,5) 10 (43,5) |
19 (63,3) 11 (36,7) |
0,619 |
|
ФК ХСН: III, n (%) IV, n (%) |
19 (82,6) 4 (17,4) |
25 (83) 5 (17) |
0,792 |
|
Класс INTERMACS: III, n (%) IV, n (%) V, n (%) |
3 (13) 19 (83) 1 (4) |
1 (3,3) 28 (93,4) 1 (3,3) |
0,344 |
|
Наличие ФП, n (%) Пароксизмальная форма, n (%) Постоянная форма, n (%) |
13 (56,5) 7 (53,8) 6 (46,2) |
15 (50) 8 (53,3) 7 (46,7) |
0,641 0,98 0,98 |
|
Сахарный диабет 2 типа, n (%) |
3 (13) |
7 (23,3) |
0,347 |
|
ИМТ, кг/м2, Me [Q25; Q75] |
26,0 [ 23; 29] |
27,5 [ 23; 31,25] |
0,217 |
|
ФВ ЛЖ, %, Me [Q25; Q75] |
23,0 [ 20; 24] |
23,5 [ 19; 26,25] |
0,296 |
|
КДР ЛЖ, см, Me [Q25; Q75] |
7,4 [ 7,1; 8,0] |
7,1 [ 6,6; 7,9] |
0,141 |
|
ФВ ПЖ (3D), %, Me [Q25; Q75] |
43 [ 38; 50] |
44 [ 41; 48] |
0,489 |
|
NT-pro-BNP, пг/мл, Me [Q25; Q75] |
2239 [1623; 4057] |
2438 [1040; 4008] |
0,760 |
Примечание: ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, КДР ЛЖ — конечный диастолический размер левого желудочка, ПИКС — постинфарктный кардиосклероз, ФП — фибрилляция предсердий, ФВ ЛЖ — фракция выброса левого желудочка, ФВ ПЖ — фракция выброса правого желудочка, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность, INTERMACS — Interagency Registry for Mechanically Assisted Circulatory Support, Me [Q25; Q75] — медиана [интерквартильный размах], NT-proBNP — N-концевой промозговой натрийуретический пептид.
Таблица 2
Исходная терапия ХСН в обеих группах
|
Препарат |
Группа 1 |
Группа 2 |
р1 |
р2 |
||
|
n (%) |
мг/сут., M±SD |
n (%) |
мг/сут., M±SD |
|||
|
Валсартан + сакубитрил |
18 (78,3) |
93±66 |
24 (80,0) |
128,1±91,9 |
0,88 |
0,10 |
|
Эналаприл |
3 (13,0) |
6,7±2,9 |
4 (13,3) |
8,8±2,5 |
0,98 |
0,30 |
|
Бисопролол |
19 (82,6) |
3,8±2,5 |
27 (90,0) |
4,8±4 |
0,73 |
0,46 |
|
Дапаглифлозин |
23 (100) |
10 |
28 (93,3) |
10 |
0,21 |
1,00 |
|
Спиронолактон |
23 (100) |
40,2±16,4 |
30 (100) |
47,9±34,4 |
1,00 |
0,56 |
|
Фуросемид |
23 (100) |
55,7±40,9 |
30 (100) |
50,7±24,5 |
1,00 |
0,90 |
|
Дигоксин |
8 (34,8) |
0,16±0,06 |
9 (30,0) |
0,15±0,06 |
0,71 |
0,90 |
Примечание: р1 — значимость различий между группами по количеству пациентов, принимающих препарат; р2 — значимость различий между группами по дозам препаратов. ХСН — хроническая сердечная недостаточность.
Таблица 3
Терапия ХСН через год после имплантации LVAD
|
Препарат |
Исходно (n=23) |
Через 12 мес. (n=16) |
р1 |
р2 |
||
|
n (%) |
мг/сут., M±SD |
n (%) |
мг/сут., M±SD |
|||
|
Валсартан + сакубитрил |
18 (78,3) |
93±66 |
13 (81,3) |
234,6±128,1 |
0,822 |
0,001 |
|
Эналаприл |
3 (13,0) |
6,7±2,9 |
3 (18,7) |
18,3±18,9 |
0,63 |
0,52 |
|
Бисопролол |
19 (82,6) |
3,8±2,5 |
14 (87,5) |
4,6±3,4 |
0,96 |
0,27 |
|
Дапаглифлозин |
23 (100) |
10 |
16 (100) |
10 |
1,00 |
1,00 |
|
Спиронолактон |
23 (100) |
40,2±16,4 |
16 (100) |
54,7±35,6 |
1,00 |
0,76 |
|
Фуросемид |
23 (100) |
55,7±40,9 |
11 (68,8) |
52,3±49,0 |
0,005 |
0,59 |
|
Дигоксин |
8 (34,8) |
0,16±0,06 |
2 (12,5) |
0,19±0,08 |
0,12 |
0,51 |
|
Амлодипин |
5 (31,3) |
10 |
Нп |
Нп |
||
Примечание: р1 — значимость различий между группами по количеству пациентов, принимающих препарат; р2 — значимость различий между группами по дозам препаратов. Нп — неприменимо.
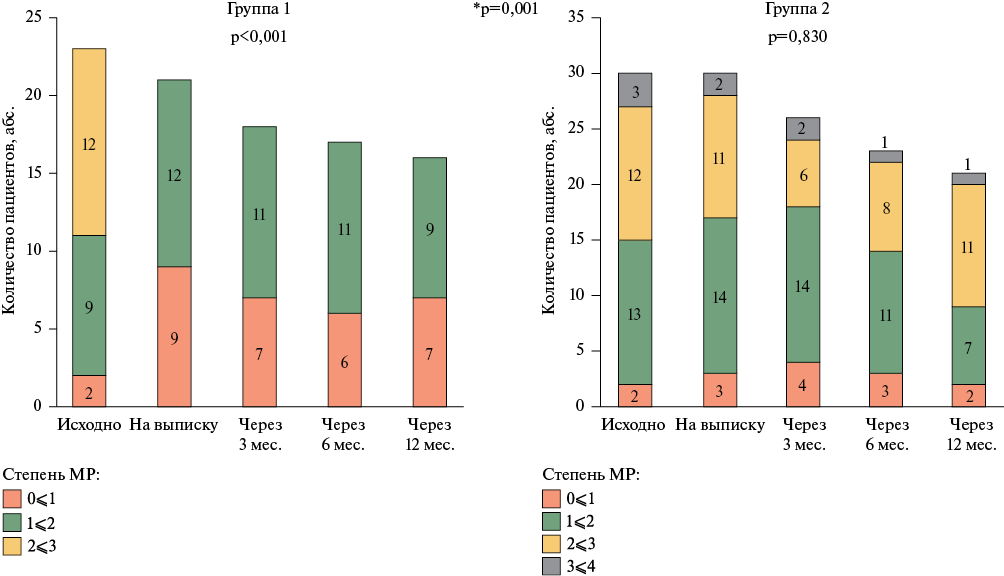
Рис. 1 Динамика митральной регургитации в обеих группах.
Примечание: р — внутри группы, p* — между группами. МТ — митральная регургитация.
Таблица 4
Динамика эхокардиографических показателей и уровня NT-proBNP в обеих группах
|
Группа 1 |
Группа 2 |
|||||
|
Показатель |
Исходно (n=23) |
Через 12 мес. (n=16) |
р |
Исходно (n=30) |
Через 12 мес. (n=21) |
р |
|
КДР, см, Me [Q25; Q75] |
7,4 [ 7,1; 8,0] |
6,4 [ 5,7; 6,9] |
<0,001 |
7,1 [ 6,6; 7,9] |
7,0 [ 6,4; 7,7] |
0,908 |
|
СДЛА, мм рт.ст., Me [Q25; Q75] |
30 [ 25; 40] |
27 [ 21,5; 28,75] |
0,034 |
38 [ 29; 47] |
32 [ 26,5; 38] |
0,174 |
|
ПЗР ПЖ, см, Me [Q25; Q75] |
2,7 [ 2,4; 3,0] |
2,6 [ 2,5; 2,8] |
0,886 |
2,75 [ 2,4; 3,13] |
2,6 [ 2,35; 2,95] |
0,495 |
|
БРПЖ, см, Me [Q25; Q75] |
4,3 [ 3,4; 4,6] |
4,1 [ 3,6; 4,4] |
0,742 |
4,1 [ 3,6; 4,5] |
4,2 [ 3,95; 4,65] |
0,282 |
|
МР, степень, M±SD |
2,2±0,54 |
1,44±0,4 |
<0,001 |
2,3±0,8 |
2,2±0,7 |
0,830 |
|
ТР, степень, M±SD |
1,32±0,51 |
1,38±0,34 |
0,459 |
1,6±0,6 |
1,5±0,6 |
0,245 |
|
АР, степень, M±SD |
0,48±0,53 |
0,84±0,54 |
0,044 |
0,47±0,54 |
0,57±0,57 |
0,519 |
|
NT-proBNP, Me [Q25; Q75] |
2239 [ 1623; 4057] |
740 [ 438,5; 1273] |
<0,001 |
2438 [ 1040; 4008] |
1892 [ 1005; 4371] |
0,774 |
Примечание: АР — аортальная регургитация, БРПЖ — базальный размер правого желудочка, КДР конечный диастолический размер, МР — митральная регургитация, ПЗР ПЖ — переднезадний размер правого желудочка, СДЛА — систолическое давление в легочной артерии, — ТР трикуспидальная регургитация, Me [Q25; Q75] — медиана [интерквартильный размах], NT-proBNP — N-концевой промозговой натрийуретический пептид.
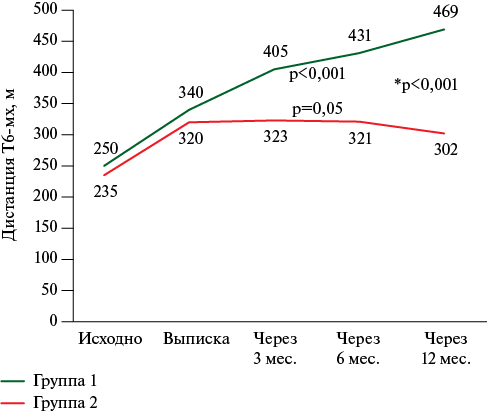
Рис. 2 Динамика Т6-мх в обеих группах.
Примечание: р — внутри группы, p* — между группами. Т6-мх — тест 6-минутной ходьбы.
Таблица 5
Общее количество осложнений у пациентов с LVAD
|
Осложнение |
Количество случаев |
|
Плеврит |
18 |
|
Делирий |
4 |
|
ЖТ |
4 |
|
ПЖН |
13 |
|
ЖКК |
3 |
|
Инфекция кабеля |
14 |
|
Сепсис |
2 |
|
ОНМК |
2 |
Примечание: ЖКК — желудочно-кишечное кровотечение, ЖТ — желудочковая тахикардия, ОНМК — острое нарушение мозгового кровообращения, ПЖН — правожелудочковая недостаточность, LVAD — left ventricular assist device (устройство механической поддержки левого желудочка).

Рис. 3 Динамика ФК ХСН в обеих группах.
Примечание: p — внутри группы, p* — между группами. ФК ХСН — функциональный класс хронической сердечной недостаточности.
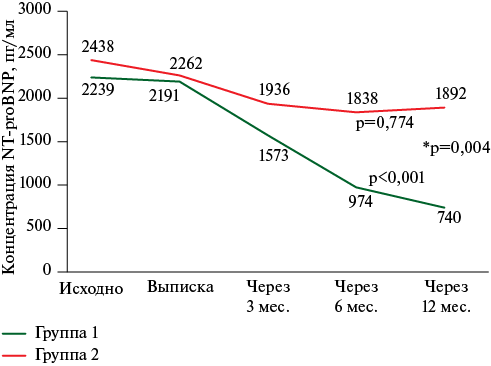
Рис. 4 Динамика уровня NT-proBNP в обеих группах.
Примечание: p — внутри группы, p* — между группами. NT-proBNP — N-концевой фрагмент предшественника мозгового натрийуретического пептида.
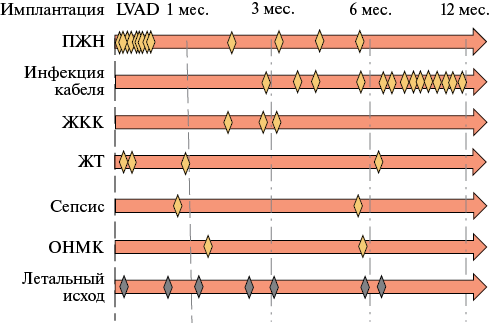
Рис. 5 Временнáя шкала развития осложнений у пациентов с LVAD.
Примечание: ЖКК — желудочно-кишечное кровотечение, ЖТ — желудочковая тахикардия, ОНМК — острое нарушение мозгового кровообращения, ПЖН — правожелудочковая недостаточность, LVAD — left ventricular assist device (устройство механической поддержки левого желудочка).
Обсуждение
Имплантация LVAD кардинальным образом перестраивает гемодинамику. В настоящем исследовании у большинства пациентов с LVAD изменения соответствовали критериям оптимальной разгрузки ЛЖ: уменьшению его размера более чем на 15% [14]. Такое улучшение внутрисердечной гемодинамики сопровождалось повышением толерантности к физическим нагрузкам, улучшением ФК и клинического течения терминальной ХСН по сравнению с оптимальной медикаментозной терапией. Стоит отметить, что улучшение наступает уже в ранние послеоперационные сроки и продолжается в течение всего периода наблюдения, в то время как в группе 2 какая-либо положительная динамика отмечается только во время госпитализации, т.е. в период достижения максимально возможной компенсации ХСН с дальнейшей тенденцией к ухудшению. Наглядным подтверждением этому в настоящей работе послужило различие в ФК между группами: через 12 мес. наблюдения I ФК имели большинство пациентов с LVAD и ни один пациент из группы 2. Схожие результаты были получены в большинстве исследований [10][15][16]. Благодаря улучшению функциональных возможностей и меньшему количеству госпитализаций, пациенты с LVAD имели более высокий уровень КЖ по сравнению с группой 2, даже несмотря на чрескожный кабель и необходимость постоянной зарядки устройства. В 2023г было опубликовано исследование MCS A-QOL (Mechanical Circulatory Support: Measures of Adjustment and Quality of Life), посвященное физическому, социальному и психическому здоровью у пациентов с LVAD [17]. Основным отличием исследования MCS A-QOL послужил меньший срок наблюдения, 6 мес., но, как и в нашей работе, наиболее значимое улучшение толерантности к физической нагрузке и КЖ были зафиксированы уже в первые 3 мес. с момента операции. Однако важно учитывать, что увеличение продолжительности использования LVAD приводит к изменению структуры осложнений. В регистре INTERMACS было показано, что результаты имплантации LVAD в качестве целевой терапии были хуже, чем в рамках терапии моста [18]. Вероятно, это связано с тем, что стратегия целевой терапии подразумевает более тяжелую когорту пациентов с противопоказаниями к ТС.
С 2018г прослеживается закономерность увеличения доли имплантации LVAD в качестве долгосрочной терапии [8], что, видимо, обусловлено одобрением Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) применения в качестве целевой терапии устройства HM31. Сегодня эта тенденция продолжается и в 2022г уже >80% устройств были имплантированы в рамках долгосрочной терапии [8]; поэтому анализ профиля безопасности длительного использования LVAD приобретает особое значение. При хронологическом анализе осложнений прослеживается их четкое разделение на ранние и поздние. В первые 6 мес. после имплантации устройства наиболее часто встречалась ПЖН. В последующем картина кардинально меняется и начинают превалировать исключительно инфекционные осложнения, количество которых увеличивается с течением времени (рисунок 5). Более ранний период отличается лучшей комплаентностью пациентов, строгим соблюдением рекомендаций, частыми визитами на осмотр к врачу, в то время как позднее приверженность пациентов к рутинным мероприятиям по уходу снижается, что ожидаемо приводит к крайне резкому росту инфекционных осложнений.
Полученные в настоящей работе результаты согласуются с уже опубликованными литературными данными. В исследовании 2023г проведенный ретроспективный анализ по выявлению факторов риска кабель-ассоциированной инфекции выявил линейную зависимость ее кумулятивного риска от времени использования LVAD [19].
Наличие инфекции значительно увеличивает число повторных госпитализаций, что объясняет возрастание их количества после 6 мес. от времени оперативного вмешательства. В то же время наибольшее количество летальных исходов (6 из 7) было зафиксировано в первые 6 мес. после имплантации LVAD; это представляется закономерным с учетом того, что именно в этот период в основном и развивались такие грозные осложнения, как ПЖН, ЖКК, желудочковые тахикардии и ОНМК.
Ограничения исследования. Небольшая выборка пациентов, что не позволяет нивелировать влияние случайных событий и может влиять на результаты исследования.
Заключение
Имплантация LVAD в качестве целевой терапии является перспективным и нередко единственно возможным вариантом лечения терминальной ХСН. Опыт ФГБУ "НМИЦК им. акад. Е. И. Чазова" свидетельствует о положительном влиянии операции на внутрисердечную гемодинамику, функциональные возможности, количество госпитализаций и КЖ пациентов. В то же время внедрение метода часто сопровождается более высокой летальностью, которая снижается по мере накопления опыта. Наша работа продемонстрировала, что летальность во многом зависит от соблюдения критериев отбора пациентов, точности прогнозирования развития ПЖН и тщательности наблюдения за пациентами в первые 6 мес. с акцентом на своевременное выявление первых признаков ЖКК и контроль международного нормализованного отношения. В дальнейшем усилия врачей должны быть направлены на профилактику инфекционных осложнений, обучение пациентов уходу за кабелем и поддержание их высокой мотивации. Такой дифференцированный подход, на наш взгляд, будет способствовать улучшению результатов и более широкому распространению этой технологии в России.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 https://www.fda.gov/media/119049/download.
Список литературы
1. Поляков Д.С., Фомин И.В., Беленков Ю.Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
2. Habal MV, Garan AR. Long-term management of end-stage heart failure. Best Pract Res Clin Anaesthesiol. 2017;31(2):153-66. doi:10.1016/j.bpa.2017.07.003.
3. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726. doi:10.1093/eurheartj/ehab670.
4. Potapov EV, Antonides C, Crespo-Leiro MG, et al. 2019 EACTS Expert Consensus on long-term mechanical circulatory support. Eur J Cardiothorac Surg. 2019;56(2):230-70. doi:10.1093/ejcts/ezz098.
5. Галявич А. С., Терещенко С. Н., Ускач Т. М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6162. doi:10.15829/1560-4071-2024-6162.
6. Mehra MR, Cleveland JC Jr, Uriel N, et al. Primary results of longterm outcomes in the MOMENTUM 3 pivotal trial and continued access protocol study phase: a study of 2200 HeartMate 3 left ventricular assist device implants. Eur J Heart Fail. 2021;23(8): 1392-400. doi:10.1002/ejhf.2211.
7. Timmis A, Townsend N, Gale CP, et al. European society of cardiology: Cardiovascular disease statistics 2019. Eur Heart J. 2020;41(1):12-85. doi:10.1093/eurheartj/ehaa062.
8. Jorde UP, Saeed O, Koehl D, et al. The Society of Thoracic Surgeons Intermacs 2023 Annual Report: Focus on Magnetically Levitated Devices. Ann Thorac Surg. 2024;117(1):33-44. doi:10.1016/j.athoracsur.2023.11.004.
9. Shah M, Hafeez Y, Burns P, et al. Shared Care to Destination Therapy Left Ventricular Assist Device Site: a Novel Strategy to Start a Successful Mechanical Circulatory Support Program. Curr Cardiol Rep. 2021;23(8):112. doi:10.1007/s11886-021-01533-z.
10. Mehra MR, Goldstein DJ, Cleveland JC, et al. Five-Year Outcomes in Patients With Fully Magnetically Levitated vs Axial-Flow Left Ventricular Assist Devices in the MOMENTUM 3 Randomized Trial. JAMA. 2022;328(12):1233-42. doi:10.1001/jama.2022.16197.
11. Шахраманова Ж. А., Нарусов О.Ю., Аманатова В.А. и др. Влияние имплантации центрифугального устройства механической поддержки левого желудочка на течение заболевания, функциональный класс и качество жизни пациентов с терминальной хронической сердечной недостаточностью со сниженной фракцией выброса. Опыт 6-месячного наблюдения. Российский кардиологический журнал. 2024;29(12):6127. doi:10.15829/1560-4071-2024-6127.
12. Ганаев К. Г., Дзыбинская Е.В., Нарусов О.Ю. и др. Госпитальные результаты имплантации центрифугальной системы поддержки функции левого желудочка пациентам с тяжелой хронической сердечной недостаточностью (опыт НМИЦ кардиологии им. ак. Е.И. Чазова). Российский кардиологический журнал. 2024;29(6):5846. doi:10.15829/1560-4071-2024-5846.
13. Ганаев К. Г., Лаврикова Т. А., Дзыбинская Е.В. и др. Острая неокклюзионная мезентеральная ишемия после имплантации искусственного левого желудочка. Клинический разбор в общей медицине. 2024;5(6):26-32. doi:10.47407/kr2024.5.6.00431.
14. Stainback RF, Estep JD, Agler DA, et al. Echocardiography in the Management of Patients with Left Ventricular Assist Devices: Recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr. 2015;28(8):853-909. doi:10.1016/j.echo.2015.05.008.
15. Mehra MR, Castagna F, Butler J, et al. The transformative potential of left ventricular assist devices in advanced heart failure: no more a therapeutic orphan. Eur Heart J. 2024;45(8):626-8. doi:10.1093/eurheartj/ehad555.
16. Бегдильдаев А.Т., Туртабаев Б.У., Устемиров Е.Б. и др. Динамическое наблюдение пациентов с искусственным левым желудочком сердца. Кардиология и сердечно-сосудистая хирургия. 2023;16(4):358-61. doi:10.17116/kardio202316041358.
17. Hahn EA, Allen LA, Lee CS, et al. PROMIS: Physical, Mental and Social Health Outcomes Improve From Before to Early After LVAD Implant: Findings From the Mechanical Circulatory Support: Measures of Adjustment and Quality of Life (MCS A-QOL) Study. J Card Fail. 2023;29(10):1398-411. doi:10.1016/j.cardfail.2023.03.013.
18. Yuzefpolskaya M, Schroeder S, Houston B, et al. The Society of Thoracic Surgeons Intermacs 2022 Annual Report: Focus on the 2018 Heart Transplant Allocation System. Ann Thorac Surg. 2023;115(2):311-27. doi:10.1016/j.athoracsur.2022.11.023.
19. Köhler AK, Körperich H, Morshuis M, et al. Pre-operative risk factors for driveline infection in left ventricular-assist device patients. ESC Heart Fail. 2022;9(6):3995-4002. doi:10.1002/ehf2.14112.
Об авторах
Ж. А. ШахрамановаРоссия
Аспирант отдела заболеваний миокарда и сердечной недостаточности
Москва
О. Ю. Нарусов
Россия
К.м.н., с.н.с. отдела заболеваний миокарда и сердечной недостаточности
Москва
М. А. Саидова
Россия
Д.м.н., профессор, руководитель отдела ультразвуковых методов исследования
Москва
Ю. Ф. Осмоловская
Россия
К.м.н., н.с., зав. 8 клиническим отделением отдела заболеваний миокарда и сердечной недостаточности
Москва
К. Г. Ганаев
Россия
К.м.н., м.н.с. лаборатории микрохирургии сердца и сосудов отделения сердечно-сосудистой хирургии
Москва
А. А. Ширяев
Россия
Д.м.н., профессор, руководитель отдела сердечно-сосудистой хирургии, член-корреспондент РАН
Москва
И. А. Меркулова
Россия
Врач-кардиолог палаты реанимации и интенсивной терапии, м.н.с. отдела неотложной кардиологии
Москва
Д. В. Певзнер
Россия
Д.м.н., г.н.с. отдела неотложной кардиологии
Москва
С. Н. Терещенко
Россия
Д.м.н., профессор, руководитель отдела заболеваний миокарда и сердечной недостаточности
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Имплантация LVAD (устройство механической поддержки левого желудочка) является эффективным методом лечения терминальной хронической сердечной недостаточности при невозможности трансплантации сердца.
Что добавляют результаты исследования?
- Несмотря на осложнения, имплантация LVAD привела к уменьшению количества госпитализаций, улучшению качества жизни и функциональных возможностей пациентов.
- Выявлена хронологическая связь развития осложнений: в первые 6 мес. встречались правожелудочковая недостаточность, желудочно-кишечное кровотечение, желудочковая тахикардия, в последующем — LVAD-ассоциированная инфекция.
- В данном исследовании не удалось достичь снижения летальности. Необходимо совершенствовать отбор пациентов и их послеоперационное наблюдение.
Рецензия
Для цитирования:
Шахраманова Ж.А., Нарусов О.Ю., Саидова М.А., Осмоловская Ю.Ф., Ганаев К.Г., Ширяев А.А., Меркулова И.А., Певзнер Д.В., Терещенко С.Н. Результаты 12-месячного наблюдения после имплантации центрифугального устройства механической поддержки левого желудочка. Кардиоваскулярная терапия и профилактика. 2025;24(8):4420. https://doi.org/10.15829/1728-88002025-4420. EDN: UPEAHQ
For citation:
Shakhramanova Zh.A., Narusov O.Yu., Saidova M.A., Osmolovskaya Yu.F., Ganaev K.G., Shiryaev A.A., Merkulova I.A., Pevsner D.V., Tereschenko S.N. Twelve-month follow-up after implantation of a centrifugal-flow left ventricular assist device. Cardiovascular Therapy and Prevention. 2025;24(8):4420. (In Russ.) https://doi.org/10.15829/1728-88002025-4420. EDN: UPEAHQ
JATS XML

























































