Перейти к:
Прогностическое значение фибрилляции предсердий на разных этапах длительного амбулаторного наблюдения больных, перенесших острое нарушение мозгового кровообращения (по данным регистра РЕГИОН-М)
https://doi.org/10.15829/1728-8800-2025-4505
EDN: NWZYNO
Аннотация
Цель. Изучить прогностическую значимость фибрилляции предсердий (ФП) при длительном наблюдении больных, перенесших острое нарушение мозгового кровообращения (ОНМК).
Материал и методы. Исследование проведено в рамках проспективной части ретро-проспективного регистра РЕГИОН-М (РЕГИстр больных, перенесших Острое Нарушение мозгового кровообращения и госпитализированных в Московский стационар). Были включены 684 пациента, выписанных из стационара с подтвержденным диагнозом ОНМК в 2012-2017гг, прикрепленных к городской поликлинике. Медиана наблюдения составила 5,0 [2,0;6,8] лет. Наличие ФП устанавливалось на основании диагноза во время нахождения больного в стационаре и/или при первом визите в поликлинику после выписки из стационара. Первичной конечной точкой была смерть от всех причин. Проведен анализ прогностической роли ФП за весь период наблюдения от момента выписки из стационара до 2022г.
Результаты. Больные с ФП составили 29,2% (200 человек). Сравнение группы больных с ФП и без ФП показало, что больные с ФП были старше и характеризовались более высокой степенью коморбидности. Наличие ФП оказывало парадоксальное положительное влияние на риск смерти (отношение рисков — hazard ratio (HR) 0,998 (95% доверительный интервал (ДИ): 0,996-1,000), p=0,017). В связи с этим было высказано предположение, что влияние ФП на накопленное выживание носило непропорциональный характер, т.е. менялась с течением времени. Поэтому был оценен вклад ФП в показатели риска смерти отдельно для трех временных периодов наблюдения: раннее амбулаторное наблюдение — от момента выписки до контакта 2017-2018гг; промежуточное — от момента предыдущего наблюдения (2017 или 2018гг) до мая 2020г; отсроченное — с 2020 по 2022гг. Отмечено, что различия риска смерти у больных с ФП и без ФП были достоверными лишь в первые два периода наблюдения: в раннем — HR 1,003 (95% ДИ: 1,000-1,005) (p=0,016) и в промежуточном — HR 1,004 (95% ДИ: 1,001-1,007) (p=0,016). В отсроченном периоде наблюдения достоверных различий в риске смерти больных с ФП и без ФП отмечено не было, поэтому в многофакторный регрессионный анализ фактор ФП включен не был.
Заключение. ФП отрицательно влияет на риск смерти в течение первых 3-4 лет после перенесенного ОНМК. После этого ФП утрачивает самостоятельную прогностическую значимость.
Ключевые слова
Для цитирования:
Марцевич С.Ю., Загребельный А.В., Кутишенко Н.П., Драпкина О.М. Прогностическое значение фибрилляции предсердий на разных этапах длительного амбулаторного наблюдения больных, перенесших острое нарушение мозгового кровообращения (по данным регистра РЕГИОН-М). Кардиоваскулярная терапия и профилактика. 2025;24(9):4505. https://doi.org/10.15829/1728-8800-2025-4505. EDN: NWZYNO
For citation:
Martsevich S.Yu., Zagrebelny A.V., Kutishenko N.P., Drapkina O.M. Prognostic value of atrial fibrillation at different stages of longterm outpatient followup in patients after cerebrovascular accident (based on the REGIONM registry). Cardiovascular Therapy and Prevention. 2025;24(9):4505. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4505. EDN: NWZYNO
Введение
Роль фибрилляции предсердий (ФП) в возникновении кардиоэмболического мозгового инсульта (МИ) хорошо известна [1]. По данным ряда исследований МИ, вызванные ФП, составляют от 10 до 25% среди всех случаев МИ [2] и протекают более тяжело, чем атеросклеротические МИ [3]. Данные о роли ФП после перенесенного МИ противоречивы. Одни исследователи считают, что ФП и после перенесенного МИ является прогностически неблагоприятным заболеванием и ассоциирована с повышенным риском смерти [4], другие считают, что сама по себе ФП, развившаяся после МИ, не является независимым предиктором неблагоприятного исхода [5]. Некоторые исследователи даже сомневаются в необходимости антикоагулянтной терапии при ФП, развившейся после МИ [6]. Отечественные работы, посвященные прогностической роли ФП после перенесенного МИ, практически отсутствуют.
Цель исследования — изучить прогностическую значимость ФП в отношении риска смерти при длительном наблюдении больных, перенесших острое нарушение мозгового кровообращения (ОНМК), используя данные регистра ОНМК РЕГИОН-М (РЕГИстр больных, перенесших Острое Нарушение мозгового кровообращения и госпитализированных в Московский стационар).
Материал и методы
Исследование было проведено в рамках проспективной части регистра РЕГИОН-М, протокол которого был неоднократно описан ранее [7][8]. В исследование были включены 684 пациента, выписанные после перенесенного ОНМК в период с 1 января 2012г по 30 апреля 2017г из городской клинической больницы им. Ф. И. Иноземцева г. Москвы с подтвержденным диагнозом ОНМК, прикрепленных к городской поликлинике № 64 г. Москвы. Схема исследования представлена на рисунке 1.
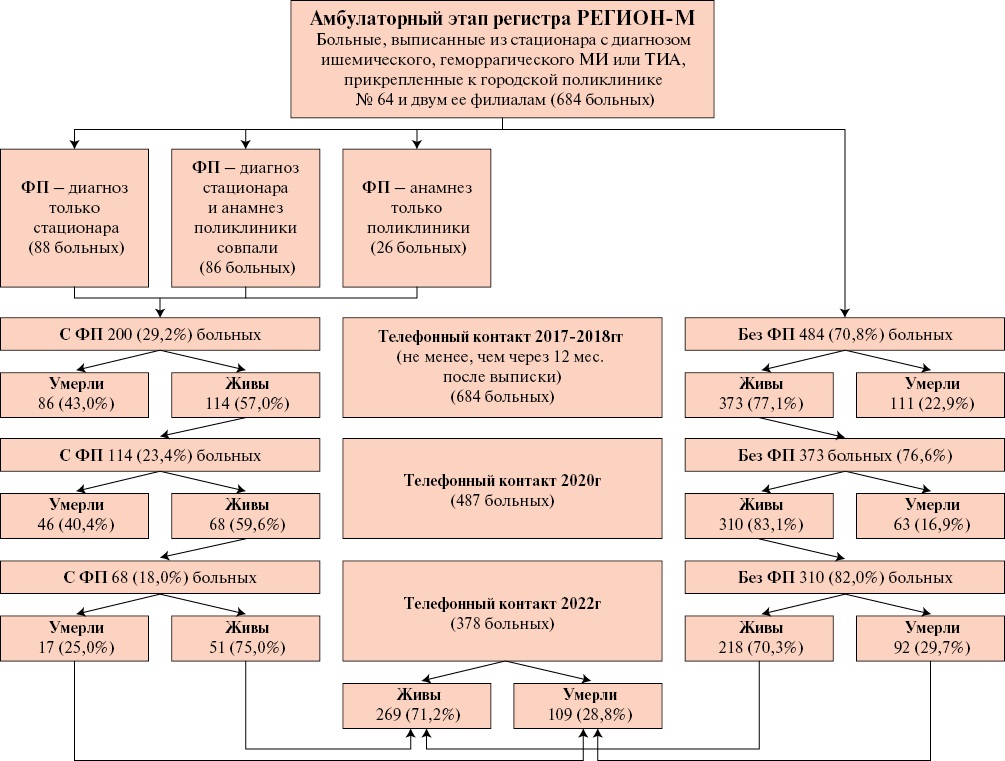
Рис. 1 Схема исследования.
Примечание: МИ — мозговой инсульт, ТИА — транзиторная ишемическая атака, ФП — фибрилляция предсердий, РЕГИОН-М — РЕГИстр больных, перенесших Острое Нарушение мозгового кровообращения и госпитализированных в Московский стационар.
Протокол исследования был одобрен независимым Этическим комитетом ФГБУ "НМИЦ ТПМ" Минздрава России.
После первого визита в поликлинику статус пациента определяли по данным телефонного контакта с пациентом, а в случае смерти — с родственниками. Согласие на телефонный контакт и на обработку персональных данных, полученных при телефонном звонке, больной подписывал при обращении в поликлинику во время первого визита или при диспансерном наблюдении. Кроме того, использовали данные системы ЕМИАС (Единая медицинская информационно-аналитическая система) для определения статуса больного. Результаты вносили в специально разработанную карту контакта с пациентом в разные периоды наблюдения, а в дальнейшем − в электронную базу данных регистра. Лиц с неустановленным жизненным статусом на момент периода наблюдения с 2017 по 2022гг не было, т.е. отклик больных составил 100%. Медиана наблюдения составила 5,0 [ 2,0;6,8] лет.
Наличие ФП устанавливалось на основании диагноза при нахождении больного в стационаре и/или при первом визите в поликлинику после выписки из стационара.
В дальнейшем сравнивали исходы заболевания у больных с ФП и у больных без ФП. Первичной конечной точкой была избрана смерть от всех причин.
Статистический анализ. Статистическая обработка полученных данных выполнена с использованием программы IBM SPSS Statistics 23 (IBM Corp., США). Основные характеристики всех пациентов и включенных в группы исследования больных с ФП и без ФП, а также умерших и выживших пациентов получены с использованием методов описательной статистики для определения средних значений и стандартного отклонения количественных показателей при нормальном распределении дисперсии. При распределении, отличном от нормального, определяли медианы (Me) и интерквартильный размах (Q25; Q75). Нормальность распределения проверялась с помощью критерия Колмогорова-Смирнова. Номинальные качественные показатели представлены в абсолютных значениях и в процентном соотношении.
Для сравнения средних величин использовали t-критерий для независимых выборок, при сравнении данных с распределением, отличным от нормального, использовали критерий Манна-Уитни (U-критерий), для оценки статистической значимости различий двух или нескольких относительных показателей использовался критерий согласия χ² Пирсона. Дискретные величины сравнивали с использованием критерия χ² с поправкой на непрерывность по Йетсу. Если число ожидаемых случаев в одной из сравниваемых групп было <5, для оценки уровня значимости различий применялся точный критерий Фишера.
Для определения риска развития первичной конечной точки (смерть от всех причин) для всех пациентов с ФП и без ФП, а также для оценки влияния заранее определённых независимых переменных (предикторов) на этот риск, использовали модель пропорциональных рисков — регрессию Кокса. При применении регрессии Кокса оценивался ряд критериев [9]. В модель Кокса включали переменные, которые различались при анализе с использованием критерия χ² Пирсона у выживших и умерших пациентов с достоверностью р≤0,1. Перед включением в модель Кокса переменные проверяли на наличие взаимосвязи между ними и при наличии высокой взаимосвязи ≥0,7 предполагалось исключение менее значимого предиктора.
Для оценки динамики показателей риска смерти от всех причин у пациентов с ФП и без ФП были построены кривые Каплана-Мейера для всего периода наблюдения с определением достоверности различий между кривыми с помощью анализа в модели регрессии Кокса. Различия считались достоверными при уровне значимости р<0,05 [10].
Результаты
На рисунке 1 видно, что всего больных с ФП оказалось 200 (29,2%) человек, которых выделили в следующие подгруппы: 88 (44,0%) больных, у которых ФП отмечена только в диагнозе стационара, 86 (43,0%) — и в диагнозе стационара, и в диагнозе поликлиники на момент первого визита, 26 (13%) — только в диагнозе поликлиники и не было в диагнозе стационара. У 484 (70,8%) пациентов указание на ФП отсутствовало.
Сравнение группы больных с ФП и без ФП представлено в таблице 1, из которой следует, что больные с ФП были старше и характеризовались более высокой степенью коморбидности.
Таблица 1
Основные гендерно-возрастные и клинико-анамнестические характеристики больных с ФП и без ФП, амбулаторный этап наблюдения до 2022г
|
Факторы (предикторы) |
Все (n=684) |
Без ФП (n=484) |
ФП (n=200) |
р |
|
|
Возраст, лет, Ме [ 25%;75%] |
Мужчины |
66 [ 57;76] |
62 [ 53;73] |
74 [ 67;80] |
<0,001** |
|
Женщины |
75 [ 62;81] |
69 [ 58;80] |
78 [ 72;84] |
0,012** |
|
|
Все больные |
70 [ 59;79] |
66 [ 56;77] |
77 [ 69;83] |
<0,001** |
|
|
Пол |
Мужчины, n (%) |
286 (41,8) |
215 (44,4) |
71 (35,5) |
0,031 |
|
Женщины, n (%) |
398 (58,2) |
269 (55,6) |
129 (64,5) |
||
|
Тип инсульта |
Геморрагический, n (%) |
52 (7,6) |
41 (8,5) |
11 (5,5) |
0,002 |
|
Ишемический, n (%) |
514 (75,1) |
346 (71,5) |
168 (84,0) |
||
|
ТИА, n (%) |
118 (17,3) |
97 (20,0) |
21 (10,5) |
||
|
ТИА в анамнезе, n (%) |
22 (3,2) |
17 (3,5) |
5 (2,5) |
0,495 |
|
|
ОНМК в анамнезе, n (%) |
121 (17,7) |
73 (15,1) |
48 (24,0) |
0,005 |
|
|
Наличие ИБС, n (%) |
423 (61,8) |
262 (54,1) |
161 (80,5) |
<0,001 |
|
|
Стенокардия в диагнозе, n (%) |
182 (26,6) |
106 (21,9) |
76 (38,0) |
<0,001 |
|
|
ИМ в анамнезе, n (%) |
84 (12,3) |
44 (9,1) |
40 (20,0) |
<0,001 |
|
|
ХСН, n (%) |
103 (15,1) |
47 (9,7) |
56 (28,0) |
<0,001 |
|
|
АГ, n (%) |
574 (83,9) |
399 (82,4) |
175 (87,5) |
0,101 |
|
|
Порок сердца в анамнезе, n (%) |
13 (1,9) |
4 (0,8) |
9 (4,5) |
0,003* |
|
|
Операции на сонных артериях, n (%) |
33 (4,8) |
19 (3,9) |
14 (7,0) |
0,088 |
|
|
СД в анамнезе, n (%) |
122 (17,8) |
85 (17,6) |
37 (18,5) |
0,771 |
|
|
Заболевания ЩЖ, n (%) |
91 (13,3) |
58 (12,0) |
33 (16,5) |
0,114 |
|
|
Ожирение, n (%) |
68 (9,9) |
50 (10,3) |
18 (9,0) |
0,597 |
|
|
Гиперлипидемия в диагнозе, n (%) |
66 (9,6) |
42 (8,7) |
24 (12,0) |
0,181 |
|
|
Хронические заболевания легких, n (%) |
122 (17,8) |
71 (14,7) |
51 (25,5) |
0,001 |
|
|
Анемия в диагнозе, n (%) |
39 (5,7) |
27 (5,6) |
12 (6,0) |
0,891 |
|
|
Массивные кровотечения в анамнезе, n (%) |
6 (0,9) |
4 (0,8) |
2 (1,0) |
1,0* |
|
|
Хронические болезни почек, n (%) |
97 (14,2) |
65 (13,4) |
32 (16,0) |
0,900 |
|
|
Онкологические заболевания, n (%) |
64 (9,4) |
42 (8,7) |
22 (11,0) |
0,343 |
|
|
Тромбозы, n (%) |
8 (1,2) |
6 (1,2) |
2 (1,0) |
1,0* |
|
|
Статус на 2022г |
Жив |
269 (39,3) |
218 (45,0) |
51 (25,5) |
<0,0001 |
|
Умер |
415 (60,7) |
266 (55,0) |
149 (74,5) |
||
|
Время наблюдения до 2022г, мес., Ме [ 25%;75%] |
64 [ 25;84] |
69 [ 40;87] |
41 [ 11;70] |
0,177** |
|
Примечание: * — точный критерий Фишера, ** — U-критерий Манна-Уитни для независимых выборок; АГ — артериальная гипертония, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, Ме — медиана [интерквартильный размах], ОНМК — острое нарушение мозгового кровообращения, СД — сахарный диабет 2 типа, ТИА — транзиторная ишемическая атака, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность, ЩЖ — щитовидная железа.
В таблице 2 показаны основные характеристики живых и умерших больных на амбулаторном этапе наблюдения за период до 2022г. Обращает на себя внимание тот факт, что среди умерших пациентов мужчины и женщины были старше, больше было пациентов, имевших в анамнезе ишемическую болезнь сердца, стенокардию, инфаркт миокарда (ИМ), ФП, сахарный диабет 2 типа и ожирение. Доля умерших и живых, кроме того, зависела от типа перенесенного МИ.
Таблица 2
Основные гендерно-возрастные и клинико-анамнестические характеристики живых и умерших больных на амбулаторном этапе наблюдения до 2022г
|
Факторы (предикторы) |
Статус на 2022 |
||||
|
Все (n=684) |
Жив (n=269) |
Умер (n=415) |
Р |
||
|
Возраст, лет, Me [ 25%;75%] |
Мужчины |
66 [ 57;76] |
57 [ 50;66] |
71 [ 61;79] |
<0,001** |
|
Женщины |
75 [ 62;81] |
64 [ 54;76] |
78 [ 69;85] |
<0,001** |
|
|
Все больные |
70 [ 59;79] |
61 [ 52;71] |
76 [ 66;82] |
<0,001** |
|
|
Пол |
Мужчины, n (%) |
286 (41,8) |
115 (42,8) |
171 (41,2) |
0,689 |
|
Женщины, n (%) |
398 (58,2) |
154 (57,2) |
244 (58,8) |
||
|
Тип инсульта |
Ишемический, n (%) |
514 (75,1) |
174 (64,7) |
340 (81,9) |
<0,001 |
|
Геморрагический, n (%) |
52 (7,6) |
23 (8,6) |
29 (7,0) |
||
|
ТИА, n (%) |
118 (17,3) |
72 (26,8) |
46 (11,1) |
||
|
ТИА в анамнезе, n (%) |
22 (3,2) |
13 (4,8) |
9 (2,2) |
0,054 |
|
|
ОНМК в анамнезе, n (%) |
121 (17,7) |
52 (19,3) |
69 (16,6) |
0,365 |
|
|
Наличие ИБС, n (%) |
423 (61,8) |
140 (52,0) |
283 (68,2) |
<0,001 |
|
|
Стенокардия в диагнозе, n (%) |
182 (26,6) |
53 (19,7) |
129 (31,1) |
0,001 |
|
|
ИМ в анамнезе, n (%) |
84 (12,3) |
18 (6,7) |
66 (15,9) |
<0,001 |
|
|
ХСН, n (%) |
103 (15,1) |
41 (15,2) |
62 (14,9) |
0,914 |
|
|
ФП в анамнезе, n (%) |
200 (29,2) |
51 (19,0) |
149 (35,9) |
<0,001 |
|
|
АГ, n (%) |
574 (83,9) |
225 (83,6) |
349 (84,1) |
0,875 |
|
|
Порок сердца в анамнезе, n (%) |
13 (1,9) |
4 (1,5) |
9 (2,2) |
0,582* |
|
|
Операции на сонных артериях, n (%) |
33 (4,8) |
15 (5,6) |
18 (4,3) |
0,460 |
|
|
СД в анамнезе, n (%) |
122 (17,8) |
37 (13,8) |
85 (20,5) |
0,025 |
|
|
Заболевания ЩЖ, n (%) |
91 (13,3) |
41 (15,2) |
50 (12,0) |
0,230 |
|
|
Ожирение, n (%) |
68 (9,9) |
37 (13,8) |
31 (7,5) |
0,007 |
|
|
Гиперлипидемия в диагнозе, n (%) |
66 (9,6) |
32 (11,9) |
34 (8,2) |
0,109 |
|
|
Хронические заболевания легких, n (%) |
122 (17,8) |
42 (15,6) |
80 (19,3) |
0,109 |
|
|
Анемия в диагнозе, n (%) |
39 (5,7) |
14 (5,2) |
25 (6,0) |
0,652 |
|
|
Массивные кровотечения в анамнезе, n (%) |
6 (0,9) |
2 (0,7) |
4 (1,0) |
1,0* |
|
|
Хронические болезни почек, n (%) |
97 (14,2) |
38 (14,1) |
59 (14,2) |
0,974 |
|
|
Онкологические заболевания, n (%) |
64 (9,4) |
25 (9,3) |
39 (9,4) |
0,964 |
|
|
Тромбозы, n (%) |
8 (1,2) |
2 (0,7) |
6 (1,4) |
0,490* |
|
|
Время наблюдения до 2022г, мес., Ме [ Q25;Q75] |
64 [ 25;84] |
81 [ 70;95] |
36 [ 9;63] |
<0,001** |
|
Примечание: * — точный критерий Фишера, ** — U-критерий Манна-Уитни для независимых выборок; АГ — артериальная гипертония, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, Ме — медиана [интерквартильный размах], ОНМК — острое нарушение мозгового кровообращения, СД — сахарный диабет 2 типа, ТИА — транзиторная ишемическая атака, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность, ЩЖ — щитовидная железа.
На рисунке 2 представлены данные регрессионной модели пропорциональных рисков Кокса, определяющей факторы, влияющие на риск смерти. В анализ были включены основные гендерно-возрастные и клинико-анамнестические характеристики выживших и умерших больных за период наблюдения до 2022г. Отрицательное влияние на риск смерти оказывали возраст и тип перенесенного инсульта (рисунок 2), положительное влияние — наличие ФП.
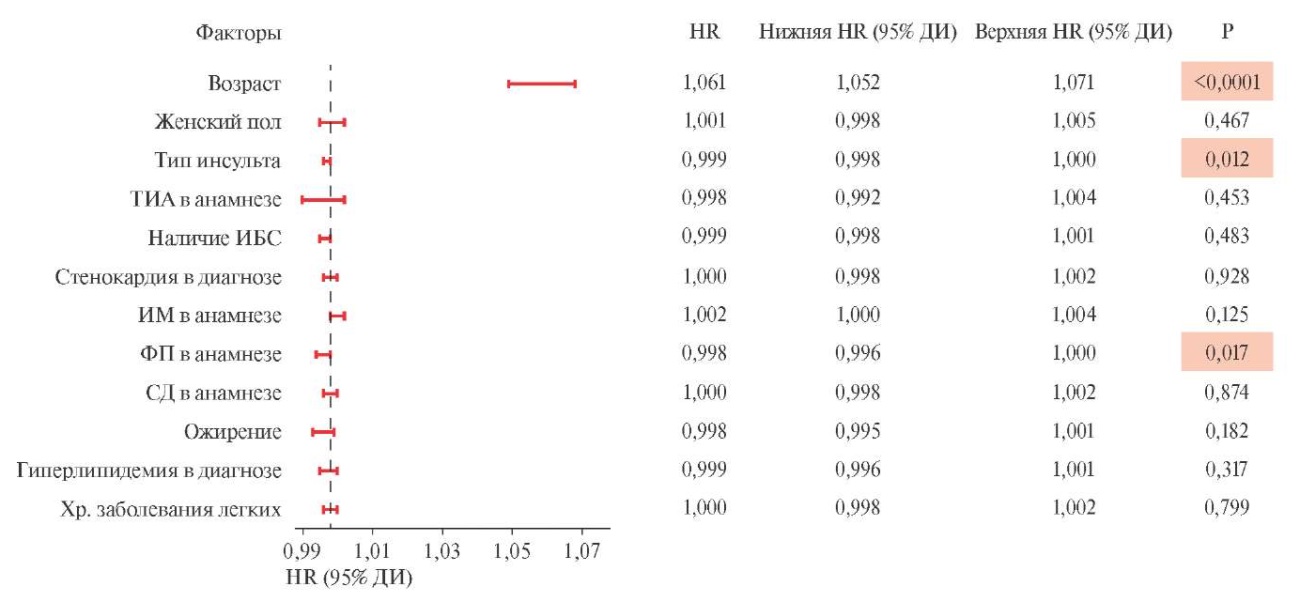
Рис. 2 Регрессионная модель пропорциональных рисков Кокса. Факторы риска отдаленной смерти у больных, амбулаторный этап наблюдения до 2022г.
Примечание: данные скорректированы: пол по возрасту, все остальные по полу и возрасту. ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, МИ — мозговой инсульт, СД — сахарный диабет 2 типа, ТИА — транзиторная ишемическая атака, ФП — фибрилляция предсердий, HR — hazard ratio (отношение рисков).
На рисунке 3 представлены кривые выживаемости Каплана-Мейера для больных с ФП и без ФП за весь период наблюдения. При этом виде анализа риск смерти больных с наличием ФП существенно превышал таковой у лиц без наличия ФП. Обращает на себя внимание, что кривая выживания Каплана-Майера больных с ФП носила непропорциональный характер, т.е. влияние фактора ФП менялось в течение всего периода наблюдения. Об этом свидетельствует тот факт, что кривые первоначально достаточно отчетливо расходились, а затем, к концу периода наблюдения, стали постепенно сближаться.
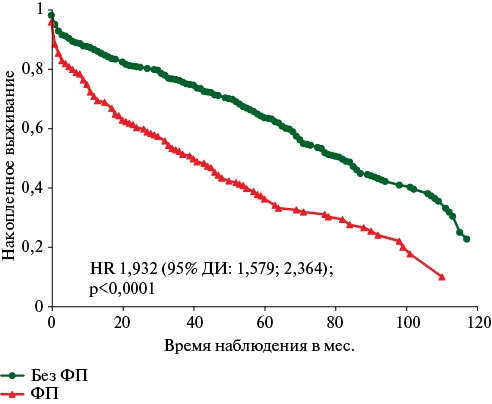
Рис. 3 Функция выживания больных с ФП и без ФП, перенесших ОНМК, амбулаторный этап наблюдения от выписки до 2022г.
Примечание: ОНМК — острое нарушение мозгового кровообращения, ФП — фибрилляция предсердий, ДИ — доверительный интервал, HR — hazard ratio (отношение рисков).
Все это свидетельствовало о том, что применение анализа пропорциональных рисков Кокса за весь период наблюдения было некорректным. Поэтому влияние ФП на исходы болезни было решено оценивать раздельно за 3 периода наблюдения:
- Раннее амбулаторное наблюдение — от момента выписки до контакта (2017г или 2018г, если больной был выписан в 2017г);
- Промежуточное амбулаторное наблюдение — от момента предыдущего наблюдения (2017г или 2018г) до мая 2020г;
- Отсроченное амбулаторное наблюдение (с 2020 по 2022гг).
На рисунке 4 представлены кривые выживаемости Каплана-Мейера больных с ФП и больных без ФП для всех трех отмеченных выше периодов наблюдения. Хорошо видно, что различия выживаемости были достоверными лишь в первые два периода наблюдения. В заключительный период наблюдения (2020-2022гг) никаких различий выживаемости больных с ФП и без ФП отмечено не было. На рисунке 4 представлено, как менялся показатель риска смерти (HR — hazard ratio) за указанные выше периоды наблюдения.
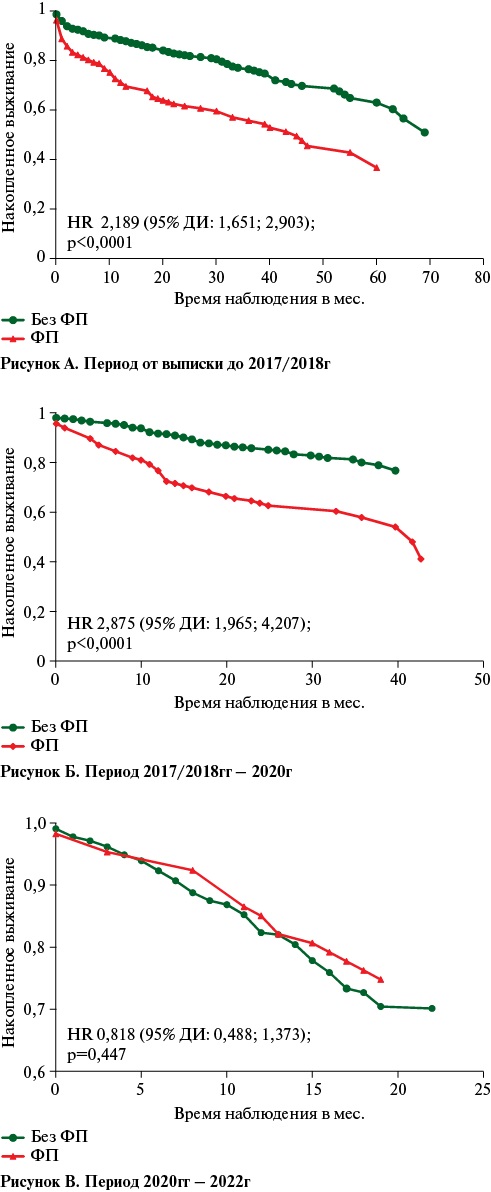
Рис. 4 Функция выживания больных с ФП и без ФП, перенесших ОНМК, в разные периоды амбулаторного этапа наблюдения: А — раннее амбулаторное наблюдение — от момента выписки до контакта (2017г или 2018г, если больной был выписан в 2017г); Б — промежуточное амбулаторное наблюдение — от момента предыдущего наблюдения (2017г или 2018г) до мая 2020г; В — отсроченное амбулаторное наблюдение (с 2020 по 2022гг).
Примечание: ФП — фибрилляция предсердий, ДИ — доверительный интервал, HR — hazard ratio (отношение рисков).
Регрессионный анализ пропорциональных рисков Кокса, выполненный раздельно для трех названных выше периодов наблюдения, показал, что ФП являлась независимым предиктором риска смерти лишь на первых двух этапах наблюдения (HR 1,003 (95% ДИ: 1,000-1,005) (p=0,016) в период раннего амбулаторного наблюдения и HR 1,004 (95% ДИ: 1,001-1,007) (p=0,016) в период промежуточного амбулаторного наблюдения от контакта 2017г до контакта 2020г, за период 2020-2022гг влияние ФП на риск смерти не было достоверным. На заключительном периоде наблюдения достоверное влияние на показатели риска смерти оказывали лишь возраст и наличие сахарного диабета 2 типа (таблица 3).
Таблица 3
Факторы риска смерти у больных, выписанных из стационара после перенесенного ОНМК в разные периоды амбулаторного этапа наблюдения (регрессионная модель пропорциональных рисков Кокса)
|
Факторы (предикторы) |
HR |
95,0% ДИ |
p |
|
|
Раннее амбулаторное наблюдение — период от выписки из стационара до контакта 2017г |
||||
|
Возраст |
1,064 |
1,049 |
1,079 |
<0,001 |
|
Женский пол |
1,000 |
0,995 |
1,006 |
0,929 |
|
Тип инсульта |
0,998 |
0,997 |
1,000 |
0,070 |
|
ТИА в анамнезе |
0,996 |
0,984 |
1,009 |
0,569 |
|
ОНМК в анамнезе |
0,997 |
0,993 |
1,000 |
0,033 |
|
Наличие ИБС |
1,001 |
0,999 |
1,004 |
0,301 |
|
Стенокардия в диагнозе |
1,000 |
0,998 |
1,002 |
0,958 |
|
ФП в анамнезе |
1,003 |
1,000 |
1,005 |
0,016 |
|
Операции на сонных артериях |
0,992 |
0,982 |
1,001 |
0,092 |
|
Ожирение |
1,000 |
0,995 |
1,004 |
0,819 |
|
Гиперлипидемия в диагнозе |
0,995 |
0,990 |
1,000 |
0,058 |
|
Промежуточное амбулаторное наблюдение — период от контакта 2017г до контакта 2020г |
||||
|
Возраст |
1,069 |
1,047 |
1,092 |
0,000 |
|
Женский пол |
0,995 |
0,990 |
1,000 |
0,067 |
|
Наличие ИБС |
0,998 |
0,995 |
1,002 |
0,388 |
|
Стенокардия в диагнозе |
1,002 |
0,998 |
1,006 |
0,260 |
|
ИМ в анамнезе |
1,002 |
0,998 |
1,006 |
0,337 |
|
ХСН в анамнезе |
0,998 |
0,994 |
1,001 |
0,228 |
|
ФП в анамнезе |
1,004 |
1,001 |
1,007 |
0,016 |
|
СД в анамнезе |
1,002 |
0,999 |
1,005 |
0,265 |
|
Отсроченное амбулаторное наблюдение — период наблюдения от контакта 2020г до контакта 2022г |
||||
|
Возраст |
1,004 |
1,000 |
1,007 |
0,000 |
|
Женский пол |
0,995 |
0,989 |
1,000 |
0,995 |
|
ИМ в анамнезе |
1,003 |
0,999 |
1,008 |
0,114 |
|
СД в анамнезе |
1,004 |
1,000 |
1,007 |
0,033 |
Примечание: данные скорректированы по возрасту (кроме самого возраста) и полу (для пола — только по возрасту). ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, СД — сахарный диабет 2 типа, ТИА — транзиторная ишемическая атака, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность, ДИ — доверительный интервал, HR — hazard ratio (отношение рисков).
Обсуждение
Проведенный традиционными методами анализ пропорциональных рисков Кокса продемонстрировал, что наличие ФП после перенесенного МИ парадоксально оказывает положительное влияние на показатели риска смерти. При этом кривые Каплана-Мейера свидетельствовали о том, что больные с ФП умирают значительно чаще, чем больные без ФП. Однако форма кривых выживаемости Каплана-Мейера больных с ФП за длительный период после перенесенного МИ с медианой наблюдения 5 лет позволила предположить непропорциональность влияния ФП на показатели выживаемости на протяжении всего периода наблюдения [11]. Иными словами, это свидетельствовало о том, что влияние ФП на показатели риска смерти менялось на протяжении всего периода наблюдения. В таких случаях применение метода пропорциональных рисков Кокса может давать неверный результат [12], о чем упоминали многие специалисты по доказательной медицине [13].
Существует целый ряд статистических подходов к оценке динамики влияния фактора на исход заболевания при проспективном наблюдении [14]. Мы использовали самый простой, разделив весь период наблюдения на несколько этапов, соответствовавших времени, когда осуществлялся контакт с больным, и оценили HR отдельно на каждом из этих этапов. После этого стало очевидным, что прогностическая роль ФП менялась на протяжении периода наблюдения, и к концу этого периода этот показатель утратил свою прогностическую значимость.
Выше отмечалось, что данные о прогностической роли ФП после перенесенного МИ являются достаточно противоречивыми. Некоторые ученые однозначно считают, что любая ФП, независимо от времени возникновения, после МИ свидетельствует о повышенном риске смерти [4]. Другие особо выделяют ФП, выявленную после МИ (ФПВПИ, или Atrial Fibrillation Detected After Stroke, AFDAS), причем ее роль также оценивается неоднозначно. Так, Bhatla A, et al. считают ФПВПИ прогностически неблагоприятной [15]. Другие, напротив, считают ФПВПИ прогностически незначимой [16] или прогностически более благоприятной, чем ФП у больных, не переносивших МИ [17]. Третьи выделяют два вида ФП после МИ: нейрогенную и кардиогенную, при этом первую считают более благоприятной [6]. Эти же авторы выражают сомнения в целесообразности назначения антикоагулянтов при ФПВПИ.
К сожалению, дизайн многих названных выше исследований, большинство из которых были ретроспективными, не позволяет однозначно утверждать, что ФП развилась именно после МИ. Возможно, ФП, особенно пароксизмальная, у ряда больных существовала и до МИ, но не была выявлена [18]. Нельзя исключить, что именно этим объясняется противоречивость суждений о прогностической роли ФП после МИ. Аналогичная ситуация наблюдалась и в нашем исследовании. Возможно, что в подгруппу больных, у которых ФП была зарегистрирована только в поликлинике, могли войти как больные с вновь развившейся ФП, так и больные, у которых ФП ранее диагностировалась в поликлинике, но по каким-то причинам не была выявлена в стационаре. Больные с ФПВПИ могли войти и во вторую подгруппу. Поэтому можно предположить, что группа из 200 больных с ФП была неоднородной. Если учесть приведенные выше литературные данные, можно полагать, что больные с ранее существовавшей ФП умерли в более ранние сроки. Больные же с ФПВПИ имели более благоприятный прогноз и жили дольше. Этим может объясняться выявленная нами непропорциональность влияния ФП на риск смерти. Возможно и другое объяснение этого факта: по мере старения больных сам по себе возраст и сопутствующие заболевания, в первую очередь сахарный диабет 2 типа, начинали "перевешивать" риск смерти, обусловленный ФП, который становился статистически незначимым. Таким образом, результаты настоящего исследования диктуют необходимость проведения длительных проспективных исследований с возможностью более точной оценки времени возникновения ФП по отношению к развитию МИ.
Ограничение исследования. Имеющиеся у нас данные не позволили разграничить ФП, имевшуюся у больных до перенесенного МИ, и ФП, развившуюся во время и после МИ. Причины смерти больных далеко не всегда могли быть установлены, поэтому в качестве первичной конечной точки использовали смерть от всех причин. Аналогично, мы не имели возможности установить факт перенесения повторного МИ. Сведения о терапии антикоагулянтами были неполными, что не позволило оценить их влияние на прогноз жизни у больных с ФП.
Заключение
Проведенный в рамках проспективного наблюдения регистра РЕГИОН-М анализ показал, что прогностическая роль ФП в отношении риска смерти после перенесенного МИ меняется с течением времени. Отрицательную независимую прогностическую роль ФП играет только в течение первых 3-4 лет. После этого ФП утрачивает самостоятельную прогностическую значимость, уступая место другим факторам — возрасту и сахарному диабету 2 типа.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Kannel WB, Wolf PA, Benjamin EJ, Levy D. Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: populationbased estimates. Am J Cardiol. 1998;82(8A):2N9N. doi:10.1016/s00029149(98)005839.
2. Марцевич С. Ю., Кутишенко Н. П., Суворов А. Ю. и др. от имени рабочей группы исследования "ЛИС2". Анализ анамнестических факторов и их роль в определении ближайшего (госпитального) прогноза у больных, перенесших мозговой инсульт или транзиторную ишемическую атаку. Результаты регистра ЛИС2. Российский кардиологический журнал. 2015;(6):149. doi:10.15829/15604071201561419. EDN: TZIYDF.
3. Alberts M, Chen YW, Lin JH, et al. Risks of Stroke and Mortality in Atrial Fibrillation Patients Treated With Rivaroxaban and Warfarin. Stroke. 2020;51(2):54955. doi:10.1161/STROKEAHA. 119.025554.
4. Nishimura T, Matsugaki R, Fujimoto K, Matsuda S. Atrial fibrillation and mortality after ischemic stroke: An observational study using an insurance claim database. Clin Neurol Neurosurg. 2023:235:108042. doi:10.1016/j.clineuro.2023. 108042.
5. Tracz J, GorczycaGłowacka I, Rosołowska A, WożakowskaKapłon B. LongTerm Outcomes after Stroke in Patients with Atrial Fibrillation: A Single Center Study. Int J Environ Res Public Health. 2023;20(4):3491. doi:10.3390/ijerph20043491.
6. Cerasuolo JO, Cipriano LE, Sposato LA. The complexity of atrial fibrillation newly diagnosed after ischemic stroke and transient ischemic attack: advances and uncertainties. Curr Opin Neurol. 2017;30(1):2837. doi:10.1097/WCO.0000000000000410.
7. Марцевич С. Ю., Кутишенко Н. П., Лукьянов М. М. и др. Госпитальный регистр больных, перенесших острое нарушение мозгового кровообращения (РЕГИОН): портрет заболевшего и исходы стационарного этапа лечения. Кардиоваскулярная терапия и профилактика. 2018;17(6):328. doi:10.15829/17288800201863238. EDN: YPXLCP.
8. Марцевич С. Ю., Толпыгина С. Н., Чернышева М. И. и др. Приверженность посещению поликлиники и отдаленная выживаемость больных, перенесших острое нарушение мозгового кровообращения, по данным амбулаторного этапа наблюдения в регистре РЕГИОНМ (посещение поликлиники и выживаемость после инсульта). Рациональная Фармакотерапия в Кардиологии. 2021;3(17):38693. doi:10.20996/1819644620210604. EDN: XTMLMH.
9. Шарашова Е. Е., Холматова К. К., Горбатова М. А. и др. Применение анализа выживаемости в здравоохранении с использованием пакета статистических программ SPSS. Наука и Здравоохранение. 2017;(5):528.
10. Шарашова Е. Е., Холматова К. К., Горбатова М. А. и др. Гржибовский А. М. Применение регрессии Кокса в здравоохранении с использованием пакета статистических программ SPSS. Наука и Здравоохранение. 2017;(6):527.
11. Hess KR. Graphical methods for assessing violations of the proportional hazards assumption in Cox regression. Stat Med. 1995;14(15):170723. doi:10.1002/sim.4780141510.
12. Jiang N, Wu Y, Li C. Limitations of using COX proportional hazards model in cardiovascular research. Cardiovasc Diabetol. 2024;23:219. doi:10.1186/s12933024023022.
13. Gregson J, Sharples L, Stone GW, et al. Nonproportional Hazards for TimetoEvent Outcomes in Clinical Trials: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;74(16):210212. doi:10.1016/j.jacc.2019.08.1034.
14. Klinglmüller F, Fellinger T, König F, et al. A Comparison of Statistical Methods for TimeToEvent Analyses in Randomized Controlled Trials Under NonProportional Hazards. Stat Med. 2025;44(5):e70019. doi:10.1002/sim.70019.
15. Bhatla A, Borovskiy Y, Katz R, et al. Stroke, Timing of Atrial Fibrillation Diagnosis, and Risk of Death. Neurology. 2021;96(12):e165562. doi:10.1212/WNL.0000000000011633.
16. Cigdem I, Zekeriya D, Beste O, et al. Is there any difference in mortality rates of atrial fibrillation detected before or after ischemic stroke? Ideggyogy Sz. 2023;76(1112):36571. English. doi:10.18071/isz.76.0365.
17. Chang YK, Hsu CC, Huang CT, et al. Differences between atrial fibrillation diagnosed before and after stroke: A large realworld cohort study. PLoS One. 2024;19(8):e0308507. doi:10.1371/journal.pone.0308507.
18. Lip GY, Hee FL. Paroxysmal atrial fibrillation. QJM. 2001; 94(12):66578. doi:10.1093/qjmed/94.12.665.
Об авторах
С. Ю. МарцевичРоссия
Сергей Юрьевич Марцевич — д.м.н., профессор, г.н.с., руководитель отдела профилактической фармакотерапии
Петроверигский пер., 10, стр. 3, Москва, 101990
А. В. Загребельный
Россия
Александр Васильевич Загребельный — к.м.н., в.н.с. отдела профилактической фармакотерапии
Петроверигский пер., 10, стр. 3, Москва, 101990
Н. П. Кутишенко
Наталья Петровна Кутишенко — — д.м.н., руководитель лаборатории фармакоэпидемиологических исследований отдела профилактической фармакотерапии
Петроверигский пер., 10, стр. 3, Москва, 101990
О. М. Драпкина
Россия
Оксана Михайловна Драпкина — д.м.н., профессор, академик РАН, директор
Петроверигский пер., 10, стр. 3, Москва, 101990
Дополнительные файлы
Что известно о предмете исследования?
- Фибрилляция предсердий после перенесенного мозгового инсульта является прогностически неблагоприятной и ассоциирована с повышенным риском смерти.
Что добавляют результаты исследования?
- Фибрилляция предсердий после перенесенного мозгового инсульта является прогностически неблагоприятной и ассоциирована с повышенным риском смерти на более ранних этапах амбулаторного наблюдения, а на более поздних — утрачивает самостоятельную прогностическую значимость, уступая место другим факторам.
Рецензия
Для цитирования:
Марцевич С.Ю., Загребельный А.В., Кутишенко Н.П., Драпкина О.М. Прогностическое значение фибрилляции предсердий на разных этапах длительного амбулаторного наблюдения больных, перенесших острое нарушение мозгового кровообращения (по данным регистра РЕГИОН-М). Кардиоваскулярная терапия и профилактика. 2025;24(9):4505. https://doi.org/10.15829/1728-8800-2025-4505. EDN: NWZYNO
For citation:
Martsevich S.Yu., Zagrebelny A.V., Kutishenko N.P., Drapkina O.M. Prognostic value of atrial fibrillation at different stages of longterm outpatient followup in patients after cerebrovascular accident (based on the REGIONM registry). Cardiovascular Therapy and Prevention. 2025;24(9):4505. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4505. EDN: NWZYNO
JATS XML

























































