Перейти к:
Роль ультразвуковой оценки мышечной массы в диагностике саркопении у пациентов с сердечно-сосудистыми заболеваниями
https://doi.org/10.15829/1728-8800-2021-2699
Аннотация
Цель. Изучить преимущества оценки мышечной массы с помощью ультразвукового метода в сравнении с антропометрическим для ранней диагностики саркопении у пациентов >45 лет.
Материал и методы. В исследование включено 79 пациентов в возрасте 45-89 лет с ишемической болезнью сердца, артериальной гипертонией, сахарным диабетом 2 типа, хронической сердечной недостаточностью, ожирением 1-3 ст. Диагностика артериальной гипертонии проводилась по рекомендациям Европейского (2018) и Российского (2019) кардиологических обществ; ишемическая болезнь сердца — по клиническим рекомендациям Российского кардиологического общества (2020). Диагностика саркопении проводилась по критериям EWGSOP (European Working Group on Sarcopenia in Older People) 2010, и рекомендациям EWGSOP2 2018. Мышечная масса (ММ) определялась двумя способами: 1 — измерением толщины прямой мышцы живота (ТПМЖ) с помощью ультразвукового метода; и 2 — с помощью измерения мышечной окружности плеча (МОП) и окружности голени (ОГ). Мышечная сила определялась методом кистевой динамометрии. Мышечная функция определялась с помощью теста “скорости ходьбы на 4 м”.
Результаты. Исследование показало, что у пациентов >45 лет, госпитализированных в отделение неотложной кардиологии, индекс массы тела превышал значение 25 кг/м2 в 88,6% случаев. Частота выявления саркопении различной степени тяжести составила 55,7% (44 случая из 79). Различия в ТПМЖ, МОП и ОГ между группами пациентов без саркопении и с саркопенией были статистически значимы (р<0,001), но были меньше пороговых только для показателя ТПМЖ. Значения ТПМЖ прогрессивно снижались с нарастанием тяжести саркопении; статистически достоверно отличались при всех стадиях от показателя ТПМЖ у пациентов без саркопении (р<0,001) вне зависимости от индекса массы тела. Уменьшение ОГ ниже пороговых значений, определяющих снижение ММ, наблюдалось только при тяжелой саркопении, а МОП — и у мужчин, и у женщин только при тяжелой стадии саркопении. Статистически достоверных отличий для МОП и ОГ в зависимости от стадий саркопении у пациентов с избыточной массой тела и ожирением не выявлено.
Заключение. Определение ММ путем измерения ТПМЖ с помощью ультразвукового метода в сравнении с антропометрическим позволяет диагностировать саркопению у пациентов >45 лет с сердечно-сосудистыми заболеваниями и ожирением на более ранних стадиях и своевременно рекомендовать профилактические мероприятия.
Ключевые слова
Для цитирования:
Ерохина А.С., Голованова Е.Д., Милосердов М.А. Роль ультразвуковой оценки мышечной массы в диагностике саркопении у пациентов с сердечно-сосудистыми заболеваниями. Кардиоваскулярная терапия и профилактика. 2021;20(3):2699. https://doi.org/10.15829/1728-8800-2021-2699
For citation:
Erokhina A.S., Golovanova E.D., Miloserdov M.A. Ultrasound assessment of muscle mass in the diagnosis of sarcopenia in cardiovascular patients. Cardiovascular Therapy and Prevention. 2021;20(3):2699. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2699
Введение
Связанные со старением инволютивные процессы постепенной утраты мышечной массы (ММ) (“саркопения”), формально являясь физиологическими, могут существенно отягощать состояние больного. Европейская группа по саркопении у пациентов старшего возраста EWGSOP, 2010 (European Working Group on Sarcopenia in Older People, 2010), определила её как “синдром, характеризующийся прогрессирующей и генерализованной утратой ММ и силы с увеличением риска неблагоприятных событий, таких как инвалидизация, ухудшение качества жизни и смерть” и рекомендовала для диагностики саркопении и определения ее степени тяжести (пресаркопения, саркопения, тяжелая саркопения) использовать 3 параметра, или критерия: 1 — определение ММ, 2 — мышечной силы (МС) и 3 — мышечной функции (МФ), причем 1 критерий является обязательным для верификации саркопении любой стадии [1][2].
Международные эксперты прогнозируют, что саркопения к 2045г станет общемировой проблемой [3] в связи с резким увеличением числа лиц пожилого и старческого возрастов. По прогнозам к 2025г рост доли лиц старших возрастных групп составит 1,2 млрд, к 2050г >2 млрд [4]. В России в настоящее время >20% населения имеют возраст >60 лет, к 2030г по прогнозам лица >65 лет составят четверть населения РФ [5]. Термин “саркопения” в сентябре 2016г был официально включен в 10-ю международную классификацию болезней (МКБ10) под кодом М 62.84 [6], а в 2018г в обновленном консенсусе EWGSOP2 (European Working Group on Sarcopenia in Older People 2) саркопению рекомендовано рассматривать как “прогрессирующее и генерализованное заболевание скелетных мышц, которое связано с повышенной вероятностью неблагоприятных исходов, включая падения, переломы, физическую инвалидность и смерть” [7]. В EWGSOP2 (2018) для “вероятной саркопении” рекомендовано использовать критерий снижения МС, но, тем не менее, для подтверждения диагноза саркопении необходимо документировать снижение ММ, а для тяжелой саркопении — снижение всех 3 показателей: МС, ММ, МФ (или физической работоспособности).
В рутинной клинической практике не всегда возможно определение ММ с использованием дорогостоящих и не всегда доступных врачам первичного звена методик: индекса аппендикулярной скелетной мускулатуры по данным двухфотонной рентгеновской абсорбциометрии (ДРА), магнитнорезонансной или компьютерной томографии и др., т.к. они требуют значительных финансовых и временных затрат, ограничены при проведении скрининговых исследований из-за лучевой нагрузки на пациента [8]. Существующий метод биоимпедансного анализа (БИА), основанный на пропускании переменного тока определенной частоты через массив тканей с измерением их сопротивления, являясь альтернативой ДРА, тем не менее, имеет некоторые ограничения: наличие отеков у пациентов с хронической сердечной недостаточностью (ХСН), заболеваниями почек, может влиять на результаты измерения, он противопоказан пациентам с кардиостимуляторами [8]. Данные методики имеют и свои ограничения у тяжелых пациентов с ограниченной транспортабельностью.
В амбулаторной практике чаще используют антропометрические методы измерения ММ с оценкой таких показателей, как окружность голени (ОГ), окружность средней трети плеча (ОП) и толщина его кожно-мышечной складки, индекс массы тела (ИМТ). При проведении комплексного гериатрического осмотра, являющегося в настоящее время основным “инструментом и методическим пособием” для гериатра, терапевта, врача общей практики, в соответствии с “Клиническими рекомендациями для диагностики старческой астении” [9], предложен целый ряд шкал и тестов: определение МС с помощью кистевой динамометрии, МФ с помощью SPPB-тестов и ММ с помощью антропометрических методов (измерение ОГ или ОП). Потеря эластичности кожи и перераспределение жировой ткани с возрастом приводят к неправильной интерпретации данных, полученных при измерении окружностей конечностей или толщины складки кожи у людей >60 лет [2]. У пациентов старших возрастных групп, как с нормальным ИМТ, так и избыточной массой тела или ожирением, ОП и ОГ долго остаются в пределах пороговых значений для данного показателя, поэтому потеря ММ проходит незаметно и ранняя стадия саркопении, как правило, не диагностируется. И только когда у пациента снижается МС и МФ, что фиксируется изменением скорости походки и силы “сжатия кисти” пациент попадает в “поле зрения” гериатра или терапевта, т.е. уже на стадии саркопении или тяжелой саркопении, и, соответственно, начинает получать терапию. Таким образом, в настоящий момент в рутинной клинической практике диагностика ранних степеней саркопении, а именно пресаркопении, является проблематичной из-за сложности трактовки антропометрических данных для определения ММ, особенно у пациентов с ожирением, распространенность которого увеличивается с возрастом. Соответственно, ранняя профилактика этого заболевания часто не проводится, если нет возможности определения ММ с помощью БИА, ДРА или других высокотехнологичных методов [9].
Современные исследования продемонстрировали возможности использования ультразвуковых методов (УЗМ) для определения ММ путем измерения толщины прямой мышцы живота (ТПМЖ) [10, 11]. Эксперты EWGSOP2 2018 пришли к заключению, что ультразвуковая оценка ММ — надежный и достоверный метод у пожилых людей с сопутствующей патологией [12]. Данный метод обладает большей точностью по сравнению с антропометрическими методами, большей доступностью, чем ДРА и БИА, т.к. может проводиться практически “всем” пациентам без ограничений. Поэтому дальнейшие исследования по разработке нормативных значений для различных стадий саркопении и ее ранней диагностике с помощью неинвазивного, удобного в амбулаторной практике метода являются перспективным направлением, т.к. позволят проводить раннюю профилактику этого заболевания у пациентов различных возрастных групп. Авторами настоящего исследования был разработан и запатентован способ диагностики саркопении у лиц пожилого и старческого возраста (RU 2713905 C1) для верификации стадии процесса и решения задач профилактики.
Цель — изучить преимущества оценки ММ с помощью УЗМ в сравнении с антропометрическим для ранней диагностики саркопении у пациентов >45 лет.
Материал и методы
Исследование было проведено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской Декларации. Протокол исследование одобрен независимым Этическим комитетом ФГБОУ ВО “Смоленский государственный медицинский университет” Минздрава России (Протокол № 1 от 20.05.2020г). До включения в исследование у всех участников было получено письменное информированное добровольное согласие на участие в исследовании.
В исследование включены 79 пациентов в возрасте 45-89 лет (средний возраст 60,2±4,3 лет), находившихся на стационарном лечении в отделении неотложной кардиологии Клинической больницы скорой медицинской помощи (г. Смоленск) с 01.10.2019 по 01.10.2020гг: в зрелом возрасте (45-59 лет) — 23 чел. (29,1%); пожилом (60- 74 лет) — 33 чел. (41,8%); старческом (75-89 лет) — 23 чел. (29,1%); 39 мужчин (49,4%) и 40 женщин (50,6%) с ишемической болезнью сердца (ИБС) (стенокардией напряжения 1-4 функционального класса, постинфарктным кардиосклерозом), артериальной гипертонией (АГ) 2-3 ст., сахарным диабетом 2 типа в стадии компенсации, ХСН I-IIА стадии, ожирением 1-3 ст. Диагностика АГ проводилась по рекомендациям Европейского (2018) и Российского (РКО) (2019) кардиологических обществ; ИБС и ХСН — по клиническим рекомендациям РКО 2020. Критерии исключения: инфаркт миокарда и нарушение мозгового кровотока в предшествующие 6 мес., печеночная и почечная недостаточность, неопластические процессы, тяжелые заболевания центральной и периферической нервной системы.
У всех пациентов проанализирована медицинская документация (истории болезни, амбулаторные карты); проведено антропометрическое исследование (рост, вес, ИМТ, ОП, ОГ, мышечная окружность плеча — МОП).
Определение ММ первым способом проводилось путем измерения ТПМЖ на ультразвуковом сканере Philips HD11XE линейным датчиком L9-3. Ультразвуковое сканирование проводили линейным датчиком (частота от 5 до 10 МГц), расположенным перпендикулярно поверхности верхней трети живота по срединной линии (от мечевидного отростка до пупка) на расстоянии 2-3 см справа от пупка. На экране в В-режиме визуализировалась поверхность кожи, подкожная жировая клетчатка, граница раздела между жировой тканью и прямой мышцей живота, прямая мышца живота, граница между прямой мышцей живота и брюшной полостью. Измерения проводились непосредственно с экрана монитора с помощью электронных штангенциркулей; определялось расстояние (в мм) от границы между жировой тканью и прямой мышцей живота до границы между прямой мышцей живота и брюшной полостью (рисунок 1). Референсными значениями ТПМЖ были: у мужчин — 11,1 мм, у женщин — 8,3 мм [10].
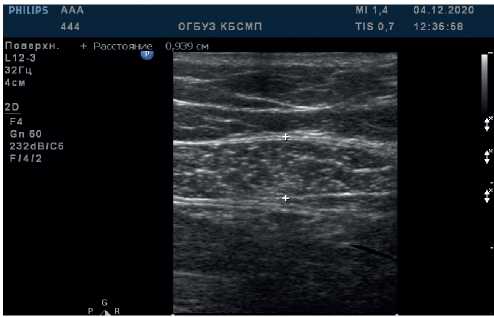
Рис. 1 Ультразвуковое сканирование ТПМЖ.
Измерение ММ вторым способом проводилось с использованием показателей МОП (MAMC — mid-arm muscle circumference), и ОГ (CC — calf circumference). МОП определялась в средней трети плеча (середина между плечевым суставом и локтевым сгибом) путем измерения ОП и толщины кожно-мышечной складки трицепса. Расчет производился по формуле: МОП, см = ОП -3,14 × толщину кожно-мышечной складки трицепса [13]. ОГ измерялась в точке ее наибольшей окружности в положении пациента сидя с согнутыми коленными и голеностопными суставами под углом 90○ . Для выявления саркопении при антропометрии использовались значения: ОГ <31 см, для МОП <21,1 см у мужчин, <19,9 см у женщин), согласно критериям EWGSOP 2 [7].
МС определялась методом кистевой динамометрии с помощью динамометра (ДК-100-э). Снижение МС фиксировалось при значениях: у мужчин <27 кг, у женщин <16 кг [7][14]. Использовались три попытки на доминантной руке, за результат принималось среднее значение. МФ определялась с помощью теста “скорости ходьбы на 4 м” (скорость походки <0,8 м/с расценивалась как сниженная) [7]. После определения ММ, МС и МФ саркопения различной степени тяжести была выявлена у 44 (55,7%) пациентов, у 35 (44,3%) обследованных саркопения не обнаружена.
Диагностика стадий саркопении проводилась по критериям EWGSOP 2010: пресаркопения — снижение ММ при нормальных значениях МС и МФ, саркопения — при снижении ММ и МС или МФ; тяжелая саркопения — при снижении ММ, МС, МФ.
Статистический анализ результатов исследования проводился с использованием программы STATISTICA-10.0. Описательная статистика для количественных данных приведена в виде медианы, 25-го и 75-го квартилей (Me [Q25; Q75]), для качественных данных — в виде абсолютных значений и относительных частот (n, %). Сравнение количественных показателей между двумя группами проводилось с использованием критерия Манна-Уитни, для множественных сравнений применялся критерий Краскела-Уоллиса. Сравнение групп по качественным показателям проводилось с использованием двустороннего точного критерия Фишера, корреляционный анализ — с использованием коэффициента Спирмена. Различия считались статистически значимыми при p<0,05.
Результаты
В таблице 1 представлена сравнительная характеристика коморбидной патологии в зависимости от отсутствия (1 группа) или наличия саркопении (2 группа) у обследованных пациентов. Группы были сопоставимы по полу и ИМТ. Пациенты с саркопенией были старше, что связано с увеличением частоты саркопении у лиц старшего возраста. Так, например, в ряде эпидемиологических исследований было показано, что частота саркопении может увеличиваться до 50% к 80 годам, а в возрасте до 60 лет достигать 11-13% [15]. Анализ коморбидной патологии показал, что у пациентов с саркопенией достоверно чаще выявлялись: ИБС, АГ и ХСН. Наличие более тяжелой кардиоваскулярной патологии у пациентов с саркопенией, соответственно будет влиять на смертность и инвалидизацию: риск смерти от всех причин у лиц с саркопенией составляет 2,32 в сравнении с пациентами без саркопении (р<0,05) [16]. Среди обследованных пациентов обеих групп нормальный ИМТ имели только 9 (11,4%) чел., 40 (50,6%) чел. имели избыточную массу тела (ИМТ 25-29,9 кг/м2 ), а 30 (38,0%) чел. — ожирение 1-3 ст. (ИМТ >30 кг/м2 ). Таким образом, 88,6% обследованных пациентов имели ИМТ >25 кг/м2 и только у 11,4% не выявлено ожирения или избыточной массы тела. ИМТ >25 кг/м2 у пациентов с саркопенией был достоверно выше, чем у пациентов без саркопении. Ожирение и избыточная масса тела являются фактором риска кардиоваскулярных осложнений и часто выявляются у пациентов, госпитализируемых в кардиологические стационары с АГ и ИБС.
Таблица 1
Сравнительная характеристика коморбидной патологии у исследуемых пациентов в зависимости от отсутствия (1 группа) или наличия (2 группа) саркопении (n, %, Me [Q25; Q75])
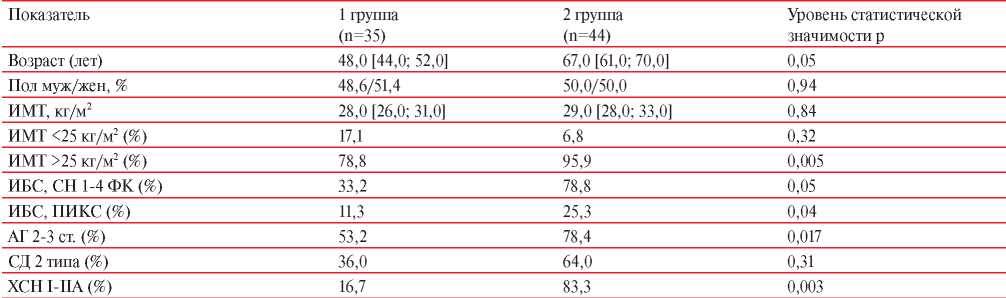
Примечание: АГ — артериальная гипертония, ИМТ — индекс массы тела, ПИКС — постинфарктный кардиосклероз, СД — сахарный диабет, СН — стенокардия напряжения, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность.
Проведено сравнение медианы значений показателей ММ у пациентов исследуемых групп, полученных с помощью УЗМ и антропометрического метода (таблица 2).
Таблица 2
Значения ТПМЖ, МОП и ОГ у пациентов с отсутствием (1 гр.) или наличием (2 гр.) саркопении (Me [Q25; Q75])

Примечание: МОП — мышечная окружность плеча, ОГ — окружность голени, ТПМЖ — толщина прямой мышцы живота.
Несмотря на то, что разница в средних значениях между группами без саркопении и с саркопенией была статистически значима, по всем показателям, определяющим ММ, только для ТПМЖ у пациентов с саркопенией значения были ниже пороговых, необходимых для верификации дефицита ММ. МОП и ОГ были достоверно снижены у пациентов с саркопенией в сравнении с пациентами без саркопении. Однако их медианы не достигали порогового уровня, необходимого для подтверждения снижения ММ.
При исследовании саркопении различной степени тяжести с использованием определения ММ с помощью УЗМ оказалось, что выше референсных значений ТПМЖ (у мужчин — 11,1 мм, у женщин — 8,3 мм) [10] выявлена у 35 (44,3%) из 79 чел., снижение ТПМЖ — у 44 (55,7%), из которых: у 12 (27,3%) диагностирована пресаркопения, у 11 (25,0%) — саркопения (у 5 — снижение ММ + МС; у 6 — снижение ММ + МФ), у 21 (47,7%) — тяжелая саркопения. Статистически значимых различий между пресаркопенией, саркопенией, тяжелой саркопенией в зависимости от пола выявлено не было (р≥0,05).
На рисунке 2 представлены данные исследования зависимости значений ТПМЖ от стадии саркопении.
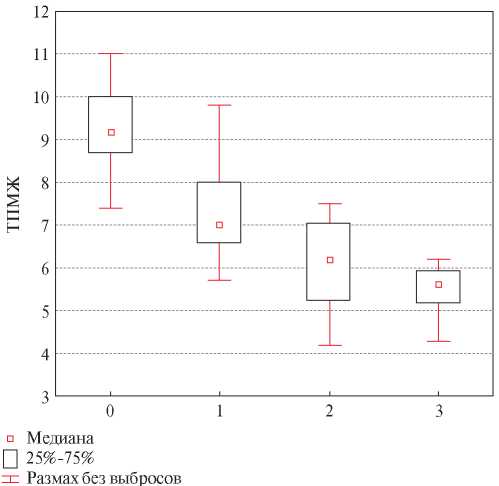
Рис. 2 ТПМЖ (мм) в зависимости от стадии саркопении: 0 — без саркопении, 1 — пресаркопения, 2 — саркопения, 3 — тяжелая саркопения.
Различия в ТПМЖ у пациентов с различной степенью тяжести саркопении оказались статистически значимы (p<0,001). У пациентов без саркопении ТПМЖ составила 9,2 [ 8,4; 10,0 ] мм; в группе пресаркопении — 7,0 [ 6,6; 8,0 ] мм; в группе саркопении — 6,2 [ 5,2; 7,1 ] мм; в группе тяжелой саркопении — 5,6 [ 5,2; 5,9 ] мм. Таким образом, значения ТПМЖ прогрессивно снижались с нарастанием тяжести саркопении.
Проведено множественное сравнение показателей, определяющих диагностику саркопении (ТПМЖ, МОП, ОГ, МС, МФ) в зависимости от степени тяжести, в сравнении с пациентами без саркопении, с учетом ИМТ. Данные представлены в таблице 3.
Таблица 3
Показатели ММ, МС и МФ у пациентов без саркопении, с пресаркопенией, саркопенией, тяжелой саркопенией (Me [Q25; Q75])

Примечание: ИМТ — индекс массы тела, МОП — мышечная окружность плеча, ОГ — окружность голени, ТПМЖ — толщина прямой мышцы живота.
Анализ множественных сравнений продемонстрировал, что снижение ТПМЖ происходило у всех пациентов с саркопенией и не зависело от наличия ожирения или избыточной массы тела. Степень снижения была наибольшей у пациентов с тяжелой саркопенией, в меньшей степени она снижалась у лиц с пресаркопенией, однако вне зависимости от степени тяжести ТПМЖ была меньше пороговых значений, необходимых для верификации снижения ММ — 1 критерия в диагностике саркопении, согласно критериям 2010. ОГ снижена была только при тяжелой степени саркопении, в целом по группе. У пациентов с избыточной массой тела и ожирением разница по степени тяжести была недостоверна, и все значения превышали 31 см. Аналогичным образом, значения МОП были снижены и у женщин (<19,9 см), и у мужчин (<21,1 см) с тяжелой саркопенией.
У мужчин обнаружена статистически значимая умеренная прямая корреляционная взаимосвязь между ОП (абс.) и ТПМЖ (R=0,39; p=0,03). У женщин такой связи не выявлено (R=0,07; p=0,71), что объясняется, по-видимому, более развитой ММ у мужчин.
Обсуждение
Известно, что МС и ММ начинают постепенно уменьшаться уже после 30 лет, а после 60 лет этот процесс ускоряется, что приводит к изменениям композиционного состава тела в сторону преобладания жировой массы, т.е. саркопения — это, в первую очередь, возраст-зависимый процесс. Однако ее ассоциация с сердечно-сосудистыми заболеваниями, ожирением и др. состояниями увеличивает риск госпитализации и стоимость лечения, а также риск падений и переломов (EWGSOP2, 2018). Еще в 1998г Richard Baumgartner описал саркопению как “синдром, ассоциированный с повышенным риском падений, снижением минеральной плотности костной ткани, ухудшением качества жизни, функциональных способностей и, соответственно, ростом летальности пациентов”. Наличие саркопении влияет на показатели смертности от всех причин, особенно с увеличением возраста [15]. Ранняя диагностика саркопении в рутинной клинической практике подразумевает использование определенных критериев, которые должны быть доступны для практического врача, воспроизводимы и достоверно отражать динамику процесса. В 2010г рекомендации EWGSOP в диагностике саркопении на 1 месте определяли критерий ММ, в 2018г в обновленном консенсусе EWGSOP2 (2018) для “вероятной” саркопении рекомендовано использовать критерий снижения МС, или “силы захвата кисти”; тем не менее, для подтверждения диагноза саркопении необходимо документально зафиксировать снижение ММ, для верификации тяжелой саркопении необходимо иметь снижение всех 3-х показателей — МС, ММ, МФ (или физической работоспособности). УЗМ является точным, надежным, доступным методом измерения ММ, сравнимым по достоверности с ДРА, магнитно-резонансной и компьютерной томографией, причем он позволяет оценить как качество, так и количество мышц. В рекомендациях 2018г предлагается проводить дополнительные обследования у пациентов с различным функциональным статусом и состоянием здоровья. Опросник SARC-F (Strength, Assistance with walking, Rising from chair, Climbing stairs and Falls), рекомендованный для скрининга саркопении, в основном позволяет выявлять тяжелые случаи [7].
В последнее время появился ряд работ по изучению использования УЗМ в диагностике саркопении: измерение толщины мышц, площади по перечного сечения, длины пучка, угла перистости и эхогенности [7]. Существуют единичные работы по оценке с помощью УЗМ мышц и толщины подкожной жировой клетчатки в области передней брюшной стенки. В В-режиме определяли ТПМЖ (в мм) в верхней трети живота по срединной линии
(от мечевидного отростка до пупка) на расстоянии 2-3 см справа от пупка. Авторами была проведена количественная оценка ММ у лиц обоего пола в возрасте от 20 до 40 лет и получены референсные значения ТПМЖ: у мужчин — 11,1 мм, у женщин — 8,3 мм [10]. Наши данные, полученные у пациентов без саркопении — 9,2 [ 8,4; 10,0 ] мм, сопоставимы с литературными, однако следует учесть тот факт, что средний возраст пациентов в наших исследованиях был выше — обследованы пациенты не только зрелого, но и пожилого возраста.
В организме человека различные группы мышц испытывают различную нагрузку. Мышцы голени и кисти тренируются “постоянно, в течение всей активной жизни”, а мышцы брюшного пресса — только при занятии определенными видами спорта или специальной гимнастикой. С позиций общебиологических закономерностей процессы деградации должны начинаться в первую очередь в тех органах или частях органа, которые в наименьшей степени подвержены нагрузке, т.е. детренированы. Саркопения — это многофакторный синдром, связанный с алиментарными факторами, изменениями гормонального фона, снижением способности мышечной ткани к регенерации и др. [15]. В молодом и среднем возрасте под влиянием физических нагрузок на мышечную ткань происходит формирование микротравмы, в эту область мигрируют стволовые клетки, которые приходят в активное состояние и начинают продуцировать разнообразные миогенные факторы, что приводит к слиянию мышечных волокон и стволовых клеток с формированием нового, увеличенного в объёме и обладающего большей силой мышечного волокна. В пожилом возрасте ввиду уменьшения физическойактивности способность мышечной ткани к гиперпластическим процессам снижается, происходит нарушение процессов гиперплазии, т.е. нарушается формирование нового мышечного волокна. Старение мышечной ткани у человека тесно связано с гиподинамией и детренированностью мышц. Зрелые мышечные волокна (продукт конечной дифференцировки), состоят из многоядерных клеток, которые не делятся, вследствие чего рост и регенерация осуществляется за счет пролиферации миогенных стволовых клеток — спутников, или сателлитов [17]. Количество этих клеток уменьшается при саркопении, а также наблюдается их жировое перерождение и как следствие, жировая инфильтрация мыщц. Возникает порочный круг — дисбаланс жировой и мышечной ткани затрудняет физическую активность и усиливает гиподинамию. Поэтому, когда клинически у пациента наблюдается снижение скорости походки, снижение силы “сжатия кисти”, можно констатировать, что процессы деградации мышечной ткани зашли достаточно далеко, что еще раз подчеркивает необходимость как можно более раннего начала профилактики, а именно на стадии пресаркопении, когда весь комплекс профилактических мероприятий (физические нагрузки, прием витамина D и др.) будет наиболее эффективным, т.к. истощение пула сателлитов, их способности к регенерации еще будут не так катастрофичны, как при тяжелой саркопении, когда возможности регенерации практически исчерпаны.
Заключение
У лиц >45 лет в исследуемой выборке с избыточной массой тела и ожирением показатели МОП и ОГ ниже значений, необходимых для верификации снижения ММ только у пациентов с тяжелой степенью саркопении.
Измерение ТПМЖ с помощью УЗМ продемонстрировало снижение показателя у всех пациентов с саркопенией вне зависимости от массы тела и прогрессивное снижение с увеличением стадии саркопении.
Верификация снижения ММ, подтвержденная с помощью динамики ТПМЖ, может способствовать диагностике саркопении на начальных стадиях и, соответственно, раннему назначению профилактической терапии.
Список литературы
1. Cruz-Jentoft AJ, Baeyens JP, Bauer JM, et al. Sarcopenia: European consensus on definition and diagnosis: report of the European Working Group on Sarcopenia in Older People. Age Ageing, 2010;39:412-23. doi:10.1093/ageing/afq034.
2. Зоткин Е. Г., Сафонова Ю. А., Шкиреева С.Ю. Возраст-ассоциированная саркопения: определение, диагностика и подходы к профилактике. Фарматека. 2013;2:33-8.
3. Давузов Р. Р., Сабиров И. С., Цой Л. Г. и др. Саркопенический синдром: современный взгляд на проблему (Обзор литературы). Вестник КРСУ. 2018;18(2):104-8.
4. Beard JR, Officer AM, Cassels AK, et al. The world report on ageing and health. The Gerontologist. 2016;56(2):163-6. doi:10.1093/geront/gnw037.
5. Дроздов А. В. Люди старше 60 лет составят более четверти населения России к 2030 году. ТАСС Электронный ресурс. https://tass.ru/obschestvo/5907395 (13 дек 2018).
6. Anker SD, Morley JE, von Haehling, et al. Welcome to the ICD10 code for sarcopenia. Cachexia, sarkopenia and muscle. 2016;7(5):512-4. doi:10.1002/jcsm.12147.
7. Alfonso JCJ, Gulistan B, Juergen MB, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. doi:10.1093/ageing/afy169.
8. Cruz-Jentoft AJ, Bahat G, Bauer J, et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31. doi:10.1093/ageing/afy169.
9. Ткачева О. Н., Котовская Ю. В., Рунихина Н. К. и др. Клинические рекомендации “Старческая астения”. Российский журнал гериатрической медицины. 2020;1:11-46. doi:10.37586/2686-8636-1-2020-11-46.
10. Ido A, Nakayama Y, Ishii K, et al. Ultrasound-derived abdominal muscle thickness better detects metabolic syndrome risk in obese patients than skeletal muscle index measured by dualenergy X-ray absorptiometry. PLoS One. 2015;10(12):0143858. doi:10.1371/journal.pone.0143858.
11. Sanada K, Kuchiki T, Miyachi M, et al. Effects of age on ventilator threshold and peak oxygen uptake normalized for regional skeletal muscle mass in Japanese men and women aged 20-80 years. Eur J Appl Physiol. 2007;99(5):475-83. doi:10.1056/NEJMc2001737.
12. Nijholt W, Scafoglieri A, Jager-Wittenaar H, et al. The reliability and validity of ultrasound to quantify muscles in older adults: a systematic review. J Cachexia Sarkopenia Muscle. 2017;8(5):702-12. doi:10.1002/jcsm.12210.
13. Akin S, Mucuk S, Ozturk A, et al. Muscle function-dependent sarcopenia and cut-off values of possible predictors in community-dwelling Turkish elderly: calf circumference, midarm muscle circumference and walking speed. Eur J Clin Nutr. 2015;69(10):1087-90. doi:10.1038/ejcn.2015.42.
14. Dodds RM, Syddall HE, Cooper R, et al. Grip strength across the life course: normative data from twelve British studies. PLoS One. 2014;9(12):113637. doi:10.1371/journal.pone.0113637.
15. Григорьева И. И., Раскина Т. А., Летаева М. В. и др. Саркопения: особенности патогенеза и диагностики. Фундаментальная и клиническая медицина. 2019;4(4):105-16. doi:10.23946/2500-0764-2019-4-4-105-116.
16. С. Н., Заводчиков А. А., Лаврухина А. А. и др. Клиническое значение саркопении и миопении. Клиническая геронтология. 2015;5(6):46-50.
17. Ryall JG, Schertzer JD, Lynch GS. Cellular and molecular mechanisms underlying agerelated skeletal muscle wasting and weakness. Biogerontology. 2008;9(4):213-28. doi:10.1007/s10522-008-9131-0.
Об авторах
А. С. ЕрохинаРоссия
Ерохина Анна Сергеевна — ассистент кафедры общей врачебной практики, поликлинической терапии с курсом гериатрии ФДПО.
Смоленск.
Тел.: +7 (960) 579-14-37
Е. Д. Голованова
Россия
Голованова Елена Дмитриевна — доктор медицинских наук, профессор, заведующая кафедрой общей врачебной практики, поликлинической терапии с курсом гериатрии ФДПО.
Смоленск.
М. А. Милосердов
Россия
Милосердов Максим Алексеевич — кандидат медицинских наук, ассистент кафедры неврологии и нейрохирургии.
Смоленск.
Рецензия
Для цитирования:
Ерохина А.С., Голованова Е.Д., Милосердов М.А. Роль ультразвуковой оценки мышечной массы в диагностике саркопении у пациентов с сердечно-сосудистыми заболеваниями. Кардиоваскулярная терапия и профилактика. 2021;20(3):2699. https://doi.org/10.15829/1728-8800-2021-2699
For citation:
Erokhina A.S., Golovanova E.D., Miloserdov M.A. Ultrasound assessment of muscle mass in the diagnosis of sarcopenia in cardiovascular patients. Cardiovascular Therapy and Prevention. 2021;20(3):2699. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2699
JATS XML

























































