Перейти к:
Ультраструктурные изменения митрального клапана при инфекционном эндокардите
https://doi.org/10.15829/1728-8800-2021-2742
Аннотация
Цель. С использованием оригинального метода, основанного на сканирующей электронной микроскопии с детекцией обратно отраженных (обратно рассеянных) электронов (back scattered electrons), изучить структурные особенности створок митральных клапанов при инфекционном эндокардите.
Материал и методы. Исследовано 9 митральных клапанов, извлеченных при хирургических вмешательствах в связи с развитием структурной несостоятельности вследствие инфекционного эндокардита (ИЭ). Образцы фиксировали в забуференном параформальдегиде с постфиксацией в тетраокиси осмия. После обезвоживания в спиртах возрастающей концентрации и ацетоне образцы помещали в эпоксидную смолу. После полимеризации смолы образцы шлифовали, а затем полировали до нужной глубины образца. Для повышения электронного контраста образцы обрабатывали спиртовым раствором уранилацетата в процессе обезвоживания и цитратом свинца по Рейнольдсу после полировки эпоксидных блоков. Образцы визуализировали посредством сканирующей электронной микроскопии с детекцией обратно рассеянных электронов при ускоряющем напряжении 15 кВ.
Результаты. Структурные нарушения створок, обусловленные развитием ИЭ, имели наибольшую выраженность в центральной части и в основании створок. Зоны некроза представляли собой обширные электронно-плотные образования, находящиеся в центральных слоях створок, либо смещенные в направлении желудочковой поверхности. Электронно-плотный материал в зоне некроза был слабо структурирован и содержал отдельные клетки и бактерии. Бактерии также присутствовали за пределами зоны некроза. Зоны некроза были окружены слоем видоизмененного внеклеточного матрикса, обычно покрытого слоем фибрина. Среди волокон внеклеточного матрикса отмечали наличие макрофагов, гладких миоцитов и фибробластов. Фибриновый слой, кроме указанных клеток, содержал большое количество кровеносных сосудов и часто был покрыт эндотелием.
Заключение. Инфицирование створок митрального клапана вызывает ответную реакцию, сопровождающуюся одновременным развитием воспалительных реакций и активизацией регенеративных процессов. Без адекватных регулирующих факторов процессы воспаления и образования соединительной ткани приводят к структурной и функциональной несостоятельности створок. Конкретными причинами могут явиться разрастание областей некроза и воспаления, отек тканей и нарушение ориентации волокон, разрыв створок.
Ключевые слова
Для цитирования:
Мухамадияров Р.А., Кутихин А.Г. Ультраструктурные изменения митрального клапана при инфекционном эндокардите. Кардиоваскулярная терапия и профилактика. 2021;20(3):2742. https://doi.org/10.15829/1728-8800-2021-2742
For citation:
Mukhamadiyarov R.A., Kutikhin A.G. Ultrastructural mitral valve abnormalities in infective endocarditis. Cardiovascular Therapy and Prevention. 2021;20(3):2742. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2742
Инфекционный эндокардит (ИЭ) занимает важную нишу в структуре сердечно-сосудистых заболеваний, что связано с высокой госпитальной и годичной летальностью. К причинам высокого уровня осложнений при ИЭ можно отнести отсутствие высокочувствительной ранней диагностики заболевания, изменение возрастного состава населения, появление широкого спектра бактерий, устойчивых к антибиотикам [1]. Успешность лечения ИЭ, кроме своевременной диагностики заболевания, зависит от координации усилий кардиологов, кардиоторакальных хирургов, специалистов по инфекционным заболеваниям и радиологов [1][2]. Вместе с тем, несмотря на использование новейших средств диагностики, даже в странах с высокоразвитой экономикой в 38,2% случаев ИЭ обнаруживается только на этапах аутопсии [3][4]. Сложившаяся ситуация требует принятия эффективных решений, в основе которых должны быть исследования, направленные на создание новых вариантов своевременной диагностики ИЭ и детальное изучение особенностей динамики процессов, протекающих в створках инфицированных клапанов, для выявления клеточных и молекулярных механизмов их развития. Многие исследователи отмечают важность гистологических исследований ИЭ и роль этих данных в усовершенствовании диагностики и терапии заболевания [5-8]. Вместе с тем, анализ современной литературы показывает, что имеется сравнительно немного исследований ИЭ, в основе которых лежит гистопатологический подход. Возможно, это частично связано с ограничениями самих гистологических методов, в которых для детальных исследований одного и того же образца требуется использование различных методов окраски, включающих, кроме рутинных, гистохимические и иммуногистохимические. Данные трансмиссионной электронной микроскопии (ТЭМ) в этих исследованиях практически отсутствуют, хотя именно они позволяют получить детальную картину процесса.
В представленной работе применяется оригинальный метод, основанный на использовании сканирующей электронной микроскопии с детекцией обратно отраженных (обратно рассеянных) электронов (back scattered electrons) после специально обработки и контрастирования образца [9]. Изображения, полученные этим методом, аналогичны полученным при ТЭМ и сопоставимы с электронограммами, приведёнными в электронно-микроскопических атласах биологических тканей. Несмотря на меньшую разрешающую способность метода, он позволяет уверенно идентифицировать клетки и структуры внеклеточного матрикса в составе створок митрального клапана (МК). Важным преимуществом использованного метода перед ТЭМ является возможность изучать всю область поперечного сечения створок клапана без приготовления ультратонких срезов и потери материала.
Поскольку для исследования структуры инфицированных клапанов сердца данный метод применяется впервые, на этом этапе было сосредоточено основное внимание на изучении общих морфологических закономерностей деструкции створок МК при ИЭ. Критериями выбора образцов служили: наличие структурных изменений створок с образованием зон некроза, разволокнение внеклеточного матрикса, изменение клеточного состава, наличие бактерий. Кроме того, были исключены образцы, структурные изменения которых могли быть обусловлены возможной видовой спецификой патогенной микрофлоры [5].
Цель: с использованием оригинального метода, основанного на сканирующей электронной микроскопии с детекцией обратно рассеянных электронов, изучить структурные особенности створок МК при ИЭ.
Материал и методы
Исследовано 9 МК, извлеченных при хирургических вмешательствах в связи с развитием структурной несостоятельности вследствие ИЭ. Когорту пациентов составили 5 женщин и 4 мужчины. Средний возраст пациентов на момент выполнения операций составил 51,4±8,9 год.
Исследование проводилось в соответствии с Хельсинкской декларацией о правах человека. Все больные подписали добровольное информированное согласие.
Критериями диагноза ИЭ были клинические проявления инфекционно-токсического синдрома до хирургических вмешательств, а также выявление микробных вегетаций при предоперационной эхокардиографии клапанов сердца. Результаты гемокультур в большинстве случаев были отрицательными, что являлось следствием предшествующего использования антимикробных препаратов широкого спектра действия. Для исключения случаев аутоиммунного поражения створок дополнительно выполняли ревизию образцов, в исследования брали только образцы, имеющие поверхностные вегетации. Предварительно выполняли рутинную макроскопическую оценку всех эксплантированных клапанов на содержание соединений кальция. При обнаружении крупных минеральных отложений, вызывающих деструкцию соединительно-тканных структур и значительно нарушающих послойное строение створок, образцы исключались из последующего анализа. Единичные мелкокристаллические включения не являлись препятствием для проведения исследования.
После извлечения фрагменты створок помещали в забуференный (рН 7,4) 10% водный раствор формалина (B06-003, БиоВитрум). После суточной фиксации (2 смены раствора формалина по 12 ч каждая) фрагменты створок постфиксировали 1% тетраоксидом осмия (OsO4, 19110, Electron Microscopy Sciences, EMS) в 0,1M фосфатном буфере в течение 12 ч, затем окрашивали 2% тетраоксидом осмия в течение 48 ч. Далее образцы обезвоживали в серии спиртов возрастающей концентрации, окрашивали 2% уранилацетатом (22400-2, EMS) в 95% этаноле (10 ч), обезвоживали 99,7% изопропанолом (06-002, БиоВитрум) в течение 5 ч и ацетоном (150495, ЛенРеактив) в течение 1 ч, пропитывали смесью ацетона с эпоксидной смолой Epon (Epon (14120, EMS) в соотношении 1:1 (10 ч), после чего переносили в свежую порцию эпоксидной смолы (на 24 ч) и далее проводили ее полимеризацию в емкостях FixiForm (Struers, США) в свежей порции смолы при 600С. После этого образцы в эпоксидных блоках подвергали шлифовке и полировке на установке TegraPol-11 (Struers, США). Шлифы контрастировали цитратом свинца (17810, EMS) в течение 7 мин путем нанесения раствора на поверхность шлифованного образца с последующей его отмывкой бидистиллированной водой. Далее проводили напыление поверхности эпоксидных блоков углеродом (толщина покрытия 10-15 нм) с помощью вакуумного напылительного поста (EM ACE200, Leica). Образцы просматривали с использованием сканирующего электронного микроскопа HitachiS-3400N (Hitachi, Япония) в режиме визуализации BSECOMP при ускоряющем напряжении 15 кВ.
На цифровых микрофотографиях исследовали общую структуру инфицированных митральных клапанов, нарушение структуры внеклеточного матрикса, идентифицировали различные клеточные популяции, определяли их локализацию и взаимодействие между собой и с другими элементами тканей.
Результаты
Как правило, проявления ИЭ имели наибольшую выраженность в центральной части и в основании створок. Чаще всего зоны некроза представляли собой обширные электронно-плотные образования в центральных слоях створок (рисунок 1 А, Б), либо были смещены в направлении желудочковой поверхности (рисунок 1 В, Г) и могли иметь массивные разрастания (рисунок 1 В). Часто вблизи областей со сплошным обширным некрозом наблюдали некрозы в виде небольших прерывистых участков (рисунок 1 Д). С обеих поверхностей зоны некроза были окружены внеклеточным матриксом и слоем структурированного фибрина, имеющего в своем составе клетки.
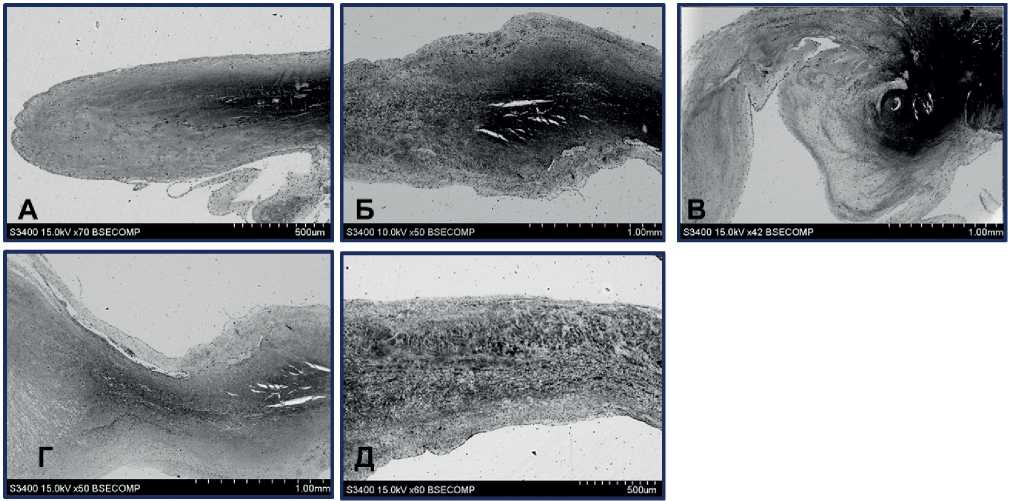
Рис. 1 Варианты локализации массивных зон эндокардита: А-В — массивный сплошной эндокардит во внутренней зоне створки (А — без разрастания, Б-В — с разрастанием створки); Г — поверхностная локализация зоны некроза, Д — диссеминированный некроз во внутренней части створки.
На участках с минимальными структурными повреждениями, например, в краевой зоне створки, показанной на рисунке 1 А, обе поверхности были покрыты эндотелием, имеющим высокую сохранность (рисунок 2). С предсердной стороны створок эндотелий образовывал плоскую поверхность, слой цитоплазмы в клетках тонкий, ядра уплощенные и погружены в субэндотелиальный слой (рисунок 2 А). Этот слой был представлен коллагеновыми волокнами, за которым находилась рыхлая соединительная ткань, содержащая макрофаги. Глубже лежали слои относительно сохранного внеклеточного матрикса. С противоположной, желудочковой поверхности, эндотелиальный слой имел более рыхлую структуру, ядра эндотелиоцитов немного выступали над поверхностью (рисунок 2 Б). Под эндотелием находился слой плотного внеклеточного матрикса. Область створки на границе между желудочковой и предсердной поверхностями также была покрыта эндотелием, близким по строению к лежащему на предсердной поверхности створок (рисунок 2 В).

Рис. 2 Строение эндотелиального слоя на желудочковой (А), предсердной (Б) и концевой (В) поверхностях створок относительно сохранного участка створки МК, приведенного на рисунке 1 А.
Зона некроза состояла из темного слабо структурированного материала с редко расположенными клетками, имеющими морфологическое сходство с гладкими миоцитами и макрофагами (рисунок 3 А). Часто отмечали присутствие бактерий (рисунок 3 Б, В), которые также встречались и за пределами зоны некроза. Между электронно-плотной зоной некроза и более светлой тканью резкой границы не было. В пограничной зоне наблюдали разрыхление коллагеновых волокон с нарушением их параллельной ориентации. В результате направление волокон было не параллельным, а перпендикулярным поверхности (рисунок 3 Г). В области условной границы между зоной некроза и соседним участком створки часто отмечали наличие гладкомышечных клеток (рисунок 3 Г, Д), окружающих зону некроза. В участках разрыхления коллагеновых волокон также присутствовали гладкие миоциты, которые ориентировались вдоль фибрилл матрикса (рисунок 3 Е).
За пределами зоны некроза в участках, содержащих коллагеновые волокна, бактерии находились либо во внутренней структуре волокон (рисунок 3 Д, Е), либо внутри и снаружи волокон (рисунок 3 Ж, З). В участках с разрыхленными волокнами внеклеточного матрикса и наличием бактерий часто наблюдали присутствие макрофагов (рисунок 3 З, И).

Рис. 3 Структура створок в областях с деструктивными изменениями внутренней части створок МК: А, Б — зона некроза с отдельными клетками или их остатками; В — зона некроза с большим количеством бактерий; Г — разволокнение коллагеновых волокон на границе с зоной некроза; Д, Е — локализация бактерий внутри волокон внеклеточного матрикса створок; Ж, З — локализация бактерий внутри волокон и свободном пространстве между ними; И — макрофаги в окружении бактерий.
Наружная поверхность створок, находящаяся над зонами с выраженной деструкцией, имела несколько вариантов организации. В первом варианте на поверхности находился слой эндотелия, лежащий на субэндотелиальном слое с относительно сохранными волокнами внеклеточного матрикса с фиброцитами и гладкими миоцитами (рисунок 4 А). Еще глубже присутствовал слой разрыхленных коллагеновых волокон с фиброцитами. Во втором варианте поверхность материала створки была покрыта структурированным слоем фибрина (рисунок 4 Б-Д). Поверхность фибринового слоя могла быть покрыта эндотелием либо оставалась свободной. Иногда на поверхности фибрина находился слой клеток, состоящий их гладких миоцитов, не образующих плотного, сплошного покрытия поверхности (рисунок 4 Д).
В случае отсутствия эндотелия на поверхности фибрина, он имел низкую электронную плотность и содержал большое количество диффузно расположенных клеток, среди которых преобладали гладкие миоциты, макрофаги и фибробласты (рисунок 4 Б, В). При наличии эндотелиального слоя клетки, лежащие под ним, были представлены гладкими миоцитами и фибробластами (рисунок 4 Г). В варианте, когда внешняя поверхность фибрина была покрыта гладкими миоцитами, под ними также находились плотно расположенные гладкомышечные клетки (рисунок 4 Д).
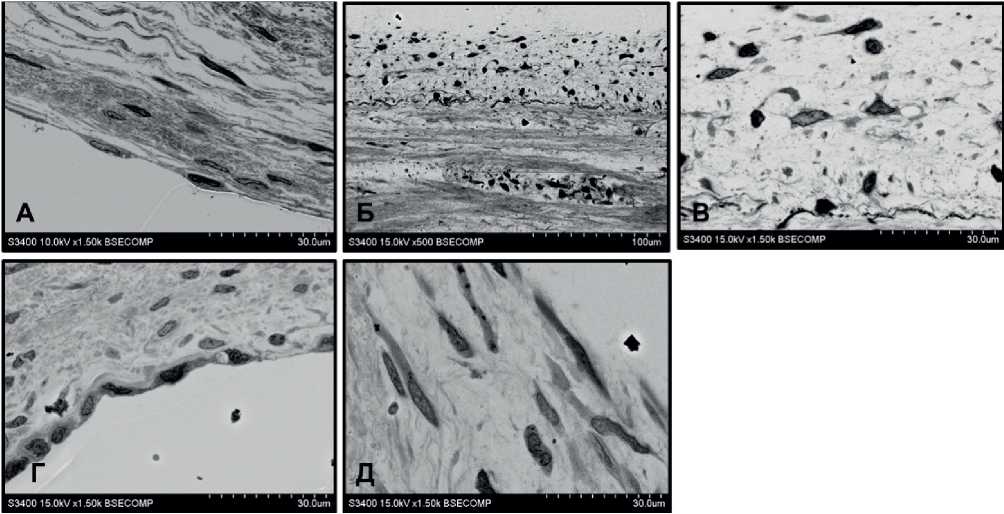
Рис. 4 Структура поверхностного слоя створок: А — эндотелий в зоне сохранного внеклеточного матрикса; Б — фибриновый слой на поверхности створки, без клеточного покрытия; В — клетки в составе неэндотелизированного фибринового слоя; Г — эндотелий на поверхности фибрина; Д — гладкие миоциты на поверхности и во внутренней структуре фибринового слоя.
На границе между фибриновым слоем и тканью створки наблюдали наличие различных типов клеток (рисунок 5), среди которых чаще всего встречались гладкие миоциты и макрофаги, находящиеся вблизи друг друга (рисунок 5 А). В участках с присутствующими бактериями и разреженным расположением коллагеновых волокон часто находились макрофаги (рисунок 5 Б). В этих же областях отмечали наличие фибробластов, активно продуцирующих компоненты внеклеточного матрикса (рисунок 5 В). Кроме того, в этой области отмечали присутствие единичных пенистых клеток (рисунок 5 Г).
Еще одной особенностью фибринового слоя было наличие большого количества мелких кровеносных сосудов (рисунок 6). Чаще всего они находились в его толще, либо на границе с зоной некроза (рисунок 5 А-Д). Сосуды имели различную структурную организацию, но обычно структура стенки сосудов была редуцирована, и они состояли только из слоя эндотелия, без субэндотелиального слоя. Диаметр сосудов был различным, но преобладали сосуды малого диаметра. Вблизи сосудов отмечали наличие клеток, преимущественно гранулоцитов и моноцитов. Локализация клеток вблизи сосудов указывает на массивный выход лейкоцитов через стенки капилляров в окружающее пространство. Лейкоциты располагались либо диффузно вокруг сосуда (рисунок 5 А, Б), либо их распределение имело полярный характер, и наибольшее их количество находилось со стороны, обращенной в направлении зоны некроза (рисунок 5 В-Д). Среди гранулоцитов преобладали нейтрофилы и базофилы, реже встречались эозинофилы (рисунок 5 Д-Е).
Иногда встречались участки створок, в которых фибрин находился в центральной зоне (рисунок 6). В таких участках в фибриновом слое наблюдали разнонаправленно расположенные фибриновые волокна и большое количество кровеносных сосудов.
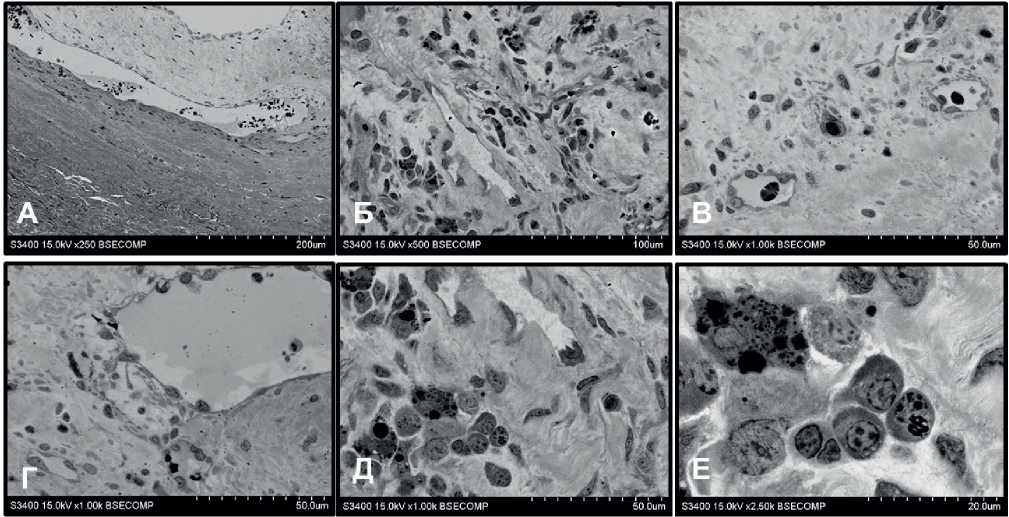
Рис. 5 Кровеносные сосуды и их клеточное окружение внутри фибринового слоя на поверхности створок МК при ИЭ: А — крупный сосуд на границе фибринового слоя и внеклеточного матрикса створки; Б, В — диффузное расположение клеток вблизи сосудов; Г, Д — полярная локализация клеток вблизи сосудов; Е — структура клеток, окружающих сосуды.
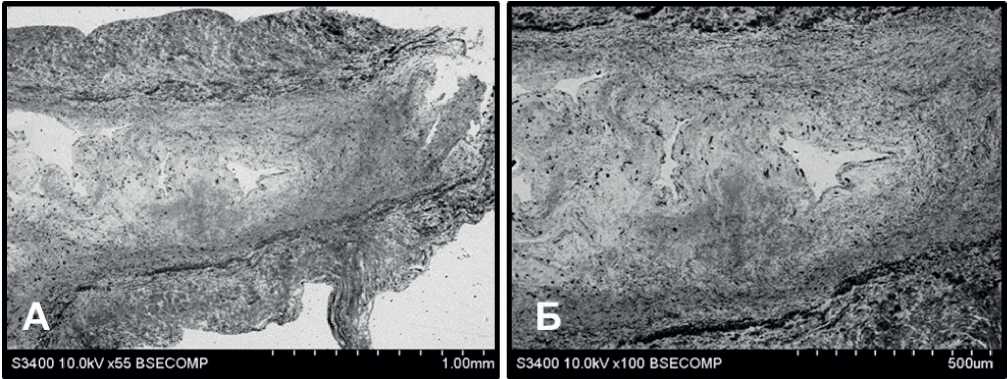
Рис. 6 Створка клапана с фибрином во внутренней части створки с большим количеством кровеносных сосудов: А — общий вид участка створки, Б — внутренний фибриновый слой створки с большим количеством кровеносных сосудов.
Обсуждение
Полученные результаты подтвердили, что инфицирование створок МК вызывает ответную реакцию, конечным результатом которой является развитии структурной несостоятельности клапана. Если принять, что процесс деструкции створок при ИЭ происходит постепенно и распространяется от зоны инфекции вдоль волокон внеклеточного матрикса, то морфологические отличия структуры створок в разных участках логично принять за различные стадии протекания этого процесса. При таком допущении зоны максимальной сохранности структуры можно принимать за начальные стадии процесса, а зоны максимальной деструкции за максимальное проявление ИЭ.
Отметим, что локализация бактерий в структуре створки имеет характерные особенности. В частности, максимальное их количество находится не в зоне некроза, а за ее пределами. В обоих случаях бактерии образуют скопления, локализующиеся параллельно ориентации волокон. Такое расположение может объясняться тем, что по мере размножения бактерий, распространение инфекции идет вдоль волокон створок. Локализация зон некроза преимущественно во внутренней части створок указывает, с одной стороны, на латеральную миграцию бактерий, с другой — на наличие эффективных способов элиминации бактерий в областях, близких к поверхности створок, за счет миграции лейкоцитов и проникновением антибиотиков. Дополнительное влияние могут оказывать и гладкие миоциты, локализующиеся вдоль сохранных волокон матрикса и создающие своеобразный барьер между зоной некроза и относительно сохранными областями створок, препятствующий миграции бактерий. По мере продвижения бактерий из зоны воспаления вдоль волокон внеклеточного матрикса структура поверхностных слоев створок меняется.
Известно, что бактериальное обсеменение створок клапанов сердца вызывает ответную реакцию организма, индуцируемую экскрецией в среду воспалительных факторов, запускающих иммунные реакции. Одним из следствий может быть миграция лейкоцитов внутрь створки [6][10]. Развитие микроциркуляторного русла также может рассматриваться в качестве адаптивной реакции на воспаление, вызванное инфекционным процессом. Прежде всего, новые капилляры участвуют в транспорте иммунокомпетентных клеток внутрь створки, а также в санации и дезактивации очагов поражения. Появление гладких миоцитов в фибриновом слое может рассматриваться в качестве еще одного элемента адаптивной реакции. Кроме изоляции зон некроза они, возможно, берут на себя выполнение механической функции взамен разрушенного внеклеточного матрикса [11]. Обращает на себя внимание высокая жизнестойкость этих клеток в экстремальных условиях. В частности, в инфицированных створках часто встречались участки, в которых единственным типом жизнеспособных клеток были гладкие миоциты. Кроме того, в составе структурированного фибринового слоя наблюдали присутствие фибробластов, активно продуцирующих компоненты внеклеточного матрикса. Таким образом, на определенных этапах ИЭ, фибриновый слой служит местом, где регенеративные процессы имеют максимальное проявление.
Вероятно, структурные особенности створок клапанов сердца не позволяют в полной мере реализовать иммунный потенциал организма, в первую очередь из-за слабо развитого микроциркуляторного русла и особенностей расположения волокон внеклеточного матрикса, затрудняющего поперечную миграцию иммунокомпетентных клеток и провоспалительных агентов. Кроме того, инфекционное воспаление протекает на фоне функционирования створок, что вносит дополнительные сложности в процессы регенерации повреждённых структур. Наиболее эффективно процессы ремоделирования створок протекают в поверхностных слоях. На это указывает отсутствие в них бактерий, слабо выраженные процессы воспаления. Возможен вариант, при котором процесс ремоделирования достигает такой стадии, при которой створки с обеих поверхностей практически полностью замещаются фибрином и только в центре между фибриновыми слоями имеется тонкий слой исходной ткани створки [12]. Теоретически можно допустить развитие позитивного сценария ремоделирования створок, но в нашем распоряжении имелись только удаленные створки с драматическими повреждениями. Как вариант, не исключается возможность полного замещения зон некроза фибрином, с последующим его структурированием, заселением клетками соединительной ткани, но доказательств возможной успешности этого процесса у нас нет. В одном из образцов наблюдали участок створки, в котором фибрин замещал внутренний слой створки и содержал большое количество кровеносных сосудов, но нет данных, указывающих на возможность успешного завершения такого пути ремоделирования. Скорее всего, в условиях функционирующей створки и недостатка химических стимулов, как воспалительные, так и восстановительные процессы приводят к дегенерации створок либо по пути их деструкции, либо за счет неконтролируемого разрастания ткани [13].
Отдельного внимания заслуживает рассмотрение роли эндотелия в этом процессе. Целостный эндотелий полностью защищает створки от вторжения инфекционных агентов в толщу створки, за исключением варианта миграции из миокарда через основание створки. Повреждение эндотелия приводит к образованию микротромбов, которые могут служить своеобразными воротами для проникновения инфекции [6, 10, 14]. Этому способствует тот факт, что, находясь в слое фибрина, бактерии становятся менее уязвимыми по отношению к клеткам моноцитарного ряда. Затем бактерии мигрируют в толщу створки, вызывая развитие ИЭ. Для предотвращения негативного сценария требуется максимальная сохранность эндотелиального слоя и быстрая регенерация поврежденных участков. Если после эффективной антибактериальной терапии слой эндотелия не будет восстановлен, существует высокая вероятность развития вторичной бактериальной инфильтрации [15].
Заключение
Тканевая деструкция створок МК при ИЭ представляет собой мозаичную картину и характеризуется массивной миграцией лейкоцитов (в первую очередь нейтрофилов), формированием богатого кровеносными сосудами и заселенного иммунокомпетентными, гладкомышечными и соединительнотканными клетками фибринового слоя, отграничением зон некроза слоями патологического внеклеточного матрикса. Нарушение целостности эндотелия сопутствовало высокой выраженности патологических процессов в пораженных ИЭ створках клапанов.
Список литературы
1. Yang E, Frazee BW. Infective Endocarditis. Emerg Med Clin N Am. 2018;36(4):645-63. doi:10.1016/j.emc.2018.06.002.
2. Cahill TJ, Prendergast BD. Infective endocarditis. Lancet. 2016;387(10021):882-93. doi:10.1016/S0140-6736(15)00067-7.
3. Guerrero MLF, Alvarez B, Manzarbeitia F, et al. Infective endocarditis at autopsy: a review of pathologic manifestations and clinical correlates. Medicine (Baltimore). 2012;91(3):152-64. doi:10.1097/MD.0b013e31825631ea.
4. Sun BJ, Choi SW, Park KH, et al. Infective endocarditis involving apparently structurally normal valves in patients without previously recognized predisposing heart disease. J Am Coll Cardiol. 2015;65(3):307-9. doi:10.1016/j.jacc.2014.10.046.
5. Liesman RM, Pritt BS, Maleszewski JJ, et al. Laboratory diagnosis of infective endocarditis. J Clin Microbiol. 2017;55:2599-608. doi:10.1128/JCM.00635-17.
6. Iung B, Duval X. Infective endocarditis: innovations in the management of an old disease. Nat Rev Cardiol. 2019;16(10):623-35. doi:10.1038/s41569-019-0215-0.
7. Lamas CC, Fournier PE, Zappa M, et al. Diagnosis of blood culture-negative endocarditis and clinical comparison between blood culture-negative and blood culture-positive cases. Infection. 2016;44(4):459-66. doi:10.1007/s15010-015-0863-x.
8. Lepidi H, Durack DT, Raoult D. Diagnostic methods current best practices and guidelines for histologic evaluation in infective endocarditis. Infect Dis Clin N Am. 2002;16(2):339-61. doi:10.1016/s0891-5520(02)00005-3.
9. Mukhamadiyarov RA, Kutikhin AG. Backscattered scanning electron microscopy approach for assessment of microvessels under conditions of normal microanatomy and pathologica neovascularization. Bull Exp Biol Med. 2020;169;(4):525-30. doi:10.1007/s10517-020-04927-1.
10. Holland TL, Baddour LM, Bayer AS, et al. Infective endocarditis. Nat Rev Dis Primers. 2016;2:16059. doi:10.1038/nrdp.2016.59.
11. Мухамадияров Р.А., Рутковская Н.В., Мильто И.В. и др. Клеточный состав экс-плантированных биопротезов клапанов сердца при инфекционном эндокардите. Архив патологии. 2019;81(6):16-23. doi:10.17116/patol20198106116.
12. Collins J, Zhang Y, Burke A. Pathologic findings in native infective endocarditis. Pathol Res Pract. 2014;210(12):997-1004. doi:10.1016/j.prp.2014.04.024.
13. Skowasch D, Steinmetz M, Nickenig G, et al. Is the degeneration of aortic valve bioprostheses similar to that of native aortic valves? Insights into valvular pathology. Expert Rev Med Devices. 2006;3(4):453-62. doi:10.1586/17434440.3.4.453.
14. Аль-Ганади А. А., Гриценко В. В., Зуева Е. Е. и др. Значение исследования функции эндотелия в диагностике и оценке эффективности лечения инфекционного эндокардита. Вестник хирургии. 2008;167(4):21-5.
15. Oberbach A, Friedrich M, Lehmann S, et al. Bacterial infiltration in structural heart valve disease. J Thorac Cardiovasc Surg. 2020;159(1):116-24.e4. doi:10.1016/j.jtcvs.2019.02.019.
Об авторах
Р. А. МухамадияровРоссия
Мухамадияров Ринат Авхадиевич — кандидат биологических наук, старший научный сотрудник лаборатории фундаментальных аспектов атеросклероза.
Кемерово.
Тел.: + 7 (923) 610-67-47
А. Г. Кутихин
Россия
Кутихин Антон Геннадиевич — кандидат медицинских наук, заведующий лабораторией фундаментальных аспектов атеросклероза.
Кемерово.
Дополнительные файлы
Рецензия
Для цитирования:
Мухамадияров Р.А., Кутихин А.Г. Ультраструктурные изменения митрального клапана при инфекционном эндокардите. Кардиоваскулярная терапия и профилактика. 2021;20(3):2742. https://doi.org/10.15829/1728-8800-2021-2742
For citation:
Mukhamadiyarov R.A., Kutikhin A.G. Ultrastructural mitral valve abnormalities in infective endocarditis. Cardiovascular Therapy and Prevention. 2021;20(3):2742. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2742
JATS XML

























































