Перейти к:
Генетические и негенетические факторы в оценке прогноза у высоко приверженных лекарственной терапии больных, перенесших инфаркт миокарда
https://doi.org/10.15829/1728-8800-2021-2773
Аннотация
Цель. Оценить влияние генетических и негенетических факторов на риск развития неблагоприятного исхода в течение однолетнего наблюдения у высоко приверженных лекарственной терапии пациентов, перенесших инфаркт миокарда (ИМ).
Материал и методы. В исследование включено 250 пациентов, госпитализированных в стационар по поводу ИМ в период 01.09.2018-01.05.2019 гг. и имеющих потенциально высокий уровень приверженности к лекарственной терапии. Через 12 мес. после ИМ у пациентов оценивали приверженность к лекарственной терапии и влияние генетических и негенетических факторов на прогноз заболевания.
Результаты. В течение 12 мес. после ИМ 70 (28,0%) пациентов перенесли комбинированную конечную точку: смерть от всех причин, ИМ, мозговой инсульт и незапланированную реваскуляризацию коронарного русла. К факторам, увеличивающим риск достижения комбинированной конечной точки, относились: не-QИМ — относительный риск (ОР)=2,63; 95% доверительный интервал (ДИ): 1,63-4,25 (p=0,001); фракция выброса левого желудочка ≤35% — OP=2,03; 95% ДИ: 1,17-3,50 (p<0,0001); генотипы GA+AA гена CYP2C19 — OР=1,58; 95% ДИ: 1,06-2,37 (p<0,00001).
Заключение. Результаты исследования позволяют выделить пациентов, имеющих высокий риск неблагоприятного исхода: пациентов с не-Q-ИМ, с фракцией выброса левого желудочка ≤35%, с генотипами GA и AA гена CYP2C19.
Для цитирования:
Переверзева К.Г., Якушин С.С., Галус А.С., Шанина А.Р. Генетические и негенетические факторы в оценке прогноза у высоко приверженных лекарственной терапии больных, перенесших инфаркт миокарда. Кардиоваскулярная терапия и профилактика. 2021;20(4):2773. https://doi.org/10.15829/1728-8800-2021-2773
For citation:
Pereverzeva K.G., Yakushin S.S., Galus A.S., Shanina A.R. Genetic and nongenetic factors in assessing the prognosis of patients after myocardial infarction with high medical adherence. Cardiovascular Therapy and Prevention. 2021;20(4):2773. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2773
Введение
В последние годы в Российской Федерации наблюдается положительная динамика снижения заболеваемости и смертности пациентов, перенесших инфаркт миокарда (ИМ), но при этом показатель смертности пациентов от повторного ИМ остается высоким [1], несмотря на то, что основные лечебные мероприятия при ведении таких пациентов направлены преимущественно на профилактику повторных сосудистых событий. Степень приверженности врачей к соблюдению клинических рекомендаций в настоящее время возросла, а вопросам приверженности лечению пациентов и методам ее увеличения уделяется большое внимание [2][3]. Таким образом, высокие показатели смертности от повторного ИМ в значительной степени могут быть связаны с генетически детерминированной лекарственной устойчивостью [4], обусловленной полиморфизмом генов, которые в совокупности с негенетическими факторами риска неблагоприятного прогноза и определяют неблагоприятный исход.
Вклад генетических и негенетических факторов в развитие повторного ИМ в современных реалиях целесообразно оценивать только у пациентов, высоко приверженных к лекарственной терапии. С одной стороны, это обусловлено тем, что приверженность к лекарственной терапии, сохраняющаяся в течение длительного периода наблюдения, во многом определяет прогноз и эффективность применения лекарственных препаратов. А с другой стороны — тем, что число пациентов, даже среди перенесших ИМ, которые в течение длительного времени привержены лечению, невелико и по данным ряда авторов составляет ≤45% [5, 6]; соответственно, проанализировать у них причину возможной неэффективности лекарственной терапии крайне затруднительно.
В настоящем исследовании для оценки уровня потенциальной приверженности использовался количественный опросник приверженности (КОП-25), позволяющий оценить такие компоненты приверженности как “приверженность к лекарственной терапии”, “приверженность к медицинскому сопровождению”, “приверженность к модификации образа жизни” и интегральный показатель “приверженность к лечению” [7]. Согласно данному опроснику, “для всех показателей приверженности уровень значений в интервале до 50% интерпретируют как “низкий”, 51-75% — “средний”, >75% — “высокий” [7]. В настоящее исследование включали пациентов с высоким уровнем приверженности к лекарственной терапии.
Выбор анализируемых полиморфизмов генов базировался на литературных данных о связи их с метаболизмом лекарственных препаратов, улучшающих прогноз [8-10].
Цель исследования — оценить влияние генетических и негенетических факторов на риск развития неблагоприятного исхода в течение однолетнего наблюдения у высоко приверженных лекарственной терапии пациентов, перенесших ИМ.
Материал и методы
В проспективное, одноцентровое исследование включали пациентов, госпитализированных в стационар по поводу ИМ (из них у 179 (71,6%) пациентов Q-ИМ) в период с 01.09.2018 по 01.5.2019гг.
Пациентов включали в исследование при условии подписания информированного согласия и при наличии у них высокого уровня потенциальной приверженности к лекарственной терапии, определяемой по КОП-25 [7], заполняемому пациентом на момент включения. Критериями исключения в исследование являлись:
- абсолютные противопоказания к назначению ингибиторов ангиотензинпреврашающего фермента (иАПФ), бета-адреноблокаторов (БАБ), статинов, антиагрегантов;
- психические заболевания;
- злоупотребление алкоголем и наркотическими средствами;
- низкая и средняя потенциальная приверженность лекарственной терапии по данным опросника КОП-25.
Исследование было одобрено локальным этическим комитетом и зарегистрировано на ClinicalTrials.gov с идентификационным номером NCT04424368.
В исследование включено 250 пациентов, из них 179 (71,6%) — с Q-ИМ, мужчин — 172 (68,9%), медиана возраста — 62,8 (54,7; 71,4) года. Все пациенты получали аторвастатин в дозе 40 мг/сут., иАПФ, БАБ, клопидогрел в составе двойной антиагрегантной терапии.
Всем пациентам методом полимеразной цепной реакции c электрофоретической схемой детекции результата “SNP-ЭКСПРЕСС” (НПФ “Литех”, Россия) определяли полиморфизмы Thr174Met и Met235Thr в гене ангиотензиногена (AGT), Arg389Gly и Ser49Gly в гене адренорецептора бета-1 (ADRB1), Ser447Ter в гене липопротеинлипазы (LPL) и Leu28Pro в гене аполипопротеина Е, Trp212Ter (*3) и G681A (*2) в гене цитохрома Р450 семейства 2 подсемейства С номер 19 (CYP2C19). Через 12 мес. от момента включения на каждого пациента собирали сведения о перенесенных ими за это время ИМ, мозговых инсультов (МИ), экстренных сердечно-сосудистых вмешательств и случаев смерти, которые были объединены в комбинированную конечную точку (ККТ). В тех случаях, когда пациент переносил два и более события, объединённых в ККТ, для оценки прогностических факторов было взято только одно (первое по времени наступления) событие. Через 12 мес. наблюдения были получены сведения обо всех включенных в исследование пациентах, таким образом, полнота охвата наблюдением составила 100%. Все пациенты из числа выживших (n=221) через 12 мес. от момента включения были привержены к лекарственной терапии.
Для статистической обработка материала использовали программы Microsoft Excel 2010 и StatsoftStatistica10.0. Данные представлены в виде частот (%).
Распределение всех признаков отличалось от нормального. Количественные признаки описывались медианой и нижним и верхним квартилями.
Сравнение двух независимых групп по количественным признакам проводили с использованием U-критерия Манна-Уитни, по качественным — с использованием критериев χ2 (хи-квадрат) по Пирсону, χ2 с поправкой Йетса, критерия Фишера.
С целью анализа смертельных исходов использовали регрессионную модель пропорциональных рисков Кокса. При этом в случаях, когда в ходе многофакторного анализа фактор сохранял свое влияние на время наступления исхода, для него рассчитывали относительный риск (RR) и его 95% доверительный интервал (ДИ). За статистически значимые принимались различия p<0,05.
Определение сопоставимости распределения генотипов изучаемых полиморфных генов в исследуемой выборке по отношению к популяции проводили путем оценки соответствия равновесию Харди-Вайнберга с помощью доступного в on-line режиме программного обеспечения http://ihg2.helmholtzmuenchen.de/cgi-bin/hw/hwa1.pl. Отклонение от равновесия Харди-Вайнберга наблюдалось для полиморфизмов гена — ADRB1 (Ser49Gly) и AGT (Thr174Met).
Результаты
В течение одного года наблюдения из 250 пациентов от всех причин умерло 29 (11,6%) пациентов, из них от сердечно-сосудистых причин — 25 (86,2%) пациентов. У 9 (3,6%) пациентов случился нефатальный ИМ, у 5 (2,0%) пациентов — нефатальный МИ. У 27 (10,8%) пациентов проводилась незапланированная реваскуляризация коронарного русла. Всего 70 (28,0%) пациентов перенесли ККТ.
Данные о пациентах были проанализированы в отношении клинико-анамнестических данных и профиля сопутствующей патологии — возраста, пола, фактов курения и употребления алкоголя, отягощенной наследственности, частоте ожирения, артериальной гипертонии, нарушений углеводного обмена, ишемической болезни сердца в анамнезе, стадий и функциональных классов хронической сердечной недостаточности, форм фибрилляции предсердий, заболеваний опорно-двигательного аппарата, легких, почек, патологии желудочно-кишечного тракта и щитовидной железы.
Пациенты, у которых зарегистрированы события, составляющие ККТ, по сравнению с теми, у кого событий не было, были старше — 64,7 (57,3; 76,0) vs 61,5 (53,9; 69,7) года (p=0,047), реже курили — 32,9 vs 47,8%, соответственно (p=0,03). Они чаще страдали ожирением: в 70,0 vs 14,4% случаев, соответственно (p<0,0001) и реже имели гипертоническую болезнь: в 62,9 vs 91,7% случаев, соответственно (p<0,0001). Заболевания желудочно-кишечного тракта также реже встречались у пациентов с зарегистрированными событиями, объединенными в ККТ, по сравнению с пациентами, не достигшими ее: в 10,0% и 32,2% случаев, соответственно (p=0,0001).
Особенности течения референсного ИМ и тактики ведения пациентов с референсным ИМ представлены в таблице 1.
Таблица 1
Особенности течения инфаркта миокарда и ведения пациентов в остром периоде ИМ среди достигших и не достигших ККТ
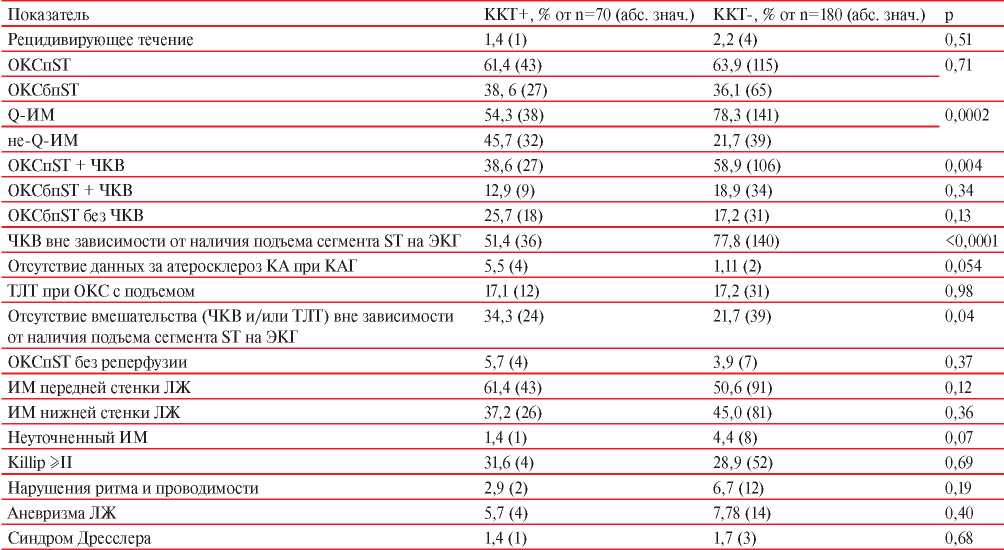
Примечание: ИМ — инфаркт миокарда, КА — коронарная артерия, КАГ — коронароангиография, ККТ — комбинированная конечная точка, ЛЖ — левый желудочек, ОКС — острый коронарный синдром, ОКСбпST — ОКС без подъема сегмента ST, ОКСпST — ОКС c подъемом сегмента ST, ТЛТ — тромболитическая терапия, ЧКВ — чрескожное коронарное вмешательство, ЭКГ — электрокардиограмма.
В ходе исследования были проанализированы структурные, объемные и функциональные показатели эхокардиографии обеих групп пациентов. Результаты анализа представлены в таблице 2. Статистически значимые различия были получены в отношении наличия легочной гипертензии: среди пациентов с зарегистрированными событиями, относящимися к ККТ, она встречалась в 37,1% (n=26) случаев, среди пациентов без событий — в 24,4% (p<0,0001), регургитации I степени на трикуспидальном клапане, которая встречалась в 28,6 и 42,2% случаев, соответственно (p=0,046), регургитации II степени на аортальном клапане — в 34,3 и 20,0% (p=0,009).
Таблица 2
Сравнение показателей эхокардиографии у пациентов, достигших и не достигших ККТ
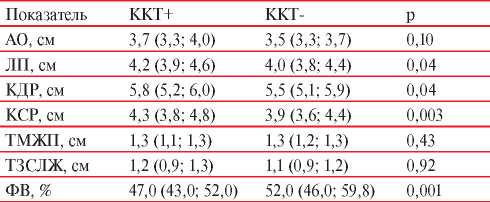
Примечание: АО — аорта, КДР — конечный диастолический размер, ККТ — комбинированная конечная точка, КСР — конечный систолический размер, ЛП — левое предсердие, ТЗСЛЖ — толщина задней стенки левого желудочка, ТМЖП — толщина межжелудочковой перегородки, ФВ — фракция выброса.
При анализе лабораторных показателей (уровней общего холестерина, холестерина липопротеинов высокой и низкой плотности, триглицеридов, глюкозы крови, креатинфосфокиназы, высокочувствительного тропонина I, общего билирубина, аланинаминотрансферазы и аспартатаминотрансферазы, креатинина, гемоглобина и лейкоцитов) статистически значимые различия были получены только для уровня креатинина сыворотки крови: для пациентов с зарегистрированными событиями, объединенными в ККТ, уровень креатинина сыворотки крови составил 102,5 (84,0; 118,5) мкмоль/л, для пациентов без событий — 93,0 (81,5; 106,0) мкмоль/л (p=0,02).
Что касается полиморфизма генов, то между пациентами с зарегистрированными событиями, объединенными в ККТ, и без таковых наблюдалась статистически значимая разница по частоте встречаемости генотипов и частоте аллелей гена CYP2C19 (G681A) и LPL (Ser447Ter). Данные о распределении генотипов и частоте аллелей анализируемых генов представлены в таблице 3.
Таблица 3
Данные о распределении генотипов и частоте аллелей анализируемых генов
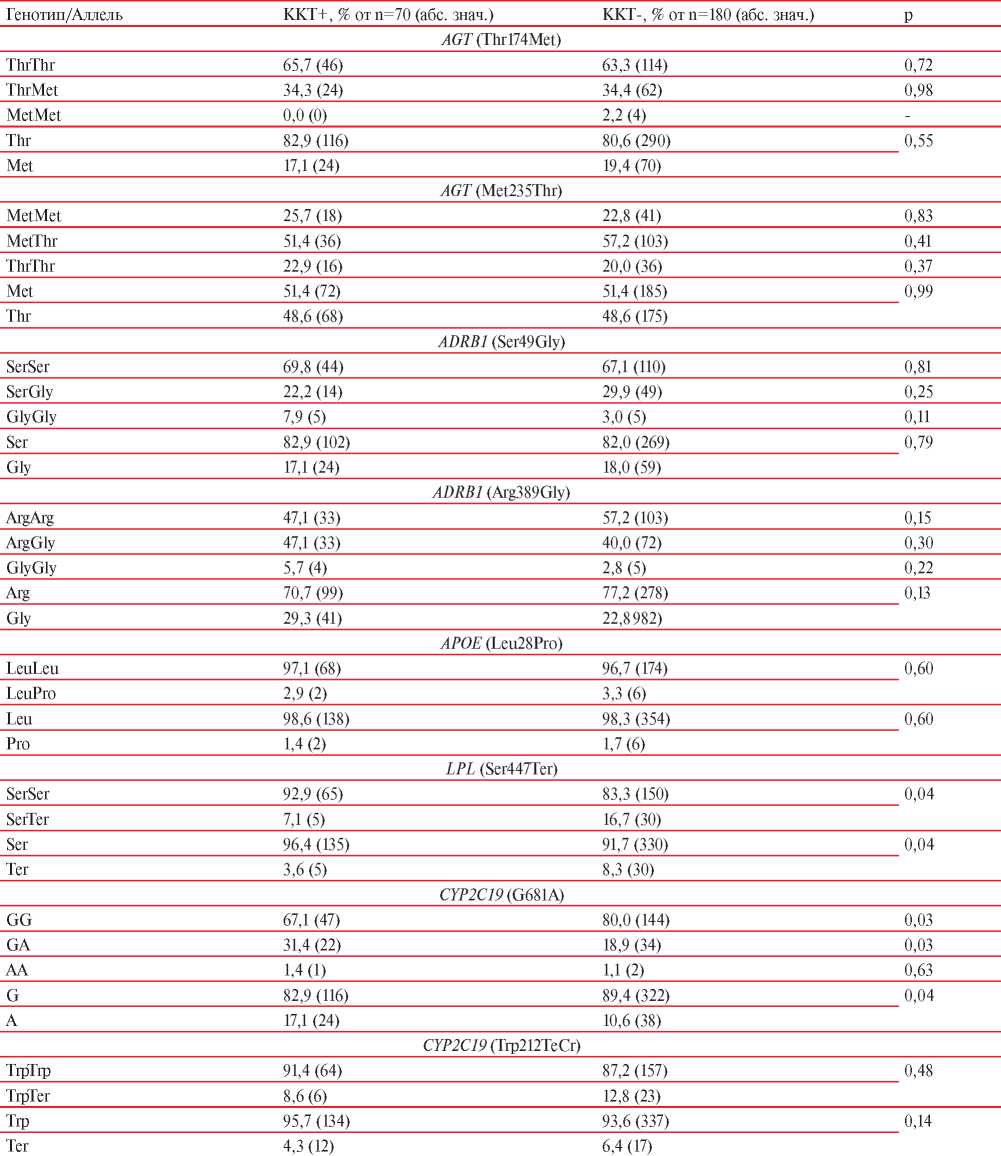
Примечание: ККТ — комбинированная конечная точка.
В дальнейшем все параметры, значимо различающиеся между обеими группами пациентов, включались в однофакторный регрессионный анализ, а при выявлении связи со временем наступления исхода (p<0,05) в многофакторный анализ, по результатам которого для факторов, влияющих на прогноз, был рассчитан RR и его 95% ДИ (таблица 4).
Таблица 4
RR и 95% ДИ для факторов, независимо влияющих на частоту развития ККТ

Примечание: ДИ — доверительный интервал, ЛЖ — левый желудочек, ФВ — фракция выброса, RR — относительный риск.
Таким образом, к факторам, увеличивающим риск развития неблагоприятного исхода, относятся: не-Q-ИМ — RR 2,63; 95% ДИ: 1,63-4,25 (p=0,001), фракция выброса (ФВ) левого желудочка (ЛЖ) ≤35%, а также генотипы GA + AA гена CYP2C19 — RR 2,03; 95% ДИ: 1,17- 3,50 (p<0,0001) и RR 1,58; 95% ДИ: 1,06- 2,37 (p<0,00001), соответственно.
К факторам, уменьшающим риск развития неблагоприятного исхода, относится генотип GG гена CYP2C19 — RR 2,33; 95% ДИ: 1,39-3,85 (p=0,001).
В отношении всех других изучаемых полиморфизмов генов, связанных с метаболизмом БАБ, статинов и иАПФ статистически значимой разницы не получено.
Обсуждение
Результаты, полученные в настоящем исследовании, в частности, по увеличению риска неблагоприятного исхода при не-Q-ИМ, сопоставимы с данными других исследований и авторов. Например, у пациентов с острым коронарным синдромом (ОКС), включённых в российский регистр “РЕКОРД-3”, “сумма событий смерть, ИМ, МИ, срочное вмешательство за 12 мес. после выписки из стационара при ОКС с подъемом сегмента ST (ОКСпST) составила 9,5%, а при ОКС без подъема сегмента ST (ОКСбпST) — 16,3% (р=0,0027). В этом регистре также различалась частота смертельных исходов, развившихся после выписки из стационара за 12 мес. после ОКС. Она составила 4,8% при ОКСпST и 10,5% при ОКСбпST (р=0,0012)” [11]. Отсутствие статистически значимой разницы в общем числе летальных исходов (18,3% при ОКСпST и 14,2% при ОКСбпST; р=0,077), сумме событий: смерть, ИМ, МИ (21,4% при ОКСпST и 18,9% при ОКСбпST; р=0,32) за 12 мес. от начала ОКС, повидимому, обусловлено бóльшим вкладом госпитальной летальности и неблагоприятных событий во время госпитализации при ОКСбпST [11], что неоднократно подтверждалось и в других работах. Например, в обзорной статье Ганюкова В.И. и др., основанной на данных регистров ОКС, отмечается, что госпитальная летальность среди пациентов с ОКСбпST ниже, чем при ОКСпST, а смертность в отдаленном периоде — выше [12]. Данный факт потенциально может быть связан с меньшей частотой выполнения чрескожного коронарного вмешательства (ЧКВ), как единственно возможного метода восстановления адекватного кровотока при не-Q-ИМ. В настоящем исследовании тромболитическая терапия и/или ЧКВ при Q-ИМ были проведены 83,2% пациентам, а ЧКВ при не-Q-ИМ — 53,5% (p<0,0001). При этом при многофакторном анализе данный параметр утратил свою статистическую значимость по влиянию на частоту регистрации событий, объединенных в ККТ. Поэтому, с учетом данных литературы, можно предположить, что на частоту развития неблагоприятных событий у пациентов с не-Q-ИМ, по аналогии с пациентами с Q-ИМ, влияют не только факт выполнения, но и время до проведения ЧКВ, и полнота реваскуляризации, и особенности ведения в постинфарктном периоде [13][14].
Негативное влияние уменьшения ФВ ЛЖ на частоту развития неблагоприятного исхода у пациентов с ИМ, полученное в настоящем исследовании, также согласуется с результатами других работ [15][16].
Что касается аллельных вариантов гена CYP2C19*1/*2 и CYP2C19*2/*2, то проводившиеся ранее исследования не дают однозначного ответа об их влиянии на летальность пациентов с ИМ [17][18]; ряд исследователей сходятся во мнении, что “у носителей минорного аллеля (CYP2C19*2) на фоне лечения клопидогрелом отмечается увеличение частоты ИМ, МИ и риска тромбоза стента по сравнению с лицами, не являющимися носителями данного аллеля” [19]. В представленной работе носительство данного аллеля также повышало риск развития ККТ, которая включала в себя смерть от всех причин, ИМ, МИ и экстренную реваскуляризацию коронарных артерий. Однако на основании накопленных к настоящему времени данных, рутинное клиническое генотипирование больных, перенесших ЧКВ, на нефункционирующие аллели CYP2C19 не рекомендуется вследствие отсутствия данных проспективных наблюдений [20]. Более того, недавно закончившееся крупное рандомизированное исследование TAILOR-PCI (Tailored Antiplatelet Initiation to Lessen Outcomes due to Decreased Clopidogrel Response After Percutaneous Coronary Intervention), целью которого было определить влияние генотипически ориентированной стратегии выбора перорального ингибитора P2Y12 на ишемические исходы у носителей CYP2C19*2 и *3 после ЧКВ среди 5302 рандомизированных пациентов (82% имели ОКС и 18% — стабильную ишемическую болезнь сердца), показало, что генотипически ориентированный выбор перорального ингибитора P2Y12 по сравнению с традиционной терапией клопидогрелом без генотипирования не привел к статистически значимой разнице в частоте регистрации событий, объединенных в ККТ (сердечно-сосудистая смерть, ИМ, МИ, тромбоз стента и тяжелая рецидивирующая ишемия) за 12 мес. наблюдения. Первичная конечная точка наступила у 4,0% носителей CYP2C19*2 и *3 в группе генотип-ориентированной терапии и у 5,9% носителей CYP2C19*2 и *3 в группе традиционной терапии через 12 мес. — RR 0,66; 95% ДИ: 0,43-1,02 (p=0,06). Среди всех рандомизированных пациентов первичная конечная точка наблюдалась у 4,4% в группе, ориентированной на генотип, и у 5,3% в обычной группе — RR 0,84; 95% ДИ: 0,65-1,07 (p=0,16) [21].
Вместе с тем в Российских клинических рекомендациях 2020г по “острому ИМ с подъемом сегмента ST на ЭКГ” [22] и “ОКСбпST на ЭКГ” [23] возможность генотипирования рассматривается, и указывается, что “для прогнозирования сниженной лабораторной чувствительности к клопидогрелу возможно проведение фармакогенетического тестирования по CYP2С19” [22][23]. На основании полученных нами результатов данную рекомендацию можно считать целесообразной, особенно в тех случаях, когда пациент не имеет медицинских противопоказаний к назначению тикагрелора или прасугрела, и выбор клопидогрела обоснован экономической составляющей, предпочтениями пациента и/или врача. Иными словами, в тех случаях, когда при планируемом назначении клопидогрела результаты генетического тестирования могут послужить основанием для назначения более эффективного препарата (тикагрелора или прасугрела), который у пациентов с генотипами GA и AA гена CYP2C19, ассоциированными с неблагоприятными исходами, необязательно связанными с неэффективностью клопидогрела, может оказать бóльший положительный эффект. Таким образом, генотипирование по гену CYP2C19 нужно не столько с целью прогнозирования неэффективности клопидогрела, сколько с целью прогнозирования возможного развития неблагоприятного исхода и принятия превентивных мер по его предотвращению (в частности, это выбор более эффективного ингибитора P2Y12).
Несмотря на сходство полученных нами данных с результатами других исследований, значимой особенностью настоящего исследования является то, что все выявленные факторы риска неблагоприятного прогноза получены на выборке пациентов, которым в постинфарктном периоде не только была назначена оптимальная медикаментозная терапия, но которые были высоко приверженными лекарственной терапии.
Таким образом, даже среди высоко приверженных пациентов с ИМ, получающих оптимальную медикаментозную терапию, крайне пристального внимания заслуживают пациенты с не-Q-ИМ, с ФВ ЛЖ ≤35%, генотипами GA и AA гена CYP2C19.
Ограничения исследования: ограничением исследования является небольшое число генов-кандидатов, включенных в оценку отдаленного прогноза у пациентов с ИМ, а также отсутствие контроля за эффективностью терапии в течение первого года наблюдения.
Заключение
Результаты проведенного исследования у больных, перенесших ИМ с высокой приверженностью лекарственной терапии, свидетельствуют о значимом негативном влиянии на частоту развития неблагоприятного исхода в течение 12 мес. наблюдения у пациентов с ИМ не-Q-ИМ, генотипов GA+AA гена CYP2C19, ФВ ЛЖ ≤35% и позитивном влиянии генотипа GG гена CYP2C19.
Список литературы
1. Самородская И. В., Барбараш О. Л., Кашталап В. В. и др. Анализ показателей смертности от инфаркта миокарда в Российской Федерации в 2006 и 2015 годах. Российский кардиологический журнал. 2017;(11):22-6. doi:10.15829/1560-4071-2017-11-22-26.
2. Калинова Ю. А., Филиппов Е. В. Приверженность к лечению и пути ее повышения у пациентов, перенесших чрескожное коронарное вмешательство при остром коронарном синдроме без подъема сегмента ST. Наука молодых (Eruditio Juvenium). 2020;8(3):444-56. doi:10.23888/HMJ202083444-456.
3. Уланова Н. Н., Яковлева Н. В. Особенности здоровьесберегающего поведения и приверженности лечению у врачей на разных этапах профессионального становления. Российский медико-биологический вестник имени академика И. П. Павлова. 2015;1(23):102-8.
4. Becquemont L, Alfirevic A, Amstutz Ursula, et al. Practical recommendations for pharmacogenomics-based prescription: 2010 ESF-UB Conference on Pharmacogenetics and Pharmacogenomics. 2010;12(1):113-24. doi:10.2217/pgs.10.147.
5. Переверзева К. Г., Якушин С. С., Лукьянов М. М. и др. Приверженность лечению пациентов в отдаленном периоде наблюдения после перенесенного инфаркта миокарда (данные регистра РЕГАТА). Кардиология. 2020;60(10):66-72. doi:10.18087/cardio.2020.10.n1264.
6. Гарганеева А. А., Кужелева Е. А., Тукиш О. В. Роль приверженности лечению в клиническом течении постинфарктного периода (по данным регистра острого инфаркта миокарда). Комплексные проблемы сердечно-сосудистых заболеваний. 2019;8(4):56-64. doi:10.17802/2306-1278-2019-8-4-56-64.
7. Драпкина О. М., Ливзан М. А., Мартынов А. И. и др. Первый российский консенсус по количественной оценке приверженности к лечению: основные положения Обзоры литературы, алгоритмы и рекомендации. Медицинский вестник Северного Кавказа. 2018;13(1-2):259-71. doi:10.14300/mnnc.2018.13039.
8. Хохлов А. Л., Яворский А. Н., Поздняков Н. О. и др. Клинико-генетические аспекты терапии пациентов с атеросклерозом. Архивъ внутренней медицины. 2018;8(1):45-52. doi:10.20514/2226-6704-2018-8-1-45-52.
9. Замахина О. В., Бунова С. С., УсаЛитература/References81 Сердечно-сосудистый риск чева Е. В. и др. Предикторы эффективности бисопролола у больных стабильной стенокардией, перенесших инфаркт миокарда. Медицинский Совет. 2019;(5):68-73. doi:10.21518/2079-701X-2019-5-68-73.
10. Казаков Р. Е., Чеча О. А., Муслимова О. В. и др. Фармакогенетические подходы к повышению эффективности и безопасности применения статинов на примере аторвастатина. Безопасность и риск фармакотерапии. 2020;8(1):43-51. doi:10.30895/2312-7821-2020-8-1-43-51.
11. Эрлих А. Д. 12-месячные исходы у пациентов с острым коронарным синдромом, включённых в российский регистр “РЕКОРД-3”. Российский кардиологический журнал. 2018;(3):23-30. doi:10.15829/1560-4071-2018-3-23-30.
12. Ганюков В. И., Тарасов Р. С., Кочергин Н. А. и др. Чрескожное коронарное вмешательство при остром коронарном синдроме без подъема сегмента ST. Эндоваскулярная хирургия. 2016;3(1):19-5.
13. Масленникова О. М., Закарян Н. В., Ардашев В. Н. и др. Исходы, осложнения и реабилитационный потенциал при выполнении чрескожного коронарного вмешательства в различные сроки острого инфаркта миокарда. Терапия. 2019;1(27):48-53. doi:10.18565/therapy.2019.1.48-53.
14. Переверзева К. Г., Якушин С. С., Грачева А. И. и др. Пациент с инфарктом миокарда в анамнезе: сравнение тактики ведения терапевтом и кардиологом по данным регистра РЕГАТА (регистр пациентов, перенесших инфаркт миокарда). Кардиоваскулярная терапия и профилактика. 2020;19(3):2525. doi:10.15829/1728-8800-2020-2525.
15. Солодун М. В., Аксентьев С. Б., Никифоров А. А. и др. Оценка влияния генетических факторов на отдаленный прогноз у пациентов, перенесших инфаркт миокарда. Клиническая фармакология и терапия. 2016;25(3):31-6.
16. Гарганеева А. А., Борель К. Н., Округин С. А. и др. Влияние фракции выброса левого желудочка на отдаленный прогноз пациентов, перенесших коронарную катастрофу. Анализ 5-летнего мониторинга в рамках популяционой программы “Регистр острого инфаркта миокарда”. Сердечная недостаточность. 2014;15,4(85):218-23.
17. Holmes MV, Perel P, Shah T, et al. CYP2C19 Genotype, Clopidogrel Metabolism, Platelet Function, and Cardiovascular Events A Systematic Review and Meta-analysis. JAMA. 2011;306(24):2704-14. doi:10.1001/jama.2011.1880.
18. Mega JL, Simon T, Collet JP, et al. Reduced-Function CYP2C19 Genotype and Risk of Adverse Clinical Outcomes Among Patients Treated With Clopidogrel Predominantly for PCI: a Meta-analysis. JAMA. 2010;304(16):1821-30. doi:10.1001/jama.2010.1543.
19. Бокерия О. Л., Кудзоева З. Ф., Шварц В. А., Коасари А. К., Донаканян С. А. Возможность подбора терапии у больных ишемической болезнью сердца с учетом полиморфизма гена CYP2C19. Терапевтический архив. 2016;88(5):47-54. doi:10.17116/terarkh201688547-54.
20. Pereira NL, Rihal CS, So DYF, et al. Clopidogrel pharmacogenetics state-of-the-art review and the TAILOR-PCI study. Circ Cardiovasc Interv. 2019;12(4):e007811. doi:10.1161/CIRCINTERVENTIONS.119.007811.
21. Pereira NL, Farkouh ME, So D, et al. Effect of Genotype-Guided Oral P2Y12 Inhibitor Selection vs Conventional Clopidogrel Therapy on Ischemic Outcomes After Percutaneous Coronary Intervention: The TAILOR-PCI Randomized Clinical Trial. JAMA. 2020;324(8):761-71. doi:10.1001/jama.2020.12443.
22. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российское кардиологическое общество, Ассоциация сердечно-сосудистых хирургов России. Российский кардиологический журнал. 2020;25(11):4103. doi:10.15829/29/1560-4071-2020-4103.
23. Клинические рекомендации. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Министерство здравоохранения Российской Федерации. 2020:1-152. URL: http://cr.rosminzdrav.ru/#!/recomend/1016.
Об авторах
К. Г. ПереверзеваРоссия
Кристина Геннадьевна Переверзева — кандидат медицинских наук, доцент кафедры госпитальной терапии с курсом медико-социальной экспертизы
Рязань, Тел.: +7 (920) 994-55-58
SPIN: 4995-1465
С. С. Якушин
Россия
Сергей Степанович Якушин — доктор медицинских наук, профессор, зав. кафедрой госпитальной терапии с курсом медико-социальной экспертизы
А. С. Галус
Россия
Анна Сергеевна Галус — студентка 6 курса лечебного факультета
А. Р. Шанина
Россия
Анастасия Романовна Шанина — студентка 6 курса лечебного факультета
Дополнительные файлы
Рецензия
Для цитирования:
Переверзева К.Г., Якушин С.С., Галус А.С., Шанина А.Р. Генетические и негенетические факторы в оценке прогноза у высоко приверженных лекарственной терапии больных, перенесших инфаркт миокарда. Кардиоваскулярная терапия и профилактика. 2021;20(4):2773. https://doi.org/10.15829/1728-8800-2021-2773
For citation:
Pereverzeva K.G., Yakushin S.S., Galus A.S., Shanina A.R. Genetic and nongenetic factors in assessing the prognosis of patients after myocardial infarction with high medical adherence. Cardiovascular Therapy and Prevention. 2021;20(4):2773. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2773
JATS XML

























































