Перейти к:
Клинико-анамнестическая характеристика пациентов с инфарктом миокарда без подъема сегмента ST, перенесших COVID-19
https://doi.org/10.15829/1728-8800-2021-3062
Аннотация
Цель. Изучить особенности клинико-анамнестических характеристик, данных лабораторных и инструментальных исследований у пациентов с инфарктом миокарда (ИМ) без подъема сегмента ST (ИМбпST), перенесших новую коронавирусную инфекцию (COVID-19, COronaVIrus Disease 2019).
Материал и методы. В исследование включено 209 пациентов с ИМбпST, поступавших в ГКБ им. В.П. Демихова г. Москвы. В зависимости от факта перенесенной COVID-19 пациенты разделены на 2 группы: в основную вошли 104 пациента, которые перенесли COVID-19, в группу контроля — 105 пациентов, не имеющих COVID-19 в анамнезе. Всем пациентам выполнялись рутинные лабораторные и инструментальные исследования согласно действующим стандартам и клиническим рекомендациям.
Результаты. Средний возраст больных в основной группе составил 61,8±12,2 лет, в группе контроля — 69,0±13,0 лет (p<0,0001). Срок развития ИМ после перенесенной COVID-19 составил 49 дней [34,0; 82,0]. Предшествующая стенокардия напряжения наблюдалась у 76,9% пациентов основной группы и у 88,6% группы контроля (χ2 =4,97; р=0,0258). Уровень С-реактивного белка в основной группе составил 19,2 мг/л [4,9; 53,0], а в группе контроля — 5,6 мг/л [0,4; 21,8] (р=0,0007). Средний уровень тропонина I в основной группе составил 2,7 нг/мл [1,3; 8,0], в контрольной группе — 1,8 нг/мл [0,8; 3,5] (р=0,0091).
Заключение. Пациенты с ИМбпST, перенесшие COVID-19, статистически были значимо моложе, в сравнении с пациентами без COVID-19 в анамнезе. У них реже отмечалась предшествующая ИМ стенокардия напряжения, уровень C-реактивного белка и тропонина I статистически значимо выше в сравнении с пациентами контрольной группы. Кроме того, у больных ИМбпST, перенесших COVID-19, расчетное систолическое давление в легочной артерии было значимо выше в сравнении с пациентами без перенесенной COVID-19 в анамнезе.
Для цитирования:
Чащин М.Г., Горшков А.Ю., Драпкина О.М., Косицына И.В., Голубев А.В., Чаус Н.И., Переходов С.Н. Клинико-анамнестическая характеристика пациентов с инфарктом миокарда без подъема сегмента ST, перенесших COVID-19. Кардиоваскулярная терапия и профилактика. 2021;20(7):3062. https://doi.org/10.15829/1728-8800-2021-3062
For citation:
Chashchin M.G., Gorshkov A.Yu., Drapkina O.M., Kositsyna I.V., Golubev A.V., Chaus N.I., Perekhodov S.N. Clinical and anamnestic characteristics of patients with non-ST elevation myocardial infarction after COVID-19. Cardiovascular Therapy and Prevention. 2021;20(7):3062. https://doi.org/10.15829/1728-8800-2021-3062
Введение
В декабре 2019г в Китайской Народной Республике произошла вспышка новой коронавирусной инфекции (COVID-19, COronaVIrus Disease 2019), вызванная вирусом SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2), которая быстро приобрела масштаб пандемии. На момент написания статьи, по данным Университета Джона Хопкинса, общее число выявленных случаев COVID-19 достигло 222,5 млн, а 4,5 млн человек скончались [1]. Несмотря на способность COVID-19 у ряда пациентов вызывать тяжелый острый респираторный синдром, в большинстве случаев инфекция протекает в бессимптомной или легкой форме без существенных клинических проявлений [2]. Однако вне зависимости от формы течения заболевания опубликованные данные указывают на сохраняющиеся длительное время в постковидном периоде (ПКП) изменения в системе гемостаза и повышенный уровень маркеров воспаления у переболевших пациентов [3].
Greenhalgh Т предложил считать подострым период, начиная с 3 нед. от развития клинической картины COVID-19, а “хроническим COVID-19” — состояние, характеризующееся наличием стойких симптомов длительностью >12 нед. от момента развития COVID-19 [4]. В конце 2020г в Руководстве по ведению пациентов после COVID-19 [5] впервые введены термины и обозначены временные интервалы, разделившие ПКП на: острый период COVID-19 — острое заболевание длительностью до 4 нед.; продолжающийся симптоматический период COVID-19 — сохранение симптомов COVID-19 от 4 до 12 нед.; постковидный синдром — симптомокомплекс, развившийся вследствие инфицирования SARS-CoV-2 и сохраняющийся >12 нед., который не объясняется альтернативным диагнозом; длительный период COVID-19 (Long COVID) — обобщающий термин для описания клинического состояния, развившегося в острой фазе COVID-19, и не регрессировавшего после 4 нед. заболевания.
Считается, что долгосрочные эффекты COVID-19 не коррелируют с тяжестью перенесенной инфекции в остром периоде, а возможные последствия в долгосрочной перспективе на текущий момент остаются лишь предполагаемыми [3].
Особую группу составляют пациенты с сердечно-сосудистыми заболеваниями. Сопутствующая сердечно-сосудистая патология предполагает как высокие риски сердечно-сосудистых осложнений (ССО), так и шансы тяжелого течения COVID-19. Гипоксемия, эндотелиальная дисфункция, системное воспаление, прогрессирование атеросклероза, протромботическая активация системы гемостаза могут приводить к развитию острого коронарного синдрома (ОКС) как в остром периоде COVID-19, так и в ПКП [6].
Результаты исследований прошлых лет, посвященные изучению влияния гриппозной инфекции, подтверждают высокие риски ССО среди переболевших пациентов [7][8]. Однако данные, указывающие на непосредственную связь перенесенных вирусных инфекций (в т.ч. COVID-19) и их вклад в развитие инфаркта миокарда (ИМ), в настоящее время достаточно ограничены. Персистирующее воспаление в ПКП, на которое указывают повышенный уровень С реактивного белка (СРБ) и интерлейкина-6, может предрасполагать к развитию ОКС и оказывать влияние на тяжесть течения ИМ [9][10].
Цель настоящего исследования — изучить особенности клинико-анамнестических характеристик, данных лабораторных и инструментальных исследований у пациентов с ИМ без подъема сегмента ST (ИМбпST), перенесших COVID-19.
Материал и методы
В исследование последовательно включено 209 пациентов, проходивших лечение с июля 2020 по март 2021гг в отделении реанимации для больных кардиологического профиля ГКБ им. В. П. Демихова г. Москвы с установленным ИМбпST. Всем пациентам проводился полный объем диагностических и лечебных мероприятий согласно действующим стандартам оказания медицинской помощи, а также актуальным клиническим рекомендациям для пациентов с ИМбпST Минздрава России, включая коронароангиографию (КАГ) и стентирование по показаниям.
Критерии включения: клинически, лабораторно и инструментально подтвержденный диагноз ИМбпST, наличие ангиографических признаков стенозирующего атеросклероза коронарных артерий (КА), отсутствие клинических проявлений острых респираторных вирусных инфекций на момент поступления в стационар, возраст >18 лет.
Критерии исключения: острое повреждение миокарда, возникшее вследствие проведения чрескожного коронарного вмешательства (ЧКВ) или иных оперативных методов лечения; наличие клинических или лабораторных данных острой фазы COVID-19 на момент поступления, или выявившиеся (выявившихся) в течение периода госпитализации.
Факт перенесенной COVID-19 устанавливался на основании анамнестических данных, выписных эпикризов (с указанием на положительный результат тестирования методом полимеразной цепной реакции (ПЦР) или наличия антител класса IgG к SARS-CoV-2, наличие характерных изменений по данным компьютерной томографии органов грудной клетки). Случаи бессимптомного течения определялись, как выявленное значимое повышение IgG к SARS-CoV-2 (> верхнего референсного значения), без предыдущих клинических признаков COVID-19.
Диагноз ИМ выставлялся в соответствии с 4-м универсальным определением ИМ, согласно рекомендациям Европейского общества кардиологов 2018 [11].
При поступлении осуществлялся подробный сбор анамнеза, объективный осмотр, взятие мазков из ротои носоглотки для диагностики COVID-19 с помощью ПЦР, определение титра антител IgM и IgG к SARS-CoV-2; стандартные общеклинические и биохимические исследования, включая исследование уровня СРБ, количественную оценку сердечного тропонина I, коагулограммы; проводилась регистрация электрокардиограммы (ЭКГ) в 12-ти отведениях, эхокардиография (ЭхоКГ) и КАГ.
Исследование антител к SARS-CoV-2 выполнялось полуколичественным методом на анализаторе CL 6000i (Shenzhen Mindray Bio-Medical Electronics Cо.; Китай) с референсными значениями для IgM до 2 Ед/мл и для IgG до 10 Ед/мл.
Статистическая обработка данных осуществлялась с использованием пакетов прикладных программ Microsoft Excel, IBM SPSS Statistica 26 (США). Для описания количественных данных с нормальным распределением или близким к нормальному использовалось среднее значение и стандартное отклонение (M±SD), при распределении, отличным от нормального, — медиана и межквартильный размах (Me [Q25; Q75]). Нормальность распределения проверялась с помощью критерия Колмогорова-Смирнова. Качественные показатели описаны в виде абсолютного числа и частоты выявления признака n (%). Различия между двумя независимыми группами для непрерывных переменных определялись с помощью U-критерия Манна-Уитни. Статистическая значимость различия между качественными переменными определялась с помощью критерия χ2 Пирсона или точного критерия Фишера. Критический уровень статистической значимости определен на уровне р<0,05.
Результаты
Средний возраст пациентов в общей группе составил 65,4±13,1 лет. Больше половины из обследованных были мужчины 55% (n=115), 18,2% (n=38) имели отягощенную наследственность по наличию ранних сердечно-сосудистых заболеваний у ближайших родственников. У значительной части пациентов 82,8% (n=173) до референсного ИМбпST отмечалась стенокардия напряжения; 35,4% (n=74) больных в анамнезе перенесли ИМ. Ранее КАГ выполнялась у 24,4% (n=51), стентирование КА у 20,1% (n=42), а 1,4% (n=3) пациентам выполнялось аортокоронарное шунтирование; 31,6% (n=66) пациентов были курильщиками, ожирением страдали 61,7% (n=129) больных. У подавляющего большинства пациентов 78,9% (n=165) имела место артериальная гипертензия, у 23% (n=48) — дислипидемия, у 30,1% (n=63) — сахарный диабет 2 типа, у 18,7% (n=39) — фибрилляция предсердий. Бронхиальной астмой страдали 6,7% (n=14), хронической обструктивной болезнью легких — 19,6% (n=41). Нарушение мозгового кровообращения перенесли 11,5% (n=24) пациентов. Перенесенный COVID-19 анамнестически и лабораторно был верифицирован у 49,7% (n=104) больных. Медиана срока от начала клинических проявлений COVID-19 до развития ОКС, в среднем, составила 49 дней [ 34,0; 82,0 ]. Основные данные о течении COVID-19 и результаты серологического исследования в изучаемой группе пациентов с ИМбпST представлены в таблице 1. Следует отметить, что 74,1% (n=77) пациентов перенесли COVID-19 в легкой или бессимптомной форме.
Таблица 1
Анамнестические и лабораторные данные пациентов с ИМбпST, перенесших COVID-19

Примечание: * — Me [Q25; Q75].
Все включенные в исследование пациенты были разделены на две группы в зависимости от перенесенной COVID-19: основную группу составили 104 пациента, перенесших COVID-19, а группу контроля — 105 пациентов без COVID 19 в анамнезе. Результаты сравнения клинико-анамнестических данных больных ИМбпST основной группы и группы контроля представлены в таблице 2. Пациенты основной группы были достоверно моложе, чем больные из группы контроля. Среди них реже встречались лица с предшествующей клиникой стенокардии напряжения. Доля женщин в основной группе составила 51% (n=53), в контрольной — 39% (n=41), однако различия не достигли статистической значимости (p=0,0834).
Таблица 2
Сравнение основных клинико-анамнестических характеристик больных ИМбпST в зависимости от перенесенной COVID-19
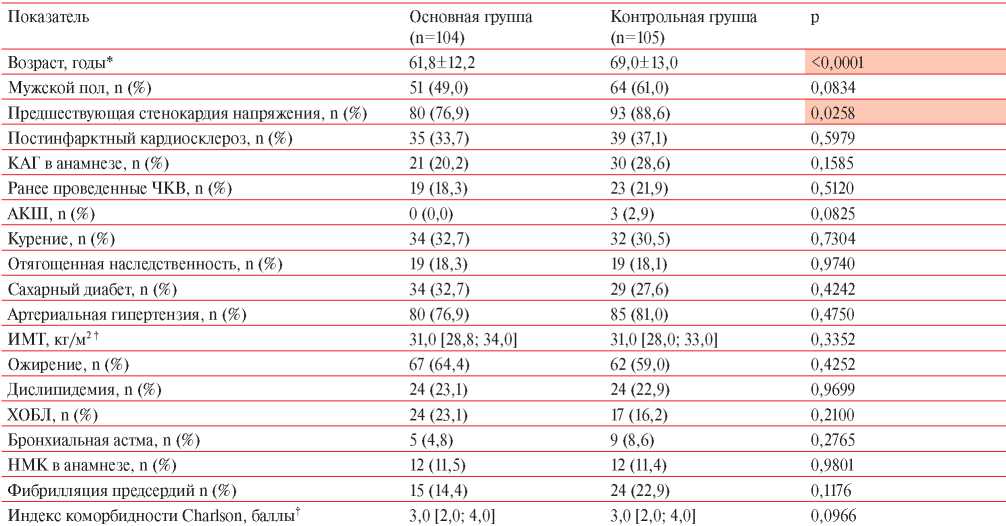
Примечание: АКШ — аортокоронарное шунтирование, ИМТ — индекс массы тела, НМК — нарушения мозгового кровообращения, ХОБЛ — хроническая обструктивная болезнь легких, ЧКВ — чрескожное коронарное вмешательство; * — M±SD; † — Me [Q25; Q75].
В таблице 3 представлены результаты распределения больных ИМбпST в соответствии со стадиями хронической болезни почек (ХБП). Среди пациентов группы контроля статистически достоверно чаще отмечалась стадия ХБП 3а и выше (χ2=15,44; df=4; p=0,0039). По распределению иных сопутствующих заболеваний и факторов риска, пациенты обеих групп были сопоставимы.
Таблица 3
Анализ распределения пациентов с ИМбпST в соответствии со стадией ХБП

Клинические данные и результаты объективного и инструментального обследования пациентов обеих групп представлены в таблице 4. При поступлении в стационар типичный ангинозный болевой синдром отмечался у подавляющего большинства пациентов обеих групп. Жалобы на предшествующую одышку на фоне привычных физических нагрузок предъявляли ~1/3 пациентов основной и контрольной группы (р=0,8449). Кашель несколько чаще отмечался у пациентов основной группы, однако различия статистически незначимы (р=0,0951). Гемодинамические показатели в обеих группах сопоставимы между собой, а средние значения не отклонялись от общепринятых норм. По тяжести острой сердечной недостаточности (Killip) пациенты основной группы и группы сравнения между собой также не различались (p>0,05).
Таблица 4
Клинические данные пациентов с ИМбпST при поступлении в стационар
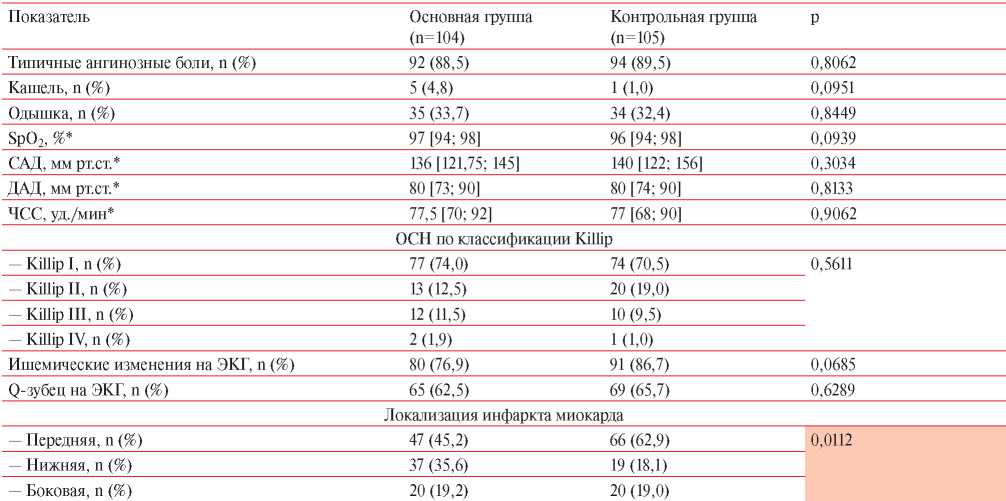
Примечание: ДАД — диастолическое артериальное давление, ОСН — острая сердечная недостаточность, САД — систолическое артериальное давление, ЧСС — частота сердечных сокращение, * — Me [Q25; Q75].
В таблице 5 представлены результаты сравнения показателей ЭхоКГ у пациентов обеих групп. У пациентов основной группы отмечалось более высокое расчетное высокое систолическое давление в легочной артерии (СДЛА), чем в группе контроля (р=0,0097), по остальным показателям, значимых различий между группами выявлено не было (p>0,05).
Таблица 5
Данные ЭхоКГ у пациентов с ИМбпST
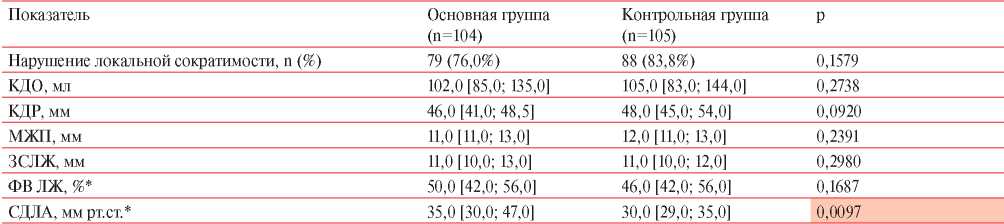
Примечание: КДО — конечно-диастолический объем, КДР — конечно-диастолический размер, МЖП — межжелудочковая перегородка, ЗСЛЖ — задняя стенка левого желудочка, ФВ ЛЖ — фракция выброса левого желудочка, * — Me [Q25; Q75].
Результаты проведенной КАГ (таблица 6) показали, что по тяжести гемодинамически значимого поражения КА обе группы были также сопоставимы.
Таблица 6
Характеристика поражений КА у пациентов с ИМбпST по данным КАГ

Примечание: SYNTAX Score — шкала SYNTAX (Synergy between Percutaneous Coronary Intervention with TAXUS and Cardiac Surgery); * — Me [Q25; Q75].
Лабораторные данные пациентов обеих групп представлены в таблице 7. По показателям гемограммы и коагулограммы в исследуемых группах статистически значимых различий не выявлено (p>0,05). В биохимическом анализе крови у пациентов основной группы показатели мочевины и креатинина статистически значимо ниже, а клиренс креатинина статистически значимо выше, чем в контрольной группе. Уровень СРБ и тропонина I в основной группе оказался достоверно выше в сравнении с группой контроля.
Таблица 7
Данные лабораторных исследований у пациентов с ИМбпST
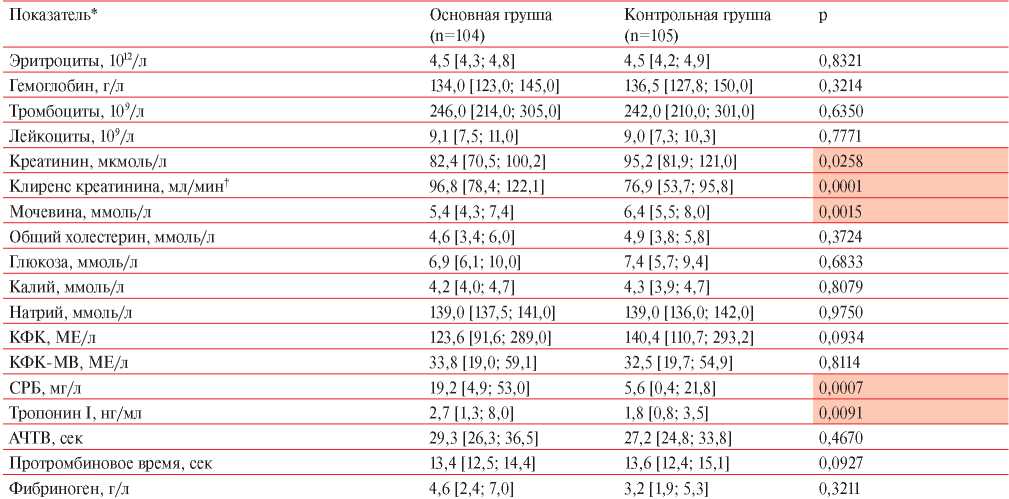
Примечание: АЧТВ — активированное частичное тромбопластиновое время, КФК — креатинфосфокиназа, СРБ — С-реактивный белок; * — Me [Q25; Q75]; † — по формуле Кокрофта-Голта.
Обсуждение
В ходе проведенного анализа установлен ряд различий между пациентами с ИМбпST, болевшими и неболевшими COVID-19, по данным клинико-анамнестических, лабораторных и инструментальных исследований. Пациенты с ИМбпST, перенесшие COVID-19, по сравнению с группой контроля оказались статистически значимо моложе. Несмотря на недостигнутую статистическую значимость, отмечалась тенденция к преобладанию женского пола в группе больных, перенесших COVID-19 в сравнении с группой контроля. Это может объясняться несколько большей частотой инфицирования среди женщин, что, по данным, опубликованным Организацией объединенных наций и Всемирной организацией здравоохранения, обусловлено, в первую, очередь социально-экономическими факторами [12]. Предшествующая ИМ стенокардия напряжения отмечалась у подавляющего большинства пациентов обеих групп, однако в основной группе частота была несколько ниже, что может быть следствием более молодого возраста больных и преобладания женского пола. Более высокая частота ИМбпST нижней локализации, наблюдаемая в основной группе больных, может также являться следствием преобладания лиц женского пола в группе пациентов, перенесших COVID-19. Эти данные сопоставимы с ранее опубликованными, в которых указывается на большую распространенность нижнего и бокового ИМ среди женщин [13]. У пациентов, перенесших COVID-19, регистрировались статистически значимо более высокие значения СДЛА в сравнении с группой контроля, эти данные подтверждаются уже опубликованными результатами исследований, которые указывают на высокую степень распространенности ЭхоКГ-признаков легочной гипертензии, в т.ч. повышения СДЛА, среди пациентов с перенесенной COVID-19 [14].
Особый интерес представляет распределение пациентов, перенесших COVID-19, по тяжести течения инфекции. Согласно данным литературы, частота бессимптомного течения COVID-19 достаточно вариабельна, однозначных эпидемиологических данных пока не представлено. В большинстве публикаций частота бессимптомного течения составляет 35-40% [15], но по некоторым данным может превышать 80%. В популяционном исследовании, проведенном на пике заболеваемости COVID-19 в Санкт-Петербурге, бессимптомное течение инфекции зафиксировано в 84,5% случаев среди серопозитивных лиц, прошедших обследование (n=2713), не имевших в анамнезе COVID-19, положительного результата ПЦР [16]. Аналогичные результаты продемонстрированы в отчете Ing A [17] на примере распространения COVID-19 в условиях изолированного круизного лайнера “Ernest Shackleton”, на борту которого находились 217 пассажиров — в 81% случаев COVID-19 протекал бессимптомно, >50% пассажиров лайнера Diamond Princess также имели бессимптомное течение [18]. При сопоставлении полученных данных с опубликованными ранее обращает на себя внимание тот факт, что в 61,5% случаев пациенты с ИМбпST имели симптомное течение COVID-19, что позволяет рассматривать данную категорию как наиболее подверженную риску ССО в ПКП. Кроме того, 74,1% пациентов перенесли COVID-19 в бессимптомной или легкой форме, что вызывает значительную настороженность, и требует проведения дальнейшего обследования и наблюдения за пациентами после COVID-19 вне зависимости от тяжести перенесенной инфекции.
Пациенты, перенесшие COVID-19, характеризовались более низким уровнем креатинина и мочевины и высокими показателями клиренса креатинина, что является следствием сравнительно низкой распространенности ХБП в группе переболевших COVID-19 в целом. Кроме того, для перенесших COVID-19 был характерен более высокий уровень СРБ, чем у пациентов без COVID-19 в анамнезе. В опубликованных отчетах результатов обследования пациентов в ПКП указывается на сохранение повышенного уровня острофазных белков в течение длительного времени после клинического выздоровления [14][19]. В свою очередь, это может являться признаком продолжающегося фонового системного воспалительного процесса. Как известно, пациенты с ИМ и более высоким уровнем СРБ имеют худшие ближайшие и отдаленные прогнозы по сравнению с пациентами, имеющими низкий уровень СРБ [20].
Более высокий уровень тропонина I в основной группе может не только указывать на объем ишемизированного миокарда, но и на признаки ранее описанного, продолжающегося ковидного стрессорного миокардита [21]. Достаточно частой находкой у пациентов с COVID-19 является повышение уровня высокочувствительного тропонина [22], однако достоверных данных о прямом цитопатическом воздействии SARS-CoV-2 на кардиомиоциты крайне мало [23]. В опубликованном обсервационном исследовании [24], по данным магнитно-резонансной томографии сердца, у пациентов с перенесенной COVID-19 выявлены более высокий конечно-диастолический объем, масса миокарда, повышение времени продольной и поперечной релаксации Т1 и Т2. Результаты биопсии миокарда показали наличие гистологических признаков воспаления и лимфоцитарной инфильтрации [24].
Полученные в настоящей работе результаты у пациентов с ИМбпST обеих групп были сопоставлены с данными, опубликованными ранее в крупных отечественных регистрах РЕКОРД 1-3 (РЕгистр острого КОРонарного синДрома), ЛИС 1,3 (Люберецкое Исследование Смертности больных, перенесших острый инфаркт миокарда), Московский регистр [25-28] и международных регистрах EHS-ACSII (Euro Heart Survey on acute coronary syndromes II), EPICOR (long-tErm follow uP of antithrombotic management patterns In acute CORonary syndrome patients) и GRACE (Global Registry of Acute Coronary Events) [29-31]. По демографическим и клиническим характеристикам, сопутствующей патологии пациенты контрольной группы, включавшей пациентов без COVID-19 в анамнезе, сопоставимы с данными регистров, что, несмотря на относительно небольшой объем выборки (n=209), в целом указывает на ее репрезентативность.
Основные ограничения настоящего исследования, обусловлены небольшим объемом выборки, одноцентровым характером исследования, высокой частотой бессимптомного и легкого течения COVID-19 среди пациентов с ИМбпST, что требует проведения отдельного, более детального анализа. Выявленные различия в группе пациентов с ИМбпST, перенесших COVID-19, требуют дальнейшего изучения, проведения корреляционного и факторного анализа.
Заключение
Полученные результаты позволили сформировать “портрет” пациента с ИМбпST, перенесшего COVID-19. Пациенты с ИМбпST, перенесшие COVID-19, статистически значимо моложе, в сравнении с пациентами без COVID-19 в анамнезе. У данных больных реже отмечалась предшествующая ИМ клиника стенокардии напряжения. Пациенты, перенесшие COVID-19, характеризовались более высоким уровнем CРБ и тропонина I в сравнении с пациентами контрольной группы. По объемным и линейным показателям ЭхоКГ значимых различий с группой контроля не выявлено, однако у пациентов, перенесших COVID-19, расчетное СДЛА было значимо выше. Средний срок развития ИМ после перенесенной COVID-19 составил 49 дней [ 34,0; 82,0 ].
Полученные данные позволяют рассматривать перенесенную COVID-19 в ПКП в качестве потенциального триггера более ранней манифестации ишемической болезни сердца в форме ИМ у пациентов, уже имевших иные факторы риска сердечнососудистых заболеваний. Ранние сроки развития ИМбпST после COVID-19, укладывающиеся в интервал “симптоматического периода COVID-19”, указывают на критически важное выделение временных периодов после разрешения острой фазы COVID-19, которые являются наиболее опасными по риску развитию ССО. Эти данные могут внести существенный вклад в оптимизацию диагностических и лечебных мероприятий, направленных на эффективную профилактику развития ССО в ПКП.
Дальнейшее выявление факторов риска ССО, определение их значимости, критических сроков по развитию осложнений после перенесенной COVID-19 в настоящее время представляют большой интерес и являются темой будущих исследований.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. COVID-19 Map — Johns Hopkins Coronavirus Resource Center n.d. https://coronavirus.jhu.edu/map.html. (accessed September 9, 2021).
2. Gao Z, Xu Y, Sun C, et al. A systematic review of asymptomatic infections with COVID-19. J Microbiol Immunol Infect. 2021;54:12- 6. doi:10.1016/J.JMII.2020.05.001.
3. Lam MH-B, Wing Y-K, Yu MW-M, et al. Mental Morbidities and Chronic Fatigue in Severe Acute Respiratory Syndrome Survivors: Long-term Follow-up. Arch Intern Med. 2009;169:2142-7. doi:10.1001/ARCHINTERNMED.2009.384.
4. Greenhalgh T, Knight M, A’Court C, et al. Management of post-acute covid-19 in primary care. BMJ. 2020;370:m3026. doi:10.1136/BMJ.M3026.
5. National Institute for Health and Care Excellence, Practitioners RC of G, Scotland HI. COVID-19 rapid guideline: managing the long-term effects of COVID-19. NICE Guidel. 2020:1-35.
6. Wu J, Mamas M, Rashid M, et al. Patient response, treatments, and mortality for acute myocardial infarction during the COVID-19 pandemic. Eur Hear J — Qual Care Clin Outcomes. 2020;0:1-9. doi:10.1093/ehjqcco/qcaa062.
7. Chughtai AA, Tan TC, Hitchen EM, et al. Association of influenza infection and vaccination with cardiac biomarkers and left ventricular ejection fraction in patients with acute myocardial infarction. IJC Hear Vasc. 2020;31:1-6. doi:10.1016/j.ijcha.2020.100648.
8. Vejpongsa P, Kitkungvan D, Madjid M, et al. Outcomes of Acute Myocardial Infarction in Patients with Influenza and Other Viral Respiratory Infections. Am J Med. 2019;132:1173-81. doi:10.1016/j.amjmed.2019.05.002.
9. Kaminski KA, Kozuch M, Bonda T, et al. Coronary sinus concentrations of interleukin 6 and its soluble receptors are affected by reperfusion and may portend complications in patients with myocardial infarction. Atherosclerosis. 2009;206:581-7. doi:10.1016/j.atherosclerosis.2009.03.033.
10. Van Den Berg VJ, Umans VAWM, Brankovic M, et al. Stabilization patterns and variability of hs-CRP, NT-proBNP and ST2 during 1 year after acute coronary syndrome admission: Results of the BIOMArCS study. Clin Chem Lab Med. 2020;58:2099-106. doi:10.1515/cclm-2019-1320.
11. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018). Eur Heart J. 2019;40:237-69. doi:10.1093/EURHEARTJ/EHY462.
12. United Nations. The Impact of COVID-19 on Women 2020. https://www.unwomen.org/-/media/headquarters/attachments/sections/library/publications/2020/policy-brief-the-impact-of-covid-19-on-women-en.pdf?la=en&vs=1406. (accessed October 13, 2021).
13. Liakos M, Parikh PB. Gender Disparities in Presentation, Management, and Outcomes of Acute Myocardial Infarction. Curr Cardiol Reports. 2018;20:1-9. doi:10.1007/S11886-018-1006-7.
14. Sonnweber T, Sahanic S, Pizzini A, et al. Cardiopulmonary recovery after COVID-19: an observational prospective multicentre trial. Eur Respir J. 2021;57:1-11. doi:10.1183/13993003.03481-2020.
15. Сыров А.В., Стуров Н.В., Колупаев В. Е. и др. Диагностика COVID-19 в амбулаторных условиях. Трудный пациент. 2020;18(5):6-9. doi:10.24411/2074-1995-2020-10031.
16. Попова А.Ю., Ежлова Е.Б., Мельникова А.А. и др. Популяционный иммунитет к SARSCoV-2 среди населения Санкт-Петербурга в период эпидемии. Проблемы Особо Опасных Инфекций. 2020;3:124-30. doi:10.21055/0370-1069-2020-3-124-130.
17. Ing AJ, Cocks C, Green JP. COVID-19: in the footsteps of Ernest Shackleton. Thorax. 2020;75:693-4. doi:10.1136/THORAXJNL-2020-215091.
18. Mizumoto K, Kagaya K, Zarebski A, et al. Estimating the asymptomatic proportion of coronavirus disease 2019 (COVID-19) cases on board the Diamond Princess cruise ship, Yokohama, Japan, 2020. Eurosurveillance. 2020;25:1-6. doi:10.2807/1560-7917.ES.2020.25.10.2000180.
19. Чащин М. Г., Горшков А.Ю., Драпкина О.М. Острый коронарный синдром у пациентов с COVID-19. Кардиоваскулярная терапия и профилактика. 2021;20(5):2806. doi:10.15829/1728-8800-2021-2806.
20. Sheikh AS, Yahya S, Sheikh NS, et al. C-reactive Protein as a Predictor of Adverse outcome in Patients with Acute Coronary Syndrome. Heart Views. 2012;13:7. doi:10.4103/1995-705X.96660.
21. Li C, Jiang J, Wang F, et al. Longitudinal correlation of biomarkers of cardiac injury, inflammation, and coagulation to outcome in hospitalized COVID-19 patients. J Mol Cell Cardiol. 2020;147:74- 87. doi:10.1016/j.yjmcc.2020.08.008.
22. Chen C, Yan JT, Zhou N, et al. Analysis of myocardial injury in patients with COVID-19 and association between concomitant cardiovascular diseases and severity of COVID-19. Zhonghua Xin Xue Guan Bing Za Zhi. 2020;48:567-71. doi:10.3760/cma.j.cn112148-20200225-00123.
23. Chen L, Li X, Chen M, et al. The ACE2 expression in human heart indicates new potential mechanism of heart injury among patients infected with SARS-CoV-2. Cardiovasc Res. 2020;116:1097-100. doi:10.1093/cvr/cvaa078.
24. Puntmann VO, Carerj ML, Wieters I, et al. Outcomes of Cardiovascular Magnetic Resonance Imaging in Patients Recently Recovered From Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020;5:1265-73. doi:10.1001/JAMACARDIO.2020.3557.
25. Эрлих А. Д. 12-месячные исходы у пациентов с острым коронарным синдромом, включённых в российский регистр РЕКОРД-3. Российский кардиологический журнал. 2018;(3):23-30. doi:10.15829/1560-4071-2018-3-23-30.
26. Марцевич С.Ю., Гинзбург М. Л., Кутишенко Н.П. и др. Исследование ЛИС (люберецкое исследование смертности больных, перенесших острый инфаркт миокарда). Оценка лекарственной терапии часть 1. Как лечатся больные перед инфарктом миокарда, и как это влияет на смертность в стационаре. Рациональная Фармакотерапия в Кардиологии. 2012;8(5):681-4. doi:10.20996/1819-6446-2012-8-5-681-684.
27. Марцевич С. Ю., Семенова Ю.В., Кутишенко Н.П. и др. Регистр острого коронарного синдрома ЛИС-3: что изменилось за прошедшие годы в “портрете” больного и ближайших исходах заболевания в сравнении с регистром ЛИС-1. Рациональная фармакотерапия в кардиологии. 2017;13(1):63-8. doi:10.20996/1819-6446-2017-13-1-63-68.
28. Эрлих А.Д. Первый московский регистр острого коронарного синдрома: результаты 6-месячного наблюдения. Неотложная кардиология. 2014;2:3-9.
29. Mandelzweig L, Battler A, Boyko V, et al. The second Euro Heart Survey on acute coronary syndromes: characteristics, treatment, and outcome of patients with ACS in Europe and the Mediterranean Basin in 2004. Eur Heart J. 2006;27:2285-93. doi:10.1093/EURHEARTJ/EHL196.
30. Tang EW, Wong CK, Herbison P. Global Registry of Acute Coronary Events (GRACE) hospital discharge risk score accurately predicts long-term mortality post acute coronary syndrome. Am Heart J. 2007;153:29-35. doi:10.1016/J.AHJ.2006.10.004.
31. Pocock S, Bueno H, Licour M, et al. Predictors of one-year mortality at hospital discharge after acute coronary syndromes: A new risk score from the EPICOR (long-tErm follow uP of antithrombotic management patterns In acute CORonary syndrome patients) study. Eur Heart J. Acute Cardiovasc Care. 2015;4:509-17. doi:10.1177/2048872614554198.
Об авторах
М. Г. ЧащинРоссия
Чащин Михаил Георгиевич — младший научный сотрудник отдела фундаментальных и прикладных аспектов ожирения, врач-анестезиолог-реаниматолог отделения реанимации и интенсивной терапии для больных с острым инфарктом миокарда
Москва
SPIN-код: 4511-5960
А. Ю. Горшков
Россия
Горшков Александр Юрьевич — кандидат медицинских наук, руководитель лаборатории микроциркуляции и регионарного кровообращения
Москва
О. М. Драпкина
Россия
Драпкина Ольга Михайловна — доктор медицинских наук, профессор, член-корреспондент РАН, директор
Москва
И. В. Косицына
Россия
Косицына Ирина Васильевна — врач-анестезиолог-реаниматолог отделения реанимации и интенсивной терапии для больных с острым инфарктом миокарда, кандидат медицинских наук, доцент кафедры скорой медицинской помощи
Москва
А. В. Голубев
Россия
Голубев Алексей Владимирович — заведующий отделением реанимации и интенсивной терапии для больных с острым инфарктом миокарда, врач-анестезиолог-реаниматолог, кандидат медицинских наук, доцент кафедры скорой медицинской помощи
Москва
Н. И. Чаус
Россия
Чаус Николай Иванович — кандидат медицинских наук, заместитель главного врача по анестезиологии и реаниматологии, доцент кафедры анестезиологии и неотложной медицины
Москва
С. Н. Переходов
Россия
Переходов Сергей Николаевич — доктор медицинских наук, профессор, главный врач, заведующий кафедрой госпитальной хирургии
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Чащин М.Г., Горшков А.Ю., Драпкина О.М., Косицына И.В., Голубев А.В., Чаус Н.И., Переходов С.Н. Клинико-анамнестическая характеристика пациентов с инфарктом миокарда без подъема сегмента ST, перенесших COVID-19. Кардиоваскулярная терапия и профилактика. 2021;20(7):3062. https://doi.org/10.15829/1728-8800-2021-3062
For citation:
Chashchin M.G., Gorshkov A.Yu., Drapkina O.M., Kositsyna I.V., Golubev A.V., Chaus N.I., Perekhodov S.N. Clinical and anamnestic characteristics of patients with non-ST elevation myocardial infarction after COVID-19. Cardiovascular Therapy and Prevention. 2021;20(7):3062. https://doi.org/10.15829/1728-8800-2021-3062
JATS XML

























































