Перейти к:
Опыт использования стент-графтов в лечении пациентов с аррозионным кровотечением после операций на поджелудочной железе
https://doi.org/10.15829/1728-8800-2022-3257
Аннотация
Цель. Оценить госпитальные результаты рентгенэндоваскулярного лечения у пациентов, которым было выполнено эндопротезирование пораженного сосуда при аррозионном кровотечении после операции на поджелудочной железе.
Материал и методы. В период 2012-2021гг в НМИЦ хирургии им. А. В. Вишневского Минздрава России была выполнена 821 операция на поджелудочной железе (ПЖ) по поводу опухолей ПЖ и осложненных форм хронического панкреатита. У 75 (9,1%) пациентов развилось послеоперационное аррозионное кровотечение. Для остановки кровотечений у 14 (18,7%) из них были использованы стент-графты. Мужчин было 9 (64,3%), женщин — 5 (35,7%). Медиана возраста пациентов составила 60 лет: мужчины — 61 год, женщины — 59 лет. Аррозионное кровотечение возникло после панкреатодуоденальной резекции у 13 пациентов, в одном наблюдении отмечено после дистальной резекции ПЖ. Во всех 14 наблюдениях послеоперационные кровотечения относились к тяжелым и классифицировались как тип С по классификации ISGPS (International Study Group for Pancreatic Surgery).
Результаты. Источниками кровотечения являлась: гастродуоденальная артерия у 4 (28,6%), проксимальные сегменты печеночных артерий (правая/левая) — у 4 (28,6%) пациентов, проксимальный сегмент верхней брыжеечной артерии — у 2 (14,3%), дорсальная панкреатическая артерия — у 1 (7,1%), ложная аневризма проксимального сегмента селезеночной артерии — у 1 (7,1%), проксимальный сегмент общей печеночной артерии — у 2 (14,3%). У 10 (71,4%) пациентов выполнили эндопротезирование проксимального сегмента пораженной артерии, у 4 (28,6%) — при аррозии короткой культи гастродуоденальной артерии и ложной аневризмы, выполнено эндопротезирование общей печеночной артерии с переходом в собственную печеночную артерию. Технический успех рентгенэндоваскулярного гемостаза, характеризующийся отсутствием экстравазации контрастного вещества, достигнут в 100% наблюдений. У 3 (21,4%) из 14 пациентов развилось повторное кровотечение из другого артериального источника. Госпитальная летальность составила 28,6% (4 пациента). Причиной летальных исходов в 3 случаях служили непосредственные осложнения рентгенэндоваскулярного гемостаза, в одном наблюдении — прогрессирующее течение послеоперационного панкреатита с исходом в полиорганную недостаточность.
Заключение. Рентгенэндоваскулярный гемостаз с использованием стент-графта является эффективным оперативным методом лечения аррозионных кровотечений после операций на ПЖ. Вмешательство сопряжено с возможными осложнениями, риск которых необходимо учитывать при формировании показаний к данному методу гемостаза. Показанием к выполнению эндопротезирования артерий считаем возникновение аррозионного кровотечения из дефекта магистрального сосуда (общая/собственная/ правая или левая печеночные артерии, верхняя брыжеечная артерия).
Для цитирования:
Алекян Б.Г., Варава А.Б., Горин Д.С., Лусников В.П. Опыт использования стент-графтов в лечении пациентов с аррозионным кровотечением после операций на поджелудочной железе. Кардиоваскулярная терапия и профилактика. 2022;21(5):3257. https://doi.org/10.15829/1728-8800-2022-3257
For citation:
Alekyan B.G., Varava A.B., Gorin D.S., Lusnikov V.P. Experience of using stent grafts in the treatment of patients with arrosive bleeding after pancreatic surgery. Cardiovascular Therapy and Prevention. 2022;21(5):3257. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3257
Введение
Операции на поджелудочной железе (ПЖ) являются одними из наиболее сложных вмешательств в абдоминальной хирургии и зачастую сопряжены с высоким риском послеоперационных осложнений. Одной из ведущих причин послеоперационной летальности при резекционных вмешательствах на ПЖ является послеоперационное кровотечение [1]. По данным Wolk S, et al., кровотечение после резекционных вмешательств на ПЖ встречается в 11-38% случаев и характеризуется высокой летальностью (от 30 до 50%) при выполнении релапаратомии с целью гемостаза [2].
Согласно классификации ISGPS (International Study Group for Pancreatic Surgery), кровотечения после резекционных вмешательств на ПЖ по времени возникновения делятся на ранние (до 24 ч) и поздние (после 24 ч) от окончания операции на ПЖ [1]. Поздние кровотечения чаще всего носят аррозионный характер и, как правило, патогенетически связаны с послеоперационным панкреатитом и панкреатическим свищом. Воздействие агрессивного панкреатогенного отделяемого на компрометированную, в результате лимфодиссекции сосудистую стенку, приводит к ее повреждению с последующим возникновением кровотечения [3][4]. В последнее время для остановки послеоперационных кровотечений все большее распространение получают методы рентгенэндоваскулярного гемостаза [5][6].
Имплантация стент-графтов при кровотечении из магистральных сосудов (общей печеночной артерии, ОПА) и ее ветвей, а также верхней брыжеечной артерии (ВБА) способствует сохраняю артериального кровотока дистальнее сосудистого дефекта, что позволяет избежать ишемии кровоснабжаемых органов и минимизировать риск развития органной недостаточности, абсцессов печени [7].
Ранее были опубликованы результаты исследования, в котором оценивались источники кровотечения, технический успех, рецидив кровотечения, характеристика используемых методов при выполнении рентгенэндоваскулярного гемостаза у 74 пациентов с поздним аррозионным кровотечением после резекционных вмешательств на ПЖ. Было выявлено 84 источника кровотечения. Наиболее часто встречающимися артериями были бассейн гастродуоденальной артерии (ГДА) — 35,7%, бассейн ВБА — 21,4%, артерии печени — 17,9%; другие артериальные бассейны были редкими. При выполнении трансартериальной эмболизации (ТАЭ) технический успех составил 100%. Госпитальная летальность составила 12,2% пациентов. Таким образом, пришли к выводу, что ТАЭ является эффективной лечебной процедурой у пациентов с аррозионным кровотечением [8].
Материал и методы
С 2011 по 2021гг в НМИЦ хирургии имени А.В. Виш - невского была выполнена 821 резекционная операция на ПЖ. У 75 (9,1%) пациентов развилось позднее послеоперационное кровотечение. В 14 (18,7%) наблюдениях при позднем послеоперационном кровотечении гемостаз был достигнут при рентгенэндоваскулярном лечении с имплантацией стент-графтов.
Сравнительная характеристика групп пациентов, которым была выполнена имплантация стент-графта с целью остановки кровотечения, продемонстрировала их статистическую однородность (таблица 1). Медиана возраста пациентов составила 60 лет (Min-Max: 35-73): у мужчин 61 год (Min-Max: 37-70), у женщин 59 лет (Min-Max: 35-73). С опухолью ПЖ было 12 (85,7%) пациентов, а с осложненными формами хронического панкреатита — 2 (14,3%).
Таблица 1
Клиническая характеристика пациентов (n=14)
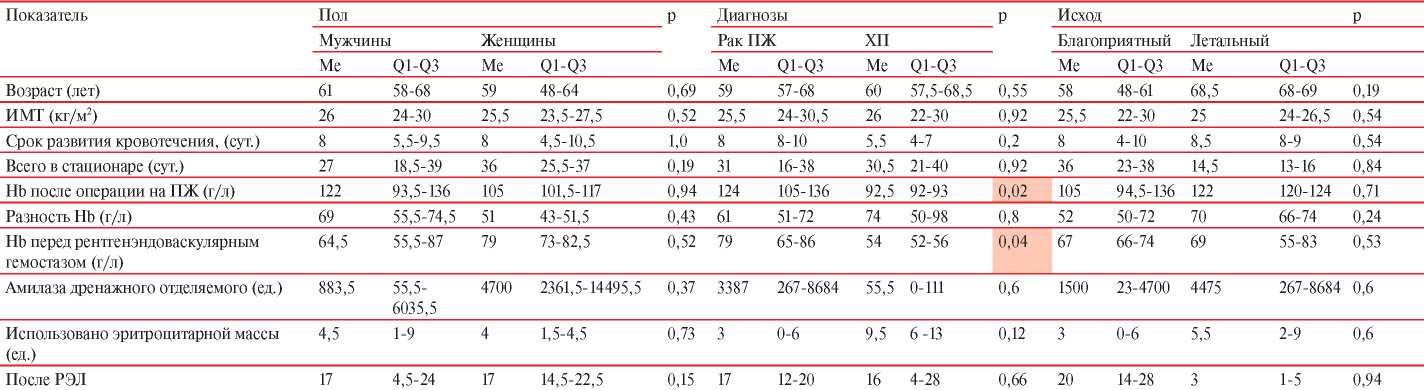
Примечание: Hb — гемоглобин, ХП — хронический панкреатит, РЭЛ — рентгенэндоваскулярное лечение, ИМТ — индекс массы тела.
Аррозионное кровотечение возникло после панкреатодуоденальной резекции (ПДР) у 13 пациентов, в одном наблюдении — после дистальной резекции (ДР) ПЖ. Медиана развития кровотечения у пациентов составила 8 сут. (интерквартильный размах (Q1; Q3): 7-12 сут.) после оперативного вмешательства на ПЖ и характеризовалась снижением гемоглобина крови на 69 г/л (55,5-74,5 г/л) у мужчин и на 51 г/л (43-51,5 г/л) у женщин. Данное снижение уровня гемоглобина крови сопровождалось пресинкопальными и синкопальными состояниями, нестабильной гемодинамикой пациентов. Поскольку у всех пациентов было отмечено снижение уровня гемоглобина на >30 г/л, их состояние было классифицировано как тяжелая степень послеоперационного кровотечения С (ISGPS), угрожающего жизни.
Выбор артериального доступа зависел от анатомии целиако-мезентериального бассейна (ЦМБ) и ангуляции мезентериальных артерий относительно аорты. При ангуляции чревного ствола (ЧС) и/или ВБА <450 относительно аорты предпочтение было за трансбрахиальным доступом, при ангуляции >450— трансфеморальным. Чаще использовался трансфеморальный доступ, который применен у 10 (71,4%) пациентов, в 4 (28,6%) наблюдениях рентгенэндоваскулярный гемостаз выполнялся трансбрахиальным доступом.
Первичной конечной точкой служил технический успех операции, проявляющийся в отсутствии экстравазации контрастного вещества и стабилизации состояния пациента. Вторичной конечной точной являлась сохраненная проходимость стент-графта.
Статистическая обработка. Результаты исследования были подвергнуты статистической обработке с использованием методов параметрического и непараметрического анализа. Статистический анализ проводился с использованием программы IBM SPSS Statistics v.26. Совокупности количественных показателей, распределение которых отличалось от нормального, описывались при помощи значений медианы (Me), интерквартильного размаха (Q1; Q3), а также минимумом и максимумом (Min-Max). Для сравнения независимых совокупностей, в случаях отсутствия признаков нормального распределения данных, использовался U-критерий Манна-Уитни. Статистически значимыми считали различия при р<0,05.
Результаты
При выполнении ангиографии во всех 14 наблюдениях выявлены источники кровотечения: культя ГДА — у 4 (28,6%) больных, левая/правая печеночные артерии — 4 (28,6%), ВБА и аберрантные ветви печени (общая и правая) — 4 (28,6%), дорсальная панкреатическая артерия (ДПА) — у 1 (7,1%), селезеночная артерия (СА) — 1 (7,1%). Эндопротезирование ОПА с переходом в собственную печеночную артерию (СПА) было выполнено 5 (35,7%) пациентам, правой/левой печеночных артерий — 4 (28,6%), ВБА — 2 (14,3%), СА с выходом в ЧС — 2 (14,3%). На рисунке 1 отмечены наиболее часто встречающиеся источники кровотечения и их анатомическая топография.
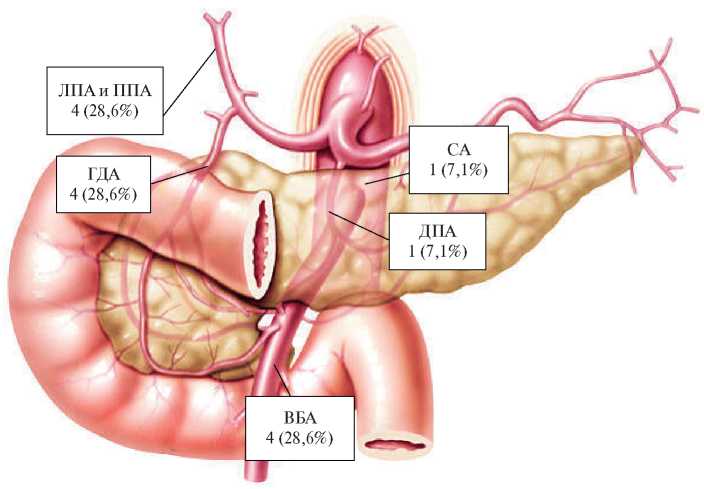
Рис. 1 Источники кровотечения в соответствии с анатомической топографией: ЛПА, ППА, ДПА.
Примечание: ВБА — верхняя брыжеечная артерия, ГДА — гастродуоденальная артерия, ДПА — дорсальная панкреатическая артерия, ЛПА — левая печеночная артерия, ППА — правая печеночная артерия, СА — селезеночная артерия.
Этапность выполнения рентгенэндоваскулярного гемостаза
При выполнении диагностической цифровой субтракционной ангиографии и визуализации более одного источника кровотечения, очередность рентгенэндоваскулярного гемостаза определялась с учетом источника кровотечения, который в большей степени оказывал влияние на гемодинамический статус пациента. При экстравазации контрастного вещества из проксимального сегмента висцеральной артерии первым этапом выполнялось эндопротезирование, а затем эмболизация иного источника кровотечения, таких случаев было 2. В таблице 2 представлена этапность выполнения операции в зависимости от источника кровотечении, а также указана зона имплантации стент-графта.
Таблица 2
Этапы рентгенэндоваскулярного гемостаза с применением стент-графта
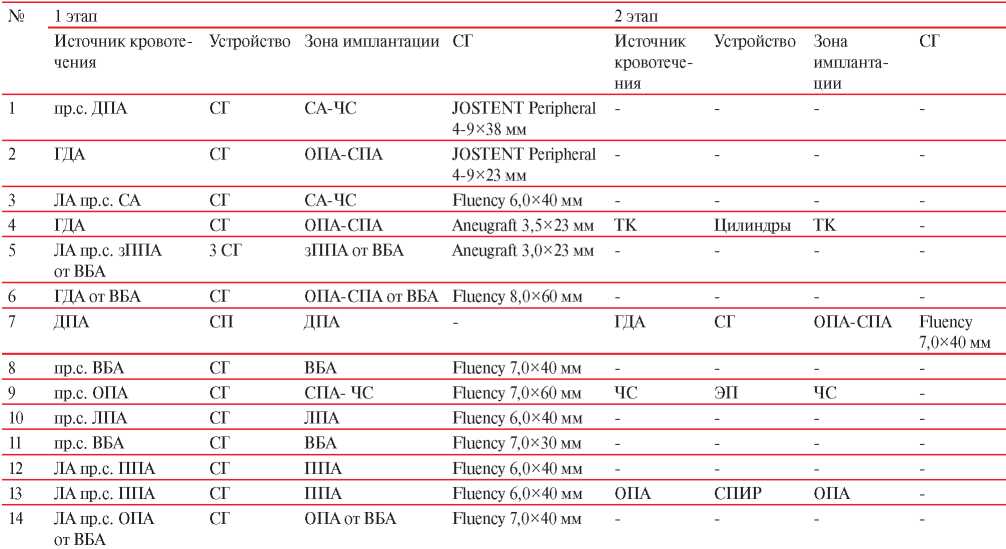
Примечание: ЛА — ложная аневризма, ТК — тощекишечная артерия, СГ — стент-графт, СП — спираль, ЭП — эндоваскулярный плаг, ППА — правая печеночная артерия, ЛПА — левая печеночная артерия, зППА — замещающая правая печеночная артерия, ДПА — дорсальная панкреатическая артерия; пр.с. — проксимальный сегмент.
С целью сохранения дистального артериального кровотока, снижения риска ишемических осложнений, а также профилактики рецидива кровотечения у 10 (71,4%) пациентов выполнялось эндопротезирование проксимального сегмента висцеральных артерий: артерий печени (правой/ левой), СА с переходом в ЧС, ВБА. У 4 (28,6%) пациентов показанием к эндопротезированию ОПА с переходом в СПА являлись аррозия короткой культи ГДА и/или наличие ложной аневризмы.
Подбор стент-графта
В условиях гиповолемии, местной воспалительной реакции и сосудистого спазма крайне важно определить необходимую длину и диаметр стентграфта. Недостаточный диаметр может привести к неполному прилеганию стента-графта к стенкам пораженного сосуда и/или его миграции. В то же время избыточный диаметр стент-графта может привести к повреждению сосудистой стенки — диссекции или разрыву. Также принципиально важно учитывать зону имплантации, чтобы стент-графт закрывал артериальный дефект, но не компрометировал/окклюзировал крупные артериальные ветви.
При определении параметров стент-графта ориентировались на данные мультиспиральной компьютерной томографии (МСКТ)-ангиографии, выполненной до оперативного вмешательства на ПЖ, где измеряли длину сосуда и его диаметр. На МСКТ-ангиографии, выполненной при подозрении на аррозионное кровотечение, необходимо оценить размер артериального дефекта и длину зоны имплантации стент-графта. В таблице 2 представлены виды примененных стент-графтов при различных источниках кровотечения.
Чаще всего использовали стент-графт Fluency как в позицию ОПА, так и в проксимальную часть ВБА размерами 7,0×40 мм (таблица 2). Данный стент-графт является самораскрывающимся, что способствует уменьшению травматизации аррозированного сосуда, однако он имеет чрезмерный профиль доставляющего катетера, что создает трудности при выполнении вмешательства и выборе артериального доступа. На рисунках 2-5 представлены различные варианты эндопротезирования висцеральных артерий.
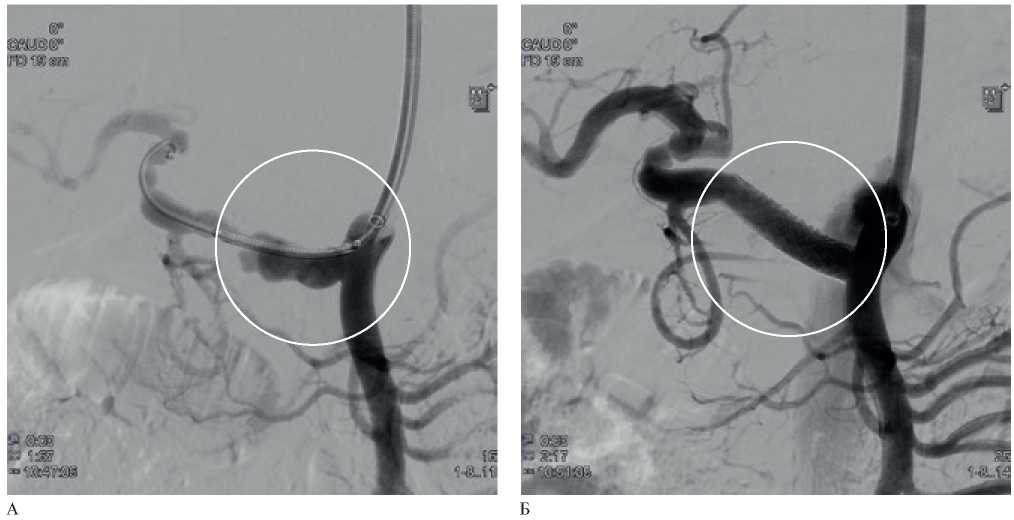
Рис. 2 Ангиограмма висцеральных артерий: А — ложная аневризма ОПА, отходящей от ВБА; Б — эндопротезирование ОПА (бассейн ВБА).
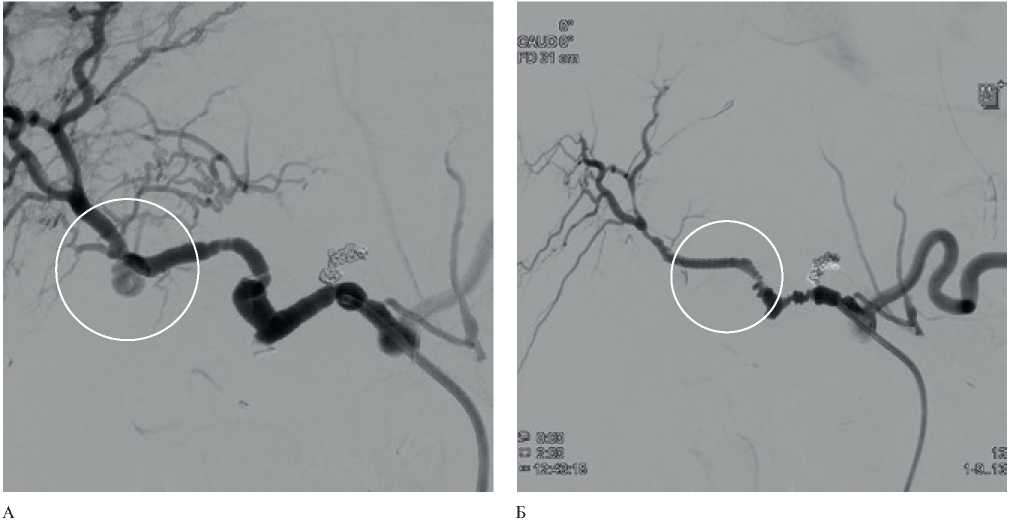
Рис. 3 Ангиограмма висцеральных артерий: А — аневризма проксимального сегмента правой печеночной артерии; Б — эндопротезирование проксимального сегмента правой печеночной артерии.
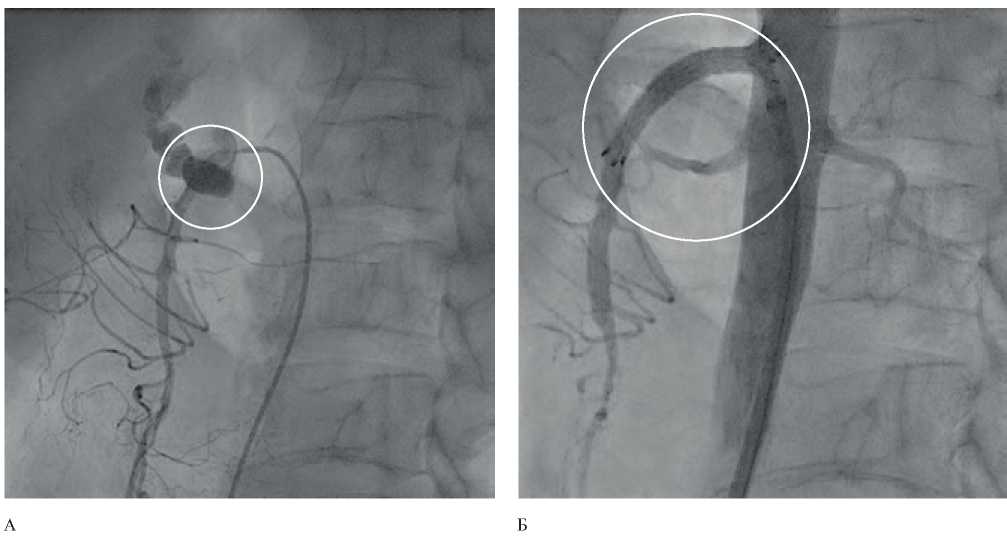
Рис. 4 Ангиограмма висцеральных артерий: А — экстравазация контрастного вещества из проксимального сегмента ВБА; Б — эндопротезирование проксимального сегмента ВБА.
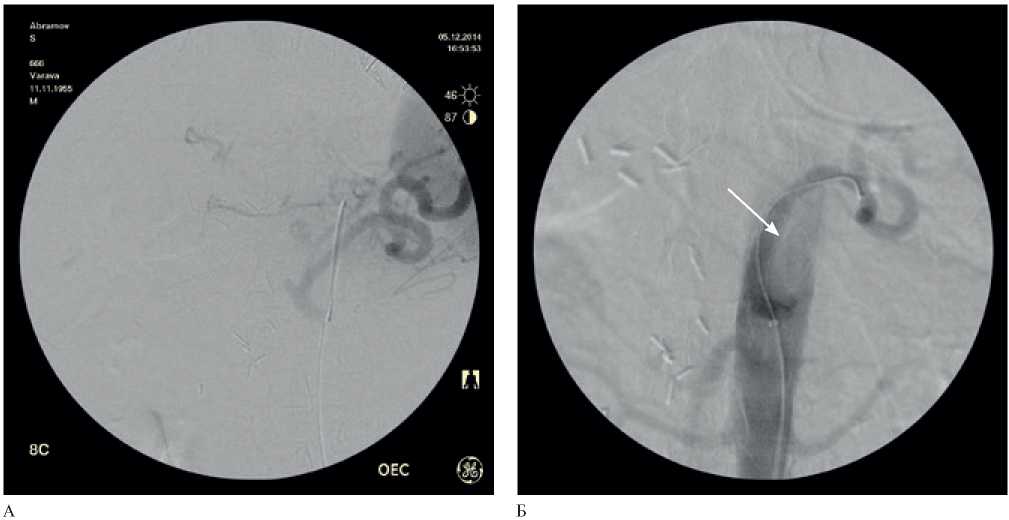
Рис. 5 Ангиограмма висцеральных артерий: А — ложная аневризма проксимального сегмента СА по данным МСКТ-ангиографии; Б — эндопротезирование проксимального сегмента СА. ОПА лигирована во время открытого хирургического вмешательства.
Медиана времени, затраченного на выполнение рентгенэндоваскулярного гемостаза, составила 72,5 (55-105) мин: при трансфеморальном доступе — 65 (55-78) мин, при трансбрахиальном — 110 (77,5-130) мин. При сравнении с помощью U-критерия Манна-Уитни времени, затраченного на выполнение операции, в зависимости от выбранного доступа, статистически значимых различий выявлено не было (р=0,137). Длительность операции в зависимости от артериального доступа представлена на рисунке 6.
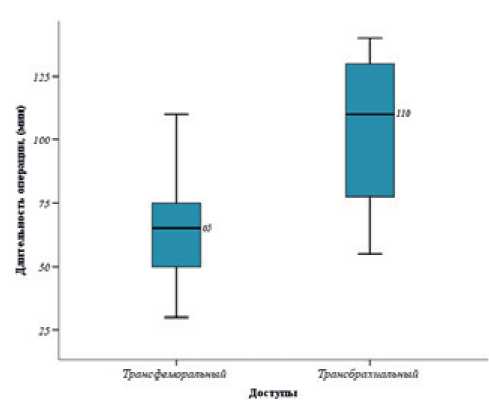
Рис. 6 Длительность рентгенэндоваскулярного гемостаза в зависимости от доступа.
При выполнении анализа исхода операции от выбора артериального доступа не было выявлено статистически значимых различий (р=1,0), что позволяет сделать вывод о том, что выбор артериального доступа не влияет на исход, однако несет в себе риски осложнений, связанные с доступом.
Технический успех операции, определяющийся как отсутствие экстравазации контрастного вещества в целевом сосуде, достигнут у всех пациентов. У 9 (80%) из них при дуплексном сканировании перед выпиской отмечалась проходимость ранее имплантированных стент-графтов, а у 1 (10%) был выявлен их тромбоз, без клинических проявлений.
Осложнения
Специфические осложнения рентгенэндоваскулярного гемостаза по времени развития можно разделить на интраоперационные и ранние послеоперационные. Интраоперационное осложнение развилось у 1 (7,1%) пациента при имплантации стент-графта в ОПА с переходом СПА, перекрытием зоны дефекта устья ГДА, отмечался дефект контрастирования — диссекция проксимального сегмента ОПА с переходом на среднюю треть СПА, что потребовало имплантации дополнительного стент-графта (рисунок 7). В раннем послеоперационном периоде у 3 (21,4%) пациентов выявились следующие осложнения: у пациентки с трансбрахиальным артериальным доступом развилась пульсирующая гематома в месте доступа с последующим ее переходом в флегмону локтевого сгиба, что потребовало хирургической санации данной зоны. Возникшее профузное кровотечение из плечевой артерии послужило причиной развития геморрагического шока и полиорганной недостаточности, далее с развитием синдрома полиорганной недостаточности (СПОН) и летальным исходом; во втором случае на первые сутки после эндопротезирования ОПА в позиции отхождения ГДА развился тромбоз стент-графта, приведший к абсцедированию II и III сегментов печени, а также нарастанию ферментов цитолиза гепатоцитов — аланинаминотрансферазы и аспартатаминотрансферазы (АЛТ, АСТ), что в последующем привело к развитию СПОН и летальному исходу; у третьего пациента также на 1 сут. после эндопротезирования ОПА развился тромбоз стент-графта без клинически значимого нарушения функции печени.
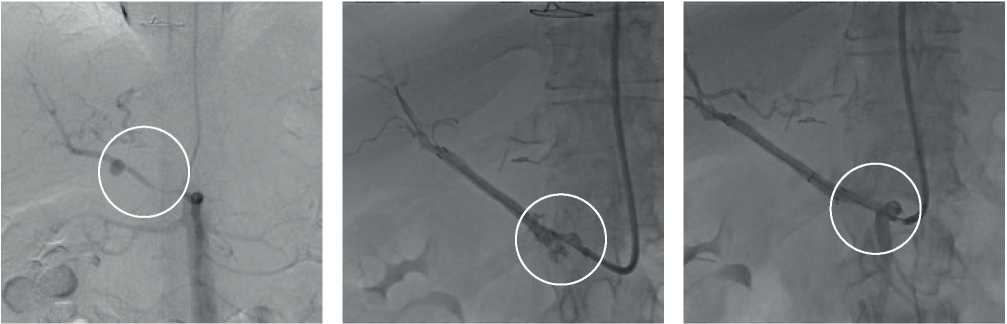
Рис. 7 Ангиограмма висцеральных артерий: А — ложная аневризма устья ГДА; Б — диссекция проксимального сегмента ОПА, отходящая от ВБА; В — дополнительное эндопротезирование ОПА от устья.
Рецидив кровотечения отмечен у 3 (21,4%) пациентов. Учитывая сроки развития рецидива, медиана которого составила 4 (1-6) сут., можно полагать, что его возникновение было связано с прогрессирующим течением тяжелого послеоперационного панкреатита. Источниками кровотечения являлись дистальная ветвь средней ободочной артерии (бассейн ВБА), левая желудочная и желудочно-сальниковая артерии. Для окклюзии использовались некалиброванные частицы PVA (Contour).
Госпитальная летальность при выполнении операции рентгенэндоваскулярного гемостаза с использованием стент-графтов составила 28,6% (4 пациента). Причиной летальных исходов в 3 случаях служили непосредственные осложнения рентгенэндоваскулярного гемостаза, в одном наблюдении — прогрессирующее течение послеоперационного панкреатита с исходом в полиорганную недостаточность.
Обсуждение
До настоящего времени в отечественной литературе нет опубликованных работ об использовании стент-графтов у пациентов с тяжелым жизнеугрожающим кровотечением после операций на ПЖ. В зарубежной же литературе имеется небольшое количество публикаций на данную тему, но они характеризуются небольшой выборкой пациентов.
В настоящем исследовании тромбоз стентграфта наблюдался у 3 (21,4%) пациентов, приведший к летальному исходу у одного пациента (причиной смерти был СПОН), два пациента были выписаны из стационара в удовлетворительном состоянии под наблюдение онколога-химиотерапевта.
На сегодняшний день нет четких рекомендаций относительно наиболее подходящей антикоагулянтной терапии после имплантации стентграфтов, а клинический опыт использования имплантируемых устройств в аррозированные сосуды ограничен. Тем не менее, после имплантации стент-графта рекомендуется антитромбоцитарная терапия. Общее мнение таково, что клинически стабильные пациенты с функционирующим стентграфтом должны получать ацетилсалициловую кислоту в дозировке 100 мг ежедневно и после выписки из стационара на протяжении всей жизни [7].
В 2021г учеными из Тайбэй (Тайвань) под руководством Lin Y-M было выполнено исследование, в котором в период 2006-2018гг сравнивали результаты у 25 пациентов после ПДР, у которых наблюдались клинико-лабораторные признаки кровотечения. При диагностической ангиографии ЦМБ отсутствовали какие-либо ангиографические признаки продолжающегося кровотечения. Группа была разделена на 2 подгруппы: подгруппа А — с превентивной имплантацией стент-графта (15 человек), и подгруппа Б — с консервативной терапией (10 человек). Конечными точками исследования являлись: клинические исходы, техническая успешность и осложнения. В результате клинический успех составил 86,7% (13 из 15) и 50% (5 из 10), в подгруппе А и подгруппе Б, соответственно (p=0,07). 30-суточная летальность составила 40% (4 из 10) и 0 в группах консервативного лечения и превентивной имплантации стент-графта (р=0,02). Тем самым авторы пришли к выводу, что превентивная имплантация стент-графта в позицию устья ГДА снижает отсроченное массивное кровотечение и краткосрочную смертность у больных без ангиографичекских признаков кровотечения [9].
Целесообразность выполнения превентивной имплантации стент-графтов в позицию устья ГДА остается предметом дискуссий, поскольку любое оперативное вмешательство несет в себе риски развития осложнений как сосудистого характера (диссекция, тромбоз, разрыв), так и не сосудистого (дислокация эндопротеза, мальпозиция, ошибки в выборе размера стент-графта).
В исследовании немецких ученных под руководством Wolk S (2020) были проанализированы такие факторы риска госпитальной летальности, как локализация источника кровотечения и рецидив у пациентов, перенесших вмешательства на панкреатобилиарной зоне и развившимся послеоперационным кровотечением, которые перенесли эндоваскулярное лечение. За 5-летний период у 52 (8,4%) из 622 пациентов был выполнен рентгенэндоваскулярный гемостаз по поводу послеоперационного кровотечения. У более чем половины пациентов (59,6%) остановка кровотечения была достигнута путем имплантации стент-графта. Частота повторных вмешательств была выше после имплантации стент-графта по сравнению с эмболизацией металлическими спиралями — 39,3 vs 21,1% (р=0,012). Причинами повторного вмешательства были рецидив кровотечения дистальнее предыдущей локализации кровотечения, катетерный тромболизис тромбоз стент-графта, диагностические причины. При однофакторном анализе была выявлена связь с высокой внутрибольничной летальностью при рецидивах кровотечения и повторных вмешательствах [2].
В настоящем исследовании рецидив кровотечения развился у 3 (21,4%) пациентов с последующим летальным исходом 1 пациентки с раком терминального отдела холедоха, ранее перенесшей ПДР с сохранением привратника.
Заключение
Имплантация стент-графта является высокоэффективным рентгенэндоваскулярным вмешательством при лечении жизнеугрожающих аррозионных кровотечений после операций на ПЖ.
Выбор артериального доступа (трансфеморальный или трансбрахиальный) не влияет на продолжительность операции и на исход, однако имеются риски развития осложнений после пункции.
При экстравазации контрастного вещества, либо наличии ложной аневризмы проксимального сегмента артерии (ОПА/СПА/правой/левой печеночных артерий, СА, ВБА), рекомендуется выполнять эндопротезирование пораженной артерии.
Аррозия или наличие ложной аневризмы короткой культи ГДА являются показанием к эндопротезированию ОПА с переходом в СПА.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Wente MN, Veit JA, Bassi C, et al. Postpancreatectomy hemorrhage (PPH): an International Study Group of Pancreatic Surgery (ISGPS) definition. Surgery. 2007;142:20-5. doi:10.1016/j.surg.2007.02.001.
2. Wolk S, Radosa CG, Distler M, et al. Risk Factors for In-hospital Mortality After Transarterial Intervention After Postpancreatectomy Hemorrhage. CardioVascular and Interventional Radiology 2020;43:1342-52. doi:10.1007/s00270-020-02509-2.
3. Ревишвили А. Ш., Кригер А. Г., Горин Д. С. и др. Эндоваскулярные вмешательства в хирургии поджелудочной железы. Хирургия. Журнал им. Н. И. Пирогова. 2018;(4):4-16. doi:10.17116/hirurgia201844-16.
4. Гоев А. А., Берелавичус С. В., Карчаков С. С. и др. Аррозионные кровотечения после резекционных вмешательств на поджелудочной железе. Хирургия. Журнал им. Н. И. Пирогова. 2021;(1):77-82. doi:10.17116/hirurgia202101177.
5. Roulin D, Cerantola Y, Demartines N, et al. Systematic Review of Delayed Postoperative Hemorrhage after Pancreatic Resection. J Gastrointest Surg. 2011;15:1055-62. doi:10.1007/s11605-011-1427-8.
6. Guan Y, Zhang JL, Li XH, et al. Postpancreatectomy hemorrhage with negative angiographic findings: outcomes of empiric embolization compared to conservative management. Clin Imaging 2021;73:119-23. doi:10.1016/j.clinimag.2020.12.009.
7. Hassold N, Wolfschmidt F, Dierks A, et al. Effectiveness and outcome of endovascular therapy for late-onset postpancreatectomy hemorrhage using covered stents and embolization. J Vasc Surg. 2016;64:1373-83. doi:10.1016/j.jvs.2016.05.071.
8. Алекян Б. Г., Варава А. Б., Лусников В. П. и др. Результаты рентгенэндоваскулярного лечения позднего артериального кровотечения после операций на поджелудочной железе. Опыт одного центра. Хирургия. Журнал им. Н. И. Пирогова. 2022;(3):5-15. doi:10.17116/hirurgia20220315.
9. Kleive D, Sahakyan M, Søreide K, et al. Risk for hemorrhage after pancreatoduodenectomy with venous resection. Langenbecks Arch Surg. 2018;403:949-57. doi:10.1007/s00423-018-1721-y.
Об авторах
Б. Г. АлекянРоссия
Баграт Гегамович Алекян — доктор медицинских наук, профессор, академик РАН, руководитель Центра рентгенэндоваскулярной хирургии.
Москва
А. Б. Варава
Россия
Алексей Борисович Варава — младший научный сотрудник, врач рентгенэндоваскулярный хирург Центра рентгенэндоваскулярной хирургии.
Москва
Д. С. Горин
Россия
Давид Семенович Горин — кандидат медицинских наук, старший научный сотрудник отделения абдоминальной хирургии.
Москва
В. П. Лусников
Россия
Вячеслав Петрович Лусников — врач рентгенэндоваскулярный хирург, аспирант Центра рентгенэндоваскулярной хирургии.
Москва ул. Большая Серпуховская, 27, 117997, Тел.: +7 (999) 977-88-69
Дополнительные файлы
Рецензия
Для цитирования:
Алекян Б.Г., Варава А.Б., Горин Д.С., Лусников В.П. Опыт использования стент-графтов в лечении пациентов с аррозионным кровотечением после операций на поджелудочной железе. Кардиоваскулярная терапия и профилактика. 2022;21(5):3257. https://doi.org/10.15829/1728-8800-2022-3257
For citation:
Alekyan B.G., Varava A.B., Gorin D.S., Lusnikov V.P. Experience of using stent grafts in the treatment of patients with arrosive bleeding after pancreatic surgery. Cardiovascular Therapy and Prevention. 2022;21(5):3257. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3257
JATS XML

























































