Перейти к:
Сравнительная эффективность ивабрадина и бета-блокаторов в коррекции тахикардии у пациентов, перенесших COVID-19
https://doi.org/10.15829/1728-8800-2022-3330
Аннотация
Цель. Оценить динамику частоты сердечных сокращений (ЧСС), толерантности к физической нагрузке и качества жизни у пациентов, перенесших новую коронавирусную инфекцию (COVID-19, COronaVIrus Disease 2019), на фоне лечения ивабрадином в монотерапии или в комбинации с бета-адреноблокаторами (БАБ) по сравнению с монотерапией БАБ.
Материал и методы. В рандомизированное сравнительное исследование включены 90 пациентов, выписанных из университетской клиники после острого периода COVID-19. Основная группа (n=60) получала в дополнение к стандартной терапии ивабрадин в монотерапии или в сочетании с БАБ; контрольная (n=30) — стандартную терапию в сочетании с БАБ. Срок наблюдения — 24 нед. При статистической обработке использовали программу STATISTICA 8.0. Уровень статистической значимости — р<0,05.
Результаты. На фоне проводимого лечения отмечено достоверное снижение ЧСС, прирост физической активности, а также улучшение качества жизни в обеих группах. В группе ивабрадина достигнуты достоверно более низкие показатели ЧСС: 71,2±4,1 по сравнению с 73,9±5,1 уд./мин (р=0,015), выявлено достоверное увеличение физической активности: 80 (60; 135) vs 65 м (40; 100) (р=0,017), а также достоверно более высокий прирост качества жизни: 35 (27; 45) vs 30 (26; 36) баллов (р=0,03).
Заключение. Показано, что ивабрадин и БАБ могут использоваться для коррекции постковидной тахикардии, причем ивабрадин в монотерапии или в комбинации с БАБ по сравнению с монотерапией БАБ вызывает более выраженное снижение ЧСС, сопровождающееся достоверно более значимым улучшением переносимости физической нагрузки и качества жизни данной категории пациентов.
Ключевые слова
Для цитирования:
Подзолков В.И., Брагина А.Е., Тарзиманова А.И., Огибенина Е.С., Шведов И.И., Быкова Е.Е., Иванников А.А. Сравнительная эффективность ивабрадина и бета-блокаторов в коррекции тахикардии у пациентов, перенесших COVID-19. Кардиоваскулярная терапия и профилактика. 2022;21(7):3330. https://doi.org/10.15829/1728-8800-2022-3330
For citation:
Podzolkov V.I., Bragina A.E., Tarzimanova A.I., Ogibenina E.S., Shvedov I.I., Bykova E.E., Ivannikov A.A. Comparative efficacy of ivabradine and beta-blockers in the treatment of tachycardia in patients after COVID-19. Cardiovascular Therapy and Prevention. 2022;21(7):3330. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3330
Введение
Пандемия новой коронавирусной инфекции (COVID-19, CoronaVirus Disease 2019), вызванной SARS-CoV2 (Severe Acute Respiratory Syndrome CoronaVirus 2), охватила все страны и континенты. С декабря 2019г, когда были зарегистрированы первые заболевшие в китайском городе Ухань, до текущего момента это вирусное заболевание только по официальным подсчетам перенесли 522783196 чел., в т.ч. в России 182976081. Смертельные исходы зафиксированы в >6 млн случаев, в Российской Федерации в >378 тыс. случаев, иными словами, глобальная смертность от этого заболевания превышает 10%. Тяжелое течение COVID-19 обусловлено не только поражением легких, но и сердечно-сосудистой системы [1], в т.ч. у лиц с уже имеющимися сердечно-сосудистыми заболеваниями (ССЗ) и факторами риска их развития. Существенное значение для качества жизни и функциональной активности пациентов, перенесших COVID-19, имеет длительное (>12 нед.) сохранение симптомов, что получило название постковидного синдрома, постковидного состояния или долгого ковида2 и было включено в Международную классификацию болезней в формулировке “Post COVID-19 condition”3. Несмотря на угасание заболеваемости самой коронавирусной инфекцией, сохраняется значительная потребность в коррекции ее последствий. Распространенность постковидного синдрома по данным разных исследователей составляет от 33% в США [2] до 87% в Италии [3]. В одном из наиболее крупномасштабных исследований по этому вопросу, проведённом в России и включившем 2649 пациентов, выписанных из стационара после острого COVID-19, было показано, что симптомы сохраняются у 47% пациентов на протяжении 4-6 мес. [4]. Имеются данные и о длительности постковидных симптомов вплоть до 9 мес. [5], что является одним из факторов высокой распространенности данного состояния и высокой потребности в его коррекции.
Следует подчеркнуть, что персистенция симптомов после острой коронавирусной инфекции также наблюдалась и во время вспышки тяжелого острого респираторного синдрома (SARS) в 2003г, и ближневосточного респираторного синдрома (Middle East Respiratory Syndrome, MERS) в 2015г. Проспективные исследования показали максимальную длительность посткоронавирусных проявлений до 12 мес. в случае SARS [6] и до 18 — при MERS [7]. Это свидетельствует об общности патогенетических механизмов и клинических проявлений как прошлых, так и текущей COVID-19, а возможно, и будущих.
К наиболее частым проявлениям постковидного синдрома относятся слабость/мышечная слабость (по разным данным от 34,8 до 64%), одышка/ снижение толерантности к физическим нагрузкам (11,1-41,7%), выпадение волос (20-22%), тревога/депрессия (23%), нарушения сна (24-30,8%) и сердцебиение (9-10,9%) [8].
Исходя из наших данных у каждого пятого больного COVID-19 отмечается синусовая тахикардия. В период с марта по август 2020г в ковидный госпиталь, функционировавший на базе Университетской клинической больницы № 4 (УКБ № 4) при Первом МГМУ им. И. М. Сеченова Минздрава России (Сеченовский Университет) было госпитализировано 1641 человек с диагнозом “коронавирусная инфекция 2019 (COVID-19)”. Из них у 19,75% была выявлена синусовая тахикардия (95% доверительный интервал (ДИ): 17,35; 22,15). Высокая частота сердечных сокращений (ЧСС) регистрировалась не только у пациентов с артериальной гипертензией (АГ), но и с несколько большей частотой среди лиц с нормальным уровнем артериального давления (АД): 18,03% (95% ДИ: 14,92; 21,14) и 21,91% (95% ДИ: 18,17; 25,65), соответственно [9].
Известно, что тахикардия >80 уд./мин представляет собой фактор риска развития ССЗ [10]. Возникновение синусовой тахикардии у пациентов с COVID-19 статистически значимо увеличивало риск летального исхода — отношение шансов (ОШ) 1,248; ДИ: 1,038-1,499 (р=0,018), повышало вероятность применения искусственной вентиляции легких — ОШ 1,451; ДИ: 1,168-1,803 (р<0,001) и пребывания в отделении реанимации и интенсивной терапии — ОШ 1,440; ДИ: 1,166-1,778 (р<0,001) [11].
Рекомендации по лечению синусовой тахикардии предусматривают применение у симптомных пациентов селективного ингибитора If-каналов клеток синоатриального узла — ивабрадина — в виде монотерапии или в комбинации с бета-адреноблокаторами (БАБ) (уровень рекомендации IС) или БАБ (уровень доказательности IIa B) [12]. Результаты применения ивабрадина у пациентов с постковидной синусовой тахикардией представлены в работе Jadhav K и Jariwala P [13]. Авторами продемонстрирована эффективность ивабрадина по сравнению с карведилолом на протяжении 7 сут. лечения в отношении ЧСС и качества жизни пациентов, выписанных из стационара после подтвержденной COVID-19. Прямых сопоставлений ивабрадина с БАБ при лечении постковидной тахикардии в российской популяции не проводилось.
В связи с этим целью нашего исследования стала оценка динамики ЧСС, толерантности к физической нагрузке и качества жизни у пациентов, перенесших COVID-19, на фоне лечения ивабрадином в монотерапии или в комбинации с БАБ по сравнению с монотерапией БАБ.
Материал и методы
В рандомизированное сравнительное исследование были включены 90 пациентов, находившихся на лечении в УКБ № 4 Сеченовского Университета по поводу коронавирусной инфекции SARS-CoV-2. Критериями включения в исследование были возраст пациента >18 лет, жалобы на сердцебиение, ЧСС >80 уд./мин, согласие на участие в исследовании. Критерии невключения: дисфункция щитовидной железы, острый коронарный синдром, фибрилляция предсердий, острое нарушение мозгового кровообращения, тромбоэмболия ветвей легочной артерии, тяжелая патология печени или почек (креатинин плазмы крови >132 мкмоль/л), гиперкалиемия >5,0 ммоль/л, анемия тяжелой степени, онкологические заболевания, беременность, противопоказания/ непереносимость к ивабрадину/БАБ.
В ходе исследования выполнено 5 визитов: визит включения (Н0) в день выписки из стационара, визит 1-й (Н1), 4-й (Н4), 12-й (Н12) и 24-й нед. лечения или финальный визит (Н24). При включении пациентов в исследование и через 24 нед. наблюдения выполнялось общеклиническое обследование, включающее общий и биохимический анализы крови, электрокардиограмму (ЭКГ) в 12 отведениях, суточное мониторирование ЭКГ по Холтеру, эхокардиографию. Толерантность к физической нагрузке оценивалась при проведении теста с шестиминутной ходьбой (ТШХ) на визитах Н0, Н12 и Н24. Для оценки качества жизни использовалась 100-балльная визуальная аналоговая шкала на визитах Н0, Н1, Н4, Н12 и Н24.
Проведение исследования было одобрено локальным этическим Комитетом (протокол № 04-21 от 18.02.2021г). Все пациенты до включения в исследование подписывали информированное согласие.
При выписке из стационара больные были распределены методом конвертов в отношении 2:1 в две группы: основная группа (n=60) и контрольная группа (n=30). Пациенты основной группы для коррекции синусовой тахикардии на протяжении 24 нед. в дополнение к стандартной медикаментозной терапии принимали ивабрадин в начальной дозе 5 мг/сут. (Раеном®, Гедеон Рихтер) в монотерапии; пациенты контрольной группы получали стандартную медикаментозную терапию, в т.ч. БАБ. При недостижении уровня ЧСС <80 уд./мин на последующих визитах Н1 (через 1 нед.), Н4 (через 4 нед.) и Н12 (через 12 нед.) проводилось титрование дозы.
Статистическую обработку полученных результатов проводили на персональном компьютере с помощью программы Statistica 8.0 (Statsoft Inc., США). Количественные данные представлены в виде среднего и стандартного отклонения (M±SD) или медианы и интерквартильного размаха [Ме (Q25; Q75)], качественные ‒ в виде процентов от общей группы. При сравнении средних величин использовали t-критерий для зависимых (динамика внутри группы) или независимых (динамика между группами) выборок, при сравнении данных с распределением, отличным от нормального, использовали критерий Вилкоксона (для зависимых выборок) или критерий Манна-Уитни (для независимых выборок), при сравнении качественных характеристик — критерий χ2. Статистически значимыми различия считали при р<0,05.
Результаты
Клинические характеристики основной и контрольной групп представлены в таблице 1. Группы достоверно не различались, в т.ч. по тяжести течения COVID-19, оцениваемой на основании радиологической степени поражения легких и по потребности в генно-инженерных биологических препаратах и глюкокортикоидах. Сопутствующие заболевания в обеих группах встречались одинаково часто (таблица 1). Сопутствующая терапия представлена в таблице 2. Различия касались только частоты использования БАБ, которые получали все пациенты контрольной группы и 55% из основной группы, что определялось протоколом исследования. В основной группе все пациенты получали БАБ по поводу ССЗ до начала исследования, в т.ч. 83,3% ‒ бисопролол, 16,7% ‒ метопролола тартрат в среднетерапевтических дозах.
Таблица 1
Основные клинические и демографические характеристики групп наблюдения

Примечание: АГ — артериальная гипертензия, ДАД — диастолическое АД, ИБС — ишемическая болезнь сердца, КТ — компьютерная томография, САД — систолическое АД, СД — сахарный диабет, ТШХ — тест шестиминутной ходьбы, ФВ — фракция выброса, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность, ЧСС — частота сердечных сокращений.
Таблица 2
Сопутствующая терапия в группах наблюдения

Примечание: АПФ — ангиотензинпревращающий фермент, БАБ — бета-адреноблокаторы.
Начальная доза ивабрадина в основной группе составляла 5 мг/сут. Увеличение дозы ивабрадина потребовалось у 25 (41,7%) пациентов. На Н1 средняя доза ивабрадина составила 6,14 мг, на Н4 — 6,9 мг, на Н12 — 6,98 мг, на Н24 — 6,98 мг. Распределение среднесуточных дозировок на визите Н24 составило: 5 мг/сут. у 58,3%, 7,5 мг/сут. у 6,7% и 10 мг/сут. у 35% пациентов. Повышение дозы БАБ в основной группе не проводилось. Титрование дозы БАБ в контрольной группе проведено у 10 (33,3%) человек.
На момент госпитализации у 13 (21,7%) человек из основной группы и 6 (20%) из контрольной были зафиксированы цифры АД выше целевых значений (>140/90 мм рт.ст.). Уровень АД ≤110/70 мм рт.ст. на визите Н0 был зафиксирован у 16 (26,7%) и 5 (16,7%), соответственно. Уровень АД на последнем визите Н24 составил 118,1±8,2/75,5±6,9 мм рт.ст. в основной группе и 118,5±10,7/73,9±6,9 мм рт.ст. в контрольной (р>0,05), уровень АД ≤110/70 мм рт.ст. был зафиксирован у 15 (25%) человек из основной группы и 12 (40%) группы контроля. Динамика частоты гипотензии в основной группе была статистически недостоверна. Прирост частоты гипотензии в контрольной группе был статистически значим (р<0,05).
На фоне проводимого лечения отмечено достоверное снижение ЧСС в обеих группах (рисунок 1). Межгрупповые различия достигли уровня статистической значимости с достоверно более низкими показателями в основной группе, получавшей ивабрадин, через 4 нед. лечения (на визите Н4) и через 24 нед. наблюдения (на финальном визите). Средние значения ЧСС на визите Н4 составили в основной группе 71,2±4,1, а в контрольной — 73,9±5,1 уд./мин (р=0,015), на визите Н24 — 68,9±3,5 и 70,6±8,4 уд./мин (р=0,035), соответственно.
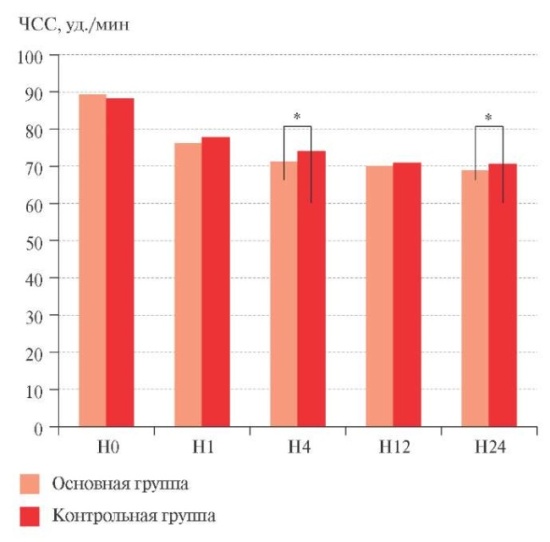
Рис. 1 Динамика ЧСС в течение 24 нед. наблюдения.
Примечание: * — р<0,05.
Помимо снижения абсолютных значений ЧСС на фоне проводимой терапии выявлено достоверное уменьшение доли лиц с ЧСС >90 уд./мин и лиц со спонтанной тахикардией, определяемой по данным холтеровского мониторирования ЭКГ как среднесуточная ЧСС >90 уд./мин и ЧСС в покое >100 уд./мин. На визите включения ЧСС >90 уд./мин была выявлена у 71,6% пациентов в основной группе и у 70% в контрольной, в т.ч. спонтанная тахикардия имелась у 18,3 и 16,7%, соответственно.
На фоне проводимой терапии в обеих группах отмечен достоверный прирост физической активности, оцененной на визитах Н0, Н12 и Н24 методом ТШХ (таблица 3). Достоверных различий между результатами ТШХ в основной и контрольной группах на каждом из визитов выявлено не было. Тем не менее, при сопоставлении степени прироста физической активности на протяжении 24 нед. лечения выявлен достоверно более высокий показатель в основной группе: 80 м (60; 135) по сравнению с 65 м (40; 100) в контрольной (р=0,017) (рисунок 2).
Таблица 3
Динамика ТШХ на фоне лечения в группах наблюдения

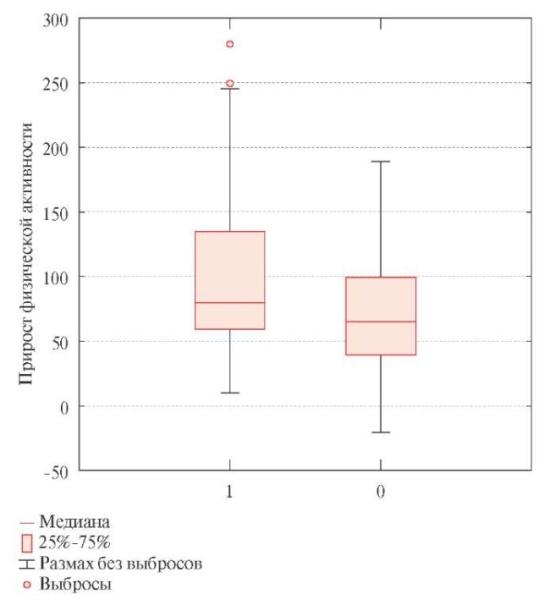
Рис. 2 Прирост физической активности по результатам ТШХ через 24 нед. наблюдения.
Примечание: 1 — основная группа, 0 — контрольная группа, значимость для межгрупповых различий р=0,017.
Лечение пациентов в течение 24 нед. после выписки из стационара сопровождалось достоверным улучшением качества жизни как в основной группе, получавшей ивабрадин, так и в контрольной группе (таблица 4). Статистически значимые межгрупповые различия результатов оценки качества жизни по ВАШ отсутствовали. Выявлен достоверно более высокий прирост качества жизни в основной группе ивабрадина 35 (27; 45) по сравнению с 30 (26; 36) в контрольной группе (р=0,03) (рисунок 3).
Таблица 4
Динамика качества жизни на фоне лечения в группах наблюдения
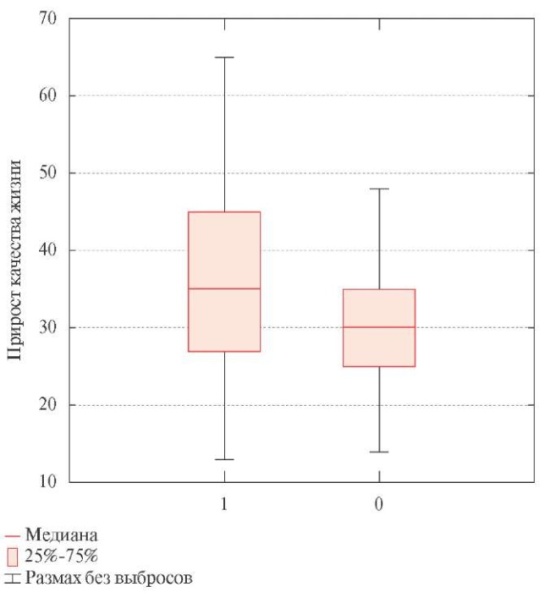
Рис. 3 Прирост показателя качества жизни через 24 нед. наблюдения.
Примечание: 1 — основная группа, 0 — контрольная группа, значимость для межгрупповых различий р=0,005.
Все пациенты обеих групп завершили участие в исследовании, пройдя визит Н24. Серьезные нежелательные явления в обеих группах отсутствовали.
Обсуждение
Синусовая тахикардия представляет собой значимый прогностический фактор, повышающий риск сердечно-сосудистой и общей смерти. В ряде крупномасштабных рандомизированных клинических исследований: SYST-EUR (The Systolic Hypertension in Europe Trial), INVEST (INternational VErapamil SRTrandolapril STudy), LIFE (Losartan Intervention For Endpoint reduction in hypertension), ASCOT (AngloScandinavian Cardiac Outcomes Trial), VALUE (The Valsartan Antihypertensive Long-Term Use Evaluation), ONTARGET/TRANSCEND (The Ongoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial/The Telmisartan Randomized AssessmeNt Study in ACE iNtolerant subjects with cardiovascular Disease), показано, что ЧСС в покое является предиктором неблагоприятных исходов у пациентов с АГ [14]. Эти данные нашли подтверждение и в когортных исследованиях. В Chinese Kailuan cohort Study, включившем 46561 пациента со сроком наблюдения 9,25 лет, ОШ смерти в группе с ЧСС >82 уд./мин составило 1,31 по сравнению с группой с ЧСС <68 уд./мин [15]. В сравнительно недавно проведенном крупномасштабном исследовании, базирующемся на анализе данных 502534 пациентов из UK biobank, также было показано увеличение ОШ общей смертности на 22% и сердечно-сосудистой смертности на 17% при увеличении ЧСС в покое на каждые 10 уд./мин у мужчин и на 19 и 14% у женщин, соответственно [16]. И наконец, в метаанализе 46 исследований, включившем в общей сложности 1246203 пациента для анализа общей смертности и 848320 пациентов для анализа сердечно-сосудистой смертности нарастание относительного риска (relative risk, RR) с увеличением ЧСС на каждые 10 уд./мин составило 1,09 (95% ДИ: 1,071,12) для общей смертности и 1,08 (95% ДИ: 1,06-1,10) для сердечно-сосудистой смертности [17].
Сходные данные получены отечественными исследователями. В работе Шальновой С. А. и др. показано, что даже после коррекции на все факторы лица с ЧСС >80 уд./мин имели достоверно более высокий относительный риск как общей смертности (RR 1,29, 95% ДИ: 1,17-1,41 и RR 1,30, 95% ДИ: 1,05-1,61 соответственно для мужчин и женщин), так и сердечно-сосудистой смертности (ОР 1,31, 95% ДИ: 1,15-1,50 и ОР 1,63, 95% ДИ: 1,19-2,34) по сравнению с лицами с ЧСС <60 уд./мин. При этом выживаемость мужчин с ЧСС >80 уд./мин оказалась на 7 лет меньше, чем с ЧСС <60 уд./мин. Аналогичный показатель для женщин составил 3,2 года [18].
Таким образом, коррекция синусовой тахикардии представляет собой не только способ повышения качества жизни в случае симптомного течения, но и улучшения прогноза пациента.
Новая коронавирусная инфекция SARS-CoV2 представляет собой значимый фактор развития сердечно-сосудистых нарушений, в т.ч. тахикардии и сердцебиения. Предложен новый фенотип постковидного состояния — постковидная тахикардия [19]. К механизмам развития этих проявлений COVID-19 относят прямое поражение миокарда, дисрегуляцию ренин-ангиотензин-альдостероновой системы, патологический системный воспалительный ответ, гипоксию, непосредственное действие вируса на миокард с развитием миокардита, поражение сосудов микроциркуляторного русла, прямое повреждающее действие вируса в отношении эндотелия сосудов, в т.ч., коронарных артерий , тромботические осложнения вследствие прокоагулянтного и протромбогенного эффектов системного воспаления, а также дисфункцию ствола головного мозга смешанного генеза [20].
По нашему опыту частота синусовой тахикардии у пациентов, перенесших COVID-19, составляет 19,75% (95% ДИ: 17,35-22,15) [9]. Сходные данные получены в ряде исследований. В работе индийских ученых Jadhav K и Jariwala P частота этого состояния среди лиц, исходно не имевших нарушений сердечного ритма, составила 24% [13]. В испанской когорте 200 пациентов после COVID-19 частота спонтанной синусовой тахикардии составила 20% и была связана с нарушением вариабельности ритма сердца [21].
Коррекция синусовой тахикардии предусматривает применение двух классов препаратов: БАБ и селективного ингибитора If-каналов клеток синоатриального узла — ивабрадина [12]. В настоящем исследовании проведено сопоставление эффективности этих двух классов препаратов в отношении симптомной тахикардии у пациентов после COVID-19. Оба класса препаратов вызывали достоверное уменьшение выраженности сердцебиения, ЧСС, как по данным осмотра, так и суточного мониторирования ЭКГ, что сопровождалось достоверным повышением толерантности к физической нагрузке и улучшением качества жизни. При сравнении результатов, полученных в двух группах, обнаружено, что у пациентов, принимавших ивабрадин, достигнуто достоверно более выраженное снижение ЧСС. Это может быть связано с тем, что в контрольной группе не представлялось возможным повышать дозу БАБ в связи с исходно невысокими цифрами АД у большинства пациентов. У 79,3% пациентов основной группы и 80% контрольной группы АД на момент включения в исследование было в пределах целевых значений. Более того, часть пациентов с симптомной тахикардией имела низкие цифры АД, в связи с чем назначение БАБ повлекло бы за собой риск развития гипотонических реакций. Это представляется существенным фактором, поскольку высокая ЧСС при COVID-19 может регистрироваться не только у пациентов с АГ, но и среди лиц с нормальным уровнем АД: 18,03% (95% ДИ: 14,92; 21,14) vs 21,91% (95% ДИ: 18,17; 25,65), соответственно [9].
Преимущество ивабрадина перед БАБ карведилолом у пациентов с постковидной тахикардией продемонстрировано в работе Jadhav K и Jariwala P. Авторами показано, что в группе, получавшей ивабрадин, степень снижения ЧСС достоверно больше, чем в группе карведилола — 31,51 и 18,2%, соответственно, что сопровождалось уменьшением сердцебиения у достоверно большего количества пациентов — 91,67 vs 66,67%, соответственно [13]. К ограничениям этого исследования следует отнести его небольшую продолжительность (7 сут.), отсутствие титрования доз используемых препаратов и небольшие размеры выборки (по 12 человек в каждой группе), что было преодолено в настоящем исследовании.
Заключение
Таким образом, в настоящем исследовании показано, что селективный ингибитор If-каналов клеток синоатриального узла — ивабрадин и БАБ могут использоваться для коррекции постковидной тахикардии. При сравнении этих двух классов препаратов складывается впечатление, что ивабрадин в монотерапии или в комбинации с БАБ по сравнению с монотерапией БАБ вызывает более выраженное снижение ЧСС, сопровождающееся достоверно более значимым улучшением переносимости физической нагрузки и качества жизни данной категории пациентов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Временные методические рекомендации Минздрава России. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19) Версия 15 (22.02.2022) https://static-0.minzdrav.gov.ru/system/attachments/attaches/000/059/392/original/ВМР_COVID-19_V15.pdf.
2. COVID-19 rapid guideline: managing the long-term effects of COVID-19. https://www.nice.org.uk/guidance/ng188/chapter/5- Management NICE guideline [NG188] (30 April 2022).
3. Emergency use ICD codes for COVID-19 disease outbreak. https://www.who.int/standards/classifications/classification-of-diseases/emergency-use-icd-codes-for-covid-19-disease-outbreak. (30 April 2022).
Список литературы
1. Шляхто Е. В., Конради А. О., Арутюнов Г. П. и др. Руководство по диагностике и лечению болезней системы кровообращения в контексте пандемии COVID-19. Российский кардиологический журнал. 2020;25(3):3801. doi:10.15829/1560-4071-2020-3-3801.
2. Chopra V, Flanders SA, O’Malley M, et al. Sixty-day outcomes among patients hospitalized with COVID-19. Ann. Intern. Med. 2020;20:5661. doi:10.7326/M20-5661.
3. Carfi A, Bernabei R, Landi F, et al. Persistent symptoms in patients after acute COVID-19. J. Am. Med. Assoc. 2020;324:603-605. doi:10.1001/jama.2020.12603.
4. Munblit D, Bobkova P, Spiridonova E, et al. Risk factors for long-term consequences of COVID-19 in hospitalised adults in Moscow using the ISARIC Global follow-up protocol: StopCOVID cohort study. medRxiv, 2021. doi:10.1101/2021.02.17.21251895.
5. Logue JK, Franko NM, McCulloch DJ, et al. Sequelae in Adults at 6 Months After COVID-19 Infection. JAMA Netw Open. 2021;4(2):e210830. doi:10.1001/jamanetworkopen.2021.0830.
6. Lee AM, Wong JG, W. S., McAlonan GM, et al. Stress and psychological distress among SARS survivors 1 year after the outbreak Can. J. Psychiatry. 2007;52:233-40. doi:10.1177/070674370705200405.
7. Lee SH, Shin HS, Park HY, et al. Depression as a Mediator of Chronic Fatigue and Post-Traumatic Stress Symptoms in Middle East Respiratory Syndrome Survivors. Psychiatry Investig. 2019;16(1):59-64. doi:10.30773/pi.2018.10.22.3.
8. Nalbandian A, Sehgal K, Gupta A, et al. Post-acute COVID-19 syndrome. Nat Med. 2021;27:601-15. doi:10.1038/s41591-021-01283-z.
9. Подзолков В. И., Брагина А. Е., Тарзиманова А. И. и др. Постковидный синдром и тахикардия: теоретические основы и опыт лечения. Рациональная Фармакотерапия в Кардиологии. 2021;17(2):256-62. doi:10.20996/1819-6446-2021-04-08.
10. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
11. Подзолков В. И., Тарзиманова А. И., Брагина А. Е. и др. Поражение сердечно-сосудистой системы у больных с коронавирусной инфекцией SARS-CoV-2. Часть 1: Предикторы развития неблагоприятного прогноза. Рациональная Фармакотерапия в Кардиологии. 2021;17(6):825-30. doi:10.20996/1819-6446-2021-11-03.
12. Бокерия А. Л., Голухова Е. З., Попов С. В. и др. Наджелудочковые тахикардии у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4484. doi:10.15829/1560-4071-2021-4484.
13. Jadhav K, Jariwala P. ‘Ivabradin’ versus ‘Carvedilol’ in the management of Post-COVID-19 palpitation with sinus tachycardia. Indian Heart J. 2020;72:S33. doi:10.1016/j.ihj.2020.11.092.
14. Palatini P. Resting Heart Rate as a Cardiovascular Risk Factor in Hypertensive Patients: An Update. Am J Hypertension. 2021;34(4):307-17. doi:10.1093/ajh/hpaa187.
15. Zhao MX, Zhao Q, Zheng M, et al. Effect of resting heart rate on the risk of all-cause death in Chinese patients with hypertension: analysis of the Kailuan follow-up study. BMJ Open.2020;10:e032699. doi:10.1136/bmjopen-2019-032699.
16. Raisi-Estabragh Z, Cooper J, Judge R, et al. Age, sex and disease-specific associations between resting heart rate and cardiovascular mortality in the UK BIOBANK. PLoS One. 2020;15:e0233898. doi:10.1371/journal.pone.0233898.
17. Zhang D, Shen X, Qi X. Resting heart rate and all-cause and cardiovascular mortality in the general population: a meta-analysis. CMAJ. 2016;188:E53-63. doi:10.1503/cmaj.150535.
18. Шальнова С. А., Деев А. Д., Оганов Р. Г. и др. Частота пульса и смертность от сердечно-сосудистых заболеваний у российских мужчин и женщин. Результаты эпидемиологического исследования. Кардиология. 2005;10:45-50.
19. Ståhlberg M, Reistam U, Fedorowski A, et al. Post-COVID-19 Tachycardia Syndrome: A Distinct Phenotype of Post-Acute COVID-19 Syndrome. Am J Med. 2021;134(12):1451-6. doi:10.1016/j.amjmed.2021.07.004
20. Белоцерковская Ю. Г., Романовских А. Г., Смирнов И. П., Синопальников А. И. Долгий COVID-19. Consilium Medicum. 2021;23(3):261-8. doi:10.26442/20751753.2021.3.200805.
21. Aranyó J, Bazan V, Lladós G, et al. Inappropriate sinus tachycardia in post-COVID-19 syndrome. Sci Rep. 2022;12:298. doi:10.1038/s41598-021-03831-6.
Об авторах
В. И. ПодзолковРоссия
Подзолков Валерий Иванович — доктор медицинских наук, профессор, заведующий кафедрой факультетской терапии № 2 Института клинической медицины им. Н.В. Склифосовского.
Москва.
А. Е. Брагина
Россия
Брагина Анна Евгеньевна — доктор медицинских наук, профессор кафедры.
Москва.
Тел.: +7 (903) 628-94-67
А. И. Тарзиманова
Россия
Тарзиманова Аида Ильгизовна — доктор медицинских наук, профессор кафедры.
Москва.
Е. С. Огибенина
Россия
Огибенина Екатерина Сергеевна — заведующая приемным отделением Университетской клинической больницы № 4.
Москва.
И. И. Шведов
Россия
Шведов Илья Игоревич — аспирант кафедры факультетской терапии №2 Института клинической медицины им. Н.В. Склифосовского.
Москва.
Е. Е. Быкова
Россия
Быкова Екатерина Евгеньевна — аспирант кафедры факультетской терапии №2 Института клинической медицины им. Н.В. Склифосовского.
Москва.
А. А. Иванников
Россия
Иванников Александр Александрович — аспирант кафедры факультетской терапии №2 Института клинической медицины им. Н.В. Склифосовского.
Москва.
Рецензия
Для цитирования:
Подзолков В.И., Брагина А.Е., Тарзиманова А.И., Огибенина Е.С., Шведов И.И., Быкова Е.Е., Иванников А.А. Сравнительная эффективность ивабрадина и бета-блокаторов в коррекции тахикардии у пациентов, перенесших COVID-19. Кардиоваскулярная терапия и профилактика. 2022;21(7):3330. https://doi.org/10.15829/1728-8800-2022-3330
For citation:
Podzolkov V.I., Bragina A.E., Tarzimanova A.I., Ogibenina E.S., Shvedov I.I., Bykova E.E., Ivannikov A.A. Comparative efficacy of ivabradine and beta-blockers in the treatment of tachycardia in patients after COVID-19. Cardiovascular Therapy and Prevention. 2022;21(7):3330. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3330
JATS XML

























































