Перейти к:
Эффективность и безопасность различных режимов антитромботической терапии после имплантации окклюдера ушка левого предсердия
https://doi.org/10.15829/1728-8800-2022-3353
Аннотация
Цель. Оценить эффективность и безопасность различных режимов антитромботической терапии после имплантации окклюдера ушка левого предсердия (ОУЛП) в реальной клинической практике.
Материал и методы. В проспективное наблюдательное исследование были включены 90 пациентов с неклапанной формой фибрилляции предсердий и высоким риском развития ишемического инсульта/системной эмболии, которым была выполнена эндоваскулярная изоляция ушка левого предсердия устройством Watchman. Первичной конечной точкой была выбрана кумулятивная частота развития ишемического инсульта/транзиторной ишемической атаки/системной эмболии, больших и клинически значимых кровотечений по критериям регистра GARFIELD (The Global Anticoagulant Registry in the Field-Atrial Fibrillation), смерти от всех причин.
Результаты. Пациенты были разделены на подгруппы в зависимости от антитромботической терапии, проводимой после имплантации ОУЛП: 1) прямые оральные антикоагулянты (ПОАК) ± антиагреганты; 2) варфарин ± антиагреганты; 3) двойная антитромбоцитарная терапия (аспирин + клопидогрел). При проведении многофакторного анализа выявлена тенденция к меньшей частоте достижения первичной конечной точки в группе ПОАК в сравнении как с варфарином (отношение рисков 8,49; 95% доверительный интервал: 2,0-36,15; p=0,004), так и с антиагрегантами (отношение рисков 4,34; 95% доверительный интервал: 1,08-17,36; p=0,038). При этом значимых различий по частоте достижения первичной конечной точки между группами варфарина и антиагрегантов не выявлено. Связи тромбоза поверхности устройства с режимом послеоперационной антитромботической терапии не обнаружено.
Заключение. Эндоваскулярная окклюзия ушка левого предсердия является эффективной и безопасной альтернативой антикоагулянтной терапии. В настоящем исследовании впервые в условиях реальной клинической практики получены данные о том, что назначение ПОАК после имплантации ОУЛП ассоциировано с бóльшим профилем эффективности и безопасности в сравнении с варфарином и с двойной антитромбоцитарной терапией.
Ключевые слова
Для цитирования:
Певзнер Д.В., Рытова Ю.К., Меркулова И.А., Меркулов Е.В. Эффективность и безопасность различных режимов антитромботической терапии после имплантации окклюдера ушка левого предсердия. Кардиоваскулярная терапия и профилактика. 2022;21(8):3353. https://doi.org/10.15829/1728-8800-2022-3353
For citation:
Pevsner D.V., Rytova Yu.K., Merkulova I., Merkulov E.V. Efficacy and safety of various antithrombotic regimens after left atrial appendage occlusion. Cardiovascular Therapy and Prevention. 2022;21(8):3353. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3353
Введение
Фибрилляция предсердий (ФП) является самым распространенным нарушением ритма сердца в мире, которым страдает до 4% взрослого населения [1].
Неклапанная ФП увеличивает риск возникновения острого нарушения мозгового кровообращения (ОНМК) по ишемическому типу в 5 раз [2], в связи с чем профилактика ОНМК является одной из важных составляющих лечения больных с ФП.
Источником кардиоэмболии более чем в 90% случаев является тромб ушка левого предсердия (УЛП) [3]. Основным методом профилактики тромбоэмболических осложнений (ТЭО) у пациентов с ФП является постоянный прием оральных антикоагулянтов (ОАК): антагонистов витамина К или прямых оральных антикоагулянтов (ПОАК).
Однако эффективность данной терапии часто снижается из-за недостаточной приверженности пациентов к лечению. Кроме того, сложности в профилактике кардиоэмболических инсультов возникают у пациентов с высоким риском геморрагических осложнений, наличием противопоказаний к приему антикоагулянтов (АК) [4][5].
Сложности длительной антикоагулянтной терапии (АКТ) у отдельных категорий пациентов явились причиной появления методов механической изоляции УЛП. Одним из таких методов является чрескожная имплантация в УЛП окклюдера — устройства, блокирующего миграцию тромбов через его устье в левое предсердие. В настоящее время для практического использования в Российской Федерации доступны устройства Watchman и Amplatzer Cardiac Plug в модификации Amulet.
Устройство Watchman было изучено в рамках двух рандомизированных контролируемых исследований (РКИ): PROTECT-AF (Watchman Left Atrial Appendage System for Embolic PROTECTion in Patients with Atrial Fibrillation) [6] и PREVAIL (Prospective Randomized Evaluation of the Watchman Left Atrial Appendage Closure Device in Patients with Atrial Fibrillation vs Long Term Warfarin Therapy) [7]. Данные об эффективности и безопасности устройства Amplatzer были продемонстрированы в исследовании PRAGUE-17 (Left Atrial Appendage Closure vs Novel Anticoagulation Agents in Atrial Fibrillation) [8] и в ряде регистров [9].
Оперативное вмешательство проводится на фоне внутривенного (в/в) введения гепарина с достижением уровня активированного частичного тромбопластинового времени >250 сек. После имплантации устройства Watchman пациентам назначают аспирин и варфарин (международное нормализованное отношение (МНО) 2-3), как минимум, в течение 45 сут. после операции. Варфарин может быть отменен после контрольной чреспищеводной эхокардиографии (ЧПЭхоКГ) при оптимальной установке устройства и отсутствии тромботических масс на поверхности окклюдера. После отмены варфарина пациенты в течение 6 мес. должны получать двойную антитромбоцитарную терапию (ДАТТ) аспирином в комбинации с клопидогрелом 75 мг/сут., далее — аспирин неопределенно долго [10]. Однако у больных с высоким геморрагическим риском и другими противопоказаниями к АКТ придерживаться такой терапии достаточно сложно в связи с возможным возникновением кровотечений и последующим вынужденным прерыванием терапии.
Согласно рекомендациям Европейского общества кардиологов и Российского кардиологического общества, имплантация окклюзирующих устройств в УЛП рекомендована пациентам с противопоказаниями к АКТ [11][12]. В экспертном консенсусном документе EHRA/EAPCI (European Heart Rhythm Association/European Association of Percutaneous Cardiovascular Interventions) рекомендации распространяются также и на пациентов, которые отказываются от приема АКТ [13]. Поэтому в реальной клинической практике после имплантации окклюдеров пациентам часто не назначают ОАК, сокращают срок приема ДАТТ, ограничиваются монотерапией аспирином или вовсе не назначают антитромботическую терапию (АТТ).
Цель настоящего исследования — оценка эффективности и безопасности различных режимов АТТ после имплантации окклюдера ушка левого предсердия (ОУЛП) в реальной клинической практике.
Материал и методы
В когортное проспективное наблюдательное исследование были включены пациенты >40 лет с неклапанной формой ФП и высоким риском ТЭО, которым была выполнена эндоваскулярная гемодинамическая изоляция УЛП устройством Watchman в ФГБУ “НМИЦ кардиологии имени академика Е. И. Чазова” Минздрава России с 2011 по 2018гг.
Критериями включения в исследование являлись:
- эпизод ФП длительностью не <30 сек., зарегистрированный на электрокардиограмме в течение предшествующего года;
- индекс CHA2DS2-VASc (Congestive Heart failure, Hypertension, Age (2 ball), Diabetes mellitus, Stroke (2 ball), Vascular disease, Age, Sex category — шкала для оценки риска тромбоэмболических осложнений у больных с ФП) ≥3 для женщин и ≥2 для мужчин;
- наличие противопоказаний к длительному приему АК или отказ пациента от их приема;
- согласие пациента на проведение имплантации устройства, окклюзирующего УЛП;
- согласие на участие в исследовании.
Критериями невключения были: наличие механических протезов клапанов сердца, митрального стеноза выраженной или умеренной ст.; проксимальный тромбоз глубоких вен правой нижней конечности; тромбоз УЛП.
Использовались окклюзирующие устройства типа Watchman (Boston Scientific, Natwick, MA, USA). Режим АТТ в послеоперационном периоде выбирался лечащим врачом.
Фиксировались такие неблагоприятные события, как транзиторная ишемическая атака (ТИА), системная эмболия (СЭ), ишемический (ИИ) и геморрагический инсульт, кровотечения по критериям, принятым в регистре GARFIELD (The Global Anticoagulant Registry in the Field-Atrial Fibrillation), сердечно-сосудистая смерть, смерть от всех причин, наличие девайс-ассоциированных тромбов, эндоликов >5 мм.
В качестве первичной конечной точки (ПКТ) была выбрана сумма всех неблагоприятных событий: кумулятивная частота развития ИИ/ТИА/СЭ, больших и клинически значимых кровотечений по критериям регистра GARFIELD, смерти от всех причин.
Вторичными конечными точками были: частота развития ИИ/ТИА/СЭ, смерть от всех причин, частота всех кровотечений, включая большие и фатальные, а также частота развития тромбоза на поверхности окклюдера.
Период наблюдения составил 3 года. Неблагоприятные события регистрировались в течение госпитализации, а также через 45 сут., 6 мес., 1 год, 2 года и 3 года от момента включения в исследование. Регистрация событий после выписки проводилась на каждом визите с выполнением ЧПЭхоКГ в динамике. Анализ событий проводился по intention-to-treat протоколу.
Статистический анализ проводили стандартными методами с применением статистической программы IBM SPSS Statistics, версия 28. Проверка на нормальность распределения количественных показателей выполнена методом Колмогорова-Смирнова с поправкой Лиллиефорса при n >50 и методом Шапиро-Уилка при n <50. Анализ номинальных данных выполнен при помощи критерия χ2, точного критерия Фишера. При сравнении трёх групп использовалась поправка Бонферрони для множественных сравнений. Кривые дожития были построены по методу Каплана-Мейера с оценкой статистической значимости с помощью лог-ранк критерия Мантеля-Кокса. Влияние различных режимов АТТ на значимые исходы было скорректировано с помощью многофакторной регрессии Кокса с включением исходных клинико-анамнестических характеристик, для которых были получены статистически значимые различия при сравнении групп. С целью поиска независимых предикторов неблагоприятных исходов (за весь период наблюдения и за первый год) был выполнен однофакторный анализ всех исходных параметров. Клинико-анамнестические факторы, значимость ассоциации которых с исходом была p≤0,2, были затем протестированы в многофакторных регрессионных моделях, выполненных методом исключения Вальда.
Статистически значимыми считали различия при значениях двустороннего р<0,05.
Характеристика пациентов. Всего в исследование были включены 90 больных с ФП, которым в УЛП был имплантирован окклюдер Watchman.
Медиана возраста больных в общей когорте составила 66 лет (интерквартильный размах (Q25-Q75): 59-71). Все пациенты имели высокий риск развития ИИ и СЭ, средний балл по шкале CHA2DS2-VASc составил 4 (Q25-Q75: 3-4), по шкале HAS-BLED — 3 балла (Q25-Q75: 2-3), при этом доля пациентов с высоким риском геморрагических осложнений (HAS-BLED ≥3 баллов, или геморрагический инсульт в анамнезе, или большое кровотечение по критериям регистра GARFIELD в анамнезе) составила 60,9%. К группе высочайшего риска, тромбозов и кровотечений (≥5 баллов по шкале CHA2DS2-VASc и высокий риск геморрагических осложнений) были отнесены 20,7% пациентов. ИИ или ТИА в анамнезе были у 31,5%, ОНМК по геморрагическому типу до момента включения в исследование перенесли 6,5% пациентов. Также включенные пациенты имели значительное число сопутствующих заболеваний и патологических состояний. Медиана индекса коморбидности Чарльсона составила 5 баллов (Q25-Q75: 4-6,75).
В соответствии с назначенными антитромботическими препаратами пациенты были разделены на следующие группы:
- пациенты, получающие ПОАК ± антиагреганты (группа ПОАК, n=35);
- пациенты, получающие варфарин ± антиагреганты (группа варфарина, n=20);
- пациенты, получающие ДАТТ (аспирин + клопидогрел) (группа ДАТТ, n=35).
Из данного анализа были исключены пациенты, которые после выписки в качестве АК получали эноксапарин натрия (n=2).
Исходные клинико-анамнестические характеристики пациентов, а также АТТ на момент включения в исследование представлены в таблице 1.
Таблица 1
Исходная характеристика пациентов в группах


Примечание: АКТ — антикоагулянтная терапия, АТТ — антитромботическая терапия, АГ — артериальная гипертензия, ДАТТ — двойная антитромбоцитарная терапия, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, КШ — коронарное шунтирование, ОНМК — острое нарушение мозгового кровообращения, ПОАК — прямые оральные антикоагулянты, СД — сахарный диабет, ТИА — транзиторная ишемическая атака, ТЭ — тромбоэмболии, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность, ЧКВ — чрескожное коронарное вмешательство. * — HAS-BLED ≥3 баллов, или геморрагический инсульт в анамнезе, или кровотечение 3 типа по критериям BARC в анамнезе; ** — CHA2DS2-VASc ≥5 и отношение к группе особенно высокого риска кровотечений.
Между группами наблюдались статистически значимые различия по некоторым базовым клинико-анамнестическим характеристикам.
Среди пациентов в группе антиагрегантов наблюдалась тенденция к более старшему возрасту (p=0,031, различия незначимы при попарном анализе), они чаще подвергались чрескожному коронарному вмешательству (ЧКВ) в анамнезе в сравнении с обеими группами пациентов на АК (p=0,005), чаще переносили кровотечение в анамнезе (p<0,001) и, соответственно, наиболее часто им имплантировался ОУЛП в связи с наличием противопоказаний к постоянному приему АК — 71,4% (p<0,001). Кроме того, в этой группе пациентов было наибольшее число пациентов с одновременно крайне высоким тромботическим и геморрагическим риском (p=0,048). В группе пациентов, получающих после операции ПОАК, чаще была хроническая болезнь почек (p=0,023) и хроническая сердечная недостаточность (p=0,014) и реже — кровотечения (p<0,001), соответственно, в этой группе было наибольшее число пациентов, которым ОУЛП имплантировался в связи с отказом и низкой приверженностью к приему АКТ (p <0,001).
У 52,2% пациентов в общей когорте имплантация ОУЛП проводилась из-за наличия противопоказаний к приему АК (рисунок 1), 47,8% пациентам имплантация выполнялась в связи с отказом или невозможностью приема АКТ в соответствии с текущим консенсусом Европейского общества кардиологов [13].

Рис. 1 Противопоказания к приему АК у пациентов в исследовании.
Примечание: ЖКТ — желудочно-кишечный тракт, СКФ — скорость клубочковой фильтрации.
Протокол оперативного вмешательства и периоперационная АТТ. Для подбора размера устройства пациентам выполнялась ЧПЭхоКГ и мультиспиральная компьютерная томография сердца с контрастированием. Имплантация ОУЛП осуществлялась под общей анестезией или под сочетанной в/в седацией и местной анестезией. При общей анестезии использовали методы комбинированной (севофлуран + фентанил) или тотальной в/в анестезии (пропофол/дексмедетомидин + фентанил) с миорелаксацией пипекурония бромидом и искусственной вентиляцией легких. Седацию в/в осуществляли с помощью диазепама или дексмедетомидина. Для местной анестезии применяли 2% раствор лидокаина. Доступ проводился путем катетеризации бедренной вены с последующей пункцией межпредсердной перегородки. Затем подходящее по диаметру устройство устанавливалось в устье УЛП.
До операции пациентам назначали эноксапарин натрия в лечебной дозе 1 мкг/кг 2 раза/сут. (вместо ОАК или в дополнение к ДАТТ) с последним приемом препарата за 12 ч до операции. Во время вмешательства вводили гепарин 100 Ед/кг с достижением целевого уровня активированного частичного тромбопластинового времени 250-350 с. Режим АТТ в послеоперационном периоде был выбран на усмотрение лечащего врача, АКТ возобновлялась через 12 ч после вмешательства.
Результаты
Результаты имплантации ОУЛП
ОУЛП типа Watchman был имплантирован 92 пациентам. Два пациента исключены из анализа отдаленных исходов в связи с назначением эноксапарина натрия после вмешательства.
В первые 24 ч после оперативного вмешательства у 1 пациента была диагностирована пульсирующая гематома, у 2 пациентов развилась контрастиндуцированная нефропатия — в обоих случаях 1 стадии по классификации KDIGO (Kidney Disease: Improving Global Outcome). Помимо осложнений, непосредственно связанных с имплантацией ОУЛП, у 1 пациента развилось осложнение общей анестезии в виде отека легких, возникшего после экстубации трахеи, купированного стандартной терапией.
Таких возможных периоперационных осложнений как большие кровотечения, тампонада сердца, воздушная эмболия, инсульт, повреждение пищевода, инфицирование устройства не наблюдалось.
Частота всех больших госпитальных осложнений вмешательства в соответствии с критериями регистра EWOLUTION (Evaluating Real-Life Clinical Outcomes in Atrial Fibrillation Patients Receiving the Watchman Left Atrial Appendage Closure Technology), составила 2,2%.
Все выявленные осложнения имплантации окклюдера представлены в таблице 2. Все ранние эндолики >5 мм закрылись к первому визиту через 45 сут. от оперативного вмешательства.
Таблица 2
Внутригоспитальные осложнения, ассоциированные с имплантацией ОУЛП

АТТ на момент выписки
Данные о назначенной после выписки АТТ представлены в таблице 3. Комбинация аспирина и АК была назначена в 41,3% случаев (9,8% получали варфарин + аспирин, 31,5% — ПОАК + аспирин). ДАТТ была назначена 38,0% пациентов.
Таблица 3
Схемы АТТ у пациентов в исследовании

В когорте пациентов с наличием противопоказаний к приему АК только 16,7% пациентов после выписки получали ПОАК и 27,1% — варфарин. Эти пациенты могли получать краткосрочную АКТ. В когорте пациентов, отказавшихся от долгосрочного приема АК, ОАК при выписке были назначены в 77,3% случаев.
Отдаленные результаты
В ходе наблюдения отмечалось закономерное снижение интенсивности АТТ, назначенной после эндоваскулярного закрытия УЛП (рисунок 2).
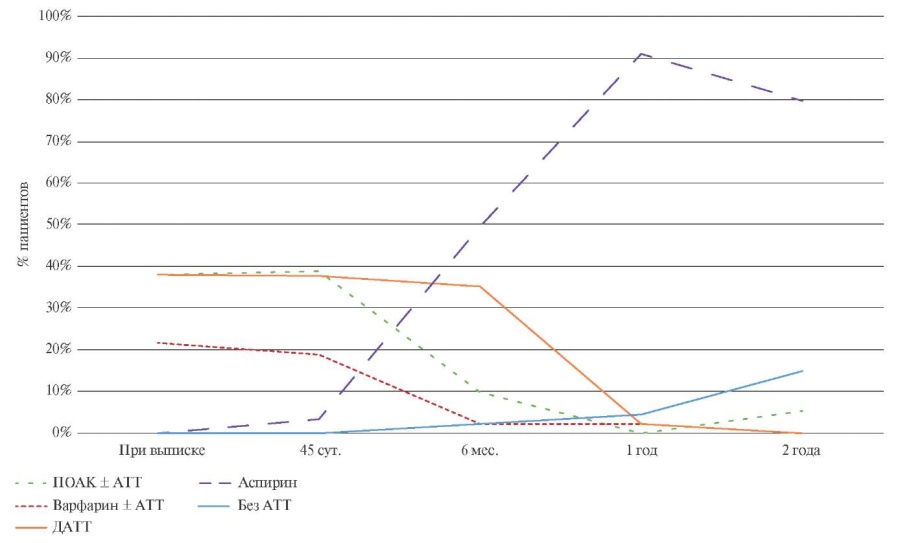
Рис. 2 Изменение АТТ в первые 2 года наблюдения.
Примечание: АТТ — антитромботическая терапия, ДАТТ — двойная антитромбоцитарная терапия, ПОАК — прямые оральные антикоагулянты.
В соответствии с текущими клиническими рекомендациями большинство пациентов на варфарине или ПОАК перешли на ДАТТ на первом визите через 45 сут. от имплантации ОУЛП, длительность приема ДАТТ, согласно клиническим рекомендациям, составила 6 мес. К концу первого года наблюдения подавляющее число пациентов находилось на монотерапии аспирином. К концу второго года наблюдения уже >10% пациентов не получали никакой АТТ.
При анализе взаимосвязи исходов с проводимой АТТ (таблица 4) следует отметить, что в группе ПОАК имелась тенденция к меньшей частоте достижения ПКТ в сравнении с варфарином (p=0,057) и антиагрегантами (p=0,09) — 5,56 vs 19,05 и 14,38 событий на 100 пациенто-лет, соответственно. Полученные различия были скорректированы по отличающимся между группами исходным клинико-анамнестическим характеристикам при помощи многофакторной регрессии Кокса: возраст, ЧКВ в анамнезе, эрозивно-язвенное поражение желудочно-кишечного тракта в анамнезе, наличие хронической сердечной недостаточности, хронической болезни почек, кровотечение в анамнезе, сумма баллов по шкале CHA2DS2-VASc, прием антиагрегантов, ПОАК и варфарина на момент включения в исследование (таблица 4). В результате были получены статистически значимые различия по частоте достижения ПКТ в пользу группы ПОАК.
Таблица 4
Накопительная частота конечных точек за 3 года наблюдения в зависимости от режима АТТ

Примечание: ДАТТ — двойная антитромбоцитарная терапия, ДИ — доверительный интервал, ИИ — ишемический инсульт, ОР — отношение рисков, ПКТ — первичная конечная точка, ПОАК — прямые оральные антикоагулянты, СЭ — системная эмболия, ТИА — транзиторная ишемическая атака.
Назначение варфарина в составе послеоперационной АТТ было связано с 8,5-кратным ростом риска неблагоприятных событий (отношение рисков, ОР) 8,49; 95% доверительный интервал (ДИ): 2,00-36,15); p=0,004), а назначение только ДАТТ — 4-кратным (ОР 4,34; 95% ДИ: 1,08-17,36; p=0,038). При этом значимых различий по частоте ПКТ между группами варфарина и антиагрегантов выявлено не было ни в однофакторном, ни в многофакторном анализе.
У пациентов, получавших ПОАК, по сравнению с группой больных, получавших варфарин, отмечалась тенденция к меньшей смертности от всех причин (0 vs 5,25 на 100 пациенто-лет; p=0,113), а также меньшая частота кровотечений (11,64 vs 15,87 на 100 пациенто-лет; p=0,129). Частота всех (ОР 9,98; 95% ДИ: 2,14-46,62; p=0,003) и больших (ОР 311,8; 95% ДИ: 2,55-38167; p=0,019) кровотечений в группе варфарина была статистически значимо больше в многофакторном анализе. Кроме того, за весь период наблюдения в группах пациентов, получавших АК, не произошло ни одного ТЭО, что связано с равной эффективностью варфарина и ПОАК.
Подробное сравнение конечных точек в группах ПОАК и антиагрегантов показало, что назначение ПОАК ассоциировано с меньшей частотой случаев смерти от всех причин — 0 vs 5,44 на 100 пациенто-лет (p=0,129) и тромботических событий — 0 vs 4,48 на 100 пациенто-лет (p=0,103). Частота всех кровотечений в однофакторном анализе была выше в группе ПОАК, чем в группе антиагрегантов — 11,64 vs 1,09 на 100 пациенто-лет (p=0,019), однако после коррекции в многофакторном анализе по исходным различиям в клиникоанамнестической характеристике различия по кровотечениям нивелировались (p=0,211).
Таким образом, как показано в настоящем исследовании, назначение ПОАК было ассоциировано с большей эффективностью и безопасностью в сравнении с варфарином и антиагрегантными препаратами.
Что касается тромбоза поверхности устройства — в многофакторном анализе связи этого осложнения с режимом послеоперационной АТТ обнаружено не было. Также в исследовании не отмечалось связи между девайс-ассоциированным тромбозом и последующими ТЭО.
Для выявления других факторов риска событий ПКТ был проведен дополнительный многофакторный анализ. Помимо типа послеоперационной АТТ факторы отбирались среди всех исходных клинико-анамнестических характеристик пациентов, а также таких параметров, как сумма баллов по шкалам CHA2DS2-VASc и HAS-BLED, анатомический тип УЛП, степень спонтанного эхоконтрастирования по данным предоперационной ЧПЭхоКГ, показание к имплантации ОУЛП (противопоказания или отказ от ОАК) и наличие раннего значимого послеоперационного эндолика. Факторы, значимость ассоциации которых с исходом составила p≤0,2 при однофакторном анализе, были протестированы в многофакторной модели. В результате отбора параметров методом включения Вальда в итоговую модель пропорциональных рисков были включены факторы: тип послеоперационной АТТ, пол, ЧКВ в анамнезе, показания к имплантации ОУЛП. Данная модель была статистически значимой в целом (p<0,001), а также статистическая значимость была продемонстрирована для каждого фактора в отдельности. Характеристика ОР для каждого предиктора в составе модели представлена в таблице 5 и на рисунке 3.
Таблица 5
Предикторы развития ПКТ за 3 года наблюдения (многофакторная регрессионная модель)

Примечание: в модель включены все параметры, по которым исходно отличались группы, а также параметры со значимостью p<0,2 в однофакторном анализе. ДАТТ — двойная антитромбоцитарная терапия, ДИ — доверительный интервал, ОАК — оральные антикоагулянты, ОР — отношение рисков, ПКТ — первичная конечная точка, ПОАК — прямые оральные антикоагулянты, ЧКВ — чрескожное коронарное вмешательство.

Рис. 3 Влияние различных факторов на риск событий суммарной клинической эффективности (смерть от всех причин, ИИ/ТИА/СЭ, большие и клинически значимые малые кровотечения).
Примечание: ДАТТ — двойная антитромбоцитарная терапия, ДИ — доверительный интервал, ОАК — оральные антикоагулянты, ОР — отношение рисков, ПОАК — прямые оральные антикоагулянты, ЧКВ — чрескожное коронарное вмешательство.
Исходя из коэффициентов регрессии, мужской пол, имплантация окклюдера по поводу отказа от терапии ОАК, ЧКВ в анамнезе, а также назначение в послеоперационном периоде режима АТТ с варфарином или ДАТТ вместо ПОАК было связано с повышением риска неблагоприятного исхода в виде событий ПКТ.
В настоящем исследовании подавляющее большинство пациентов получали АТТ в течение первого года наблюдения, поэтому был проведен дополнительный анализ событий ПКТ, произошедших за первый год после имплантации ОУЛП. Был выполнен дополнительный однофакторный регрессионный анализ риска событий ПКТ за 1 год. Полученные предполагаемые предикторы с уровнем значимости p≤0,2 были включены в многофакторный анализ. По результатам данного анализа была выявлена статистическая значимость тех же самых предикторов, что и при анализе событий за 3 года, только с более широкими значениями ДИ (таблица 6).
Таблица 6
Предикторы развития ПКТ (многофакторная регрессионная модель) за первый год наблюдения

Назначение ПОАК после имплантации ОУЛП
в настоящем исследовании являлось независимым предиктором благоприятного исхода. Согласно полученным данным, возможно рассмотреть назначение ПОАК у пациентов групп риска: с высоким риском кровотечений, лицам мужского пола, а также пациентам с ЧКВ в анамнезе.
По выполненному многофакторному анализу риска неблагоприятных событий за первый год наблюдения также были построены скорректированные кривые Каплана-Мейера для исследуемых групп (рисунок 4).

Рис. 4 Скорректированная в многофакторном анализе свобода от событий, составивших ПКТ (смерть от всех причин + ИИ/ТИА/СЭ + большие и клинически значимые кровотечения по критериям регистра GARFIELD) в исследуемых группах за первый год наблюдения.
Примечание: ПОАК — прямые оральные антикоагулянты, ТИА — транзиторная ишемическая атака.
Обсуждение
Несмотря на то, что класс рекомендаций и уровень доказательности эндоваскулярной окклюзии УЛП в клинических рекомендациях остаются невысокими (IIb/B) [11][12], данный метод профилактики ТЭО у пациентов с неклапанной ФП показал себя как эффективная и безопасная альтернатива АКТ в ходе различных РКИ.
В рамках двух многоцентровых РКИ — PROTECT-AF и PREVAIL [14], а также в продолжающих их регистрах CAP (Continued Access to PROTECT-AF) и CAP-2 (Continued Access to PREVAIL) [15] было доказано, что имплантация ОУЛП Watchman сопоставима по эффективности с терапией варфарином и при этом снижает частоту смерти, крупных кровотечений. Сопоставимый профиль эффективности и безопасности эндоваскулярной окклюзии УЛП в сравнении с ПОАК был показан в РКИ PRAGUE-17 [8] и проспективном регистре [16]. Согласно результатам данных исследований между группами имплантации окклюдера и ПОАК не было различий в частоте развития ИИ, а частота крупных кровотечений была сопоставима в обеих группах в исследовании PRAGUE-17 и меньше в группе окклюдера в исследовании проспективного реестра.
Важно подчеркнуть, что во все вышеуказанные исследования включались пациенты, не имеющие противопоказаний к длительному приему АКТ. Кроме того, в исследования PROTECT-AF и PREVAIL были, в т.ч., включены и пациенты с низким риском ишемических осложнений, включая пациентов с 1 баллом по шкале CHA2DS2-VASc. Тем не менее, несмотря на различия в дизайнах, более высокий риск ТЭО и наличие противопоказаний к приему АК у большинства пациентов, включенных в настоящее исследование, частота неблагоприятных исходов в исследовании была сопоставима с результатами, полученными в исследовании PROTECT-AF.
Крупным проспективным регистром, в котором пациенты высокого риска получали различные схемы АТТ после имплантации ОУЛП, является регистр EWOLUTION [17]. В нем после имплантации устройства Watchman 27% пациентов получали ОАК, 60% — ДАТТ, 7% — монотерапию антиагрегантами, 6% пациентов не получали никакой АТТ. Частота случаев смерти от всех причин составила 16,4%, кардиальной смерти — 4,5%, частота развития ИИ/ТИА/СЭ — 2 на 100 паценто-лет, крупных кровотечений — 2,7 на 100 пациенто-лет. Данные исследования EWOLUTION были частично сопоставимы с результатами, полученными в настоящем исследовании, при приблизительно равных тромбоэмболических и геморрагических рисках. Частота случаев смерти от всех причин в нашем исследовании была ниже — 7,6%. Частота развития ИИ/ ТИА/СЭ в нашем исследовании была идентична данным исследования EWOLUTION — 2,1 на 100 пациенто-лет. Более частое развитие кровотечений в настоящем исследовании — 4,8 на 100 пациентолет, вероятнее всего, было обусловлено тем, что в нашем исследовании 62% пациентов при выписке получали АК, в то время как в исследовании EWOLUTION доля таких пациентов составила всего 27%. Кроме того, в исследовании EWOLUTION, как в нашем и ряде других исследований, не было выявлено достоверной зависимости между частотой развития девайс-ассоциировнного тромбоза и схемой АТТ, назначенной после эндоваскулярной окклюзии УЛП [18-20].
Отдельно стоит отметить, что в анализе данных регистра EWOLUTION, проведенном Bergmann M, et al., было продемонстрировано, что назначение ДАТТ или ПОАК сразу после имплантации ОУЛП Watchman, является эффективной и безопасной альтернативой АКТ варфарином. Кроме того, в данном анализе, как и в настоящем исследовании, ПОАК получили преимущество по эффективности и безопасности в сравнении с ДАТТ [21].
Аналогичный нашему исследованию дизайн был у ретроспективного одноцентрового нерандомизированного исследования [22], в которое были включены пациенты с неклапанной формой ФП, высоким риском ТЭО и кровотечений, которым выполнялась эндоваскулярная окклюзия УЛП с последующим назначением различных схем АТТ. В общей когорте 71,5% пациентов были выписаны на ДАТТ, 19% на монотерапии ОАК, 4,5% на “минимальной” терапии (монотерапии одним из антиагрегантов или без АТТ), и оставшиеся 4,5% на других режимах терапии, включая сочетания ОАК и антиагрегантов. В данном исследовании общее число неблагоприятных событий за 3 мес. наблюдения было достаточно невелико, и статистически значимых различий между группами по ПКТ (тромб в УЛП по ЧПЭхоКГ + ИИ + ТИА + геморрагический инсульт + большие и малые кровотечения + смерть от всех причин) не было выявлено ни в раннем периоде в течение 3 мес., ни в отдаленном периоде в течение 2 лет наблюдения.
В многоцентровом проспективном нерандомизированном исследовании ASAP (ASA Plavix Feasibility Study With Watchman Left Atrial Appendage Closure Technology) [23] было доказано, что имплантация устройства Watchman с последующим назначением только ДАТТ является эффективной и безопасной у пациентов с наличием противопоказаний к приему АК в сравнении с комбинированной терапией варфарином и антиагрегантами. Среднегодовая частота всех инсультов и ИИ в регистре ASAP была аналогичной данным, полученным в регистре PROTECT-AF. Частота развития всех инсультов и СЭ составила 2,3%. ИИ развился у 3 пациентов, что составило 1,7% от обследованной популяции.
В настоящем исследовании режимы АТТ с варфарином по своей эффективности и безопасности также были сопоставимы с ДАТТ, однако применение в послеоперационном периоде ПОАК ассоциировалось с лучшим профилем суммарной клинической эффективности.
Отдельно следует отметить исследования, в которых оценивалась эффективность и безопасность “минимальной” АТТ после имплантации устройства Amplatzer, а именно — назначение в послеоперационном периоде монотерапии аспирином или клопидогрелом. В одноцентровом проспективном нерандомизированном исследовании была продемонстрирована безопасность монотерапии аспирином после имплантации ОУЛП Amplatzer cardiac plug и Amulet у пациентов с высоким риском ишемических и геморрагических осложнений [24]. В исследовании, в которое был включен 31 пациент с неклапанной формой ФП и противопоказаниями к приему АК, высоким риском как геморрагических, так и ишемических осложнений, также была продемонстрирована эффективность и безопасность монотерапии аспирином или клопидогрелом после имплантации различных ОУЛП, однако стоит отметить, что подавляющему большинству пациентов было имплантировано устройство Amplatzer [25].
В нашем исследовании большому количеству пациентов после имплантации устройства Watchman была назначена не стандартная терапия варфарином с последующим переходом на ДАТТ, а ПОАК. В ходе исследования впервые в условиях реальной клинической практики проводилось сравнение частоты развития неблагоприятных событий при назначении варфарина и ПОАК после эндоваскулярной окклюзии УЛП. Согласно полученным данным, назначение в послеоперационном периоде ПОАК ассоциировано с статистически значимым снижением частоты достижения ПКТ в сравнении с варфарином, а также в сравнении с антитромбоцитарной терапией. При этом различия в частоте развития неблагоприятных ишемических событий не получили статистической значимости. В метаанализе исследований, в которых проводилось сравнение эффективности и безопасности варфарина и препаратов из группы ПОАК у пациентов с ФП и кровотечением в анамнезе, было доказано, что назначение ПОАК в сравнении с варфарином приводит к снижению частоты развития инсульта и СЭ, смерти от всех причин, не приводя при этом к увеличению геморрагических осложнений [26].
Ограничения исследования. Исследование имело одноцентровый, наблюдательный характер. Выбор режима АТТ не был рандомизирован, схема АТТ назначалась на усмотрение лечащих врачей. Было включено относительно небольшое число пациентов. Участие в исследовании реальной популяции привело к гетерогенности исследуемых групп.
Заключение
В настоящем исследовании впервые в условиях реальной клинической практики были получены данные о том, что назначение ПОАК после имплантации ОУЛП ассоциируется с более высокой эффективностью и безопасностью в сравнении с варфарином и ДАТТ. Это свидетельствует о том, что при отсутствии абсолютных противопоказаний к приему АК в послеоперационном периоде следует рассмотреть возможность назначения ПОАК в протоколе АТТ пациентам с высоким риском кровотечений, а также пациентам при наличии дополнительных факторов риска, таких как мужской пол, перенесенное ЧКВ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Virani S, Alonso A, Benjamin E, et al. Heart Disease and Stroke Statistics — 2020 Update: A Report from the American Heart Association. Circulation. 2020;41(9):139-596. doi:10.1161/cir.0000000000000757.
2. Вечерский Ю.Ю., Богданов Ю. И., Баталов Р.Е. и др. Новый способ окклюзии ушка левого предсердия с целью профилактики тромбоэмболических осложнений у пациентов с фибрилляцией предсердий во время коронарного шунтирования. Российский кардиологический журнал. 2020;25(8):3699. doi:10.15829/1560-4071-2020-3699.
3. Заиграев И. А., Явелов И. С. Тромбоз левого предсердия и/или его ушка при неклапанной фибрилляции предсердий: эхокардиографические и лабораторные факторы риска, возможности прогнозирования и коррекции. Атеротромбоз. 2020;(1):56-70. doi:10.21518/2307-1109-20201-56-70.
4. Paquette M, Franca LR, Teutsch C, et al. Dabigatran persistence and outcomes following discontinuation in atrial fibrillation patients from the GLORIA-AF registry. Am J Cardiol. 2020;125:383-91. doi:10.1016/j.amjcard.2019.10.047.
5. Hellfritzsch M, Grove EL, Husted SE, et al. Clinical events preceding switching and discontinuation of oral anticoagulant treatment in patients with atrial fibrillation. Europace. 2017;19:1091-5. doi:10.1093/europace/euw241.
6. Holmes D, Reddy V, Turi Z, et al. Percutaneous closure of the left atrial appendage versus warfarin therapy for prevention of stroke in patients with atrial fibrillation: a randomised noninferiority trial. Lancet. 2009;374:534-42. doi:10.1016/S01406736(09)61343-X.
7. Holmes DR, Kar S, Price MJ, et al. Prospective Randomized Evaluation of the Watchman Left Atrial Appendage Closure Device in Patients With Atrial Fibrillation Versus Long-Term Warfarin Therapy. J Am Coll Cardiol. 2014;64(1):1-12. doi:10.1016/j.jacc.2014.04.029.
8. Osmancik P, Herman D, Neuzil P, et al.; PRAGUE-17 Trial Investigators. Left Atrial Appendage Closure Versus Direct Oral Anticoagulants in High-Risk Patients with Atrial Fibrillation. J Am Coll Cardiol. 2020;75(25):3122-35. doi:10.1016/j.jacc.2020.04.067.
9. Tzikas A, Shakir S, Gafoor S, et al. Left atrial appendage occlusion for stroke prevention in atrial fibrillation: Multicentre experience with the AMPLATZER Cardiac Plug. EuroIntervention. 2016;11(10):1170-9. doi:10.4244/EIJY15M01_06.
10. Голицын С. П., Панченко Е. П., Кропачева Е. С. и др. Диагностика и лечение фибрилляции предсердий. Евразийский кардиологический журнал. 2019;(4):4-85.
11. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for CardioThoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42(5):373-498. doi:10.1093/eurheartj/ehaa612.
12. Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. doi:10.15829/1560-4071-2021-4594.
13. Glikson M, Wolff R, Hindricks G, et al. EHRA/EACTS expert consensus statement on catheter-based left atrial appendage occlusion — an update. EuroIntervention. 2020;15(13):1133-80. doi:10.4244/EIJY19M08_01.
14. Reddy VY, Doshi SK, Kar S, et al. 5-Year Outcomes After Left Atrial Appendage Closure. J Am Coll Cardiol. 2017;70(24):2964-75. doi:10.1016/j.jacc.2017.10.021.
15. Holmes DR, Reddy VY, Gordon NT, et al. Long-Term Safety and Efficacy in Continued Access Left Atrial Appendage Closure Registries. Am Coll Cardiol. 2019;74(23):2878-89. doi:10.1016/j.jacc.2019.09.064.
16. Nielsen-Kudsk JE, Korsholm K, Damgaard D, et al. Clinical Outcomes Associated With Left Atrial Appendage Occlusion Versus Direct Oral Anticoagulation in Atrial Fibrillation. ACC Cardiovasc Interv. 2021;14(1):69-78. doi:10.1016/j.jcin.2020.09.051.
17. Boersma LV, Ince H, Kische S, et al. Evaluating Real-World Clinical Outcomes in Atrial Fibrillation Patients Receiving the WATCHMAN Left Atrial Appendage Closure Technology. Final 2-Year Outcome Data of the EWOLUTION Trial Focusing on History of Stroke and Hemorrhage. Circ Arrhythm Electrophysiol. 2019;12(4):e006841. doi:10.1161/circep.118.006841.
18. Давтян К.В., Симонян Г.Ю., Топчян А. Г. и др. Антитромботическая терапия после успешной эндоваскулярной окклюзии ушка левого предсердия у пациентов с неклапанной фибрилляцией предсердий и высоким риском кардиоэмболического инсульта. Вестник аритмологии. 2022;29(1):24-31. doi:10.35336/VA-2022-1-04.
19. Lempereur M, Aminian A, Freixa X, et al. Device-associated thrombus formation after left atrial appendage occlusion: A systematic review of events reported with the Watchman, the Amplatzer Cardiac Plug and the Amulet. Catheter Cardiovasc Interv. 2017;90(5):E111-21. doi:10.1002/ccd.26903.
20. Simard T, Jung RG, Lehenbauer K, et al. Predictors of DeviceRelated Trombus Following Percutaneus Left Atrial Appendage Occlusion. J Am Coll Cardiol. 2021;78(4):297-313. doi:10.1016/j.jacc.2021.04.098.
21. Bergmann M, Betts TR, Sievert H, et al. Early Anticoagulation drug regimens after WATCHMAN Left Atrial Appendage Closure: Safety and efficacy. EuroIntervention. 2017;13(7):877-84. doi:10.4244/EIJ-D-17-00042.
22. Mazzone P, Laricchia A, D’Angelo G, et al. Role of Different Antithrombotic Regimens after Percutaneous Left Atrial Appendage Occlusion: A Large Single Center Experience. J Clin Med. 2021;10(9):1959. doi:10.3390/jcm10091959.
23. Reddy VY, Möbius-Winkler S, Miller MA, et al. Left Atrial Appendage Closure With the Watchman Device in Patients With a Contraindication for Oral Anticoagulation. J Am Coll Cardiol. 2013;61(25):2551-6. doi:10.1016/j.jacc.2013.03.035.
24. Korsholm K, Nielsen KM, Jensen JM, et al. Transcatheter left atrial appendage occlusion in patients with atrial fibrillation and a high bleeding risk using aspirin alone for post-implant antithrombotic therapy. EuroIntervention. 2017;12:2075-82. doi:10.4244/EIJ-D-16-00726.
25. Rodriguez-Gabella T, Nombela-Franco L, Regueiro A, et al. Single Antiplatelet Therapy Following Left Atrial Appendage Closure in Patients with Contraindication to Anticoagulation. J Am Coll Cardiol. 2016;68:1920-1. doi:10.1016/j.jacc.2016.08.016.
26. Lip GYH, Keshishian A, Kang A, et al. Effectiveness and safety of oral anticoagulants in non-valvular atrial fibrillation patients with prior bleeding events: a retrospective analysis of administrative claims databases. J Thromb Thrombolysis. 2022:54(1):33-46. doi:10.1007/s11239-022-02660-2.
Об авторах
Д. В. ПевзнерРоссия
Певзнер Дмитрий Вольфович — кандидат медицинских наук, зав. блоком интенсивной терапии отдела неотложной кардиологии
Москва
Ю. К. Рытова
Россия
Рытова Юлия Константиновна — врач-ординатор отдела неотложной кардиологии
Москва
И. А. Меркулова
Россия
Меркулова Ирина Алексеевна — врач-кардиолог блока интенсивной терапии, лаборант-исследователь отдела неотложной кардиологии
Москва
Е. В. Меркулов
Россия
Меркулов Евгений Владимирович — доктор медицинских наук, старший научный сотрудник, заведующий 1 отделением рентгенхирургических методов диагностики и лечения
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Певзнер Д.В., Рытова Ю.К., Меркулова И.А., Меркулов Е.В. Эффективность и безопасность различных режимов антитромботической терапии после имплантации окклюдера ушка левого предсердия. Кардиоваскулярная терапия и профилактика. 2022;21(8):3353. https://doi.org/10.15829/1728-8800-2022-3353
For citation:
Pevsner D.V., Rytova Yu.K., Merkulova I., Merkulov E.V. Efficacy and safety of various antithrombotic regimens after left atrial appendage occlusion. Cardiovascular Therapy and Prevention. 2022;21(8):3353. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3353
JATS XML

























































