Перейти к:
Роль межгенных взаимодействий между генами цитокинов и Toll-подобных рецепторов в этиологии врожденных пороков сердца
https://doi.org/10.15829/1728-8800-2023-3368
Аннотация
Частота встречаемости врожденных пороков сердца (ВПС) достигает 1% от всех новорожденных детей. Особое значение имеет группа пороков сердца без семейной истории и хромосомных заболеваний, которая составляет >80% из всех ВПС. Эти пороки сердца можно обозначить как спорадические ВПС, их этиология и патогенез продолжают изучаться.
Цель. Изучить ассоциативные связи между генами цитокинов, Toll- подобных рецепторов (TLR) и ВПС у детей.
Материал и методы. Обследовано 188 детей со спорадическими (без семейной истории) ВПС (основная группа) и 103 условно здоровых детей без ВПС (контрольная группа). Генотипирование проводили методом полимеразной цепной реакции (ПЦР) в режиме реального времени.
Результаты. Спорадические ВПС, в целом, и септальные ВПС, в частности, формируются на схожих межгенных ассоциациях, которые детерминируют нарушение регуляции пролиферации и дифференцировки прогениторных клеток сердечно-сосудистой системы. Вероятно, одним из молекулярных механизмов формирования спорадических септальных ВПС может быть неэффективность внутриклеточных сигнальных путей до NF-κB (Nuclear Factor kappa B) из-за первичного дефицита мембранных гетеродимеров TLR1/ TLR6, TLR2/TLR6 и TLR1/TLR2.
Заключение. Данные об измененном провоспалительном потенциале в группе спорадических септальных ВПС необходимо учитывать в постнатальном периоде при проведении кардиохирургического лечения этих нозологий.
Ключевые слова
Для цитирования:
Шабалдин А.В., Шмулевич С.А., Синицкая А.В., Замараев Р.Ю. Роль межгенных взаимодействий между генами цитокинов и Toll-подобных рецепторов в этиологии врожденных пороков сердца. Кардиоваскулярная терапия и профилактика. 2023;22(2):3368. https://doi.org/10.15829/1728-8800-2023-3368
For citation:
Shabaldin A.V., Shmulevich S.A., Sinitskaya A.V., Zamaraev R.Yu. Role of intergenic interactions between cytokine and Toll-like receptor genes in the etiology of congenital heart defects. Cardiovascular Therapy and Prevention. 2023;22(2):3368. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3368
Введение
Современные исследования этиологии и патогенеза врожденных пороков сердца (ВПС) показали неоспоримую значимость молекулярно-генетических особенностей, лежащих в основе данной патологии [1]. В то же время, на сегодняшний день существуют проблемы изучения патогенетических механизмов развития ВПС, которые связаны с большой разнородностью нозологических форм ВПС и аномалий сердечно-сосудистой системы (ССС).
Есть незначительная группа ВПС с семейной историей, которые относят к моногенным заболеваниям с наследуемыми миссенс-мутациями, передающимися из поколения в поколение. Литературные данные демонстрируют, что подобного вида мутации кодируют молекулы, преимущественно регулирующие экспрессию функциональных генов [2][3]. Другая группа ВПС, отдельно учитываемая в мировых регистрах, связана с хромосомными заболеваниями, такими как синдром Дауна, синдром Шершевского-Тернера и др. Современные исследования показывают, что существует группа ВПС, при которых обнаруживаются хромосомные транслокации с мало проявляемыми фенотипическими признаками. Удельный вес этих пороков сердца во всей структуре ВПС не >10% [4]. Кроме того, стоит отметить, что >80% из всех ВПС приходится на спорадические (без семейной истории) [5].
Современные Omics технологии (исследования протеома, экзома, транскриптома и метаболома) при ВПС показали значимые отклонения в регуляторных сетях, детерминирующих пролиферацию клеток, формирующих зачатки ССС у эмбриона. Получены схожие данные и для комбинированных ВПС, таких как тетрада Фалло. В некоторых работах показана ассоциативная связь с ВПС генов цитокинов и мембранных рецепторов межклеточных контактов [6].
Изучение генетических, социальных, семейных, экологических факторов, ассоциированных с ВПС, продемонстрировало, что они являются преимущественно мультифакторным заболеванием. Период формирования ССС приходится на 3-8 нед. гестации, на протяжении которого идет активное "приживление" эмбриона, регулируемое межклеточными контактами и цитокиновой регуляцией. Соответственно, конституционально обусловленные отклонения в данной цепи событий могут оказывать влияние на эмбриогенез ССС [7][8].
Исходя из этого, была поставлена цель исследования — изучить ассоциативные связи взаимодействий между генами цитокинов и Toll-подобных рецепторов (TLR, Toll-like receptors) со спорадическими ВПС у детей.
Материал и методы
Настоящее исследование проведено на базе Научно-исследовательского института комплексных проблем сердечно-сосудистых заболеваний (НИИ КПССЗ) и одобрено локально этическим комитетом. Работа выполнена при поддержке комплексной программы фундаментальных научных исследований СО РАН в рамках фундаментальной темы НИИ КПССЗ № 0419-2022-0001.
В исследование включено 188 детей (103 девочки и 85 мальчиков) со спорадическими (без семейной истории) ВПС (основная группа). Все матери детей подписывали информированное согласие на участие в генетическом исследовании. Диагноз ВПС у детей был подтвержден с помощью эхокардиографии и других инструментальных методов. У всех детей с ВПС было исключено наличие хромосомных заболеваний. Структура ВПС представлена в таблице 1.
Таблица 1
Нозологические формы спорадических ВПС у детей основной группы (n=188)
Нозология | В группах по нозологиям, n (%) |
Септальные пороки сердца | |
ДМЖП | 28 (14,89) |
ДМПП | 64 (34,04) |
ДМЖП и ДМПП | 6 (3,19) |
Пороки клапанов сердца | |
Стеноз аортального клапана | 5 (2,66) |
Двустворчатый аортальный клапан | 3 (1,60) |
Стеноз клапана легочной артерии | 8 (4,26) |
Дисплазия трикуспидального клапана | 1 (0,53) |
Отдельные нозологии | |
Тетрада Фалло | 15 (7,98) |
Единый желудочек сердца | 9 (4,79) |
Коарктация аорты | 10 (5,32) |
Открытый артериальный проток | 32 (17,02) |
Тотальный аномальный дренаж легочных вен | 3 (1,60) |
Частичный аномальный дренаж легочных вен | 4 (2,13) |
Примечание: ДМЖП — дефект межжелудочковой перегородки, ДМПП — дефект межпредсердной перегородки.
Доминирующей патологией у детей основной группы были септальные пороки сердца без семейной истории (таблица 1).
Контрольная группа сформирована из 103 условно здоровых детей (52 девочки и 51 мальчик). Группа была сформирована на клинической базе ФГБОУ ВО Кемеровского государственного медицинского университета Минздрава России. У всех матерей контрольной группы получено информированное согласие на участие в генетическом исследовании. Средний возраст детей основной группы был 3,9±2,3 лет, контрольной — 4,7±1,8 лет, что было сопоставимо.
Кровь брали из локтевой вены в пробирку, содержащую калиевую соль этилендиаминтетрауксусной кислоты (К3ЭДТА). Выделение дезоксирибонуклеиновой кислоты (ДНК) проводили стандартной фенол-хлороформной экстракцией согласно протоколу. Концентрацию выделенной ДНК измеряли на спектрофотометре NanoDrop ND-2000C (Thermo, USA).
Генотипирование проводили методом полимеразной цепной реакции (ПЦР) в режиме реального времени на амплификаторе "Viia7" (Applied Biosystems, США) с использованием Taqman зондов. Для исследования выбрано пять генов цитокинов и их рецепторов: IL6 (rs1800796, rs2069827), IL6R (rs2228145, rs2229238), IL8 (rs4073), IL10 (rs1800871, rs1800896, rs1800872), TNFa (rs1800629, rs361525, rs1799964) и четыре гена сигнальных TLR (TLR: TLR1 (rs5743611, rs5743551), TLR2 (rs5743708, rs3804099), TLR4 (rs4986791, rs4986790), TLR6 (rs3775073, rs5743810). Для отбора полиморфизмов использовались базы данных dbSNP, SNPinfo, SNPnexus.
Статистическая обработка данных проводилась с помощью пакетов программ SNPstats и MDR (http://sourceforge.net/projects/mdr).
Анализ соблюдения закона Харди-Вайнберга проводили при помощи программы SNPstats. Анализ межгенных взаимодействий осуществляли при помощи метода MDR (Multifactor Dimensionality Reduction) [9][10]. MDR-анализ выполнен для всей основной группы спорадических ВПС (n=188), а также для отдельных нозологических групп: септальные спорадические — дефект межжелудочковой перегородки/дефект межпредсердной перегородки (ДМЖП/ДМПП) (n=98), пороки клапанов сердца (n=17) и по отдельным нозологиям, представленным в таблице 1. Контрольная группа для всех сравнений была представлена условно-здоровыми детьми (n=103). Различия считались статистически значимыми при p<0,05 [11].
Результаты
Распределение всех частот генотипов цитокинов и TLR в основной и контрольной группах соответствовало распределению Харди-Вайнберга.
При помощи метода MDR проведена оценка SNP*SNP взаимодействия полиморфных вариантов генов цитокинов и TLR со спорадическими ВПС в целом (без разделения на группы). Характер межгенных взаимодействий (синергизм, антагонизм и аддитивные взаимодействия) представлен на рисунке 1.
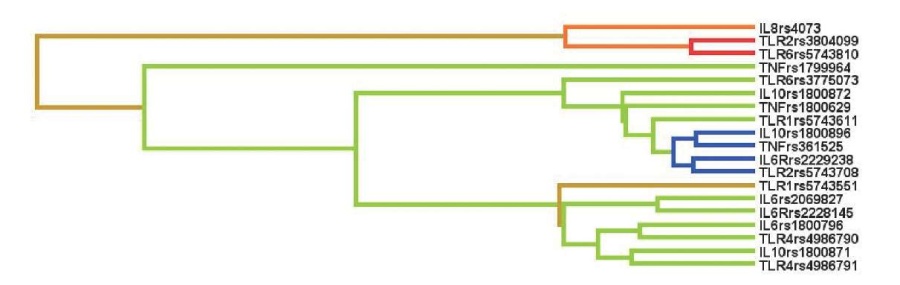
Рис. 1 Дендрограмма взаимодействий полиморфных локусов генов цитокинов и TLR.
Примечание: направленность взаимодействий между генами-кандидатами и предрасположенностью к развитию спорадических ВПС отмечены цветами различного цвета: красный — выраженный антагонизм, зеленый — умеренный антагонизм, синий/коричневый — аддитивное взаимодействие, оранжевый — умеренный синергизм. Цветное изображение доступно в электронной версии журнала.
Умеренный синергизм имел место между полиморфным вариантом гена IL8 (rs4073) с одной стороны, и полиморфизмами TLR2 (rs3804099) и TLR6 (rs5743810), с другой (рисунок 1), причем сами по себе взаимодействия TLR2 (rs3804099) с TLR6 (rs5743810) носили выраженный антагонистический характер.
Проведенный анализ показал доминирование антагонистических взаимодействий как отдельно между генами семейств цитокинов и TLR, так и между этими группами (TLR-цитокины). Наиболее значимым первичным антагонизмом обладали: IL10 (rs1800871) с TLR4 (rs4986791); IL6(rs1800796) с TLR4 (rs4986790); IL6 (rs2069827) с IL6R (rs2228145). Все эти три кластера также находились между собой в умеренном антагонизме.
Для более детального понимания вклада межгенных взаимодействий в формирование спорадических ВПС проведена оценка ассоциаций отдельно для цитокинов и их рецепторов и TLR. Получены значимые взаимосвязи с ВПС только для генов цитокинов и их рецепторов. Характер межгенных взаимодействий (синергизм, антагонизм и аддитивные взаимодействия), а также доля их вклада в общую энтропию спорадических ВПС представлены на рисунке 2. В результате проведенного анализа выявлено большое количество взаимодействий, однако наибольший долевой вклад в общую энтропию вносили варианты TNFa rs361525 (1,33%), IL6R rs2229238 (1,61%), IL6 rs2069827 (1,09%), IL10 rs1800896 (1,15%).
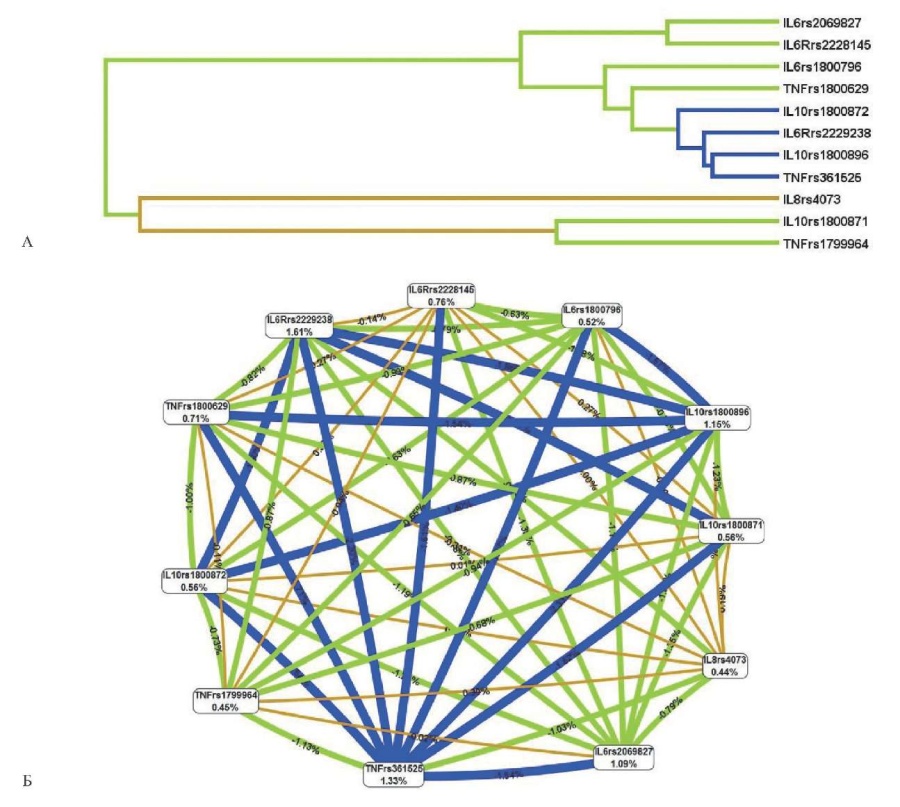
Рис. 2 Дендрограмма (А) и граф (Б) взаимодействий полиморфных локусов генов цитокинов и их рецепторов при спорадических ВПС в целом.
Примечание: направленность взаимодействий между генами-кандидатами и предрасположенностью к развитию ВПС отмечены цветами различного цвета: зеленый — умеренный антагонизм, синий/коричневый — аддитивное взаимодействие. Цветное изображение доступно в электронной версии журнала.
Анализ межгенных взаимодействий для отдельных нозологических форм ВПС, представленных в таблице 1, выявил значимые взаимосвязи ген-генных взаимодействий только со спорадическими септальными ВПС (ДМЖП/ДМПП). Характер межгенных взаимодействий (синергизм, антагонизм и аддитивные взаимодействия), а также доля вклада в общую энтропию при спорадических септальных ВПС (ДМЖП/ДМПП), представлены на рисунке 3.
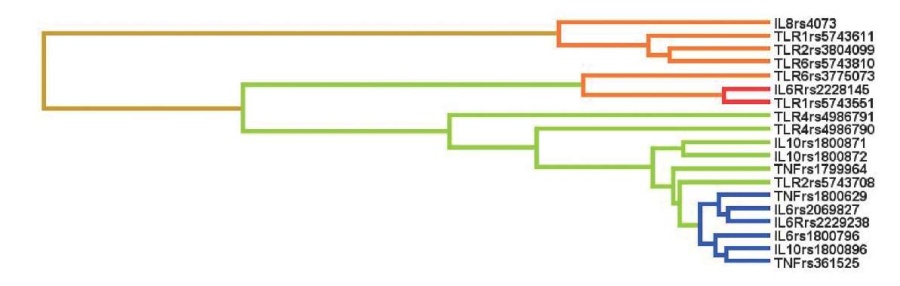
Рис. 3 Дендрограмма взаимодействий полиморфных локусов генов цитокинов и TPR при септальных (ДМЖП/ДМПП) ВПС.
Примечание: направленность взаимодействий между генами-кандидатами и предрасположенностью к развитию ВПС отмечены цветами различного цвета: красный — выраженный антагонизм, зеленый — умеренный антагонизм, синий/коричневый — аддитивное взаимодействие, оранжевый — умеренный синергизм. Цветное изображение доступно в электронной версии журнала.
Умеренный первичный синергизм имел место между полиморфным вариантом гена TLR2 (rs3804099) c TLR6 (rs5743810). Этот кластер, в свою очередь, имел умеренный синергизм с TLR1 (rs5743611) и далее — c IL8 (rs4073). Четыре полиморфных варианта генов цитокинов и TLR образуют единый синергетический блок, совместно усиливающих формирование спорадических септальных (ДМЖП/ДМПП) ВПС (рисунок 3).
Взаимодействия TLR1 (rs5743551) с IL6R (rs2228145) носили выраженный первичный антагонистический характер. Умеренный первичный антагонизм при спорадических септальных ВПС (ДМЖП/ДМПП) выявлен для IL10 (rs1800871) c IL10 (rs1800872). Этот первичный кластер имел антагонизм с дополнительными кластерами TNF (rs1799964) и TLR2 (rs5743708), а также третичные и четвертичные антагонистические связи с TLR4 (rs4986790) и с TLR4 (rs4986791), соответственно.
Детальное исследование с помощью метода MDR вклада межгенных взаимодействий в формирование спорадических септальных ВПС (ДМЖП/ДМПП) показало наличие значимых взаимосвязей только для генов цитокинов и их рецепторов. Характер межгенных взаимодействий (синергизм, антагонизм и аддитивные взаимодействия), а также доля вклада в общую энтропию при спорадических септальных ВПС (ДМЖП/ДМПП), представлены на рисунке 4.
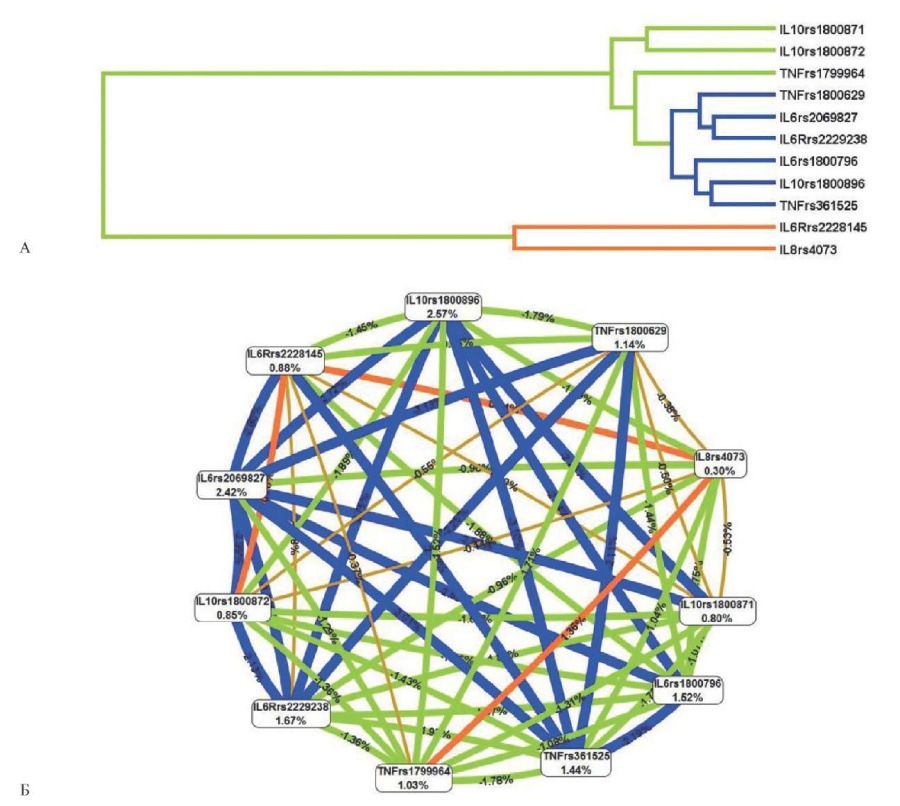
Рис. 4 Дендрограмма (А) и граф (Б) взаимодействий полиморфных локусов генов цитокинов и их рецепторов при спорадических септальных ВПС (ДМЖП/ДММПП).
Примечание: направленность взаимодействий между генами-кандидатами и предрасположенностью к развитию ВПС отмечены цветами различного цвета: зеленый — умеренный антагонизм, синий/коричневый — аддитивное взаимодействие, оранжевый — умеренный синергизм. Цветное изображение доступно в электронной версии журнала.
В результате анализа выявлено большое количество взаимодействий, однако наибольший долевой вклад в общую энтропию при септальных спорадических ВПС (ДМЖП/ДМПП) вносили полиморфные локусы IL10 rs1800896 (2,57%), IL6 rs2069827 (2,42%), TNFa rs361525 (1,44%), IL6Rrs2229238 (1,67%), TNFa rs1800629 (1,14%), TNFa rs1799964 (1,03%) (рисунок 4).
Обсуждение
Гипотеза настоящего исследования состояла в том, что возникновение спорадических ВПС связано с конституциональной предрасположенностью к нарушениям регуляции процессов пролиферации и дифференцировки клеток, формирующих зачатки ССС у эмбриона. Высказано предположение, что важными молекулярными элементами регуляторных сетей являются цитокины и их рецепторы, а также TPR, как важные мембранные сигнальные системы. Плейотропность цитокинов и TPR реализуется, в т.ч. в эффектах регуляции деления и дифференцировки клеток и инициировании клеточной гибели. Особый путь, ассоциированный с провоспалительными цитокинами, представлен пироптозом — запрограммированной гибелью клетки за счет активации рецепторов апоптоза цитокиновыми лигандами [12]. Метод MDR позволил, преимущественно качественно, оценить вклад синергетических, антагонистических и аддитивных взаимодействий между генами цитокинов и TPR. Важные результаты получены для спорадических ВПС в целом и для спорадических септальных ВПС (ДМЖП/ДМПП). Отсутствие значимых ассоциаций для отдельных нозологий и групп ВПС связано с ограничением размеров выборок и требует дальнейшего изучения.
Выявлено, что важным геном для синергетических взаимодействий, которые ассоциированы со спорадическими ВПС в целом и со спорадическими септальными ВПС (ДМЖП/ДМПП), является IL8 (rs4073). Молекула IL (интерлейкин)-8 является основным хемокином для нейтрофильных лейкоцитов и лимфоцитов. Синергетическое влияние данного гена может быть связано с конституциональным повышением или понижением (гомозиготность по дикому или мутантному аллелю, соответственно) синтеза или нарушением функциональной активности этого цитокина [13][14]. Для IL8rs4073 получено большое количество ассоциаций с инфекционной, аутовоспалительной и аутоиммунной патологией [13].
Проведенное исследование также показало, что IL8 (rs4073) связан синергизмом с кластером TLR2 (rs3804099) и TLR6 (rs5743810) как при спорадических ВПС в целом, так и при спорадических септальных ВПС (ДМЖП/ДМПП). Различия между этими двумя группами ВПС заключаются в том, что в данном кластере гены взаимодействовали прямо противоположно: при спорадических ВПС с выраженным антагонизмом, а при септальных ВПС с умеренным синергизмом. Это указывает на значимость данных полиморфных вариантов в детерминировании ВПС. Достаточно большое количество исследований показало значимость полиморфного участка rs5743810 гена TLR6 в формировании провоспалительных, инфекционных, онкологических заболеваний [15-17].
Показано, что TLR6 образует гетеродимеры c TLR2, через которые воспринимаются сигналы от различных лигандов, в т.ч. от молекул регулирующих пролиферацию клеток. Формирование гетородимеров активирует внутриклеточные каскады, передающие сигналы на ядерный фактор транскрипции каппа B (NF-κB). В отношении эмбриобласта нет данных об особенностях экспрессии TLR. В то же время, исследования транскриптома эндометрия у женщин с повторяющимися репродуктивными потерями после экстракорпорального оплодотворения, показали доминирование регуляторных сетей с активацией IL-6, интерферона-γ, IL-17A, IL-23A, интерферонов-α и β, IL-2, TLR4 и TLR6, а также ряда хемокинов и внутриклеточных мессенджеров (STAT3, RAG1) [18][19].
Обнаружено, что именно в кластер, определяющий формирование ВПС, входит полиморфный вариант гена TLR2 (rs3804099). Данный полиморфный участок кодирует синонимичную мутацию (Asn199=), при которой замена Цитозина на Тимин не приводит к изменению аминокислоты в 199 положении. Данный тип мутации может влиять на сплайсинг РНК, на ее стабильность, а также на фолдинг белковый молекулы. Соответственно, через данные эффекты может снижаться как экспрессия самого рецептора, так и его функциональная активность [20][21].
Еще один значимый синергизм входил в кластер, ассоциированный со спорадическими септальными ВПС (ДМЖП/ДМПП). Это полиморфный участок гена TLR1 (rs5743611), который детерминирует миссенс-мутацию (Arg80Thr). Как показано выше, сигнальные TPR эффективно функционируют как гетеродимеры, в частности TLR2 с TLR1 или TLR6 с TLR1. Именно неэффективное образование данных структур может быть основой патогенеза заболеваний ССС, в т.ч. септальных ВПС [21][22].
Для септальных ВПС (ДМЖП/ДМПП) получено отдельное ген-генное синергетическое взаимодействие (IL8 rs4073 с IL6R rs2228145). Полиморфный участок гена IL6R rs2228145 детерминирует миссенс-мутацию (Asp358Ala), которая может изменять функциональную активность рецептора. Для данного полиморфного варианта показана ассоциация с патологической кальцификацией биологического протеза митрального клапана [23].
Для септальных ВПС получен большой антагонистический кластер, в который входят гены, кодирующие молекулы IL-10, фактора некроза опухоли-альфа (TNF-α), рецептора к IL-6, а также TPR (TLR1, TLR2, TLR4). TLR2 rs5743708 является фактором риска формирования хронических инфекционных заболеваний, вызванных Borrelia burgdorferi и Mycobacterium tuberculosis [24]. Доказано, что мутантный TLR2 не способен эффективно образовывать гетеродимеры с TLR4 и активировать внутриклеточные каскады до NF-κB.
В первичный антагонистический кластер входят два полиморфных участка гена IL10 (rs180871 и rs180872), которые находятся в промоторе и влияют на экспрессию самого гена. В то же время, указанные полиморфизмы имели незначительные ассоциации с атопическими заболеваниями у детей с нарушениями функционирования Т-регуляторных лимфоцитов и Т-хелперов 1 и 2 типов [25]. Молекула IL-10 играет значительную роль в иммуносупресссии и в ограничении пролиферативной активности клеток [26]. Возможно, первичный антагонизм двух участков гена, определяющих экспрессию IL10, является проявлением конкуренции за ограничение пролиферативного потенциала. Это особо актуально в связи с тем, что в антагонистическом кластере находится и полиморфный участок гена TNFa rs1799964, который также детерминирует активацию гена. Повышенный синтез самой молекулы TNF-α дополнительно к ограничению пролиферации может запускать пироптоз [27].
Заключение
Таким образом, спорадические ВПС, в целом, и септальные ВПС (ДМЖП/ДМПП), в частности, формируются на схожих межгенных ассоциациях, которые детерминируют нарушение регуляции пролиферации и дифференцировки клеток, формирующих зачатки ССС у эмбриона.
Вероятно, одним из молекулярных механизмов формирования спорадических септальных ВПС может быть неэффективность внутриклеточных сигнальных путей до NF-κB из-за первичного дефицита мембранных гетеродимеров TLR1/TLR6, TLR2/TLR6 и TLR1/TLR2, однако данное предположение требует проведения дополнительных исследований.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Morton SU, Quiat D, Seidman JG, et al. Genomic frontiers in congenital heart disease. Nat Rev Cardiol. 2022;19(1):26-42. doi:10.1038/s41569-021-00587-4.
2. Wang J, Luo XJ, Xin YF, et al. Novel GATA6 Mutations Associated with Congenital Ventricular Septal Defect or Tetralogy of Fallot. DNA Cell Biol. 2012;31(11):1610-7. doi:10.1089/dna.2012.1814.
3. Li C, Li X, Pang S, et al. Novel and Functional DNA Sequence Variants within the GATA6 Gene Promoter in Ventricular Septal Defects. Int J Mol Sci. 2014;15(7):12677-87. doi:10.3390/ijms150712677.
4. Byrne A, MacDonald J, Buckley S. Reading, language and memory skills: a comparative longitudinal study of children with Down syndrome and their mainstream peers. Br J Educ Psychol. 2002;72(4):513-29. doi:10.1348/00070990260377497.
5. Fahed AC, Gelb BD, Seidman JG, et al. Genetics of congenital heart disease: the glass half empty. Circ Res. 2013;112:707-20. doi:10.1161/CIRCRESAHA.112.300853.
6. Chen L, Guan J, Wei Q, et al. Potential role of "omics" technique in prenatal diagnosis of congenital heart defects. Clin Chim Acta. 2018;482:185-90. doi:10.1016/j.cca.2018.04.011.
7. Шабалдин А.В., Шмулевич С. А., Чистякова Г. Н. и др. Особенности аллогенных взаимодействий в краткосрочной культуре лимфоцитов супругов, имеющих детей с врожденными пороками сердца или ранние репродуктивные потери. Медицинская иммунология. 2019;21(2):279-92. doi:10.15789/1563-0625-2019-2279-292.
8. Zhang J, Yang J, Han D, et al. Dvl3 polymorphism interacts with life events and pro-inflammatory cytokines to influence major depressive disorder susceptibility. Sci Rep. 2018;8(1):14181. doi:10.1038/s41598-018-31530-2.
9. Polonikov A, Kharchenko A, Bykanova M, et al. Polymorphisms of CYP2C8, CYP2C9 and CYP2C19 and risk of coronary heart disease in Russian population. Gene. 2017;627:451-9. doi:10.1016/j.gene.2017.07.004.
10. Пономаренко И. В. Использование метода Multifactor Dimensionality Reduction (MDR) и его модификаций для анализа ген-генных и генно-средовых взаимодействий при генетико-эпидемиологических исследованиях (обзор). Научные результаты биомедицинских исследований. 2019;5(1):4-21. doi:10.18413/2313-8955-2019-5-1-0-1.
11. Gola D, Mahachie John JM, van Steen K, et al. A roadmap to multifactor dimensionality reduction methods. Brief Bioinform. 2015;17(2):293-308. doi:10.1093/bib/bbv038.
12. Chadha S, Behl T, Bungau S, et al. Mechanistic insights into the role of pyroptosis in rheumatoid arthritis. Curr Res Transl Med. 2020;68(4):151-8. doi:10.1016/j.retram.2020.07.003.
13. Zhang S, Gao Y, Huang J. Interleukin-8 Gene -251 A/T (rs4073) Polymorphism and Coronary Artery Disease Risk: A MetaAnalysis. Med Sci Monit. 2019;25:1645-55. doi:10.12659/MSM.913591.
14. Hu D, Wang H, Huang X, et al. Investigation of association between IL-8 serum levels and IL8 polymorphisms in Chinese patients with sepsis. Gene. 2016;594(1):165-70. doi:10.1016/j.gene.2016.09.024.
15. Wang H, Zhou S, Zhang J, et al. Correlations between TLR polymorphisms and inflammatory bowel disease: a meta-analysis of 49 case-control studies. Immunol Res. 2019;67(1):142-50. doi:10.1007/s12026-018-9061-0.
16. Semlali A, Almutairi M, Rouabhia M, et al. Novel sequence variants in the TLR6 gene associated with advanced breast cancer risk in the Saudi Arabian population. PLoS One. 2018;13(11):e0203376. doi:10.1371/journal.pone.0203376.
17. Kutikhin AG, Ponasenko AV, Khutornaya MV, et al. Association of TLR and TREM-1 gene polymorphisms with atherosclerosis severity in a Russian population. Meta Gene. 2016;9:76-89. doi:10.1016/j.mgene.2016.04.001.
18. Amjadi F, Zandieh Z, Mehdizadeh M, et al. The uterine immunological changes may be responsible for repeated implantation failure. J Reproduct Immunol. 2020;138:103080. doi:10.1016/j.jri.2020.103080.
19. Шабалдин А. В., Цепокина А.В., Шмулевич С.А. и др. Генетические предикторы спорадических врожденных пороков сердца у детей. Молекулярная медицина. 2022;(1). doi:10.29296/249994902022-01-09.
20. Ilyas M, Afzal S, Alghamdi S, et al. Synonymous and nonsynonymous polymorphisms in toll-like receptor 2 (TLR2) gene among complicated measles cases at a tertiary care hospital, Peshawar, Pakistan. Saudi Medical J. 2021;42(11):1229-36. doi:10.15537/smj.2021.42.11.20210515.
21. Sharma S, Garg I, Ashraf MZ. TLR signalling and association of TLR polymorphism with cardiovascular diseases. Vasc Pharmacol. 2016;87:30-7. doi:10.1016/j.vph.2016.10.008.
22. Richard K, Piepenbrink KH, Shirey KA, et al. A mouse model of human TLR4 D299G/T399I SNPs reveals mechanisms of altered LPS and pathogen responses. J Exp Med. 2021;218(2):e20200675. doi:10.1084/jem.20200675.
23. Li L, Yu R, Cai T, et al. Effects of immune cells and cytokines on inflammation and immunosuppression in the tumor microenvironment. Int Immunopharmacol. 2020;88:106939. doi:10.1016/j.intimp.2020.106939.
24. Bhatnager R, Jalthuria J, Sehrawat R, et al. Evaluating the association of TNF-α promoter haplotype with its serum levels and the risk of PCOS: A case control study. Cytokine. 2019;114:86-91. doi:10.1016/j.cyto.2018.11.004.
25. Raedler D, Illi S, Pinto LA, et al. IL10 polymorphisms influence neonatal immune responses, atopic dermatitis, and wheeze at age 3 years. J Allergy Clin Immunol. 2013;131(3):789-96. doi:10.1016/j.jaci.2012.08.008.
26. Nakada TA, Takahashi W, Nakada E, et al. Genetic polymorphisms in sepsis and cardiovascular disease: do similar risk genes suggest similar drug targets? Chest. 2019;155(6):1260-71. doi:10.1016/j.chest.2019.01.003.
27. Ponasenko AV, Khutornaya MV, Kutikhin AG, et al. A GenomicsBased Model for Prediction of Severe Bioprosthetic Mitral Valve Calcification. Int J Mol Sci. 2016;17(9):1385. doi:10.3390/ijms17091385.
Об авторах
А. В. ШабалдинРоссия
Шабалдин Андрей Владимирович — доктор медицинских наук, доцент, ведущий научный сотрудник лаборатории пороков сердца
Кемерово
С. А. Шмулевич
Россия
Шмулевич Светлана Александровна — кандидат медицинских наук, старший преподаватель научно-образовательного отдела
Кемерово
А. В. Синицкая
Россия
Синицкая Анна Викторовна — кандидат биологических наук, научный сотрудник лаборатории геномной медицины
Кемерово
Р. Ю. Замараев
Россия
Замараев Роман Юрьевич — кандидат технических наук, старший научный сотрудник
Кемерово
Что известно о предмете исследования?
- В патогенез врожденных пороков сердца (ВПС) вовлечен комплекс экологических, социальных и генетических факторов.
- Период формирования сердечно-сосудистой системы приходится на 3-8 нед. гестации, на протяжении которого идет активное "приживление" эмбриона, регулируемое межклеточными контактами и цитокиновой регуляцией.
Что добавляют результаты исследования?
- Показано, что спорадические ВПС в целом и септальные ВПС (дефект межжелудочкой перегородки/дефект межпредсердной перегородки), в частности, формируются на схожих межгенных ассоциациях.
- Данные об измененном провоспалительном потенциале в группе спорадических септальных ВПС необходимо учитывать в постнатальном периоде при проведении кардиохирургического лечения этих нозологий.
Рецензия
Для цитирования:
Шабалдин А.В., Шмулевич С.А., Синицкая А.В., Замараев Р.Ю. Роль межгенных взаимодействий между генами цитокинов и Toll-подобных рецепторов в этиологии врожденных пороков сердца. Кардиоваскулярная терапия и профилактика. 2023;22(2):3368. https://doi.org/10.15829/1728-8800-2023-3368
For citation:
Shabaldin A.V., Shmulevich S.A., Sinitskaya A.V., Zamaraev R.Yu. Role of intergenic interactions between cytokine and Toll-like receptor genes in the etiology of congenital heart defects. Cardiovascular Therapy and Prevention. 2023;22(2):3368. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3368
JATS XML

























































