Перейти к:
Отрыв хорд митрального клапана на фоне воспалительного поражения сердца, ассоциированного с инфекцией SARS-CoV-2. Серия клинических случаев
https://doi.org/10.15829/1728-8800-2023-3405
Аннотация
В постоянно меняющемся потоке информации о пандемии новой коронавирусной инфекции 2019г (COVID-19 — COrona VIrus Disease 2019) мы приводим описание серии случаев отрыва хорд митрального клапана (ОХМК) у некоморбидных мужчин среднего возраста, произошедших в течение от 3 до 5 нед. после заражения вирусом SARS- CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2). На фоне значительных успехов в профилактике острой ревматической лихорадки, лечении бактериального эндокардита и острого коронарного синдрома "острая митральная недостаточность" стала относительно редким диагнозом. В период пандемии наметился всплеск встречаемости спонтанного ОХМК, и накапливаются новые данные о проблеме, вероятно, обусловленные кардиотропностью нового коронавируса. Представленные наблюдения объединены тем, что симптомы инфекции были легкими, в последующем прослеживались признаки вероятного эндомиокардита, нераспознанные вовремя, а острая недостаточность митрального клапана развилась на фоне физической провокации (нагрузки и кашель). У двух пациентов ранее был диагностирован пролапс митрального клапана (миксоматозная дегенерация и синдром дисплазии соединительной ткани). Два пациента были успешно прооперированы в различных клиниках. Описанные истории болезни подчеркивают, что последствия персистенции воспаления могут быть тяжелее первичного вирусного повреждения, что обуславливает важность всестороннего обследования и долговременного наблюдения. На сегодняшний день в дифференциальный диагноз пациентов с внезапно развившейся одышкой и болью в груди, ассоциированными с инфекционным процессом, следует включать ОХМК.
Для цитирования:
Сукмарова З.Н., Мацкевич Л.А., Овчинников Ю.В., Голощапов О.И., Лила А.М. Отрыв хорд митрального клапана на фоне воспалительного поражения сердца, ассоциированного с инфекцией SARS-CoV-2. Серия клинических случаев. Кардиоваскулярная терапия и профилактика. 2023;22(2):3405. https://doi.org/10.15829/1728-8800-2023-3405
For citation:
Sukmarova Z.N., Matskevich L.A., Ovchinnikov Yu.V., Goloshchapov O.I., Lila A.M. Mitral valve chordal rupture against the background of cardiac SARS-CoV-2 infection. Cases series. Cardiovascular Therapy and Prevention. 2023;22(2):3405. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3405
Введение
К настоящему моменту превалирует субклиническое течение заболевания новой коронавирусной инфекции COVID-19 (COronaVIrus Disease 2019). В связи с этим снизилась бдительность относительно режимных мероприятий и профилактики осложнений. Отрыв хорд митрального клапана (ОХМК), который принято считать осложнением бактериального эндокардита и острой ревматической лихорадки, стал все чаще встречаться у пациентов, перенесших коронавирус острого респираторного синдрома SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2), особенно у мужчин среднего возраста на фоне физических нагрузок [1]. Несмотря на очевидную связь с перенесенной инфекцией, стандартное ведение пациентов с ОХМК в период пандемии практически не претерпело изменений. Целью представления клинических случаев является привлечение внимания к вероятности эндокардита и миокардита, спровоцированного кардиотропным вирусом, как причины ОХМК у пациентов с COVID-19, и рекомендации активного выявления воспаления сердца при терапии пациентов с сердечно-сосудистыми симптомами после перенесенной инфекции.
Клинические случаи
Во всех случаях от пациентов или их законных представителей получено письменное добровольное информированное согласие на публикацию описания клинического случая.
Информация о пациенте 1
Пациент М 60 лет поступил в отделение неотложной кардиологии 17.02.2022г с впервые возникшей болью в области сердца, продолжающейся в течение недели после перенесенной респираторной вирусной инфекции. Предшествующих сердечно-сосудистых заболеваний, патологической наследственности у него не было.
Результаты физикального осмотра
При осмотре респираторные симптомы отсутствовали, экспресс-тест на SARS-CоV-2, анализ крови на кардиоспецифические ферменты показали отрицательный результат.
Диагностическая оценка
Отмечалось повышение скорости оседания эритроцитов (СОЭ) до 26 мм/ч, относительные лимфопения (16%) и нейтрофилия (75%), характерные для вирусной инфекции, и субфебрилитет 37,1° С. По данным трансторакальной эхокардиографии (ЭхоКГ) клапаны и размеры сердца изменены не были, фракция выброса (ФВ) левого желудочка (ЛЖ) 68%, зарегистрирована начальная гипертрофия межжелудочковой перегородки, признаки незначительной экссудации в полость перикарда. По данным электрокардиографии (ЭКГ) на фоне синусовой тахикардии в динамике фиксировалось появление неспецифических нарушений реполяризации.
Клинический диагноз
Подозрение на острый коронарный синдром.
Медицинские вмешательства
Проведена экстренная коронарография, гемодинамически значимых стенозов не выявлено, пациент был выписан.
Динамика и исходы
Преходящий дискомфорт за грудиной сохранялся в течение последующего месяца. 18.03.2022г на фоне физической работы произошел спонтанный отрыв хорд задней створки митрального клапана (МК) (рисунок 1) с развитием недостаточности 3 ст. и отека легких. В срочном порядке проведена аннулопластика МК синтетической полоской, краевая шовная пластика створок МК по Alrieri. Признаков миксоматозной дегенерации и вегетаций во время операции не выявлено. Операция и восстановительный период прошли без осложнений. Тесты, взятые при поступлении, подтвердили персистенцию вируса SARS-CоV-2 и высокий титр иммуноглобулинов М. На контрольной рентгенографии признаков поражения легких не выявлено, сатурация в динамике оставалась в пределах нормальных значений. По данным ЭхоКГ, локальная и глобальная сократимость миокарда, размеры камер сердца сохранялись нормальными, ФВ ЛЖ 60%, отмечалась гиперэхогенность перикарда. При холтеровском мониторировании ЭКГ (ХМЭКГ) зарегистрировано учащение среднесуточной частоты сердечных сокращений до 85 уд./мин, эпизоды удлинения QT-интервала до 485 мс. Пациент выписан 26.03.2022г и наблюдается по настоящее время без осложнений.

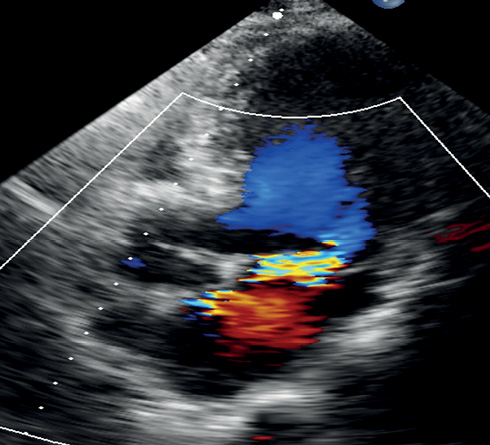
Рис. 1 ЭхоКГ пациента М. Модифицированная апикальная 5-камерная позиция.
Примечание: признаки отека межжелудочковой перегородки: утолщение, локальная гиперэхогенность. А) Пролабирование задней створки МК в полость предсердия. Б) Режим цветового допплеровского картирования. Эксцентричный поток регургитации 3 ст. (эффективная площадь отверстия регургитации 34 мм², объем регургитации 45 мл/удар, TVI митральная/TVI аортальная =1,3).
Информация о пациенте 2
Пациент Л 48 лет 15.04.2022г обратился к кардиологу с одышкой малых напряжений, покашливанием. Ранее был зарегистрирован минимальный пролапс передней створки МК без признаков другой патологии клапанно-хордального аппарата, с формированием недостаточности 0-1 ст., что не мешало службе в армии. Около 5 лет назад отметил некоторое снижение переносимости нагрузок, был диагностирован отрыв 1 хорды передней створки МК (рисунок 2 А). По ЭхоКГ на тот момент, по-прежнему, описывалась регургитация 1 ст. без расширения камер сердца (конечно-диастолический размер ЛЖ (КДР ЛЖ) 43 мм, объем левого предсердия (ОЛП) 36 мл) и признаков развития кальцинозно-дегенеративного порока. В январе 2022г перенес COVID-19, сопровождавшийся сильным кашлем, поражения паренхимы легких по данным компьютерной томографии не выявлено. Субфебрилитет регистрировался ~3 нед., интенсивный приступообразный кашель ~6 нед. В течение 4 дней перед поступлением в стационар пациент отметил резкое нарастание одышки, дискомфорта в груди и появление отеков ног.

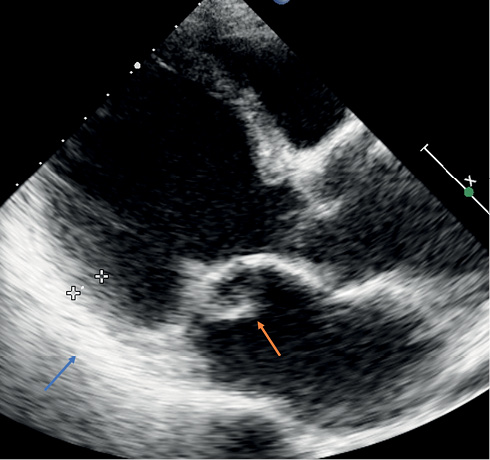
Рис. 2 ЭхоКГ пациента Л.
Примечание: А) Исследование 2017 г: апикальная 4-камерная позиция. "Болтающаяся" хорда передней митральной створки (стрелка) с формированием начального пролапса клапана. Б) 2022г: после отрыва еще нескольких хорд, клапан, потеряв фиксацию, пролабирует в полость левого предсердия (красная стрелка). Признаки воспаления (гиперэхогенность, утолщение) перикарда (синяя стрелка). Цветное изображение доступно в электронной версии журнала.
Результаты физикального осмотра
При обследовании в клинике одышка покоя, пастозность голеней до средней трети, частота сердечных сокращений 102 уд./мин, артериальное давление 96/55 мм рт.ст., грубый систоликум по левому краю грудины.
Диагностическая оценка
Тропонин Т без патологии, повышение концентрации N-концевого фрагмента промозгового натрийуретического пептида (NT-proBNP) до 237 пг/мл, уровень С-реактивного белка (СРБ) 10 мг/л. ЭКГ: синусовый ритм, распространенные изменения реполяризации, единичные левожелудочковые экстрасистолы. При ЭхоКГ выявлен отрыв хорд передней створки МК (рисунок 2 Б), пролабирование утолщенной створки в полость левого предсердия (ЛП), недостаточность клапана 3 ст., расширение полостей сердца: КДР ЛЖ 56 мм, ОЛП 66 мл, гипокинез средних сегментов межжелудочковой перегородки, ФВ ЛЖ 55%, признаки воспаления перикарда (отек, экссудация), левосторонний малый гидроторакс.
Клинический диагноз
Заподозрено механическое осложнение ишемической болезни сердца, явившееся причиной обострения сердечной недостаточности.
Медицинские вмешательства
Коронароангиография признаков сосудистого атеросклероза не выявила. Пациент экстренно подготовлен на операцию. После неудачных попыток реконструкции, связанной, со слов хирургов, со свойствами ткани эндокарда, была проведена операция протезирования МК биосинтетическим протезом, клипирование ушка ЛП.
Динамика и исходы
Периоперационный период проходил без осложнений. Пациент был выписан 02.05.2022г в удовлетворительном состоянии.
Информация о пациенте 3
У пациента К 52 лет в феврале 2019г во время медосмотра впервые был диагностирован пролапс передней створки МК, признаки его фиброзного уплотнения с регургитацией до 2 ст. Учитывая нормальные размеры камер (КДР ЛЖ 46 мм, конечно-систолический размер (КСР) ЛЖ 35 мм, ОЛП 31 мл) и сократимости миокарда (ФВ ЛЖ 62%), отсутствие клиники недостаточности кровообращения, была принята наблюдательная тактика. 04.2019г пациент перенес кишечную форму COVID-19, было зарегистрировано повышение СОЭ до 19 мм/ч, лечился симптоматически в амбулаторных условиях. В августе 2019г обратился к кардиологу с жалобами на одышку умеренных напряжений. По ЭКГ, ХМЭКГ патологии выявлено не было, ЭхоКГ демонстрировала относительное расширение левых камер сердца (КДР ЛЖ 51 мм, КСР ЛЖ 39 мм, ОЛП 36 мл), развитие начальной легочной гипертензии (расчетное систолическое давление в легочной артерии 45 мм рт.ст.), утолщение передней створки МК до 3 мм с недостаточностью 2 ст. На фоне консервативной терапии сердечной недостаточности состояние улучшилось, клинических признаков застоя по малому и большому кругу кровообращения не было, в течение последующих 21 мес. чувствовал себя хорошо, переносимость нагрузок оставалась удовлетворительной, к врачам не обращался. Был вакцинирован Спутник-Лайт 10.2021г, прививку перенес хорошо. В мае 2022г заболел COVID-19 с гипертермией до 40° С, развитием дыхательной недостаточности III ст., поражением 60% правого, 40% левого легкого. По компьютерной томографии также был диагностирован малый двусторонний гидроторакс и внутригрудная лимфаденопатия, исключена тромбоэмболия легочной артерии. Пациент в течение 3 нед. проходил лечение в инфекционном отделении, инвазивная искусственная вентиляция легких не потребовалась, однако беспокоил изнурительный кашель. В анализах крови максимальный лейкоцитоз 16×109/л, повышение СОЭ — 83 мм/ч, уровня СРБ — 168 мг/л, аспартатаминотрансферазы — 188 ед./л, фибриногена — 7,5 г/л, D-димера — 1,23 мкг/мл. Также во время госпитализации перенес пароксизм фибрилляции предсердий, купированный однократной инфузией амиодарона. На каждом этапе обсуждался вопрос о направлении на кардиохирургию и откладывался в связи с тяжестью состояния и высоким операционным риском. В домашних условиях ощущение нехватки воздуха и кашель сохранялись. На 3 сут. с внезапным усилением одышки, слабости, пациент повторно госпитализирован в ковидный стационар, т.к. мазок из зева был положительным на SARS-CоV-2. Выставлен диагноз "вирусно-бактериальная пневмония в стадии разрешения", стационарное лечение продолжалось в течение 2 нед. до стабилизации состояния, включая антибиотики, диуретики, бронхолитики. Через нед. после выписки пациент обратился к кардиологу.
Результаты физикального осмотра
При осмотре обращали на себя внимание одышка покоя, акроцианоз, отеки голеней до колена. Аускультативно над областью сердца выслушивался систолодиастолический шум с максимумом на верхушке, а также крепитации в нижних отделах легких билатерально на фоне ослабленного дыхания.
Диагностическая оценка
Были выявлены рентген-признаки интерстициального отека легких, выпот в плевральные полости в области синусов. По данным ЭхоКГ регистрировалась кардиомегалия: КДР ЛЖ 60 мм, КСР ЛЖ 43 мм, ОЛП 46 мл/м2, площадь правого предсердия 29 мм2, базальный размер правого желудочка 41 мм, молотящая передняя митральная створка, неравномерные фиброзные уплотнения утолщенных хорд, тотальная митральная регургитация (рисунок 3), присоединение умеренной аортальной недостаточности, трикуспидальной недостаточности 2 ст. и повышение систолического давления в легочной артерии до 100 мм рт.ст. при ФВ ЛЖ 60%, незначительный гидроперикард, а также признаки "застойной" печени и почки по результатам биохимического анализа крови. Во время обследования по данным ЭКГ впервые зафиксировано удлинение интервала QT до 502 мс, умеренные изменения миокарда переднее-перегородочной области, менее выраженные — в нижних и высоко — в боковых отделах ЛЖ, предсердная экстрасистолия.

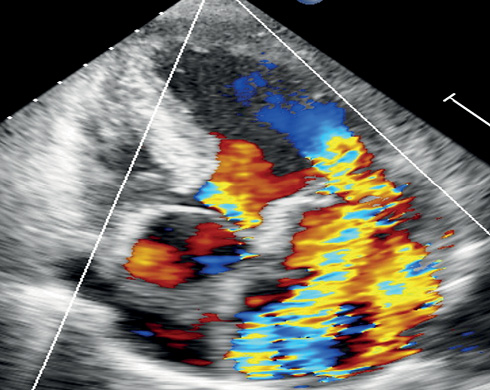
Рис. 3 ЭхоКГ пациента К. Апикальная 5-камерная позиция.
Примечание: А) Молотящая передняя створка МК (красная стрелка). Визуализируются натянутые хорды от заднелатеральной сосочковой мышцы к передней и задней створкам с признаками хронической травматизации (гиперэхогенность, узелковые утолщения) по ходу и в месте прикрепления (синие стрелки). Б) Режим цветового допплеровского картирования. Тяжелая митральная регургитация: ширина струи регургитации (Vena contracta) 9 мм, радиус площади проксимальной изоскоростной поверхности (proximal isovelocity surface area, PISA) 11 мм. Цветное изображение доступно в электронной версии журнала.
Клинический диагноз
Диагноз при поступлении: ишемическая болезнь сердца: стенокардия III функционального класса. ОХМК, митральная регургитация 4 ст. Хроническая сердечная недостаточность 2Б, функциональный класс IV. Легочная гипертензия 2 типа.
Медицинские вмешательства
Коронарография наличия значимых стенозов не подтвердила. Терапия сердечной недостаточности была усилена, начата подготовка к кардиохирургии.
Динамика и исходы
К сожалению, пациент отказался от операции и в течение недели умер от остановки сердечной деятельности. По данным секционного исследования выявлена лимфоцитарная инфильтрация миокарда, миксоматозная дегенерация МК, отрыв хорд, разрыв передней створки МК, двустворчатый аортальный клапан, в связи с чем диагностирован синдром соединительно-тканной дисплазии.
Обсуждение
Отрыв сухожильных хорд МК является причиной 6,6-8,1% всех операций на клапанах сердца, 9,3-20% всех операций на МК и до 26% экстренных операций по поводу митральной недостаточности [2]. Первые статьи о проблеме появились ~200 лет назад, в 1980-90гг наблюдался всплеск, связанный с развитием диагностики и кардиохирургии, а в 2000гг количество публикаций сократилось, вероятно, благодаря успешной профилактике острой ревматической лихорадки, эндокардита и реперфузионным методам [2]. В последние годы отмечено некоторое учащение встречаемости спонтанного разрыва сухожильных хорд, что, на наш взгляд, связано с относительно высокой распространенностью вовлечения структур сердца в воспаление, ассоциированное с SARS-CоV-2 [1]. Типичным сценарием острого отрыва хорд, описанным в настоящей публикации, является субклиническое течение COVID-19 у мужчин среднего возраста, недооценка кардиологических симптомов, а также связь с ранним возобновлением физических нагрузок или сильным кашлем.
Физическое напряжение среди причин острого отрыва хорд в литературе описывается относительно редко, в основном, у профессиональных атлетов, людей, труд которых связан с натуживанием, а также беременных [1-5]. По данным метаанализа, повреждения интактных ранее клапанов составляет 13,5% случаев ОХМК, ОХМК при предшествующем наличии пролапса МК — 44,5%, в т.ч. вследствие миксоматозной дегенерации (11,7%) или дисплазии соединительной ткани [2][6]. К наиболее распространенным заболеваниям, предрасполагающим к вторичному разрыву хорд, относятся подострый эндокардит (37,4%) и хроническая ревматическая болезнь сердца (24,8%) [2][6]. Более редкими факторами риска разрыва являются системная или генерализованная аномалия соединительной ткани (например, при синдроме Марфана, несовершенном остеогенезе и синдроме Элерса-Данлоса), гипертрофическая кардиомиопатия, гипертоническая болезнь, другие (не митральные) пороки сердца и клапанов, тупая травма грудной клетки (0,2%), талассемия, ишемическая болезнь сердца (1,4%) [2][6][7]. Изменение ткани миокарда и эндокарда вследствие описанной патологии приводит к снижению растяжимости хорд и во время приложения деформирующей силы (чаще это нагрузки с натуживанием) порог прочности может превышаться. Сочетание имеющихся исходно дегенерации и воспаления и/или гемодинамического стресса потенцирует нарушение несущей способности МК [4][6][7], но ОХМК может возникать и у практически здоровых людей [1][2][7]. Если суммировать группы инфекционного эндокардита и ревматических болезней сердца, более половины причин ОХМК имеют воспалительный характер, что отражено в клинических и секционных исследованиях отчетами о сочетании эндокардита и миокардита, миокардита папиллярных мышц и вальвулита [6][8].
Как известно, среди идентифицируемых причин воспалительных заболеваний сердца лидирует вирусная инфекция1. Патофизиология кардиального повреждения, ассоциированного с SARS-CoV-2, представляет собой несколько параллельно или последовательно происходящих процессов:
- прямое повреждение клеток циркулирующим вирусом посредством связывания с рецепторами ангиотензинпревращающего фермента,
- цитокиновый шторм из-за нерегулируемого ответа Т-хелперов, что приводит к длительной системной гипервоспалительной реакции, гипоксии и апоптозу кардиомиоцитов,
- гиперактивация аутоиммунной системы с возможной активацией врожденной и адаптивной иммунной систем, опосредованной интерфероном [9].
Доказано, что уровень интерлейкина-6 и фактора некроза опухоли-α у пациентов с ОХМК значительно выше, чем у пациентов с митральной недостаточностью без ОХМК, и соответствует уровню данных воспалительных маркеров у пациентов с ревматическим пороком сердца [10]. Авторы в 2014г продемонстрировали прямую положительную связь между общей окислительной активностью и ОХМК, дополнив знания о том, что высокий окислительный стресс является фактором риска прогрессирования как ревматических, так и дегенеративных заболеваний клапанов [10]. Можно предположить, что механизмы острого цитокинового повреждения и длительно сохраняющегося окислительного стресса при COVID-19 обуславливают хрупкость структур сердца, способствуют прогрессированию имеющихся аномалий клапанов, что подчеркивает схожесть процессов воспаления с системными заболеваниями соединительной ткани. Показано, что инфекция SARS-CoV-2 потенциально способна индуцировать как обострение иммуновоспалительного процесса, так и развитие "новой" аутоиммунной патологии [9]. Биологической моделью изучения образования антикардиальных антител служат исследования Malkiel S (1996г) на мышах, показавшие высвобождение аутоантигенов в результате вирусного воспаления и некроза кардиомиоцитов, которые до болезни были скрыты от иммунной системы клеточной оболочкой. Это может объяснять персистенцию кардиального воспаления в течение нескольких месяцев после выздоровления от COVID-19, о чем свидетельствуют исследования последних лет [11]. Вирусный или аутоиммунный эндокардит без значительного нарушения функции клапана неинвазивными методами определить маловероятно, поэтому в кардиохирургической практике доля "идиопатических" ОХМК может достигать 71%, как, например, в ретроспективном анализе 497 случаев [7]. Однако при использовании возможностей современной диагностики выявляемая относительно высокая встречаемость миокардита и перикардита, ассоциированных с SARS-CоV-2, позволяют предположить недооценку распространенности поражения эндокарда при COVID-19. У описанных пациентов были признаки вовлечения в воспалительный процесс всех структур сердца: увеличение толщины миокарда в отсутствие причин для гипертрофии, выпот в перикард (пациенты М, Л, К), расширение QT (пациенты М и К), нарушение сократимости миокарда с повышением уровня NT-proBNP и развитие сердечной недостаточности на фоне инфекции, повышение уровня СРБ, новые изменения ЭКГ (пациенты Л, К), сопровождающиеся прекардиальной болью при отсутствии ангиографически выявляемой ишемической болезни сердца и ранее известных сердечно-сосудистых заболеваний, которые могут объяснить симптомы. Однако в диагнозе воспалительные заболевания не были отражены из-за принятых рекомендаций опираться на данные биопсии1. Хотелось бы отметить и другие, заслуживающие внимания, диагностические дилеммы. Так, отек легких вследствие митральной недостаточности рентгенологически напоминал острый респираторный дистресс-синдром у пациента К, однако отмечалось нетипично пóзднее относительно заражения SARS-CоV-2 развитие дыхательной недостаточности. В противоположность этому отек легких у пациента Г, вероятно, маскировал начинающуюся пневмонию COVID-19. Случаи пациентов Л и К подтверждают, что отрыв одной хорды обычно не приводит к значительному гемодинамическому эффекту и имеет риск не быть диагностированным [2][12]. По данным литературы, ОХМК является частичным в 91% случаев [13]. При вовлечении нескольких хорд формируется тяжелая митральная регургитация с развитием недостаточности кровообращения по малому кругу, которая требует хирургического вмешательства. У таких пациентов декомпенсация обычно протекает остро, однако описаны случаи постепенно прогрессирующего процесса, при котором минимальный разрыв предшествует более обширному или даже полному отрыву, как произошло у пациентов Л и К. При хроническом прогрессировании показаниями для более раннего вмешательства, независимо от симптомности, служат такие факторы как наличие ФВ ЛЖ ≤60%, КСР ЛЖ ≥40 мм, ОЛП ≥60 мл или диаметр ЛП ≥55 мм, систолическое давление в легочной артерии >50 мм рт.ст. и фибрилляция предсердий, т.к. продемонстрирована их связь с плохим прогнозом [13], что подтвердилось в нашей группе. При хроническом развитии ОХМК может длительное время не предполагаться как причина митральной недостаточности. ЭхоКГ нераспознанный ОХМК обнаруживается у 41% пациентов, перенесших операцию на МК по поводу митральной регургитации [12].
В отличие от относительно благоприятных сценариев историй болезни, когда до ОХМК клапаны были интактны [1], в настоящую серию включены случаи пациентов, у которых отрыву хорд предшествовала миксоматозная дегенерация с пролапсом МК, что, безусловно, повлияло на тяжесть повреждения. Вероятно, системное воспаление и кардиотропность вируса послужили триггером прогрессирования дегенерации клапана, поэтому ОХМК был более массивным, что потребовало кардиохирургии. Исходная "рыхлость" ткани клапана и хордального аппарата из-за дисбаланса между синтезом и деградацией внеклеточного матрикса приводит к тому, что ОХМК, наряду с инфекционным эндокардитом являются главными угрожающими осложнениями при миксоматозной дегенерации МК [14]. Распространенность пролапса МК в популяции составляет около 1,2%; по данным метаанализа отмечена ассоциация пролапса МК с внезапной сердечной смертью неясной этиологии [14]. В доступной литературе описан один случай ОХМК у пациента с SARS-CoV-2, приведший к тяжелой регургитации и потребовавший экстренной хирургической замены клапана [15]. Как и в случаях Л и К, пациент также был мужчиной средних лет, ранее имевшим митральную недостаточность 1 ст., не влияющую на переносимость нагрузок. Отек легких развился через месяц лечения по поводу острого респираторного дистресс-синдрома, уже после купирования пневмонита. Из диагностических находок обращало на себя внимание вовлечение перикарда, признаки миксоматозной дегенерации иссеченного клапана с воспалительной инфильтрацией CD4-лимфоцитами и гистиоцитами, а также отложение гемосидерина в многочисленных макрофагах, что свидетельствовало о подостром или хроническом характере воспалительного процесса. Авторы сделали вывод о прямом поражении клапанного аппарата вирусом SARS-CoV-2. Еще один случай описывает ОХМК у пациента с COVID-19 и острым коронарным синдромом, произошедший на следующие сутки после успешной реваскуляризации и стабилизации состояния, что привело авторов к мысли о воспалительном характере повреждения миокарда (инфаркт миокарда 2 типа) [16]. Кроме того, опубликовано несколько работ о дисфункции протезированного МК при COVID-19 как на фоне инфекционного эндокардита (стафилокковой природы) [17], так и вследствие тромбоза [18][19]. Общим с предыдущими случаями в них является то, что осложнения развивались через 3-5 нед. после диагностики COVID-19 [16][18].
В наших случаях хотелось бы отметить клинические признаки длительной персистенции вируса или повторного заражения пациентов через короткое время, что невозможно дифференцировать из-за несовершенства тест-систем. Оба варианта должны приниматься во внимание при наблюдении затяжных, осложненных случаев с волнообразным ухудшением, а также при формировании индивидуальных рекомендаций по реабилитации и возвращению пациентов к нагрузкам [20].
Заключение
Во время пандемии COVID-19, когда любая одышка связывается с острым дыхательным дистресс-синдромом, важно не задерживать диагностику сердечно-сосудистых осложнений для оказания пациентам необходимой помощи, включая своевременное проведение ЭхоКГ, несмотря на трудности, связанные с контагиозностью заболевания. В дифференциальный диагноз пациентов с внезапно развившейся одышкой и болью в области сердца после недавно перенесенной инфекции SARS-CоV-2, следует включать ОХМК, особенно у лиц с ранее диагностированным пролапсом МК. В качестве профилактики данного осложнения у пациентов с COVID-19 и реконвалесцентов можно рекомендовать соблюдение щадящего режима физической активности и контроль кашля.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Caforio AL, Pankuweit S, Arbustini E, et al.; European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. https://www.escardio.org/Working-groups/Working-Group-on-Myocardial-and-Pericardial-Diseases/Publications/Paper-of-the-Month/Current-state-of-knowledge-on-aetiology-diagnosis-management-and-therapy-of-m. (30 Sep 2013).
Список литературы
1. Сукмарова З. Н., Овчинников Ю.В., Ларина О.М. и др. Отрыв хорд митрального клапана у высокотренированных мужчин в ранние сроки после COVID-19. Серия клинических случаев. Спортивная медицина: наука и практика. 2022;12(1):77-85. doi:10.47529/22232524.2022.1.2.
2. Gabbay U, Yosefy C. The underlying causes of chordae tendinae rupture: a systematic review. Int J Cardiol. 2010;143(2):113-8. doi:10.1016/j.ijcard.2010.02.011.
3. Elbadawi A, Elgendy IY, Mahmoud K. Temporal trends and outcomes of mechanical complications in patients with acute myocardial infarction. J Am Coll Cardiol Intv. 2019;12:1825-36. doi:10.1016/j.jcin.2019.04.039.
4. Fox T, Akhtar H, Blocher N, et al. Mitral valve chord rupture in a pregnant patient with uncontrolled hyperthyroidism. Endocrinology Diabetes and Metabolism Case Reports 2022;1:22-0298. doi:10.1530/EDM-22-0298.
5. Chiu FH, Yang CJ, Huang CK, et al. Spontaneous chordae tendineae rupture during peripartum. Am J Emerg Med. 2018;36(6):1127.e1-1127.e3. doi:10.1016/j.ajem.2018.03.038.
6. Zwane NL, Ponnusamy S, Naidoo DP. The spectrum of rheumatic mitral valve regurgitation presenting to Inkosi Albert Luthuli Central Hospital, KwaZulu-Natal, over a 10-year period. Cardiovasc J Afr. 2021;230;32(2):62-9. doi:10.5830/CVJA2020-029.
7. Juang JJ, Ke SR, Lin JL, et al. Rupture of mitral chordae tendineae: adding to the list of hypertension complications. Heart. 2009;95(12):976-9. doi:10.1136/hrt.2008.159848.
8. Luo XL, Qiao SB, Yuan JS, et al. Clinical and echocardiographic characteristics of mitral chordal rupture from 292 hospitalized patients. Zhonghua Xin Xue Guan Bing Za Zhi. 2009;37(3):253-6.
9. Насонов Е. Л., Лила А. М., Мазуров В. И. и др. Коронавирусная болезнь 2019 (COVID-19) и иммуновоспалительные ревматические заболевания. Рекомендации Общероссийской общественной организации "Ассоциация ревматологов России". Научно-практическая ревматология. 2021;59(3):239-54. doi:10.47360/1995-4484-2021-239-254.
10. Kaplan M, Yavuz F, Davutoğlu V, et al. The Relationship between Mitral Chordae Rupture and Inflammation Level and Oxidative Stress. Eur J Ther. 2020;26:117-21. doi:10.5152/EurJTher.2019.19063.
11. Puntmann VO, Martin, S, Shchendrygina A, et al. Long-term cardiac pathology in individuals with mild initial COVID-19 illness. Nat Med. 2022;28(10):2117-23. doi:10.1038/s41591-02202000-0.
12. Yu HT, Moon J, Yang WI, et al. High prevalence of unrecognized chordae tendineae rupture in mitral valve prolapse patients undergoing valve replacement surgery. Can J Cardiol. 2013;29(12):1643-8. doi:10.1016/j.cjca.2013.09.002.
13. Vahanian A, Beyersdorf F, Praz F, et al; ESC/EACTS Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022; 43(7):561-632. doi:10.1093/eurheartj/ehab395.
14. Nalliah CJ, Mahajan R, Elliott AD, et al. Mitral valve prolapse and sudden cardiac death: a systematic review and meta-analysis. Heart. 2019;105(2):144-51. doi:10.1136/heartjnl-2017-312932.
15. Khanduri A, Anand U, Doss M, et al. Severe acute mitral valve regurgitation in a COVID-19-infected patient. BMJ Case Rep. 2021;14(1):e239782. doi:10.1136/bcr-2020-239782.
16. Alizadehasl A, Salehi P, Roudbari S, et al. Complicated AMI in a COVID-19 Patient; Chordal Rupture and Flail of Mitral Valve. Multidiscip Cardio Annal. 2020;11(2):e106953. doi:10.5812/mca.106953.
17. Alizadehasl A, Salehi P, Roudbari S, et al. Infectious endocarditis of the prosthetic mitral valve after COVID-19 infection. Eur Heart J. 2020;41(48):4604. doi:10.1093/eurheartj/ehaa852.
18. Llopis Gisbert G, Vidal Urrutia V, Moruno Benita MA, et al. Bioprosthetic Valve Thrombosis and Obstruction Secondary to COVID-19. Can J Cardiol. 2021;37(6):938.e3-938.e6. doi:10.1016/j.cjca.2020.10.008.
19. Jeckelmann C, Djokic B, Duchatelle V, Girod G. Case report: Mechanical mitral prosthetic valve thrombosis in the context of COVID-19 despite effective anticoagulation. Eur Heart J Case Rep. 2022;6(2):ytac006. doi:10.1093/ehjcr/ytac006.
20. Бубнова М. Г., Шляхто Е. В., Аронов Д. М. и др. Новая коронавирусная инфекционная болезнь COVID-19: особенности комплексной кардиологической и респираторной реабилитации. Российский кардиологический журнал. 2021;26(5):4487. doi:10.15829/1560-4071-2021-4487.
Об авторах
З. Н. СукмароваРоссия
Сукмарова Зульфия Наилевна — кандидат медицинских наук, научный сотрудник лаборатории системной красной волчанки
Москва
Л. А. Мацкевич
Россия
Мацкевич Людмила Алексеевна — заведующая отделением функциональной диагностики
Москва
Ю. В. Овчинников
Россия
Овчинников Юрий Викторович — доктор медицинских наук, профессор кафедры терапии неотложных состояний
Москва
О. И. Голощапов
Россия
Голощапов Олег Игоревич — врач-кардиолог, анестезиолог-реаниматолог отделения неотложной кардиологии
Гатчина, Ленинградская область
А. М. Лила
Россия
Лила Александр Михайлович — доктор медицинских наук, профессор, член-корреспондент РАН, директор, заведующий кафедрой ревматологии, Главный внештатный специалист-ревматолог МЗ РФ, заслуженный врач России
Москва
- Описана серия случаев отрыва хорд митрального клапана на фоне недиагностированного воспаления сердца, ассоциированного с SARS-CoV-2.
- Случаи иллюстрируют общие черты течения вероятного эндомиокардита и отрыва хорд митрального клапана у пациентов, перенесших COVID-19, а также различия, связанные с исходным состоянием клапанов и принятой тактикой.
Рецензия
Для цитирования:
Сукмарова З.Н., Мацкевич Л.А., Овчинников Ю.В., Голощапов О.И., Лила А.М. Отрыв хорд митрального клапана на фоне воспалительного поражения сердца, ассоциированного с инфекцией SARS-CoV-2. Серия клинических случаев. Кардиоваскулярная терапия и профилактика. 2023;22(2):3405. https://doi.org/10.15829/1728-8800-2023-3405
For citation:
Sukmarova Z.N., Matskevich L.A., Ovchinnikov Yu.V., Goloshchapov O.I., Lila A.M. Mitral valve chordal rupture against the background of cardiac SARS-CoV-2 infection. Cases series. Cardiovascular Therapy and Prevention. 2023;22(2):3405. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3405
JATS XML

























































