Перейти к:
Структурно-функциональные свойства артерий у лиц, перенесших новую коронавирусную инфекцию
https://doi.org/10.15829/1728-8800-2023-3541
Аннотация
Цель. Изучение структурно-функциональных свойств артерий различного калибра у пациентов после перенесенной новой коронавирусной инфекции COVID-19 (COronaVIrus Disease-2019).
Материал и методы. Включено 113 человек: 45 человек, которые обследованы до начала пандемии COVID-19, здоровые лица, перенесшие COVID-19 (n=44), 24 больных артериальной гипертензией (АГ) в сочетании с COVID-19 в анамнезе. У включенных в исследование лиц определяли параметры биохимического анализа крови, оценивали артерии каротидного бассейна с применением технологии высокочастотного сигнала RF, проводили аппланационную тонометрию, объемную сфигмографию, пробу с постокклюзионной реактивной гиперемией.
Результаты. По результатам исследования артерий каротидного бассейна технологией высокочастотного сигнала RF зарегистрированы достоверные различия между группами здоровых лиц (с анамнезом COVID-19 и без такового) и больных АГ, перенесших COVID-19. Согласно данным аппланационной тонометрии у пациентов с АГ и COVID-19 в анамнезе давление в аорте и каротидно-феморальная скорость распространения пульсовой волны существенно превышали аналогичные показатели в когортах лиц без анамнеза сердечно-сосудистых заболеваний. По результатам объемной сфигмографии в группе пациентов после перенесенной COVID-19 выявлены признаки раннего сосудистого старения, причем максимальные значения этих показателей зарегистрированы в группе пациентов с АГ.
Заключение. Полученные в ходе настоящего исследования результаты позволяют констатировать у лиц, перенесших COVID-19, увеличение жесткости артериальной стенки, что можно расценивать как признак раннего сосудистого старения.
Ключевые слова
Для цитирования:
Олейников В.Э., Авдеева И.В., Полежаева К.Н., Павленко К.И., Борисова Н.А., Хромова А.А., Кулюцин А.В. Структурно-функциональные свойства артерий у лиц, перенесших новую коронавирусную инфекцию. Кардиоваскулярная терапия и профилактика. 2023;22(5):3541. https://doi.org/10.15829/1728-8800-2023-3541
For citation:
Oleinikov V.E., Avdeeva I.V., Polezhaeva K.N., Pavlenko K.I., Borisova N.A., Khromova A.A., Kulyutsin A.V. Structural and functional properties of arteries in COVID-19 survivors. Cardiovascular Therapy and Prevention. 2023;22(5):3541. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3541
Введение
Для определения изменений сосудистой стенки, отражающих несоответствие показателей для человека данного возраста и пола, еще в начале XXI века Nilsson PM (2008) обозначил проблему раннего сосудистого старения (РСС) (Early vascular aging), при котором происходят структурно-функциональные изменения стенки сосудов, что проявляется повышением жесткости артерий [1][2]. Новым аспектом изучения РСС является поиск причин, которые способны ускорять развитие данного состояния. Предполагается, что одним из таких факторов может служить влияние новой коронавирусной инфекции (COVID-19, COronaVIrus Disease-2019) на сосудистую стенку.
Объявленная в марте 2020г пандемия COVID-19 серьезно вмешалась в функционирование системы здравоохранения всего мира. Сегодня хорошо известно, что COVID-19 является мультисистемным заболеванием, инициирующим развитие не только респираторных нарушений, но и сопровождающееся множеством внелегочных проявлений.
Уже в конце 2020г появились первые упоминания о новом медицинском термине "постковидный синдром" (post-COVID-19 syndrome) [3]. Более 30% лиц, перенесших COVID-19, столкнулись с этим синдромом, причем продолжительность отклонений могла варьировать от 12 нед. до 6 мес. [4]. Одним из наиболее серьезных последствий перенесенной инфекции является поражение сердечно-сосудистой системы, в инициации которого участвуют разнообразные механизмы. Большое значение в патогенезе имеют дисбаланс в работе ренин-ангиотензин-альдостероновой системы, чрезмерное и неконтролируемое высвобождение цитокинов с развитием цитокинового шторма, вирус-индуцированный миокардит в результате прямого действия severe acute respiratory syndrome coronavirus-2 (SARS-CoV-2) на миокардиальные клетки, гипоксия в результате острого респираторного дистресс-синдрома, приводящая к повреждению кардиомиоцитов, эндотелиит, тромбоз вследствие активации прокоагулянтного звена гемостаза1.
В последнее время появились дополнительные данные, подтверждающие, что эндотелиальным клеткам принадлежит множество ролей в патогенезе COVID-19 [5]. Являясь мишенью, которая может быть непосредственно повреждена SARS-CoV-2, эндотелиоциты одновременно продуцируют большое количество медиаторов, вовлеченных в воспалительные и тромботические каскады. Поскольку эндотелий — это активный паракринный, эндокринный и аутокринный орган, его изменения, проявляющиеся в т.ч. артериальной ригидностью, являются важным звеном в патогенезе большинства сердечно-сосудистых заболеваний (ССЗ), включая атеросклероз, артериальную гипертензию (АГ), ишемическую болезнь сердца и сердечную недостаточность [6].
В связи с этим закономерен повышенный интерес к поиску и изучению неинвазивных маркеров, изменяющихся после перенесенной COVID-19. Первые исследования свидетельствовали об увеличении плече-лодыжечной скорости распространения пульсовой волны (СРПВ) и каротидно-феморальной СРПВ (кфСРПВ) у пациентов, перенесших COVID-19 [7]. Европейское общество кардиологов подтверждает необходимость тщательного наблюдения и дальнейших исследований для изучения потенциальных терапевтических и прогностических последствий эндотелиита, вызванного инфицированием SARS-CoV-2, и рекомендует оценку жесткости артерий в качестве маркера исходов COVID-19 и мониторинга лечения [8].
Цель настоящего исследования — изучение структурно-функциональных свойств артерий различного калибра у пациентов после перенесенной COVID-19.
Материал и методы
На базе кафедры "Терапия" проведено одноцентровое открытое сравнительное исследование в параллельных группах, в которое было включено 113 человек в возрасте 30-70 лет. Протокол исследования был составлен в соответствии с принципами Хельсинкской декларации, одобрен комитетом по этике Пензенского государственного университета. Все лица, включаемые в исследование, подписывали информированное добровольное согласие.
Здоровые добровольцы, составившие группу 1 (n=45), средний возраст 51 (43; 59) год, были обследованы до начала пандемии COVID-19 в 2018-2019гг. Критерии включения: отсутствие сердечно-сосудистой и иной патологии по результатам физикального осмотра, лабораторного и инструментального обследования; отсутствие регулярного приема каких-либо препаратов; нормальные значения артериального давления (АД).
Здоровые лица, перенесшие COVID-19, составили группу 2 (n=44), средний возраст 47,9±9,1 лет. Критерии включения в исследование были аналогичны таковым в группе 1. Однако обязательным условием было наличие диагноза COVID-19, подтвержденного методом полимеразной цепной реакции давностью до 3 мес.
Группа 3 (n=24) — больные АГ в сочетании с COVID-19 в анамнезе (средний возраст 48,8±7,2 лет); у 9 пациентов АГ была диагностирована впервые. Критерии включения: уровень систолического АД (САД) от 140 до 179 мм рт.ст. и/или диастолического АД (ДАД) от 90 до 109 мм рт.ст., длительность АГ не >5 лет или впервые выявленная АГ, дислипидемия, диагноз COVID-19, подтвержденный методом полимеразной цепной реакции в течение последних 6 мес. Критерии невключения: уровень САД/ДАД >180 и/или 110 мм рт.ст., симптоматическая гипертония, наличие сахарного диабета, требующего коррекции инсулином, хроническая сердечная недостаточность III-IV функционального класса. Включение пациентов в исследование осуществляли после 10-дневного отмывочного периода, во время которого был возможен прием короткодействующих антигипертензивных препаратов (по требованию).
Первоначально всем лицам, включенным в исследование, проводили биохимический анализ крови с помощью прибора OLYMPUS AU400 ("OLYMPUS CORPORATION", Япония). Анализировали уровни общего холестерина (ХС), триглицеридов (ТГ), ХС липопротеинов низкой (ЛНП) и высокой плотности (ЛВП) и уровень глюкозы венозной крови.
Ультразвуковое исследование общих сонных артерий (ОСА) проводили на сканере MyLab 90 ("Esaote", Италия) с применением технологии высокочастотного сигнала RF. Определяли толщину комплекса интима-медиа (ТКИМ), индекс жесткости β, коэффициенты поперечной растяжимости (DC) и поперечной податливости (СС), локальную СРПВ в ОСА (locPWV) и индекс аугментации (Aix).
Методом аппланационной тонометрии (SphygmoCor "AtCorMedical", Австралия) оценивали показатели центрального давления: систолическое давление в аорте (СДао), пульсовое давление в аорте (ПДао), а также кфСРПВ.
СРПВ в аорте (PWV) и артериях преимущественно эластического типа справа и слева (R/L-PWV), а также сердечно-лодыжечный сосудистый индекс справа и слева (L-/CAVI1) определяли методом объёмной сфигмографии на аппарате VS-1000 ("Fukuda Denshi", Япония).
Всем обследуемым оценивали функцию эндотелия методом потокзависимой вазодилатации (ПЗВД) в пробе с постокклюзионной реактивной гиперемией на аппарате MyLab 90 ("Esaote", Италия). Регистрировали диаметр плечевой артерии (ПА) и скорость кровотока в ПА. На плечо, выше места визуализации, накладывали манжету сфигмоманометра и создавали в ней давление, на 50 мм рт.ст. превышающее САД. Прекращение кровотока по ПА на 4 мин отслеживали по цветному доплеровскому картированию потока. После завершения пробы в ответ на реактивную гиперемию расширение ПА <10% указывало на эндотелиальную дисфункцию. По индексу реактивности (ИРе) определяли положительный прирост скорости кровотока: >1,1 — положительная реакция; 0,9-1,1 — отрицательная и <0,9 — парадоксальная реакции.
Статистическую обработку результатов проводили с помощью лицензионной версии программы Statistica 13.0 (StatSoft Inc., США). Параметрические данные были отражены в виде M±SD, непараметрические — Me (Q25; Q75). При параметрическом характере распределения использовался критерий Стьюдента; при непараметрическом распределении связанных групп применяли параметр Вилкоксона, для несвязанных групп — критерий Манна-Уитни. Различия считались статистически значимыми при p<0,05. Для исследования взаимосвязи между количественными признаками применяли коэффициент корреляции Спирмена. При R≤0,3 корреляцию считали слабой, при 0,3<R<0,7 — умеренной и при R≥0,7 — сильной.
Сбор, анализ и интерпретацию данных проводили за счет средств гранта Российского научного фонда № 22-75-00059.
Результаты
Сравниваемые группы были сопоставимы по возрасту, росту. Отмечается неравномерное распределение обследуемых по гендерному составу. Курящие лица присутствовали только в группе больных АГ — 5 (20,8%) человек. Лица с отягощенной наследственностью имелись во всех группах. Зарегистрированы достоверные отличия между группами лиц без анамнеза ССЗ (группы 1 и 2) и группой 3 по индексу массы тела, уровням САД и ДАД (таблица 1).
Значения общего ХС, ХС ЛНП и ТГ достоверно различались между группами 1, 2 и группой 3 (р1,2-3=0,001), причем эти показатели были выше у лиц с АГ, перенесших COVID-19. Прослеживается значимое различие по уровню ХС ЛВП в группах сравнения (р1-2=0,007, р1,2-3=0,001), хотя значения соответствовали норме. Нарушений углеводного обмена во всех группах лиц, включенных в исследование, выявлено не было (таблица 1).
Данные, полученные в ходе неинвазивного изучения структурно-функциональных свойств артерий различного типа, свидетельствуют о наличии достоверных различий по большинству параметров у перенесших COVID-19 в отличие от здоровых добровольцев, а также зависимость ригидности артерий от наличия АГ.
Исследования ОСА технологией RF выявило достоверные различия между группами здоровых лиц (с анамнезом COVID-19 и без такового) и больных АГ, перенесших COVID-19. Так, минимальные значения ТКИМ отмечены в группе здоровых добровольцев, а максимальные — у больных АГ. Аналогичные изменения отмечены по показателям locPWV и индекс β, при этом последний (наряду с Aix) также оказался достоверно выше в группе 2 по сравнению с контрольной группой. Коэффициенты DC и CC также значимо различались между группами здоровых добровольцев и пациентов с АГ. Показатели ТКИМ и locPWV оказались несколько выше у перенесших инфицирование SARS-CoV-2, а коэффициент CC в группе лиц с COVID-19 в анамнезе — ниже таковых в группе контроля, однако различия по перечисленным параметрам не достигли статистической значимости (рисунок 1).
Согласно данным аппланационной тонометрии, давление в аорте у пациентов с АГ, перенесших COVID-19, существенно превышало аналогичные показатели в когорте здоровых лиц. Выявлены достоверные различия между 1 и 2 группами и по показателю ПДао. Значимые различия касались и основного маркера, отражающего жесткость артериальной стенки — кфСРПВ, который оказался наибольшим в группе 3 (рисунок 2).
После инфицирования SARS-CoV-2 выше PWV, R/L-PWV и L-/CAVI1, согласно результатам объемной сфигмографии, что подтверждает наличие у этой когорты лиц признаков РСС, причем максимальные значения этих показателей зарегистрированы в группе 3 (рисунок 3).
Эндотелиальная дисфункция по данным ПЗВД встречалась несколько чаще во 2 группе по сравнению с контрольной группой. Статистически значимая разница зарегистрирована в отношении распространенности патологических реакций: 33,1% лиц 2 группы имели ИРе <1,1, тогда как у здоровых добровольцев такие значения ИРе встречались лишь в 6,7% случаев (рисунок 4).
Для выявления возможных взаимосвязей в каждой выделенной нами группе проанализированы корреляции показателей артериальной ригидности с возрастом, некоторыми антропометрическими характеристиками, уровнем САД, ДАД. По результатам проведенного анализа установлено, что в группе здоровых лиц ТКИМ, DC, CC, индекс β, locPWV и кфСРПВ достоверно коррелировали с возрастом, причем корреляция ТКИМ с возрастом прямая сильная. Вместе с тем между индексами CC, DC и возрастом обнаружены обратные средней силы корреляции (рисунок 5 А). Выявленная взаимосвязь параметров сосудистой жесткости с возрастом согласуется с данными о влиянии возраста на артериальную ригидность [9]. Вполне логичной является и корреляция индексов DC, СС с уровнем САД (R=-0,34, p=0,021 и R=-0,36, p=0,016, соответственно), поскольку при повышенных цифрах АД снижается растяжимость сосудистой стенки. В группе 2 выявлены достоверные умеренные корреляции ТКИМ, индекса β, кфСРПВ и R/L-PWV с возрастом (рисунок 5 Б), а также взаимосвязь САД с индексом DC (R=-0,33, p=0,029). В группе 3 интересной является взаимосвязь таких показателей как индекс β и locPWV с индексом массы тела (рисунок 5 В). Отмечена прямая средней силы корреляция ряда параметров сосудистой жесткости с уровнем АД: кфСРПВ и ДАД (R=0,53, p=0,009), L-/CAVI1 и САД (R=0,41, p=0,049), R/L-PWV и САД (R=0,59, p=0,002). Выявленные изменения также вполне укладываются в концепцию сосудистых изменений при АГ.
Таблица 1
Характеристика сравниваемых групп (n=113)
Параметр | Группа 1 (n=45) | Группа 2 (n=44) | Группа 3 (n=24) | р |
Возраст, лет | 51 (43; 59) | 47,9±9,2 | 48,8±7,2 | р1-2=0,097 р1-3=0,481 р2-3=0,657 |
Рост, см | 170,8±10,3 | 167 (161; 172) | 170,3±8,3 | р1-2=0,051 р1-3=0,836 р2-3=0,102 |
Мужчины, n (%) | 26 (57,8) | 6 (13,6) | 16 (66,7) | р1-2=0,001 р1-3=0,645 р2-3=0,001 |
Женщины, n (%) | 19 (42,2) | 38 (86,4) | 8 (33,3) | р1-2=0,001 р1-3=0,645 р2-3=0,001 |
ИМТ, кг/м2 | 25,3±1,8 | 25,9±4,3 | 30,3±3,7 | р1-2=0,371 р1-3=0,001 р2-3=0,001 |
Отягощенная наследственность, n (%) | 8 (17,8) | 25 (56,8) | 10 (41,7) | р1-2=0,001 р1-3=0,063 р2-3=0,888 |
САД, мм рт.ст. | 120 (115; 125) | 120 (112,5; 125) | 152,9±8,5 | р1-2=0,876 р1-3=0,001 р2-3=0,001 |
ДАД, мм рт.ст. | 80 (70; 80) | 77,5 (70; 80) | 96±5,9 | р1-2=0,915 р1-3=0,001 р2-3=0,001 |
Общий ХС, ммоль/л | 5 (4,3; 5,4) | 4,9±0,6 | 5,9±1,1 | р1-2=0,713 р1-3=0,001 р2-3=0,001 |
ХС ЛВП, ммоль/л | 1,8±0,3 | 1,6±0,3 | 1,2±0,3 | р1-2=0,007 р1-3=0,001 р2-3=0,001 |
ХС ЛНП, ммоль/л | 2,5±0,5 | 2,8 (2,5; 3,3) | 3,7±0,9 | р1-2=0,284 р1-3=0,001 р2-3=0,001 |
ТГ, ммоль/л | 1,2 (0,9; 1,5) | 0,9 (0,7; 1,3) | 2,1 (1,5; 2,9) | р1-2=0,128 р1-3=0,001 р2-3=0,001 |
Глюкоза, ммоль/л | 5,3±0,4 | 5,1±0,5 | 5,6±1,1 | р1-2=0,075 р1-3=0,059 р2-3=0,005 |
Примечание: ДАД — диастолическое АД, ИМТ — индекс массы тела, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, САД — систолическое АД, ТГ — триглицериды, ХС — холестерин.
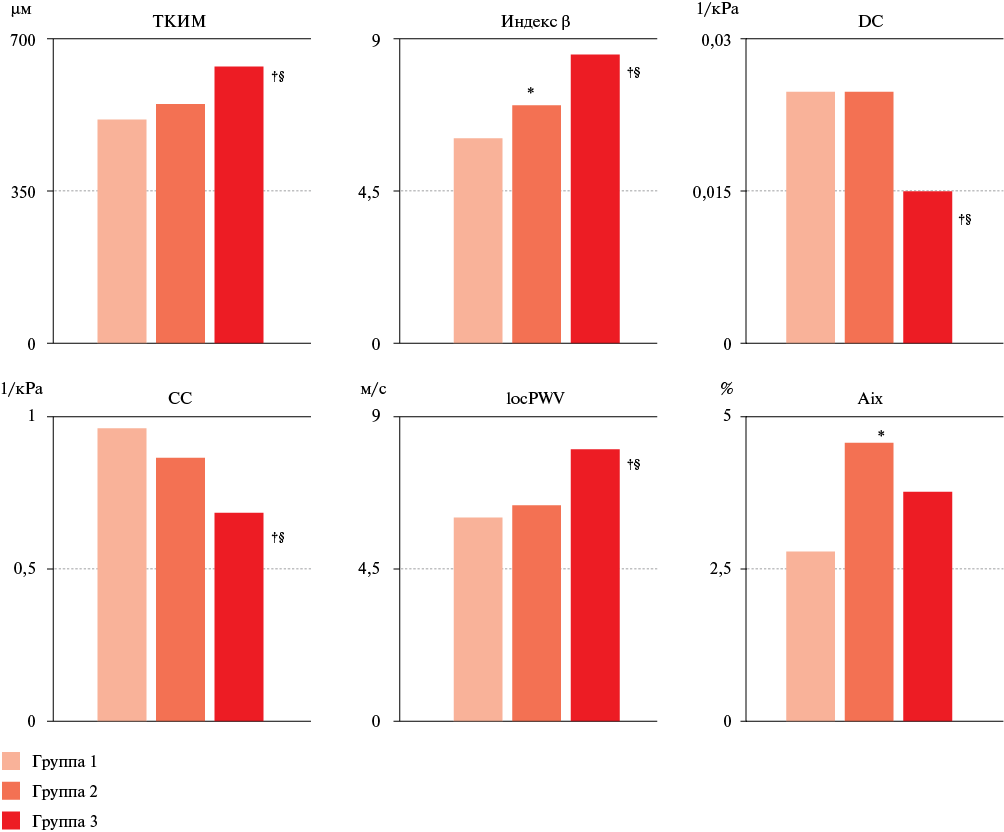
Рис. 1 Показатели, полученные по данным ультразвукового исследования ОСА технологией RF.
Примечание: * — р<0,05 — достоверные различия между группами 1 и 2; † — р<0,05 — достоверные различия между группами 1 и 3; § — р<0,05 — достоверные различия между группами 2 и 3. ТКИМ — толщина комплекса интима-медиа, Aix — индекс аугментации, DC — коэффициент поперечной растяжимости, СС — коэффициент поперечной податливости, locPWV — локальная СРПВ в сонной артерии.

Рис. 2 Показатели центральной гемодинамики в группах сравнения.
Примечание: * — р<0,05 — достоверные различия между группами 1 и 2; † — р<0,05 — достоверные различия между группами 1 и 3; § — р<0,05 — достоверные различия между группами 2 и 3. кфСРПВ — каротидно-феморальная скорость распространения пульсовой волны, ПДао — пульсовое давление в аорте, СДао — систолическое давление в аорте.
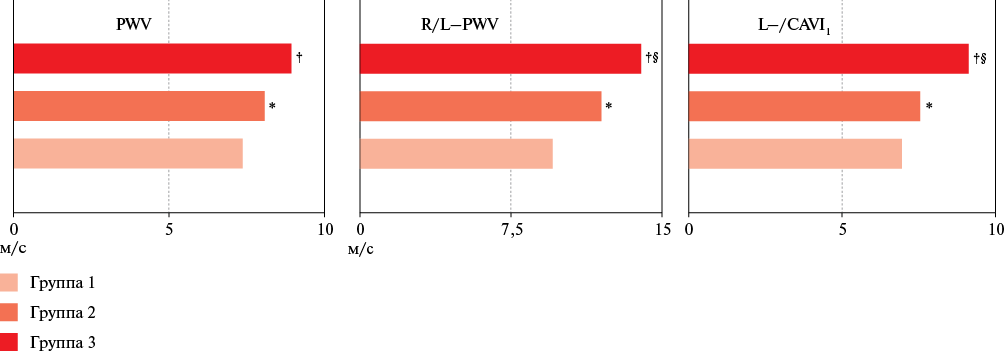
Рис. 3 Показатели объемной сфигмографии в группах сравнения.
Примечание: * — р<0,05 — достоверные различия между группами 1 и 2; † — р<0,05 — достоверные различия между группами 1 и 3; § — р<0,05 — достоверные различия между группами 2 и 3. L-/CAVI1 — сердечно-лодыжечный сосудистый индекс справа и слева, PWV — СРПВ в аорте, R/L-PWV — СРПВ в артериях преимущественно эластического типа справа и слева.

Рис. 4 Показатели, отражающие функцию эндотелия в группах сравнения.
Примечание: * — р<0,05 — достоверные различия между сравниваемыми группами. ИРе — индекс реактивности, ПЗВД — потокзависимая вазодилатация.

Рис. 5 Корреляции показателей, полученных с помощью комплексной неинвазивной оценки артериальной жесткости в группах 1 (А), 2 (Б) и 3 (В).
Примечание: ИМТ — индекс массы тела, кфСРПВ — каротидно-феморальная скорость распространения пульсовой волны, ТКИМ — толщина комплекса интима-медиа, DC — коэффициент поперечной растяжимости, locPWV — локальная СРПВ в сонной артерии, СС — коэффициент поперечной податливости, R — коэффициент корреляции Спирмена. R/L-PWV — СРПВ в артериях преимущественно эластического типа справа и слева.
Обсуждение
В настоящее время COVID-19 считается сложным мультисистемным заболеванием с потенциальными долгосрочными последствиями, описанными у 25% пациентов [10]. Поражение сердечно-сосудистой системы занимает одно из центральных мест при COVID-19, а ранее развившиеся ССЗ связаны с худшими клиническими исходами.
При COVID-19 наиболее частым и типичным проявлением поражения сосудистого русла является дестабилизация АД, ухудшение течения АГ или выявление заболевания впервые, что нашло отражение в настоящей работе — в группе 3 у 9 (37,5%) человек заболевание было выявлено после перенесенной COVID-19 [11]. По данным международного регистра АКТИВ (Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2), неконтролируемая АГ также была наиболее частой причиной обращения за медицинской помощью в первые 3 мес. после выздоровления [12]. Вместе с тем, постковидный синдром включает значительно возросший риск тромботических катастроф, в первую очередь, ишемического инсульта и острого инфаркта миокарда, даже у лиц молодого возраста [13]. В связи с этим очевидна практическая ценность полученных результатов для раннего выявления доклинических изменений артериального русла с целью дальнейшей профилактики сердечно-сосудистых катастроф.
Имеющиеся данные показывают, что инфекция, вызванная SARS-CoV-2, обусловливает развитие долгосрочных изменений в артериях даже у здоровых молодых людей [14]. Системное воспаление снижает биодоступность оксида азота, что увеличивает жесткость сосудов, в т.ч. у лиц, не имеющих ССЗ в анамнезе [15].
В качестве других потенциальных причин клеточного старения и артериальной ригидности предложены митохондриальная дисфункция, повышенная локальная продукция активных форм кислорода, обусловленные инфекцией COVID-19 [16]. Окислительно-восстановительный дисбаланс способствует эндотелиальной дисфункции и хроническому субинтимальному воспалению, которое вызывает ускоренную фрагментацию париетальных эластиновых волокон и их замещение жесткой фиброзной тканью [17]. Поскольку фиброз легких, вызванный COVID-19, обратим только частично [18], предполагается, что артериальная жесткость может быть долгосрочным сердечно-сосудистым осложнением для большинства пациентов независимо от тяжести течения COVID-19 [17].
Исследование структурно-функциональных свойств артерий часто направлено на выявление корреляционных взаимосвязей оцениваемых параметров с полом и возрастом, учитывая вклад последних в структуру немодифицируемых факторов риска. Показано, что СРПВ на отдельных участках, пульсовое АД и показатели эндотелиальной функции не имеют гендерных различий у лиц <50 лет [19].
Появляется все больше клинических исследований, оценивающих влияние COVID-19 на артериальную ригидность. Одними из первых вклад в эту тему внесли Ratchford SM, et al. (2021), которые наблюдали у пациентов, перенесших инфицирование SARS-CoV-2, более высокие в сравнении со здоровыми лицами значения кфСРПВ, а также признаки эндотелиальной дисфункции в пробе с постокклюзионной реактивной гиперемией [20]. В исследовании "случай-контроль" при выявлении COVID-19 имело место нарастание сонно-бедренной и плече-лодыжечной СРПВ, что позволило авторам сделать вывод о возможной связи COVID-19 с возрастанием СРПВ [7]. В настоящей работе также зарегистрированы признаки увеличения жесткости сосудистой стенки у переболевших COVID-19, выражающиеся увеличением кфСРПВ согласно данным аппланационной тонометрии, по сравнению со здоровыми лицами. Вероятнее всего, данные изменения свидетельствуют о развитии РСС после COVID-19. Помимо этого, среди перенесших ранее инфицирование SARS-CoV-2, чаще встречались патологические реакции по сравнению со здоровой когортой, что продемонстрировала неинвазивная оценка функции эндотелия.
Дополнительные доказательства сердечно-сосудистых нарушений у молодых людей в возрасте 23,0±1,0 лет представлены в работе Szeghy RE, et al. (2022) [21]. Согласно их материалам, ультразвуковое исследование ОСА свидетельствовало об увеличении жесткости сосудов каротидного бассейна у пациентов с подтвержденным случаем инфекции COVID-19 по сравнению с лицами здоровой группы. Однако обследуемые обеих групп имели сходные значения ТКИМ, что могло быть обусловлено легким течением коронавирусной инфекции. Aix в аорте оказался выше среди молодых людей с COVID-19 по сравнению с контрольной группой [21]. Исследование каротидного бассейна технологией высокочастотного сигнала RF в настоящем исследовании также продемонстрировало потерю сосудистой стенкой эластических свойств, что проявлялось увеличением индекса жесткости β в группах пациентов, перенесших COVID-19. Значения ТКИМ достоверно различались между когортой здоровых лиц и больными АГ. Однако между здоровыми добровольцами и не страдавшими АГ, перенесшими COVID-19, статистически значимого различия не выявлено. Коэффициент CC у пациентов с COVID-19 в анамнезе был ниже в контрольной группе, что свидетельствует о нарушении поперечной податливости артерий, но значимые различия выявлены только между здоровыми лицами и пациентами, страдающими АГ.
В проспективном анализе Aydin E, et al. сердечно-лодыжечный индекс (CAVI) возрастал у пациентов с коронавирусной инфекцией по сравнению со здоровыми добровольцами [22]. В настоящей работе анализ показателей, полученных методом объемной сфигмографии, продемонстрировал наличие в группе лиц с COVID-19 признаков РСС, выражавшихся в увеличении PWV, R/L-PWV и L-/CAVI1, поскольку подобные изменения связаны с доклиническим атеросклерозом [1].
У пациентов с COVID-19 наблюдается стойкое увеличение артериальной ригидности и нарушение функции эндотелия после подтверждения случая инфицирования SARS-CoV-2, как показал Lambadiari V, et al. (2021). По их данным, значения ПЗВД были сходными на 4 и на 12 мес. от начала заболевания COVID-19 и отличались от таковых в группе контроля, представленной здоровой когортой. Кроме того, значения кфСРПВ оставались одинаковыми между 4 и 12 мес. и были увеличены по сравнению со здоровыми лицами [23].
Появление новых штаммов SARS-CoV-2 обусловливает трансформацию клинической картины COVID-19. Например, "Omicron", преимущественно повреждал слизистую верхних дыха- тельных путей и вызывал меньше тромботичес- ких осложнений [24]. Следовательно, изменение структурно-функциональных свойств артерий после COVID-19, вероятно, может значительно варь- ировать в зависимости от штамма SARS-CoV-2. Это обстоятельство необходимо учитывать при интерпретации полученных на сегодняшний день данных.
Таким образом, COVID-19 оказывает серьезное влияние на сердечно-сосудистую систему, в связи с чем неинвазивная оценка жесткости артерий, несомненно, будет способствовать выявлению лиц с плохим клиническим прогнозом для своевременной профилактики и адекватной реабилитации.
Ограничение исследования. Ограничением исследования является отсутствие группы пациентов с АГ без COVID-19.
Заключение
Полученные в ходе настоящего исследования результаты позволяют констатировать у лиц, перенесших COVID-19, увеличение жесткости артериальной стенки, что можно расценивать как признак РСС. Представляется целесообразным проведение дальнейших масштабных исследований для изучения обратимости подобных сосудистых изменений и влияния их на долгосрочный прогноз у переболевших лиц. Лучшее понимание характера поражения сосудов при инфицировании SARS-CoV-2 и его прогностическом значении расширит представления о синдромокомплексе COVID-19 в целом, что явится важным шагом в его успешном лечении.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 22-75-00059.
1. Временные методические рекомендации по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19). Версия 17. 14.12.2022г.
Список литературы
1. Nilsson PM. Early vascular aging (EVA): consequences and prevention. Vasc Health Risk Manag. 2008;4(3):547-52. doi:10.2147/vhrm.s1094.
2. Васюк Ю. А., Иванова С. В., Школьник Е. Л. и др. Согласованное мнение российских экспертов по оценке артериальной жесткости в клинической практике. Кардиоваскулярная терапия и профилактика. 2016;15(2):4-19. doi:10.15829/1728-8800-2016-2-4-19.
3. Barker-Davies RM, O’Sullivan O, Senaratne KPP, et al. The Stanford Hall consensus statement for postCOVID-19 rehabilitation. Br J Sports Med. 2020;54(16):949-59. doi:10.1136/bjsports-2020-102596.
4. Бубнова М. Г., Шляхто Е. В., Аронов Д. М. и др. Новая коронавирусная инфекционная болезнь COVID-19: особенности комплексной кардиологической и респираторной реабилитации. Российский кардиологический журнал. 2021;26(5):4487. doi:10.15829/1560-4071-2021-4487.
5. Кузник Б. И., Хавинсон Н. Х., Линькова Н. С. COVID-19: влияние на иммунитет, систему гемостаза и возможные пути коррекции. Успехи физиологических наук. 2020;51(4):51-63. doi:10.31857/S0301179820040037.
6. Воробьева Е. Н., Шумахер Г. И., Хорева М. А. и др. Дисфункция эндотелия — ключевое звено в патогенезе атеросклероза. Российский кардиологический журнал. 2010;(2):84-91.
7. Schnaubelt S, Oppenauer J, Tihanyi D, et al. Arterial stiffness in acute COVID-19 and potential associations with clinical outcome. J Intern Med. 2021;290(2):437-43. doi:10.1111/joim.13275.
8. Evans PC, Rainger GE, Mason JC, et al. Endothelial dysfunction in COVID-19: a position paper of the ESC Working Group for Atherosclerosis and Vascular Biology, and the ESC Council of Basic Cardiovascular Science. Cardiovasc Res. 2020;116(14):2177-84. doi:10.1093/cvr/cvaa230.
9. Ефимов А. А. Морфологический анализ возрастных изменений артериальной стенки. Российский медико-биологический вестник им. акад. И. П. Павлова. 2011;3:28-33.
10. Амиров Н. Б., Давлетшина Э. И., Васильева А. Г. и др. Постковидный синдром: мультисистемные "дефициты". Вестник современной клинической медицины. 2021;14:94-104. doi:10.20969/VSKM.2021.14(6).94-104.
11. Чазова И. Е., Блинова Н. В., Жернакова Ю. В. и др. Консенсус экспертов Российского медицинского общества по артериальной гипертонии: артериальная гипертония и постковидный синдром. Системные гипертензии. 2022;19(3):5-13. doi:10.38109/2075-082X-2022-3-5-13.
12. Арутюнов Г. П., Тарловская Е. И., Арутюнов А. Г. и др. Клинические особенности постковидного периода. Результаты международного регистра "Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2 (АКТИВ SARS-CoV-2)". (12 месяцев наблюдения). Российский кардиологический журнал. 2023;28(1):5270. doi:10.15829/1560-4071-2023-5270.
13. Асфандиярова Н. С. Постковидный синдром. Клиническая медицина. 2021;99(7-8):429-35. doi:10.30629/0023-2149-2021-99-7-8-429-435.
14. Авдеева И. В., Полежаева К. Н., Бурко Н. В. и др. Влияние инфекции SARS-COV-2 на структурно-функциональные свойства артерий. Известия высших учебных заведений. Поволжский регион. Медицинские науки. 2022;2(62):14-25. doi:10.21685/2072-3032-2022-2-2.
15. Стаценко М. Е., Деревянченко М. В. Роль системного воспаления в снижении эластичности магистральных артерий и прогрессировании эндотелиальной дисфункции у больных артериальной гипертензии в сочетании с ожирением и сахарным диабетом 2 типа. Российский кардиологический журнал. 2018;(4):32-6. doi:10.15829/1560-4071-2018-4-32-36.
16. Макацария А. Д., Слуханчук Е. В., Бицадзе В. О. и др. Тромботический шторм, нарушения гемостаза и тромбовоспаление в условиях COVID-19. Акушерство, Гинекология и Репродукция. 2021;15(5):499-514. doi:10.17749/2313-7347/ob.gyn.rep.2021.247.
17. Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417-8. doi:10.1016/S0140-6736(20)30937-5.
18. Poissy J, Goutay J, Caplan M, et al. Haemostasis COVID-19 Group. Pulmonary Embolism in Patients with COVID-19: Awareness of an Increased Prevalence. Circulation. 2020;142(2):184-6. doi:10.1161/CIRCULATIONAHA.120.047430.
19. Кательницкая Л. И., Хаишева Л. А. Гендерные особенности клинического течения и лечения больных артериальной гипертонией. Рациональная Фармакотерапия в Кардиологии. 2008;4(1):76-80. doi:10.20996/1819-6446-2008-4-1-76-80.
20. Ratchford SM, Stickford JL, Province VM, et al. Vascular alterations among young adults with SARS-CoV-2. Am J Physiol Heart Circ Physiol. 2021;320(1):H404-10. doi:10.1152/ajpheart.00897.2020.
21. Szeghy RE, Province VM, Stute NL, et al. Carotid stiffness, intima-media thickness and aortic augmentation index among adults with SARS-CoV-2. Exp Physiol. 2022;107(7):694-707. doi:10.1113/EP089481.
22. Aydın E, Kant A, Yilmaz G. Evaluation of the cardio-ankle vascular index in COVID-19 patients. Rev Assoc Med Bras (1992). 2022;68(1):73-6. doi:10.1590/1806-9282.20210781.
23. Lambadiari V, Mitrakou A, Kountouri A, et al. Association of COVID-19 with impaired endothelial glycocalyx, vascular function and myocardial deformation 4 months after infection. Eur J Heart Fail. 2021;23(11):1916-26. doi:10.1002/ejhf.2326.
24. Горелов А. В., Плоскирева А. А., Музыка А. Д. Эволюция клинико-патогенетических особенностей коронавирусной инфекции COVID-19. РМЖ. Медицинское обозрение. 2022;6(11):626-34. doi:10.32364/2587-6821-2022-6-11-626-634.
Об авторах
В. Э. ОлейниковРоссия
Олейников Валентин Эливич — доктор медицинских наук, профессор, заведующий кафедры "Терапия".
Пенза
И. В. Авдеева
Россия
Авдеева Ирина Владимировна — кандидат медицинских наук, доцент кафедры «Терапия».
Пенза
К. Н. Полежаева
Россия
Полежаева Кристина Николаевна — аспирант 3 года обучения кафедры «Терапия».
Пенза
К. И. Павленко
Россия
Павленко Ксения Игоревна — аспирант 2 года обучения кафедры, ассистент кафедры «Терапия».
Пенза
Н. А. Борисова
Россия
Борисова Наталья Александровна — кандидат медицинских наук, доцент кафедры «Терапия».
Пенза
А. А. Хромова
Россия
Хромова Ангелина Анатольевна — кандидат медицинских наук, доцент кафедры «Терапия».
Пенза
А. В. Кулюцин
Россия
Кулюцин Алексей Валерьевич — кандидат медицинских наук, доцент кафедры «Терапия».
Пенза
Дополнительные файлы
Что известно о предмете исследования?
- Поражение сердечно-сосудистой системы занимает одно из центральных мест при COVID-19 (COronaVIrus Disease-2019).
Что добавляют результаты исследования?
- У лиц, перенесших COVID-19, отмечается повышение артериальной ригидности и развитие эндотелиальной дисфункции.
- По результатам неинвазивного исследования сосудистого русла можно предположить, что COVID-19 способен инициировать процесс раннего сосудистого старения.
Рецензия
Для цитирования:
Олейников В.Э., Авдеева И.В., Полежаева К.Н., Павленко К.И., Борисова Н.А., Хромова А.А., Кулюцин А.В. Структурно-функциональные свойства артерий у лиц, перенесших новую коронавирусную инфекцию. Кардиоваскулярная терапия и профилактика. 2023;22(5):3541. https://doi.org/10.15829/1728-8800-2023-3541
For citation:
Oleinikov V.E., Avdeeva I.V., Polezhaeva K.N., Pavlenko K.I., Borisova N.A., Khromova A.A., Kulyutsin A.V. Structural and functional properties of arteries in COVID-19 survivors. Cardiovascular Therapy and Prevention. 2023;22(5):3541. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3541
JATS XML

























































