Перейти к:
Изучение значимости морфологических и лабораторных маркеров в предсказании эффективности криобаллонной изоляции устьев легочных вен при фибрилляции предсердий
https://doi.org/10.15829/1728-8800-2023-3545
Аннотация
Цель. Определить клинические, морфологические и биохимические предикторы субстратной, не-венозависимой фибрилляции предсердий (ФП) путем морфологического и иммунологического исследований у пациентов с рецидивами ФП после изоляции легочных вен (ЛВ).
Материал и методы. В исследование включено 100 человек (58 мужчин и 42 женщины) с пароксизмальной (n=89) и персистирующей формой (n=11) ФП и средним возрастом 58,2±9,4 лет. После первичной операции 15 человек выбыли из исследования по причине отказа от повторного вмешательства и 1 человек выбыл по причине нагноения ложа петлевого регистратора электрокардиограммы и его эксплантации. 100 пациентам проведена первичная криобаллонная изоляция устьев ЛВ с одномоментной биопсией миокарда из межжелудочковой и межпредсердной перегородок, у 60 пациентов с последующими окрасками гематоксилин-эозином и по Ван Гизону. Также 100 пациентам одномоментно имплантированы петлевые регистраторы электрокардиограммы для объективного отслеживания рецидивов ФП и взята кровь (до вмешательства) для последующего анализа маркеров воспаления и антимиокардиальных антител. Пациенты подверглись клиническому наблюдению в течение года (визиты через 3, 6, 12 мес.). Пациенты с рецидивами направлены на повторное электрофизиологическое исследование и сегментарную аблацию в случае выявления прорывов ЛВ. После повторного вмешательства срок наблюдения продлевался на год с прежним графиком визитов. По результатам общего наблюдения сформированы 2 группы пациентов: без рецидивов (вено-зависимая ФП, группа I) и с рецидивами (не-венозависимая ФП, группа II), несмотря на достигнутую изоляцию ЛВ в результате 1 или 2 операций.
Результаты. Анализ морфологических изменений показал, что с увеличением шансов рецидива ФП в среднем в 6,14 раз (95% доверительный интервал: 1,14-47,6 (p=0,0462) ассоциируется фиброз межжелудочковой перегородки 2 ст. С тенденцией к увеличению шансов рецидива ФП ассоциировалась инфильтрация лимфоцитами эндокарда межжелудочковой перегородки в среднем в 9 раз (95% доверительный интервал: 0,89-95,37) (р=0,0519).
Среди лабораторных показателей выявлена статистически значимо более высокая концентрация N-концевого промозгового натрийуретического пептида и статистически значимо меньшая концентрация антимиокардиальных антител в группе пациентов с рецидивами ФП после изоляции ЛВ (p=0,0101).
Заключение. Воспалительные изменения миокарда являются важным звеном патогенеза ФП и ассоциированы с ее рецидивированием.
Для цитирования:
Калемберг Е.Н., Давтян К.В., Благова О.В., Брутян А.А., Злобина П.Д., Харлап М.С. Изучение значимости морфологических и лабораторных маркеров в предсказании эффективности криобаллонной изоляции устьев легочных вен при фибрилляции предсердий. Кардиоваскулярная терапия и профилактика. 2023;22(5):3545. https://doi.org/10.15829/1728-8800-2023-3545
For citation:
Kalemberg E.N., Davtyan K.V., Blagova O.V., Brutyan A.A., Zlobina P.D., Kharlap M.S. Value of morphological and laboratory markers in predicting the effectiveness of cryoballoon pulmonary vein isolation in atrial fibrillation. Cardiovascular Therapy and Prevention. 2023;22(5):3545. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3545
Введение
Фибрилляция предсердий (ФП) — наиболее часто встречающийся вид нарушений ритма сердца в популяции, с распространенностью в европейской части Российской Федерации — 2,04% [1], сопряженный с высоким социально-экономическим бременем. Это заставляет исследователей по всему миру многие десятилетия заниматься изучением патогенеза и разработкой подходов к ее лечению.
В 1998г Haissaguerre М, et al. описали роль эктопической активности муфт легочных вен (ЛВ) в патогенезе ФП [2]. Это открытие лежит в основе широко распространенных катетерных методик лечения ФП. Тем не менее, эта теория не объясняет рецидивирования ФП после достоверно успешной изоляции муфт ЛВ. Разные результаты эффективности изоляции у клинически схожих больных делают затруднительным корректный отбор потенциальных ответчиков на катетерное лечение, т.к. отсутствует всестороннее понимание, что именно делает процедуру эффективной или наоборот.
В связи с этим продолжается поиск и изучение новых теорий, объясняющих наличие аритмогенного субстрата не только в области устьев ЛВ, но и в миокарде левого предсердия (ЛП). Объектом изучения одной из теорий аритмогенеза при ФП является воспалительный процесс и его роль в происхождении и поддержании ФП [3-5].
В настоящей работе задались целью определить клинические, морфологические и биохимические предикторы субстратной, не-венозависимой ФП путем морфологического и иммунологического исследований у пациентов с рецидивами ФП после изоляции ЛВ.
Материал и методы
Настоящее одноцентровое проспективное исследование выполнено на базе ФГБУ "НМИЦ ТПМ" Минздрава России. Набор и наблюдение пациентов осуществлялись в 2017-2021гг с последовательным включением пациентов (начало включения пациентов — 2017г, окончание — 2019г).
Протокол исследования был разработан в соответствии с критериями Хельсинкской декларации и одобрен Независимым этическим комитетом ФГБУ "НМИЦ ТПМ" Минздрава России.
Дизайн исследования. Дизайн исследования схематично изображен на рисунке 1.
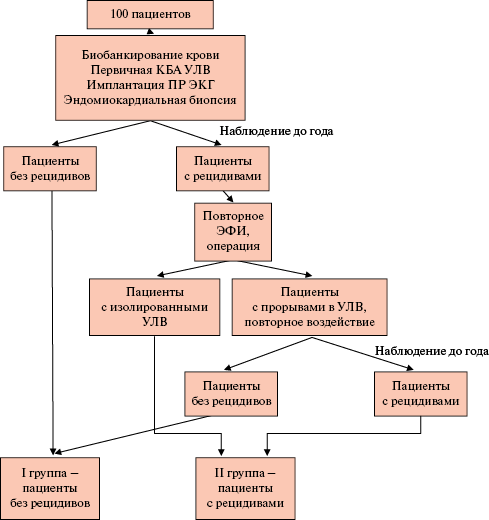
Рис. 1 Схематическое изображение дизайна исследования.
Примечание: КБА — криобаллонная аблация, ПР — петлевой регистратор, УЛВ — устья ЛВ, ЭКГ — электрокардиограмма, ЭФИ — электрофизиологическое исследование.
Пациенты для участия в исследовании выбирались согласно критериям включения (перечислены далее) из тех, кто поступал в ФГБУ "НМИЦ ТПМ" Минздрава России для проведения катетерного лечения ФП. Всем включенным в исследование пациентам во время госпитализации в день операции или накануне проводили забор венозной крови с целью дальнейшего определения в ней уровня маркеров воспаления, включая определенный высокочувствительным методом С-реактивный белок (вчСРБ), фактор роста фибробластов-2 (fibroblast growth factor-2, FGF2), белок, связывающий жирные кислоты-3 (fatty acid-binding protein,-3 FABP-3), трансформирующий фактор роста бета-1 (transforming growth factor beta, TGF β-1), интерлейкин-1 бета (ИЛ-1β), фактор некроза опухоли альфа (tumor necrosis factor alpha (TNFα), белков протеолиза, в т.ч. матриксных металлопротеиназ (MMP)-1,3,9 и тканевого ингибитора MMP), а также N-концевого промозгового натрийуретического пептида (NT-proBNP) и антимиокардиальных антител.
Далее всем пациентам проводили первичную криобаллонную изоляцию устьев ЛВ ЛП, в ходе операции до начала изоляционного воздействия выполняли биопсию межпредсердной (МПП) и межжелудочковой (МЖП) перегородок, а также имплантацию петлевого регистратора электрокардиограммы (ЭКГ). После выписки из стационара за пациентами продолжалось наблюдение в течение 1 года после оперативного вмешательства с графиком визитов через 3, 6, 12 мес. Конечной точкой считался рецидив ФП вне слепого периода после изоляции ЛВ. Во время визитов проводилось считывание информации с петлевого регистратора ЭКГ. По результатам годового наблюдения обследуемых разделили на пациентов с рецидивами ФП после первичной операции (в т.ч. важным представлялось выявление бессимптомных рецидивов посредством анализа данных петлевого регистратора ЭКГ) и пациентов без рецидивов ФП. Группе пациентов с рецидивами выполняли повторное эндокардиальное электрофизиологическое исследование (ЭФИ) для определения причины рецидивирования ФП. По результатам ЭФИ либо выявляли участки несостоятельности первичной изоляции устьев ЛВ, и в дальнейшем данной группе пациентов выполняли сегментарную радиочастотную аблацию в данных местах, либо верифицировали субстрат аритмии за пределами устьев ЛВ (верификация не-венозависимой ФП). Пациенты, которым была выполнена повторная изоляция ЛВ, вновь проходили годовое наблюдение с прежним графиком визитов для верификации рецидивирования ФП после второй операции. Наблюдение длилось до 1 года либо до первого рецидива ФП вне слепого периода. Пациенты, у которых на повторной процедуре верифицировалась изоляция ЛВ, достигали своей конечной точки. По результатам общего наблюдения пациенты разделились на 2 группы: группа I — без рецидивирования ФП после одной или двух операций катетерной изоляции ЛВ и группа II — пациенты с рецидивированием ФП, несмотря на достигнутую изоляцию ЛВ в результате 1 или 2 операций.
Далее у каждого пациента анализировали уровень NT-proBNP в сыворотке крови и выполняли морфологический анализ биоптатов сердца.
Критерии включения и невключения пациентов:
Критерии включения соответствовали стандартным показаниям к катетерной изоляции ФП и были следующими: мужской и женский пол, возраст >18 лет, пароксизмальная или персистирующая форма ФП, симптомность ФП по шкале EHRA (European Heart Rhythm Association) 2b-4. Пациентов включали в исследование после подписания информированного согласия на участие.
Не включали пациентов с некомпенсированной сопутствующей патологией (гипертоническая болезнь, сахарный диабет, нестабильная ишемическая болезнь сердца, хроническая сердечная недостаточность, системные заболевая в фазе обострения и т.д.), а также имеющих грубую структурную патологию сердца по данным эхокардиографии (ЭхоКГ): ЛП >50 мм, тромбоз камер сердца, митральную регургитацию ≥3 ст., фракцию выброса левого желудочка <40%, гипертрофию >14 мм.
Материалы исследования:
В исследование включены 100 человек (58 мужчин и 42 женщины) с пароксизмальной (n=89) и персистирующей формой (n=11) ФП, средний возраст составил 58,2±9,4 лет. После первичной операции 15 человек выбыли из исследования по причине отказа от повторного вмешательства и 1 человек — по причине нагноения ложа петлевого регистратора и его эксплантации.
Характеристика клинических данных включенных пациентов представлена в таблице 1.
Статистический анализ. Статистический анализ и визуализация полученных данных проводились с использованием среды для статистических вычислений R 4.2.2 (R Foundation for Statistical Computing, Вена, Австрия).
Описательные статистики представлены в виде наблюдаемого числа наблюдений (относительная частота) для качественных переменных и среднего (M) ± стандартное отклонение (SD) и медианы (Me) и интерквартильного размаха (Q25-Q75) — симметричных и асимметричных выборочных распределений количественных переменных, соответственно. Асимметрия выборочного распределения оценивалась с использованием коэффициента асимметрии, в качестве порогового значения использовалось абсолютное значение коэффициента, равное 1,96.
Оценка ассоциации бинарных и количественных переменных с развитием рецидива проводилась с использованием логистических регрессионных моделей, в качестве мер эффекта использовалось отношение шансов (ОШ) с соответствующим 95% доверительным интервалом (ДИ).
Для сравнения групп в отношении качественных переменных использовался точный тест Фишера, в отношении количественных переменных — тест Манна-Уитни.
Уровнем статистической значимости в проведенных анализах считали значение p<0,05.
Результаты
Были сопоставлены группы пациентов с достигнутой изоляцией устьев ЛВ, не имеющих рецидивов ФП (группа I) и имеющих рецидивы (группа II), по клинико-демографическим данным, характеристикам ФП, сопутствующей патологии, лабораторным и гистологическим изменениям.
Общая характеристика включенных пациентов и их клинико-анамнестических данных
При сравнительном анализе демографических и анамнестических показателей (таблица 1) была выявлена тенденция к большей длительности анамнеза ФП у пациентов с рецидивами после изоляции ЛВ (рисунок 2). Статистически значимых отличий в отношении возраста, гендерного состава, индекса массы тела, сопутствующих заболеваний и возраста манифестации аритмии выявлено не было.
Была установлена статистически значимо более высокая частота персистирующей ФП во II группе пациентов по сравнению с первой (рисунок 3) (p=0,0009).
Во II группе пациентов статистически значимо чаще наблюдалось рецидивирование в слепом периоде после операции — 7/9 (77,8%) vs 14/75 (18,7%) (p=0,007) (рисунок 4).
Анализ биопсии миокарда
Статистически значимых различий по морфологическим изменениям эндокарда, миокарда, интерстиция и сосудов при исследовании материала МПП пациентов I и II групп выявлено не было.
В таблице 2 представлены результаты сравнительного анализа патоморфологических характеристик МЖП в сравниваемых группах пациентов.
У 5 (31,2%) из 16 пациентов с фиброзом МЖП 2 ст. развился рецидив ФП после изоляции ЛВ, в то время как из 29 пациентов с фиброзом МЖП 1 ст. рецидив развился у 2 (6,9%) пациентов. Иными словами, фиброз МЖП 2 ст. ассоциировался с увеличением шанса рецидива ФП в 6 раз (ОШ 6,14; 95% ДИ: 1,14-47,6) (p=0,0462).
У 2 (50%) из 4 пациентов с инфильтрацией лимфоцитами эндокарда МЖП развился рецидив ФП после изоляции ЛВ, в то время как из 40 пациентов без инфильтрации рецидив развился у 4 (10%) пациентов. Инфильтрация лимфоцитами эндокарда МЖП ассоциировалась с тенденцией к увеличению шанса рецидива ФП (ОШ 9; 95% ДИ: 0,89-95,37) (p=0,0519).
Анализ уровня NT-proBNP и антикардиальных антител в сыворотке крови:
Была выявлена статистически значимо более высокая концентрация NT-proBNP у пациентов I группы по сравнению со II группой (рисунок 5). Увеличение концентрации NT-proBNP в 2 раза ассоциировалось с двукратным увеличением шансов рецидива ФП после изоляции ЛВ (ОШ 2; 95% ДИ: 1,33-3,29) (p=0,002).
При сравнительном анализе антикардиальных антител в сыворотке крови выявлена статистически значимо меньшая концентрация антител к проводящей системе сердца во II группе пациентов (p=0,0101) (таблица 3).
Таблица 1
Клинико-демографические характеристики пациентов исследуемых групп
Характеристика | I группа Пациенты без рецидивов после изоляции ЛВ | II группа Пациенты с рецидивами после изоляции ЛВ | p | |
Возраст (лет) | 57,4 (9,6) 58 (53,5-63) | 57,8 (7,4) 57 (55-64) | 0,977 | |
Пол, n (%) | ж | 30 (40) | 4 (44,4) | >0,999 |
м | 45 (60) | 5 (55,6) | ||
ИМТ (кг/м2) | 29,4 (3,7) 29,4 (27,6-32,2) | 30,7 (2,9) 31,2 (30,7-31,9) | 0,271 | |
Возраст манифестации аритмии (лет) | 52,6 (10,5) 54 (45-59) | 52,1 (9) 52 (46-58) | 0,806 | |
Длительность анамнеза ФП (лет) | 5,3 (6,1) 4 (2-6,5) | 7 (5) 5 (3-9) | 0,139 | |
Форма ФП, n (%) | пароксизмальная | 73 (97,3) | 5 (55,6) | 0,001 |
персистирующая | 2 (2,7) | 4 (44,4) | ||
Симтпомность по EHRA, n (%) | I | 2 (2,7) | 0 (0) | 0,33 |
IIa | 1 (1,3) | 1 (11,1) | ||
IIb | 37 (49,3) | 5 (55,6) | ||
III | 35 (46,7) | 3 (33,3) | ||
Количество баллов по CHA2DS2VASc, n (%) | 0 | 13 (17,3) | 0 (0) | 0,452 |
1 | 25 (33,3) | 1 (11,1) | ||
2 | 11 (14,7) | 7 (77,8) | ||
3 | 19 (25,3) | 1 (11,1) | ||
4 | 5 (6,7) | 0 (0) | ||
5 | 2 (2,7) | 0 (0) | ||
Количество баллов по HASBLED, n (%) | 0 | 30 (40) | 5 (55,6) | 0,244 |
1 | 23 (30,7) | 3 (33,3) | ||
2 | 17 (22,7) | 1 (11,1) | ||
3 | 5 (6,7) | 0 (0) | ||
Примечание: ИМТ — индекс массы тела, ЛВ — легочные вены, ФП — фибрилляция предсердий, EHRA — European Heart Rhythm Association, шкала CHA2DS2VASc — Congestive heart failure (хроническая сердечная недостаточность), 1 балл; Hypertension (гипертоническая болезнь), 1 балл; Age (возраст, >75 лет), 2 балла; Diabetes mellitus (сахарный диабет), 1 балл; Stroke (инсульт/транзиторная ишемическая атака/системный эмболизм в анамнезе), 2 балла; Vascular disease (поражение сосудов), 1 балл; Age (возраст 65-74 лет), 1 балл; Sex category (пол (женский), 1 балл, 2 балла), шкала HASBLED — Hypertension (гипертония); Abnormal renal/liver function (нарушение функции почек и печени); Stroke (инсульт); Bleeding history or predisposition (кровотечения в анамнезе и/или предрасположенность к ним); Labile international normalized ratio (лабильное международное нормализованное отношение); Elderly (возраст, >65 лет); Drugs/alcohol concomitantly (совместный прием медикаментов и/или алкоголя).

Рис. 2 Длительность анамнеза ФП в группах пациентов.
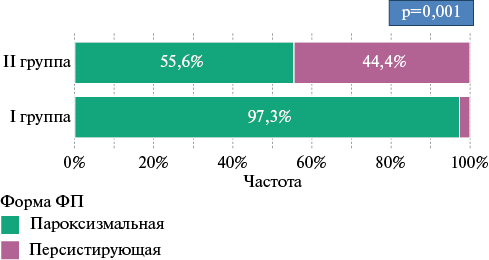
Рис. 3 Форма ФП в группах пациентов.
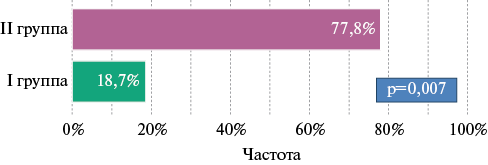
Рис. 4 Частота рецидивирования в слепом периоде в группах пациентов.
Таблица 2
Результаты морфологического исследования МЖП в группах пациентов
Показатель, n (%) | I группа Пациенты без рецидивов после изоляции ЛВ | II группа Пациенты с рецидивами после изоляции ЛВ | p | |
Миокардит | 28/38 (73,7) | 4/7 (57,1) | 0,394 | |
Активный/пограничный | 0 | 10/38 (26,3) | 3/7 (42,9) | 0,529 |
1 | 12/38 (31,6) | 1/7 (14,3) | ||
2 | 16/38 (42,1) | 3/7 (42,9) | ||
Эндокардит | 0 | 30/38 (78,9) | 4/7 (57,1) | 0,237 |
1 | 6/38 (15,8) | 2/7 (28,6) | ||
2 | 2/38 (5,3) | 1/7 (14,3) | ||
Степень фиброза | 1 | 27/38 (71,1) | 2/7 (28,6) | 0,079 |
2 | 11/38 (28,9) | 5/7 (71,4) | ||
Морфологические изменения в интерстиции эндокарда МЖП в группах пациентов | ||||
Тромбы на эндокарде | 2/38 (5,3) | 0 (0) | >0,999 | |
Утолщение эндокарда | 9/38 (23,7) | 3/6 (50) | 0,321 | |
Склероз эндокарда | 23/38 (60,5) | 4/6 (66,7) | >0,999 | |
Инфильтрация лимфоцитами эндокарда | 2/38 (5,3) | 2/6 (33,3) | 0,083 | |
Эозинофилы в эндокарде | 2/38 (5,3) | 0 (0) | >0,999 | |
Липоматоз в эндокарде | 7/38 (18,4) | 1/6 (16,7) | >0,999 | |
Гиалиноз в эндокарде | 0 (0) | 1/6 (16,7) | 0,136 | |
Фиброз в эндокарде | 0 (0) | 1/7 (14,3) | 0,148 | |
Морфологические изменения миокарда МЖП в группах пациентов | ||||
Гипертрофия миокарда | 37/38 (97,4) | 6/6 (100) | >0,999 | |
Исчезновение поперечной исчерченности миокарда | 10/38 (26,3) | 1/6 (16,7) | >0,999 | |
Полосы пересокращения в миокарде | 28/38 (73,7) | 4/6 (66,7) | 0,657 | |
Дистрофия кардиомиоцитов | 26/38 (68,4) | 2/6 (33,3) | 0,169 | |
Некроз/миолиз/апоптоз кардиомиоцитов | 12/38 (31,6) | 1/6 (16,7) | 0,652 | |
Липофусцин в кардиомиоцитах | 15/38 (39,5) | 3/6 (50) | 0,676 | |
Исчезновение/лизис ядер кардиомиоцитов | 21/38 (55,3) | 5/6 (83,3) | 0,375 | |
Перинуклеарный цитолиз кардиомиоцитов | 12/35 (34,3) | 0 (0) | 0,298 | |
Жировая дистрофия в кардиомиоцитах | 6/38 (15,8) | 0 (0) | 0,573 | |
Кариопикноз/кариорексис в кардиомиоцитах | 1/38 (2,6) | 0 (0) | >0,999 | |
Морфологические изменения в интерстиции МЖП в группах пациентов | ||||
Расширение интерстиция | 6/38 (15,8) | 2/6 (33,3) | 0,296 | |
Отек интерстиция | 7/38 (18,4) | 1/6 (16,7) | >0,99 | |
Перимускулярный склероз интерстиция | 24/38 (63,2) | 3/6 (50) | 0,661 | |
Периваскулярный склероз интерстиция | 24/38 (63,2) | 1/6 (16,7) | 0,070 | |
Очаговый склероз интерстиция | 3/38 (7,9) | 0 (0) | >0,999 | |
Инфильтрация 10-13 клеток в интерстиции | 3/38 (7,9) | 1/6 (16,7) | 0,456 | |
Инфильтрация >14 лимфоцитов в интерстиции | 28/38 (73,7) | 4/6 (66,7) | 0,657 | |
Морфологические изменения в cосудах МЖП в группах пациентов | ||||
Васкулит | 2/35 (5,7) | 0 (0) | >0,999 | |
Набухание эндотелия сосудов | 17/35 (48,6) | 3/4 (75) | 0,605 | |
Склероз сосудов | 4/35 (11,4) | 1/4 (25) | 0,436 | |
Тромбоз сосудов | 1/35 (2,9) | 0 (0) | >0,999 | |
Примечание: ЛВ — легочные вены, МЖП — межжелудочковая перегородка.
Таблица 3
Титры антикардиальных антител в группах пациентов
Антитела (титр) | I группа (пациенты без рецидивов после изоляции ЛВ) | II группа (пациенты с рецидивами после изоляции ЛВ) | p | |
Антитела к ядрам кардиомиоцитов, n (%) | 0 | 44 (75,9) | 6 (85,7) | 0,555 |
1:40 | 2 (3,4) | 0 (0) | ||
1:80 | 8 (13,8) | 1 (14,3) | ||
1:160 | 4 (6,9) | 0 (0) | ||
Антитела к эндотелию, n (%) | 0 | 10 (17,2) | 1 (14,3) | 0,608 |
1:20 | 2 (3,4) | 1 (14,3) | ||
1:40 | 3 (5,2) | 1 (14,3) | ||
1:80 | 12 (20,7) | 1 (14,3) | ||
1:160 | 11 (19) | 1 (14,3) | ||
1:320 | 18 (31) | 1 (14,3) | ||
>1:320 | 2 (3,4) | 1 (14,3) | ||
Антитела к кардиомиоцитам, n (%) | 1:20 | 4 (6,9) | 0 (0) | 0,839 |
1:40 | 18 (31) | 2 (28,6) | ||
1:80 | 23 (39,7) | 5 (71,4) | ||
1:160 | 11 (19) | 0 (0) | ||
1:320 | 2 (3,4) | 0 (0) | ||
Антитела к гладкой мускулатуре, n (%) | 1:20 | 1 (1,7) | 0 (0) | 0,084 |
1:40 | 13 (22,4) | 4 (57,1) | ||
1:80 | 23 (39,7) | 2 (28,6) | ||
1:160 | 13 (22,4) | 1 (14,3) | ||
1:320 | 8 (13,8) | 0 (0) | ||
Антитела к проводящей системе сердца, n (%) | 1:80 | 10 (17,2) | 6 (85,7) | 0,003 |
1:160 | 18 (31) | 0 (0) | ||
1:320 | 26 (44,8) | 1 (14,3) | ||
>1:320 | 4 (6,9) | 0 (0) | ||
Примечание: ЛВ — легочные вены.
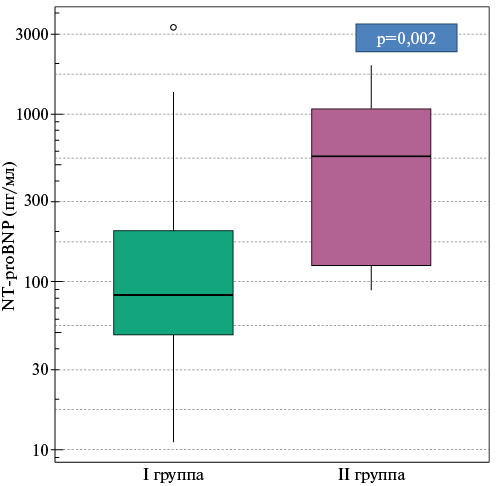
Рис. 5 Концентрация NT-proBNP в группах пациентов.
Обсуждение
В настоящей работа была поставлена цель изучить маркеры воспаления, антикардиальные антитела и морфологические изменения миокарда в качестве потенциальных предикторов рецидивирования ФП после успешной катетерной изоляции ЛВ.
В настоящее время "портрет" потенциального ответчика на изоляцию устьев ЛВ отчетливо не сформирован. Даже в рамках одного и того же центра эффективность процедуры у пациентов со стандартными на сегодняшний день показаниями к вмешательству разная. Такая ситуация требует изучения дополнительных звеньев патогенеза ФП и верификации предикторов эффективности (или, наоборот, неэффективности) изоляции ЛВ.
Можно полагать, что более точное понимание патофизиологии ФП позволит улучшить отбор пациентов для катетерного лечения. Действительно, в течение последнего десятилетия активно изучается роль воспалительных процессов в возникновении и поддержании ФП. Изучение различных звеньев воспаления и их влияния на миокард предсердий нашло свое отражение в теории атриопатии (предсердной кардиомиопатии) [6]. Она объединяет в себе различные формы и степени протекания воспаления — от бессимптомных каскадов на уровне кардиомиоцитов под влиянием всевозможных факторов (острые воспалительные заболевания и т.д.) до уже произошедших структурных гистологических изменений (фиброз миокарда), не разделяя эти процессы [6-8].
Морфологические изменения миокарда давно являются предметом интереса исследователей. В гистологических (биопсия и аутопсия) исследованиях [9][10] было показано, что замещение кардиомиоцитов фиброзными волокнами — одно из основных проявлений структурного ремоделирования миокарда предсердий.
В исследовании Frustaci А, et al. [11] были исследованы пациенты с идиопатической ФП, изучался предсердный гистологический субстрат ФП в сопоставлении с изменениями в биоптатах правого и левого желудочков у пациентов с ФП, резистентной к стандартной антиаритмической терапии. У всех пациентов предсердная биопсия выявила отклонения от нормы, но гистологические находки варьировали: у 66% пациентов изменения соответствовали диагнозу миокардита, у 17% пациентов — кардиомиопатии невоспалительного генеза, еще у 17% был выявлен очаговый фиброз. По мнению авторов, в независимости от происхождения, воспалительный процесс в предсердном миокарде с высокой степенью вероятности является главной причиной предсердной тахикардии и ФП.
Таким образом, данные литературы демонстрируют, что в миокарде пациентов с ФП стабильно выявляются различные гистологические изменения, соответствующие тем или иным морфологическим диагнозам. Результаты, полученные в настоящем исследовании, также это подтверждают.
В настоящем исследовании большое количество различных морфологических изменений, ряд из которых (наличие >14 лимфоцитов на 1 мм2, выявление разной степени фиброза, участков некроза) могут указывать на наличие пограничного и хронического миокардита у части пациентов, не обладающих выраженной коморбидностью.
В представленной работе не удалось выделить четких предикторов рецидива ФП среди морфологических изменений, соответствующих диагнозу миокардит. Однако были продемонстрированы весьма логичные находки: в частности, фиброз МЖП 2 ст. ассоциировался с увеличением шанса рецидива ФП в среднем в 6 раз, а инфильтрация лимфоцитами эндокарда МЖП — с тенденцией к увеличению шанса рецидива ФП, что согласуется с данными литературы [9, 10].
Лабораторные предикторы рецидивирования ФП, косвенно или прямо связанные с воспалительными процессами, также многие годы являются предметом внимания исследователей. Было выявлено, что увеличение концентрации NT-proBNP ассоциируется с двухкратным увеличением шанса рецидива ФВ после изоляции ЛВ. В литературе имеются работы, которые содержат аналогичные результаты. Так, риск выявления бессимптомной фибрилляторной активности достоверно выше у пациентов с исходно повышенным уровнем NT-proBNP [12].
При анализе белков системы протеолиза внеклеточного матрикса данных за влияние отдельно взятых маркеров на риск рецидива ФП нами получено не было. Имеются небольшие исследования, продемонстрировавшие связь отдельных показателей с течением ФП. Так, отмечается, что повышение уровня вчСРБ и ИЛ-6, а также снижение уровня ИЛ-18 коррелирует с увеличением размера ЛП [13][14]. Кроме того, в исследовании Liew R, Khairunnisa K, et al. было показано, что ФНО-α активирует миофибробласты и секрецию ими ММP-2 и ММP-9, что, в свою очередь, активирует продукцию коллагена [15].
В связи с отсутствием в литературе данных, касающихся уже выполненных крупных исследований, и невозможностью сравнить полученные нами результаты по маркерам воспаления с данными других авторов, рассматриваем наше исследование как пилотное для планирования проверки предиктивной способности параметров крови в отношении выявления на дооперационном этапе пациентов с невенозависимой ФП.
Основанием для изучения уровня антикардиальных антител и их предикторной способности в отношения рецидива ФП стали работы Благовой О. В. и др., в которых была продемонстрирована связь между уровнем антител и воспалительным процессом в миокарде. Авторы продемонстрировали диагностическую значимость антикардиальных антител в диагностике миокардита, чувствительность метода составила 84,9%, прогностическая ценность положительного результата — 69,7%, отрицательного — 63,6%. Максимальной специфичностью обладало выявление антител к ядрам кардиомиоцитов в титре 1:160-1:320. При этом диагностическая значимость описана для совокупности всех антикардиальных антител [16].
Результаты нашего анализа выявили обратную взаимосвязь одного из показателей панели антикардиальных антител и рецидивирования ФП: выявлена статистически значимо меньшая концентрация антител к антигенам волокон проводящей системы сердца в группе пациентов, имеющих рецидивы ФП после изоляции ЛВ (p=0,0101), в сравнении с пациентами без рецидивов.
Ранее проведенные работы по схожей тематике не демонстрировали аналогичных результатов. Например, в исследовании Динова Б. А. и др. 2012г [17] изучались группы пациентов детского возраста с различными нарушениями ритма и проводимости сердца. Повышение титра антител (в т.ч. к антигенам проводящей системы) определялось во всех группах.
Интерпретация нашей находки, обратной по смыслу всем имеющимся данным, в настоящее время представляется затруднительной в виду отсутствия опыта изучения данного отдельно взятого показателя. Данное направление требует дальнейшего изучения.
Ограничения исследования. Это одноцентровое исследование с небольшим размером выборки. Ввиду изначально небольшого объема выборки после завершения наблюдения сформировались разные по численности группы. Отсутствие единого рекомендованного протокола, техники по забору гистологического материала в связи с малым мировым опытом проведения эндомиокардиальной биопсии также является ограничением настоящего исследования. Также в ходе статистического анализа и интерпретации результатов обращает на себя внимание, что разные морфологические признаки встречаются в разных сочетаниях у разных больных, что затрудняет выделение отдельных предикторов рецидивирования ФП после изоляции.
Заключение
У подавляющего большинства пациентов с ФП даже без выраженной сопутствующей патологии выявляются морфологические изменения в биоптатах миокарда, соответствующие воспалительному процессу в нем, при этом риск рецидива ФП достоверно не связан у пациентов с признаками воспалительного процесса.
Повышенные уровни NT-proBNP у пациентов до изоляции прогнозируют потенциально более низкую эффективность вмешательства.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Мареев Ю. В., Поляков Д. С., Виноградова Н. Г. и др. ЭПОХА: Эпидемиология фибрилляции предсердий в репрезентативной выборке Европейской части Российской Федерации. Кардиология. 2022;62(4):12-19. doi:10.18087/cardio.2022.4.n1997.
2. Haïssaguerre M, Jaïs P, Shah DC, et al. Spontaneous Initiation of Atrial Fibrillation by Ectopic Beats Originating in the Pulmonary Veins. N Engl J Med. 1998;339(10):659-66. doi:10.1056/nejm199809033391003.
3. Nanthakumar K, Lau YR, Plumb VJ, et al. Electrophysiological findings in adolescents with atrial fibrillation who have structurally normal hearts. Circulation. 2004;110:117-23. doi:10.1161/01.cir.0000134280.40573.D8.
4. Kobayashi Y, Yazawa T, Baba T, et al. Clinical, electrophysiological, and histopathological observations in supraventricular tachycardia. Pacing. Clin Electrophysiol. 1988;11;8:1154-67. doi:10.1111/j.1540-8159.1988.tb03967.x.
5. Морозова М. П., Лукошкова Е. В., Гаврилова С. А. Особенности оценки вариабельности ритма сердца у крыс. Российский физиологический журнал им. И. М. Сеченова. 2015;101(3):291-307. EDN TLUJNH.
6. Coats A, Heymans S, Farmakis D, et al. Atrial disease and heart failure: the common soil hypothesis proposed by the Heart Failure Association of the European Society of Cardiology. Eur Heart J. 2021;00:1-5. doi:10.1093/eurheartj/ehab834.
7. Packer M. Characterization, Pathogenesis, and Clinical Imlications of Inflammation-Related Atrial Myopathy as an Important Cause of Atrial Fibrillation. J Am Heart Assoc. 2020;9:e015343. doi:10.1161/JAHA.119.015343.
8. Shen M, Arora R, Jalife J, et al. Atrial Myopathy. J Am Coll Cardiol Basic Trans Science. 2019;4(5):640-54. doi:10.1016/j.jacbts.2019.05.005.
9. Frustaci A, Caldarulo M, Buffon A, et al. Cardiac biopsy in patients with "primary" atrial fibrillation; Histologic evidence of occult myocardial diseases. Chest. 1991;100(2):303-6. doi:10.1378/chest.100.2.303.
10. Баталов Р. Е., Роговская Ю. В., Рябов В. В. и др. Идиопатическая форма фибрилляции предсердий, воспаление и клинические результаты радиочастотной изоляции. Российский кардиологический журнал. 2014;(12):7-12. doi:10.15829/1560-4071-2014-12-7-12.
11. Frustaci A, Chimenti C, Bellocci F, at al. Histological substrate of atrial biopsies in patients with lone atrial fibrillation. Circulation. 1997;96:1180-4. doi:10.1161/01.cir.96.4.1180.
12. Chua W, Purmah Y, Cardoso V, et al. Data-driven discovery and validation of circulating blood-based biomarkers associated with prevalent atrial fibrillation. Eur Heart J. 2019;21;40(16):1268-76. doi:10.1093/eurheartj/ehy815.
13. Luan Y, Guo Y, Li S, et al. Interleukin-18 among atrial fibrillation patients in the absence of structural heart disease. Europace. 2010;12(12):1713-8. doi:10.1093/europace/euq321.
14. Psychari SN, Apostolou T, Sinos L, et al. Relation of elevated C-reactive protein and interleukin-6 levels to left atrial size and duration of episodes in patients with atrial fibrillation. Am J Cardiol. 2005;95(6):764-7. doi:10.1016/j.amjcard.2004.11.032.
15. Liew R, Khairunnisa K, Gu Y, et al. Role of tumor necrosis factor-α in the pathogenesis of atrial fibrosis and development of an arrhythmogenic substrate. Circ J. 2013;77(5):1171-9. doi:10.1253/circj.cj-12-1155.
16. Благова О., Осипова Ю., Недоступ А. и др. Клинические, лабораторные и инструментальные критерии миокардита, установленные в сопоставлении с биопсийным исследованием миокарда (алгоритм неинвазивной диагностики). Терапевтический архив. 2017;89(9):30-40. doi:10.17116/terarkh201789930-40.
17. Динов Б. А., Куприянова А. Г., Белецкая Л. В. и др. Определение титра антикардиальных антител у детей с заболеваниями сердечно-сосудистой системы. Российский вестник перинатологии и педиатрии. 2012;4(1):70-4.
Об авторах
Е. Н. КалембергРоссия
Калемберг Елена Николаевна — врач-кардиолог.
Москва
К. В. Давтян
Россия
Давтян Карапет Воваевич — доктор медицинских наук, доцент, руководитель отдела нарушений сердечного ритма и проводимости сердца.
Москва
О. В. Благова
Россия
Благова Ольга Владимировна — доктор медицинских наук, профессор кафедры факультетской терапии № 1, кардиолог.
Москва
А. А. Брутян
Россия
Брутян Акоп Альбетович — кандидат медицинских наук, врач рентгенэндоваскулярной диагностики и лечения.
Москва
П. Д. Злобина
Россия
Злобина Полина Дмитриевна — аспирант отдела нарушений сердечного ритма и проводимости.
Москва
М. С. Харлап
Россия
Кандидат медицинских наук, ведущий научный сотрудник отдела нарушений сердечного ритма и проводимости.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Роль воспаления в патогенезе фибрилляции предсердий (ФП) длительно изучается.
- Изучается вопрос по разработке неинвазивных предикторов неэффективности аблации при ФП для улучшения отбора пациентов.
Что добавляют результаты исследования?
- NT-proBNP и некоторые антимиокардиальные антитела имеют потенциал в качестве предикторов рецидива ФП после катетерной изоляции легочных вен.
- Морфологические изменения миокарда (в частности, степень фиброза) прогнозируют рецидив ФП и подтверждают роль воспаления в развитии атриопатии и рецидивировании ФП.
Рецензия
Для цитирования:
Калемберг Е.Н., Давтян К.В., Благова О.В., Брутян А.А., Злобина П.Д., Харлап М.С. Изучение значимости морфологических и лабораторных маркеров в предсказании эффективности криобаллонной изоляции устьев легочных вен при фибрилляции предсердий. Кардиоваскулярная терапия и профилактика. 2023;22(5):3545. https://doi.org/10.15829/1728-8800-2023-3545
For citation:
Kalemberg E.N., Davtyan K.V., Blagova O.V., Brutyan A.A., Zlobina P.D., Kharlap M.S. Value of morphological and laboratory markers in predicting the effectiveness of cryoballoon pulmonary vein isolation in atrial fibrillation. Cardiovascular Therapy and Prevention. 2023;22(5):3545. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3545
JATS XML

























































