Перейти к:
Особенности вариабельности сердечного ритма у пациентов с острым инфарктом миокарда с подъемом сегмента ST, перенесших COVID-19
https://doi.org/10.15829/1728-8800-2023-3688
EDN: MCKRLM
Аннотация
Цель. Сравнительная оценка состояния параметров вариабельности сердечного ритма у больных, перенесших Covid-19, с острым инфарктом миокарда с подъемом ST (ОИМпST) в госпитальный и постгоспитальный периоды лечения.
Материалы и методы. 140 пациентов с ОИМпST рандомизированы на 2 группы: I - основная - пациенты с ОИМпST, переносившие Covid-19 (52 человека) в период от 1,5-6 мес. до развития острого коронарного синдрома (ОКС), II - группа сравнения (88 человек), в которую вошли пациенты с ОИМпST, не переносившие Covid-19. Всем пациентам выполнялось ЧКВ со стентированием инфаркт-связанной артерии в первые 24 часа от начала ангинозного синдрома. Параметры вариабельности ритма сердца (ВРС) всем пациентам определялись на 2-3 сут., 9-11 сут. и через 6 мес. от момента госпитализации по поводу ОИМпST.
Результаты.
У пациентов в основной группе отмечены более выраженные изменения показателей ВРС на 2-3 сут. ОИМпST: значения RMSSD на 21 % (p<0,05), Var на 33 % (p<0,05), VLF на 7 % (p<0,05) были выше, а величины HF на 40% (p<0,05), pNN50% на 66 % (p<0,05), были ниже, чем в контрольной группе, соответственно.
На 9-11 сут. заболевания при ОИМпST и Covid-19 в анамнезе в отличие от контрольной группы выявлено более выраженное увеличение значения SDNN на 46% (p<0,05), VLF на 42% (p<0,05), тогда как в контрольной группе регистрировалось увеличение лишь на 22% и 11% (p<0,05), соответственно. Величина HF в основной группе увеличивалась на 25% (p<0,05), в контрольной уменьшалась на 19 % (p<0,05). Через 6 месяцев после ОИМпST в основной группе выявлено уменьшение величины исследуемых параметров: значение RMSSD сократилось на 19% (p<0,05), Var на 16% (p>0,05), VLF на 30% (p>0,05), LF на 11% (p>0,05), контрольной группе увеличение на 20% (p>0,05), 21% (p>0,05), 9% (p>0,05), и 7% (p>0,05), соответственно.
Заключение.
У больных с ОИМпST, перенесших Covid-19, исходные значения показателей ВРС отличаются от аналогичных параметров ВРС при ОИМпST без Сovid-19 в анамнезе. В госпитальный и постгоспитальный периоды динамика показателей ВРС у больных, переносивших и не переносивших Covid-19, имеет разнонаправленный характер: преобладает выраженная симпатикотония, замедление восстановления ВРС у пациентов, перенесших Covid-19.
Ключевые слова
Для цитирования:
Михин В.П., Осипова О.А., Гиндлер А.И., Брижанева А.С., Заикина Н.В., Заикина М.П., Николенко Т.А., Савельева В.В., Чернятина М.А. Особенности вариабельности сердечного ритма у пациентов с острым инфарктом миокарда с подъемом сегмента ST, перенесших COVID-19. Кардиоваскулярная терапия и профилактика. 2023;22(9):3688. https://doi.org/10.15829/1728-8800-2023-3688. EDN: MCKRLM
For citation:
Mikhin V.P., Osipova O.A., Gindler A.I., Brizhaneva A.S., Zaikina N.V., Zaikina M.P., Nikolenko T.A., Savelyeva V.V., Chernyatina M.A. Heart rate variability in patients with acute ST-segment elevation myocardial infarction after COVID-19. Cardiovascular Therapy and Prevention. 2023;22(9):3688. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3688. EDN: MCKRLM
Введение
Повышение эффективности лечения острого инфаркта миокарда (ОИМ) и профилактики фатальных осложнений по-прежнему остается важной проблемой современной кардиологии [1]. Пандемия новой коронавирусной инфекции (COVID-19 — COrona Virus Disease 2019) внесла существенные особенности в характер течения сердечно-сосудистых заболеваний, что проявилось утяжелением течения гипертонической болезни, снижением эффективности гипотензивных и антиангинальных средств, увеличением частоты тромботических осложнений, приростом числа больных со сложными нарушениями сердечного ритма, вегетативной дисфункцией1 [2]. Перенесенная COVID-19 приводит к декомпенсации уже имеющихся сердечно-сосудистых заболеваний и провоцирует развитие новых сердечно-сосудистых катастроф [3]. Патогенетический механизм влияния COVID-19 на развитие острой коронарной патологии заключается, с одной стороны, в усугублении дисфункции сосудистого эндотелия, в т.ч. и в коронарных артериях, как результат васкулита и его последствий, а с другой ‒ в увеличении риска коронаротромбоза, развитие которого может происходить без манифестации атеросклеротической бляшки [4-6]. Кроме того, вследствие перенесенной COVID-19 в 5-20% случаев у больных имеется постковидное поражение миокарда как проявление перенесенного миокардита [7][8], который в 25-50% случаев на фоне коронавирусной инфекции остается недиагностированным [9]. В результате перенесенной COVID-19 повышается чувствительность миокарда к ишемии, снижается уровень антиоксидантной защиты кардиомиоцитов, что при окклюзии коронарных артерий может приводить к более обширному поражению миокарда в зоне инфаркт-ответственной артерии с частым развитием гемодинамически значимых фатальных аритмий. Предварительные исследования в этой области свидетельствуют о частой встречаемости как желудочковых, так и суправентрикулярных нарушений ритма в постковидный период [10]. В ряде случаев описано повышение агрегационной способности тромбоцитов и склонность к гиперкоагуляции, которые сохраняются на протяжении нескольких месяцев после коронавирусной инфекции [11]. Имеющаяся на этом фоне дисфункция сосудистого эндотелия в постковидный период, продолжающаяся от 4 до 16 мес., может значительно усугублять тяжесть острого коронарного синдрома (ОКС) и способствовать увеличению частоты фатальных и нефатальных осложнений [12][13]. Важную роль в формировании аритмической активности у больных с ОКС, перенесших COVID-19, играет наличие существенного вегетативного дисбаланса в постковидном периоде [2]. Указанные сложные нарушения сердечной деятельности в постковидный период в большей степени являлись предметом изучения при хронических заболеваниях сердечно-сосудистой системы, тогда как исследования особенностей течения острой коронарной патологии у лиц, перенесших COVID-19, носят единичный и предварительный характер.
Развитие ОКС и формирование ОИМ всегда ассоциируются с изменением функциональной активности вегетативной нервной системы, вследствие чего развиваются нарушения нейрогуморальной регуляции, инициирующие аритмическую активность миокарда [14]. По имеющимся на сегодняшний день данным, возникающая при ОИМ симпатикотония является пусковым механизмом увеличения тонуса коронарных артерий, имеющих гемодинамически значимые сужения, обусловленные атеросклерозом, что способствует нарушению перфузии миокарда и атеротромбозу. Указанный механизм повреждения кардиомиоцитов приводит к электрической нестабильности миокарда и провоцирует возникновение жизнеугрожающих аритмий [15].
Одним из информативных критериев прогностической оценки эффективности реабилитации больных ОИМ может служить вариабельность ритма сердца (ВРС) — неинвазивный метод оценки степени вегетативной дисфункции [16]. Оценка характера ВРС, к сожалению, в настоящее время не находит широкого применения в клинической практике в силу трудоемкости исследования, хотя ее прогностическая значимость доказана, т.к. ВРС позволяет оценивать адаптацию организма к изменениям внешней и внутренней среды, определять нарушения функциональных резервов организма и судить о наличии дисбаланса симпатическо-парасимпатической систем. Отдельные параметры ВРС могут служить прогностическими критериями характера течения и осложнений заболевания в ранний и отдаленный периоды ОИМ [17]. Особенности ВРС у пациентов с ОИМ, перенесших COVID-19, недостаточно изучен, в связи с чем оценка параметров ВРС у больных ОКС, перенесших COVID-19, представляется крайне актуальной задачей клинической кардиологии [18].
Цель исследования — провести сравнительную оценку состояния параметров ВРС у больных, перенесших COVID-19, с ОИМ с подъемом ST (ОИМпST) в госпитальный и постгоспитальный периоды лечения.
Материал и методы
В исследование, проведенное в период с октября 2019 по октябрь 2021гг, включены 140 пациентов с ОИМпST в возрасте от 42 до 66 лет (55,1±8,95 лет; мужчин — 121, женщин — 19). Диагноз ОИМпST верифицировался по наличию типичных изменений на электрокардиограмме, клинической картине и динамике маркеров некроза миокарда в крови (КФК-МВ — креатинфосфокиназа сердечной мышцы, тропонин Т). Всем пациентам выполнялось чрескожное коронарное вмешательство (ЧКВ) со стентированием единственной инфаркт-связанной артерии (ИСА) в первые 24 ч от начала ангинозного синдрома. В исследование вошли пациенты, госпитализированные в первые 2,5 ч от начала ангинозного синдрома, 12,0% пациентов (17 чел.), в первые 2,5-6 ч — 48,0% (67 чел.), в первые 6-12 ч — 30,0% (42 чел.), в первые 12-24 ч — 10% (14 чел.). Критерии включения: ОИМпST давностью до 24 ч, ЧКВ со стентированием исключительно ИСА, синусовый ритм. Критерии невключения: наличие острой COVID-19 и положительного теста по полимеразной цепной реакции на COVID-19, повторный ОИМ, ЧКВ в анамнезе, заболевания опорно-двигательной системы, последствия острого нарушения мозгового кровообращения с выраженным неврологическим дефицитом, операция аортокоронарного шунтирования в анамнезе, тяжелые заболевания печени и почек, сопровождающиеся хронической болезнью почек III-V стадии, хроническая обструктивная болезнь легких, бронхиальная астма, хроническая сердечная недостаточность II-III стадии, сахарный диабет 1 типа. Часть больных, включенных в исследование (пациенты I группы), перенесли COVID-19, осложнившийся пневмонией с лучевой характеристикой по компьютерной томографии (КТ) 1-2, в период от 1,5 до 6 мес. до начала ОКС. Верификация COVID-19 проходила в соответствии с временными методическими рекомендациями Минздрава России, 8-9 версии2. Все пациенты, перенесшие коронавирусную инфекцию, имели лабораторно подтвержденную методом полимеразной цепной реакции коронавирусную пневмонию с лучевой характеристикой КТ 1-2. По данным амбулаторной карты, а также анамнеза у пациентов, перенесших COVID-19 до развития ОКС, отсутствовали признаки как перенесенного, так и активного миокардита в соответствии с критериями клинических рекомендаций Минздрава России [19]; также не регистрировались явления продолжающегося симптоматического COVID-19 и постковидного синдрома (затрудненное дыхание или одышка, учащенное сердцебиение или нарушения сердечного ритма, боли в области сердца)3.
Пациенты, включенные в исследование, были разделены на 2 группы: I — основная — пациенты с ОИМпST, переносившие COVID-19 (n=52), II — группа сравнения (n=88), в которую вошли пациенты, отвечающие критериям включения/невключения, но не имеющие COVID-19 в анамнезе, что подтверждалось отсутствием упоминания о перенесенном COVID-19 в амбулаторной карте и отсутствием информации о пациенте в федеральном регистре лиц, больных COVID-19.
Стратифицирующими факторами были пол (мужской и женский) и возрастная группа пациентов (до 50 лет, 50-59 лет, ≥60 лет), что образовывало 6 разных комбинаций, т.е. виртуальных стратификационных групп. В каждую из вышеназванных 6 стратификационных групп включались одинаковые доли пациентов, перенесших COVID-19, и не имевших COVID-19 в соотношении 2:3 (указанное соотношение было установлено в результате пилотного исследования первых 20 поступающих в сосудистый центр в потоке пациентов), что обеспечивало сопоставимую структуру итоговой основной группы и группы сравнения по всем комбинациям стратифицирующих факторов и достижение адекватной стратификации в двух сопоставляемых итоговых группах (таблица 1). Мы не добивались с помощью специальных методов стратификации одинакового долевого соотношения пациентов по признаку инфаркт-связанной артерии (передняя нисходящая артерия — ПНА, правая коронарная артерия — ПКА, огибающая артерия — ОА), однако после набора основной и сравниваемой групп долевое соотношение по локализации инфаркт-связанной артерии (ПНА, ПКА, ОА) составляло 2:2:1 = как в основной группе, так и в группе сравнения. В исследование были включены пациенты с различной степенью тяжести инфаркта: Killip II-IV класса, по шкале GRACE (Global Registry of Acute Coronary Events) при поступлении — от средней до тяжелой степени (>126 баллов) [20].
Таблица 1
Клинико-инструментальная характеристика пациентов,
включенных в исследование
Показатель | ОИМпST c предшествующим COVID-19 (n=52) | ОИМпST без предшествующего COVID-19 (n=88) | p |
Возраст средний (лет), M±SD | 55,2± 6,3 | 56,6±7,1 | 0,872 |
Возраст 42-49 лет, n (%) | 15 (29%) | 26 (29,5%) | 0,996 |
Возраст 50-59 лет, n (%) | 19 (36,5%) | 33 (37,5%) | 0,994 |
Возраст >60 лет, n (%) | 18 (34,5%) | 29 (33%) | 0,982 |
Мужчины, n (%) | 44 (84,7%) | 77 (87,5%) | 0,985 |
Женщины, n (%) | 8 (15,3%) | 11 (12,5%) | 0,558 |
Рост (см), M±SD | 171±9 | 173±10 | 0,238 |
Вес (кг), Me [ Q25;Q75] | 89 [ 78;98] | 92 [ 80;100] | 0,143 |
Гипертоническая болезнь, n (%) | 36 (69,2%) | 59 (67,1%) | 0,989 |
Сахарный диабет, n (%) | 8 (15,4%) | 13 (14,7%) | 0,988 |
Кардиогенный шок, n (%) | 3 (5,8%) | 6 (6,8%) | 0,982 |
Острая левожелудочковая недостаточность, n (%) | 4 (7,7%) | 7 (8%) | 0,995 |
Сохраненная ФВ ЛЖ (≥50%)*, n (%) | 10 (19,2%) | 16 (18,2%) | 0,884 |
Промежуточная ФВ ЛЖ (40-49%)*, n (%) | 29 (55,7%) | 48 (54,5%) | 0,890 |
Низкая ФВ ЛЖ (<40%)*, n (%) | 13 (25,1%) | 24 (27,3%) | 0,775 |
ХСН 0 стадии**, n (%) | 22 (42,3%) | 36 (40,9%) | 0,871 |
ХСН I стадии**, n (%) | 30 (57,7%) | 52 (59,1%) | 0,871 |
Время симптом-баллон <2,5 ч, n (%) | 5 (9,6%) | 8 (9,1%) | 0,922 |
Время симптом-баллон 2,5-6 ч, n (%) | 23 (44,2%) | 41 (46,5%) | 0,792 |
Время симптом-баллон 6-12 ч, n (%) | 17 (32,7%) | 27 (30,6%) | 0,797 |
Время симптом-баллон 12-24 ч, n (%) | 7 (13,5%) | 12 (13,8%) | 0,960 |
Тромболитическая терапия, n (%) | 23 (44,2%) | 39 (44,3%) | 1,0 |
Фибрилляция желудочков, n (%) | 1 (1,9%) | 2 (2,2%) | 0,990 |
ИСА — ПНА, n (%) | 22 (42,3%) | 38 (43,2%) | 0,995 |
ИСА — ПКА, n (%) | 20 (38,5%) | 34 (38,6%) | 0,999 |
ИСА — ОА, n (%) | 10 (19,2%) | 16 (18,2%) | 0,832 |
Примечание: * — параметры исследовались на 2 сут. заболевания,
** — предшествовала ОКС и определялась по анамнезу
и данным амбулаторной карты.
ИСА — инфаркт-связанная артерия,
ОА — огибающая артерия,
ОИМпST — острый инфаркт миокарда с подъемом сегмента ST,
ПКА — правая коронарная артерия,
ПНА — передняя нисходящая артерия,
ФВ ЛЖ — фракция выброса левого желудочка,
ХСН — хроническая сердечная недостаточность,
COVID-19 — COrona Virus Disease 2019
(новая коронавирусная инфекция 2019г).
Лечение пациентов с ОИМпST включало догоспитальную тромболитическую терапию (проурокиназа, алтеплаза, стафилокиназа) и ЧКВ. Тромболитическая терапия (ТЛТ) была выполнена у пациентов в тех случаях, когда предполагаемое время от момента постановки диагноза ОКСпST до введения проводника в коронарную артерию превышало 2,5 ч — в 44,8% случаев от общего числа больных (в I группе — 44,2%, во II группе — 45,4%), из них в 46,9% случаев она была эффективна: в I группе — 47,8%, во II группе — 46,1% [20]. В обеих группах всем пациентам выполнялось ЧКВ со стентированием единственной ИСА: ПНА — 42,3% в группе I, 43,2% в группе II, ПКА — 38,5% и 38,6%, ОА — 19,2% и 18,2%, соответственно. Реваскуляризация выполнялась в первые 40-60 мин от момента госпитализации у пациентов с ОИМпST без предшествующей ТЛТ: 29 (55,8%) пациентов в основной, 49 (55,7%) пациентов в контрольной группе (р=0,990). У больных с предшествующей ТЛТ при наличии продолжающейся или с симптомами рецидивирующей ишемии миокарда, кардиогенного шока, острой сердечной недостаточности, жизнеугрожающих нарушений ритма сердца реперфузионная терапия выполнялась в первый час от момента поступления в ЧКВ-центр. Указанные состояния наблюдались у 10 (19,2%) пациентов в основной, у 18 (20,5%) пациентов в контрольной группе (р=0,852). При наличии успешной ТЛТ реперфузионная терапия выполнялась в сроки 2-6 ч от момента окончания ТЛТ [20] при условии отсутствия рецидивирования ангинозного синдрома: 13 (25,0%) человек в основной, 21 (23,8%) человек в контрольной группе (р=0,873).
Фармакотерапия пациентов в обеих группах не различалась и включала: наркотические и ненаркотические анальгетики, антиагреганты (ацетилсалициловая кислота, клопидогрел (на догоспитальном этапе) с дальнейшей эскалацией дезагрегантной терапии на тикагрелор), нефракционированный гепарин, низкомолекулярный гепарин, селективные β-блокаторы, статины (аторвастатин 80-40 мг), ингибиторы ангиотензинпревращающего фермента или валсартан, амлодипин, при показаниях и/или развитии явлений сердечной недостаточности — антагонисты альдостероновых рецепторов (спиронолактон или эплеренон), петлевые диуретики и нитраты (таблица 2). У пациентов с фатальными аритмиями лечение дополнялось амиодароном, при наличии кардиогенного шока лечение включало допамин, норэпинефрин [20]. Дозовые режимы β-блокаторов определялись достижением целевой частоты сердечных сокращений и/или антиаритмической эффективностью. После выписки из стационара пациенты продолжали прием β-блокаторов, статинов, двойной дезагрегантной терапии, ингибиторов ангиотензинпревращающего фермента или валсартана, при показаниях — антагонистов альдостероновых рецепторов, петлевой диуретик. При выписке у пациентов явлений постинфарктной стенокардии и декомпенсации хронической сердечной недостаточности не наблюдалось.
Таблица 2
Фармакотерапия пациентов с ОИМпST
Наименование препарата | Суточная доза препарата | Суточная доза препарата | Суточная доза препарата |
Ацетилсалициловая кислота | 75-100 мг | 75-100 мг | 75-100 |
Клопидогрел | 75 мг | 0 мг | 0 мг |
Тикагрелор | 180 мг | 180 мг | 180 мг |
Бисопролол | 1,25-5 мг | 2,5-7,5 мг | 2,5-10 мг |
Метопролола тартрат | 25-75 мг | 50-125 мг | 75-200 мг |
Аторвастатин | 80 мг | 80 мг | 40-80 мг |
Гепарин | 20-28 тыс. МЕ | 0 МЕ | 0 МЕ |
Эноксапарин | 1,2-1,8 тыс. антиXa МЕ | 0 МЕ | 0 МЕ |
Лизиноприл | 1,25-2,5 мг | 1,25-10 мг | 5-10 мг |
Рамиприл | 1,25-2,5 мг | 2,5-5 мг | 2,5-10 мг |
Валсартан | 20-80 мг | 80-160 мг | 80-320 мг |
Спиронолактон | 25-50 мг | 25-50 мг | 25-50 мг |
Эплеренон | 25-50 мг | 25-50 мг | 25-50 мг |
Фуросемид | 80-160 мг | 40-60 мг | 40 мг |
Амлодипин | 2,5-5 мг | 5-10 мг | 5-10 мг |
Нитроглицерин | 0,5 мг | 50-150 мг | 0 мг |
Амиодарон | 300-600 мг | 300-600 мг | 0 |
Допамин | 5-10 мг | 0 | 0 |
Норэпинефрин | 2-4 мг | 0 | 0 |
Примечание: ОИМпST — острый инфаркт миокарда с подъемом сегмента ST.
Исследование не закончили 2 пациента по причине смертельного исхода, оба пациента входили в контрольную группу: первый пациент умер на 10 сут. заболевания по причине рецидивирующей фибрилляции желудочков, второй пациент умер на 42 сут. заболевания по причине развития ишемического инсульта.
Методы обследования включали суточное мониторирование электрокардиограммы (монитор Кардиотехника, "Инкарт", Россия) на 2-3 сут. (первая контрольная точка), 9-11 сут. (вторая контрольная точка), через 6 мес. (третья контрольная точка) от момента госпитализации по поводу ОИМпST. Исследовались следующие параметры.
- Неспектральные (временные) показатели:
- SDNN — стандартное отклонение полного массива кардиоинтервалов RR (норма=30-100 мс);
- RMSSD — √ среднеквадратического отклонения последовательных RR-интервалов (норма=20-50 мс);
- рNN50 — отношение числа последовательных пар RR-интервалов, отличающихся на >50 мс, к общему числу RR-интервалов (норма=6,3±0,8%);
- SDANN — стандартное отклонение усредненных нормальных синусовых интервалов R-R всех 5-минутных периодов за все время наблюдения (норма=92-162 мс);
- VAR-вариация — разница между минимальным и максимальным RR-интервалом, мс;
- Спектральные (частотные) показатели:
- HF, мс² — суммарная мощность высокочастотного компонента ВРС (норма=975±203 мс² );
- LF, мс² — суммарная мощность низкочастотного компонента ВРС (норма=1170±416 мс² );
- VLF, мс² — суммарная мощность очень низкочастотного компонента ВРС (норма=1542±145 мс²) [21].
Используемые в работе референтные значения параметров ВРС соответствовали национальным рекомендациям [21].
Статистический анализ полученных результатов исследования выполнен с использованием Statistica 12.0. Характер распределения выборки оценивался по критерию Шапиро-Уилка. Данные представлены в виде медианы (Me) и интерквартильного размаха [ Q25;Q75]. При статистической обработке использовались методы как параметрической, так и непараметрической статистики. Уровень статистической значимости различий между частотами бинарных и других качественных показателей в сравниваемых группах определяли с помощью специальной модификации параметрического t-критерия Стьюдента с учетом arcsin-преобразования Фишера. Достоверность различий между количественными признаками в сравниваемых группах оценивался по критерию Манна-Уитни, критерию Вилкоксона (для парного сравнения групп) с учетом поправки Бонферрони. Статистическую оценку достоверности динамики показателей определяли по t-критерию Стьюдента для парных измерений. Уровнем критической значимости (р) считали значения <0,05.
Настоящее исследование выполнено в соответствии этическими принципами согласно положения Хельсинкской декларации; включение пациентов проводилось после подписания каждым из них добровольного информированного согласия. Дизайн исследования одобрен комитетом по этике при ФГБОУ ВО "Курский государственный медицинский университет" Минздрава России (протокол № 11 от 10.12.2018).
Результаты
Оценка исходных значений ВРС у включенных в исследование больных (таблица 3) показала, что на 2-3 сут. ОИМпST величина SDNN в обеих группах находилась в пределах референсных значений. На 9-11 сут. ОИМпST у пациентов основной группы выявлено более выраженное увеличение уровня SDNN на 46% (p=0,005), тогда как в контрольной группе прирост составил лишь 22% (p=0,004). К 6 мес. после ОИМпST уровень SDNN снижался в обеих группах в равной степени, однако превышал исходные значения на 29% (p=0,012) и 33% (p=0,001), соответственно (рисунок 1). Абсолютные значения SDNN у больных, перенесших COVID-19, были ниже, чем у пациентов, не переносивших COVID-19 (p=0,003) (таблица 3).
Таблица 3
Величина параметров ВРС у пациентов с ОИМпST
в госпитальный и постгоспитальный периоды лечения (Me [ Q25;Q75])
Показатель | Сроки оценки параметров ВРС | Группы больных | |
ОИМпST c предшествующим COVID-19 | ОИМпST без предшествующего COVID-19 | ||
SDNN, мс | 2-3 сут. | 80,0 [ 66,0;139,0] *р=0,197 | 86,5 [ 65,5;108,5] *р=0,197 |
9-11 сут. | 149,0 [ 97,0;190,0] ✓р=0,005 *р=0,021 | 111,0 [ 91,0;140,0] ✓р=0,004 *р=0,021 | |
6 мес. | 112,0 [ 105,0;123,0] ✓р=0,012 *р=0,003 | 130,0 [ 108,0;166,0] ✓р=0,001 *р=0,003 | |
RMSSD, мс | 2-3 сут. | 31,0 [ 20,0;45,0] *р=0,027 | 24,5 [ 20,0;35,0] *р=0,027 |
9-11 сут. | 44,0 [ 22,0;212,0] ✓р=0,026 *р=0,005 | 24,0 [ 19,0;33,0] ✓р=0,938 *р=0,005 | |
6 мес. | 26,0 [ 21,0;30,0] ✓р=0,009 *р=0,022 | 31,0 [ 20,0;45,0] ✓р=0,006 *р=0,022 | |
рNN50, % | 2-3 сут. | 1,0 [ 0,0;13,0] *p=0,399 | 3,0 [ 1,0;7,5] *p=0,399 |
9-11 сут. | 6,0 [ 1,0;16,0] ✓р=0,009 *р=0,402 | 3,0 [ 1,0;7,0] ✓р=1,000 *р=0,402 | |
6 мес. | 4,0 [ 3,0;5,0] ✓р=0,011 *р=0,887 | 4,5 [ 2,0;9,5] ✓р=0,006 *р=0,887 | |
SDANN, мс | 2-3 сут. | 64,5 [ 50,0;96,0] *р=0,857 | 66,0 [ 44,0;80,0] *р=0,857 |
9-11 сут. | 95,0 [ 82,0;125,0] ✓р=0,005 *р=0,557 | 97,0 [ 75,0;127,0] ✓р=0,007 *р=0,557 | |
6 мес. | 99,0 [ 83,5;146,0] ✓р=0,902 *р=0,795 | 113,0 [ 91,0;149,0] ✓р=0,029 *р=0,795 | |
Var, мс | 2-3 сут. | 1260,0 [ 914,0;2257,0] *р=0,029 | 848,5 [ 726,0;1110,5] *р=0,029 |
9-11 сут | 1284,0 [ 1175,0;1451,0] ✓р=0,911 *р=0,035 | 1011,0 [ 876,0;1238,0] ✓р=0,003 *р=0,035 | |
6 мес. | 1086,0 [ 976,0;1152,0] ✓р=0,026 *р=0,971 | 1076,0 [ 856,0;1339,0] ✓р=0,018 *р=0,971 | |
VLF, мс | 2-3 сут. | 2055,0 [ 1530,0;6626,0] *р=0,003 | 1902,0 [ 1153,0;2794,5] *р=0,016 |
9-11 сут. | 3545,0 [ 1502,0;9070,0] ✓р=0,031 *р=0,018 | 2142,0 [ 1351,0;3534,0] ✓р=0,022 *р=0,018 | |
6 мес. | 1576,0 [ 1327,0;2114,0] ✓р=0,025 *р=0,008 | 2094,0 [ 1361,0;3301,0] ✓р=0,011 *р=0,008 | |
LF, мс | 2-3 сут. | 809,0 [ 365,0;1818,0] *р=0,825 | 769,5 [ 437,5;1168,0] *р=0,825 |
9-11 сут. | 1986,0 [ 538,0;1634,0] ✓р=0,001 *р=0,020 | 775,0 [ 488,0;1282,0] ✓p=0,791 *р=0,020 | |
6 мес. | 729,0 [ 479,0;1413,0] ✓р=0,023 *р=0,158 | 831,0 [ 506,0;1363,0] ✓р=0,016 *р=0,158 | |
Показатель | Сроки оценки параметров ВРС | Группы больных | |
ОИМпST c предшествующим COVID-19 | ОИМпST без предшествующего COVID-19 | ||
HF, мс | 2-3 сут. | 110,5 [ 61,0;129,0] *р=0,001 | 184,0 [ 106,0;334,0] *р=0,001 |
9-11 сут. | 147,0 [ 97,0;276,0] ✓р=0,007 *р=0,898 | 155,0 [ 88,0;305,0] ✓р=0,030 *р=0,898 | |
6 мес. | 306,0 [ 206,0;441,5] ✓р=0,007 *p=0,033 | 187,0 [ 89,0;291,0] ✓р=0,733 *p=0,033 | |
Примечание: * — достоверность различий между группами ОИМпST без предшествующего COVID-19 и ОИМпST с предшествующим COVID-19.
✓ — достоверность внутригрупповых различий значения параметра
с его исходной величиной.
ОИМпST — острый инфаркт миокарда с подъемом сегмента ST,
ВРС — вариабельность ритма сердца,
COVID-19 — COrona Virus Disease 2019,
HF — суммарная мощность высокочастотного компонента ВРС,
LF — суммарная мощность низкочастотного компонента ВРС,
pNN50% — отношение числа последовательных пар RR-интервалов,
отличающихся более чем на 50 мс, к общему числу RR-интервалов,
RMSSD — корень квадратный среднеквадратического отклонения
последовательных RR-интервалов,
SDANN — стандартное отклонение усредненных нормальных
синусовых интервалов RR всех 5-минутных периодов за все время наблюдения,
SDNN — стандартное отклонение полного массива кардиоинтервалов RR,
Var — разница между минимальным и максимальным RR-интервалом,
VLF — суммарная мощность очень низкочастотного компонента ВРС.
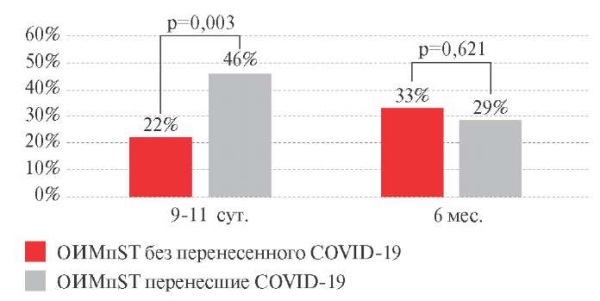
Рис. 1 Динамика стандартного отклонения
полного массива кардиоинтервалов RR (SDNN)
у пациентов с ОИМпST (∆ %).
Примечание: ОИМпST — острый инфаркт миокарда с подъемом сегмента ST,
COVID-19 — COrona Virus Disease 2019,
SDNN — стандартное отклонение полного массива кардиоинтервалов RR.
При включении в исследование величина RMSSD находилась в пределах референсных значений в обеих группах, однако абсолютная величина RMSSD в основной группе была выше на 21% (p=0,027). В госпитальный период наблюдалось увеличение значения RMSSD в основной группе на 29% (p=0,026), тогда как в контрольной группе величина RMSSD не изменялась. К 6 мес. наблюдения изменения уровня RMSSD носили разнонаправленный характер: в основной группе определялось существенное снижение параметра на 19% (p=0,009, в сравнении с исходной величиной), тогда как в контрольной группе значение RMSSD возросло на 20% (p=0,006) (рисунок 2). Абсолютное значение Me RMSSD в основной группе было на 16% ниже (p=0,022), чем в контрольной группе к 6 мес. после ОИМпST.
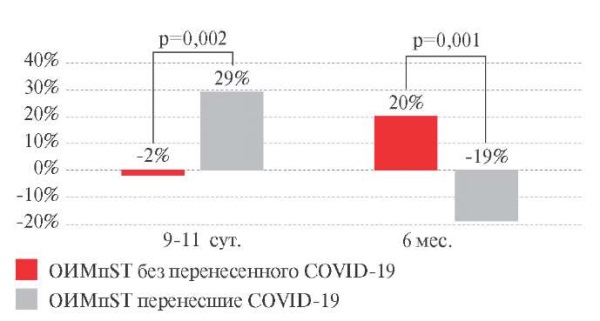
Рис. 2 Динамика √ среднеквадратического отклонения
последовательных RR-интервалов (RMSSD) у пациентов с ОИМпST (∆ %).
Примечание: ОИМпST — острый инфаркт миокарда с подъемом сегмента ST,
COVID-19 — COrona Virus Disease 2019,
RMSSD — корень квадратный среднеквадратического отклонения
последовательных RR-интервалов.
Исходные значения SDANN в обеих группах были ниже референсных значений (таблица 3) и в госпитальный период изменялись однонаправленно: у больных с ОИМпST, перенесших COVID-19, увеличивалось на 32,1% (p=0,005) и в группе больных с ОИМпST, не переносивших COVID-19, на 31,9% (p=0,007) (межгрупповые различия в динамике SDANN к 9-11 сут. отсутствуют) (рисунок 3). Примечательно, что к 9-11 сут. наблюдения величина SDANN достигала уровня референсных значений в обеих группах. К 6 мес. в основной группе значение SDANN сохранялось на достигнутом уровне, а в контрольной группе продолжало увеличиваться: прирост составил 51,6% (p=0,029) в сравнении с исходной величиной (рисунок 3).
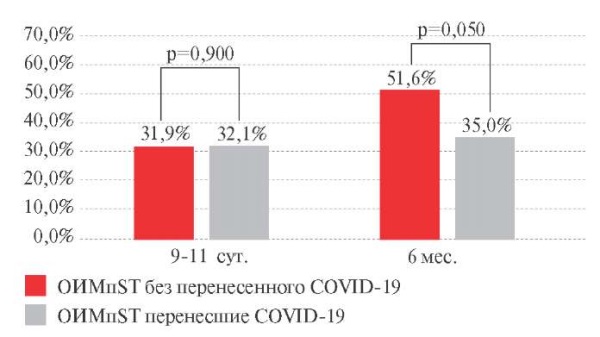
Рис. 3 Динамика стандартного отклонения
усредненных нормальных синусовых интервалов RR
всех 5-минутных периодов за все время наблюдения (SDANN)
у пациентов с ОИМпST (∆ %).
Примечание: ОИМпST — острый инфаркт миокарда с подъемом сегмента ST,
COVID-19 — COrona Virus Disease 2019,
RMSSD — корень квадратный среднеквадратического отклонения
последовательных RR-интервалов.
Оценка исходного уровня pNN50% показала, что эта величина была ниже референсных значений в обеих группах и в госпитальный период (9-11 сут.) изменялась разнонаправленно: увеличивалась на 83% (p=0,009) и достигала референсных значений в основной группе, но оставалась на достигнутом уровне в контрольной группе. К 6 мес. наблюдения изменения уровня pNN50% носили разнонаправленный характер: в основной группе определялось существенное снижение на 50% (p=0,011, в сравнении со второй контрольной точкой), тогда как в контрольной группе значение pNN50% возросло на 33% (p=0,006, в сравнении со второй контрольной точкой). По абсолютным значениям Me pNN50% обе группы достоверно не различались через 6 мес. после ОИМпST (таблица 3).
Исходные значения Var существенно различались: Me в основной группе составила 1260,0 [ 914,0;2257,0], контрольной группе — 848,5 [ 726,0;1110,5]. В госпитальный период наблюдалось увеличение значения Var в контрольной группе на 16% (p=0,003), тогда как в основной группе величина Var не изменялась. К 6 мес. наблюдения изменения уровня Var носили разнонаправленный характер: в основной группе значение Var сократилось на 16% (p=0,026, в сравнении с исходной величиной), тогда как в контрольной группе значение Var продолжало возрастать — на 21% (p=0,018, в сравнении с исходной величиной) (рисунок 4). Следует отметить, что по абсолютным значениям Var достоверных различий между группами в период постгоспитального наблюдения (6 мес.) не выявлено.
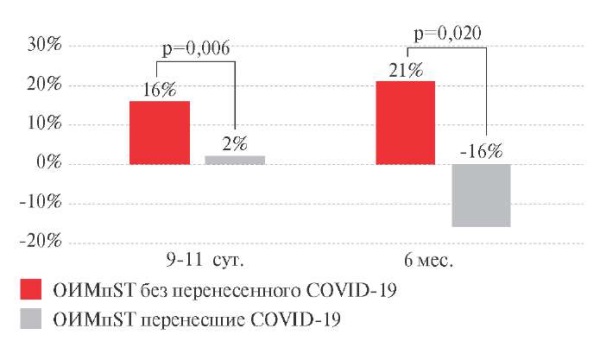
Рис. 4 Динамика вариации (Var) — разницы между минимальным
и максимальным RR-интервалом у пациентов с ОИМпST (∆ %).
Примечание: ОИМпST — острый инфаркт миокарда с подъемом сегмента ST,
COVID-19 — COrona Virus Disease 2019,
Var — разница между минимальным и максимальным RR-интервалом.
Исходные значения VLF в обеих группах были выше референсных (таблица 3). В госпитальный период наблюдалось увеличение величины VLF в основной группе на 42% (p=0,031), тогда как в контрольной группе величина VLF увеличивалась только на 11% (p=0,022). К 6 мес. наблюдения выявлены разнонаправленные изменения уровня VLF в исследуемых группах: в основной группе отмечено существенное снижение на 30% (p=0,025, в сравнении с исходной величиной), в то время как в контрольной группе значение VLF сохранялось на достигнутом уровне (+9% от исходного значения, p=0,011) (рисунок 5). Абсолютные значения VLF в основной группе были на 33% (p=0,023) ниже, чем в контрольной группе через 6 мес. после ОИМпST.
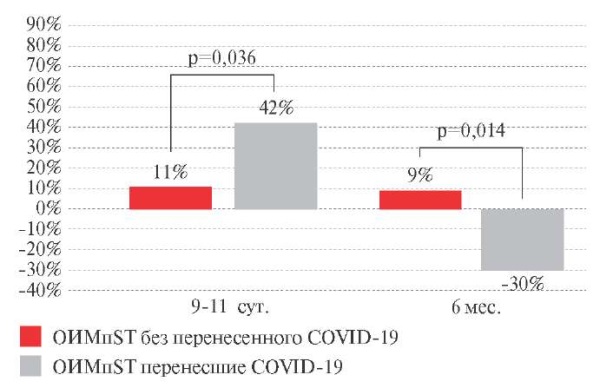
Рис. 5 Динамика суммарной мощности
очень низкочастотного компонента ВРС (VLF)
у пациентов с ОИМпST (∆ %).
Примечание: ВРС — вариабельность ритма сердца,
ОИМпST — острый инфаркт миокарда с подъемом сегмента ST,
COVID-19 — COrona Virus Disease 2019,
VLF — суммарная мощность очень низкочастотного компонента ВРС.
Оценка исходных значений LF ВРС у включенных в исследование больных (таблица 3) показала, что на 2-3 сут. ОИМпST величина LF в обеих группах находилась в пределах референсных значений, достоверные различия между группами отсутствовали. На 9-11 сут. ОИМпST у пациентов основной группы выявлено более выраженное увеличение уровня LF на 59% (p=0,001) и значение LF достигало уровня выше референсных значений, тогда как в контрольной группе не изменялось. К 6 мес. после ОИМпST уровень LF снижался в основной группе на 11% (p=0,023) и достигал уровня ниже референсных значений, тогда как в контрольной группе величина LF увеличивалась на 7% (p=0,016) и находилось в референтных пределах (рисунок 6). Обращает на себя внимание тот факт, что абсолютные значения LF у больных, перенесших COVID-19, были ниже на 12% (p=0,007), чем у пациентов, не переносивших COVID-19 в период постгоспитального наблюдения (таблица 3).
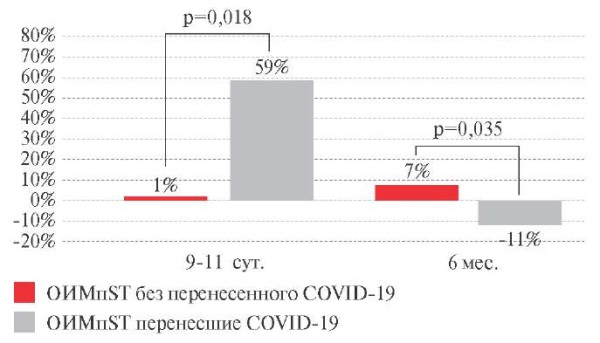
Рис. 6 Динамика суммарной мощности низкочастотного компонента ВСР (LF)
у пациентов с ОИМпST (∆ %).
Примечание: ВРС — вариабельность ритма сердца,
ОИМпST — острый инфаркт миокарда с подъемом сегмента ST,
COVID-19 — COrona Virus Disease 2019,
LF — суммарная мощность низкочастотного компонента ВРС.
При сравнительной оценке показателя HF установлено, что исходная величина HF в основной и контрольной группах была ниже референсных значений, причем у больных с ОИМпST, перенесших СOVID-19, на 33% (p=0,001) ниже, чем у больных с ОИМпST, не переносивших COVID-19 (таблица 3). В госпитальный и постгопитальный периоды наблюдалась разнонаправленная динамика значения HF в обеих группах: величина HF увеличивалась на 25% (р=0,007) и на 64% (p=0,033) в основной группе, соответственно, тогда как в контрольной группе снижалась на 19% (p=0,030), а далее достигала уровня исходного значения, соответственно (рисунок 7). Следует отметить, что через 6 мес. после ОИМпST уровень HF не достигал референтных значений в обеих группах, но в основной группе был значимо выше (на 36%, p=0,029), чем в контрольной группе.
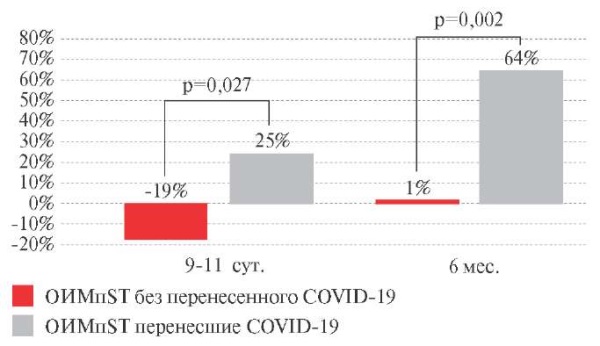
Рис. 7 Динамика суммарной мощности высокочастотного компонента ВСР (HF)
у пациентов с ОИМпST (∆ %).
Примечание: ВРС — вариабельность ритма сердца,
ОИМпST — острый инфаркт миокарда с подъемом сегмента ST,
COVID-19 — COrona Virus Disease 2019,
HF — суммарная мощность высокочастотного компонента ВРС.
Обсуждение
Анализ исходного состояния показателей ВРС и их динамики в госпитальный и постгопитальный периоды наблюдения у пациентов с ОИМпST в обеих группах выявил статистически значимые различия (p<0,05), а характер динамики параметров ВРС зависел от сроков наблюдения и в ряде случаев оказался разнонаправленным. В госпитальный период наблюдения увеличение значения ряда параметров ВРС — SDNN, RMSSD, VLF, LF у пациентов ОИМпST, перенесших COVID-19, было более выражено в сравнении с группой больных без COVID-19 в анамнезе (рисунки 1, 2, 5, 6), однако величина Var в наибольшей степени возрастала в контрольной группе. Различий в динамики SDANN не наблюдалось, в то время как изменения величины HF носили разнонаправленный характер в обеих группах. В постгоспитальный период в контрольной и основной группах регистрировалась разнонаправленная динамика большинства параметров ВРС: RMSSD, Var, LF, а также более выраженный прирост величины VLF и HF в основной группе, в то время как наибольший прирост SDANN отмечался в контрольной группе.
Полученные результаты свидетельствуют о том, что перенесенный COVID-19 у пациентов с ОИМпST, оказывал влияние на характер ВРС при ОКС и развивающемся ОИМ, что, вероятно, обусловлено выраженным вегетативным дисбалансом с преобладанием симпатикотонии и снижением парасимпатического влияния, более значимой активацией гуморальных механизмов, включая ренин-ангиотензиновую систему [22]. Подтверждением симпатикотонии в этом случае служат более выраженные увеличения ВРС в ранний госпитальный период у пациентов с ОИМпST c перенесенным COVID-19: SDNN на 46%, LF на 59%. Более значимое увеличение VLF на 42% у больных основной группы свидетельствует о более выраженной реакции ренин-ангиотензиновой системы. Отсутствие значимого увеличения Var в основной группе в госпитальный период свидетельствует о более выраженной монотонности ритма. Полученные в ходе работы результаты свидетельствуют о снижении парасимпатической активности у пациентов с ОИМпST с перенесенным COVID-19 — более низкое абсолютное значение HF и pNN50% на 2-3 сут. ОИМпST. У лиц, перенесших COVID-19, величина SDNN и LF на 9-11 сут. возрастает в значительно большей степени, превышая референсные значения, в сравнении с динамикой указанных параметров в контрольной группе, где их величины имеют однонаправленный, но менее выраженный прирост, достигая референсных значений. Однако величина SDANN, также характеризующая уровень симпатикотонии, в равной степени возрастала в контрольной и основной группах, достигая лишь референсных значений. Примечательно, что, в отличие от контрольной группы, в основной группе на 9-11 сут. отмечена более выраженная активация парасимпатического тонуса, что подтверждается более высокими значениями RMSSD и более выраженным увеличением HF.
Несмотря на более выраженную динамику показателей ВРС на 9-11 сут. и к 6 мес. наблюдения величина большинства параметров (SDNN, RMSSD, SDANN, VLF, LF) у лиц, перенесших COVID-19, достоверно отличалась от значений указанных показателей у лиц, не переносивших COVID-19. Исключение составляли величины pNN50% и Var, которые как в основной группе, так и в контрольной группе были сопоставимы.
Таким образом, если типичные изменения параметров ВСР при ОИМ, без предшествующей коронавирусной инфекции, заключаются в слабовыраженной симпатикотонии в госпитальный период и более выраженной симпатикотонии в постгоспитальный период4, то у лиц с ОИМ, перенесших COVID-19, наблюдается более выраженная симпатикотония в госпитальный период с дальнейшим нарастанием симпатикотонии в постгоспитальный период.
В работе впервые установлено, что существенное снижение парасимпатического тонуса и достаточно выраженная симпатикотония наблюдается у пациентов с ОИМпST, перенесших коронавирусную инфекцию, на госпитальном и постгоспитальном этапах. Перенесенная коронавирусная инфекция, инициирует активацию симпатической нервной системы, в связи с чем применение β-блокаторов оказывает положительное влияние на восстановление симпатико-парасимпатической регуляции. В связи с этим представляется целесообразным применять более высокие дозы β-блокаторов у пациентов с ОИМпST, перенесших COVID-19, для восстановления симпатико-парасимпатического баланса. Замедление восстановления и адаптации, с одной стороны, и дисбаланс вегетативной нервной системы, с другой, могут способствовать развитию жизнеугрожающих аритмий и фатального исхода [23]. В связи с указанными особенностями восстановления нейрогуморальных механизмов регуляции миокарда, при выборе фармакотерапии на госпитальном и постгоспитальном этапах, повышении ее эффективности, при построении реабилитационных программ и прогнозировании их эффективности у пациентов с ОИМпST, перенесших коронавирусную инфекцию, следует учитывать наличие у них более продолжительного периода выраженной симпатикотонии.
Заключение
Пациенты с ОИМпST, перенесшие COVID-19, в период госпитального лечения имеют более высокие показатели ВРС, характеризующие влияние симпатической регуляции (SDNN, LF), ее нейрогуморального компонента (VLF) и более низкие показатели ВРС, характеризующие парасимпатическую регуляцию (HF, pNN50%).
Перенесенный COVID-19, ассоциируется с разнонаправленным изменением параметров ВРС у пациентов с ОИМпST в первые 6 мес. после коронарного события (снижение величины параметров ВРС: RMSSD, pNN50%, LF, VLF, Var и увеличение HF).
Перенесенная COVID-19, ассоциирована с замедлением восстановления показателей ВРС у пациентов с ОИМпST в первые 6 мес. после коронарного события (более низкие абсолютные значения параметров ВРС: SDNN, RMSSD, SDANN, VLF, LF).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Rajan S, Khunti K, Alwa N, et al. In the wake of the pandemic: Preparing for Long COVID [Internet]. European Observatory on Health Systems and Policies. 2021. PMID: 33877759. ID: NBK569598. URL: https://iris.who.int/bitstream/handle/10665/339629/Policy-brief-39-1997-8073-eng.pdf. https://www.hsdl.org/c/abstract/?docid=857025.
2. Временные методические рекомендации (Версия 8, 9) Минздрава России "Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)" (03.09.2020, 26.10.2020).
3. Rajan S, et al. In the wake of the pandemic: Preparing for Long COVID.
4. Коробова, В.Н. Особенности показателей вариабельности ритма сердца у больных нестабильной стенокардией и острым инфарктом миокарда на фоне госпитальной и постгоспитальной реабилитации. В. Н. Коробова. Молодежь — практическому здравоохранению: Материалы XII Международной научно-практической конференции студентов и молодых ученых-медиков, Тверь, 18 мая 2018 года. — Тверь: государственное бюджетное образовательное учреждение высшего профессионального образования Тверская государственная медицинская академия Министерства здравоохранения Российской Федерации, 2018; С. 506-510.
Список литературы
1. Газарян Г. А., Тюрина Л. Г., Нефедова Г. А. и др. Оптимизация тактики лечения инфаркта миокарда с подъемом сегмента ST в грудных отведениях. Клиническая медицина. 2021;27(4):33947. doi:10.17816/0869-2106-2021-27-4-339-347.
2. Dani M, Dirksen A, Taraborrelli P, et al. Autonomic dysfunction in 'long COVID': rationale, physiology and management strategies. Clin Med (Lond). 2021;21(1):e63-7. doi:10.7861/clinmed.2020-0896.
3. Katsoularis I, Fonseca-Rodríguez O, Farrington P, et al. Risk of acute myocardial infarction and ischaemic stroke following COVID-19 in Sweden: a self-controlled case series and matched cohort study. Lancet. 2021;398(10300):599-607. doi:10.1016/S0140-6736(21)00896-5.
4. Амброзино П., Калькатерра И., Молино А. и др. Стойкая эндотелиальная дисфункция при подостром синдроме COVID-19: исследование "Случай-контроль". Биомедицина. 2021;9(8):957. doi:10.3390/biomedicines9080957.
5. Meizinger C, Klugherz B. Focal ST-segment elevation without coronary occlusion: myocardial infarction with no obstructive coronary atherosclerosis associated with COVID-19-a case report. Eur Heart J Case Rep. 2021;5(2):ytaa532. doi:10.1093/ehjcr/ytaa532.
6. Stefanini GG, Montorfano M, Trabattoni D, et al. ST-Elevation Myocardial Infarction in Patients With COVID-19: Clinical and Angiographic Outcomes. Circulation. 2020;141(25):2113-6. doi:10.1161/CIRCULATIONAHA.120.047525.
7. Сергеева В. А., Липатова Т. Е. Миокардит на фоне COVID-19: клинические особенности и медикаментозное лечение. РМЖ. Медицинское обозрение. 2022;6(1):26-32. doi:10.32364/2587-6821-2022-6-1-26-32.
8. Суджаева С. Г. Вирусный миокардит в условиях пандемии COVID-19. Кардиология в Беларуси. 2022;14(20:206-24. doi:10.34883/PI.2022.14.2.006.
9. Ho JS, Sia CH, Chan MY, et al. Coronavirus-induced myocarditis: A meta-summary of cases. Heart Lung. 2020;49(6):681-5. doi:10.1016/j.hrtlng.2020.08.013.
10. Хазова Е. В., Валиахметов Р. В., Булашова О. В. и др. Нарушения ритма сердца при новой коронавирусной инфекции (COVID-19). Практическая медицина. 2021;19(6):10-3. doi:10.32000/2072-1757-2021-6-10-13.
11. Gu SX, Tyagi T, Jain K, et al. Thrombocytopathy and endotheliopathy: crucial contributors to COVID-19 thromboinflammation. Nat Rev Cardiol. 2021;18(3):194-209. doi:10.1038/s41569-020-00469-1.
12. Ройтман Е.В. Восстановление функции эндотелия при новой коронавирусной инфекции COVID-19 (обзор литературы). Медицинский совет. 2021;(14):78-86. doi:10.21518/2079-701X-2021-14-78-86.
13. Talasaz AH, Kakavand H, Van Tassell B, et al. Cardiovascular Complications of COVID-19: Pharmacotherapy Perspective. Cardiovasc Drugs Ther. 2021;35(2):249-59. doi:10.1007/s10557020-07037-2 .
14. Булгакова С., Булгаков С., Захарова Н. и др. Изменение вариабельности сердечного ритма у пациентов с разными клиническими формами ишемической болезни сердца. Врач. 2017;6:55-7.
15. Kieiger RE. Heart rate variability: measurement and clinical utility. Ann. Noninvasive. Electrocardiol. 2005;10(1):88-101. doi:10.1111/j.1542-474X.2005.10101.x.
16. Бокерия Л. А., Бокерия О. Л., Волковская И. В. Вариабельность сердечного ритма: методы измерения, интерпретация, клиническое использование. Анналы аритмологии. 2009;4:21-32.
17. Михин В. П., Коробова В. Н., Харченко А. В. и др. Значения параметров вариабельности ритма сердца с использованием краткосрочных записей у больных с острой коронарной патологией в условиях госпитальной и постгоспитальной реабилитации. Вестник Волгоградского государственного медицинского университета. 2018;2(66):39-43. doi:10.19163/1994-9480-2018-2(66)-39-43.
18. Сказкина В. В., Попов К. А., Красикова Н. С. Спектральный анализ сигналов вегетативной регуляции кровообращения пациентов с COVID-19 и артериальной гипертензией. Кардио-И Т. 2021;8(2):201. doi:10.15275/cardioit.2021.0201.
19. Арутюнов Г. П., Палеев Ф. Н., Моисеева O. М. и др. Миокардиты у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(11):4790. doi:10.15829/1560-4071-2021-4790.
20. Российское кардиологическое общество (РКО). Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4103. doi:10.15829/29/1560-4071-2020-4103.
21. Макаров Л. М., Комолятова В. Н., Куприянова О. О. и др. Национальные Российские рекомендации по применению методики холтеровского мониторирования в клинической практике. Российский кардиологический журнал. 2014;(2):6-71. doi:10.15829/15604071-2014-2-6-71.
22. Samantha L Cooper, Eleanor Boyle, Sophie R Jefferson, et al. Role of the Renin-Angiotensin-Aldosterone and Kinin-Kallikrein Systems in the Cardiovascular Complications of COVID-19 and Long COVID. Int J Mol Sci. 2021;22(15):8255. doi:10.3390/ ijms22158255.
23. Люсов В. А., Волов Н. А., Гордеев И. Г. и др. Динамика показателей вариабельности ритма сердца в клинике острого периода инфаркта миокарда. Российский кардиологический журнал. 2007;(3):31-5.
Об авторах
В. П. МихинРоссия
Вадим Петрович Михин — доктор медицинских наук, профессор, зав. кафедрой внутренних болезней № 2
Курск
О. А. Осипова
Россия
Ольга Александровна Осипова— доктор медицинских наук, доцент, профессор кафедры госпитальной терапии НИУ БелГУ; ведущий научный сотрудник отдела стратегического развития первичной медико-санитарной помощи, профессор кафедры профилактической кардиологии
Белгород; Москва
А. И. Гиндлер
Россия
Анна И. Гиндлер — зав. кардиологическим отделением для лечения больных с острым инфарктом миокарда
Липецк
А. С. Брижанева
Россия
Анастасия Сергеевна Брижанева. — ассистент кафедры госпитальной терапии
Белгород
Н. В. Заикина
Россия
Наталья Викторовна Заикина — кандидат медицинских наук, зав. отделением функциональной диагностики
Липецк
М. П. Заикина
Россия
Маргарита Павловна Заикина — ординатор кафедры
Москва
Т. А. Николенко
Россия
Тамара Александровна Николенко — кандидат медицинских наук, доцент кафедры внутренних болезней №2
Курск
В. В. Савельева
Россия
Валентина Владимировна Савельева — кандидат медицинских наук, доцент кафедры внутренних болезней №2,
Курск
М. А. Чернятина
Россия
Марина Александровна Чернятина — кандидат медицинских наук, доцент, доцент кафедры внутренних болезней №2
Курск
Что известно о предмете исследования?
- COVID-19 (COrona Virus Disease 2019) сопровождается развитием дисфункции сосудистого эндотелия, дисбалансом вегетативной регуляции, проявляющимся в нарушении вариабельности ритма сердца (ВРС) и метаболизма миокарда. Изменения ВРС в постковидный период являлись предметом изучения при хронических заболеваниях сердечно-сосудистой системы, однако исследования особенностей ВРС при острой коронарной патологии у лиц, перенесших COVID-19, носят единичный и предварительный характер.
Что добавляют результаты исследования?
- При наличии COVID-19 в анамнезе изменения ВРС при остром инфаркте миокарда с подъемом ST (ОИМпST) носят разнонаправленный характер и проявляются в приросте HF и снижении RMSSD, pNN50%, LF, VLF, Var.
- Больные с ОИМпST, перенесшие COVID-19, в отличие от больных без COVID-19 в анамнезе, имеют более выраженную симпатикотонию, проявляющуюся в более выраженном увеличении SDNN, LF, VLF и менее выраженном приросте HF, pNN50%.
- У пациентов с ОИМпST с COVID-19 в анамнезе показано более длительное восстановление параметров ВРС, что проявляется в более низких абсолютных значениях показателей ВРС в первые 6 мес. после острого коронарного события.
Рецензия
Для цитирования:
Михин В.П., Осипова О.А., Гиндлер А.И., Брижанева А.С., Заикина Н.В., Заикина М.П., Николенко Т.А., Савельева В.В., Чернятина М.А. Особенности вариабельности сердечного ритма у пациентов с острым инфарктом миокарда с подъемом сегмента ST, перенесших COVID-19. Кардиоваскулярная терапия и профилактика. 2023;22(9):3688. https://doi.org/10.15829/1728-8800-2023-3688. EDN: MCKRLM
For citation:
Mikhin V.P., Osipova O.A., Gindler A.I., Brizhaneva A.S., Zaikina N.V., Zaikina M.P., Nikolenko T.A., Savelyeva V.V., Chernyatina M.A. Heart rate variability in patients with acute ST-segment elevation myocardial infarction after COVID-19. Cardiovascular Therapy and Prevention. 2023;22(9):3688. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3688. EDN: MCKRLM

























































