Перейти к:
Легочная артериальная гипертензия, ассоциированная с аномалией Абернети II типа у подростка (клинический случай)
https://doi.org/10.15829/1728-8800-2024-3754
EDN: MKKBYP
Аннотация
В статье приведено клиническое описание случая легочной артериальной гипертензии (ЛАГ), ассоциированной с врожденным внепеченочным портокавальным шунтом (ВПКШ), или аномалией Абернети, у пациентки 17 лет. ВПКШ, длительное время остававшийся нераспознанным, манифестировал тяжелой энцефалопатией в раннем возрасте, к 6 годам осложнился ЛАГ, к 9 годам — фокальной нодулярной гиперплазией печени. В отсутствие своевременного хирургического лечения ВПКШ и адекватной терапии ЛАГ прогрессировала. Комбинированная двойная терапия ЛАГ, назначенная лишь в 14 лет, была малоэффективной. Несмотря на потенциал клинического и функционального улучшения, документированный в условиях клиники на фоне комбинированной тройной терапии в 17-летнем возрасте, пациентка продолжала соответствовать критериям высокого риска неблагоприятных событий, включая летальность. Через 2 мес. от момента инициации тройной терапии ЛАГ, в отсутствие достижения целевых значений параметров гемодинамики, позволяющих снизить операционные и периоперационные риски, предпринята попытка хирургического лечения ВПКШ, что привело к гибели пациентки в раннем послеоперационном периоде. Описание данного клинического случая показывает трудности диагностики редкой формы портопульмональной гипертензии, современные возможности медикаментозной терапии тяжелой, на ранних этапах потенциально излечимой формы ЛАГ.
Ключевые слова
Для цитирования:
Миклашевич И.М., Потрохова Е.А., Морозов Д.А., Исаева Ю.С. Легочная артериальная гипертензия, ассоциированная с аномалией Абернети II типа у подростка (клинический случай). Кардиоваскулярная терапия и профилактика. 2024;23(2):3754. https://doi.org/10.15829/1728-8800-2024-3754. EDN: MKKBYP
For citation:
Miklashevich I.M., Potrokhova E.A., Morozov D.A., Isaeva Yu.S. Pulmonary arterial hypertension associated with type II Abernethy malformation in an adolescent: a case report. Cardiovascular Therapy and Prevention. 2024;23(2):3754. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3754. EDN: MKKBYP
Введение
Легочная артериальная гипертензия (ЛАГ) — тяжелое легочно-сердечное заболевание у детей и взрослых. Задача педиатра, терапевта, кардиолога — провести всестороннее обследование для выявления всех возможных состояний и заболеваний, которые могли бы быть причиной ее развития, поскольку воздействие на триггерный фактор может улучшить прогноз заболевания.
Врожденный портокавальный шунт (ВПКШ) — редкая врожденная аномалия развития системы портальной вены, которая сопровождается шунтированием портомезентериальной венозной крови в систему нижней полой вены (НПВ), минуя физиологический клиренс в печени. Продукты метаболизма, содержащиеся в портомезентериальной венозной крови, попадая в правые камеры сердца, затем в легочный кровоток, запускают процесс концентрического ремоделирования легочных сосудов с прогрессирующим повышением легочного сосудистого сопротивления. Состояние может сопровождаться узловым поражением печени, энцефалопатией, метаболическими нарушениями [1][2]. Ассоциация ВПКШ с ЛАГ мало изучена и ограничивается несколькими десятками наблюдений в мире, часто остается нераспознанной [3-5]. Уникальность этого класса ЛАГ − в ее патофизиологии и потенциальной обратимости при своевременном лечении ВПКШ.
До настоящего времени в Российской Федерации нет опубликованных случаев ЛАГ, ассоциированной с ВПКШ (ЛАГ-ВПКШ) у детей-подростков.
Клинический случай
Информация о пациенте. Пациентка Д., 17 лет, поступила в кардиологическое отделение НИИ педиатрии и детской хирургии им. акад. Ю. Е. Вельтищева с жалобами на утомляемость, одышку при умеренной физической нагрузке.
Анамнез жизни. Девочка от 7 беременности, молодых здоровых родителей, 2 срочных, оперативных родов, с весом 3350 г, длиной 51 см. Неонатальный период осложнился транзиторной легочной гипертензией (ЛГ) новорожденных. С раннего возраста девочка росла с отставанием в физическом и умственном развитии. Случаи ЛАГ в семье не зафиксированы.
Анамнез заболевания. ЛГ заподозрена в возрасте 6 лет при обследовании по поводу жалоб на утомляемость ребенка. При инвазивной оценке параметров гемодинамики получены данные, соответствующие критериям ЛАГ: давление в легочной артерии (ДЛА) 78/42 (54) мм рт.ст., индекс легочного сосудистого сопротивления (ЛСС) 8,88 Ед Вуда/м², давление заклинивания легочной артерии 12 мм рт.ст. Тест на вазореактивность отрицательный. Состояние расценивалось как идиопатическая ЛАГ. Рекомендованная терапия ЛАГ семьей не выполнена. При повторном обследовании в возрасте 9 лет, кроме сохраняющихся признаков ЛГ при эхокардиографии, по данным ультразвукового исследования брюшной полости впервые заподозрена аномалия портальной системы. При компьютерной томографии (КТ) брюшной полости с контрастным усилением выявлено соединение портальной вены (ПВ) бок в бок с НПВ через портокавальный анастомоз. От ПВ отходили мелкие сосуды в левую долю печени. При прямой портографии определялся выраженный сброс крови из ПВ в НПВ, расширенные ПВ и ее левая ветвь, резко сниженный кровоток в ее правой ветви. При пробе с баллонной окклюзией левой ПВ выявлен ток крови в правую ветвь ПВ. Признаков портальной гипертензии не выявлено. Давление в ПВ и НПВ 3 мм рт.ст. От предложенного хирургического лечения выявленного ВПКШ родители ребенка отказались. За лечением ЛАГ не обращались. Слабость, утомляемость при физической нагрузке прогрессировали.
При катетеризации сердца в возрасте 14 лет выявлено прогрессирование ЛАГ: ДЛА 101/50 (71) мм рт.ст. при уровне систолического артериального давления (САД) 94/43 (60) мм рт.ст. Тест на вазореактивность отрицательный. Состояние расценивалось как ЛАГ, ассоциированная с портальной гипертензией. Хирургическое лечение ВПКШ не рассматривалось. Инициированная терапия бозентаном в дозе 2-4 мг/кг/сут. — без эффекта, через год препарат заменен на мацитентан 10 мг/сут., с 16 лет монотерапия усилена силденафилом 60 мг/сут.
Результаты физикального осмотра. При осмотре контакт затруднен, признаки ментального дефицита. Физическое развитие дисгармоничное за счет дефицита веса. В легких дыхание везикулярное, частота дыхания 20 в мин, уровень насыщения крови кислородом (SpO2) на руках и ногах: 98-99%. Тоны сердца отчетливы, ритмичны, частота сердечных сокращений 74 уд./мин, акцент II тона над легочной артерией, систолодиастолический шум во 2-3 межреберье слева от грудины. Артериальное давление 120/72 мм рт.ст. Живот мягкий, безболезненный, печень не увеличена.
Предварительный диагноз: ЛАГ-ВПКШ.
Временнáя шкала (рисунок 1).

Рис. 1 Пациентка Д.: хронология течения болезни, ключевые события и прогноз.
Примечание: ДЛА — давление в легочной артерии,
ВПКШ — врожденный портокавальный шунт,
ЛАГ — легочная артериальная гипертензия.
Диагностическая оценка. Гемограмма, биохимические тесты в норме. Гипераммониемия до 113 мкмоль/л. Скрининг на маркеры вирусных гепатитов В и С, вирус иммунодефицита человека, системные заболевания отрицателен. Уровень мозгового натрийуретического пептида (brain natriuretic peptide, BNP) 68 пг/мл.
При электрокардиографии — синусовый ритм 85-87 в мин, патологическое отклонение электрической оси сердца вправо (угол ά=147°), Rs тип гипертрофии правого желудочка.
При эхокардиографии (рисунки 2, 3, таблица 1) сохранялись признаки ЛГ, дезадаптивного ремоделирования правого желудочка. Давление в легочной артерии 162/63 (107) мм рт.ст.
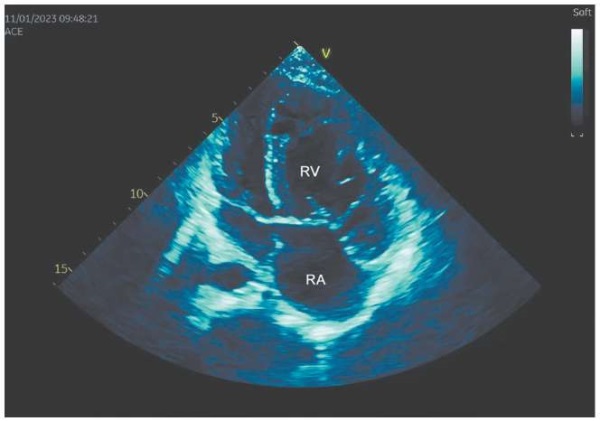
Рис. 2 Показатели трансторакальной эхокардиографии пациентки Д., 17 лет.
Примечание: умеренная дилатация и значительная гипертрофия правого желудочка.
Увеличение объема правого предсердия. Левые камеры оттеснены правыми.
Соотношение базальных размеров в конце систолы показывает преобладание
размера правого желудочка по сравнению с размером левого желудочка в 1,78 раза.
Цветное изображение доступно в электронной версии журнала.

Рис. 3 Показатели трансторакальной эхокардиографии пациентки Д., 17 лет.
Примечание: редуцированный паттерн систолического кровотока
в стволе легочной артерии с укорочением времени его ускорения до 68 мсек.
Пульмональная недостаточность III ст. с пиковым диастолическим градиентом 96 мм рт.ст.,
конечным диастолическим градиентом 62 мм рт.ст.
Цветное изображение доступно в электронной версии журнала.
Таблица 1
Показатели трансторакальной эхокардиографии пациентки Д., 17 лет
|
Показатель |
Результат |
Z-фактор/Референсные значения |
|
Трикуспидальный клапан: |
||
|
Фиброзное кольцо, диаметр |
47 мм |
2,72Z |
|
Систолический градиент давления |
162 мм рт.ст. |
<36 мм рт.ст. |
|
Соотношение систолы и диастолы |
1,44 |
<1 |
|
Легочная артерия: |
||
|
Фиброзное кольцо, диаметр |
29 мм |
2,1Z |
|
Ствол, диаметр |
51 мм |
5,74Z |
|
Время ускорения систолического кровотока |
68 мсек |
>100 мсек |
|
Пиковый диастолический градиент давления |
108 мм рт.ст. |
<20 мм рт.ст. |
|
Конечный диастолический градиент давления |
63 мм рт.ст. |
<5 мм рт.ст. |
|
Правое предсердие, индекс объема |
54 мл/м² |
<34 мл/м² |
|
Левое предсердие, индекс объема |
20 мл/м² |
<34 мл/м² |
|
Правый желудочек: |
||
|
Толщина миокарда свободной стенки в диастолу |
10 мм |
5 мм |
|
Приточный отдел базальный, диаметр |
50 мм |
2,1Z |
|
Приточный отдел средняя треть, диаметр |
43 мм |
2,5Z |
|
Выводной отдел, диаметр |
32 мм |
2,1Z |
|
Индекс ремоделирования |
1,42 |
1,28 |
|
Фракция укорочения площади |
30% |
>35% |
|
TAPSE |
15 мм |
-5,2 Z |
|
Левый желудочек: |
||
|
Конечно-диастолический диаметр |
36 мм |
-1,72 Z |
|
Фракция выброса |
76% |
>55% |
|
Межвентрикулярное соотношение: |
||
|
Индекс эксцентричности в диастолу |
1,64 |
<1 |
|
Индекс эксцентричности в систолу |
1,76 |
<1 |
|
Соотношение базальных диаметров правого и левого желудочков |
1,78 |
<1 |
|
Нижняя полая вена: |
||
|
Диаметр |
17 мм |
0,96 Z |
|
Инспираторный коллапс |
<50% |
>50% |
Примечание: TAPSE — Tricuspid annular plane systolic excursion
(систолическая экскурсия плоскости трикуспидального кольца).
Ультразвуковое исследование брюшной полости выявило гепатомегалию, анастомозирование систем воротной и нижней полой вен без признаков портальной гипертензии. Заподозрены объемные образования в печени. При эластометрии печени усредненное среднее значение эластичности печени: 4,4 кПа. Степень фиброза печени F 0 по шкале METAVIR (meta-analysis of histological data in viral hepatitis, шкала оценки степени фиброза печени).
При КТ-ангиографии легких ствол легочной артерии аневризматически расширен. Ствол и ветви до субсегментарного уровня контрастируются равномерно, без дефектов. Инфильтративные изменения не определяются.
КТ брюшной полости с контрастированием (рисунок 4) Печень: в размерах увеличена, КТ-плотность паренхимы снижена до 53HU. В артериальную фазу контрастирования определяются множественные узловые образования размером от 16 до 44 мм. В венозную фазу отмечается левостороннее расположение ПВ с анастомозом НПВ на уровне правого купола диафрагмы.

Рис. 4 КТ брюшной полости с контрастированием:
левостороннее расположение портальной вены
с анастомозом нижней полой вены на уровне правого купола диафрагмы.
Примечание: цветное изображение доступно в электронной версии журнала.
Учитывая наличие нейрокогнитивных нарушений, пациентке провели магнитно-резонансную томографию головного мозга; патологии при электроэнцефалографии не выявлено. Ребенок консультирован психиатром: состояние расценено как портокавальная энцефалопатия. Рекомендовано: терапия нейролептиком, коррекция гипераммониемии.
При тесте с 6-минутной ходьбой дистанция составила 500 м. Одышка по Боргу 7 баллов. Десатурация до 89% к концу теста.
Стратификация риска ЛГ. При стратификации риска по шкале EPPVDN PH Risk Score (European Paediatric Pulmonary Vascular Disease Network Pulmonary Hypertension) [6] получены 7 неинвазивных и два инвазивных критериев высокого риска, что предсказывало высокую (>10%) вероятность летальности в течение года.
Клинический диагноз. ЛАГ, ассоциированная с аномалией Абернети II типа, высокий риск.
Хроническая сердечная недостаточность II функционального класса. Нодулярная гиперплазия обеих долей печени. Умеренная гипераммониемия. Портокавальная энцефалопатия.
Дифференциальная диагностика. Дифференциальный диагноз проводился с ЛГ других классов и подклассов. Критерием постановки диагноза служило наличие прекапиллярной ЛГ, визуализация ВПКШ, отсутствие других значимых причин или состояний, достоверно ассоциированных с развитием ЛАГ.
Медицинские вмешательства. В задачи данной работы описание технических особенности хирургической операции не входит.
Динамика и исходы. Согласно Национальному Консенсусу экспертов по лечению ЛГ детям и подросткам с ЛАГ высокого риска показано незамедлительное начало тройной ЛАГ-специфической терапии с применением ингаляционного простаноида [7]. На момент поступления девочка получала терапию силденафилом и мацитентаном в максимальных дозах. Учитывая когнитивные нарушения, от постоянной ингаляционной терапии простаноидами воздержались. Препаратом выбора послужил агонист рецепторов простациклина — селексипаг в стартовой дозе 200 мкг 2 раза в сутки. Переносимость тройной ЛАГ терапии была хорошей, нежелательных явлений в течение 10 дней наблюдения в клинике не зарегистрировано. При контрольных исследованиях получена тенденция к снижению систолического ДЛА от 162 до 152 мм рт.ст., среднего ДЛА от 108 до 99 мм рт.ст., уменьшению объема правого предсердия, увеличению сердечного выброса по данным эхокардиографии, дистанции при тесте с 6-минутной ходьбой на 68 м. Девочка была выписана с рекомендациями наращивания дозы селексипага согласно инструкции. Ввиду недостатка финансирования родители не смогли выполнить эту рекомендацию, препарат принимался в стартовой дозе. Через 2 мес. родители девочки обратились в другую клинику, где была проведена хирургическая коррекция ВПКШ. В первые дни после операции состояние пациентки было стабильным. Однако на 5 сут. после операции произошла внезапная остановка сердца и девочка погибла.
Обсуждение
Демонстрация показала естественное течение аномалии Абернети II типа, потенциально излечимой на ранней стадии, но поздно диагностированной и осложнившейся тяжелой ЛАГ, манифестировавшей в возрасте 6 лет и прогрессирующей до супрасистемной формы к 14 годам на фоне неадекватной тяжести терапии. При первичном обследовании поиск возможной причины ЛАГ в должной мере не проводился. ВПКШ выявлен поздно, в возрасте 9 лет, при этом результаты инвазивной портографии показали потенциальную возможность хирургического лечения сосудистой аномалии. В последующем течение ВПКШ осложнилось энцефалопатией на фоне некорригируемой гипераммониемии, множественными узловыми образованиями обеих долей печени. Своевременное лечение ВПКШ в раннем возрасте могло бы предотвратить развитие тяжелых осложнений. При более поздней диагностике показана комбинированная тактика: сочетание хирургического лечения ВПКШ и медикаментозной терапии. Учитывая узловую трансформацию печени и портокавальную энцефалопатию, единственным методом лечения ВПКШ являлась трансплантация печени с реконструкцией системы воротной вены. Однако наличие тяжелой ЛАГ ассоциируется с высоким периоперационным риском: при среднем ДЛА >50 мм рт.ст. периоперационная летальность оценивается как 100% [8][9]. Плановому хирургическому лечению ВПКШ должна была предшествовать длительная ЛАГ терапия до достижения целевых показателей низкого периоперационого риска среднее ДЛА <35 мм рт.ст., ЛСС <3 Ед Вуда.
У нашей пациентки комбинированная тройная терапия силденафилом и мацитентаном в максимальных дозах, селексипагом в стартовой дозе привела к улучшению гемодинамических и функциональных характеристик, однако риски оставались высокими, прогноз оказался неблагоприятным.
Заключение
Это описание ЛАГ-ВПКШ, адресовано педиатрам, кардиологам, сосудистым хирургам с надеждой о принятии ими верного клинического решения при встрече с подобными пациентами.
Прогноз для пациента
Неблагоприятный (см. стратификацию риска).
Информированное согласие
- От пациента или его родителя (законного представителя) получено письменное добровольное информированное согласие на публикацию описания клинического случая. Дата подписания 11.01.2023.
- Официальный представитель ребенка подписал информированные согласия на off-label применение препаратов силденафил, мацитентан, селексипаг с ограничениями назначения до 18 лет.
- Полученные положительные заключения врачебных комиссий о назначении по жизненным показаниям препаратов off-label use до 18 лет:
- Селексипаг. ВК № 5/20 от 17.01.2023,
- Мацитентан. ВК 3/20 от 17.01.2023,
- Силденафил. ВК 9/28 от 17.01.2023.
Благодарности. Авторы выражают благодарность Соломкину А. М., врачу отделения лучевой диагностики Научно-исследовательского клинического института педиатрии и детской хирургии им. акад. Ю. Е. Вельтищева ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России за помощь в интерпретации данных компьютерной томографии и магнитно-резонансной томографии данной пациентки.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Abernethy J. Account of Two Instances of Uncommon Formation in the Viscera of the Human Body: From the Philosophical Transactions of the Royal Society of London. Med Facts Obs. 1797;7:100-8.
2. Baiges A, Turon F, Simón-Talero M, et al. Congenital Extrahepatic Portosystemic Shunts (Abernethy Malformation): An International Observational Study. Hepatology. 2020;71(2):658-69. doi:10.1002/hep.30817.
3. Lambert V, Ladarre D, Fortas F, et al. Cardiovascular disorders in patients with congenital portosystemic shunts: 23 years of experience in a tertiary referral centre. Arch Cardiovasc Dis. 2021; 114(3):221-31. doi:10.1016/j.acvd.2020.10.003.
4. Sokollik C, Bandsma RH, Gana JC, et al. Congenital portosystemic shunt: characterization of a multisystem disease. J Pediatr Gastroenterol Nutr. 2013;56(6):675-81. doi:10.1097/MPG.0b013e31828b3750.
5. Ткачева А. А., Валиева З. С., Зорин А. В. и др. Клинический случай мальформации Абернети Ib типа у взрослой пациентки с легочной артериальной гипертензией. Системные гипертензии. 2023;20(2):29-36. doi:10.38109/2075-082X-2023-1-29-36.
6. Hansmann G, Koestenberger M, Alastalo TP, et al. 2019 updated consensus statement on the diagnosis and treatment of pediatric pulmonary hypertension: The European Pediatric Pulmonary Vascular Disease Network (EPPVDN), endorsed by AEPC, ESPR and ISHLT. J Heart Lung Transplant. 2019;38(9):879-901. doi:10.1016/j.healun.2019.06.022.
7. Миклашевич И. М., Школьникова М. А., Горбачевский С. В. и др. Современная стратегия терапии легочной гипертензии у детей. Кардиоваскулярная терапия и профилактика. 2018;17(2):101-24. doi:10.15829/1728-8800-2018-2-101-124.
8. Laverdure N, Lallier M, Dubois J, Paganelli M. Congenital absence of the portal vein: Define the portosystemic shunt, avoid liver transplantation. Can Liver J. 2021;4(3):322-7. doi:10.3138/canlivj-2020-0011.
9. Robinson EB, Jordan G, Katz D, et al. Congenital Portosystemic Shunts: Variable Clinical Presentations Requiring a Tailored Endovascular or Surgical Approach. JPGN Rep. 2023;4(1):e279. doi:10.1097/PG9.0000000000000279.
Об авторах
И. М. МиклашевичНаучно-исследовательский клинический институт педиатрии и детской хирургии им. акад. Ю.Е. Вельтищева, ФГАОУ ВО "Российский национальный исследовательский медицинский университет им. Н.И. Пирогова" Минздрава России
Россия
Миклашевич Ирина Михайловна — к.м.н., заведующая детским кардиологическим отделением, врач детский кардиолог, врач ультразвуковой диагностики.
Москва
Е. А. Потрохова
Россия
Потрохова Елена Александровна — д.м.н., профессор, в.н.с. отдела радиационной экопатологии детского возраста.
Москва
Д. А. Морозов
Россия
Морозов Дмитрий Анатольевич — д.м.н., профессор, НИКИ педиатрии и детской хирургии им. ак. Ю.Е. Вельтищева ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Директор; заведующий кафедрой детской хирургии и урологии-андрологии им. Л.П. Александрова Сеченовского Университета; Главный внештатный детский специалист хирург Министерства здравоохранения Российской Федерации, врач - детский хирург высшей категории.
Москва
Ю. С. Исаева
Россия
Врач — детский кардиолог детского кардиологического отделения.
Москва
- Врожденный внепеченочный портокавальный шунт (ВПКШ) является редкой и, как правило, нераспознанной причиной тяжелой легочной артериальной гипертензии (ЛАГ), которую следует исключать во всех случаях ЛАГ неясной этиологии.
- Своевременная диагностика и хирургическое лечение сосудистой аномалии портальной системы могла бы предотвратить развитие мультисистемного поражения, включая ЛАГ.
- Поздняя (после 2 лет жизни) хирургическая коррекция потенциально могла бы уменьшить выраженность нарушений гемодинамики.
- Проведение любого планового хирургического вмешательства у пациентов с ЛАГ высокого риска должно проводиться с обязательным расчетом периоперационного риска и только после достижения целевых показателей гемодинамики на фоне предшествующей таргетной терапии ЛАГ.
Рецензия
Для цитирования:
Миклашевич И.М., Потрохова Е.А., Морозов Д.А., Исаева Ю.С. Легочная артериальная гипертензия, ассоциированная с аномалией Абернети II типа у подростка (клинический случай). Кардиоваскулярная терапия и профилактика. 2024;23(2):3754. https://doi.org/10.15829/1728-8800-2024-3754. EDN: MKKBYP
For citation:
Miklashevich I.M., Potrokhova E.A., Morozov D.A., Isaeva Yu.S. Pulmonary arterial hypertension associated with type II Abernethy malformation in an adolescent: a case report. Cardiovascular Therapy and Prevention. 2024;23(2):3754. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3754. EDN: MKKBYP
JATS XML

























































