Перейти к:
Генетические аспекты низких значений холестерина липопротеинов низкой плотности
https://doi.org/10.15829/1728-8800-2023-3846
EDN: HCJJCY
Аннотация
Цель. Изучение генетических причин низких значений холестерина липопротеинов низкой плотности (ХС ЛНП) у российских пациентов.
Материал и методы. В исследование были включены участники ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний в регионах Российской Федерации): лица с уровнем ХС ЛНП <5-го перцентиля с учетом пола и возраста (n=52), у которых проводилось таргетное секвенирование белок-кодирующих участков 6 генов (APOB, PCSK9, MTTP, ANGPTL3, SAR1B, APOC3) и определение значения шкалы генетического риска (ШГР) гиперхолестеринемии; а также репрезентативная выборка населения Ивановской области (ЭССЕ-Иваново, n=1667), для которой определялись только значения ШГР. Генетическое тестирование было проведено с помощью секвенирования следующего поколения.
Результаты. У 10 (19,2%) из 52 участников с низким уровнем ХС ЛНП выявлены редкие варианты, потенциально связанные с гипохолестеринемией: 8 — приводящие к появлению преждевременных стоп-кодонов в гене АРОВ, 1 — приводящий к преждевременному стоп-кодону в гене АРОС3 и 1 миссенс вариант в гене PCSK9. Из 10 выявленных вариантов 6 описаны нами впервые. Значение ШГР в группе лиц с низким уровнем ХС ЛНП (0,27±0,25) было достоверно ниже, чем в популяционной выборке ЭССЕ-Иваново (0,43±0,27) (p=4,7×10-06).
Заключение. Генетические причины объясняют наличие низкого уровня ХС ЛНП (<5-го перцентиля) у 32,7% пациентов, из них у 13,5% выявлены только моногенные варианты, у 5,7% наблюдается сочетание моногенной и полигенной гипохолестеринемии и у 13,5% имеется только полигенная гипохолестеринемия.
Ключевые слова
Для цитирования:
Мешков А.Н., Ершова А.И., Киселева А.В., Михайлина В.И., Сметнев С.А., Сопленкова А.Г., Куценко В.А., Сотникова Е.А., Вяткин Ю.В., Жарикова А.А., Зайченока М., Раменский В.Е., Скирко О.П., Покровская М.С., Литинская О.А., Шальнова С.А., Драпкина О.М. Генетические аспекты низких значений холестерина липопротеинов низкой плотности. Кардиоваскулярная терапия и профилактика. 2023;22(12):3846. https://doi.org/10.15829/1728-8800-2023-3846. EDN: HCJJCY
For citation:
Meshkov A.N., Ershova A.I., Kiseleva A.V., Mikhailina V.I., Smetnev S.A., Soplenkova А.G., Kutsenko V.A., Sotnikova Е.A., Vyatkin Yu.V., Zharikova A.A., Zaichenoka M., Ramensky V.E., Skirko O.P., Pokrovskaya M.S., Litinskaya O.A., Shalnova S.A., Drapkina O.M. Genetic aspects of decreased low-density lipoprotein cholesterol values. Cardiovascular Therapy and Prevention. 2023;22(12):3846. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3846. EDN: HCJJCY
Введение
Первичная гипохолестеринемия (уровень холестерина (ХС) липопротеинов низкой плотности (ЛНП) в популяции <5-го перцентиля с учетом пола и возраста) может быть вызвана мутациями в генах MTTP (абеталипопротеинемия), АРОВ (гипобеталипопротеинемия), PCSK9 (дефицит пропротеинконвертазы 9 типа), ANGPTL3 (комбинированная гиполипидемия) или SAR1B (chylomicron retention disease, болезнь задержки хиломикронов или болезнь Андерсона) или может быть связана с низкими значениями полигенной шкалы генетического риска (ШГР) гиперхолестеринемии [1][2]. Варианты с потерей функции в гене APOC3 наряду с низким уровнем триглицеридов (ТГ) также могут сочетаться с более низкими значениями ХС ЛНП [3].
Клинически первичную моногенную гипохолестеринемию можно разделить на две группы. Первую вызывают мутации в генах АРОВ, SAR1B и MTТP, которые приводят к потере функции соответствующих белков и нарушают сборку и секрецию хиломикронов и липопротеинов очень низкой плотности энтероцитами и гепатоцитами, при этом происходит накопление в этих клетках липидов, приводящее к снижению других функций клеток [4]. Напротив, мутации, связанные с потерей функции белка в генах PCSK9, ANGPTL3 и АРОС3, вызывают ускорение катаболизма липопротеинов, что также приводит к гипохолестеринемии, однако при этом нарушений функции энтероцитов и гепатоцитов не происходит [5]. Важно отметить, что миссенс-варианты в генах APOB и PCSK9, приводящие к изменению взаимодействия соответствующих белков с рецептором ЛНП, напротив, вызывают стойкое повышение уровня ХС ЛНП [1].
От трети до половины случаев первичной гипохолестеринемии имеют полигенную природу развития [2][6]. Пациенты с первичной гипохолестеринемией имеют более низкий риск ишемической болезни сердца (ИБС), однако он сочетается с большей частотой жировой болезни печени [7]. Наиболее частой причиной моногенной гипохолестеринемии являются гетерозиготные варианты нуклеотидной последовательности (ВНП) в гене APOB. ВНП в остальных генах встречаются существенно реже [2]. Среди российских пациентов описаны только единичные случаи генетически детерминированной гипохолестеринемии [8][9].
В работе приведены результаты генетического обследования 52 пациентов с гипохолестеринемией.
Материал и методы
Выборка
В исследование были включены участники исследования ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний в регионах Российской Федерации) [10]: лица с уровнем ХС ЛНП <5-го перцентиля с учетом пола и возраста (n=52), у которых проводилось таргетное секвенирование белок-кодирующих участков 6 генов (APOB, PCSK9, MTTP, ANGPTL3, SAR1B и APOC3) и определение значения ШГР гиперхолестеринемии; а также репрезентативная выборка населения Ивановской области из исследования ЭССЕ-Иваново (n=1667) [8][11], у которых определялись только значения ШГР гиперхолестеринемии. Значение 5-го перцентиля ХС ЛНП было получено на основании распределения показателей липидного спектра у мужчин и женщин трудоспособного возраста в Российской Федерации, полученного в исследовании ЭССЕ-РФ за 2012-2014гг [8][12]. В рамках исследования ЭССЕ-РФ осуществляли забор крови и получение сыворотки, а также собирали информацию о наличии у участников основных групп заболеваний (в т.ч. "заболевания печени" и "онкологические заболевания") в формате заполнения опросника [10]. Сбор и хранение биоматериала осуществляли по регламенту биобанкирования в Биобанке ФГБУ "НМИЦ ТПМ" Минздрава России (г. Москва) [13, 14]. Всем участникам исследования было проведено определение уровня ХС ЛНП в сертифицированной лаборатории с помощью автоматического биохимического анализатора крови ARCHITECT c8000 и диагностических наборов (Abbott, США).
Исследование было одобрено Независимым Этическим Комитетом ФГБУ "НМИЦ ТПМ" Минздрава России. От всех участников исследования было получено информированное согласие на их участие.
Секвенирование следующего поколения
Для всех участников исследования было проведено секвенирование следующего поколения (NGS, next-generation sequencing) с помощью таргетной панели, включающей 57 вариантов из ШГР гиперхолестеринемии [15], дополнительно для 52 частников с уровнем ХС ЛНП <5-го перцентиля проводилось секвенирование белок-кодирующих участков генов APOB, PCSK9, MTTP, ANGPTL3, SAR1B и APOC3.
Дезоксирибонуклеиновую кислоту (ДНК) выделяли из цельной крови с помощью набора QIAamp DNA Blood Mini Kit (Qiagen, Германия). Библиотеки для секвенирования были приготовлены с использованием набора SeqCap EZ Prime Choice Library (Roche, Швейцария). Секвенирование было проведено на приборе NextSeq 550 (Illumina, США) с получением парноконцевых чтений длиной 150 пар нуклеотидов. Все этапы секвенирования были проведены в соответствии с протоколами производителей.
Биоинформатичеcкий анализ
Полученные прочтения были выровнены на референсный геном GRCh38. Для обработки данных и оценки контроля качества использовался специально разработанный пайплайн [8] на базе GATK 3.8 [16]. Для полученных данных были проведены контроль качества, оценка родства и анализ генетической структуры изучаемой популяции на основе индивидуальных генотипов с помощью метода главных компонент (principal component analysis, PCA). ШГР [14] вычислена для генотипов каждого образца при помощи суммирования эффектов каждого ВНП из оригинального исследования с учетом количества копий аллеля.
Статистический анализ. Для статистического анализа использован язык R v. 4.2.2 1. Сравнение значений ШГР в группе с низким уровнем ХС ЛНП и в популяционной выборке ЭССЕ-Иваново проведено с помощью критерия Манна-Уитни. Уровень статистической значимости принят равным 0,05.
Результаты
На основании анализа показателей пола, возраста и уровня ХС ЛНП и отсутствия указаний на прием гиполипидемической терапии из участников исследования ЭССЕ-РФ в данное исследование было отобрано 52 человека с уровнем ХС ЛНП <5-го перцентиля его распределения. Медиана возраста — 36 лет (30; 47), доля мужчин — 53,8%. Показатели липидного спектра, частота заболеваний печени и онкологических заболеваний по данным опроса представлены в таблице 1. У 10 (19,2%) из 52 участников были выявлены редкие ВНП, потенциально связанные с гипохолестеринемией: 8 ВНП, приводящих к появлению преждевременных стоп-кодонов в гене АРОВ, 1 ВНП, приводящий к преждевременному стоп-кодону в гене АРОС3 и 1 миссенс ВНП в гене PCSK9 (таблица 2). Из 10 выявленных вариантов 6 описаны нами впервые.
При сравнении значений ШГР в группе с низким уровнем ХС ЛНП (0,27±0,25) и в популяционной выборке ЭССЕ-Иваново (0,43±0,27) (рисунок 1) были получены статистически значимые различия (p=4,7×10-06). При этом значения ШГР у участников с низким уровнем ХС ЛНП и наличием редкого ВНП (n=10) (0,27±0,30) достоверно не отличались от значений ШГР в популяционной выборке ЭССЕ-Иваново (0,43±0,27) (р=0,067), в то же время значения ШГР у группы лиц с низким уровнем ХС ЛНП и отсутствием редкого ВНП (n=42) (0,27±0,25) имели достоверные различия с популяционной выборкой ЭССЕ-Иваново (р=0,001). Кроме того, в выборке с низким ХС ЛНП у 10 (19,2%) из 52 человек значение ШГР было ≤ значения 10 перцентиля (0,103) ШГР в популяционной выборке ЭССЕ-Иваново (из них у 3 пациентов значение ШГР <10-го перцентиля сочеталось с редким ВНП в гене APOB). Таким образом, низкие значения ХС ЛНП могут быть объяснены генетическими причинами (наличие редкого ВНП и/или значение ШГР ≤ значения 10 перцентиля для популяции) у 17 (32,7%) участников (рисунок 2). Уровни показателей липидного спектра были минимальными в подгруппе лиц с сочетанием моногенного ВНП и значения ШНР <10 перцентиля. Достоверных различий по частоте заболеваний печени между подгруппами не выявлено (таблица 1).
Таблица 1
Показатели липидного спектра у пациентов с гипохолестеринемией в подгруппах
Пациенты с гипохолестеринемией | Заболевания печени, n (%) | Онкологические заболевания, n (%) | Общий ХС (ммоль/л) | ХС ЛВП (ммоль/л) | ХС неЛВП (ммоль/л) | ХС ЛНП (ммоль/л) | ТГ (ммоль/л) |
Все пациенты (n=52) | 22 (42,3) | 2 (3,8) | 2,91±0,75 | 1,35±0,46 | 1,56±0,47 | 1,03±0,25 | 0,73±0,3 |
Подгруппа 1 (моногенные + ШГР <10 перцентиля) (n=3) | 0 | 1 (33) | 2,02±0,871 | 1,03±0,411 | 0,99±0,461 | 0,73±0,4 | 0,46±0,163 |
Подгруппа 2 (моногенные) (n=7) | 1 (14,3) | 0 | 3,56±1,35 | 1,8±0,742 | 1,57±0,7 | 1,17±0,43 | 0,59±0,22 |
Подгруппа 3 (ШГР <10 перцентиля) (n=7) | 4 (57,1) | 0 | 3,02±0,4 | 1,49±0,3 | 1,53±0,29 | 1,02±0,1 | 0,8±0,33 |
Подгруппа 4 (ШГР >10 перцентиля) (n=35) | 17 (48,6) | 1 (2,9) | 2,83±0,53 | 1,26±0,36 | 1,54±0,49 | 1,02±0,19 | 0,76±0,324 |
Примечание: 1 — p<0,05 при сравнении подгрупп 1 и 2, 2 — p<0,05 при сравнении подгрупп 2 и 4, 3 — p<0,05 при сравнении подгрупп 1 и 3, 4 — p<0,05 при сравнении подгрупп 1 и 4, в остальных группах сравнения различия были недостоверны. ТГ — триглицериды, ХС — холестерин, ХС ЛВП — ХС липопротеинов высокой плотности, ХС неЛВП — ХС, не входящий в состав липопротеинов высокой плотности, ХС ЛНП — ХС липопротеинов низкой плотности, ШГР — шкала генетического риска.
Таблица 2
Варианты в генах APOB, APOC3 и PCSK9, выявленные у 10 участников с низким уровнем ХС ЛНП
Номер пациента | Значение ШГР | Ген (ВНП) | Геномная координата (GRCh38) | Кодирующая последовательность* | Аминокислотная последовательность** |
1 | -0,039 | APOB (rs776467440) | chr2:21010399_G/A | c.6469C>T | p.Gln2157Ter |
2 | 0,163 | PCSK9 (rs11591147) | chr1:55039974_G/T | c.137G>T | p.Arg46Leu |
3 | 0,305 | APOB | chr2:21234967_GA/G | c.4772del | p.Phe1591SerfsTer19 |
4 | 0,072 | APOB | chr2:21260870_AC/A | c.496del | p.Val166PhefsTer66 |
5 | -0,1 | APOB | chr2:21042389_G/C | c.209C>G | p.Ser70Ter |
6 | 0,245 | APOB | chr2:21032441_21032447del | c.1262_1268del | p.Pro421HisfsTer23 |
7 | 0,274 | APOB | chr2:21004271_G/A | c.12085C>T | p.Gln4029Ter |
8 | 0,252 | APOB | chr2:21006681_21006685dup | c.10183_10187dup | p.Thr3397Ter |
9 | 0,602 | APOC3 (rs76353203) | chr11:116830637_C/T | c.55C>T | p.Arg19Ter |
10 | 0,928 | APOB | chr2:21232683_G/A | c.7057C>T | p.Gln2353Ter |
Примечание: * — для APOB ENST00000233242.5, для PCSK9 ENST00000302118.5, для APOC3 ENST00000227667.8, ** — для APOB ENSP00000233242.1, для PCSK9 ENSP00000303208.5, для APOC3 ENSP00000227667.2. ВНП — вариант нуклеотидной последовательности, ХС ЛНП — холестерин липопротеинов низкой плотности, ШГР — шкала генетического риска.
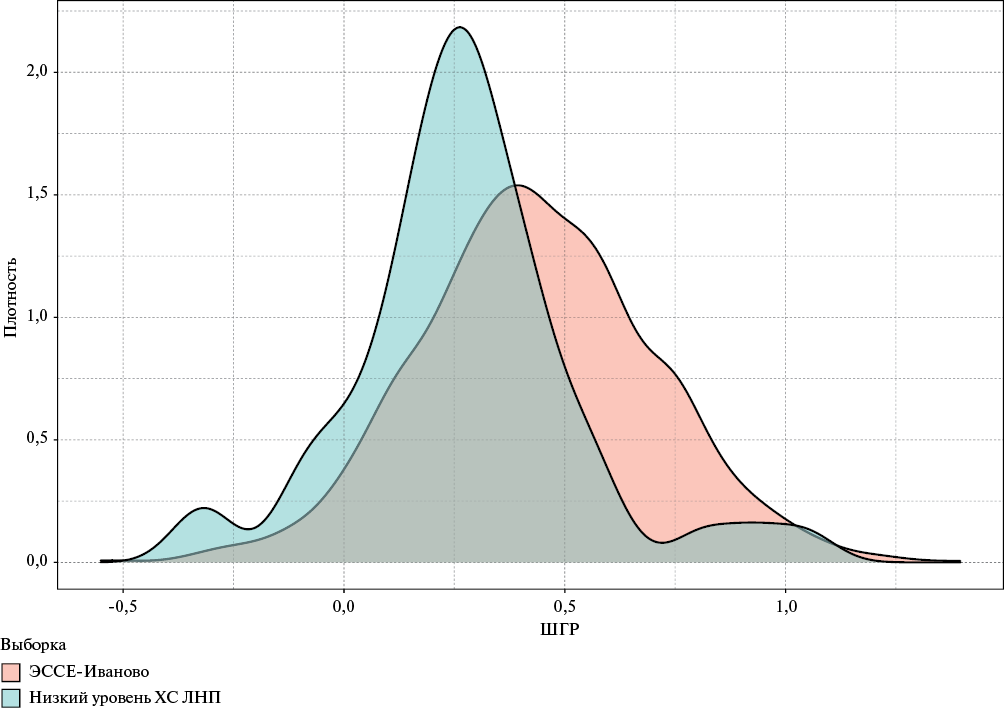
Рис. 1 Распределение значений ШГР в группе с низким уровнем ХС ЛНП и в популяционной выборке ЭССЕ-Иваново.
Примечание: ХС ЛНП — холестерин липопротеинов низкой плотности, ШГР — шкала генетического риска.
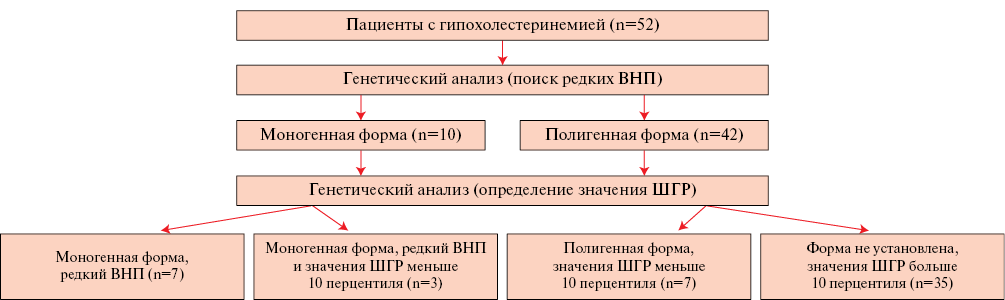
Рис. 2 Генетическое тестирование в группе с низким уровнем ХС ЛНП.
Примечание: ВНП — вариант нуклеотидной последовательности, ХС ЛНП — холестерин липопротеинов низкой плотности, ШГР — шкала генетического риска.
Обсуждение
ХС является важным компонентом клеточных мембран; кроме того, он необходим для выработки витамина D, продукции различных стероидных гормонов и синтеза желчных кислот. Состояния, приводящие к нарушению синтеза ХС, критичны для организма человека. В то же время необходимо разделять два показателя — низкий уровень ХС в клетках и низкий уровень ХС в крови. Именно низкий уровень в клетках сопряжен с нарушением вышеуказанных функций [17]. При этом даже у пациентов с гомозиготной формой семейной гиперхолестеринемии, у которых не функционируют рецепторы к ЛНП и отмечается относительно низкий внутриклеточный уровень ХС, не наблюдается никаких структурных, неврологических, эндокринологических и других проблем, за счет внутриклеточного синтеза ХС [18].
Показано, что уровень ХС ЛНП в крови ≥0,32 ммоль/л обеспечивает нормальное функционирование клеток с потенциально высокой потребностью в ХС [19].
Низкий уровень ХС ЛНП крови может быть вызван: соблюдением строгой вегетарианской диеты, наличием тяжелых заболеваний печени, приводящих к снижению ее функции, патологией пищеварительного тракта, гипертиреозом, онкологическими заболеваниями, приемом гиполипидемической терапии и генетическими причинами [20].
В настоящем исследовании изучены генетические причины гипохолестеринемии у 52 российских пациентов (средний уровень ХС ЛНП — 1,03 ммоль/л) с помощью метода NGS. У 32,7% пациентов гипохолестеринемия может быть объяснена генетическими причинами: наиболее частыми причинами были редкие гетерозиготные ВНП, приводящие к появлению преждевременных стоп-кодонов в гене АРОВ (tvAPOB) и полигенная гипохолестеринемия со значениями ШГР <10-го перцентиля, что сочетается с полученными ранее в других исследованиях результатах. В работе Rimbert A, et al. (2021) редкие tvAPOB варианты и значения ШГР <10-го перцентиля также были основными причинами гипохолестеринемии у французских пациентов, однако они встречались суммарно в 2 раза чаще чем в нашей группе пациентов: 70 vs 32,7%, что, возможно, связано с популяционными различиями [2]. Редкие tvAPOB варианты ассоциированы с более низкими уровнями ХС ЛНП и ТГ и обладают протективным эффектом в отношении развития ИБС. В работе Peloso GA, et al. (2019) при анализе 12 исследований типа "случай-контроль" (>57 тыс. участников) было показано, что гетерозиготные носители tvАРОВ встречались с частотой 0,038% среди пациентов с ИБС и в 0,092% среди пациентов контрольной группы. Наличие tvАРОВ было связано со снижением уровня ХС ЛНП на 43 мг/дл (p=2×10-7), снижением на 30% уровня ТГ (p=5*10-4) и снижением риска наличия ИБС на 72% (отношение шансов =0,28; 95% доверительный интервал: 0,12-0,64; p=0,002) [7]. При этом у таких пациентов часто отмечается жировой гепатоз и повышение уровня аланинаминотрансферазы [2].
Полигенная гипохолестеринемия также обладает протективным эффектом в отношении развития ИБС. В исследовании Ripatti P, et al. было показано, что у лиц со значением ШГР гиперхолестеринемии <10-го перцентиля риск наличия ИБС снижался на 26% (отношение шансов = 0,74; 95% доверительный интервал: 0,7-0,79; p<0,01) [21].
В настоящем исследовании у лиц с низким уровнем ХС ЛНП достоверно более низкие значения общего ХС, ТГ и ХС, не входящего в состав липопротеинов высокой плотности, имела только подгруппа лиц с наличием редкого tvAPOB варианта в сочетании со значениями ШГР гиперхолестеринемии <10 перцентиля, у которых, по-видимому, и риск ИБС будет минимальный.
Не были выявлены пациенты с наличием гомозиготных или компаунд-гетерозиготных носителей мутаций в генах MTTP, APOB и SAR1B что, однако, было ожидаемым. Во-первых, данные состояния встречаются крайне редко и их относят к орфанным заболеваниям. Во-вторых, у таких пациентов заболевание проявляется уже в раннем детском возрасте, у них практически полностью отсутствуют хиломикроны и липопротеины очень низкой плотности, что приводит к дефициту жирорастворимых витаминов, к выраженной неврологической и гематологической патологии и к значительному снижению продолжительности жизни [22]. Таким образом, выявление таких пациентов в рамках эпидемиологического исследования среди взрослого населения, крайне маловероятно.
Подробно не были изучены вторичные причины низкого уровня ХС ЛНП у участников настоящего исследования. При анализе данных опроса участников исследования о наличии у них заболеваний, было показано, что онкологические заболевания отмечались редко — у 3,8%, заболевания печени встречались значительно чаще — у 42,3% лиц, однако какая доля из этих лиц имела тяжелые заболевания печени, выяснить не удалось. Жировой гепатоз является частым осложнением как моногенных, так и полигенных форм гипохолестеринемии, однако в данном исследовании этот аспект не изучался, что является ограничением исследования.
Заключение
Показано, что у лиц трудоспособного возраста генетические причины объясняют наличие низкого уровня ХС ЛНП (<5-го перцентиля) у 32,7%, из них у 13,5% выявлены только моногенные ВНП, у 5,7% наблюдается сочетание моногенной и полигенной гипохолестеринемии и у 13,5% имеется только полигенная гипохолестеринемия. Рекомендуется проведение генетического тестирования для дифференциальной диагностики гипохолестеринемии всем пациентам с уровнем ХС ЛНП <5-го перцентиля.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. R Development Core Team. R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing: Vienna, Austria, 2013. https://www.R-project.org. (31 October 2023).
Список литературы
1. Hegele RA, Borén J, Ginsberg HN, et al. Rare dyslipidaemias, from phenotype to genotype to management: A European Atherosclerosis Society task force consensus statement. Lancet Diabetes Endocrinol. 2020;8(1):50-67. doi:10.1016/S22138587(19)30264-5.
2. Rimbert A, Vanhoye X, Coulibaly D, et al. Phenotypic differences between polygenic and monogenic hypobetalipoproteinemia. Arterioscler Thromb Vasc Biol. 2021;41(1):e63-71. doi:10.1161/ATVBAHA.120.315491.
3. Crosby J, Peloso GM, Auer PL, et al. Loss-of-function mutations in APOC3, triglycerides, and coronary disease. N Engl J Med. 2014;371(1):22-31. doi:10.1056/NEJMoa1307095.
4. Bredefeld C, Hussain MM, Averna M, et al. Guidance for the diagnosis and treatment of hypolipidemia disorders. J Clin Lipidol. 2022;16(6):797-812. doi:10.1016/j.jacl.2022.08.009.
5. Iskandar SE., Bowers AA. mRNA display reaches for the clinic with new PCSK9 inhibitor. ACS Med Chem Lett. 2022;13(9):1379-83. doi:10.1021/acsmedchemlett.2c00319.
6. Blanco-Vaca F, Martin-Campos JM, Beteta-Vicente Á, et al. Molecular analysis of APOB, SAR1B, ANGPTL3, and MTTP in patients with primary hypocholesterolemia in a clinical laboratory setting: Evidence supporting polygenicity in mutation-negative patients. Atherosclerosis. 2019;283:52-60. doi:10.1016/j.atherosclerosis.2019.01.036.
7. Peloso GM, Nomura A, Khera AV, et al. Rare proteintruncating variants in apo В, lower low-density lipoprotein cholesterol, and protection against coronary heart disease. Circ Genom Precis Med. 2019;12(5):e002376. doi:10.1161/CIRCGEN.118.002376.
8. Ramensky VE, Ershova AI, Zaicenoka M, et al. Targeted sequencing of 242 clinically important genes in the Russian population from the ivanovo region. Front Genet. 2021;12:709419. doi:10.3389/fgene.2021.709419.
9. Ершова А. И., Щербакова Н. В., Суворова А. А. и др. Дифференциальная диагностика наследственного синдрома гипохолестеринемии с применением экзомного секвенирования. Рациональная фармакотерапия в кардиологии. 2014;10(5):509-12. doi:10.20996/1819-6446-2014-10-5-509-512.
10. Бойцов С. А., Чазов Е. И., Шляхто Е. В. и др. Научно-организационный комитет проекта ЭССЕ-РФ. Эпидемиология сердечнососудистых заболеваний в различных регионах России (ЭССЕ-РФ). Обоснование и дизайн исследования. Профилактическая медицина. 2013;16(6):25-34.
11. Sotnikova EA, Kiseleva AV, Kutsenko VA, et al. Identification of Pathogenic Variant Burden and Selection of Optimal Diagnostic Method Is a Way to Improve Carrier Screening for Autosomal Recessive Diseases. J Pers Med. 2022;12(7):1132. doi:10.3390/jpm12071132.
12. Мешков А. Н., Ершова А. И., Деев А. Д. и др. Распределение показателей липидного спектра у мужчин и женщин трудоспособного возраста в Российской Федерации: результаты исследования ЭССЕ-РФ за 20122014гг. Кардиоваскулярная терапия и профилактика. 2017;16(4):62-7. doi:10.15829/1728-8800-2017-4-62-67.
13. Покровская М. С., Борисова А. Л., Метельская В. А. и др. Роль биобанкирования в организации крупномасштабных эпидемиологических исследований. Кардиоваскулярная терапия и профилактика. 2021;20(5):2958. doi:10.15829/17288800-2021-2958.
14. Копылова О. В., Ершова А. И., Покровская М. С. и др. Популяционно-нозологический исследовательский биобанк "НМИЦ ТПМ": анализ коллекций биообразцов, принципы сбора и хранения информации. Кардиоваскулярная терапия и профилактика. 2021;20(8):3119. doi:0.15829/1728-88002021-3119.
15. Willer CJ, Schmidt EM, Sengupta S, et al. Discovery and refinement of loci associated with lipid levels. Nat Genet. 2013;45(11):1274-83. doi:10.1038/ng.2797.
16. Van der Auwera, Geraldine A, O’Connor B. Genomics in the cloud: using Docker, GATK, and WDL in Terra. O’Reilly Media. 2020. ISBN 9781491975190.
17. Parente M, Tonini C, Segatto M, Pallottini V. Regulation of cholesterol metabolism: New players for an old physiological process. J Cell Biochem. 2023;124(10):1449-65. doi:10.1002/jcb.30477.
18. Bruckert E. Recommendations for the management of patients with homozygous familial hypercholesterolaemia: overview of a new European Atherosclerosis Society consensus statement. Atheroscler Suppl. 2014;15(2):26-32. doi:10.1016/j.atherosclerosissup.2014.07.004.
19. Olsson AG, Angelin B, Assmann G, et al. Can LDL cholesterol be too low? Possible risks of extremely low levels. J Intern Med. 2017;281(6):534-53. doi:10.1111/joim.12614.
20. Masana L, Girona J, Ibarretxe D, et al. Clinical and pathophysiological evidence supporting the safety of extremely low LDL levels-The zero-LDL hypothesis. J Clin Lipidol. 2018;12(2):292-9.e3. doi:10.1016/j.jacl.2017.12.018.
21. Ripatti P, Rämö JT, Mars NJ, et al. Polygenic Hyperlipidemias and Coronary Artery Disease Risk. Circ Genom Precis Med. 2020;13(2):e002725. doi:10.1161/CIRCGEN.119.002725.
22. Takahashi M, Okazaki H, Ohashi K, et al. Current Diagnosis and Management of Abetalipoproteinemia. J Atheroscler Thromb. 2021;28(10):1009-19. doi:10.5551/jat.RV17056.
Об авторах
А. Н. МешковРоссия
д.м.н., руководитель Института персонализированной терапии и профилактики.
Москва
А. И. Ершова
Россия
д.м.н., руководитель лаборатории клиномики, зам. директора по фундаментальной науке.
Москва
А. В. Киселева
Россия
к.б.н., в.н.с., руководитель лаборатории молекулярной генетики Института персонализированной терапии и профилактики.
Москва
В. И. Михайлина
Россия
м.н.с. отдела персонализированной диагностики, терапии и профилактики атеросклеротических сердечно-сосудистых заболеваний Института персонализированной терапии и профилактики.
Москва
С. А. Сметнев
Россия
лаборант-исследователь лаборатории молекулярной генетики Института персонализированной терапии и профилактики.
Москва
А. Г. Сопленкова
Россия
Лаборант лаборатории биостатистики отдела эпидемиологии хронических неинфекционных заболеваний.
Москва
В. А. Куценко
Россия
с.н.с. лаборатории биостатистики отдела эпидемиологии хронических неинфекционных заболеваний; аспирант кафедра теории вероятностей отделения математики механико-математический факультета.
Москва
Е. А. Сотникова
Россия
с.н.с. лаборатории молекулярной генетики Института персонализированной терапии и профилактики.
Москва
Ю. В. Вяткин
Россия
с.н.с. лаборатории геномной и медицинской биоинформатики Института персонализированной терапии и профилактики, программист Института перспективных исследований проблем искусственного интеллекта и интеллектуальных систем.
Москва
А. А. Жарикова
Россия
к.б.н., в.н.с. лаборатории молекулярной генетики Института персонализированной терапии и профилактики, старший преподаватель факультета биоинженерии и биоинформатики факультета биоинженерии и биоинформатики.
Москва
М. Зайченока
Россия
Аспирант.
Московская область, Долгопрудный
В. Е. Раменский
Россия
д.ф.м.н., в.н.с., руководитель лаборатории геномной и медицинской биоинформатики Института персонализированной терапии и профилактики, доцент Института перспективных исследований проблем искусственного интеллекта и интеллектуальных систем, в.н.с. факультета биоинженерии и биоинформатики.
Москва
О. П. Скирко
Россия
м.н.с. лаборатории молекулярной генетики Института персонализированной терапии и профилактики.
Москва
М. С. Покровская
Россия
к.б.н., в.н.с., руководитель лаборатории "Банк биологического материала" Института персонализированной терапии и профилактики.
Москва
О. А. Литинская
Россия
к.м.н., зав. клинико-диагностической лаборатории, врач клинической лабораторной диагностики высшей категории.
Москва
С. А. Шальнова
Россия
д.м.н., профессор, руководитель отдела эпидемиологии хронических неинфекционных заболеваний.
Москва
О. М. Драпкина
Россия
д.м.н., профессор, академик РАН, директор.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Первичная гипохолестеринемия может быть вызвана мутациями в генах MTTP, АРОВ, PCSK9, ANGPTL3, SAR1B, APOC3 или связана с низкими значениями полигенной шкалы генетического риска гиперхолестеринемии.
Что добавляют результаты исследования?
- Выявлено 6 новых вариантов в генe APOB, связанных с первичной гипохолестеринемией. Показано, что генетические причины объясняют наличие низкого уровня холестерина липопротеинов низкой плотности (<5-го перцентиля) у 32,7% пациентов, из них у 13,5% выявлены только моногенные варианты нуклеотидной последовательности, у 5,7% наблюдается сочетание моногенной и полигенной гипохолестеринемии и у 13,5% имеется только полигенная гипохолестеринемия.
Рецензия
Для цитирования:
Мешков А.Н., Ершова А.И., Киселева А.В., Михайлина В.И., Сметнев С.А., Сопленкова А.Г., Куценко В.А., Сотникова Е.А., Вяткин Ю.В., Жарикова А.А., Зайченока М., Раменский В.Е., Скирко О.П., Покровская М.С., Литинская О.А., Шальнова С.А., Драпкина О.М. Генетические аспекты низких значений холестерина липопротеинов низкой плотности. Кардиоваскулярная терапия и профилактика. 2023;22(12):3846. https://doi.org/10.15829/1728-8800-2023-3846. EDN: HCJJCY
For citation:
Meshkov A.N., Ershova A.I., Kiseleva A.V., Mikhailina V.I., Smetnev S.A., Soplenkova А.G., Kutsenko V.A., Sotnikova Е.A., Vyatkin Yu.V., Zharikova A.A., Zaichenoka M., Ramensky V.E., Skirko O.P., Pokrovskaya M.S., Litinskaya O.A., Shalnova S.A., Drapkina O.M. Genetic aspects of decreased low-density lipoprotein cholesterol values. Cardiovascular Therapy and Prevention. 2023;22(12):3846. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3846. EDN: HCJJCY
JATS XML

























































