Перейти к:
Клинический случай эндоваскулярной ротационной атерэктомии при многососудистом кальцинированном поражении коронарного русла с вовлечением основного ствола левой коронарной артерии и передней межжелудочковой ветви
https://doi.org/10.15829/1728-8800-2024-3890
EDN: DIWGTF
Аннотация
Стратегия реваскуляризации при тяжелых кальцинированных поражениях является одной из наиболее актуальных проблем современных чрескожных коронарных вмешательств, поскольку выраженная кальцификация наблюдается все чаще и существенно затрудняет проведение традиционного эндоваскулярного лечения. В настоящее время методом выбора при тяжелом кальцинозе коронарного русла является ротационная атерэктомия, которая позволяет модифицировать атероматозные массы с увеличением просвета сосуда для возможности выполнения баллонной ангиопластики и стентирования с удовлетворительным результатом. В настоящей статье представлен клинический случай пациента очень высокого сердечно-сосудистого риска с отягощенным коронарным анамнезом и выраженной клиникой стенокардии напряжения на фоне приема максимально возможной многокомпонентной терапии. При обследовании было выявлено многососудистое кальцинированное поражение коронарного русла, однако в проведении коронарного шунтирования пациенту было отказано в связи с высокими периоперационными рисками. SYNTAX Score I (Synergy between Percutaneous Coronary Intervention with TAXUS and Cardiac Surgery score) — 25,5 баллов, SYNTAX Score II — 40,4% и 70,1% для чрескожного коронарного вмешательства и коронарного шунтирования, соответственно, EuroSCORE II (European System for Cardiac Operative Risk Evaluation) — 4,95%. Попытки традиционного чрескожного вмешательства не увенчались успехом и пациенту была выполнена эндоваскулярная ротационная атерэктомия с последующим стентированием пораженных сегментов коронарных артерий, на фоне чего в динамике отмечалось улучшение переносимости физических нагрузок с уменьшением функционального класса стенокардии.
Ключевые слова
Для цитирования:
Шукуров Ф.Б., Мясников Р.П., Куликова О.В., Нефедова Д.А., Фещенко Д.А., Васильев Д.К. Клинический случай эндоваскулярной ротационной атерэктомии при многососудистом кальцинированном поражении коронарного русла с вовлечением основного ствола левой коронарной артерии и передней межжелудочковой ветви. Кардиоваскулярная терапия и профилактика. 2024;23(2):3890. https://doi.org/10.15829/1728-8800-2024-3890. EDN: DIWGTF
For citation:
Shukurov F.B., Myasnikov R.P., Kulikova O.V., Nefedova D.A., Feshchenko D.A., Vasiliev D.K. Endovascular rotational atherectomy for multivessel coronary calcification involving the main trunk of left coronary artery and the left anterior descending artery. Cardiovascular Therapy and Prevention. 2024;23(2):3890. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3890. EDN: DIWGTF
Введение
Стратегия реваскуляризации при тяжелых кальцинированных поражениях является одной из наиболее актуальных проблем современных чрескожных коронарных вмешательств (ЧКВ), поскольку, согласно статистике, у каждого пятого пациента, перенесшего эндоваскулярное лечение, наблюдается умеренная или тяжелая кальцификация коронарного русла [1]. С одной стороны, это может быть обусловлено увеличением средней продолжительности жизни, а, с другой, — связано с совершенствованием технологии стентирования и расширением показаний к ЧКВ для более анатомически сложных поражений.
Следует отметить, что выраженная кальцификация существенно затрудняет проведение традиционного эндоваскулярного вмешательства. Отложение солей кальция в атеросклеротических бляшках препятствует заведению и раскрытию коронарных баллонов и стентов, увеличивая риск интраоперационных осложнений, включая диссекцию и перфорацию коронарных артерий (КА). Кроме того, нередко можно наблюдать технические проблемы, такие как недостаточное и/или асимметричное раскрытие стента и его неправильное позиционирование, что ассоциировано с субоптимальным непосредственным результатом и высокой вероятностью отдаленных сердечно-сосудистых событий на фоне рестеноза и тромбоза, которые требуют повторного ЧКВ [2][3].
Неудовлетворительные клинические исходы реваскуляризации при выраженном кальцинированном поражении на протяжении последнего десятилетия обусловили значительный рост интереса к ротационной атерэктомии, которая в настоящее время является методом выбора при тяжелой кальцификации коронарного русла. Ротаблация, в отличие от стандартного вмешательства, позволяет безопасно модифицировать и частично раздробить атероматозные массы путем продвижения вращающегося бура и создать равномерный увеличенный просвет сосуда для возможности выполнения баллонной ангиопластики и стентирования с удовлетворительным ангиографическим результатом [4][5]. Данная процедура способствует минимизации баротравмы сосуда при баллонировании, таким образом, предупреждая диссекцию и гиперплазию неоинтимы как фактора риска рестеноза, а также облегчает диффузию препаратов при использовании стентов с лекарственным покрытием за счет разрушения кальциевого барьера [6]. Однако данная методика сопряжена и с повышенным риском перипроцедуральных осложнений: диссекция артерии (до 6-7%), из них окклюзирующие диссекции (до 1,8%), замедление кровотока по артерии (феномен slow-flow) (до 7%), перфорация артерии (до 1%), что корректируется посредством имплантации стентов в случае возникновения травматических осложнений и назначением спазмолитических препаратов и ингибиторов IIB/IIIA гликопротеиновых рецепторов в случае тромботических осложнений [7]. Методика может быть безопасно выполнена как трансрадиальным, так и трансфеморальным доступом [8] и сочетает в себе преимущества открытой эндартерэктомии и малоинвазивной эндоваскулярной хирургии, сокращая длительность вмешательства при выраженной кальцификации и, следовательно, уменьшая лучевую нагрузку и объем введенного контрастного вещества. Все это нашло отражение в зарубежных рекомендациях по реваскуляризации миокарда, где применение ротационной атерэктомии с целью модификации кальцинированной атеросклеротической бляшки и улучшения результатов эндоваскулярного лечения имеет IIA класс рекомендаций и уровень доказательности B [9]. В отечественных национальных рекомендациях по лечению стабильной ишемической болезни сердца технические особенности эндоваскулярного лечения не описаны.
Ниже представлен клинический пример успешного эндоваскулярного лечения пациента с многососудистым поражением с вовлечением основного ствола (ОС) левой КА (ЛКА) и передней межжелудочковой ветви (ПМЖВ) с предварительным разрушением кальцинированных атеросклеротических бляшек методом ротационной атерэктомии.
Клинический случай
Информация о пациенте
Пациент К. 73 лет находился на стационарном лечении в сентябре 2022г с жалобами на давящие боли за грудиной и одышку при незначительной физической нагрузке, проходящие в покое с положительным эффектом от использования Нитроспрея.
Из анамнеза известно, что пациент длительное время страдал гипертонической болезнью. С осени 2019г отметил появление одышки с постепенным снижением толерантности к физической нагрузке, а в марте 2022г без предшествующего коронарного анамнеза перенес инфаркт миокарда нижней и боковой стенок левого желудочка (ЛЖ) с развитием интенсивного ангинозного приступа, однако госпитализирован не был. В последующем отмечал прогрессивное нарастание одышки, в связи с чем в апреле 2022г поступил в стационар по месту жительства. При селективной коронароангиографии было выявлено многососудистое поражение коронарного русла: выраженный кальциноз КА, стенозы в устье и среднем сегменте ОС ЛКА до 80%; стенозы ПМЖВ: в проксимальном сегменте 30% и в среднем сегменте 90%, ниже — аневризматическое расширение артерии до 6 мм; стенозы диагональной ветви: в проксимальном сегменте 50% и в среднем сегменте 70%; правая КА (ПКА) была диффузно изменена с эктазией на всем протяжении до 5-6 мм; задняя боковая ветвь (ЗБВ) ПКА окклюзирована от устья. При расчете SYNTAX Score I1 (Synergy between Percutaneous Coronary Intervention with TAXUS and Cardiac Surgery score) (шкала оценки тяжести поражения коронарного русла и риска неблагоприятных сердечно-сосудистых событий после ЧКВ) составил 25,5 баллов, SYNTAX Score II2 (шкала оценки вероятности 4-летней смертности после ЧКВ и коронарного шунтирования (КШ) с учетом клинических показателей) (в случае обсуждаемого пациента: пожилой возраст, мужской пол, клиренс креатинина по формуле Кокрофта-Голта — 66 мл/мин, фракция выброса (ФВ) ЛЖ — 40%, наличие хронической обструктивной болезни легких и периферического атеросклероза) — 40,4% и 70,1% для ЧКВ и КШ, соответственно, EuroSCORE II3 (European system for cardiac operative risk evaluation) (шкала оценки риска внутрибольничной смерти после КШ) — 4,95%. Пациент был консультирован сердечно-сосудистым хирургом, однако в проведении операции КШ отказано по тяжести состояния, рекомендованы коррекция терапии с улучшением функционального статуса и проведение эндоваскулярной реваскуляризации миокарда. В июне 2022г обратился в ФГБУ "НМИЦ терапии и профилактической медицины" Минздрава России, была проведена повторная коронароангиография — выявлены 80% кальцинированный стеноз в ОС ЛКА и 90% протяженный кальцинированный стеноз в проксимальном и среднем сегментах ПМЖВ. Была выполнена попытка проведения эндоваскулярной реваскуляризации миокарда, однако многочисленные попытки заведения баллонных катетеров низкого профиля с использованием различных техник оказались безуспешны из-за выраженного отложения кальция в зоне стеноза. От дальнейшей имплантации стента было принято решение отказаться в связи с высоким риском интраоперационных осложнений и рекомендовано выполнение эндоваскулярной ротационной атерэктомии в плановом порядке, по поводу чего пациент был повторно госпитализирован в сентябре 2022г.
Результаты физикального осмотра
Общее состояние: средней тяжести, стабильное. Сознание: ясное. Состояние психики: не изменено. Положение: активное. Телосложение: нормостеническое. Рост: 180 см. Вес: 97 кг. Индекс массы тела: 29,9 кг/м². Температура тела: 36,6º С. Кожные покровы: нормальной окраски, сухие, теплые, чистые. Видимые слизистые: нормальной окраски и влажности, чистые. Периферические отеки: незначительные отеки обеих голеней до уровня средней трети. Лимфоузлы: не увеличены. Мышечная система: развита удовлетворительно. Костная система: не изменена. Суставы: не изменены. Система дыхания: дыхание через нос свободное. Пальпация грудной клетки: безболезненная. Аускультация легких: дыхание жесткое, диффузно ослабленное, хрипы не выслушиваются. Частота дыхательных движений: 16. Сатурация при дыхании атмосферным воздухом — 97%. Система кровообращения: осмотр сосудов шеи: сосуды шеи не изменены. Осмотр области сердца: не изменена. Видимые пульсации: нет. Пальпация области сердца: верхушечный толчок пальпируется в V межреберье по среднеключичной линии. Аускультация сердца: Тоны сердца: Приглушены, ритмичные. Частота сердечных сокращений: 62 уд./мин. I тон: приглушен. II тон: приглушен. Дополнительные тоны: нет. Шумы сердца: выслушивается мягкий систолический шум в проекции верхушки сердца. Шум трения перикарда: нет. Артериальное давление справа: 110/70 мм рт.ст., артериальное давление слева: 115/70 мм рт.ст.
Предварительный диагноз
Основное заболевание: Ишемическая болезнь сердца: стенокардия напряжения III функционального класса (ФК). Постинфарктный кардиосклероз (Q-образующий заднебазальный и нижнеперегородочный инфаркт миокарда от 18.03.2022г). Многососудистое поражение коронарного русла (стеноз в устье и среднем отделе ствола левой КА до 80%; стенозы ПМЖВ: в проксимальном сегменте 30%, в среднем сегменте 90%; стенозы диагональной ветви: в проксимальном сегменте 50%, в среднем сегменте 70%; окклюзия ЗБВ ПКА от устья). Баллонная ангиопластика ПМЖВ от 30.06.2022г.
Фоновые заболевания: Гипертоническая болезнь III стадии, контролируемая артериальная гипертония. Дислипидемия. Атеросклероз аорты, коронарных, брахиоцефальных и подвздошно-бедренных артерий. Риск сердечно-сосудистых осложнений IV.
Осложнения основного заболевания: Хроническая сердечная недостаточность со сниженной ФВ 2а стадии (II ФК по NYHA — New-York Heart Association).
Сопутствующие заболевания: Цереброваскулярная болезнь. Хроническая ишемия головного мозга смешанного генеза.
Диагностическая оценка
На электрокардиограмме при поступлении были зарегистрированы синусовый ритм с частотой сердечных сокращений 58 уд./мин, отклонение электрической оси сердца влево, признаки очагово-рубцовых изменений миокарда нижней стенки ЛЖ и неспецифические изменения сегмента ST и зубца T, не позволяющие исключить недостаточность кровоснабжения миокарда ЛЖ. По данным эхокардиографии были выявлены значительная дилатация ЛЖ, умеренное расширение обоих предсердий, умеренная эксцентричная гипертрофия миокарда ЛЖ, выраженное нарушение локальной сократимости миокарда ЛЖ: диффузный гипокинез, наиболее выраженный (до акинеза) в области нижней и боковой стенок, значительное снижение глобальной систолической функции ЛЖ (ФВ по методу Simpson — 37%), митральная регургитация 2-3 ст. и трикуспидальная регургитация 2 ст.
Клинический диагноз
Основное заболевание: ишемическая болезнь сердца: Стенокардия напряжения III ФК. Постинфарктный кардиосклероз (Q-образующий заднебазальный и нижнеперегородочный инфаркт миокарда от 18.03.2022г). Многососудистое поражение коронарного русла (стеноз в устье и среднем отделе ствола ЛКА до 80%; стенозы ПМЖВ: в проксимальном сегменте 30%, в среднем сегменте 90%; стенозы диагональной ветви: в проксимальном сегменте 50%, в среднем сегменте 70%; окклюзия ЗБВ ПКА от устья). Баллонная ангиопластика ПМЖВ от 30.06.2022г.
Фоновые заболевания: Гипертоническая болезнь III стадии, контролируемая артериальная гипертония. Дислипидемия. Атеросклероз аорты, коронарных, брахиоцефальных и подвздошно-бедренных артерий. Риск сердечно-сосудистых осложнений IV.
Осложнения основного заболевания: Хроническая сердечная недостаточность со сниженной ФВ 2а стадии (II ФК по NYHA).
Сопутствующие заболевания: Цереброваскулярная болезнь. Хроническая ишемия головного мозга смешанного генеза.
Медицинские вмешательства
Пациенту была выполнена эндоваскулярная ротационная атерэктомия с последующим стентированием пораженных сегментов КА. Вмешательство проводилось под сопровождением оптической когерентной томографии (ОКТ). Первоначально под местной анестезией была пунктирована правая общая бедренная артерия и установлен интродьюсер 7F. Далее катетер-гид EBU 4,0 был установлен в устье ЛКА. На коронарограмме выявлены 80% кальцинированный стеноз в терминальном отделе ОС ЛКА с переходом на проксимальный сегмент ПМЖВ и 90% кальцинированный стеноз в среднем сегменте ПМЖВ (рисунок 1). С помощью микрокатетера в верхушечный сегмент ПМЖВ был заведен проводник. Проведение датчика ОКТ через стенозированный сегмент не увенчалось успехом, в связи с чем далее выполнен "дебалкинг" кальцинированных атеросклеротических бляшек в ОС ЛКА и ПМЖВ с помощью системы ротационной атерэктомии Rotablator (диаметр бура 1,5 мм (рисунок 2), после чего проведена ОКТ-оценка референсных диаметров и длины поражения, определены предполагаемые зоны приземления стентов (рисунок 3) Референсная площадь в дистальной части зоны приземления стентов составила 5,5 мм², диаметр артерии 3 мм. Длина пораженного сегмента от среднего сегмента ПМЖВ с переходом на ствол ЛКА =74 мм. Далее проведена предилатация стенозированных участков ПМЖВ некомплаенсным баллонным катетером 2,5×21 мм с последующими позиционированием и имплантацией в область остаточных стенозов в средний сегмент ПМЖВ, проксимальный сегмент ПМЖВ и ОС ЛКА стентов с лекарственным покрытием эверолимус 3×38 мм и 4×38 мм, соответственно. Затем были выполнены постдилатация стентированных сегментов некомплаенсными баллонными катетерами 3,5×20 мм, 4,5×15 мм и проксимальная оптимизация в ОС ЛКА баллонным катетером 5×15 мм с достижением хорошего ангиографического результата: кровоток в артериях TIMI-3 (Thrombolysis In Myocardial Infarction). На контрольной съемке и при ОКТ-контроле стенты были полностью расправлены, признаков диссекции не выявлено, остаточных стенозов обнаружено не было. Площадь стента по дистальному краю составила 7,5 мм², минимальная площадь стентированного сегмента составила 5,8 мм², что полностью удовлетворяет критериям оптимального раскрытия стента (105% от референсной площади). Минимальная площадь раскрытия стента в стволе ЛКА составила 12,8 мм². Несмотря на то, что в зонах наиболее выраженного циркулярного кальцинирования артерии раскрытие стента имело нестандартную округлую форму, площадь раскрытия и аппозиция стентов были расценены как оптимальные и вмешательство было завершено (рисунки 4, 5).

Рис. 1 Селективная коронарная ангиография:
А. и В. 80% кальцинированный стеноз в терминальном отделе ОС ЛКА
и проксимальном сегменте ПМЖВ (белые стрелки),
90% кальцинированный стеноз в среднем сегменте ПМЖВ (черные стрелки)
и аневризма в среднем сегменте ПМЖВ диаметром до 6 мм (красная стрелка);
С. ПКА диффузно изменена, расширена на всем протяжении до 5-6 мм;
ЗБВ окклюзирована от устья (белая стрелка).
Примечание: цветное изображение доступно в электронной версии журнала.

Рис. 2 Эндоваскулярная ротационная атерэктомия:
А. Ротаблационный бур в области стенозированного
среднего сегмента ПМЖВ (белая стрелка);
В. Ангиографический результат ротационной атерэктомии
в области среднего сегмента ПМЖВ (белая стрелка).

Рис. 3 Оптическая когерентная томография после ротационной атерэктомии.
Белыми стрелками указан разрушенный концентрический кальциноз (1).
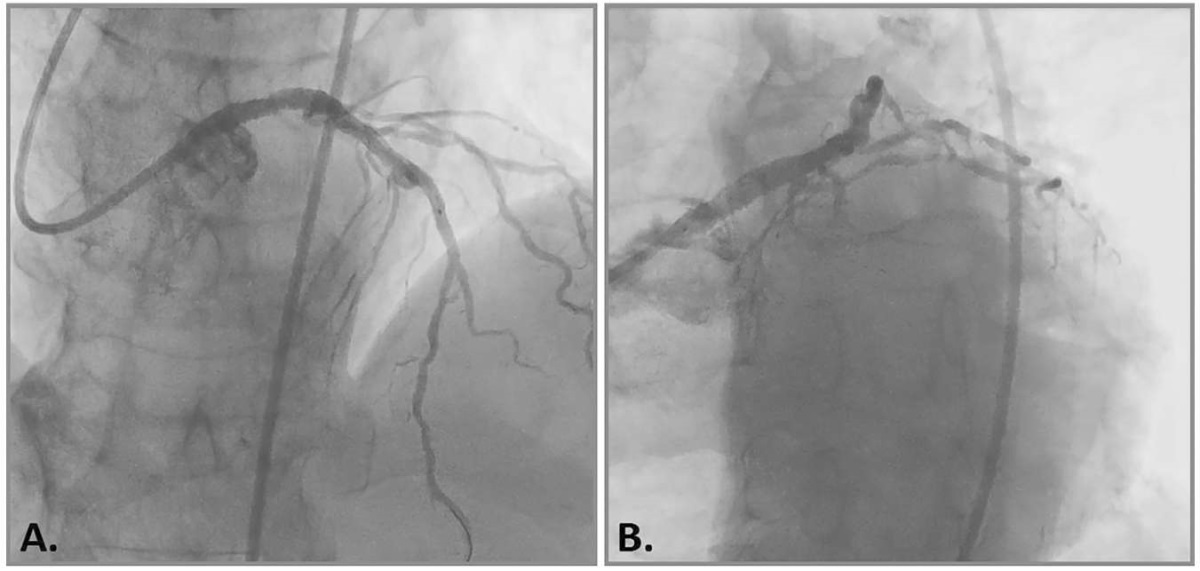
Рис. 4 Ангиографический результат баллонной ангиопластики (А) и стентирования (В).
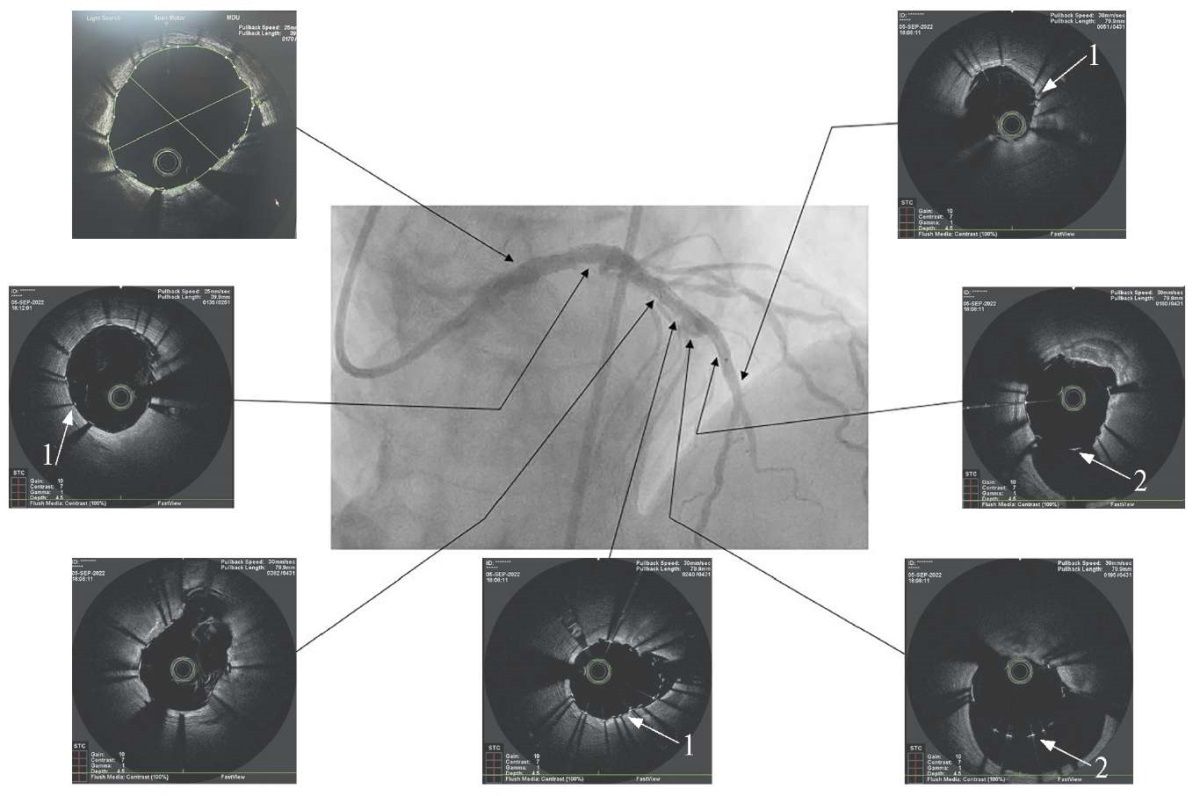
Рис. 5 ОКТ после баллонной ангиопластики и стентирования.
Белыми стрелками указаны полное прилегание ячеек стента
к стенке сосуда (акустические тени страт стента) (1)
и ячейки стента в зоне аневризматического расширения сосуда (2).
Динамика и исходы
Послеоперационный период протекал без осложнений, отмечалась положительная динамика в состоянии, на фоне медикаментозной терапии в послеоперационном периоде и после выписки из стационара: клопидогрел 75 мг, ацетилсалициловая кислота 100 мг, валсартан + сакубитрил 25 мг×2 раза/сут., бисопролол 5 мг + 2,5 мг, спиронолактон 50 мг, аторвастатин 80 мг, омепразол 20 мг, боли в груди не беспокоили, в т.ч. на фоне расширения режима двигательной активности, явления сердечной недостаточности не нарастали, и пациент был выписан из стационара на 3 сут. после операции.
В настоящее время пациент находится под динамическим наблюдением, и при плановом контрольном осмотре через 3 мес. и 12 мес. после вмешательства отмечал улучшение общего самочувствия с увеличением объема физической активности без клиники стенокардии.
Обсуждение
Первоначально, >30 лет назад, ротационная атерэктомия была разработана как метод полного удаления атеросклеротических бляшек и рассматривалась как самостоятельное вмешательство или предварительный этап перед баллонной ангиопластикой. Однако при таком подходе наблюдалась высокая частота рестеноза в отдаленном периоде [10][11], а прочие недостатки процедуры, такие как риск дистальной эмболизации при отсутствии активной аспирации и защиты периферическим фильтром, использование интродьюсеров большего размера и увеличение продолжительности вмешательства, способствовали тому, что ротаблация утратила практическую значимость, особенно после появления методики стентирования, которая позволила существенно улучшить непосредственные и отдаленные результаты эндоваскулярного лечения.
Попытки рутинного выполнения ротаблации с последующими ангиопластикой и стентированием как в эпоху голометаллических стентов [10], так и в эру стентов с лекарственным покрытием [12] не оказали весомого влияния на выраженность рестеноза и частоту поздних ишемических событий, в связи с чем методика также не нашла широкого практического применения.
Однако спустя многие годы клинического опыта и большое количество исследований, благодаря совершенствованию оборудования и техники интервенционных вмешательств, ротационная атерэктомия заняла нишу, где традиционные баллонирование и имплантация стентов оказываются недостаточными, — при тяжелой кальцификации коронарного русла.
В период с 2021 по 2023гг в нашем учреждении выполнено 18 вмешательств с применением системы ротационной атерэктомии, которые были проведены пациентам после безуспешной попытки традиционной эндоваскулярной реваскуляризации миокарда с применением баллонной ангиопластики. Частота успеха вмешательства составила 100%, в двух случаях отмечалось развитие гемодинамически-незначимых диссекций, что было корректировано имплантацией стентов.
По результатам многоцентрового проспективного рандомизированного исследования ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) проведение ротаблации перед ангиопластикой и стентированием кальцинированного поражения приводило к большему немедленному ангиографическому успеху (92,5% в группе ротаблации vs 83,3% в группе без ротаблации), что заключалось в более выраженном увеличении просвета артерии и меньшем остаточном стенозе [12]. При последующем клиническом наблюдении почти у трети пациентов, включенных в исследование, в течение 2-летнего периода отмечалось развитие серьезных сердечно-сосудистых событий, однако без статистически значимых различий между группами ротаблации и изолированных ангиопластики и стентирования [13].
Схожие результаты были получены в проспективном рандомизированном исследовании PREPARE-CALC (Comparison of Strategies to Prepare Severely Calcified Coronary Lesions) в котором пациенты с выраженной кальцификацией КА были разделены на группы ротационной атерэктомии и применения модифицированных баллонов перед имплантацией стента. Критериев успешности процедуры достигли 98% пациентов из первой группы и 81% пациентов из второй группы, соответственно. Через 9 мес. наблюдения различия в потере диаметра стентированного сосуда между группами были статистически незначимы. Кроме того, при оценке процедурных осложнений суммарная частота диссекций в группе ротаблации составила 7%, а в группе баллонирования — 9% [14].
Особого внимания требует ротационная атерэктомия в области сильно кальцинированного "незащищенного" ОС ЛКА, поскольку данный сосуд обеспечивает кровоснабжение 75% массы миокарда ЛЖ при "правом" или "сбалансированном" типе кровоснабжения и 100% — в случае "левого" типа кровоснабжения [15]. Данное вмешательство доказано эффективно [16], однако в случае осложнения в виде замедления кровотока может приводить к гемодинамическому коллапсу.
Сообщалось, что методика ротаблации при бифуркационном кальцинированном поражении коронарного русла также приводит к более благоприятным немедленным и долгосрочным результатам по сравнению с изолированными пластикой и стентированием, предупреждая смещение, как правило, крупных бифуркационных бляшек и острую окклюзию боковых ветвей [17].
Заключение
В настоящий момент использование ротаблации в Российской Федерации ограничено и составляет <1% от общего числа эндоваскулярных вмешательств. Внедрение данной процедуры в более широкую клиническую практику, чему способствует в т.ч. использование таких методов визуализации как внутрисосудистое ультразвуковое исследование и/или ОКТ, позволит значительно улучшить непосредственные и отдаленные результаты эндоваскулярного лечения данной категории пациентов.
Прогноз для пациента
Согласно результатам рандомизированных исследований, приведенных в данной статье, лечение пациентов с кальцинированными поражениями коронарного русла с применением систем ротационной атерэктомии обеспечивает более благоприятный прогноз для пациента в вопросе отдаленной проходимости артерии и отсутствии необходимости в последующем стентировании, по сравнению с традиционной стратегией эндоваскулярного лечения [5][7][9-11].
Информированное согласие
От пациента получено письменное добровольное информированное согласие на публикацию описания клинического случая, на использование медицинских данных в научных целях (дата подписания 20.08.2023г).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. https://www.syntaxscore.org/calculator/syntaxscore/frameset.htm.
2. https://www.syntaxscore.org/calculator/syntaxscore/framesetss2.htm.
3. https://www.euroscore.org/index.php?id=17.
Список литературы
1. Lee MS, Yang T, Lasala J, et al. Impact of coronary artery calcification in percutaneous coronary intervention with paclitaxel-eluting stents: Two-year clinical outcomes of paclitaxel-eluting stents in patients from the ARRIVE program. Catheter Cardiovasc Interv. 2016;88:891-7. doi:10.1002/ccd.26395.
2. Copeland-Halperin RS, Baber U, Aquino M, et al. Prevalence, correlates, and impact of coronary calcification on adverse events following PCI with newer-generation DES: Findings from a large multiethnic registry. Catheter Cardiovasc Interv. 2018;91(5):859-66. doi:10.1002/ccd.27204.
3. Shiode N, Kozuma K, Aoki J, et al. The impact of coronary calcification on angiographic and 3-year clinical out-comes of everolimus-eluting stents: results of a XIENCE V/PROMUS post-marketing surveillance study. Cardiovasc Interv Ther. 2018;33:313-20. doi:10.1007/s12928-017-0484-7.
4. Tomey MI, Kini AS, Sharma SK. Current status of rotational atherectomy. JACC Cardiovasc Interv. 2014;7:345-53. doi:10.1016/j.jcin.2013.12.196.
5. Sharma SK, Tomey MI, Teirstein PS, et al. North American expert review of rotational atherectomy. Circ Cardiovasc Interv. 2019;12(5):e007448. doi:10.1161/CIRCINTERVENTIONS.118.007448.
6. Katsanos K, Spiliopoulos S, Reppas L, et al. Debulking Atherectomy in the Peripheral Arteries: Is There a Role and What is the Evidence? Cardiovasc Intervent Radiol. 2017;40(7):964-77. doi:10.1007/s00270-017-1649-6.
7. Khalid N, Javed H, Shlofmitz E, et al. Adverse Events and Modes of Failure Related to Rotational Atherectomy System: The Utility of the MAUDE Database. Cardiovasc Revasc Med. 2021;27:57-62. doi:10.1016/j.carrev.2020.08.038.
8. Watt J, Oldroyd KG. Radial versus femoral approach for high-speed rotational atherectomy. Catheter Cardiovasc Interv. 2009;74:550-4. doi:10.1002/ccd.22066.
9. Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145:e18-e114. doi:10.1161/CIR.0000000000001038.
10. Dill T, Dietz U, Hamm CW, et al. A randomized comparison of balloon angioplasty versus rotational atherectomy in complex coronary lesions (COBRA study). Eur Heart J. 2000;21:1759-66. doi:10.1053/euhj.2000.2242.
11. Mauri L, Reisman M, Buchbinder M, et al. Comparison of rotational atherectomy with conventional balloon angioplasty in the prevention of restenosis of small coronary arteries: results of the Dilatation vs Ablation revascularization trial targeting restenosis (DART). Am Heart J. 2003;145(5):847-54. doi:10.1016/S0002-8703(03)00080-2.
12. Abdel-Wahab M, Richardt G, Joachim Büttner H, et al. High-speed rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: the randomized ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) trial. JACC Cardiovasc Interv. 2013;6:10-9. doi:10.1016/j.jcin.2012.07.017.
13. De Waha S, Allali A, Büttner HJ, et al. Rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: two-year clinical outcome of the randomized ROTAXUS trial. Catheter Cardiovasc Interv. 2016;87:691-700. doi:10.1002/ccd.26290.
14. Abdel-Wahab M, Toelg R, Byrne RA, et al. High-Speed Rotational Atherectomy Versus Modified Balloons Prior to Drug-Eluting Stent Implantation in Severely Calcified Coronary Lesions. Circ Cardiovasc Interv. 2018;11(10):e007415. doi:10.1161/CIRCINTERVENTIONS.118.007415.
15. Барбараш О. Л., Поликутина О. М., Тавлуева Е. В. и др. Поражение ствола левой коронарной артерии: взгляд кардиолога. Креативная Кардиология. 2015;(2):5-15. doi:10.15275/kreatkard.2015.02.01.
16. Garcia-Lara J, Pinar E, Valdesuso R, et al. Percutaneous coronary intervention with rotational atherectomy for severely calcified unprotected left main: immediate and two-years follow-up results. Catheter Cardiovasc Interv. 2012;80:215-20. doi:10.1002/ccd.23419.
17. Rathore S, Matsuo H, Terashima M, et al. Rotational atherectomy for fibro-calcific coronary artery disease in drug-eluting stent era: procedural outcomes and angiographic follow-up results. Catheter Cardiovasc Interv. 2010;75:919-27. doi:10.1002/ccd.22437.
Об авторах
Ф. Б. ШукуровФГБУ "Национальный медицинский исследовательский центр терапии и профилактической медицины" Минздрава России
Россия
Шукуров Фирдавс Баходурович — к.м.н., врач рентгенэндоваскулярных диагностики и лечения, с.н.с. отдела инновационных методов профилактики, диагностики и лечения сердечно-сосудистых и других хронических неинфекционных заболеваний.
Москва
Р. П. Мясников
Россия
Мясников Роман Петрович — к.м.н., в.н.с. отдела клинической кардиологии.
Москва
О. В. Куликова
Россия
Куликова Ольга Викторовна — к.м.н., н.с. отдела клинической кардиологии.
Москва
Д. А. Нефедова
Россия
Нефедова Дарья Антоновна — врач-ординатор.
Москва
Д. А. Фещенко
Россия
Фещенко Дарья Анатольевна — врач рентгенэндоваскулярных диагностики и лечения, заведующая операционным блоком, м.н.с. отдела инновационных методов профилактики, диагностики и лечения сердечно-сосудистых и других хронических неинфекционных заболеваний.
Москва
Д. К. Васильев
Россия
Васильев Дмитрий Константинович — к.м.н., врач рентгенэндоваскулярных диагностики и лечения, н.с. отдела инновационных методов профилактики, диагностики и лечения сердечно-сосудистых и других хронических неинфекционных заболеваний.
Москва
Дополнительные файлы
- Кальцинированный характер атеросклеротического поражения коронарного русла является фактором высокого риска развития перипроцедуральных осложнений.
- Применение ротационной атерэктомии для модификации атеросклеротической бляшки и подготовки кальцинированного участка артерии к стентированию позволяет достичь оптимальной имплантации стента.
- Применение внутрисосудистых методов визуализации позволяет минимизировать риски перипроцедуральных осложнений и улучшить отдаленный прогноз проходимости стентированного сегмента.
Рецензия
Для цитирования:
Шукуров Ф.Б., Мясников Р.П., Куликова О.В., Нефедова Д.А., Фещенко Д.А., Васильев Д.К. Клинический случай эндоваскулярной ротационной атерэктомии при многососудистом кальцинированном поражении коронарного русла с вовлечением основного ствола левой коронарной артерии и передней межжелудочковой ветви. Кардиоваскулярная терапия и профилактика. 2024;23(2):3890. https://doi.org/10.15829/1728-8800-2024-3890. EDN: DIWGTF
For citation:
Shukurov F.B., Myasnikov R.P., Kulikova O.V., Nefedova D.A., Feshchenko D.A., Vasiliev D.K. Endovascular rotational atherectomy for multivessel coronary calcification involving the main trunk of left coronary artery and the left anterior descending artery. Cardiovascular Therapy and Prevention. 2024;23(2):3890. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3890. EDN: DIWGTF
JATS XML

























































