Перейти к:
Внутрисосудистое ультразвуковое исследование у детей с врожденными пороками сердца. Серия клинических случаев
https://doi.org/10.15829/1728-8800-2024-3897
EDN: ZRANVZ
Аннотация
Внутрисосудистые методы визуализации — активно развивающееся направление, которое первоначально применялось при лечении коронарной патологии сердца. С помощью внутрисосудистого ультразвукового исследования (ВСУЗИ) врачи по рентгенэндоваскулярным методам диагностики и лечению имеют возможность объективнее, в отличие от рентгеноскопии, оценить анатомию сосудистого русла и морфологию поражения, а также оптимизировать результаты транскатетерных вмешательств. В последние годы внутрисосудистая визуализация получила распространение при обследовании детей с врожденными пороками сердца. Представлен обзор литературы по использованию ВСУЗИ при эндоваскулярной коррекции врожденных пороков сердца и приведены клинические случаи применения ВСУЗИ у детей с открытым артериальным протоком, стенозом нисходящей аорты после реконструкции перерыва дуги и стенозом легочной артерии.
Ключевые слова
Для цитирования:
Трошкинев Н.М., Кочергин Н.А., Ганюков И.В., Тарасов Р.С. Внутрисосудистое ультразвуковое исследование у детей с врожденными пороками сердца. Серия клинических случаев. Кардиоваскулярная терапия и профилактика. 2024;23(5):3897. https://doi.org/10.15829/1728-8800-2024-3897. EDN: ZRANVZ
For citation:
Troshkinev N.M., Kochergin N.A., Ganyukov I.V., Tarasov R.S. Intravascular ultrasound in children with congenital heart defects: a case series. Cardiovascular Therapy and Prevention. 2024;23(5):3897. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3897. EDN: ZRANVZ
Введение
На сегодняшний день врожденные пороки сердца (ВПС) занимают ведущее место в структуре всех врожденных пороков развития у детей и остаются основной причиной младенческой смертности. По данным Белозерова Ю. М. и др., заболеваемость ВПС в России составляет от 4 до 10 случаев/1000 рожденных детей [1-3].
Наиболее распространенный метод исследования врожденной патологии сердца и магистральных артерий — это ультразвуковая диагностика. Одной из разновидностей ультразвуковой диагностики стало внутрисосудистое ультразвуковое исследование (ВСУЗИ), использующееся для обследования пациентов с ВПС. Применение ВСУЗИ для оценки сосудов впервые применено Mallery J в 1987г. В 1988г Yock P, et al. [4] и Pandian N, et al. [5] применили одноэлементную ультразвуковую систему для оценки стенки сосуда и получили поперечное изображение стенки артерии.
ВСУЗИ используется для визуализации периферических и центральных артерий и вен и позволяет визуализировать структуру стенки и определить морфологию поражения, что помогает в выборе оптимальной тактики для последующего вмешательства. Ультразвуковые преобразователи позволяют получить томографическое изображение артерии на 360о с использованием частот от 10 до 40 МГц. Устройства с частотой 10-20 МГц используются для получения изображений внутрисердечных структур [6, 7].
Существует два типа катетеров для ВСУЗИ: 1) механическая система с вращающимся одиночным датчиком (совместима с направляющими катетерами ≥5 Fr); 2) твердотельная электронная система, состоящая из большого количества ультразвуковых датчиков, расположенных по окружности кончика катетера (совместима с направляющими катетерами ≥5 Fr) [6][8]. Одним из ограничений ВСУЗИ является отсутствие автоматического определения границы эхогенных структур в стенке сосуда, которое требует сегментации оператором. В настоящее время самые маленькие катетеры имеют размер 3,5 дюйма (наружный диаметр 1,16 мм), и визуализация проводится как в периферическом, так и в коронарном кровообращении [9][10].
В последние годы внутрисосудистая визуализация стала применяться при вмешательствах у пациентов с некоронарогенной патологией сердечно-сосудистой системы. Использование ВСУЗИ при патологии сердца и сосудов у детей — крайне актуальное направление, количество научных сообщений пока невелико, но увеличивается с каждым годом. Основной ценностью этого метода можно считать возможность оценки строения стенки сосуда. Это дает информацию о причинах возникновения патологии, протяженности пораженного участка сосуда, что в совокупности невозможно получить при использовании других методик визуализации.
Цель настоящей статьи — описание трех клинических случаев использования ВСУЗИ у детей с открытым артериальным протоком (ОАП), стенозом участка дуги и нисходящей аорты после коррекции перерыва дуги аорты и первичным клапанным и надклапанным стенозом легочной артерии (ЛА). Все родители или законные представители пациентов дали письменное согласие на публикацию клинического случая.
Исследования выполнялись на аппарате POLARIS Multi-Modality Guidance System (Boston Scientific, США). Использовались датчики OptiCross HD 60 MHz. Все исследования проводились во время рентгенэндоваскулярных процедур, под контролем рентгеноскопии датчик проводился в зону интереса. Методом автоматических "протяжек" от дистального сегмента зоны интереса к проксимальному проводилось сканирование со скоростью 1 мм/сек, в результате которого были получены ультразвуковые томографические срезы целевых сосудов.
Клинический случай 1
Пациентка Т., возраст 3 мес., рост 60 см, вес 5,5 кг, поступила в клинику с цианозом носогубного треугольника в покое, повышенной потливостью при кормлении. При скрининговом обследовании после рождения выявлен ОАП размером 2 мм и открытое овальное окно диаметром 3 мм. В возрасте 1 мес. по данным эхокардиографии (ЭхоКГ) отмечается увеличение размеров ОАП до 3,5 мм. Коллегиально детским кардиологом, кардиохирургом и рентгенэндоваскулярным хирургом принято решение о рентгенэндоваскулярной окклюзии ОАП.
По данным ЭхоКГ: фракция выброса (ФВ) левого желудочка (ЛЖ) была сохранной (77%), конечный диастолический размер составил 3 см, размеры левого предсердия в пределах нормы. В стволе ЛА определялся систолодиастолический поток, ОАП размером 5 мм, максимальный градиент составил 75 мм рт.ст. В центральной части межпредсердной перегородки визуализировалось открытое овальное окно 3 мм с коротким лево-правым сбросом.
В условиях рентгенологической операционной под внутривенной анестезией трансфеморальным артериальным доступом выполнена аортография катетером Pigtail с визуализацией ОАП (рисунок 1 A).
Выполнено ВСУЗИ для определения размера протока и дальнейшего выбора размера окклюзирующего устройства. По результатам ВСУЗИ (рисунок 2) диаметр ОАП составил от 2,9 до 4,4 мм, длина протока — 1,5 мм, диаметр ампулы — от 4,4 до 5,3 мм.
Для окклюзии ОАП выбрано устройство Amplatzer Duct occluder II Additional Sizes с диаметром дисков 4 мм и длинной перешейка между дисками 2 мм. Через трансфеморальный венозный доступ выполнено позиционирование и имплантация окклюдера в ОАП. При контрольной аортографии положение окклюдера корректное, резидуальный сброс минимален (рисунок 1 Б). По данным послеоперационного ЭхоКГ определяется незначимый резидуальный сброс до 1 мм по краю имплантированного окклюдера.
Данный клинический пример показывает, что использование ВСУЗИ помогает оценить анатомию протока и корректно выбрать размер окклюзирующего устройства.
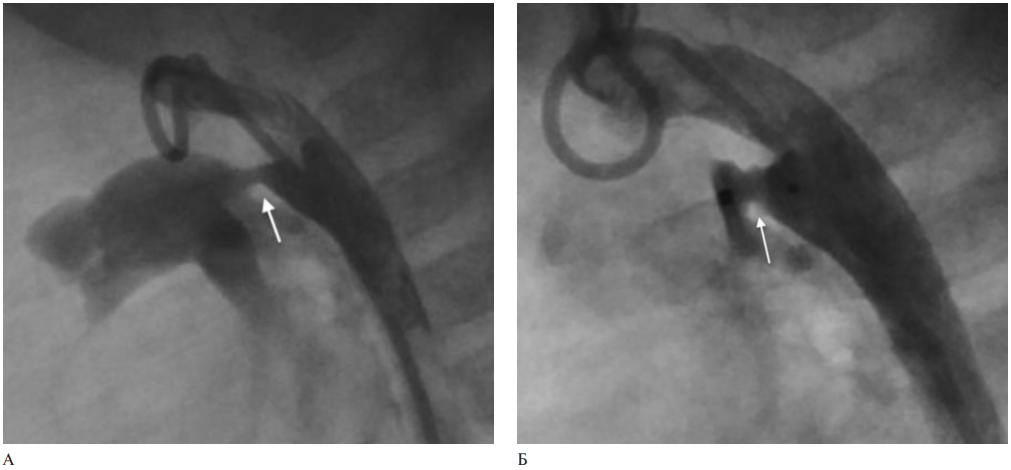
Рис. 1 A — аортография катетером Pigtail с визуализацией ОАП (указан стрелкой), Б — имплантирован окклюдер в ОАП (указан стрелкой).
Примечание: ОАП — открытый артериальный проток.
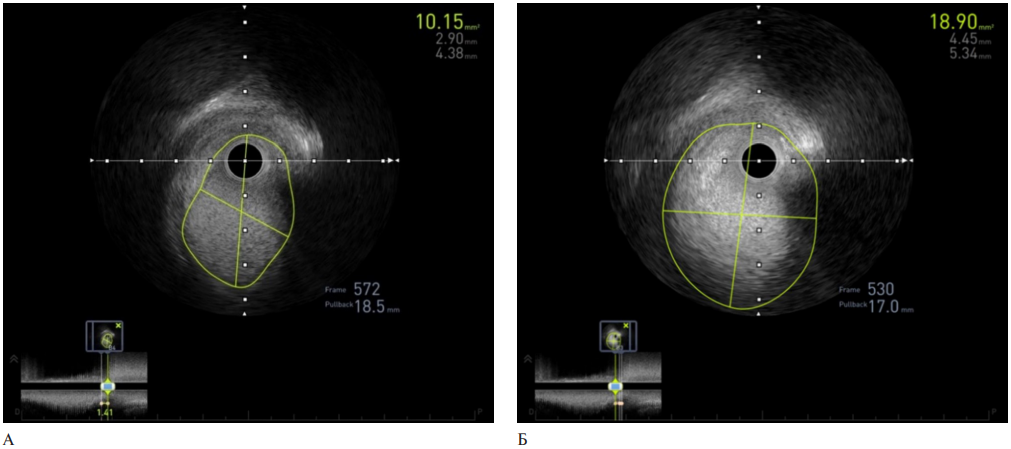
Рис. 2 A — диаметр и длина ОАП по данным ВСУЗИ, Б — размеры ампулы ОАП.
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ОАП — открытый артериальный проток.
Клинический случай 2
Пациентка В. поступила в клинику на 8 сут. после рождения с диагнозом ВПС: гипоплазия дуги аорты, перерыв дуги аорты тип A, открытый артериальный проток, дефект межжелудочковой перегородки, дефект межпредсердной перегородки.
При поступлении у ребенка наблюдались эпизоды беспокойства в течение дня, одышка и утомляемость при кормлении, далее мама ребенка стала отмечать ухудшение состояния ребенка в виде отказа от груди, затем появились нарушения сознания, эпизоды апноэ, появление цианоза кожных покровов, одышки в покое, вздутие живота. Общее состояние ребенка расценено как тяжелое за счет клиники дыхательной и сердечной недостаточности, кожные покровы серые, мраморные, двигательная активность и мышечный тонус значительно снижены. Артериальное давление на правой руке 103/76 мм рт.ст., на ноге — 86/46 мм рт.ст. При обследовании в условиях стационара диагностирован перерыв дуги аорты тип А в сочетании с гипоплазией дуги аорты. Перимембранозный дефект межжелудочковой перегородки, вторичный дефект межпредсердной перегородки, ОАП, ФВ ЛЖ составила 58%. Начата инфузия вазапростана в дозировке 5 нг/кг/мин.
Через 21 день после рождения ребенку проведена радикальная коррекция порока в условиях искусственного кровообращения в объеме: реконструкции дуги и нисходящей аорты с использованием ксеноперикардиальной заплаты, пластики дефекта межжелудочковой перегородки, ушивании открытого овального окна.
Послеоперационный период протекал закономерно тяжело на фоне сердечной и дыхательной недостаточности. При наблюдении и обследовании у ребенка сохранялась клиника дыхательной недостаточности в виде одышки до 50 дыхательных движений/мин, десатурация без ингаляции кислорода до 80%, выраженная утомляемость и одышка при кормлении, отказ от самостоятельного кормления. По данным ЭхоКГ и рентгеноскопии были признаки пареза левого купола диафрагмы, в связи с чем было принято решение о проведении пликации левого купола диафрагмы. Послеоперационный период протекал без особенностей. При обследовании в динамике в условиях стационара нарушений гемодинамики не выявлено. Ребенок переведен на самостоятельное кормление грудным молоком, отмечалась положительная прибавка в весе. На момент выписки из стационара по данным ЭхоКГ градиент давления на перешейке аорты составлял 10 мм рт.ст.
Через 6 мес. после выписки при проведении контрольной ЭхоКГ отмечалось увеличение среднего градиента давления на перешейке аорты до 65 мм рт.ст., в связи с чем была рекомендована повторная госпитализация.
ЭхоКГ при повторном поступлении в стационар: пиковый градиент на перешейке аорты 99 мм рт.ст., средний 52 мм рт.ст., заплата на межжелудочковой перегородке состоятельная, признаки гипертрофии ЛЖ, индекс массы миокарда 115 г/м2, увеличение конечного диастолического объема до 25 мл при конечном систолическом объеме 8 мл, ФВ в пределах нормы 68%. По данным мультиспиральной компьютерной томографии: просвет аорты сужен до 3×2 мм в области реконструкции дуги и нисходящей аорты, отмечается ремоделирование ЛЖ. Клинически у ребенка определялись признаки сердечной недостаточности с симптоматической артериальной гипертензией, пульс на бедренных сосудах ослаблен. По результатам проведенных обследований ребенку решено выполнить рентгенэндоваскулярную ангиопластику рестеноза дуги и нисходящей аорты.
Интраоперационно выполнена аортография через общую правую бедренную артерию, через катетер 4 Fr Pigtail. Определялось сужение участка просвета ~3 мм в зоне перешейка (рисунок 3 A). Прямая тензометрия не выполнялась. После выполнена баллонная ангиопластика баллоном диаметром 6 мм длиной 20 мм двумя инсуффляциями. Выполнена прямая тензометрия: давление в восходящей аорте 77/32 мм рт.ст., среднее 54 мм рт.ст. в нисходящей аорте 63/39 мм рт.ст., среднее 50 мм рт.ст. градиент 14 мм рт.ст. на фоне седации (рисунок 3 Б).
До баллонной ангиопластики было выполнено ВСУЗИ, по результатам которого выявлена гиперплазия неоинтимы преимущественно в зоне анастомоза и ксеноперикардиальной заплаты с формированием стеноза с диаметром просвета 2,6×3,1 мм и площадью просвета 6,52 мм2 (рисунок 4). На контрольном ВСУЗИ после баллонной ангиопластки определяется увеличение диаметра просвета до 3,7 мм с площадью просвета 9,51 мм2.
На контрольной ЭхоКГ при выписке пиковый градиент на перешейке составил 40 мм рт.ст., средний 21 мм рт.ст., ФВ ЛЖ — 76%. Клинически симптомов артериальной гипертензии нет, пульс на бедренных сосудах сохранен.
Ребенок выписан на 10 сут. после госпитализации. В динамике через 1 мес. проведена контрольная ЭхоКГ: пиковый градиент — 34 мм рт.ст., средний градиент 16 мм рт.ст.
Использование ВСУЗИ позволило оценить субстрат стеноза, а именно: нарастание неоинтимы в зоне пластики ксеноперикардиальной заплатой, что ставит под сомнение использование ксеноперикарда для реконструкции аорты.
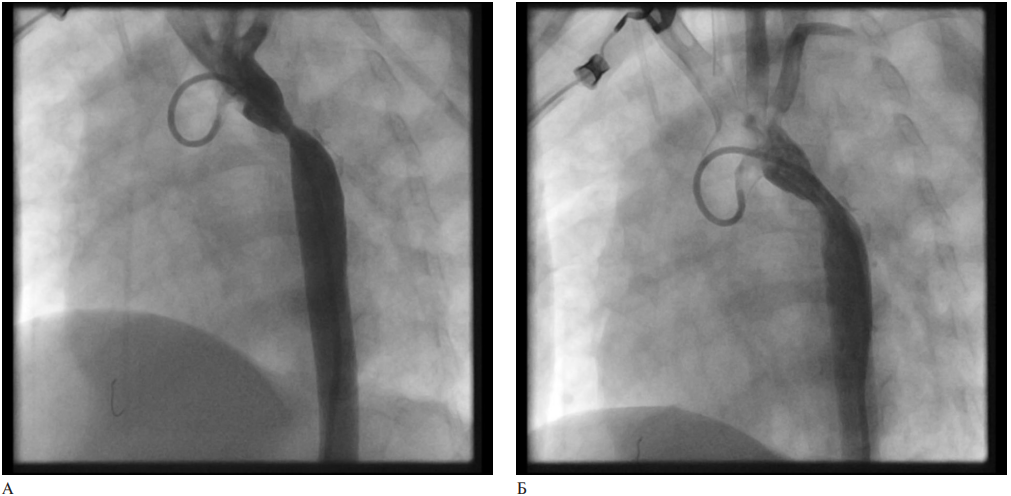
Рис. 3 Интраоперационная ангиография дуги и нисходящей аорты в области стеноза: А — до баллонной ангиопластики, Б — после баллонной ангиопластики.
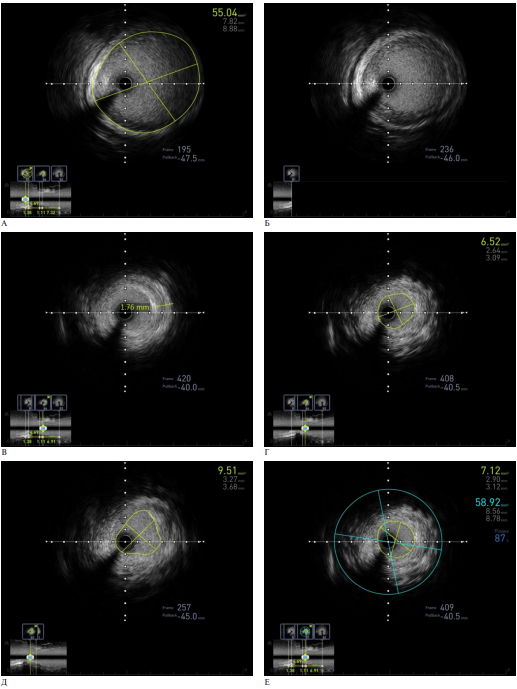
Рис. 4 Интраоперационное ВСУЗИ: A — аорта до участка ксеноперикардиального лоскута, Б — гиперплазия интимы аорты в области соединения с ксеноперикардиальным лоскутом, В — гиперплазия интимы в ксеноперикардиальной заплате, Г — диаметр просвета аорты в участке стеноза, Д — диаметр и площадь просвета аорты после баллонной дилатации, Е — площадь стеноза аорты в зоне реконструкции.
Клинический случай 3
Пациент Л. возрастом 1 год 11 мес. Поступил в клинику с жалобами на частые респираторные заболевания. Проведено ЭхоКГ исследование, по результатам которого на стволе ЛА определяется стеноз с пиковым градиентом 46 мм рт.ст.
Аускультативно определялся систолический шум над ЛА без иррадиации. Учитывая клапанный и надклапанный стеноз ЛА с давлением пиковым 47 мм рт.ст., средним 24 мм рт.ст., признаками гипертрофии правого желудочка, решено выполнить баллонную вальвулопластику клапана ЛА.
На рисунке 5 показана процедура баллонной вальвулопластики стеноза ЛА. Первоначально выполнена вентрикулография из правого желудочка с контрастированием выводного отдела, ЛА и ее ветвей. Визуализирован стеноз клапана ЛА. Измерено давление в правом желудочке — 67/1 мм рт.ст., среднее 28 мм рт.ст., давление в ЛА — 23/12 мм рт.ст., среднее 17 мм рт.ст. Выполнена вальвулопластика баллоном диаметром 12 мм и длиной 40 мм двумя инсуфляциями. Резидуальное давление в правом желудочке — 55/3 мм рт.ст., среднее 24 мм рт.ст., давление в ЛА — 22/9 мм рт.ст., среднее 17 мм рт.ст. Ангиографически дефектов наполнения в проекции ЛА не выявлено.
Исходно выполнено ВСУЗИ (рисунок 6), на котором выявлен надклапанный стеноз ЛА с площадью просвета 12,8 мм2, а также визуализирован подклапанный систолический стеноз. Контрольное ВСУЗИ после вальвулопластики продемонстрировало увеличение просвета в зоне стеноза до 17,7 мм2. Получен удовлетворительный результат вальвулопластики стеноза ЛА.
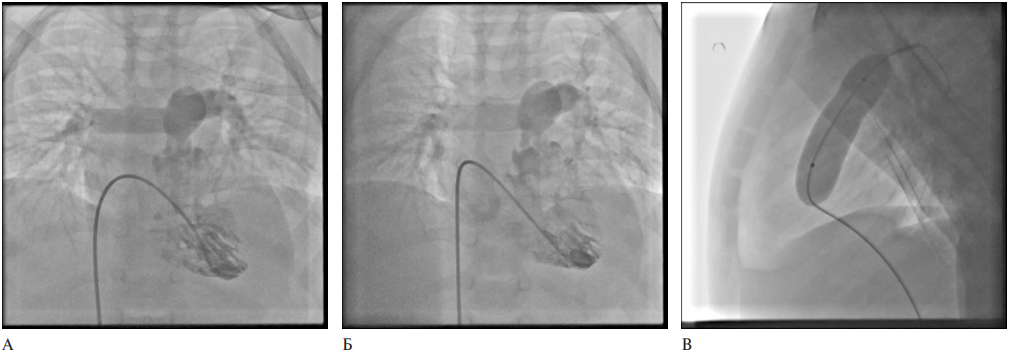
Рис. 5 Балонная вальвулопластика. A — ангиография до баллонной ангиопластики, Б — ангиография после балонной ангиопластики, В — баллон в раздутом состоянии.
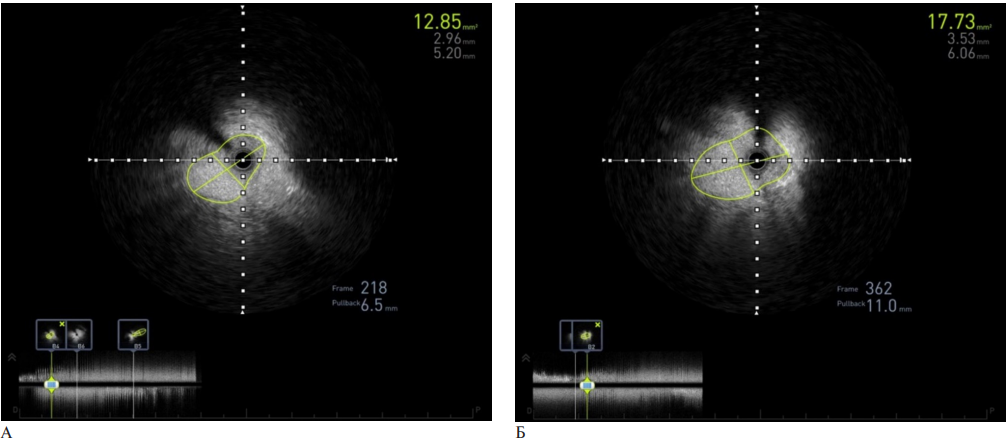
Рис. 6 Внутрисосудистая ультразвуковая визуализация надклапанного стеноза легочной артерии: A — до баллонной ангиопластики, Б — после баллонной ангиопластики.
Обсуждение
Нами продемонстрированы современные возможности ВСУЗИ при коррекции ВПС. Развитие технологий ультразвуковой визуализации позволяет не только оценить анатомию сосудистого русла, но и получить ультразвуковое изображение патологического участка. Это многообещающий инструмент для оптимизации результатов эндоваскулярного лечения и понимания первоначальной причины патологии.
ЭхоКГ является основным методом скрининга ОАП, который позволяет оценить размеры протока [11]. Однако встречаются случаи, когда размеры ОАП по ЭхоКГ не совпадают с данными ангиографии, что затрудняет выбор окклюзирующего устройства [12]. В данном случае может помочь ВСУЗИ, которое позволяет оценить форму, площадь просвета, длину, максимальный и минимальный диаметры протока.
Демин В. В. и др. ранее представили опыт применения ВСУЗИ при окклюзии ОАП у 265 пациентов в возрасте от 2 мес. до 34 лет. Выделено 3 морфологических типа протока: первый тип — стенка протока имеет небольшую или неравномерную толщину без четко различимой внутренней структуры; второй тип — стенка протока эхонегативная; третий тип — проток с четко визуализируемой по всему периметру стенкой. Индивидуальные данные ангиографии и ВСУЗИ при измерении наименьшего диаметра протока совпали только в 22,2% наблюдений. В 62,1% случаев диаметр был больше по данным ВСУЗИ (до 2,24 мм), в 15,5% — по данным ангиографии (до 5,7 мм). В 234 случаях выполнена рентгенэндоваскулярная окклюзия ОАП [13].
Ключевым преимуществом ВСУЗИ является то, что данный метод позволяет отказаться от артериального доступа, что актуально у детей раннего возраста с малым диаметром бедренной артерии. Ангиография ОАП из ЛА имеет ограничения для определения размеров ОАП, что требует более объективной оценки размера протока. Данные измерения крайне важны в выборе типа и размера окклюзирующего устройства. ВСУЗИ дает важную информацию о форме и площади поперечного сечения ОАП, что может помочь в выборе тактики лечения в пользу хирургического или транскатетерного метода [14].
Результаты оценки рекоарктации аорты после баллонной ангиопластики с использованием ВСУЗИ были представлены Mortezaeian H, et al. в 2021г [15]. В исследование включено 18 пациентов возрастом от 7 дней до 7 мес. Результаты показали умеренную чувствительность (58,3%) и высокую специфичность (100%) ВСУЗИ для определения наличия и отсутствия остаточной коарктации, а также необходимости в повторном проведении процедуры. Оценка области суженного участка аорты до и после ангиопластики у детей выполнялась с более высокой точностью при ВСУЗИ, чем ангиографии.
ВСУЗИ позволяет получить важные данные о морфологии стенки аорты до и после баллонной ангиопластики при коарктации аорты, такие как: тяжесть стеноза, разрыв интимы или медии, образование лоскута или аневризмы и расслоение. Результаты показали, что разрыв медиального слоя и формирование лоскута могут быть связаны с образованием тромба, что в дальнейшем приводит к фиброзу. У детей рестеноз аорты возникает при деформации стенки в результате фиброза, который затем требует повторного вмешательства. ВСУЗИ также позволяет получить дополнительную и более подробную информацию по сравнению с ангиографией, наряду с меньшим риском облучения или воздействия контрастных веществ. Применение этой процедуры у детей, особенно младшего возраста, представляется более безопасным при проведении ангиопластики для понимания механизмов изменений стенки сосудов.
ВСУЗИ нашло свое применение и при патологии ЛА и сосудов малого круга кровообращения при острой и хронической эмболии ЛА, визуализации аномалии сосудистой стенки и эндотелия. Оценивались результаты и после проведенных процедур ангиопластики и фармакологической терапии [7][16-18].
Группа российских ученых из Национального медицинского исследовательского центра сердечно-сосудистой хирургии им. А. Н. Бакулева в 1999г опубликовала результаты исследования 29 пациентов с ВПС и первичной легочной гипертензией и оценила анатомические изменения стенки ЛА внутрисосудистой визуализацией, соотношение ее с гистологической картиной и гемодинамическими показателями [19]. При помощи ВСУЗИ были установлены изменения в строении стенки ЛА у неоперабельных больных с ВПС и у пациентов с первичной легочной гипертензией. Характерной гистологический чертой было утолщение сосудистой стенки с истончением мышечного слоя, вплоть до полного исчезновения деления ее на слои. Данное исследование показало значимость дооперационного применения ВСУЗИ для оценки операбельности пациентов с ВПС и легочной гипертензией.
Группа авторов из Children's Hospital Boston (США) оценила целесообразность проведения ВСУЗИ при стенозах ЛА [20]. С 2016 по 2019гг обследованы 50 детей, средний возраст составил 1,7 года. В результате исследования выявлено, что ВСУЗИ дает возможность дифференцировать различные механизмы обструкции легочных вен, такие как истинно анатомические (деформация/компрессия) или рубцовые изменения после хирургической процедуры, от первичного врожденного заболевания ЛА. Авторы делают вывод о том, что ВСУЗИ безопасно в педиатрической группе и позволяет адекватно визуализировать просвет легочных сосудов и оценить строение стенки. Необходимы дальнейшие исследования в данном направлении, поскольку результаты позволят выявить предикторы для прогноза и последующего ведения пациентов с данной патологией.
Оценка стенозов легочных вен была проведена в работе Callahan R, et al. [21] Сравнивалось соответствие строения стенки легочных вен ультразвуковым методом с анализом гистологических препаратов, полученных после смерти и биопсии тканей, взятых интраоперационно. Гистологически исследовались шесть посмертных образцов тканей и ткани, взятые интраоперационно у четырех живых пациентов. Ультразвуковая картина соответствовала микроскопии гистологических препаратов, взятых после смерти пациентов. Картина ВСУЗИ, выполненного прижизненно у пациентов со стенозами легочных вен, показала те же результаты, что и в пораженных посмертных гистологических препаратах вен — наличие утолщения стенки и слои различной эхогенности. Утолщение стенки легочных вен, выявленное при помощи внутрисосудистой визуализации, влияет на прогноз и последующее ведение таких пациентов. ВСУЗИ также полезно при определении стеноза вен, когда существует дополнительный механизм обструкции, такой как внешняя анатомическая деформация или компрессия, и после радикальной коррекции тотального аномального дренажа легочных вен.
Авторы полагают, что дальнейшее изучение патологии легочных вен с помощью внутрисосудистой визуализации приведет к более четкому пониманию анатомии и механизмов обструкции легочных вен у детей.
Заключение
Анализ результатов отечественных и зарубежных исследований и приведенные нами клинические примеры показывают значимый вклад внутрисосудистой ультразвуковой визуализации для оценки морфологических изменений стенок сосудов при ВПС.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Белозеров Ю. М., Брегель Л.В, Субботин В. М. Распространенность врожденных пороков сердца у детей на современном этапе. Российский вестник перинатологии и педиатрии. 2014;59(6):7-11.
2. Hoffman JI, Kaplan S. The incidence of congenital heart disease. J Am Coll Cardiol. 2002;39(12):1890-900. doi:10.1016/s0735-1097(02)01886-7.
3. Рентгенэндоваскулярная хирургия. Национальное руководство: в 4 т. Т. 1. Врожденные пороки сердца. Под ред. Алекяна Б. Г. М.: Литтерра, 2017. 576 с. ISBN: 978-54235-0275-1.
4. Yock PG, Linker DT, White NW, et al. Clinical applications of intravascular ultrasound imaging in atherectomy. Int J Card Imaging. 1989;4(2-4):117-25. doi:10.1007/BF01745141.
5. Pandian NG, Kreis A, Brockway B, et al. Ultrasound angioscopy: real-time, two-dimensional, intraluminal ultrasound imaging of blood vessels. Am J Cardiol. 1988;62(7):493-4. doi:10.1016/0002-9149(88)90992-7.
6. Peng C, Wu H, Kim S, et al. Recent Advances in Transducers for Intravascular Ultrasound (IVUS) Imaging. Sensors (Basel). 2021;21(10):3540. doi:10.3390/s211035400.
7. Saito Y, Kobayashi Y, Fujii K, et al. Clinical expert consensus document on standards for measurements and assessment of intravascular ultrasound from the Japanese Association of Cardiovascular Intervention and Therapeutics. Cardiovasc Interv Ther. 2020;35(1):1-12. doi:10.1007/s12928-019-00625-61.
8. Zacharatos H, Hassan AE, Qureshi AI. Intravascular ultrasound: principles and cerebrovascular applications. AJNR Am J Neuroradiol. 2010;31(4):586-97. doi:10.3174/ajnr.A1810.
9. Iida O, Takahara M. What does Intravascular Ultrasound Illustrate? J Atheroscler Thromb. 2017;24(5):473-4. doi:10.5551/jat.ED0663.
10. Cismaru G, Schiau S, Muresan L, et al. Intravascular pulmonary venous ultrasound imaging for catheter ablation of atrial fibrillation. Expert Rev Med Devices. 2017;14(4):309-14. doi:10.1080/17434440.2017.1309973.
11. He M, Yang Z, Gan T, et al. Echocardiographic parameters predicting spontaneous closure of ductus arteriosus in preterm infants. Front Pediatr. 2023;11:1198936. doi:10.3389/fped.2023.11989363.
12. Wang G, Wu Y, Pan Z, et al. Transesophageal echocardiography-guided percutaneous patent ductus arteriosus closure without fluoroscopy. J Cardiothorac Surg. 2023;18(1):142. doi:10.1186/s13019-023-02248-84.
13. Демин В. В., Демин А. В., Желудков А. Н. и др. Применение внутрисосудистого ультразвукового сканирования для измерения открытого артериального протока. Международный журнал интервенционной кардиоангиологии. 2016;(44):72-81.
14. Fechtrup C, Kerber S, Karbenn U, et al. Value of intravascular ultrasound in the diagnosis and characterization of patent ductus arteriosus in an adult patient. Eur Heart J. 1993;14(8):1148-9. doi:10.1093/eurheartj/14.8.1148.
15. Mortezaeian H, Khalili Y, Farrokhi M, et al. Intravascular Ultrasound for Assessment of Residual Coarctation of the Aorta after Balloon Angioplasty in Infants. Pediatr Cardiol. 2021;42(2):442-50. doi:10.1007/s00246-020-02503-y7.
16. Porter TR, Mohanty PK, Pandian NG. Intravascular ultrasound imaging of pulmonary arteries. Methodology, clinical applications, and future potential. Chest. 1994;106(5):1551-7. doi:10.1378/chest.106.5.155119.
17. Marteslo JP, Makary MS, Khabiri H, et al. Intravascular Ultrasound for the Peripheral Vasculature-Current Applications and New Horizons. Ultrasound Med Biol. 2020;46(2):216-24. doi:10.1016/j.ultrasmedbio.2019.10.010.
18. VanderLaan D, Karpiouk A.B, Yeager D, et al. Real-Time Intravascular Ultrasound and Photoacoustic Imaging. IEEE Trans Ultrason Ferroelectr Freq Control. 2017;64(1):141-9. doi:10.1109/TUFFC.2016.2640952.
19. Иваницкий А. В., Крюков В. А., Соболев А. В. и др. Значение внутрисосудистого ультразвукового исследования в диагностике легочной гипертензии. Пульмонология. 1999;(4):35-43.
20. Callahan R, Jenkins KJ, Gauthier Z, et al. Preliminary findings on the use of intravascular ultrasound in the assessment of pediatric pulmonary vein stenosis. Catheter Cardiovasc Interv. 2021; 97(3):E362-70. doi:10.1002/ccd.29264.
21. Callahan R, Gauthier Z, Toba S, et al. Correlation of Intravascular Ultrasound with Histology in Pediatric Pulmonary Vein Stenosis. Children (Basel). 2021;8(3):193. doi:10.3390/children8030193.
Об авторах
Н. М. ТрошкиневРоссия
Трошкинев Никита Михайлович — к.м.н., н.с. лаборатории тканевой инженерии и внутрисосудистой визуализации, врач сердечно-сосудистый хирург кардиохирургического отделения № 2.
Сосновый бульвар, 6, Кемерово, 650002
Н. А. Кочергин
Россия
К.м.н., зав. лаборатории тканевой инженерии и внутрисосудистой визуализации.
Сосновый бульвар, 6, Кемерово, 650002
И. В. Ганюков
Россия
Врач по рентгенэндоваскулярной диагностике и лечению отделения рентгенхирургических методов диагностики и лечения.
Сосновый бульвар, 6, Кемерово, 650002
Р. С. Тарасов
Россия
Д.м.н., доцент, зав. лабораторией рентгенэндоваскулярной и реконструктивной хирургии сердца и сосудов отдела хирургии сердца и сосудов.
Сосновый бульвар, 6, Кемерово, 650002
Дополнительные файлы
- Описана серия случаев применения внутрисосудистого ультразвукового исследования (ВСУЗИ) при рентгенэндоваскулярной коррекции врожденных пороков сердца.
- Использование ВСУЗИ помогает в оценке морфологического строения стенки сосуда и определении площади просвета сосуда после ангиопластики.
- Применение ВСУЗИ в сочетании с ангиографией помогает более детально оценить анатомию открытого артериального протока и корректнее выбрать устройство для окклюзии.
Рецензия
Для цитирования:
Трошкинев Н.М., Кочергин Н.А., Ганюков И.В., Тарасов Р.С. Внутрисосудистое ультразвуковое исследование у детей с врожденными пороками сердца. Серия клинических случаев. Кардиоваскулярная терапия и профилактика. 2024;23(5):3897. https://doi.org/10.15829/1728-8800-2024-3897. EDN: ZRANVZ
For citation:
Troshkinev N.M., Kochergin N.A., Ganyukov I.V., Tarasov R.S. Intravascular ultrasound in children with congenital heart defects: a case series. Cardiovascular Therapy and Prevention. 2024;23(5):3897. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3897. EDN: ZRANVZ
JATS XML

























































