Перейти к:
Дополнительный анализ диапазона ширины распределения эритроцитов улучшает предсказательную ценность шкалы GRACE 2.0 в определении риска смерти в течение 18-месяцев у больных острым инфарктом миокарда
https://doi.org/10.15829/1728-88002024-3942
Аннотация
Цель. Определить может ли добавление показателя ширины распределения эритроцитов по объему (RDW — red blood cell distribution width) увеличить предсказательную ценность шкалы Global Registry of Acute Coronary Events (GRACE) 2.0 в определении риска смерти у пациентов с острым инфарктом миокарда (ОИМ).
Материал и методы. В проспективное наблюдательное исследование было включено 577 пациентов с ОИМ, которым была выполнена прямая ангиография коронарных артерий сердца в течение первых 24 ч от начала заболевания. При поступлении в стационар измерялся уровень RDW в рамках протокола автоматизированного общего анализа крови. Шкала GRACE 2.0 рассчитывалась непосредственно при поступлении в стационар после получения результатов лабораторных исследований. В качестве первичной конечной клинической точки была определена смерть в течение 18 мес. с момента окончания госпитализации. Для выявления прогностической ценности значения RDW в качестве дополнения к шкале GRACE 2.0 использовался логистический регрессионный анализ. С целью оценки прироста прогностической ценности сочетания показателя RDW со шкалой GRACE 2.0 при предсказании неблагоприятного клинического исхода рассчитывали площадь под ROC-кривой (Area under curve, AUC) сетевой показатель улучшения реклассификации (NRI — net reclassification improvement) и интегрированный показатель улучшения дискриминации (IDI — integrated discrimination improvement).
Результаты. Средний возраст пациентов составил 65 лет (интерквартильный размах: 56-74 лет), из них 60,7% были мужчины. За 18 мес. наблюдения умерли 66 пациентов, что составило 11,4%. Показатель RDW имел положительную корреляцию со шкалой GRACE 2.0 (r=0,16, p<0,001). Многофакторный анализ продемонстрировал, что и шкала GRACE 2.0, и RDW являются двумя независимыми предикторами смерти в течение 18-мес. — отношение шансов (OR — odds ratio) 1,025; 95% доверительный интервал (ДИ): 1,013-1,037 (p<0,001) и 1,298; 95% ДИ: 1,087-1,551 (p=0,004), соответственно. AUC при прогнозировании риска смерти в течение 18-мес. для шкалы GRACE 2.0, значения RDW и их комбинации составляли 0,795 (95% ДИ: 0,734-0,856), OR — 0,708 (95% ДИ: 0,642-0,775) и OR — 0,826 (95% ДИ: 0,775-0,876), соответственно. Анализ показателя RDW в дополнение к значениям бальной оценки по шкале GRACE 2.0 улучшил значения NRI — 0,428 (p=0,001) и IDI — 0,014 (p=0,002).
Заключение. Величина RDW при поступлении в стационар ассоциировалась со смертью в течение 18-мес. наблюдения у пациентов ОИМ. Дополнительный анализ значения RDW к балльной оценке по шкале GRACE 2.0 позволяет более точно предсказывать долгосрочный риск смерти у больных ОИМ по сравнению с прогнозированием клинического исхода с применением только лишь шкалы GRACE 2.0.
Ключевые слова
Для цитирования:
Хоанг Ч.Х., Майсков В.В., Мерай И.А., Кобалава Ж.Д. Дополнительный анализ диапазона ширины распределения эритроцитов улучшает предсказательную ценность шкалы GRACE 2.0 в определении риска смерти в течение 18-месяцев у больных острым инфарктом миокарда. Кардиоваскулярная терапия и профилактика. 2024;23(8):3942. https://doi.org/10.15829/1728-88002024-3942
For citation:
Hoang T.H., Maiskov V.V., Merai I.A., Kobalava Zh.D. Additional analysis of red blood cell distribution width improves the predictive value of the GRACE 2.0 score for 18-month mortality in patients with acute myocardial infarction. Cardiovascular Therapy and Prevention. 2024;23(8):3942. (In Russ.) https://doi.org/10.15829/1728-88002024-3942
Введение
Острый инфаркт миокарда (ОИМ) является проявлением ишемической болезни сердца (ИБС), представляет собой ведущую причину сердечно-сосудистой смерти и колоссальную медико-социальную проблему для современной системы здравоохранения во всем мире, оказывая крайне неблагоприятное влияние на общественное здоровье [1]. Несмотря на методы профилактики, хорошо установленные диагностические критерии своевременного выявления ОИМ и разработанные алгоритмы его лечения [2], сохраняются высокие показатели смертности от заболевания во всем мире. В настоящее время стратификация риска неблагоприятных клинических исходов, как критерий выбора своевременности начала лечения, агрессивности и длительности вторичной профилактики выходят на первый план в системе здравоохранения всех стран мира с развитой экономикой, что подчеркивает критическое значение стратификации риска для достижения оптимальных результатов выживаемости.
Шкала GRACE (Global Registry of Acute Coronary Events) была разработана и валидирована для оценки прогноза клинических событий у пациентов с острым коронарным синдромом (ОКС) [2][3]. К настоящему моменту шкала GRACE имеет несколько модификаций для прогнозирования ишемический событий среди пациентов с ОКС. Первая версия данной шкалы, опубликованная еще в 2003г, была предложена в качестве оценки риска внутрибольничной смерти на основании анализа результатов лечения 11389 пациентов, включенных в реестр GRACE с 1999 по 2001гг [4]. Затем были разработаны несколько модификаций реестра GRACE, осуществлявших набор пациентов вплоть до 2009г (GRACE 1.0 и 2.0) [5][6]. Эти версии первоначальной шкалы GRACE применялись к различным подгруппам популяции больных с ОКС и смогли продемонстрировать свою ценность как по отношению к риску смерти на протяжении более длительного периода наблюдения (через 1 и 3 года после ОКС для обновленной версии шкалы GRACE 2.0), так и по отношению к совокупному риску смерти и инфаркта миокарда (ИМ). Во всех предложенных версиях шкалы GRACE использовали одни и те же восемь переменных. Однако вклад этих переменных от версии к версии различается. Следует отметить, что в настоящее время в качестве биомаркеров, отражающих различные аспекты патофизиологии ОКС и коморбидных состояний, общепринято учитывать только показатели азотемии и повреждения миокарда. В то же время, существуют некоторые ограничения по возможности применения биомаркеров, отражающих активность тромбообразования и воспаления. Следует учитывать и тот факт, что шкала GRACE была предложена профессиональным сообществом до того момента, как чрескожная коронарная интервенция (ЧКВ, чрескожное коронарное вмешательство) получила широкое распространение в клинической практике в качестве первичной реперфузионной терапии. Остается неясным, насколько ценной она могла бы быть для пациентов, рутинно получающих раннюю реперфузию путем катетеризации, в т.ч. среди пациентов с ИМ с подъемом сегмента ST (ИМпST). Действительно, среди исследователей на этот счет существуют противоречия, и шкала GRACE может иметь иную предсказательную ценность по отношению к пациентам, получающим первичное ЧКВ [7]. Также неясно, какие переменные следует добавить к шкале GRACE, чтобы сделать ее более прогностически ценной и клинически привлекательной в настоящую эпоху ранней реперфузионной терапии.
Ширина распределения эритроцитов по объему (red blood cell distribution width, RDW) — это показатель, используемый в рутинном общем анализе крови для отображения вариабельности объема эритроцитов [8]. RDW рассчитывается путем деления стандартного отклонения (standard deviation, SD) объема эритроцитов на средний объем эритроцита (mean corpuscular volume, MCV) (т.е. RDW = SD/MCV). Результат может быть выражен как в абсолютных значениях в фемтолитрах (т.е. RDW-SD, показывающих разницу между самым маленьким и самым большим эритроцитом), так и в процентах (т.е. RDW-CV, показывающими, насколько объем эритроцитов отклоняется от среднего); последний подход более широко используется в рутинной лабораторной практике [8]. Величина RDW обычно используется в гематологии для дифференциальной диагностики анемии и гематологических расстройств, однако недавно было установлено, что RDW является сильным независимым предиктором неблагоприятных клинических исходов и у пациентов с сердечно-сосудистыми заболеваниями, включая ОКС [8-15] и сердечную недостаточность (СН) [16-19]. В патогенезе ИБС воспаление играет ключевую роль, способствуя нестабильности и разрыву покрышки бляшки [20]. Исследователи предполагали, что воспалительные процессы, нейрогормональная активность и активация адренергической системы оказывают влияние на созревание эритроцитов. Дисфункциональный эритропоэз с повреждением мембраны эритроцитов приводит к повышению значения RDW, т.е. к увеличению вариабельности среднего объема эритроцитов [21][22].
Опубликованы результаты клинических исследований, в которых изучалась возможность добавления показателя RDW в качестве переменной к существующей шкале GRACE для повышения ее прогностической эффективности в определении риска смерти в стационаре у пациентов с ОИМ [23] или долгосрочных сердечно-сосудистых событий у пациентов с ИМпST. Однако предсказательная ценность комплексной оценки значения RDW и шкалы GRACE в долгосрочном клиническом прогнозе смерти у пациентов с ОИМ ранее не изучалась [23][24].
Целью настоящей работы является: (1) оценка прогностической ценности показателя RDW в сравнении со шкалой GRACE для определения прогноза смерти пациентов ОИМ в течение 18 мес. после стационарного лечения и (2) оценка вероятной приростной прогностической ценности их возможного совместного применения.
Материал и методы
Исследуемая популяция. В проспективное одноцентровое наблюдательное исследование были включены пациенты с ОИМ с успешно выполненной коронарографией в первые 24 ч от момента госпитализации за период с 01.01.2017 по 31.12.2018гг в городской клинической больнице имени В. В. Виноградова (Москва, Россия). В исследование не включались пациенты с ОИМ 3-го, 4-го и 5-го типов, а также коморбидные пациенты, у которых развился госпитальный ОИМ во время стационарного лечения конкурирующего заболевания. ОИМ диагностировали в соответствии с критериями Третьего универсального определения [25].
В ходе исследования были проанализированы базовые демографические и клинические характеристики, факторы риска сердечно-сосудистых и сопутствующих заболеваний, данные физикального обследования и методов лабораторно-инструментальной диагностики (электрокардиография, эхокардиография, коронарография). Для измерения уровня сердечного тропонина I использовалась система иммунохимического анализа с автоматическим анализатором Access 2 (Beckman Coulter, США), с верхним референтным пределом 99-го процентиля, равным 0,02 нг/л. Пациенты с неполным медицинским анамнезом изначально не включались в наше исследование. Общий анализ крови включал определение значения RDW (измеряется в процентах, RDW-CV) и гемоглобина и проводился непосредственно при поступлении пациентов в стационар с использованием гематологического анализатора Siemens ADVIA 2120i (Siemens Healthcare Diagnostics, Erlangen, Германия). Стратификация риска для пациентов с ОИМ проводилась с использованием шкалы GRACE 2.0 [6]. Расчет проводили с использованием онлайн-калькулятора на сайте https://www.outcomes-umassmed.org/grace/acs_risk2/index.html. Первичной конечной точкой исследования была смерть от всех причин в течение 18 мес. после выписки из стационара. Смерть определялась как летальный исход от любых причин, зафиксированных в медицинских записях пациента или в Федеральном реестре медицинских документов о смерти.
На момент завершения исследования вся информация о наблюдении была доступной. Исследование соответствует положениям Хельсинкской декларации и было одобрено Локальным этическим комитетом медицинского института Российского университета дружбы народов имени Патриса Лумумбы. Все пациенты подписали письменное информированное согласие.
Статистический анализ. Статистический анализ был выполнен с использованием программного обеспечения IBM SPSS Statistics 25.0 (SPSS Inc., Чикаго, Иллинойс, США), MedCalc Версии 14 (MedCalc, Мариакерке, Бельгия) и программного обеспечения R (версия 3.6.3). Категориальные переменные описывались в виде частот и процентов, а непрерывные переменные представлялись с использованием медианы (Me) и интерквартильного размаха (Q25-Q75). Для сравнения категориальных переменных использовались тест χ2 или точный тест Фишера, а для сравнения групп непрерывных переменных использовался тест Краскела-Уоллиса. Корреляция между значением RDW и баллами по шкале GRACE выполнялась с использованием рангового теста Пирсона. Для выявления факторов, ассоциированных с риском смерти в течение 18-мес., применялись одно- и многофакторные логистические регрессионные анализы с вычислением OR — odds ratio (отношение шансов) и 95% доверительного интервала (ДИ). Предиктивный анализ значения RDW, шкалы GRACE 2.0 и их комбинации анализировались с помощью анализа AUC (Area under curve). Тест ДеЛонга использовался для сравнения AUC шкалы GRACE и комбинированной оценки значения RDW и шкалы GRACE 2.0 [26]. Индекс чистой реклассификации (net reclassification improvement, NRI) и интегрированное улучшение дискриминации (integrated discrimination index, IDI) анализировались для оценки степени, с которой добавление показателя RDW к шкале GRACE 2.0 улучшило прогностическую способность (с использованием пакета "rms" в R), как описано ранее [27]. Значимость рассматривалась при двустороннем p<0,05 для всех анализов.
Результаты
Демографические и клинические характеристики
В исследование было включено всего 577 последовательно поступавших пациентов, из них 227 (39,3%) пациентов — женщины. Me возраста пациентов составила 65 лет (56-74), у 47,1% госпитализированных выявлены электрокардиографические (ЭКГ) признаки подъема сегмента ST. В течение периода наблюдения всего было зафиксировано 66 (11,4%) смертей. Клинические характеристики пациентов и оригинальной когорты шкалы GRACE 2.0 представлены в таблице 1.
Характеристики наших больных были аналогичными оригинальной когорте шкалы GRACE 2.0, за исключением частоты заболевания периферических артерий и реваскуляризации миокарда, которые встречались реже среди нашей когорты больных.
По сравнению с выжившими возраст, доля женщин, анамнез ИБС, СН, анамнез сахарного диабета II типа, перенесенного инсульта, фибрилляции предсердий, хронической болезни почек (ХБП), заболеваний периферических артерий, анемии, значение RDW, тахипноэ, класс острой СН по шкале Killip II-IV, 3-сосудистое поражение коронарных артерий (КА), баллы по шкале GRACE 2.0 были выше в группе умерших пациентов. Уровень гемоглобина и фракция выброса левого желудочка (ФВ ЛЖ) в группе умерших пациентов были ниже. По остальным характеристикам группы были сопоставимы.
Ассоциация между RDW и шкалой GRACE 2.0
Была обнаружена слабая положительная связь между значениями RDW и шкалой GRACE 2.0 (r=0,16, p<0,001) (рисунок 1).
RDW как независимый предиктор смерти в течение 18-мес.
В однофакторном логистическом регрессионном анализе значимыми предикторами смерти в течение 18-мес. были возраст, женский пол, анамнез ИБС, перенесенный инсульт, сахарный диабет II типа, фибрилляция предсердий, ХБП, анемия, острая СН, значение шкалы GRACE 2.0, 3-сосудистое поражение КА и вариабельность значения RDW (таблица 2).
Результаты многофакторного анализа, представленные в таблице 3, показали, что RDW является значимым и независимым предиктором смерти в течение 18 мес. — OR: 1,298; 95% ДИ: 1,087-1,551 (p=0,004). Кроме того, высокий балл по шкале GRACE (OR: 1,025; 95% ДИ: 1,013-1,037; p<0,001), женский пол (OR: 2,019; 95% ДИ: 1,027-3,970; p=0,042) и 3-сосудистое поражение КА (OR: 3,146; 95% ДИ: 1,468-6,744; p=0,003) были выявлены как значимые предикторы смерти в течение 18 мес.
Прогностическое значение RDW, шкалы GRACE 2.0 и их комбинации в прогнозировании риска летального исхода в течение 18-мес.
При анализе ROC-кривых, AUC для шкалы GRACE 2.0 в прогнозировании долгосрочного риска летальности составила 0,795 (95% ДИ: 0,734-0,856, p<0,001, чувствительность 72,7%, специфичность 78,7%, пороговое значение >139 баллов). Для RDW, AUC составила 0,708, 95% ДИ: 0,642-0,775 (p<0,001), пороговое значение составило 14,20%, с чувствительностью 78,8% и специфичностью 54,8%. Добавление RDW к шкале GRACE 2.0 увеличило прогностическую ценность метода (AUC =0,826, 95% ДИ: 0,775-0,876, p<0,001), чувствительность и специфичность составили 87,9 и 65,9%, соответственно (рисунок 2).
Статистически значимых различий AUC не обнаружено при добавлении RDW к шкале GRACE 2.0 в сравнении с изолированной шкалой GRACE 2.0 для прогнозирования риска смерти в течение 18-мес. (p=0,444). Однако добавление показателя RDW к шкале GRACE 2.0 благоприятно отразилось на динамике сетевого показателя улучшения реклассификации по сравнению с использованием только шкалы GRACE 2.0 для прогнозирования риска смерти в течение 18-мес. с NRI 0,428 (p=0,001). Интегрированный показатель улучшения дискриминации также продемонстрировал, что добавление RDW к стандартному протоколу шкалы GRACE 2.0 существенно повысило диагностическую эффективность комбинированной модели (IDI 0,014, p=0,002) (рисунок 2).
Таблица 1
Основные характеристики пациентов с ИМ
Показатель | Оригинальная когорта шкалы GRACE 2.0 (n=32037) [6] | Популяция пациентов (n=577) | Выжившие пациенты (n=511) | Умершие пациенты (n=66) | p |
Возраст, годы, Ме (Q25; Q75) | 66,6 (56,0; 76,4) | 65 (56; 74) | 64 (55; 72) | 77 (67,7; 84) | <0,001 |
Женщины, n (%) | 33% | 227 (39,3) | 186 (36,4) | 41 (62,1) | <0,001 |
Подъем сегмента ST, n (%) | 36% | 272 (47,1) | 234 (45,8) | 38 (57,6) | 0,088 |
Артериальная гипертензия, n (%) | 64% | 516 (89,4) | 454 (88,8) | 22 (93,9) | 0,286 |
ИБС, n (%) | 44% | 262 (45,4) | 216 (43,2) | 46 (69,7) | <0,001 |
Предшествующий ИМ, n (%) | 30% | 124 (21,5) | 101 (20,4) | 20 (30,3) | 0,079 |
Предшествующая реваскуляризация миокарда, n (%) | 32% | 72 (12,5) | 65 (12,7) | 7 (10,6) | 0,843 |
Предшествующая СН, n (%) | 10% | 40 (6,9) | 31 (6,1) | 9 (13,6) | 0,035 |
Сахарный диабет II типа, n (%) | 26% | 126 (21,8) | 103 (20,2) | 23 (34,8) | 0,011 |
Предшествующий ЦВИ, n (%) | 8,5% | 41 (7,1) | 29 (5,7) | 12 (18,2) | 0,001 |
Фибрилляция предсердий в анамнезе, n (%) | 7,7% | 62 (10,7) | 48 (9,4) | 14 (21,2) | 0,009 |
ХБП, n (%) | 7,6% | 42 (7,3) | 31 (6,1) | 11 (16,7) | 0,005 |
ЗПА, n (%) | 9% | 18 (3,1) | 13 (2,5) | 5 (7,6) | 0,044 |
Хроническое заболевание легких, n (%) | – | 83 (14,4) | 68 (13,3) | 15 (22,7) | 0,06 |
ЯБ желудка и 12-перстной кишки, n (%) | – | 55 (9,5) | 48 (9,4) | 7 (10,6) | 0,662 |
Анемия, n (%) | – | 156 (27,0) | 120 (23,5) | 36 (54,5) | <0,001 |
Боль в грудной клетке, n (%) | – | 529 (91,7) | 473 (92,6) | 56 (84,8) | 0,053 |
Одышка, n (%) | – | 107 (18,5) | 87 (17,0) | 20 (30,3) | 0,017 |
Класс Killip II-IV, n (%) | 15% | 137 (23,7) | 101 (19,8) | 36 (54,5) | <0,001 |
Систолическое АД, мм рт.ст., Ме (Q25; Q75) | 140 (120; 160) | 137,5 (120; 157,7) | 140 (120; 160) | 130 (112; 150) | 0,094 |
Диастолическое АД, мм рт.ст., Ме (Q25; Q75) | 80 (70; 90) | 80 (74; 89,7) | 80 (75; 90) | 80 (68; 89,5) | 0,065 |
Тропонин I, нг/мл, Ме (Q25; Q75) | – | 0,39 (0,09; 2,85) | 0,37 (0,09; 2,88) | 0,36 (0,09; 2,46) | 0,896 |
Гемоглобин, г/л, Ме (Q25; Q75) | – | 136 (123; 147) | 138 (125; 148) | 121 (105; 136) | <0,001 |
RDW, %, Ме (Q25; Q75) | – | 14,2 (13,5; 15) | 14,1 (13,5; 14,9) | 15,0 (14,3; 16,6) | <0,001 |
Креатинин, мкмоль/л, Ме (Q25; Q75) | 90,2 (79,6; 110,5) | 94 (80; 107) | 92 (80; 107,25) | 100,5 (79,7; 125) | 0,050 |
ФВ ЛЖ, %, Ме (Q25; Q75) | – | 45 (40; 54) | 45 (40; 55) | 40 (35,2; 50) | 0,002 |
Отсутствие поражений/стеноз <50% КА, n (%) | – | 64 (11,1) | 61 (11,9) | 3 (4,5) | 0,093 |
3-сосудистое поражение КА, n (%) | – | 301 (52,2) | 248 (48,5) | 53 (80,3) | <0,001 |
ЧКВ, n (%) | – | 459 (79,5) | 407 (79,6) | 52 (78,8) | 0,872 |
Шкала GRACE 2.0, баллы, Ме (ИКР) | – | 117 (98; 141) | 113 (96; 136) | 152 (132,7; 179,2) | <0,001 |
Примечание: АД — артериальное давление, ЗПА — заболевания периферических артерий, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, КА — коронарные артерии, Ме (Q25; Q75) — медиана (ИКР, интерквартильный размах), СН — сердечная недостаточность, ФВ ЛЖ — фракция выброса левого желудочка, ХБП — хроническая болезнь почек, ЦВИ — цереброваскулярный инцидент, ЧКВ — чрескожное коронарное вмешательство, ЯБ — язвенные болезни, GRACE — Global Registry of Acute Coronary Events, RDW — red blood cell distribution width.
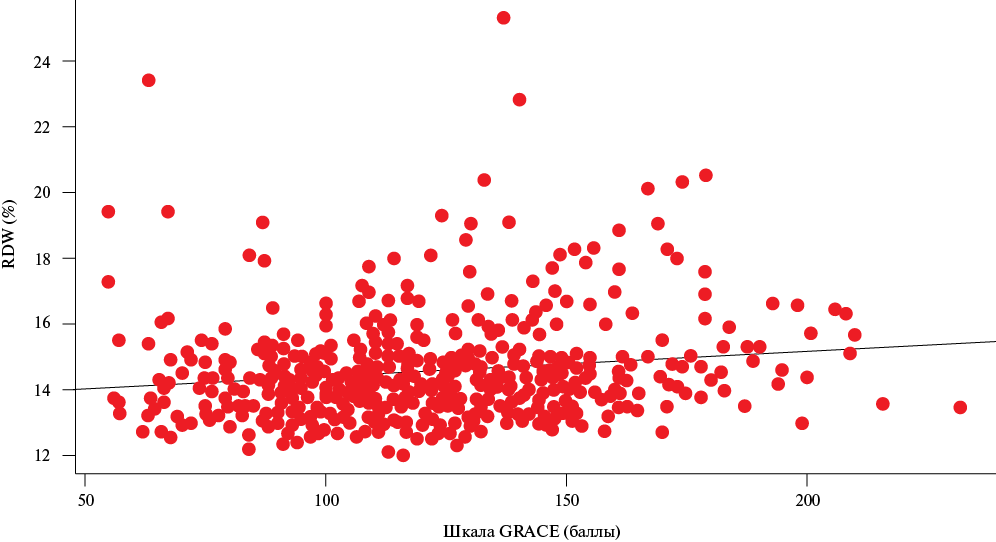
Рис. 1 Диаграмма рассеяния, демонстрирующая взаимосвязь между RDW и баллом по шкале GRACE 2.0.
Примечание: GRACE — Global Registry of Acute Coronary Events, RDW — Red blood cell Distribution Width.
Таблица 2
Однофакторный анализ факторов риска в прогнозировании летальных исходов в течение 18-мес. у пациентов с ИМ
Показатель | OR (95% ДИ) | p |
Баллы по шкале GRACE 2.0 (за каждый балл) | 1,040 (1,030-1,050) | <0,001 |
Возраст (за каждый год) | 1,099 (1,069-1,130) | <0,001 |
Женский пол | 2,866 (1,688-4,864) | <0,001 |
Анамнез ИБС | 3,141 (1,806-5,464) | <0,001 |
Предшествующий ЦВИ | 3,693 (1,781-7,658) | <0,001 |
Сахарный диабет II типа | 2,119 (1,222-3,674) | 0,008 |
Фибрилляция предсердий в анамнезе | 2,597 (1,341-5,028) | 0,005 |
ХБП | 3,097 (1,474-6,505) | 0,003 |
Анемия | 3,910 (2,311-6,616) | <0,001 |
Класс Killip II-IV ≥2 | 4,871 (2,864-8,286) | <0,001 |
ФВ ЛЖ ≤40% | 2,562 (1,428-4,599) | 0,002 |
3-сосудистое поражение КА | 4,324 (2,301-8,125) | <0,001 |
RDW (за каждый процент) | 1,378 (1,202-1,581) | <0,001 |
Примечание: ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, КА — коронарные артерии, ФВ ЛЖ — фракция выброса левого желудочка, ХБП — хроническая болезнь почек, ЦВИ — цереброваскулярный инцидент, GRACE — Global Registry of Acute Coronary Events, RDW — red blood cell distribution width, OR — odds ratio (отношение шансов).
Таблица 3
Многофакторный анализ факторов риска в прогнозировании летальных исходов в течение 18-мес. у пациентов с ИМ
Показатель | OR (95% ДИ) | p |
Баллы по шкале GRACE 2.0 (за каждый балл) | 1,025 (1,013-1,037) | <0,001 |
Женский пол | 2,019 (1,027-3,970) | 0,042 |
Анамнез ИБС | 1,321 (0,656-2,660) | 0,436 |
Предшествующий ЦВИ | 1,790 (0,725-4,420) | 0,207 |
Сахарный диабет II типа | 1,323 (0,636-2,753) | 0,454 |
Фибрилляция предсердий в анамнезе | 1,602 (0,727-3,533) | 0,243 |
ХБП | 1,202 (0,441-3,280) | 0,719 |
Анемия | 1,223 (0,602-2,486) | 0,578 |
ФВ ЛЖ ≤40% | 1,736 (0,900-3,349) | 0,100 |
3-сосудистое поражение КА | 3,146 (1,468-6,744) | 0,003 |
RDW (за каждый процент) | 1,298 (1,087-1,551) | 0,004 |
Примечание: ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, КА — коронарные артерии, ФВ ЛЖ — фракция выброса левого желудочка, ХБП — хроническая болезнь почек, ЦВИ — цереброваскулярный инцидент, GRACE — Global Registry of Acute Coronary Events, RDW — red blood cell distribution width, OR — odds ratio (отношение шансов).
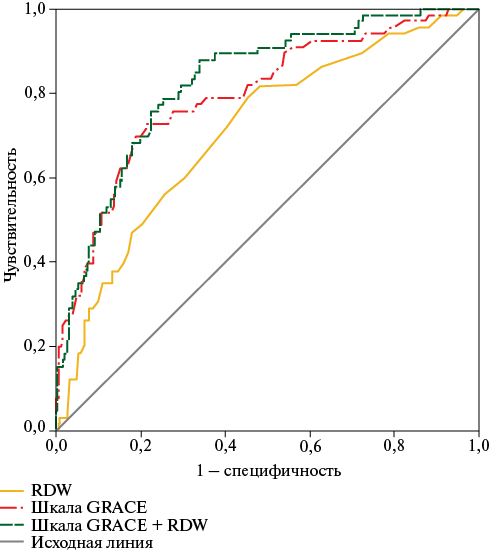
Шкала GRACE по сравнению со шкалой GRACE + RDW | |
Площадь под ROC-кривой | 0,795 vs 0,826 (Z-статистика =-0,766; p=0,444) |
Net reclassification index (NRI) | 0,428; p=0,0009 |
Integrated discrimination index (IDI) | 0,014; p=0,002 |
Рис. 2 Анализ ROC-кривой для ширины распределения эритроцитов (RDW), шкалы GRACE 2.0 и их комбинации прогнозировании риска смерти в течение 18 мес. у пациентов с ИМ.
Примечание: ИМ — инфаркт миокарда, AUC — Area Under Curve, GRACE — Global Registry of Acute Coronary Events, IDI — integrated discrimination improvement (интегрированное улучшение дискриминации), NRI — net reclassification improvement (индекс чистой реклассификации), RDW — Red red blood cell distribution width (ширина распределения эритроцитов по объему), ROC — Receiver Operating Characteristic. Цветное изображение доступно в электронной версии журнала.
Обсуждение
Результаты настоящего исследования показали, что повышенное значение RDW при поступлении пациентов с ОИМ является независимым предиктором смерти в долгосрочном периоде после поправки на другие факторы риска. Кроме того, RDW слабо коррелировал со шкалой GRACE 2.0, но добавлял инкрементальный прирост прогностической ценности при комбинации с шкалой GRACE.
RDW традиционно служил фактором для дифференциации различных форм анемии. Повышение уровня RDW указывает на наличие анизоцитоза, вариабельности размера эритроцитов, обусловленного неэффективным эритропоэзом. Повышенный RDW часто наблюдается в случаях недостатка железа, фолиевой кислоты или витамина B12 [28]. Кроме гематологических нарушений, эпидемиологические исследования продемонстрировали, что высокие уровни RDW ассоциируются с развитием осложненного течения ИБС и риском смерти от всех причин [8][12][29-31]. В контексте ОИМ предыдущие исследования предположили наличие связи между повышением значения RDW и неблагоприятными исходами у пациентов ОИМ [29][31][32]. Uyarel H, et al. [29] сообщили, что у 2506 пациентов c ИМпST, проходивших ЧКВ, повышенный уровень RDW при поступлении (среднее значение 16,1±1,6%) по сравнению с пациентами с нормальным значением RDW (среднее значение 13,4±0,8%) был связан с более высоким риском смерти в стационаре (7,6 vs 3,6%, p<0,001). Величина RDW при поступлении являлась независимым долгосрочным (21 мес.) предиктором сердечной смерти (отношение рисков (hazard ratio, HR) 1,831, 95% ДИ: 1,034-3,24 (p=0,03). Кроме того, в настоящем исследовании повышенный уровень RDW при поступлении также был расценен в качестве независимого предиктора сердечной смерти в подгруппе пациентов без анемии — HR: 2,703, 95% ДИ: 1,208-6,048 (p=0,016). Khaki S, et al. [30] последовательно отследили 649 пациентов с ОИМ в течение 6 мес. и обнаружили, что у пациентов с высоким значением RDW (≥14,6%) риск смерти в течение 6-мес. был значительно выше, чем среди пациентов с низким уровнем RDW (<14,6%) — 24,3 vs 7,9% (p<0,001). Gul M, et al. [31] показали, что уровень RDW при поступлении независимо предсказывал сердечную смерть в течение трех лет у 3101 пациента с ОИМ (HR: 3,2, 95% ДИ: 1,3-7,78, p=0,01) после коррекции факторов риска. Схожие результаты исследований показали, что RDW при поступлении независимо предсказывал риск смерти в течение 18-мес. с OR, равным 1,298. В анализе ROC-кривых RDW продемонстрировал умеренную способность для прогнозирования смертельных исходов в течение 18-мес. с AUC равной 0,708, что соответствует результатам Li, et al. [33], демонстрирующим умеренную прогностическую эффективность RDW в предсказании риска смерти в течение одного года и трех лет (AUC 0,701 и 0,725, соответственно) среди 826 пациентов ОИМ. В ретроспективной работе Turcato G, et al. [34] исследовали 979 пациентов ОИМ, по основным неблагоприятным сердечным событиям (ОНСС) и смерти в течение 3 мес. В качестве определения ОНСС рассматривалась совокупность ОИМ, необходимость ЧКВ и коронарного шунтирования, проведения обоснованной незапланированной коронарографии. В многофакторном анализе авторы исследования продемонстрировали, что значение RDW независимо ассоциировалось с ОНСС в течение 3 мес. (скорректированное OR 1,36; 95% ДИ: 1,19-1,55; p<0,001) и смертью (скорректированное OR 1,34; 95% ДИ: 1,05-1,71; p=0,02). AUC для прогнозирования ОНСС в течение 3 мес. составила 0,67 (95% ДИ: 0,66-0,72; p<0,001), с пороговым значением RDW 14,8%, что было связано с 3,8 (95% ДИ: 2,6-5,7; p<0,001) выше риском ОНСС в течение 3 мес.
Несмотря на полученные доказательства, подтверждающие прогностическую ценность RDW при сердечно-сосудистых заболеваниях, механистические связи между повышенным уровнем RDW и клиническими неблагоприятными исходами остаются недостаточно разъясненными. Вероятные механизмы включают воспалительные и нейрогормональные активации, подтверждаемые корреляциями между повышенным уровнем RDW и такими маркерами, как натрийуретический пептид В-типа, скорость оседания эритроцитов и количество лейкоцитов [17][18][35]. Подавление зрелости эритроцитов противовоспалительными цитокинами может способствовать повышению значения RDW, свидетельствующему о нарушении эритропоэза [36]. Кроме того, белково-энергетическая недостаточность и комбинированная дислипидемия также связаны с повышением уровня RDW за счет их влияния на эритропоэз [14][37].
Шкала GRACE, рекомендованная действующими руководствами [2, 3], является надежным инструментом для прогнозирования неблагоприятных клинических исходов пациентов с ОКС. Так, в проспективном исследовании с участием 2357 пациентов с ОКС, поступивших в 438 больниц Австралии и Новой Зеландии, доля лиц, умерших в течение 18 мес. составила 12,6% (n=296). Более высокий балл по шкале GRACE был связан со значительно более высоким риском смерти в многовариантной модели — HR 1,04, 95% ДИ: 1,03-1,04 (p<0,001) [38]. В отечественной литературе существует несколько исследований, подтверждающих прогностическую роль шкалы GRACE в стратификации отдаленных исходов после ИМ. Кокорин В. А. и др. [39] исследовали возможность включения в шкалу GRACE 2.0 сердечного белка, связывающего жирные кислоты, у 183 пациентов с верифицированным диагнозом ОКС, из которых у 114 (62,3%) больных был диагностирован ОИМ. Авторы продемонстрировали эффективность шкалы GRACE 2.0 в прогнозировании летального исхода в стационаре и в течение 12 мес. после ОКС с использованием сердечного тропонина I. В этом исследовании AUC составила 0,858 и 0,841, соответственно [39]. Бернс С. А. и др. [40] изучали возможность применения шкалы GRACE для долгосрочной оценки риска у 415 больных с ОКС без подъема сегмента ST. Авторы показали, что при многофакторном анализе шкала GRACE >120 баллов, ФВ ЛЖ <47% и мультифокальный атеросклероз являются независимыми предикторами смерти/ИМ в течение 6 лет. При этом сочетание трех указанных компонентов имело хорошие классификационные характеристики: чувствительность — 88,2%, специфичность — 68,7%, AUC — 0,824 (р<0,001) [40]. Результаты этого исследования частично согласуются с нашими данными.
Другие шкалы, такие как CADILLAC (Controlled Abciximab and Device Investigation to Lower Late Angioplasty Complications) и PAMI (Primary Angioplasty in Myocardial Infarction), были разработаны для оценки исходов пациентов, подвергшихся ЧКВ после ИМ. Опубликованная в 2005г шкала CADILLAC предполагает её использование у пациентов, прошедших процедуру реваскуляризации инфаркт-ответственной КА. В ней учитываются возраст пациента, класс острой СН по Killip, наличие почечной дисфункции, анемии, 3-сосудистое поражение коронарного русла и снижение ФВ ЛЖ по эхокардиографии. Шкала CADILLAC позволяет проводить стратификацию риска смерти в течение 12 мес. (AUC — 0,824) после перенесённого ИМ [41]. Шкала PAMI включает балльную оценку следующих параметров у пациентов с ОИМ: возраст, частота сердечных сокращений при поступлении, класс острой СН по Killip, переднюю локализацию ИМ или блокаду левой ножки пучка Гиса, а также подтверждённый диагноз сахарного диабета II типа [42]. Шкалу PAMI также предлагали использовать для прогнозирования клинических исходов в течение 12 мес., но существенным ограничением этой шкалы является то, что при ее составлении исключались пациенты с кардиогенным шоком, со сложной и многососудистой коронарной анатомией, а также пациенты, перенесшие ЧКВ после неудачной тромболитической терапии. Однако в реальной клинической практике такие пациенты могут составлять половину и более среди поступивших в стационар [43]. Зыков М. В. и др. [44] при изучении прогностического значения шкал PAMI, CADILLAC и GRACE у 423 последовательно госпитализированных пациентов с диагнозом ИМпST выявили, что для прогнозирования риска смертельных исходов или развития комбинированной точки (смерть или нефатальный ИМ) в течение одного года наблюдения наибольшей значимостью обладает шкала GRACE с AUC 0,78 и 0,70, соответственно. Однако в этом исследовании авторы использовали шкалу GRACE версии 1.0 [44].
Текущая версия GRACE 2.0 предполагает использование исключительно двух лабораторных биомаркеров (креатинина и сердечных тропонинов I и T), что не позволяет учитывать все патофизиологические механизмы, влияющие на клинические исходы. Попытки включения дополнительных переменных, таких как гемоглобин, D-димер и уровень кальция для внутрибольничной смерти [45-47], N-концевой промозговой натрийуретический пептид (NT-proBNP) для прогнозирования риска смерти в течение 30 сут. [48], наличие анемии и индекс коморбидности Чарлсона для прогнозирования риска смерти в течение 6 мес. [49][50], продемонстрировали дополнительные возможности шкалы GRACE. Однако возможности шкалы для осуществления долгосрочного прогноза были ограничены. В предыдущих исследованиях сообщалось о дополнительной прогностической ценности RDW в дополнение к шкале GRACE. В исследовании Sangoi MB, et al. [51], в которое вошло 109 пациентов ОКС, RDW при включении в шкалу GRACE оказался независимым предиктором смерти в стационаре (HR 1,358, 95% ДИ: 1,04-1,77; p=0,023) с удовлетворительной калибровкой (p-значение Хосмера-Лемешоу 0,174) и незначительным улучшением дискриминационной способности (AUC 0,769, 95% ДИ; 0,677-0,847; p≤0,0001). Аналогично, в исследовании Zhao N, et al. [52], в которое вошло 480 последовательно поступавших пациентов с ОКС с Me наблюдения в 37,2 мес., было выявлено, что значение RDW, как и использование шкалы GRACE, является независимым предиктором смерти от всех причин и нефатального ОИМ. Добавление RDW к шкале GRACE увеличило AUC для ОНСС с 0,749 (95% ДИ: 0,707-0,787) до 0,805 (0,766-0,839, p=0,034), с положительной динамикой сетевого показателя улучшения реклассификации (NRI=0,352, p<0,001) и приростом интегрированного показателя улучшения дискриминации (IDI 0,023, p=0,002).
Исследование Chang X, et al. [24], в которое вошли 390 пациентов с ОКС с подъемом сегмента ST, продемонстрировало, что значение RDW и шкала GRACE были ключевыми независимыми предикторами ОНСС и сердечной смерти в регрессионной модели Кокса. Оптимальные пороговые значения были определены в 13,25% для RDW (AUC =0,694, 95% ДИ: 0,639-0,750, p<0,001) и 119,5 для шкалы GRACE (AUC =0,721, 95% ДИ: 0,666-0,777, p<0,001). Комбинирование RDW и шкалы GRACE дополнительно улучшило прогностическую способность методики (AUC =0,775, 95% ДИ: 0,727-0,824, p<0,001). Анализ кривых Каплана-Мейера подчеркнул значимую прогностическую ценность комбинации с наивысшим риском сердечной смерти, наблюдаемым в группе с высоким RDW (>13,25%) и высоким баллом по шкале GRACE (>119,5 баллов (Лог-ранк χ2=24,684, p<0,001). Подобно этому настоящее исследование также продемонстрировало независимую прогностическую способность как шкалы риска GRACE, так и значения RDW для оценки риска летальных исходов в течение 18-мес. у пациентов с ОКС. Кроме того, включение показателя RDW в шкалу GRACE значительно улучшило ее прогностическую способность для оценки риска смерти в течение 18 мес. после выписки. В то время как инкрементные изменения в AUC не были статистически значимыми, анализ чистой реклассификации показал значительное улучшение прогностической способности шкалы GRACE для долгосрочной оценки риска смерти при добавлении RDW. Незначительные изменения в AUC объясняются вариабельностью результатов, в отличие от стабильно воспроизводимых значений по шкале GRACE [53]. Для оценки реклассификации с использованием новых биомаркеров рекомендуется использовать NRI [27]. Значительное улучшение чистой реклассификации при включении RDW в шкалу GRACE указывает на более точную стратификацию долгосрочного риска для пациентов с ОИМ по сравнению с использованием только шкалы GRACE, что является важным при принятии решений персонифицированного лечения в реальной клинической практике.
В предыдущих исследованиях сообщалось о корреляции между RDW и шкалой GRACE. Так, в проспективном исследовании Contreras Gutiérrez VH [54], включившем 61 пациента ИМпST, была выявлена статистически значимая положительная корреляция между RDW и шкалой GRACE при поступлении (r=0,410, p=0,01). Аналогичные результаты, соответствующие выводам нашего исследования, были получены и в работе Polat N, et al. [23] при изучении 193 пациентов с нестабильной стенокардией/ОИМ без подъема сегмента ST на ЭКГ (r=0,351, p<0,001). Очевидно, что повышение уровня RDW ожидается и у пациентов с ОИМ и высоким баллом по шкале GRACE, особенно если учитывать взаимосвязь между различными компонентами шкалы GRACE и RDW. Кроме того, повышение уровня креатинина, параметра, включенного в расчет риска по шкале GRACE [55], свидетельствует о значительной корреляции с увеличенными значениями RDW.
В настоящем исследовании установлено, что женский пол и 3-сосудистое атеросклеротическое поражение КА сердца являются независимыми предикторами смерти в отдаленный период. Этот результат согласуется с данными предыдущих публикаций [41][56], однако инкрементальный прирост прогностической ценности этих факторов в сочетании со значением RDW в шкале GRACE еще предстоит оценить в будущих исследованиях.
Настоящее исследование имеет несколько ограничений. Во-первых, несмотря на его проектирование в качестве проспективного, оно было неслучайным и наблюдательным, проведено на выборке относительно небольшого объема в рамках одного центра. Во-вторых, важные факторы, включая воспалительные маркеры, статус питания, запасы витамина B12, железа и фолиевой кислоты, уровень натрийуретического пептида, потенциально связанные с повышением значения RDW, в нашем исследовании не определялись. В-третьих, мы сосредоточились на оценке вероятности смерти в течение 18 мес., однако шкала GRACE 2.0 не была калибрована для 18-мес. периода наблюдения, поэтому ценность добавления RDW к шкале GRACE 2.0 предстоит изучить.
Заключение
Повышенный уровень RDW при поступлении пациентов в стационар оказался независимым предиктором летальных исходов в течение 18-мес. среди пациентов ОИМ. Включение значения RDW в шкалу GRACE может повысить предиктивное значение для оценки риска летальных исходов в долгосрочном периоде у пациентов ОИМ. Эти результаты указывают на потенциальные перспективы улучшения прогнозирования и разработки персонифицированных терапевтических методик лечения и профилактики.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Salari N, Morddarvanjoghi F, Abdolmaleki A, et al. The global prevalence of myocardial infarction: a systematic review and meta-analysis. BMC Cardiovasc Disord. 2023;23:206. doi:10.1186/s12872-023-03231-w.
2. Byrne RA, Rossello X, Coughlan JJ, et al. 2023 ESC Guidelines for the management of acute coronary syndromes: Developed by the task force on the management of acute coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J. 2023;44(38):3720-826. doi:10.1093/eurheartj/ehad191.
3. Gulati M, Levy PD, Mukherjee D, et al. 2021 AHA/ACC/ASE/ CHEST/SAEM/SCCT/SCMR Guideline for the Evaluation and Diagnosis of Chest Pain: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2021;78(22):e187- 285. doi:10.1016/j.jacc.2021.07.053.
4. Granger CB, Goldberg RJ, Dabbous O, et al. Predictors of Hospital Mortality in the Global Registry of Acute Coronary Events. Arch Intern Med. 2003;163(19):2345-53. doi:10.1001/archinte.163.19.2345.
5. Fox KAA, Dabbous OH, Goldberg RJ, et al. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ. 2006;333(7578):1091. doi:10.1136/bmj.38985.646481.55.
6. Fox KAA, Fitzgerald G, Puymirat E, et al. Should patients with acute coronary disease be stratified for management according to their risk? Derivation, external validation and outcomes using the updated GRACE risk score. BMJ Open. 2014;4:e004425. doi:10.1136/bmjopen-2013-004425.
7. Abu-Assi E, Ferreira-González I, Ribera A, et al. Do GRACE (Global Registry of Acute Coronary events) risk scores still maintain their performance for predicting mortality in the era of contemporary management of acute coronary syndromes? Am Heart J. 2010;160(5). doi:10.1016/j.ahj.2010.06.053.
8. Danese E, Lippi G, Montagnana M. Red blood cell distribution width and cardiovascular diseases. J Thorac Dis. 2015; 7(10):E402-11. doi:10.3978/j.issn.2072-1439.2015.10.04.
9. Arkew M, Gemechu K, Haile K, Asmerom H.Red Blood Cell Distribution Width as Novel Biomarker in Cardiovascular Diseases: A Literature Review. J Blood Med. 2022;13:413-24. doi:10.2147/JBM.S367660.
10. Li N, Zhou H, Tang Q. Red Blood Cell Distribution Width: A Novel Predictive Indicator for Cardiovascular and Cerebrovascular Diseases. Dis Markers. 2017;2017:7089493. doi:10.1155/2017/7089493.
11. Liang L, Huang L, Zhao X, et al. Prognostic value of RDW alone and in combination with NT‐proBNP in patients with heart failure. Clin Cardiol. 2022;45(7):802-13. doi:10.1002/clc.23850.
12. Huang S, Zhou Q, Guo N, et al. Association between red blood cell distribution width and in-hospital mortality in acute myocardial infarction. Med (United States). 2021;100(15):E25404. doi:10.1097/MD.0000000000025404.
13. Ren H, Hua Q, Quan M, et al. Relationship between the red cell distribution width and the one-year outcomes in Chinese patients with stable angina pectoris. Intern Med. 2013;52(16):1769-74. doi:10.2169/internalmedicine.52.9314.
14. Циванюк М. М., Гельцер Б. И., Шахгельдян К. И. и др. Показатели клинического анализа крови, липидного спектра и их соотношений в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема ST. Российский кардиологический журнал. 2022;27(8):5079. doi:10.15829/1560-4071-2022-5079.
15. Урванцева И. А., Николаев К.Ю., Саламатина Л.В. и др. Ассоциации вариабельности объема эритроцитов с клинико-лабораторными характеристиками острого инфаркта миокарда. Атеросклероз. 2013;9(3-4):31-7.
16. Костенко В.А., Ситникова М. Ю., Скородумова Е. А. и др. Прогностическое значение коэффициента анизотропии эритроцитов у пациентов, госпитализированных по поводу острой декомпенсированной хронической сердечной недостаточности. Российский кардиологический журнал. 2017;(12):26-30. doi:10.15829/1560-4071-2017-12-26-30.
17. Каранадзе Н. А., Беграмбекова Ю. Л., Борисов Е. Н. и др. Ширина распределения эритроцитов как предиктор низкой толерантности к физической нагрузке у пациентов с хронической сердечной недостаточностью. Кардиология. 2022;62(4):30-5. doi:10.18087/cardio.2022.4.n1813.
18. Гайсёнок О.В., Леонова М.В. Индекс гетерогенности эритроцитов как биомаркер тяжести хронической сердечной недостаточности у пожилых пациентов. Медицинский совет. 2021;14:134-40. doi:10.21518/2079-701X-2021-14-134-140.
19. Скородумова Е. Г., Костенко В. А., Скородумова Е. А. и др. Ширина распределения эритроцитов — потенциально новый маркер острой декомпенсации сердечной недостаточности. Кардиология: новости, мнения, обучение. 2017;1:40-3. doi:10.24411/2309-1908-2017-00015.
20. Reed GW, Rossi JE, Cannon CP. Acute myocardial infarction. Lancet. 2017;389(10065):197-210. doi:10.1016/S0140-6736(16)30677-8.
21. Salvagno GL, Sanchis-Gomar F, Picanza A, Lippi G.Red blood cell distribution width: A simple parameter with multiple clinical applications. Crit Rev Clin Lab Sci. 2015;52(2):86-105. doi:10.3109/10408363.2014.992064.
22. Xanthopoulos A, Giamouzis G, Dimos A, et al. Red Blood Cell Distribution Width in Heart Failure: Pathophysiology, Prognostic Role, Controversies and Dilemmas. J Clin Med. 2022;11(7). doi:10.3390/jcm11071951.
23. Polat N, Yildiz A, Oylumlu M, et al. Relationship between red cell distribution width and the GRACE risk score with in-hospital death in patients with acute coronary syndrome. Clin Appl Thromb. 2014;20(6):577-82. doi:10.1177/1076029613500707.
24. Chang X, Zhang S, Zhang M, et al. Combined value of red blood cell distribution width and global registry of acute coronary events risk score on predicting long-term major adverse cardiac events in STEMI patients undergoing primary PCI. Lipids Health Dis. 2018;17(1):13971-80. doi:10.1186/s12944-018-0881-7.
25. Thygesen K, Alpert J, Jaffe A, et al. Third universal definition of myocardial infarction. Circulation. 2012;126(16):2020-35. doi:10.1161/CIR.0b013e31826e1058.
26. DeLong ER, DeLong DM, Clarke-Pearson DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach. Biometrics. 1988; 44(3):837-45.
27. Pencina MJ, D'Agostino RB Sr, D'Agostino RB Jr, et al. Evaluating the added predictive ability of a new marker: from area under the ROC curve to reclassification and beyond. Stat Med. 2008; 27(2):157-72. doi:10.1002/sim.2929.
28. Bessman JD, Gilmer PR, Gardner FH. Improved classification of anemias by MCV and RDW. Am J Clin Pathol. 1983;80(3):322-6. doi:10.1093/ajcp/80.3.322.
29. Uyarel H, Ergelen M, Cicek G, et al. Red cell distribution width as a novel prognostic marker in patients undergoing primary angioplasty for acute myocardial infarction. Coron Artery Dis. 2011;22(3):138-44. doi:10.1097/MCA.0b013e328342c77b.
30. Khaki S, Mortazavi SH, Bozorgi A, et al. Relationship between red blood cell distribution width and mortality of patients with acute myocardial infarction referring to Tehran heart center. Crit Pathw Cardiol. 2015;14(3):112-5. doi:10.1097/HPC.0000000000000047.
31. Gul M, Uyarel H, Ergelen M, et al. The relationship between red blood cell distribution width and the clinical outcomes in non-ST elevation myocardial infarction and unstable angina pectoris: A 3-year follow-up. Coron Artery Dis. 2012;23(5):330-6. doi:10.1097/MCA.0b013e3283564986.
32. Lee JH, Yang DH, Jang SY, et al. Incremental predictive value of red cell distribution width for 12-month clinical outcome after acute myocardial infarction. Clin Cardiol. 2013;36(6):336-41. doi:10.1002/clc.22114.
33. Li D, Ruan Z, Wu B.Association of Red Blood Cell Distribution Width-Albumin Ratio for Acute Myocardial Infarction Patients with Mortality: A Retrospective Cohort Study. Clin Appl Thromb. 2022;28(10760296221121286):1-7. doi:10.1177/10760296221121286.
34. Turcato G, Serafini V, Dilda A, et al. Red blood cell distribution width independently predicts medium-term mortality and major adverse cardiac events after an acute coronary syndrome. Ann Transl Med. 2016;4(13). doi:10.21037/atm.2016.06.35.
35. Allen LA, Felker GM, Mehra MR, et al. Validation and Potential Mechanisms of Red Cell Distribution Width as a Prognostic Marker in Heart Failure. J Card Fail. 2010;16(3):230-8. doi:10.1016/j.cardfail.2009.11.003.
36. Afsar B, Saglam M, Yuceturk C, et al. The relationship between red cell distribution width with erythropoietin resistance in iron replete hemodialysis patients. Eur J Intern Med. 2013;24(3):e25- 9. doi:10.1016/j.ejim.2012.11.017.
37. Förhécz Z, Gombos T, Borgulya G, et al. Red cell distribution width in heart failure: Prediction of clinical events and relationship with markers of ineffective erythropoiesis, inflammation, renal function, and nutritional state. Am Heart J. 2009;158(4):659-66. doi:10.1016/j.ahj.2009.07.024.
38. Brieger DB, Chew DPB, Redfern J, et al. Survival after an acute coronary syndrome: 18-month outcomes from the Australian and New Zealand SNAPSHOT ACS study. Med J Aust. 2015;203(9):368.e1-368.e9. doi:10.5694/mja15.00504.
39. Кокорин В.А., Арефьев М. Н., Гордеев И. Г. Шкала GRACE 2.0 для прогнозирования течения острого коронарного синдрома: какой из маркеров повреждения миокарда использовать? Комплексные проблемы сердечно-сосудистых заболеваний. 2019;8(4):37-45. doi:10.17802/2306-1278-2019-8-4-37-45.
40. Бернс С.А., Шмидт Е.А., Клименкова А.В. и др. Возможности шкалы GRACE в долгосрочной оценке риска у больных с острым коронарным синдромом без подъема сегмента ST. ДокторРу. 2019;157(2):12-8. doi:10.31550/1727-2378-2019-157-2-12-18.
41. Halkin A, Singh M, Nikolsky E, et al. Prediction of mortality after primary percutaneous coronary intervention for acute myocardial infarction: The CADILLAC risk score. J Am Coll Cardiol. 2005;45(9):1397-405. doi:10.1016/j.jacc.2005.01.041.
42. Addala S, Grines CL, Dixon SR, et al. Predicting Mortality in Patients With ST-Elevation Percutaneous Coronary Intervention (PAMI Risk Score). Am J Cardiol. 2004;93(5):629-32. doi:10.1016/j.amjcard.2003.11.036.
43. Littnerova S, Kala P, Jarkovsky J, et al. GRACE score among six risk scoring systems (CADILLAC, PAMI, TIMI, Dynamic TIMI, Zwolle) demonstrated the best predictive value for prediction of long-term mortality in patients with ST-elevation myocardial infarction. PLoS One. 2015;10(4):1-15. doi:10.1371/journal.pone.0123215.
44. Зыков М.В., Кашталап В.В., Зыкова Д.С. и др. Прогнозирование осложнений инфаркта миокарда в течение одного года наблюдения. Сибирский медицинский журнал. 2011;4(1):41-6.
45. Sun Z, Yu T, Jiao Y, et al. Hospital mortality in acute coronary syndrome: adjustment of GRACE score by D-dimer enables a more accurate prediction in a prospective cohort study. BMC Cardiovasc Disord. 2019;19(1):1-7. doi:10.1186/s12872-019-1239-4.
46. Yan S Di, Liu XJ, Peng Y, et al. Admission Serum Calcium Levels Improve the GRACE Risk Score Prediction of Hospital Mortality in Patients With Acute Coronary Syndrome. Clin Cardiol. 2016;39(9):516-23. doi:10.1002/clc.22557.
47. Correia LCL, Souza AC, Sabino M, et al. Hemoglobin level adds prognostic value to the global registry of acute coronary events score in non-ST elevation acute coronary syndromes. Cardiology. 2012;121(4):213-9. doi:10.1159/000336954.
48. Kedhi E, Roolvink V, Ottervanger JP. Predictive value of NTproBNP for 30-day mortality in patients with non-ST-elevation acute coronary syndromes: a comparison with the GRACE and TIMI risk scores. Vasc Health Risk Manag. 2016;12:471-6.
49. Chiwhane A, Burchundi S, Manakshe G, et al. Incremental prognostic value of anemia in acute coronary syndrome from a rural hospital in India. Glob Heart. 2020;15(1):1-10. doi:10.5334/GH.527.
50. Erickson SR, Cole E, Kline-Rogers E, et al. The addition of the Charlson comorbidity index to the GRACE risk prediction index improves prediction of outcomes in acute coronary syndrome. Popul Health Manag. 2014;17(1):54-9. doi:10.1089/pop.2012.0117.
51. Sangoi MB, Guarda N dos S, Rödel AP, et al. Prognostic value of red blood cell distribution width in prediction of in-hospital mortality in patients with acute myocardial infarction. Clin Lab. 2014;60(8):1351-6. doi:10.7754/clin.lab.2013.130907.
52. Zhao N, Mi L, Liu X, et al. Combined value of red blood cell distribution width and global registry of acute coronary events risk score for predicting cardiovascular events in patients with acute coronary syndrome undergoing percutaneous coronary intervention. PLoS One. 2015;10(10):1-13. doi:10.1371/journal.pone.0140532.
53. Chen HC, Kodell RL, Cheng KF, et al. Assessment of performance of survival prediction models for cancer prognosis. BMC Med Res Methodol. 2012;12:102. doi:10.1186/1471-2288-12-102.
54. Contreras Gutiérrez VH. Red cell distribution width: A marker of in-hospital mortality in ST-segment elevation myocardial infarction patients? Rev Médica Hosp Gen (Méx). 2017;80(3): 165-9. doi:10.1016/j.hgmx.2016.10.001.
55. Lippi G, Targher G, Montagnana M, et al. Relationship between red blood cell distribution width and kidney function tests in a large cohort of unselected outpatients. Scand J Clin Lab Invest. 2008;68(8):745-8. doi:10.1080/00365510802213550.
56. Yim S, Ahn JH, Jeong MH, et al. Impact of sex difference on clinical outcomes in acute myocardial infarction patients with single-vessel and multi-vessel disease: based on Korea Acute Myocardial Infarction Registry-National Institute of Health. Cardiovasc Diagn Ther. 2023;13(4):660-72. doi:10.21037/cdt-22-536.
Об авторах
Ч. Х. ХоангВьетнам
К.м.н., преподаватель кафедры внутренних болезней, врач-кардиолог отделения кардиологии 5
Хошимин
В. В. Майсков
Россия
К.м.н., доцент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. В. С. Моисеева, зав. отделением рентгенохирургических методов диагностики и лечения
Москва
И. А. Мерай
Россия
К.м.н., доцент кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. В. С. Моисеева, зав. I отделением реанимации и интенсивной терапии кардиологического профиля
Москва
Ж. Д. Кобалава
Россия
Д.м.н., профессор, член-корр. РАН, зав. кафедрой внутренних болезней с курсом кардиологии и функциональной диагностики им. В. С. Моисеева, врач-кардиолог
Москва
Дополнительные файлы
Что известно о предмете исследования?
- В шкале GRACE 2.0 (Global Registry of Acute Coronary Events), разработанной для оценки клинического прогноза у пациентов с острым инфарктом миокарда, общепринято учитывать только показатели азотемии и повреждения миокарда.
- RDW (red blood cell distribution width) является сильным независимым предиктором неблагоприятных клинических исходов у пациентов ОКС.
Что добавляют результаты исследования?
- Повышенный уровень RDW при поступлении у пациентов с острым инфарктом миокарда служит независимым предиктором смерти в течение 18 мес. даже после коррекции общепринятых модифицируемых факторов риска смерти.
- RDW слабо коррелировал со шкалой GRACE 2.0, но добавлял инкрементальный прирост прогностической ценности при комбинации со шкалой GRACE 2.0.
Рецензия
Для цитирования:
Хоанг Ч.Х., Майсков В.В., Мерай И.А., Кобалава Ж.Д. Дополнительный анализ диапазона ширины распределения эритроцитов улучшает предсказательную ценность шкалы GRACE 2.0 в определении риска смерти в течение 18-месяцев у больных острым инфарктом миокарда. Кардиоваскулярная терапия и профилактика. 2024;23(8):3942. https://doi.org/10.15829/1728-88002024-3942
For citation:
Hoang T.H., Maiskov V.V., Merai I.A., Kobalava Zh.D. Additional analysis of red blood cell distribution width improves the predictive value of the GRACE 2.0 score for 18-month mortality in patients with acute myocardial infarction. Cardiovascular Therapy and Prevention. 2024;23(8):3942. (In Russ.) https://doi.org/10.15829/1728-88002024-3942
JATS XML

























































