Перейти к:
Гендерные особенности сердечной недостаточности с сохраненной фракцией выброса у женщин: акцент на факторы беременности
https://doi.org/10.15829/1728-88002024-4006
Аннотация
В связи с неуклонным нарастанием бремени сердечной недостаточности (СН) с сохраненной фракцией выброса (СНсФВ), особенно у женщин, важной задачей является поиск новых маркеров и ранних предикторов, связанных с данным заболеванием. Представляется важным изучение ассоциации факторов беременности и ее осложнений с развитием как ранних, так и поздних форм СН. Особый интерес представляет изучение более молодой когорты женщин в связи с высокой выявляемостью СНсФВ у таких пациенток в России. Цель обзора — оценить гендерные различия формирования и течения СН, обобщить результаты исследований, изучающих ассоциацию неблагоприятных факторов беременности и развития СНсФВ. В обзорной статье описаны гендерные особенности формирования различных форм СН: рассмотрены морфофункциональные, нейрогуморальные и возрастные факторы, ассоциированные с развитием СН у женщин, а также различия во влиянии ведущих факторов риска СН между мужчинами и женщинами. Особое место уделено роли факторов беременности в развитии различных форм СН. Определены варианты развития СН у женщин — ранняя (перипартальная) и поздняя (диагностированная в постменопаузе). Отдельно описаны патофизиологические механизмы воздействия экстрагенитальных осложнений беременности (ОБ) на развитие СН. Особое внимание уделено изучению связи между ОБ и развитием СНсФВ в отдаленном прогнозе, как наиболее характерной формы СН для женщин. Установлено, что ведущими ОБ, ассоциированными с развитием СНсФВ в постменопаузе, являются гипертензивные расстройства (в т.ч. преэклампсия и эклампсия) и гестационный сахарный диабет. Более широкое изучение ассоциации ОБ с развитием СНсФВ в будущем женщины является необходимым для определения новых механизмов формирования данной патологии.
Ключевые слова
Для цитирования:
Шперлинг М.И., Мольс А.А., Косулина В.М., Аболмасов Д.В., Джиоева О.Н., Драпкина О.М. Гендерные особенности сердечной недостаточности с сохраненной фракцией выброса у женщин: акцент на факторы беременности. Кардиоваскулярная терапия и профилактика. 2024;23(8):4006. https://doi.org/10.15829/1728-88002024-4006
For citation:
Shperling M.I., Mols A.A., Kosulina V.M., Abolmasov D.V., Dzhioeva O.N., Drapkina O.M. Gender-specific characteristics of heart failure with preserved ejection fraction in women: focus on pregnancy factors. Cardiovascular Therapy and Prevention. 2024;23(8):4006. (In Russ.) https://doi.org/10.15829/1728-88002024-4006
Введение
Сердечная недостаточность (СН) занимает особое место в структуре кардиологической патологии. Во многом это связано с активной модернизацией подходов к диагностике СН. С каждым годом возможности кардиовизуализации значительно увеличиваются, что ведет к динамическим переменам в критериях установки диагноза. В наибольшей степени эти изменения затрагивают СН с сохраненной фракцией выброса (ФВ) (СНсФВ) — ФВ левого желудочка (ЛЖ) ≥50%. Значимость СНсФВ неуклонно возрастает по мере увеличения средней продолжительности жизни населения, а также распространенности ожирения и кардиометаболических расстройств [1]. Если в недалеком прошлом СН воспринималась как наднозологическое понятие, представляющее собой осложнение основной сердечной патологии, то на сегодняшний день в связи с большей выявляемостью СНсФВ последнюю можно рассматривать как отдельное многофакторное заболевание. Пациенты с СНсФВ составляют около половины популяции больных с СН, что в совокупности со сложностями в понимании патофизиологических механизмов заболевания представляет значимую проблему для клинической практики [1][2]. В связи с неуклонным нарастанием бремени СН, особенно у женщин, важной задачей является поиск новых маркеров и ранних предикторов, ассоциированных с развитием данного заболевания. Ведущими факторами, предрасполагающими к развитию СНсФВ, являются пожилой возраст, метаболические нарушения, ишемическая болезнь сердца (ИБС). Кроме того, установлена значимая связь с такими параметрами, как женский пол, злоупотребление алкоголем, курение, наличие сахарного диабета (СД), хронической болезни почек (ХБП), артериальной гипертензии (АГ) и др. [3].
Преобладание СНсФВ у женщин по сравнению с мужчинами [4] определяет особый интерес к изучению ассоциации факторов беременности и ее осложнений с развитием различных форм СН как в раннем, так и в отдаленном периодах, поскольку это фактор ассоциирован исключительно с женским полом. Известно, что значительные изменения в организме женщины во время беременности сопряжены с развитием важных структурных и гемодинамических изменений сердечно-сосудистой системы, которые при отсутствии неблагоприятного фона носят в большинстве случаев обратимый характер. Однако выявленная во время беременности патология нередко является пусковым фактором формирования структурного ремоделирования сердца и сосудов, что может в дальнейшем приводить к развитию СН [5].
Несмотря на наличие крупных зарубежных исследований, демонстрирующих высокую частоту развития различных форм хронических неинфекционных заболеваний у женщин с неблагоприятными факторами в гестационном периоде, взаимосвязь осложнений беременности (ОБ), таких как гипертензивные расстройства беременных, СД, ожирение и др. с развитием отдаленной сердечной патологии, в частности, СНсФВ, изучена недостаточно [5]. Особый интерес представляет изучение более молодой когорты женщин в связи с высокой выявляемостью СНсФВ у таких пациенток в России [6]. Изучение характера этой взаимосвязи позволит расширить понимание роли ОБ в развитии структурных и функциональных изменений сердца у женщины в постменопаузе.
Цель обзора — осуществить оценку гендерных различий формирования и течения СН, обобщить результаты исследований, изучающих ассоциацию неблагоприятных факторов беременности и развития СНсФВ.
Методология исследования
Для достижения цели обзора был проведен поиск и анализ литературных обзоров и оригинальных статей из баз данных PubMed, Cochrane Library и eLibrary, опубликованных в период с 2018-2024гг с использованием следующих ключевых слов: heart failure (сердечная недостаточность), heart failure preserved ejection fraction (сердечная недостаточность с сохраненной фракцией выброса), gender features (гендерные особенности), women heart failure (сердечная недостаточность у женщин), adverse pregnancy outcomes (неблагоприятные факторы беременности), arterial hypertension (артериальная гипертензия), preeclampsia (преэклампсия), gestational diabetes (гестационный сахарный диабет). Всего проанализировано 78 источников. Глубина поиска составила 6 лет: 2018-2023гг. В обзоре также представлены источники, опубликованные ранее 2018г, если в них содержится ценная информация, касающаяся данной темы.
Результаты
Гендерные особенности формирования СН у женщин
Несмотря на то, что СН с низкой фракцией выброса (СНнФВ) и СНсФВ формально представляют собой подтипы одного заболевания, патофизиологические основы формирования данных состояний принципиально отличаются. Если снижению сократительной способности миокарда чаще всего сопутствует выраженная органическая патология сердца, то в основе диастолической дисфункции лежит более широкий спектр факторов, часто скрытых и разнородных.
Одним из отражений данных отличий является значительная разница в выявлении этих заболеваний в зависимости от пола. Так, развитие СНнФВ более характерно для мужчин, в то время как от СНсФВ чаще страдают женщины [4]. Согласно данным отечественного регистрового проспективного исследования ПРИОРИТЕТ-ХСН (n=6255), доля амбулаторных пациентов мужского пола с СНнФВ составляет 76,9%, в то время как на СНсФВ приходится 43,9% [7]. В зарубежных популяционных исследованиях выявление СНсФВ достигает соотношения 2:1 с преобладанием женщин [8].
Столь критическая разница характеризует, во-первых, различия во влиянии "традиционных" факторов риска (ФР) на структурные изменения миокарда: по данным ряда исследований, АГ, СД или курение увеличивают риск развития СН у женщин в большей степени, чем у мужчин [9][10]. Доля женщин в структуре СНсФВ также значительно возрастает за счет ожирения, которое значимо ассоциировано с формированием диастолической дисфункции, но при этом у мужчин встречается реже [11].
Во-вторых, морфофункциональные параметры сердечно-сосудистой системы также имеют существенные различия. Если мужчины в большей степени подвержены развитию макрососудистой патологии, то для женщин чаще характерна микроангиопатия. В контексте сердечно-сосудистых заболеваний (ССЗ) это во многом определяет бóльшую частоту выявления у мужчин различных форм ИБС и, как следствие, СНнФВ, в то время как у женщин предрасполагает к формированию диастолической дисфункции [12]. Весомый вклад в различное течение СН вносят также малый диастолический резерв, повышенная артериальная жесткость и пульсовое давление, бóльшая предрасположенность к формированию концентрического ремоделирования миокарда желудочков и более выраженное эндотелиальное воспаление [13].
В-третьих, установлена связь нейрогуморальных факторов с развитием СН. Известна протективная роль эстрогенов в процессе развития ССЗ, в т.ч. СНсФВ [14]. В большей степени это характерно для гормонов естественного происхождения. Защитное влияние экзогенных эстрогенов на сегодняшний день противоречиво и однозначно не доказано. С этим также связано и влияние менопаузы — наступление ранней менопаузы (до 45 лет) значимо ассоциировано с повышением риска возникновения СН у женщин (относительный риск (relative risk, RR)=1,66; 95% доверительный интервал (ДИ): 1,01-2,73) [15]. Низкие уровни эстрогенов у женщин в постменопаузе способствуют снижению релаксационной способности сосудистой стенки и ЛЖ, формированию гипоксии и активации неоангиогенеза [16].
Возрастные особенности. Известно, что развитие СНсФВ характерно для женщин пожилого возраста. Однако на сегодняшний день имеет место тенденция к повышению риска формирования СНсФВ у более молодого населения, имеющего значимые ФР. По данным метаанализа при наличии СД риск впервые выявленной СН был значимо выше в когорте пациентов <60 лет по сравнению с более пожилыми независимо от пола (RR=2,60 (95% ДИ: 2,38-2,84) vs RR=1,95 (95% ДИ: 1,79-2,13), p<0,001), а риск формирования СНсФВ (при наличии СН в анамнезе) был наиболее высокий у молодых женщин (RR=1,53 (95% ДИ: 1,40-1,68), p<0,001) [17].
Анализируя многочисленные крупные популяционные исследования, можно отметить тенденцию к снижению среднего возраста в выборках больных СНсФВ — от 75-80 лет по данным Фремингемского исследования до 60-70 лет во многих современных исследованиях [4][7][17]. Данный факт представляется парадоксальным, если учитывать общее старение населения в европейской популяции. Обосновать данный тренд можно с профессиональной точки зрения (увеличение качества и доступности методов диагностики, повышение осведомленности и настороженности врачей по поводу СНсФВ, унификация алгоритмов и критериев установки диагноза), а также с позиции роста неблагоприятных факторов, связанных с урбанизацией населения (метаболический синдром, малоподвижный образ жизни, психоэмоциональный стресс, социально-экономические факторы и др.). Весомое значение вносит и снижение количества беременностей в популяции. По данным Росстата среднее количество родившихся детей на 1 женщину в 2021г в России составило 1,505, в то время как в 2015г — 1,777 [18]. По данным метаанализа отсутствие беременности в анамнезе женщины ассоциировано с более ранним наступлением менопаузы (отношение рисков (hazard ratio, HR)=0,79, 95% ДИ: 0,74-0,85) [19]. Это приводит к уменьшению протективного влияния эстрогенов и более раннему формированию сердечно-сосудистой патологии, о чем было сказано выше.
Влияние естественных факторов беременности. Гемодинамические изменения в кровообращении матери начинаются уже в первом триместре со снижения системного сосудистого сопротивления и увеличения сердечного выброса. На более поздних сроках гиперактивация ренин-ангиотензин-альдостероновой системы способствует умеренному повышению артериального давления, задержке натрия и жидкости в связи с необходимостью поддержания дополнительного круга кровообращения плода [20]. Прогестерон и фактор роста фибробластов (FGF21) оказывают выраженное пролиферативное действие, что способствует гипертрофии миокарда. Вместе с тем, в первом триместре осуществляется умеренная вазодилатация и снижение сосудистого сопротивления за счет действия эстрогенов, прогестерона и релаксина [21].
В совокупности рост объема циркулирующей крови и рост сосудистого сопротивления на поздних сроках способствуют повышению пред- и постнагрузки, ремоделированию сердца, увеличению массы миокарда ЛЖ и, как следствие, нарушению его релаксации. Согласно метаанализу по данным 48 исследований, масса миокарда в последнем триместре женщин без АГ в среднем на 28% превышала таковую у небеременных [22]. Также получены данные, что конечный диастолический диаметр ЛЖ и правого желудочка к поздним срокам беременности увеличиваются на ~20% от исходных значений [23].
Данные изменения в большинстве случаев имеют естественное течение и являются полностью обратимыми. Однако при наличии выраженных факторов сердечно-сосудистого риска (поздний гестационный возраст, предшествующие ССЗ, АГ, СД, ожирение, курение и др.) состояние длительной гемодинамической перегрузки может привести к декомпенсации, что создает предпосылки для формирования как поздней, так и ранней СН, в т.ч. в рамках перипартальной кардиомиопатии (ПКМП), а также ишемических повреждений. При этом важно отметить, что развитие ПКМП тесно связано с развитием СНсФВ в отдаленном прогнозе [24].
Таким образом, развитие ССЗ у женщин, в т.ч. СНсФВ, во многом может быть ассоциировано с гестационными нарушениями. Важность и необходимость оценки этих нарушений в анамнезе с целью долгосрочного прогноза отражена в клинических рекомендациях Европейского общества по АГ 2023г, где патологические изменения в период гестации впервые выделены как отдельный независимый ФР [25].
Варианты развития СН у женщин
Типы и варианты развития СН у женщин, в отличие от мужчин, более разнообразны, что определяется, в частности, наличием специфических перипартальных форм. Соответственно, по отношению к беременности СН у женщин можно условно разделить на раннюю (возникшую в перипартальном периоде) и позднюю.
- Перипартальная СН
Возникновение СН во время беременности вносит значимый вклад в структуру материнской смертности от экстрагенитальной сердечно-сосудистой патологии. По данным популяционного исследования в США (n=50995050, 2001-2011гг), количество госпитализаций женщин в связи с СН составило 112/100 тыс. случаев; при этом в течение исследовательского периода динамика выявления СН у женщин неуклонно росла [26].
СН может развиться у женщины как во время беременности (чаще — во втором и третьем триместрах), так и в перипартальный период. Ряд авторов дополнительно подразделяют перипартальную СН по периодам возникновения на 3 подтипа — предродовую, внутриродовую и послеродовую [27].
1.1. СНнФВ
СНнФВ у беременных может развиваться как первичная или вторичная (при декомпенсации имеющейся ранее кардиологической патологии). Ведущими причинами развития вторичной СНнФВ являются клапанная патология сердца, ИБС и легочная гипертензия. Наличие преэклампсии (ПЭ) также служит важным предиктором формирования СН [28].
ПКМП, согласно определению рабочей группы Европейского общества кардиологов (2010), называют снижение ФВ ЛЖ <50% при исключении объективных причин (идиопатическое), развивающуюся в последний месяц беременности или в течение 5 мес. после родов [29]. Причины развития ПКМП и ассоциированные с ее развитием ФР неизвестны и в настоящее время активно изучаются. Течение ПКМП характеризуется высокой смертностью и относительно частым развитием необратимой систолической дисфункции ЛЖ спустя 6 и 12 мес. с момента установки диагноза, что отображено в крупном международном наблюдательном исследовании Hoevelmann J, et al. (2022). Так, общемировая смертность от всех причин при ПКМП составляет 8,0% (95% ДИ: 5,5-10,8, коэффициент гетерогенности (I2)=79,1%) и 9,8% (95% ДИ: 6,2-14,0, I2=80,5%) через 6 и 12 мес., соответственно. Полное восстановление систолической функции ЛЖ отмечается в среднем лишь в половине случаев — 44,1% (95% ДИ: 36,1-52,2, I2=91,7%) через 6 мес. и 58,7% (95% ДИ: 48,1-68,9, I2=75,8%) через 12 мес., что зависит от региона проживания (наилучшие показатели — в странах Европы и Северной Америки) и принимаемой терапии (β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента и бромокрипин ассоциированы со снижением смертности и улучшением восстановления функции ЛЖ) [30].
Важно отметить, что крупных исследований, посвященных отдаленному прогнозу после ПКМП (за исключением данных о 5-летней смертности), недостаточно [31]. Имеются данные о высоком риске повторного развития ПКМП при последующих беременностях у женщин. В связи с этим следует активно рассматривать вопрос о воздержании от последующих беременностей, особенно при сохранении сниженной ФВ ЛЖ [30]. Отдельный интерес для изучения представляет возможная взаимосвязь ПКМП с развитием СН в дальнейшем. Так, в одном из исследований в отдаленном прогнозе (медиана наблюдения 91 мес., n=84) наблюдались более значимые нарушения диастолической функции со снижением пиковой скорости наполнения ЛЖ и объема пассивного опорожнения левого предсердия у женщин с диагностированной ПКМП в анамнезе по сравнению с контрольной группой [32].
1.2. СНсФВ
Изучение СНсФВ во время беременности стало предметом интенсивного внимания лишь в последние годы. Как было сказано выше, выявление СН у беременных женщин возрастает [26]. Эта тенденция характерна и для СНсФВ: в период 2002-2014гг доля госпитализаций беременных с СНсФВ в США выросла на 19,4% (95% ДИ: 13,9-25,1). Более половины (56%) случаев выявления СНсФВ приходится на послеродовый период [27]. Для большинства беременных с выявленной СНсФВ характерно сочетание с гипертензивными расстройствами — ПЭ, гестационная АГ. Также установлена ассоциация с общепринятыми ФР развития диастолической дисфункции, такими как ожирение, СД, ХБП, инсулинорезистентность и метаболический синдром [33].
- СН, диагностированная в постменопаузе
Как и во время беременности, в отдаленном периоде хроническая СН у женщин подразделяется по общепринятой классификации в зависимости от ФВ ЛЖ: СНнФВ (ФВ ЛЖ <40%), СН с умеренно сниженной ФВ (ФВ ЛЖ =41-49%) и СНсФВ (ФВ ЛЖ >50%) [34]. Причины развития данных форм разнообразны и обширны, поэтому оценка независимого влияния факторов беременности на формирование поздней СН весьма затруднительна.
В вопросе развития СН в отдаленном прогнозе особое внимание следует уделить различным фенотипам пациентов. В наибольшей степени это актуально для СНсФВ, т.к. причины и механизмы ее развития очень гетерогенны. Выделение фенотипических подклассов больных с СНсФВ основано на значимых патофизиологических различиях, что, как следствие, позволяет применить более персонализированный подход в тактике ведения таких пациентов. Тем не менее, практическое применение подтипов СНсФВ в клинической практике на сегодняшний день сопряжено с определенными трудностями ввиду отсутствия единой фенотипической классификации. Первые публикации, посвященные изучению различных феногрупп СНсФВ, появились относительно недавно ~10 лет назад [35]. На сегодняшний день к фенотипированию СНсФВ применяются различные подходы, в основе которых лежат этиология, патофизиологические механизмы или клинические проявления данной патологии.
В работе Cohen B, et al. (2020) пациенты, принимавшие участие в исследовании TOPCAT (Treatment of Preserved Cardiac Function Heart Failure With an Aldosterone Antagonist) (n=3445), были ретроспективно разделены на 3 феногруппы: 1-я группа характеризовалась пациентами более молодого возраста с более высокой распространенностью курения и наименьшей выраженностью структурных изменений сердца и сосудов; для 2-й группы были свойственны старший возраст, высокая частота фибрилляции предсердий и наиболее выраженная ригидность ЛЖ и сосудов; 3-ю группу составляли преимущественно пациенты с выраженными дисметаболическими расстройствами, ХБП и более высоким уровнем провоспалительных маркеров [6]. Авторы обнаружили, что первый, более молодой фенотип пациентов, в большей степени характерен для популяций Грузии и России. Этот факт указывает на необходимость тщательного изучения особенностей формирования и вопросов профилактики развития ранней СНсФВ в России.
Ассоциация ОБ и СН
В ряде исследований на основе больших массивов данных изучалась взаимосвязь ОБ с развитием отдаленных ССЗ и исходов. Было выявлено, что среди ОБ ведущим фактором развития отдаленных сердечно-сосудистых событий являются гипертензивные расстройства. Это утверждение также справедливо и в отношении развития СН [36].
В метаанализе ПЭ была связана с 4-кратным увеличением долгосрочного риска СН и 2-кратным увеличением риска ИБС и инсульта [37]. По данным другого метаанализа была установлена связь между АГ беременных и развитием СН — RR=1,77 (95% ДИ: 1,47-2,13) [38]. В ретроспективном исследовании CALIBER (Preeclampsia and Cardiovascular Disease in a Large UK Pregnancy Cohort of Linked Electronic Health Records) (Великобритания, 2019г, n=1899150, период наблюдения 1997-2016гг) были установлены ассоциации между наличием ПЭ во время беременности и возникновением инсульта любой этиологии (HR=1,9 (95% ДИ: 1,54-2,35)), инфаркта миокарда (HR=1,67 (95% ДИ: 1,54-1,81)), АГ (HR=4,47 (95% ДИ: 4,32-4,62)) и СН вне зависимости от ФВ ЛЖ (HR=2,13 (95% ДИ: 1,64-2,76)) [39]. В другом похожем по дизайну исследовании (Канада, 2018, n=1070667, период наблюдения 1989-2013гг), посвященном изучению связи других ОБ, в частности, гестационного СД, с отдаленными исходами, была установлена ассоциация СД с ССЗ и сердечно-сосудистыми катастрофами (преимущественно атеросклеротического генеза), в т.ч. с развитием СН (HR=2,05 (95% ДИ: 1,73-2,42)) [40]. Однако следует отметить, что однозначная интерпретация результатов многих подобных исследований весьма затруднительна — зачастую за столь крупным объемом данных скрываются значимые различия в подходах к установлению диагноза, тактике ведения и наблюдения пациентов, что является смещающим фактором.
Неблагоприятные факторы беременности в отдаленном прогнозе развития СНсФВ. С учетом того, что доминирующим вариантом течения СН у женщин является именно СНсФВ, поиск связанных с беременностью предикторов развития СНсФВ имеет особую важность. В основе такой связи лежат различные патофизиологические механизмы. Наличие разного рода ОБ — АГ, ПЭ, преждевременные роды, задержка внутриутробного развития плода, HELLP-синдром — способствуют нарушению нормального ангиогенеза как во время беременности, так и спустя длительное время после родоразрешения [41]. В частности, концентрация антиангиогенных белков, таких как растворимая fms-подобная тирозинкиназа-1 (sFLT1) и растворимый эндоглин (sENG), а также провоспалительных цитокинов и маркеров эндотелиальной дисфункции, была значительно выше у женщин, имеющих ОБ в анамнезе, чем у женщин с нормально протекавшей беременностью [42]. В ряде исследований было показано, что вышеперечисленные пути активации эндотелиального воспаления и микроангиопатии имеют значительное сходство с механизмом развития СНсФВ [43]. В конечном итоге это приводит к более высокой артериальной жесткости, что играет одну из ведущих ролей в формировании СНсФВ [44].
Другим связующим фактором является изменение резерва коронарного кровотока. Женщины с ОБ в анамнезе имели более низкие значения коронарного резерва (2,39±0,48 vs 2,90±0,49; p<0,001), а также значимое утолщение комплекса интима-медиа и увеличение концентрации высокочувствительного С-реактивного белка по сравнению с контрольной группой [45]. Следует отметить, что низкий коронарный резерв является независимым маркером СНсФВ и выявляется более чем в 60% случаев [46].
Отдельно стоит сказать о роли гипертензивной патологии беременности. В метаанализе было показано, что гипертензивные расстройства беременности и СНсФВ имеют некоторые общие биомаркеры иммунной активации и миокардиального повреждения, включая мозговой натрийуретический пептид, С-реактивный белок, адреномедуллин и др. [47]. Также установлено, что женщины, имевшие АГ во время беременности, в отдаленном прогнозе имеют худшие эхокардиографические параметры диастолической функции по сравнению с женщинами с нормотензией во время беременности — нарушение релаксации — соотношение пиков Е/А (максимальной скорости кровотока во время раннего диастолического наполнения) к максимальной скорости потока во время предсердной систолы), более высокое давление наполнения ЛЖ — соотношение Е/е’ (показателя наполнения левого желудочка), увеличение массы миокарда ЛЖ и относительной толщины его стенки [48]. И, как было сказано выше, АГ во время беременности ассоциирована со снижением резерва коронарного кровотока [12] (рисунок 1).
Несмотря на немногочисленное количество исследований на данную тему, за последние годы наблюдается значительный интерес к данное проблеме. Hansen AL, et al. (2021) провели ретроспективное когортное исследование (США, n=10292) по изучению ассоциации ведущих ОБ с развитием СНсФВ у женщин в постменопаузе на основании крупного проспективного исследования WHI (Women’s Health Initiative). В результате авторам удалось установить значимую связь между наличием гипертензивных расстройств во время беременности в анамнезе (включая ПЭ) с СНсФВ (отношение шансов (odds ratio, OR)=2,06 (95% ДИ: 1,29-3,27)); при этом такой ассоциации с СНнФВ обнаружено не было (OR=1,17 (95% ДИ:0,59-2,30)). При оценке опосредованного эффекта ведущими медиаторами оказались АГ (24%), ИБС (23%) и ожирение (20%) [5].
Приведенные выше данные не в полной мере соответствуют другим исследованиям. Так, в работе Williams D (США, n=2404486) была отмечена ассоциация ПЭ/эклампсии с госпитализациями как по поводу СНсФВ (HR=2,09 (95% ДИ: 1,80-2,44)), так и СНнФВ (HR=1,92 (95% ДИ: 1,76-2,10)) [49]. При этом важно отметить, что ввиду того, что период наблюдения в данном исследований был выбран относительно недавний (выписка из стационара после родоразрешения в 2005-2014гг) и что в работу была включена вся популяция больных, медиана возраста больных с СН оказалась крайне низкой: 34,0 года у женщин с СНсФВ и 33,4 года у женщин с СНнФВ. Значимым отличием от предыдущего исследования также является иной подход к выделению гипертензивной патологии беременности (только наличие ПЭ и эклампсии).
Значимость гипертензивных гестационных расстройств отмечается в рекомендациях Американской коллегии кардиологов по СНсФВ 2023г, где ПЭ представлена как один из ФР формирования отдаленной СНсФВ [50].
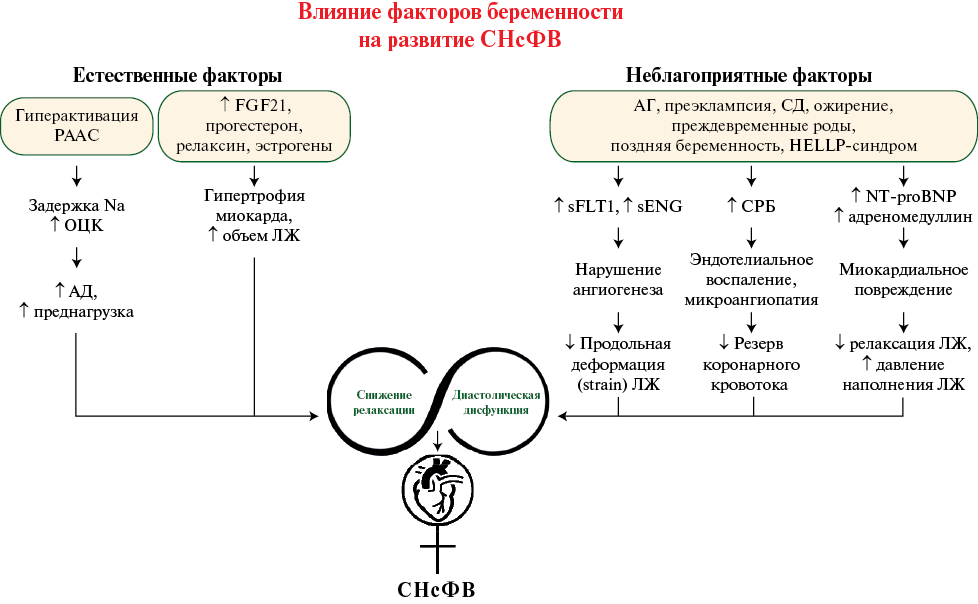
Рис. 1 Влияние естественных и неблагоприятных факторов беременности на развитие СНсФВ.
Примечание: АГ — артериальная гипертензия, АД — артериальное давление, ОЦК — объем циркулирующей крови, ЛЖ — левый желудочек, РААС — ренин-ангиотензин-альдостероновая система, СД — сахарный диабет, СРБ — С-реактивный белок, СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, LP — lоw рlаtelet соunt (тромбоцитопения), NT-proBNP — N-концевой промозговой натрийуретический пептид, sENG — растворимая форма эндоглина, sFLT1 — растворимая fms-подобная тирозинкиназа-1. FGF21 — фактор роста фибробластов 21; HELLP-синдром — Н — hemolysis (гемолиз); ЕL — еlеvated liver enzymes (повышение активности ферментов печени).
Заключение
Несмотря на то, что СН занимает ключевое место среди нозологий и для практикующих врачей, и для исследователей, многогранность и сложность этого заболевания не вызывает сомнений. Это определяет крайне высокую вариабельность и изменчивость в отношении СН: от развития новых патофизиологических концепций до значительных изменений лечебно-диагностических подходов. При анализе только лишь гендерных особенностей формирования и течения СН обнаруживается немалое количество противоречий, требующих продолжения активного изучения данной проблемы.
В статье проанализированы особенности СН у женщин. Приведены варианты формирования и течения СН у женщин, рассмотрены особые формы СН, ассоциированные с беременностью. Особое внимание уделено изучению связи между ОБ и развитием СНсФВ в отдаленном прогнозе, как наиболее характерной формы СН для женщин. Ведущими ОБ, ассоциированными с наличием СНсФВ, являются гипертензивные расстройства и гестационный СД. Дальнейший поиск предикторов формирования СНсФВ у пациентов женского пола, особенно более молодого возраста, является важным и значимым направлением.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Borlaug BA, Sharma K, Shah SJ, et al. Heart Failure With Preserved Ejection Fraction: JACC Scientific Statement. J Am Coll Cardiol. 2023;81(18):1810-34. doi:10.1016/j.jacc.2023.01.049.
2. Российское кардиологическое общество (РКО). Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
3. Nair N. Epidemiology and pathogenesis of heart failure with preserved ejection fraction. Rev Cardiovasc Med. 2020;21(4): 531- 40. doi:10.31083/j.rcm.2020.04.154.
4. Гаврюшина С. В., Агеев Ф. Т. Сердечная недостаточность с сохраненной фракцией выброса левого желудочка: эпидемиология, "портрет" больного, клиника, диагностика. Кардиология. 2018;58(4S):55-64. doi:10.18087/cardio.2467.
5. Hansen AL, Søndergaard MM, Hlatky MA, et al. Adverse Pregnancy Outcomes and Incident Heart Failure in the Women’s Health Initiative. JAMA Netw Open. 2021;4(12):e2138071. doi:10.1001/jamanetworkopen.2021.38071.
6. Cohen JB, Schrauben SJ, Zhao L, et al. Clinical Phenogroups in Heart Failure With Preserved Ejection Fraction: Detailed Phenotypes, Prognosis, and Response to Spironolactone. JACC Heart Fail. 2020;8(3):172-84. doi:10.1016/j.jchf.2019.09.009.
7. Шляхто Е.В., Беленков Ю. Н., Бойцов С. А. и др. Результаты промежуточного анализа проспективного наблюдательного многоцентрового регистрового исследования пациентов с хронической сердечной недостаточностью в Российской Федерации "ПРИОРИТЕТ-ХСН": исходные характеристики и лечение первых включенных пациентов. Российский кардиологический журнал. 2023;28(10):5593. doi:10.15829/1560-4071-2023-5593.
8. Stolfo D, Uijl A, Vedin O, et al. Sex-Based Differences in Heart Failure Across the Ejection Fraction Spectrum: Phenotyping, and Prognostic and Therapeutic Implications. JACC Heart Fail. 2019; 7(6):505-15. doi:10.1016/j.jchf.2019.03.011.
9. Chandramouli C, Teng THK, Tay WT, et al. Impact of diabetes and sex in heart failure with reduced ejection fraction patients from the ASIAN-HF registry. Eur J Heart Fail. 2019;21(3):297-307. doi:10.1002/ejhf.1358.
10. Драпкина О.М., Максимов С.А., Шальнова С.А. и др. Распространенность и динамика курения в России по данным исследования ЭССЕ-РФ. Кардиоваскулярная терапия и профилактика. 2023;22(8S):3790. doi:10.15829/1728-8800-2023-3790.
11. Муромцева Г.А., Концевая А.В., Константинов В.В. и др. Распространенность факторов риска неинфекционных заболеваний в российской популяции в 2012-2013гг. результаты исследования ЭССЕ-РФ. Кардиоваскулярная терапия и профилактика. 2014;13(6):4-11. doi:10.15829/1728-8800-2014-6-4-11.
12. Shah SJ, Lam CSP, Svedlund S, et al. Prevalence and correlates of coronary microvascular dysfunction in heart failure with preserved ejection fraction: PROMIS-HFpEF. Eur Heart J. 2018; 39(37):3439-50. doi:10.1093/eurheartj/ehy531.
13. Lala A, Tayal U, Hamo CE, et al. Sex Differences in Heart Failure. J Card Fail. 2022;28(3):477-98. doi:10.1016/j.cardfail.2021.10.006.
14. Knowlton AA, Lee AR. Estrogen and the cardiovascular system. Pharmacol Therapeut. 2012;135(1):54-70. doi:10.1016/j.pharmthera.2012.03.007.
15. Ebong IA, Watson KE, Goff DC, et al. Age at Menopause and Incident Heart Failure: The Multi-Ethnic Study of Atherosclerosis. Menopause. 2014;21(6):585-91. doi:10.1097/GME.0000000000000138.
16. Сережина Е. К., Обрезан А. Г. Влияние половозрастных гормональных изменений на формирование и развитие сердечной недостаточности. Российский кардиологический журнал. 2020;25(6): 3710. doi:10.15829/1560-4071-2020-3710.
17. Kodama S, Fujihara K, Horikawa C, et al. Diabetes mellitus and risk of new‐onset and recurrent heart failure: a systematic review and meta‐analysis. ESC Heart Fail. 2020;7(5):2146-74. doi:10.1002/ehf2.12782.
18. Klimaev SN, Nikitina SU, Frolova EB, et al. Family and children in Russia. 2021. M: "Pero", 2022. p. 120. (In Russ.) Климаев С.Н., Никитина С.Ю., Фролова Е.Б. и др. Семья и дети в России. 2021. М.: "Перо", 2022. 120 с. ISBN 978-5-00204-632-4.
19. Roman Lay AA, Do Nascimento CF, Horta BL, et al. Reproductive factors and age at natural menopause: A systematic review and meta-analysis. Maturitas. 2020;131:57-64. doi:10.1016/j.maturitas.2019.10.012.
20. Chung E, Leinwand LA. Pregnancy as a cardiac stress model. Cardiovasc Res. 2014;101(4):561-70. doi:10.1093/cvr/cvu013.
21. Conrad KP, Davison JM. The renal circulation in normal pregnancy and preeclampsia: is there a place for relaxin? Am J Physiol Renal Physiol. 2014;306(10):F1121-35. doi:10.1152/ajprenal.00042.2014.
22. De Haas S, Ghossein-Doha C, Geerts L, et al. Cardiac remodeling in normotensive pregnancy and in pregnancy complicated by hypertension: systematic review and meta-analysis. Ultrasound Obstet Gynecol. 2017;50(6):683-96. doi:10.1002/uog.17410.
23. Ducas RA, Elliott JE, Melnyk SF, et al. Cardiovascular magnetic resonance in pregnancy: insights from the cardiac hemodynamic imaging and remodeling in pregnancy (CHIRP) study. J Cardiovasc Magn Reson. 2014;16(1):1. doi:10.1186/1532-429X-16-1.
24. Rich MW. Peripartum Cardiomyopathy and Pregnancy-Associated Heart Failure with Preserved Ejection Fraction: More Similar Than Different. J Card Fail. 2021;27(2):157-8. doi:10.1016/j.cardfail.2021.01.015.
25. Mancia G, Kreutz R, Brunström M, et al. 2023 ESH Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. 2023;41(12):1874. doi:10.1097/HJH.0000000000003480.
26. Mogos MF, Piano MR, McFarlin BL, et al. Heart Failure in Pregnant Women: A Concern Across the Pregnancy Continuum. Circ Heart Fail. 2018;11(1):e004005. doi:10.1161/CIRCHEARTFAILURE.117.004005.
27. Briller JE, Mogos MF, Muchira JM, et al. Pregnancy Associated Heart Failure With Preserved Ejection Fraction: Risk Factors and Maternal Morbidity. J Card Fail. 2021;27(2):143-52. doi:10.1016/j.cardfail.2020.12.020.
28. Ruys TPE, Roos-Hesselink JW, Hall R, et al. Heart failure in pregnant women with cardiac disease: data from the ROPAC. Heart. 2014;100(3):231-8. doi:10.1136/heartjnl-2013-304888.
29. Sliwa K, Hilfiker-Kleiner D, Petrie MC, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of peripartum cardiomyopathy: a position statement from the Heart Failure Association of the European Society of Cardiology Working Group on peripartum cardiomyopathy. Eur J Heart Fail. 2010;12(8):767-78. doi:10.1093/eurjhf/hfq120.
30. Hoevelmann J, Engel ME, Muller E, et al. A global perspective on the management and outcomes of peripartum cardiomyopathy: a systematic review and meta-analysis. Eur J Heart Fail. 2022; 24(9):1719-36. doi:10.1002/ejhf.2603.
31. Sliwa K, Petrie MC, Hilfiker-Kleiner D, et al. Long-term prognosis, subsequent pregnancy, contraception and overall management of peripartum cardiomyopathy: practical guidance paper from the Heart Failure Association of the European Society of Cardiology Study Group on Peripartum Cardiomyopathy. Eur J Heart Fail. 2018;20(6):951-62. doi:10.1002/ejhf.1178.
32. Ersbøll AS, Bojer AS, Hauge MG, et al. Long-Term Cardiac Function After Peripartum Cardiomyopathy and Preeclampsia: A Danish Nationwide, Clinical Follow-Up Study Using Maximal Exercise Testing and Cardiac Magnetic Resonance Imaging. J Am Heart Assoc. 2018;7(20):e008991. doi:10.1161/JAHA.118.008991.
33. Bartsch E, Medcalf KE, Park AL, et al. High Risk of Preeclampsia Identification Group. Clinical risk factors for preeclampsia determined in early pregnancy: systematic review and meta-analysis of large cohort studies. BMJ. 2016;353:i1753. doi:10.1136/bmj.i1753.
34. Lindley KJ, Williams D, Conner SN, et al. The Spectrum of Pregnancy-Associated Heart Failure Phenotypes: An Echocardiographic Study. Int J Cardiovasc Imaging. 2020;36(9):1637-45. doi:10.1007/s10554-020-01866-w.
35. Shah AM, Solomon SD. Phenotypic and pathophysiological heterogeneity in heart failure with preserved ejection fraction. Eur Heart J. 2012;33(14):1716-7. doi:10.1093/eurheartj/ehs124.
36. Mosca L, Benjamin EJ, Berra K, et al. Effectiveness-based guidelines for the prevention of cardiovascular disease in women--2011 update: a guideline from the american heart association. Circulation. 2011;123(11):1243-62. doi:10.1161/CIR.0b013e31820faaf8.
37. Wu P, Haththotuwa R, Kwok CS, et al. Preeclampsia and Future Cardiovascular Health: A Systematic Review and Meta-Analysis. Circ Cardiovasc Qual Outcomes. 2017;10(2):e003497. doi:10.1161/CIRCOUTCOMES.116.003497.
38. Lo CCW, Lo ACQ, Leow SH, et al. Future Cardiovascular Disease Risk for Women With Gestational Hypertension: A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2020;9(13): e013991. doi:10.1161/JAHA.119.013991.
39. Leon LJ, McCarthy FP, Direk K, et al. Preeclampsia and Cardiovascular Disease in a Large UK Pregnancy Cohort of Linked Electronic Health Records: A CALIBER Study. Circulation. 2019; 140(13):1050-60. doi:10.1161/CIRCULATIONAHA.118.038080.
40. McKenzie-Sampson S, Paradis G, Healy-Profitós J, et al. Gestational diabetes and risk of cardiovascular disease up to 25 years after pregnancy: a retrospective cohort study. Acta Diabetol. 2018;55(4):315-22. doi:10.1007/s00592-017-1099-2.
41. Lane-Cordova Abbi D, Khan SS, Grobman WA, et al. LongTerm Cardiovascular Risks Associated With Adverse Pregnancy Outcomes. J Am Coll Cardiol. 2019;73(16):2106-16. doi:10.1016/j.jacc.2018.12.092.
42. Shahul S, Medvedofsky D, Wenger JB, et al. Circulating Antiangiogenic Factors and Myocardial Dysfunction in Hypertensive Disorders of Pregnancy. Hypertension. 2016;67(6):1273-80. doi:10.1161/HYPERTENSIONAHA.116.07252.
43. Hage C, Michaëlsson E, Linde C, et al. Inflammatory Biomarkers Predict Heart Failure Severity and Prognosis in Patients With Heart Failure With Preserved Ejection Fraction: A Holistic Proteomic Approach. Circ Cardiovasc Genet. 2017;10(1): e001633. doi:10.1161/CIRCGENETICS.116.001633.
44. Grand’Maison S, Pilote L, Okano M, et al. Markers of Vascular Dysfunction After Hypertensive Disorders of Pregnancy: A Systematic Review and Meta-Analysis. Hypertension. 2016;68(6): 1447-58. doi:10.1161/HYPERTENSIONAHA.116.07907.
45. Ciftci FC, Caliskan M, Ciftci O, et al. Impaired coronary microvascular function and increased intima-media thickness in preeclampsia. J Am Soc Hypertens. 2014;8(11):820-6. doi:10.1016/j.jash.2014.08.012.
46. Kelshiker MA, Seligman H, Howard JP, et al. Coronary flow reserve and cardiovascular outcomes: a systematic review and meta-analysis. Eur Heart J. 2022;43(16):1582-93. doi:10.1093/eurheartj/ehab775.
47. Alma LJ, Bokslag A, Maas AH, et al. Shared biomarkers between female diastolic heart failure and pre‐eclampsia: a systematic review and meta‐analysis. ESC Heart Fail. 2017;4(2):88-98. doi:10.1002/ehf2.12129.
48. Boardman H, Lamata P, Lazdam M, et al. Variations in Cardiovascular Structure, Function, and Geometry in Midlife Associated With a History of Hypertensive Pregnancy. Hypertension. 2020;75(6): 1542-50. doi:10.1161/HYPERTENSIONAHA.119.14530.
49. Williams D, Stout MJ, Rosenbloom JI, et al. Preeclampsia Predicts Risk of Hospitalization for Heart Failure With Preserved Ejection Fraction. J Am Coll Cardiol. 2021;78(23):2281-90. doi:10.1016/j.jacc.2021.09.1360.
50. Kittleson MM, Panjrath GS, Amancherla K, et al. 2023 ACC Expert Consensus Decision Pathway on Management of Heart Failure With Preserved Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2023;81(18):1835-78. doi:10.1016/j.jacc.2023.03.393.
Об авторах
М. И. ШперлингРоссия
Шперлинг Максим Игоревич — м.н.с. отдела фундаментальных и прикладных аспектов ожирения
Москва
А. А. Мольс
Россия
Мольс Александр Анатоль — клинический ординатор
Москва
В. М. Косулина
Россия
Косулина Василиса Михайловна — клинический ординатор
Москва
Д. В. Аболмасов
Россия
Аболмасов Денис Валерьевич — старший ординатор пульмонологического отделения
Североморск
О. Н. Джиоева
Россия
Джиоева Ольга Николаевна — д.м.н., в.н.с., руководитель лаборатории кардиовизуализации, вегетативной регуляции и сомнологии
Москва
О. М. Драпкина
Россия
Драпкина Ольга Михайловна — д.м.н., профессор, академик РАН, директор
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Сердечная недостаточность (СН) с сохраненной фракцией выброса (СНсФВ) является гетерогенным заболеванием, причины и механизмы формирования которого продолжают активно изучаться.
- СНсФВ преобладает у женщин по сравнению с мужчинами.
- Поиск новых факторов, ассоциированных с развитием СНсФВ, является одним из приоритетных направлений в кардиологии.
Что добавляют результаты исследования?
- Гендерные различия формирования СН значительны и определяются морфофункциональными, нейрогуморальными и возрастными особенностями у женщин, а также влиянием естественных факторов беременности.
- Варианты течения СН у женщин более разнообразны, чем у мужчин.
- Экстрагенитальные осложнения беременности, такие как артериальная гипертензия и сахарный диабет, являются предикторами развития СНсФВ.
Рецензия
Для цитирования:
Шперлинг М.И., Мольс А.А., Косулина В.М., Аболмасов Д.В., Джиоева О.Н., Драпкина О.М. Гендерные особенности сердечной недостаточности с сохраненной фракцией выброса у женщин: акцент на факторы беременности. Кардиоваскулярная терапия и профилактика. 2024;23(8):4006. https://doi.org/10.15829/1728-88002024-4006
For citation:
Shperling M.I., Mols A.A., Kosulina V.M., Abolmasov D.V., Dzhioeva O.N., Drapkina O.M. Gender-specific characteristics of heart failure with preserved ejection fraction in women: focus on pregnancy factors. Cardiovascular Therapy and Prevention. 2024;23(8):4006. (In Russ.) https://doi.org/10.15829/1728-88002024-4006
JATS XML

























































