Перейти к:
Внутрисосудистая визуализация — ключ к успеху коронарных интервенций. Клинический случай
https://doi.org/10.15829/1728-8800-2024-4010
EDN: OJVPMT
Аннотация
За счет высокой информативности методы внутрисосудистой визуализации в настоящее время используются все чаще при проведении чрескожных коронарных вмешательств. Эти методы позволяют оптимизировать коронарные интервенции и снизить риск как ранних, так и отдаленных осложнений, связанных с техническими аспектами реваскуляризации пораженных артериальных сегментов. В настоящей статье представлен клинический случай успешного эндоваскулярного лечения пациентки с субтотальным поражением проксимального сегмента передней межжелудочковой артерии под контролем внутрисосудистого ультразвука. Первичное вмешательство в раннем послеоперационном периоде осложнилось клинически значимой протрузией атеросклеротической бляшки через ячейки стента, что потребовало проведения ревизионной коронарографии и выполнения оптической когерентной томографии для выбора оптимального объема вмешательства и контроля его результата.
Ключевые слова
Для цитирования:
Васильев Д.К., Араблинский Н.А., Коровина О.О., Шукуров Ф.Б., Фещенко Д.А., Талиуридзе М.Т. Внутрисосудистая визуализация — ключ к успеху коронарных интервенций. Клинический случай. Кардиоваскулярная терапия и профилактика. 2024;23(6):4010. https://doi.org/10.15829/1728-8800-2024-4010. EDN: OJVPMT
For citation:
Vasiliev D.K., Arablinsky N.A., Korovina O.O., Shukurov F.B., Feshchenko D.A., Taliouridze M.T. Intravascular imaging as the key to successful coronary interventions: a case report. Cardiovascular Therapy and Prevention. 2024;23(6):4010. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4010. EDN: OJVPMT
Введение
Золотым стандартом диагностики ишемической болезни сердца служит коронарная ангиография (КАГ), которая позволяет оценить анатомию, наличие и степень выраженности поражения коронарных артерий (КА). Однако, как и любой другой диагностический метод, КАГ имеет ряд ограничений. Двухмерная рентгеноскопическая визуализация позволяет получить только профиль просвета артерии без данных о состоянии ее стенки, а определение степени стеноза КА с помощью визуальной оценки является субъективным и сопряжено с рядом неточностей. При проведении чрескожного коронарного вмешательства (ЧКВ) одних лишь данных коронароангиограмм в ряде случаев может оказаться недостаточно для определения точного размера артерии, распределения и состава атеросклеротических бляшек (АСБ) в ее стенке, а также оценки оптимального раскрытия коронарного стента и финального результата ЧКВ. Появление методов внутрисосудистой визуализации (ВСВ) позволило компенсировать ограничения КАГ. ВСВ позволяет более детально оценить морфологию АСБ [1], подобрать необходимый размер стента для полного покрытия зоны поражения [2], а также выявить возможные осложнения ЧКВ и механизмы поздней дисфункции стента [3-5]. Уже в 2018г в рекомендациях европейского общества кардиологов (ESC — European Society of Cardiology) по реваскуляризации миокарда методы ВСВ при лечении поражений общего ствола (ОСЛКА) левой коронарной артерии (ЛКА) имели уровень рекомендации и доказательной базы IIaB1. Однако последующие исследования показали возможность применения ВСВ при лечении различных коронарных поражений [6-8], что нашло свое отражение в рекомендациях ESC (от 2023г) по лечению пациентов с острым коронарным синдромом: ВСВ может применяться для проведения любых ЧКВ (IIaA)2.
В настоящее время существует два метода ВСВ: внутрисосудистое ультразвуковое исследование (ВСУЗИ) и оптическая когерентная томография (ОКТ). Физическая основа и сравнительная характеристика обоих методов представлены в таблице 1. Сочетание лучшего разрешения и клиренса крови во время ОКТ-визуализации обеспечивает гораздо более четкую границу между просветом сосуда и поверхностью интимы, что имеет свое значение в определении истинного размера просвета сосуда, а также морфологии и толщины покрышки АСБ. Кроме того, благодаря более высокому разрешению, воспроизводимость измерений ОКТ лучше, чем при ВСУЗИ [9]. Однако применение ВСУЗИ позволяет определить характеристики стенки сосуда на всю толщину. С помощью ВСУЗИ можно измерить и использовать параметры истинного размера сосуда для подбора оптимального диаметра стента. Напротив, ОКТ часто не может визуализировать истинный размер сосуда в месте поражения, и многие операторы определяют размер стентов в соответствии с эталонным диаметром просвета.
Таблица 1
Физическая основа и сравнительная характеристика методов ВСВ
|
Параметр |
ВСУЗИ |
ОКТ |
|
Характер волны |
ультразвук |
инфракрасное излучение |
|
Размер катетера, мм |
1 |
0,8 |
|
Глубина проникновения в ткани, мм |
5-8 |
1-2 |
|
Частота кадров в секунду |
30 |
100-200 |
|
Максимальная длина протяжки, мм |
100-150 |
75-150 |
|
Определение аорто-устьевых поражений |
+ |
- |
|
Оценка КА крупного диаметра |
лучше за счет большей глубины пенетрации |
хуже |
|
Определение истинного размера КА |
лучше за счет большей глубины пенетрации |
хуже |
|
Оценка кальциноза |
угол распределения |
угол распределения и толщина отложений |
|
Оценка покрышки АСБ |
- |
+ |
|
Определение диссекции, тромбоза КА |
хуже |
лучше за счет высокой разрешающей способности |
|
Определение позиции, раскрытия стента, рестеноза |
хуже |
лучше за счет высокой разрешающей способности |
|
Необходимость введения рентген-контрастного препарата |
- |
+ |
Примечание: АСБ — атеросклеротическая бляшка, ВСВ — внутрисосудистая визуализация, ВСУЗИ — внутрисосудистое ультразвуковое исследование, КА — коронарная артерия, ОКТ — оптическая когерентная томография.
Подводя итог, следует отметить, что у каждого метода ВСВ существуют свои сильные и слабые стороны, и только грамотное применение или сочетание обоих методов интервенционными специалистами может привести к оптимальному результату. Ниже представлено описание клинического случая лечения пациентки с ишемической болезнью сердца, для которого потребовалось применение обоих вышеуказанных методов.
Описание клинического случая
Информация о пациентке: Пациентка Л., 73 лет, была госпитализирована в отделение неотложной кардиологии ФГБУ "НМИЦ ТПМ" Минздрава России в феврале 2024г с жалобами на загрудинные жгучие боли при физических нагрузках (ФН), эквивалентных подъему на 1 этаж по лестнице, купирующиеся приемом нитроглицерина, а также на одышку при минимальных ФН, купирующуюся в покое. Из анамнеза заболевания известно, что вышеописанные жалобы с постепенным прогрессированием и снижением толерантности к ФН возникли с 2023г, по поводу чего длительное время за медицинской помощью не обращалась. Однако 05.01.2024 в связи с приступом длительных загрудинных болей пациентка была госпитализирована в стационар по месту жительства, диагноз острого инфаркта миокарда был исключен, КАГ не проводилась. На фоне скорректированной медикаментозной терапии в динамике отмечалось сохранение вышеуказанных жалоб, в связи с чем по месту жительства был проведен нагрузочный тест (тредмил-тест) — результат пробы положительный, отмечалась депрессия сегмента ST до 3 мм в отведениях V2-V4. По результатам дообследования была направлена на плановую госпитализацию (рисунок 1).
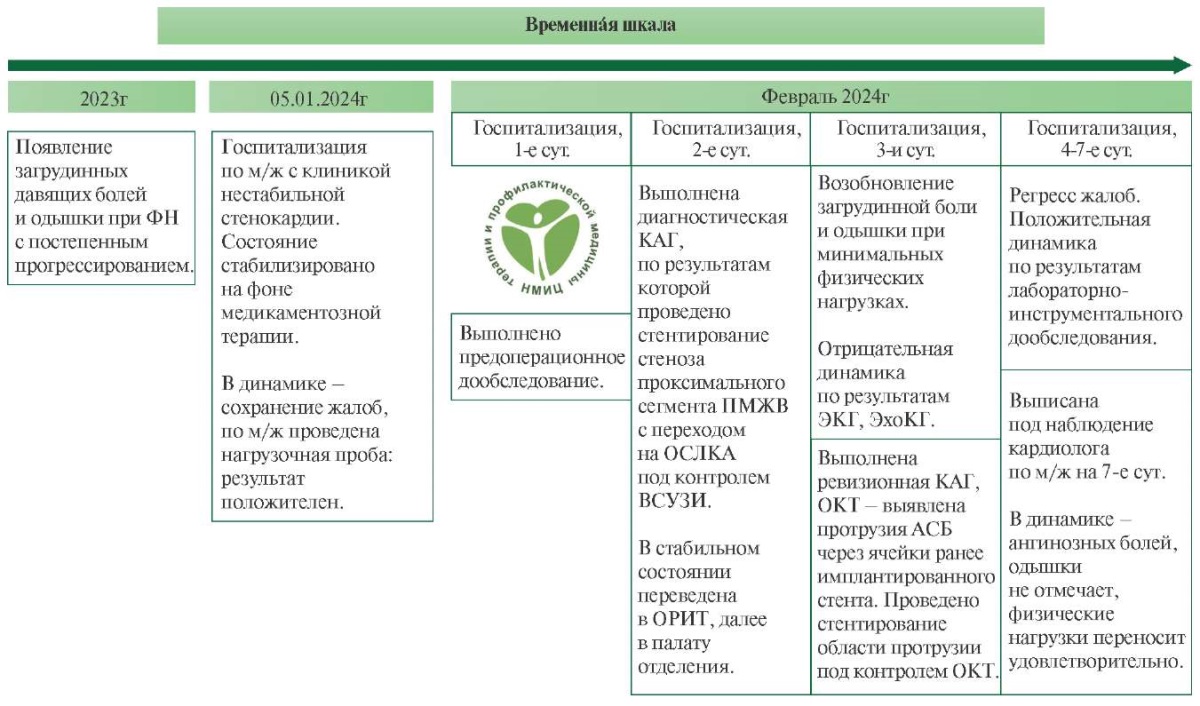
Рис. 1 Временнáя шкала.
Примечание: АСБ — атеросклеротическая бляшка, ВСУЗИ — внутрисосудистое ультразвуковое исследование, КАГ — коронарная ангиография, м/ж — место жительства, ОКТ — оптическая когерентная томография, ОРИТ — отделение реанимации и интенсивной терапии, ОСЛКА — общий ствол левой коронарной артерии, ПМЖВ — передняя межжелудочковая ветвь, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
Из анамнеза жизни известно, что в течение 20 лет пациентка страдает артериальной гипертонией; острое нарушение мозгового кровообращения и сахарный диабет отрицает; семейный анамнез по сердечно-сосудистым заболеваниям не отягощен, курение отрицает. Аллергическая реакция на ингибиторы ангиотензинпревращающего фермента в виде сухого кашля. На момент госпитализации регулярно принимала ацетилсалициловую кислоту 75 мг/сут., клопидогрел 75 мг/сут., нифедипин 30 мг/сут., бисопролол 2,5 мг/сут., изосорбида мононитрат 80 мг/сут.
При проведении предоперационного обследования по данным биохимического анализа крови отмечалось наличие гиперлипидемии IIа типа, по данным электрокардиограммы (ЭКГ): синусовый ритм, частота сердечных сокращений 80 уд./мин, электрическая ось сердца отклонена влево (рисунок 2); по данным эхокардиографии (ЭхоКГ): камеры сердца не расширены, клапанный аппарат без патологии. Глобальная и локальная сократимость левого желудочка не нарушена. На основании данных жалоб, анамнеза, физикального и инструментального обследований был выставлен предварительный диагноз:
Ишемическая болезнь сердца: стенокардия напряжения III функционального класса. Гипертоническая болезнь III стадии, контролируемая артериальная гипертония, риск сердечно-сосудистых осложнений IV. Гиперлипидемия IIа типа.
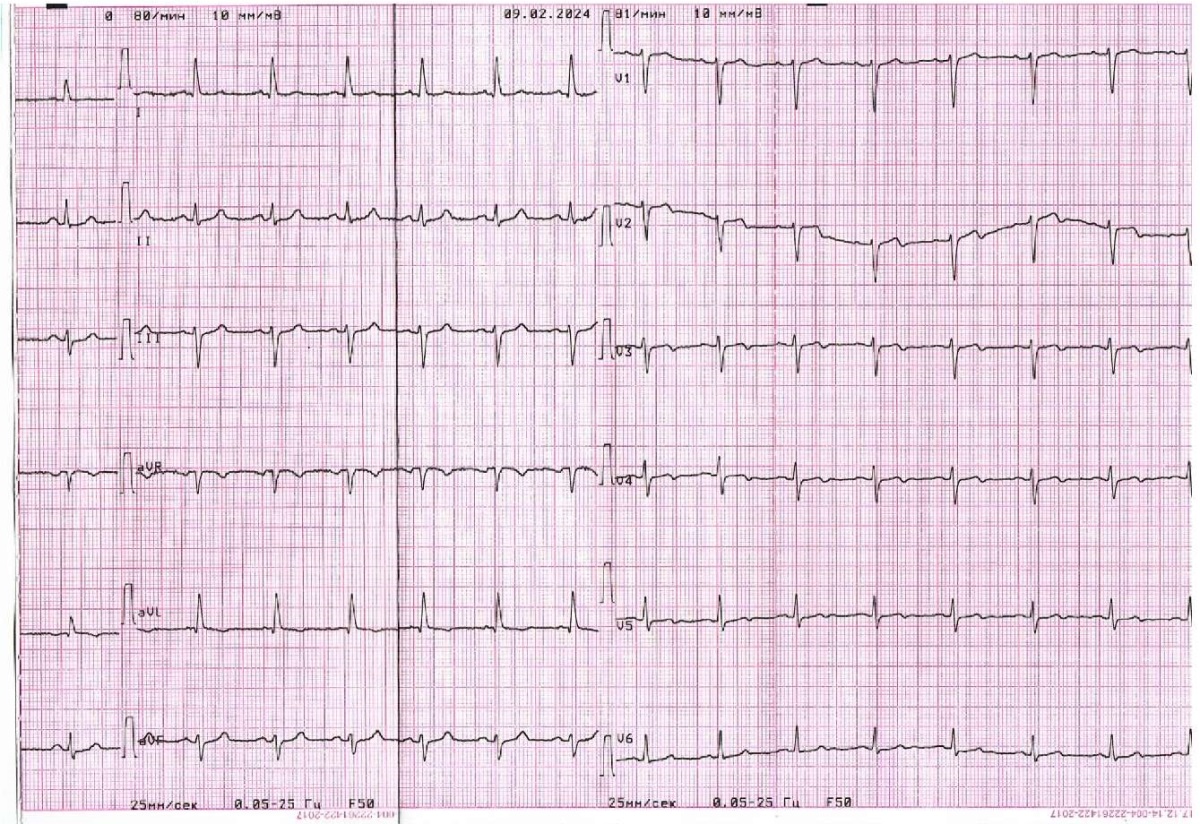
Рис. 2 ЭКГ при поступлении.
Примечание: ЭКГ — электрокардиография.
Медицинские вмешательства:
По результатам КАГ, проведенной через правый лучевой доступ, отмечалось наличие субтотального стеноза проксимального сегмента передней межжелудочковой ветви (ПМЖВ) (рисунок 3), остальные КА и их ветви не изменены (рисунок 4). Учитывая выявленное гемодинамически значимое поражение, было принято решение о проведении реваскуляризации миокарда в бассейне ПМЖВ.
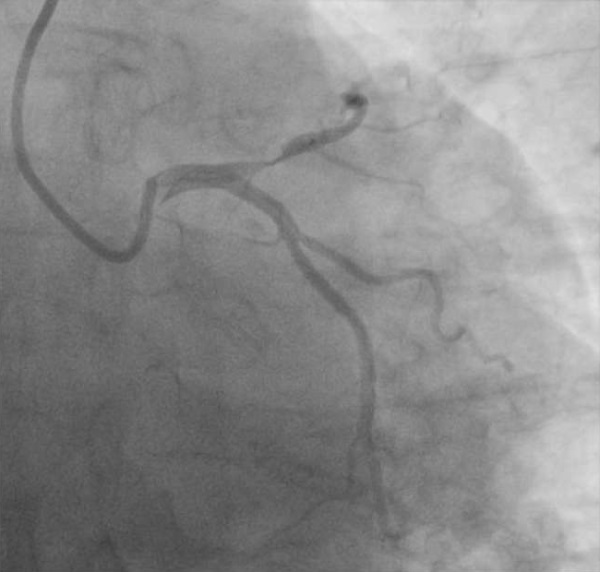
Рис. 3 Поражение проксимального сегмента ПМЖВ. Огибающая ветвь ЛКА не изменена.
Примечание: ЛКА — левая коронарная артерия, ПМЖВ — передняя межжелудочковая ветвь.
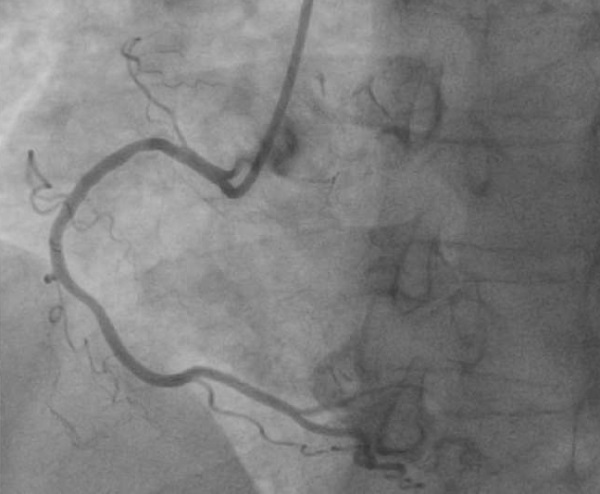
Рис. 4 Правая КА не изменена.
Примечание: КА — коронарная артерия.
Проводниковый катетер был установлен в устье ЛКА. Выполнена предилатация стенозированного участка ПМЖВ баллонным катетером 2×20 мм. Далее по коронарному проводнику для визуализации поражения и выбора оптимального размера стента был заведен датчик ВСУЗИ, данные представлены на рисунке 5. В область стеноза ПМЖВ с переходом на ОСЛКА был имплантирован стент с лекарственным покрытием 3,5×28 мм. На контрольной ангиографии визуализировались тромботические массы в дистальной части стентированного сегмента ПМЖВ (рисунок 6). Была назначена медикаментозная терапия эптифибатидом (согласно весу — 7 мл болюсно внутривенно (в/в) в 0 мин, через 10 мин повторно 7 мл болюсно в/в, далее в/в инфузия со скоростью 13 мл/ч в течение 12 ч). Согласно референтным диаметрам и размеру артерии, была выполнена постдилатация стентированного сегмента баллонным катетером NС 4,5×15 мм с удовлетворительным ангиографическим результатом. Выполнен рекроссинг проводников и киссинг-дилатация стентированного сегмента ОСЛКА-ПМЖВ и ОСЛКА-ОВ (огибающая ветвь) баллонными катетерами 3,5×20 мм и 3,5×20 мм. На контрольной ангиографии стент полностью расправлен, признаков диссекции нет, остаточного стеноза и тромбоза нет. Выполнено ВСУЗИ. Данных за диссекцию не получено, отмечалось полное прилегание стента к стенке артерии (рисунок 7). В стабильном состоянии пациентка была переведена в отделение реанимации и интенсивной терапии для дальнейшего наблюдения, на следующее утро пациентка была переведена в палату отделения.
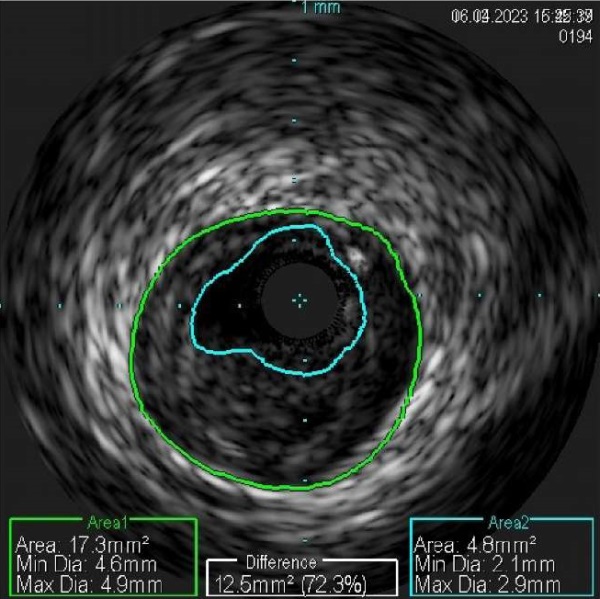
Рис. 5 Результаты ВСУЗИ. Голубым контуром отмечен истинный диаметр ПМЖВ, зеленым — фактический диаметр ПМЖВ.
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ПМЖВ — передняя межжелудочковая ветвь. Цветное изображение доступно в электронной версии журнала.
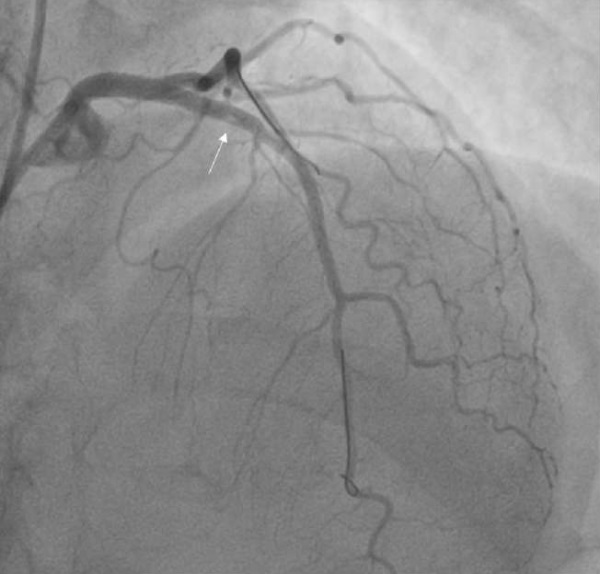
Рис. 6 Контрольная ангиограмма после имплантации стента в ОСЛКА с переходом на ПМЖВ. Визуализируются тромботические массы в дистальной части стентированного сегмента ПМЖВ (указано белой стрелкой).
Примечание: ОСЛКА — общий ствол левой коронарной артерии, ПМЖВ — передняя межжелудочковая ветвь.
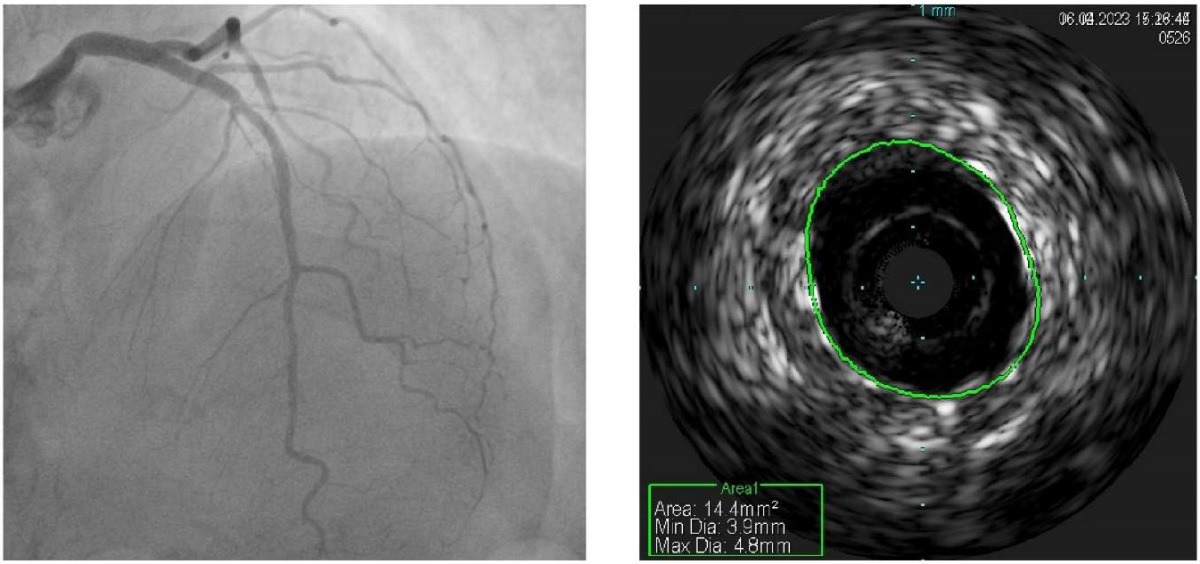
Рис. 7 Результат ангиопластики и стентирования ПМЖВ. Левая картинка — данные финальной ангиограммы. Правая картинка — данные ВСУЗИ (зеленой линией показаны контуры имплантированного стента).
Примечание: ВСУЗИ — внутрисосудистое ультразвуковое исследование, ПМЖВ — передняя межжелудочковая ветвь. Цветное изображение доступно в электронной версии журнала.
В первые сутки после проведения реваскуляризации миокарда при расширении двигательной активности в пределах отделения пациентка отметила возобновление загрудинной боли и одышки при минимальных ФН. По результатам ЭКГ отмечалась инверсия зубцов Т в отведениях I, avL, V1-V6, одиночные желудочковые экстрасистолы (рисунок 8). Было проведено исследование крови на уровень тропонина — 0,26 нг/мл (норма до 0,07 нг/мл). По результатам ЭхоКГ отмечался гипокинез апикального передне-перегородочного сегмента. Пациентке была выполнена ревизионная КАГ, по результатам которой в ОСЛКА визуализировался ранее имплантированный стент без признаков тромбоза и рестеноза, в проксимальном сегменте ПМЖВ в области имплантированного стента визуализируется дефект контрастирования (рисунок 9). Остальные КА и их ветви были без изменений. Учитывая проведенное ранее стентирование и возможные артефакты от имплантированного стента, для более детальной оценки дефекта контрастирования было проведено ОКТ-исследование, по результатам которого выявлена протрузия АСБ через ячейки ранее имплантированного стента (рисунок 10). Согласно референтным диаметрам, была выполнена баллонная ангиопластика данного участка ПМЖВ баллонным катетером NC 3,5×12 мм. Выполнено повторное ОКТ-исследование, по данным которого протрузия АСБ сохраняется, в связи с чем было принято решение имплантировать дополнительный стент в данной локализации. В область протрузии был позиционирован и имплантирован стент с лекарственным покрытием 3,5×12 мм. На контрольной съемке стент был полностью расправлен, признаков диссекции и тромбоза нет, остаточного стеноза нет. Была проведена внутрисосудистая оценка и контроль результатов стентирования с помощью ОКТ — данных за диссекции не получено, отмечалось полное прилегание стента к стенке артерии, данных за значимую протрузию АСБ не получено (рисунок 11). В стабильном состоянии пациентка была переведена в отделение реанимации и интенсивной терапии для дальнейшего наблюдения.
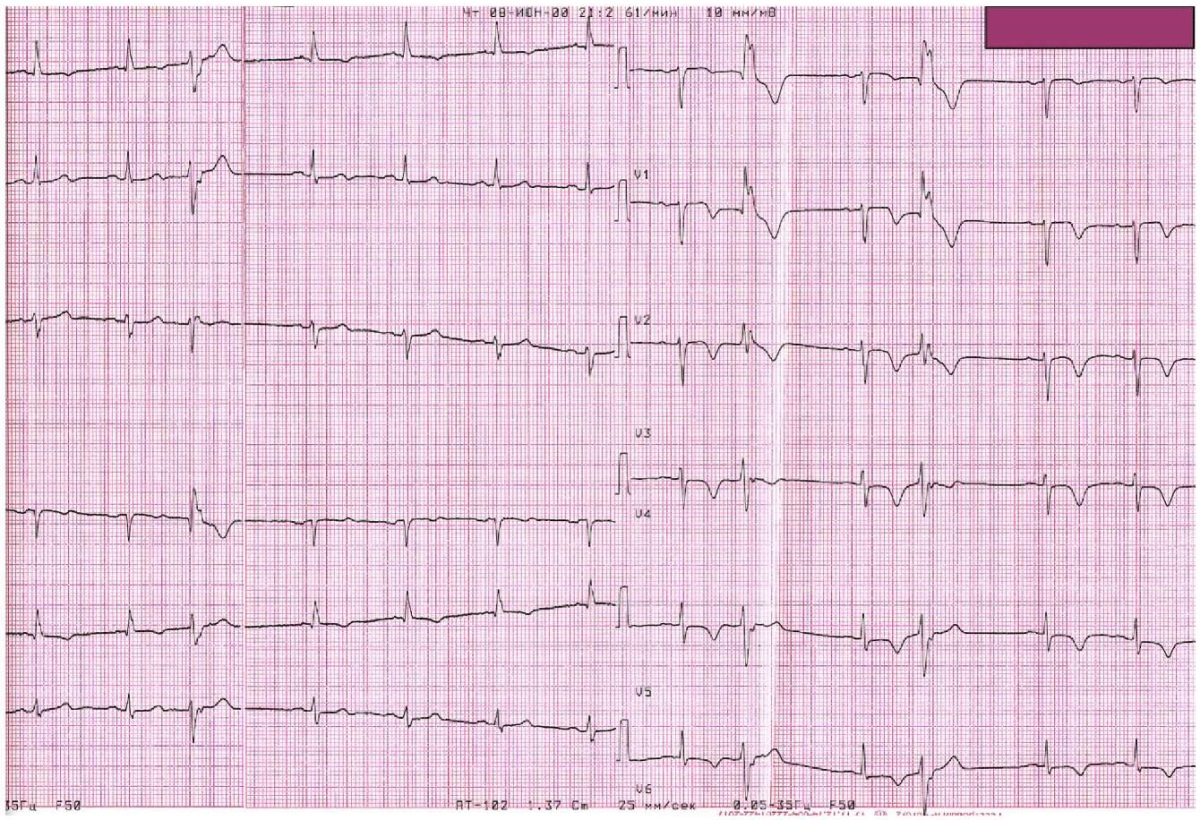
Рис. 8 ЭКГ в первые сут. после операции.
Примечание: ЭКГ — электрокардиография.
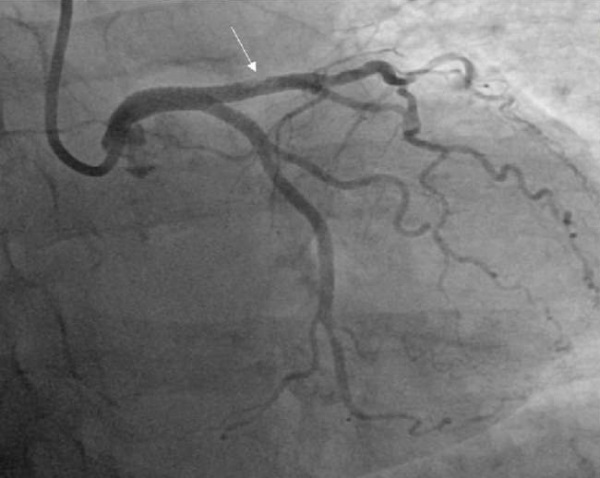
Рис. 9 Ревизионная КАГ. Дефект контрастирования в виде просветления в средней части раннее имплантированного стента в ПМЖВ (указан белой стрелкой).
Примечание: КАГ — коронарная ангиография, ПМЖВ — передняя межжелудочковая ветвь.
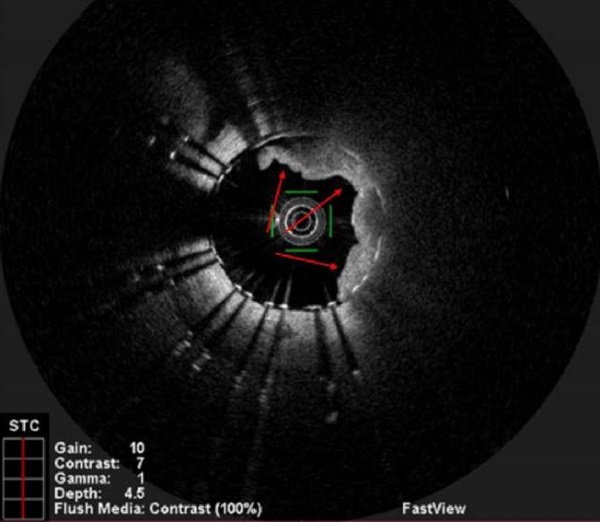
Рис. 10 ОКТ-исследование. Отмечается протрузия АСБ через ячейки ранее имплантированного стента в ПМЖВ в средней его части (указана красными стрелками).
Примечание: АСБ — атеросклеротическая бляшка, ОКТ — оптическая когерентная томография, ПМЖВ — передняя межжелудочковая ветвь. Цветное изображение доступно в электронной версии журнала.
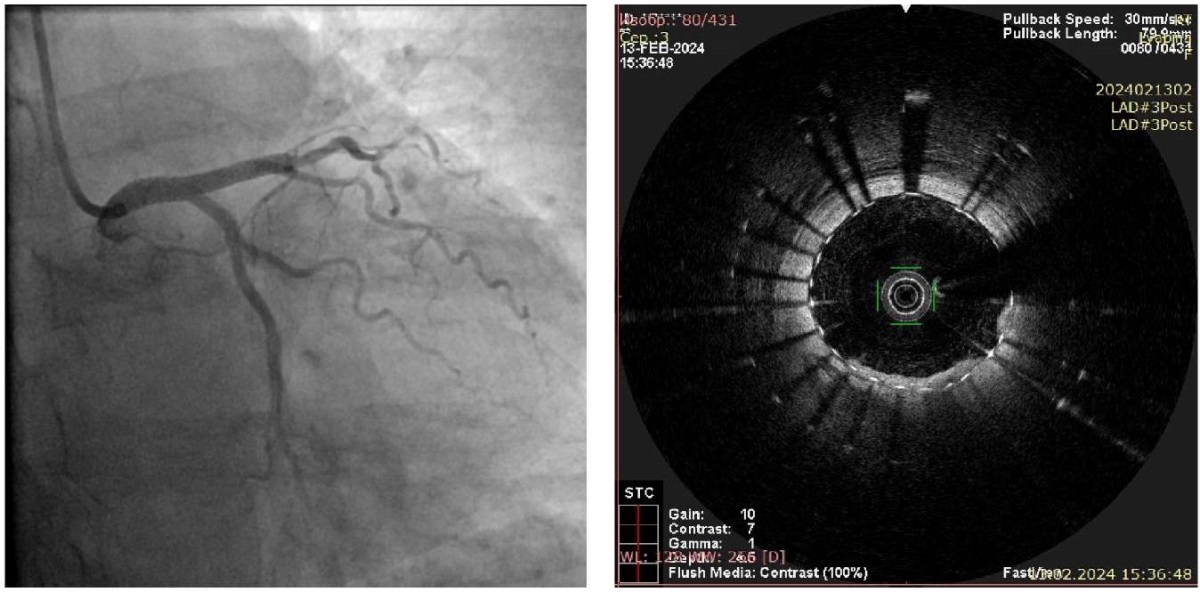
Рис. 11 Финальный результат ангиопластики со стентированием ПМЖВ (картинка слева — контрольная ангиография; картинка справа — ОКТ). Данных за диссекцию, тромбоз и значимую протрузию АСБ не получено.
Примечание: АСБ — атеросклеротическая бляшка, ОКТ — оптическая когерентная томография, ПМЖВ — передняя межжелудочковая ветвь.
Динамика и исходы
В дальнейшем боли ангинозного характера не рецидивировали, на ЭКГ отмечалась положительная динамика в виде уменьшения амплитуды отрицательного зубца Т в грудных отведениях (рисунок 12). При повторном измерении уровня тропонина — 0,23 нг/мл (максимально повышение <5 верхних границ нормы) — без тенденции к повышению. При проведении ЭхоКГ в динамике зон нарушения локальной сократимости левого желудочка нет. Пациентка была выписана на третьи сутки после повторной операции под наблюдение кардиолога по месту жительства. Были даны рекомендации по диете, соблюдению режима труда и отдыха. В качестве оптимальной медикаментозной терапии назначены ацетилсалициловая кислота 75 мг/сут., тикагрелор 180 мг/сут. в течение 1 года после стентирования, лерканидипин 20 мг/сут., бисопролол 5 мг/сут., лозартан 25 мг/сут., аторвастатин 80 мг/сут., омепразол 20 мг/сут. В дальнейшем при телефонном контроле состояния пациентки: ангинозных болей, одышки не отмечает, ФН переносит удовлетворительно.
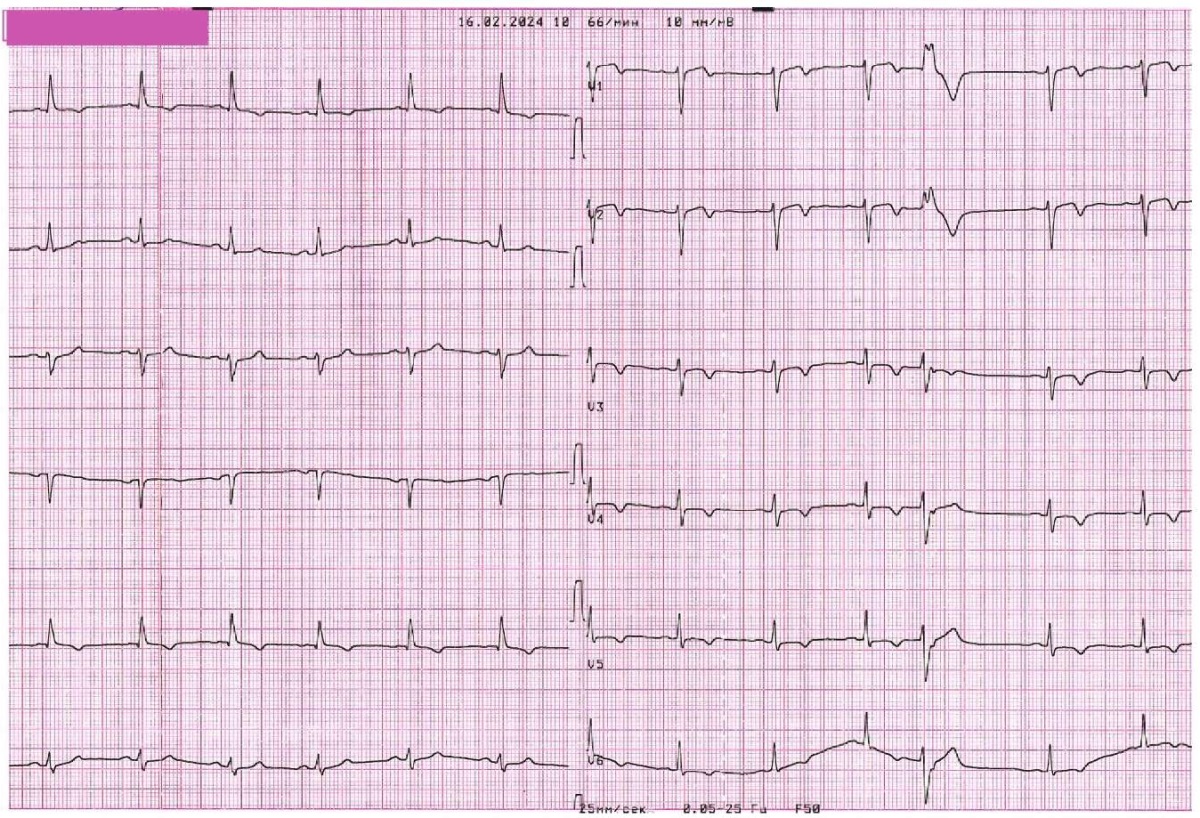
Рис. 12 ЭКГ при выписке из стационара.
Примечание: ЭКГ — электрокардиография.
Обсуждение
Методы ВСВ стали прорывным открытием в интервенционной кардиологии. В настоящее время важнейшим этапом эндоваскулярного лечения атеросклеротического поражения ОСЛКА и проксимальных сегментов КА является проведение ВСВ, которая дает важные сведения об анатомической конфигурации интересующей КА, а также о характеристике поражения, что может помочь в выборе оптимальной стратегии лечения. Кроме того, ВСВ предоставляет важные сведения для оценки результатов ЧКВ, включая раскрытие и аппозицию стента.
Расположение атеросклеротического поражения является одним из факторов, определяющих необходимый метод ВСВ. Так, ВСУЗИ дает лучшие данные, когда речь идет об аорто-устьевых и проксимальных поражениях, а также при большом диаметре сосуда. В вышеописанном клиническом случае, учитывая анатомическую локализацию атеросклеротического поражения, данные ВСУЗИ послужили отправной точкой для выбора оптимальной стратегии лечения. Несмотря на успешно проведенную реваскуляризацию миокарда с проведенным ангиографическим и ВСУЗИ-контролем, в первые сутки после ЧКВ произошла протрузия АСБ через ячейки стента. Как уже было оговорено ранее, в случае необходимости определения ранних и отсроченных осложнений после коронарного стентирования, ОКТ за счет более высокой разрешающей способности имеет преимущество перед ВСУЗИ. Именно поэтому методом выбора для ВСВ в раннем послеоперационном периоде послужило применение ОКТ-исследования. Как видим, с учетом преимуществ и ограничений каждого из методов, при ВСВ ВСУЗИ и/или ОКТ могут дополнять друг друга.
В руках опытного оператора ВСВ может быть выполнена быстро с минимальными осложнениями или вообще без них. Возможные перспективы развития, вероятно, будут включать в себя совместную ангиографическую визуализацию и ВСВ для получения максимально полных сведений об атеросклеротических процессах в сосудистой стенке и контроля проведения ЧКВ.
За счет появления и внедрения методов ВСВ выявляемость протрузии АСБ через ячейки имплантированного стента резко возросла и может встречаться вплоть до одной трети всех ЧКВ [10]. Однако в настоящее время наше понимание клинической значимости протрузии АСБ после ЧКВ остается неопределенным. По одним данным не было показано достоверного увеличения риска неблагоприятных исходов у пациентов с сохранявшейся остаточной протрузией АСБ [11], однако по другим был выявлен повышенный риск неблагоприятных сердечно-сосудистых событий в течение 12 мес. после первичного ЧКВ с сохранявшейся протрузией АСБ после стентирования [12]. При детальном изучении результатов исследований Kyodo A, et al. и Bryniarski K, et al. [12, 13] можно сделать ряд важных выводов: массивные протрузии с углом распределения ≥180° ассоциируются с худшим клиническим прогнозом; предикторами высокого риска развития массивной протрузии являются нестабильные бляшки с эрозией покрышки и большим липидным ядром, высокий уровень холестерина (ХС) липопротеинов низкой плотности (ЛНП) до проведения ЧКВ, а также большой диаметр имплантируемого стента. Последний вывод является наиболее интересным, поскольку больший диаметр КА часто сопряжен с бóльшим объемом липидного ядра АСБ, а поскольку для широких артерий используются стенты большего диаметра с крупными ячейками, риск протрузии липидного ядра АСБ через широкую ячейку выше.
В представленном клиническом случае отмечалось наличие протрузии АСБ, сопровождавшейся клинической симптоматикой, изменениями на ЭКГ и появлением зон гипокинеза в бассейне пораженной КА. Кроме того, у пациентки была гиперлипидемия IIа типа с уровнем общего ХС 7 ммоль/л и ХС ЛНП 4,3 ммоль/л. Данные клинико-анамнестические характеристики прямо коррелируют с выводами выше представленных исследований: угол распределения протрузии АСБ составлял 180°, протрузия произошла в проксимальном сегменте крупной ветви ЛКА с диаметром имплантированного стента 3,5 мм, при наличии высокого уровня ХС ЛНП. Таким образом, учитывая прогностически неблагоприятную характеристику протрузии, была выбрана инвазивная стратегия лечения с проведением баллонной ангиопластики и последующего стентирования. Учитывая наличие протрузии АСБ через ячейки ранее имплантированного стента с ухудшением клинической симптоматики, проведенное повторное стентирование данной анатомической локализации с формированием второго слоя металлического каркаса стента, риск тромботических осложнений данной пациентки был расценен как высокий, что диктовало необходимость усиления дезагрегантной терапии посредством замены клопидогрела на тикагрелор.
Заключение
Эндоваскулярная хирургия в настоящее время — одно из наиболее активно развивающихся направлений медицины. Технический прогресс, внедрение нового инструментария и соответствующих мануальных техник оказало значительное влияние на улучшение как краткосрочного, так и долгосрочного прогноза пациентов с сердечно-сосудистыми заболеваниями. В настоящее время методы ВСВ прочно вошли в арсенал интервенционных специалистов. ВСУЗИ и ОКТ являются современными визуализирующими методами, которые позволяют получить больше информации о коронарном русле до и после ЧКВ, а также внести определенные изменения в тактику ведения каждого конкретного пациента, что позволяет оптимизировать коронарные интервенции и снизить риск как ранних, так и отдаленных осложнений, связанных с техническими аспектами реваскуляризации пораженных артериальных сегментов.
Информированное согласие: информированное согласие пациента на публикацию своих данных получено 16.02.2024.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. 2018 ESC/EACTS Guidelines on myocardial revascularization.
2. 2023 ESC Guidelines for the management of acute coronary syndromes.
Список литературы
1. Ahmed M, Javaid H, Talha Maniya M, et al. Optical coherence tomography-guided versus angiography-guided percutaneous coronary intervention: A meta-analysis of randomized controlled trials. Int J Cardiol Heart Vasc. 2024;52:101405. doi:10.1016/j.ijcha.2024.101405.
2. Ahmed M, Zahra R, Ahsan A, et al. Intravascular ultrasound-guided versus angiography-guided percutaneous coronary intervention in patients with unprotected left main coronary artery disease: a systematic review and meta-analysis of randomized controlled trials and propensity score-matched studies. Arch Med Sci Atheroscler Dis. 2024;9:e82-5. doi:10.5114/amsad/188269.
3. Шумаков Д. В., Шехян Г. Г., Зыбин Д. И. и др. Поздние осложнения чрескожных коронарных вмешательств. РМЖ. 2020;10:25-8.
4. Meneveau N, Souteyrand G, Motreff P, et al. Optical Coherence Tomography to Optimize Results of Percutaneous Coronary Intervention in Patients with Non-ST-Elevation Acute Coronary Syndrome: Results of the Multicenter, Randomized DOCTORS Study (Does Optical Coherence Tomography Optimize Results of Stenting). Circulation. 2016;134(13):906-17. doi:10.1161/CIRCULATIONAHA.116.024393.
5. Räber L, Mintz GS, Koskinas KC et al.; ESC Scientific Document Group. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018;39(35):3281-300. doi:10.1093/eurheartj/ehy285.
6. Hong SJ, Mintz GS, Ahn CM, et al. IVUS-XPL Investigators. Effect of Intravascular Ultrasound-Guided Drug-Eluting Stent Implantation: 5-Year Follow-Up of the IVUS-XPL Randomized Trial. JACC Cardiovasc Interv. 2020;13(1):62-71. doi:10.1016/j.jcin.2019.09.033.
7. Prati F, Romagnoli E, La Manna A, et al. Long-term consequences of optical coherence tomography findings during percutaneous coronary intervention: the Centro Per La Lotta Contro L'infarto — Optimization Of Percutaneous Coronary Intervention (CLI-OPCI) LATE study. EuroIntervention. 2018;14(4):e443-51. doi:10.4244/EIJ-D-17-01111.
8. Ali Z, Landmesser U, Karimi Galougahi K, et al. Optical coherence tomography-guided coronary stent implantation compared to angiography: a multicentre randomised trial in PCI — design and rationale of ILUMIEN IV: OPTIMAL PCI. EuroIntervention. 2021;16(13):1092-9. doi:10.4244/EIJ-D-20-00501.
9. Gerbaud E, Weisz G, Tanaka A, et al. Multi-laboratory inter-institute reproducibility study of IVOCT and IVUS assessments using published consensus document definitions. Eur Heart J Cardiovasc Imaging. 2016;17(7):756-64. doi:10.1093/ehjci/jev229.
10. Soeda T, Uemura S, Park SJ, et al. Incidence and Clinical Significance of Poststent Optical Coherence Tomography Findings: One-Year Follow-Up Study From a Multicenter Registry. Circulation. 2015;132(11):1020-9. doi:10.1161/CIRCULATIONAHA.114.014704.
11. Ohashi H, Mizukami T, Sonck J, et al. Intravascular Imaging Findings After PCI in Patients With Focal and Diffuse Coronary Artery Disease. J Am Heart Assoc. 2024;13(5):e032605. doi:10.1161/JAHA.123.032605.
12. Kyodo A, Soeda T, Okamura A, et al. Clinical Impact of Irregular Protrusion Angle After Coronary Stenting at Culprit Lesions With ST-Elevation Myocardial Infarction — An Intravascular Optical Coherence Tomography Study. Circ Rep. 2021;3(8):431-9. doi:10.1253/circrep.CR-21-0071.
13. Bryniarski KL, Tahk SJ, Choi SY, et al. Clinical, angiographic, IVUS, and OCT predictors for irregular protrusion after coronary stenting. EuroIntervention. 2017;12(18):e2204-11. doi:10.4244/EIJ-D-16-00679.
Об авторах
Д. К. ВасильевРоссия
Васильев Дмитрий Константинович — к.м.н., руководитель отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний, врач рентгенэндоваскулярных методов диагностики и лечения.
Москва
Н. А. Араблинский
Россия
Араблинский Никита Александрович — аспирант, м.н.с. отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний, врач-кардиолог.
Москва
О. О. Коровина
Россия
Коровина Ольга Олеговна — врач-кардиолог отделения неотложной кардиологии.
Москва
Ф. Б. Шукуров
Россия
Шукуров Фирдавс Баходурович — к.м.н., с.н.с. отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний, врач рентгенэндоваскулярных методов диагностики и лечения.
Москва
Д. А. Фещенко
Россия
Фещенко Дарья Анатольевна — н.с. отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний, врач рентгенэндоваскулярных методов диагностики и лечения, заведующая операционным блоком.
Москва
М. Т. Талиуридзе
Россия
Талиуридзе Марьям Темуровна — врач-ординатор по специальности "рентгенэндоваскулярные диагностика и лечение".
Москва
- Методы внутрисосудистой визуализации способны компенсировать ограничения коронарной ангиографии и позволяют оптимизировать коронарные интервенции и снизить риск как ранних, так и отдаленных осложнений, связанных с техническими аспектами реваскуляризации пораженных артериальных сегментов.
- Согласно последним клиническим рекомендациям ESC (European Society of Cardiology) по лечению пациентов с острым коронарным синдромом, применение методов внутрисосудистой визуализации должно рассматриваться при проведении чрескожных коронарных вмешательств.
- В статье представлено описание клинического случая успешного лечения пациентки с ишемической болезнью сердца.
- Первичное вмешательство осложнилось клинически значимой протрузией атеросклеротической бляшки, что потребовало проведения ревизионной коронарографии и оптической когерентной томографии для выбора оптимального объема вмешательства и контроля его результата.
Рецензия
Для цитирования:
Васильев Д.К., Араблинский Н.А., Коровина О.О., Шукуров Ф.Б., Фещенко Д.А., Талиуридзе М.Т. Внутрисосудистая визуализация — ключ к успеху коронарных интервенций. Клинический случай. Кардиоваскулярная терапия и профилактика. 2024;23(6):4010. https://doi.org/10.15829/1728-8800-2024-4010. EDN: OJVPMT
For citation:
Vasiliev D.K., Arablinsky N.A., Korovina O.O., Shukurov F.B., Feshchenko D.A., Taliouridze M.T. Intravascular imaging as the key to successful coronary interventions: a case report. Cardiovascular Therapy and Prevention. 2024;23(6):4010. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4010. EDN: OJVPMT
JATS XML

























































