Перейти к:
Кардиоренальный континуум: клинико-патогенетические взаимосвязи между хронической сердечной недостаточностью с сохраненной фракцией выброса и дисфункцией канальцев почек
https://doi.org/10.15829/1728-8800-2024-4063
EDN: SIBHQX
Аннотация
В статье представлены данные о высокой актуальности изучения нового контура кардиоренального синдрома — повреждении канальцев почек при хронической сердечной недостаточности с сохраненной фракцией выброса (ХСНсФВ). Подробно изложены имеющиеся в мире научные сведения и предпосылки формирования ХСНсФВ, повреждения канальцевого аппарата почек; представлены маркеры тубулопатий. Обсуждается главная парадигма кардиоренального синдрома при ХСНсФВ с повреждением канальцев почек: единство факторов риска и патогенетических механизмов (низкоинтенсивное хроническое воспаление, эндотелиальная дисфункция, гиперактивность профибротических веществ). Необходимость выявления маркеров канальцевой дисфункции обусловлена возможностью расширения профилактических возможностей по замедлению этапов кардиоренального континуума — снижение фильтрационной функции и дальнейшее ремоделирование миокарда и сосудистого русла. Представленный обзор является продуктом анализа имеющихся данных в российских и зарубежных информационно-аналитических порталах.
Ключевые слова
Для цитирования:
Левицкая Е.С., Батюшин М.М., Закусилов Д.И., Батюшина А.М. Кардиоренальный континуум: клинико-патогенетические взаимосвязи между хронической сердечной недостаточностью с сохраненной фракцией выброса и дисфункцией канальцев почек. Кардиоваскулярная терапия и профилактика. 2024;23(9):4063. https://doi.org/10.15829/1728-8800-2024-4063. EDN: SIBHQX
For citation:
Levitskaya E.S., Batyushin M.M., Zakusilov D.I., Batyushina A.M. Cardiorenal continuum: clinical and pathogenetic relationships between heart failure with preserved ejection fraction and renal tubular dysfunction. Cardiovascular Therapy and Prevention. 2024;23(9):4063. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4063. EDN: SIBHQX
Введение
Хроническая сердечная недостаточность (ХСН), которая характеризуется высокими показателями распространенности, инвалидности и смертности, является медико-социальной проблемой во всем мире [1][2]. Феномен увеличения частоты ХСН в популяции объясняется тремя основными факторами — высокой эффективностью терапии хронических заболеваний, ранней и доступной диагностикой ХСН, а также большим количеством факторов риска (ФР) и коморбидных состояний, влияющих на развитие и прогрессирование сердечной недостаточности.
В последнее время большое количество научных исследований посвящается изучению особенностей ремоделирования миокарда и изменения гемодинамики, диагностических критериев и методов лечения ХСН с сохраненной фракцией выброса (ХСНсФВ) левого желудочка. Ранее считалось, что ХСН — это клинический синдром, который характеризуется нарушением в большей части сократительной функции миокарда и сопровождается из-за этого частыми госпитализациями и неблагоприятным прогнозом, а нарушения диастолической функции в патогенезе и прогнозе ХСН недооценивались [3]. Однако в последние десятилетия раскрыты новые фенотипы ХСН, уточнены патогенетические механизмы развития кардиальной дисфункции, выявлены новые маркеры необратимого ремоделирования сердечной мышцы, что кардинально изменило представление о ХСН [3]. Клинические проявления ХСН могут наблюдаться и при ХСНсФВ. Нарушение кровообращения в таких ситуациях обусловлено, главным образом, жесткостью миокарда и снижением его расслабления из-за разных причин [4]. Клинические проявления ХСНсФВ являются малоспецифичными, поэтому вероятность своевременного начала диагностического поиска снижается. В связи с этим ХСНсФВ очень часто остается нераспознанной, а возникающие клинические симптомы считают проявлением основных хронических заболеваний сердечно-сосудистой системы. Крупные клинические исследования демонстрируют высокую частоту ХСНсФВ, однако говорить об истинной распространенности достаточно трудно с учетом отсутствия точных и универсальных методов диагностики [3-6].
Статистические данные демонстрируют высокие показатели смертности при ХСНсФВ в течение однолетнего периода наблюдения, составляющие 6,3% [4]. По результатам эпидемиологических исследований 5-летняя выживаемость пациентов с ХСНсФВ составляет не >50-75%, что примерно соответствует выживаемости при ХСН со сниженной фракцией выброса (ХСНнФВ) [7-9]. Возникает некий диссонанс — пациенты с ХСНнФВ считаются тяжелыми пациентами с высоким риском фатальных событий, в то время как пациенты, имеющие ХСН, но без нарушения сократительной функции сердца считаются менее тяжелыми и часто вообще не выявляются, и это при одинаковых прогнозах выживаемости.
Патофизиологические механизмы развития ХСНсФВ и ХСНнФВ имеют ряд существенных различий, поэтому подходы к прогнозированию прогрессирования сердечной дисфункции также могут различаться.
Целью настоящего обзора является представление систематизированного материала, освещающего особенности развития и прогрессирования ХСНсФВ, научно доказанного обоснования этиопатогенетических взаимосвязей ХСНсФВ с повреждением канальцев почек и предпосылок их возникновения, возможностей ранней диагностики в клинической практике.
Методологические подходы
Проведен поиск российской и зарубежной научной литературы за период не <19 лет, годы поиска 2005-2024гг. Источниками являлись такие базы данных как eLIBRARY, PubMed, Google Scholar, Scopus. Использовались следующие ключевые слова: хроническая сердечная недостаточность с сохраненной фракцией выброса (chronic heart failure with preserved ejection fraction), маркеры повреждения канальцев почек (markers of kidney tubular damage), кардиоренальный континуум (cardiorenal continuum), эндотелиальная дисфункция (endothelial dysfunction), хроническое низкоинтенсивное воспаление (chronic low-intensity inflammation), β2-микроглобулин (β2-microglobulin), липокалин, связанный с желатиназой нейтрофилов (neutrophil gelatinase-associated lipocalin, NGAL), молекула повреждения почек (kidney injury molecule, KIM-1), цистатин С (cystatin C), N-ацетил-β-D-глюкозаминидаза (N-acetyl-β-D-glucosaminidase, NAG), фактор некроза опухоли-α (tumor necrosis factor-α), интерлейкины 6 и 8 (Interleukins 6 and 8), С-реактивный белок, определенный высокочувствительным методом (high-sensitivity C-reactive protein), моноцитарный хемоаттрактантный протеин-1 (monocyte chemoattractant protein-1), пентраксин-3 (pentraxin-3).
Результаты
Актуальность кардиоренального синдрома при ХСН. Традиционно считается, что при хронических сердечно-сосудистых заболеваниях одними из маркеров неблагоприятного прогноза являются показатели нарушения фильтрационной функции почек и повышение концентрации белка в моче. Скорость клубочковой фильтрации (СКФ) и альбуминурия являются высоко достоверными клиническими инструментами в стратификации риска развития сердечно-сосудистых осложнений, особенно при ХСНнФВ [10-12]. Генез повреждения клубочков при ХСНнФВ заключается в системной гипоперфузии, нарушении баланса регуляции системного давления (центрального венозного давления, внутрибрюшного давления), внутрипочечной гипотензии, активации нейрогуморальных систем, эндотелиальной дисфункции (ЭД) и окислительном стрессе [13]. В результате в клубочках развивается трансформация ткани обратимого (воспаление), а затем и необратимого характера (фиброз, склероз, гиалиноз). Прогностический смысл в этой ситуации заключается в том, что при гибели значительной массы действующих клубочков гиперактивируются, прежде всего, нейрогуморальные системы и усиливается окислительный стресс, воспалительные и профибротические реакции, т.е. происходит потенцирование ренокардиального влияния на поврежденный миокард и сосудистое русло. Важным является то, что при выявлении признаков стойкого снижения фильтрационной функции в клубочках развивается необратимое ремоделирование миокарда (рисунок 1).
Снижение СКФ при ХСНсФВ является неблагоприятным прогностическим фактором развития сердечно-сосудистых осложнений. Однако механизм повреждения клубочков при ХСНсФВ не описан. Имеются отдельные сведения о возможных патогенетических процессах, приводящих к повреждению клубочкового аппарата [14][15] (рисунок 1).
Маркеры канальцевой дисфункции при анализе особенностей кардиоренального синдрома и построении прогностических моделей при ХСН в клинической практике практически не используются. Однако в последнее время возрастает научный интерес к изучению предикторной роли канальцевого повреждения в прогнозе сердечно-сосудистого риска. Актуальность научного поиска может быть обоснована несколькими фактами. Во-первых, известно, что повреждение канальцевого эпителия чаще носит обратимый характер. Это связано с особенностью его строения и высокими регенеративными свойствами [16]. Во-вторых, высокая чувствительность эпителия канальцев к агрессивным факторам приводит к более раннему их повреждению по сравнению с изменениями в клубочках [16]. В связи с этим становится понятно, что прогностическая значимость маркеров канальцевой дисфункции за счет более раннего выявления и обратимости процесса, а, значит, чувствительности в отношении улучшения гемодинамики в процессе лечения больного и способности служить критериями эффективности терапии, может иметь большее значение по сравнению с традиционным определением маркеров нарушения фильтрационной способности.
Важно пояснить значение, вкладываемое в понятие канальцевой дисфункции. Канальцевая дисфункция — это обратимое или необратимое нарушение функции канальцев за счет патологических процессов, происходящих в канальцах с их повреждением. Повреждение канальцев почек происходит с изменением их структуры (ремоделированием). Поэтому термины "канальцевое повреждение", "канальцевое ремоделирование", а также "тубулопатии" считаются равнозначными и используются с одинаковой смысловой нагрузкой.

Рис. 1 Возможные варианты кардио-ренальных взаимоотношений при ХСНсФВ и ХСНнФВ.
Примечание: СКФ — скорость клубочковой фильтрации, ХСН — хроническая сердечная недостаточность, ХСНсФВ — ХСН с сохраненной фракцией выброса, ХСНнФВ — ХСН со сниженной фракцией выброса, ЦВД — центральное венозное давление, ЭД — эндотелиальная дисфункция, Р — давление, "?" — нет данных или данные недостаточны для единого общепризнанного мнения.
Патогенетические механизмы развития ХСНсФВ. Чтобы понимать особенности кардиоренальных взаимоотношений при ХСНсФВ, необходимо представить патогенетические механизмы развития сердечной недостаточности и возможные пути влияния на функцию почек.
Ранее считалось, что причиной ХСНсФВ является нарушение диастолической функции при гипертрофии миокарда левого желудочка (ЛЖ), которая приводит к снижению расслабления миокарда, повышению конечного диастолического давления ЛЖ и, как следствие, снижению "вмещаемости" объема крови в полость ЛЖ [17]. Таким образом, при нормальной фракции выброса ЛЖ, сниженный абсолютный объем крови и ригидность сосудистого русла приводят к недостаточности кровообращения, что чаще наблюдается в период физической активности. В дальнейшем научные и клинические исследования показали, что патогенез ХСНсФВ основан на том, что это мультисистемное состояние, включающее кардиальные и экстракардиальные механизмы [18]. Кроме ремоделирования миокарда в процессе развития ХСНсФВ участвуют легкие, почки, скелетные мышцы, сосуды [19]. Выделена новая парадигма, определяющая в основе формирования ХСНсФВ процессы воспаления и ЭД [19].
Низкоинтенсивное хроническое системное воспаление может являться одним из ведущих механизмов в патогенезе развития ХСНсФВ. Исследования последних лет показали, что у пациентов с ХСНсФВ часто повышены уровни провоспалительных биомаркеров в крови, таких как фактор некроза опухоли-α, интерлейкины 6 и 8, С-реактивный белок, определенный высокочувствительным методом, моноцитарный хемоаттрактантный протеин-1, пентраксин-3 [20-22]. В экспериментальных работах продемонстрировано, что повышение уровней факторов воспаления приводит к нарушению структуры ткани сердца и сосудов за счет активации окислительного стресса, повышения дифференцировки фибробластов и миофибробластов с увеличением продукции коллагена, деструкции внеклеточного матрикса [20]. Все эти процессы приводят к развитию жесткости миокарда и сосудистого русла.
ЭД также имеет высокую значимость в развитии и прогрессировании ХСНсФВ. Установлено, что изменение структуры и функции эндотелиальных клеток приводит к ремоделированию кардиомиоцитов и, как следствие, нарушению сердечной функции [20][23]. Одной из патогенетически значимых дисфункций эндотелия является нарушение регуляции тонуса сосудов. Дисбаланс между эндотелиальной секрецией вазоактивных констрикторных и дилатирующих биологических субстанций в сторону вазоконстрикции обуславливает увеличение микрососудистого сопротивления коронарного русла, следствием чего является локальное перераспределение жидкости во внутриклеточный матрикс [23][24]. Важно отметить, что не менее значимыми в развитии ХСНсФВ являются и изменения других функций эндотелия — нарушение барьерной функции, эндотелиальной паракринной активности, усиление процессов апоптоза [23][24]. Причинами формирования ЭД при ХСНсФВ могут быть различные факторы, наиболее значимыми среди которых являются взаимодействие с клетками, продуцирующими провоспалительные соединения, образование активных форм кислорода, эндотелиальное накопление натрия, нарушающее нормальное строение клеточного гликокаликса [20][23][24].
Известны данные о наличии микрососудистого разрежения (рарефикации) у пациентов с ХСНсФВ [25]. Предполагается, что наличие низкоинтенсивного воспаления в миокарде приводит к микрососудистому воспалению, а при положительном хронотропном действии и высокой сократимости миокарда (например, физическая нагрузка, стресс) возникают ишемические процессы, потенцирующие снижение коронарного резерва и сердечного выброса при ХСНсФВ.
Более того, важно отметить, что систолическая функция при ХСНсФВ также нарушена. Гипертрофированные или жесткие мышечные волокна нарушают процесс единства и последовательности сокращения, что проявляется в скрытом для рутинных клинических исследований нарушении систолы, при этом показатели ФВ ЛЖ нормальные). Подтверждением нарушения сократительной функции миокарда ЛЖ при ХСНсФВ является анализ продольной глобальной деформации, или иных деформаций мышечных волокoн [25][26] (рисунок 2).
Изучение механизмов развития и прогрессирования ХСНсФВ продолжаются. Открывающиеся детали патогенетических механизмов дополняют существующие знания, а также служат перспективой для изучения новых патологических путей развития и прогрессирования ХСНсФВ.

Рис. 2 Этиопатогенетические предпосылки развития ХСНсФВ.
Примечание: вчСРБ — С-реактивный белок, определенный высокочувствительным методом, ИЛ — интерлейкин, КА — коронарные артерии, ФНО-α — фактор некроза опухоли альфа, ХСНсФВ — хроническая сердечная недостаточность с сохраненной фракцией выброса, ЭД — эндотелиальная дисфункция, MCP-1 — моноцитарный хемоаттрактантный протеин.
Особенности патогенетических механизмов развития канальцевой дисфункции при ХСНсФВ — научные данные и предпосылки. Патогенетические процессы формирования канальцевой дисфункции при ХСНсФВ изучены недостаточно, однако уже сегодня можно выделить несколько основных механизмов развития данного варианта кардиоренального синдрома. Во-первых, наиболее очевидным является действие общих ФР. Простым примером этому может служить наличие у больного артериальной гипертензии (АГ) и сахарного диабета (СД) [27]. Действие гемодинамических факторов и гипергликемии приводит к миокардиальной регидности, с одной стороны, и гипертоническому повреждению тубулоинтерстиция и клубочков, с другой. Традиционным проявлением кардиоренального синдрома считается повреждение гломерулярного аппарата почек. Однако известно и о канальцевом ремоделировании у пациентов с АГ и СД. В повреждении канальцев важное значение играет не только непосредственное воздействие причинного фактора, но и состояние клубочков (наличие гиперфильтрации, повреждение подоцитов, продукция мезангиоцитами и подоцитами провоспалительных и профибротических соединений) [28-30]. Если на ранних стадиях хронической болезни почек фильтрационная функция может меняться динамично в зависимости от степени перфузии почечной ткани, то определение степени канальцевых повреждений, особенно в части их обратимости (наличие и выраженность канальцевого некроза) позволяет прогнозировать дальнейшее восстановление почечной функции в отдаленной перспективе [16].
Согласно имеющимся данным литературы, ЭД и воспаление являются ФР развития и прогрессирования повреждения канальцевого аппарата почек при ХСНсФВ. Streng KW, et al. на основании проведенных исследований продемонстрировали, что уровни показателей, отражающих канальцевую дисфункцию, были статистически значимо выше в группе пациентов с ХСНсФВ, по сравнению с больными с ХСН со сниженной ФВ (ХСНнФВ и ХСН с умеренно сниженной ФВ) [13]. Авторы статьи делают вывод, что нарушение функции почек при ХСНсФВ и ХСНнФВ обусловлено абсолютно разными механизмами — ведущей причиной патологии почек при последней является гемодинамический дисбаланс, тогда как при ХСНсФВ — ЭД и воспаление [13].
Почки представляют собой орган с уникальной системой кровоснабжения, а именно микроциркуляцией. Богатое кровоснабжение почек определяет высокую чувствительность к гипоксии, особенно эпителиальных клеток проксимальных канальцев. При наличии низкоинтенсивного системного воспаления вырабатываются вещества, в т.ч. непосредственно в канальцах, которые приводят к продукции активных форм кислорода, затем миграции лейкоцитов к эпителиальным и эндотелиальным клеткам, усугубляя гипоксию и воспаление [13].
В научной литературе большое внимание уделяется активации минералокортикоидных рецепторов, как фактора, не только участвующего в формировании низкоинтенсивного воспаления, но и запускающего механизмы активации провоспалительных факторов (плазминоген-1, трансформирующий фактор роста-β, интерлейкин-6, моноцитарный хемоаттрактантный протеин-1) [13]. Известно, что минералокортикоидные рецепторы находятся не только в эпителии канальцев, подоцитах, мезангиальных клетках, но и эндотелии сосудов, гладкомышечных клетках, фибробластах. В связи с этим можно предположить непосредственное повреждение канальцевого аппарата и опосредованное, по причине повреждения клубочков, а также микроциркуляторного русла почек при минералокортикоидной активности, вызванной ХСНсФВ. Влияние минералокортикоидов на почки известно. Физиологически альдостерон действует на эпителий канальцев для реабсорбции натрия и экскреции калия. Избыточное воздействие приводит к воспалению, дистрофии, а в дальнейшем и фиброзу эпителиальных клеток канальцев [31][32].
Данных о прямом влиянии других компонентов ренин-ангиотензин-альдостероновой системы (РААС) на повреждение канальцевого аппарата при ХСНсФВ накоплено мало. На основании анализа мировой научной литературы можно предполагать следующие механизмы. Скорее всего роль РААС в механизме канальцевой дисфункции при ХСНсФВ можно рассматривать как двусторонний процесс. Являясь регулятором активности секреции ренина, канальцы приводят к гиперсекреции РААС, в первую очередь, из-за гломерулярного повреждения. Иными словами, реализуется феномен, описываемый в литературе как нарушение гломерулярно-канальцевого баланса [33] — процесса, напрямую не зависящего от нейрогуморальной активации, а формирующегося вследствие высокой фильтрационной фракции (патологический процесс) и усиленной электролитной реабсорбции в проксимальном канальце (адаптивный процесс), как ответ на действие триггерного фактора на почки. Затем следует повышение уровня ренина в стенках афферентных и эфферентных артериол, как основных местах синтеза ренина (адаптивный процесс), и повышение гидростатического давления в клубочках [34]. Таким образом формируется механизм кардиоренального континуума: ХСНсФВ — почки. Следующим этапом является профибротическое и антидиуретическое действие, прежде всего ангиотензина II, как конечного компонента РААС, на все органы и ткани, а в первую очередь — нефрон. Описанный механизм являет собой замкнутый "порочный круг" в развитии и прогрессировании кардиоренальных взаимоотношений.
Важно также отметить следующий предполагаемый усугубляющий фактор в повреждении канальцев при ХСНсФВ. Известно, что работа канальцев — это высоко энергозатратный механизм [16][34]. Как уже описывалось выше, установлено, что пациенты с ХСНсФВ имеют низкоинтенсивное воспаление и ЭД с развитием тканевой гипоксии и действием свободных радикалов. В связи с этим, канальцы высоковероятно являются объектом повреждения.
По мнению ряда авторов, повреждение почек, в т.ч. и канальцевого аппарата, может происходить вследствие повышенного венозного давления, которое возникает из-за миокардиальной и сосудистой жесткости, гиперволемии при ХСНсФВ [25][35]. Увеличение центрального венозного давления способствует повышению интерстициального давления, механическому повреждению канальцев, нарушению венозного оттока и, в дальнейшем, развитию гломерулярной дисфункции. Таким образом, получается, что почка находится в ограниченном почечной капсулой пространстве в условиях высокого венозного давления, т.е. сжатой окружающими тканями. В литературе данный процесс получил название "почечной тампонады" [36][37]. Авторы считают, что явление ренальной венозной гипертензии является одним из ведущих механизмов повреждения всех почечных структур, особенно канальцевого аппарата при ХСН. Так, Boorsma EM, et al. демонстрируют снижение повреждения почечных структур при декапсулировании почки в экспериментальной модели сердечной недостаточности у лабораторных животных при формировании острой почечной ишемии [37] (рисунок 3).
Итак, анализ представленного материала позволяет заключить, что основной патогенетической концепцией развития канальцевой дисфункции при ХСНсФВ и самой ХСНсФВ являются действие факторов повреждения, низкоинтенсивное хроническое воспаление и гиперактивность профибротических медиаторов. Несомненно, что в случае вариабельности фенотипа ХСНсФВ вклад каждого патологического механизма будет меняться с развитием дополнительных повреждающих процессов. Однако стоит подчеркнуть, что достоверно говорить об инициаторе или объекте вторичного повреждения не представляется правильным. Возможно, патологические процессы в канальцах и сердце происходят одновременно после персистирующего действия ФР, с потенцированием механизмов повреждения и формированием "порочного круга". Возможен иной механизм — именно канальцы являются инициатором развития кардиоренального континуума при действии ФР, посредством, например, нарушения водно-электролитного гомеостаза, нейрогуморальной активации и т.д. Или имеет место наиболее распространенная гипотеза об изначальном повреждении сердца с последующим повреждением почечных структур? А может быть все перечисленные механизмы могут быть реализованы, только в различных клинических ситуациях? На сегодняшний день поиск патогенетических механизмов при ХСНсФВ активно продолжается, а повреждение канальцев почек изучено крайне мало.
Описанные предполагаемые процессы могут стать научной основой будущих исследований, которые необходимы для изучения возможностей ранней диагностики и терапии ХСНсФВ. В реальной клинической практике имеются трудности с постановкой диагноза ХСНсФВ, а маркеров почечной (традиционной гломерулярной) дисфункции длительное время нет. В случае выявления показателей нарушения функции канальцев, как показателей развития и прогрессирования кардиоренального синдрома, возможна более ранняя профилактика дальнейшего прогрессирования данного патологического процесса.
Перспектива использования маркеров канальцевой дисфункции в прогнозе ХСНсФВ
Маркеры нарушения функции канальцев почек при ХСНсФВ исследованы лишь в немногочисленных исследованиях, однако полученные результаты позволяют судить о высокой прогностической значимости и перспективности их дальнейшего изучения.
Липокалин, связанный с желатиназой нейтрофилов (neutrophil gelatinase-associated lipocalin, NGAL) — это белок, секретируемый и экспрессируемый в проксимальных канальцах нефрона [16][30][38]. Предикторная значимость NGAL очень велика в диагностике острого почечного повреждения [16][30]. В работе, проведенной Streng KW, et al., показано, что у пациентов с ХСНсФВ уровни NGAL и молекулы повреждения почек (kidney injury molecule-1, KIM-1) были повышены, что ассоциировано с повреждением проксимальных почечных канальцев [31]. Причем, данные маркеры имели более высокую предикторную значимость у пациентов с ХСНсФВ по сравнению с больными, имеющими ХСНнФВ, а также при сохранной СКФ (>60 мл/мин/1,73 м2).
Результаты субанализа исследования TOPCAT (Treatment of Preserved Cardiac Function Heart Failure With an Aldosterone Antagonist Trial) продемонстрировали высоко достоверную статистическую зависимость риска развития неблагоприятных сердечно-сосудистых событий (смерть, госпитализации по причине декомпенсации ХСН) с повышением уровней маркеров канальцевого повреждения NGAL и KIM-1 [39]. Важно отметить, что связи с величиной СКФ получено не было.
В исследовании PREVEND (Prevention of Renal and Vascular End-stage Disease) длительность наблюдения за пациентами в котором составила >11 лет, было показано, что повышенное выделение альбумина с мочой и уровень цистатина С были связаны с высоким уровнем развития ХСНсФВ, тогда как статистически достоверной зависимости с ХСНнФВ данных показателей установлено не было [40]. Причем, важно отметить, что в данное исследование были включены пациенты, имеющие сердечно-сосудистые заболевания, но без ХСН. Среднее время до развития ХСНсФВ составило 8,3±3,3 года, а до ХСНнФВ — 6,6±3,6 лет. Иными словами, проведенное исследование является проспективным и демонстрирует высокую прогностическую значимость маркеров канальцевой дисфункции в оценке риска развития ХСНсФВ. Полученные данные авторы исследования объясняют разницей в патогенезе формирования ХСНсФВ и ХСНнФВ, подчеркивая высокую значимость ЭД и воспаления в развитии ХСНсФВ.
Цистатин С также продемонстрировал свою предикторную значимость в риске развития и прогрессирования ХСНсФВ в ряде других исследований [41-43].
В исследовании Otaki Y, et al. в качестве маркеров повреждения канальцев были выбраны N-ацетил-β-D-глюкозаминидаза (NAG) и показатель соотношения β2-микроглобулина к креатинину мочи [44]. В исследование были включены пациенты с ХСНсФВ в стадии декомпенсации. В результате было установлено, что увеличение показателя отношения β2-микроглобулина к креатинину мочи ассоциировано с тяжестью и клиническими исходами ХСНсФВ, тогда как NAG не показал прогностическую значимость.
В другом исследовании, выполненном в группе пациентов с ХСНсФВ и митральной регургитацией, повышение уровня NAG было связано с высоким риском смерти или повторных госпитализаций [45], причем данная зависимость была установлена в группе пациентов <65 лет и без тяжелой сердечно-сосудистой патологии.
В таблице 1 приведена характеристика маркеров канальцевой дисфункции, которые продемонстрировали свою предикторную значимость в прогнозе сердечно-сосудистых осложнений у пациентов с ХСНсФВ.
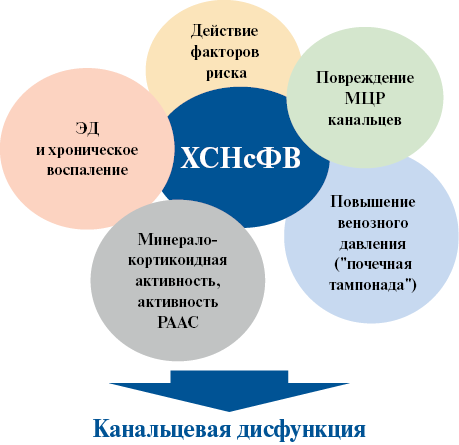
Рис. 3 Предпосылки развития канальцевой дисфункции при ХСНсФВ.
Примечание: МЦР — микроциркуляторное русло, РААС — ренин-ангиотензин-альдостероновая система, ХСНсФВ — хроническая сердечная недостаточность с сохраненной фракцией выброса, ЭД — эндотелиальная дисфункция.
Таблица 1
Характеристика маркеров канальцевой дисфункции, ассоциированных с повышением риска сердечно-сосудистых осложнений при ХСНсФВ
Маркер | Характеристика |
NGAL | Синтез и секреция молекулы происходит преимущественно в восходящей части петли Генле и собирательных протоках в случае их повреждения [16]. |
KIM-1 | KIM-1 представляет собой рецептор на поверхности неповрежденных эпителиальных клеток проксимальных канальцев. Функция KIM-1 состоит в связывании с фосфатидилсерином для реализации апоптоза. В связи с этим при повреждении эпителия проксимальных канальцев прогностическая значимость KIM-1 очень высока [16]. |
Цистатин С | Цистатин С представляет собой низкомолекулярный белок, важными свойствами которого являются его полная фильтрация клубочками и реабсорбция в проксимальных канальцах [16]. |
NAG | NAG является ферментом лизосом многих клеток, включая эпителиальные клетки проксимальных канальцев. Повышение фермента в моче свидетельствует об остром повреждении канальцев [16]. |
β2-микроглобулин | Низкомолекулярный белок, обнаруживаемый во многих клетках организма. Большая часть β2-микроглобулина фильтруется в почках и полностью реабсорбируется канальцами. |
Примечание: ХСНсФВ — хроническая сердечная недостаточность с сохраненной фракцией выброса, NGAL — липокалин, связанный с желатиназой нейтрофилов, KIM-1 — молекула повреждения почек, NAG — N-ацетил-β-D-глюкозаминидаза.
Заключение
Анализ представленных данных позволяет судить о высокой актуальности изучения нового контура кардиоренального синдрома — повреждения канальцев почек при ХСНсФВ. Главными предпосылками к выполнению научно-исследовательских работ являются единство ФР (главным образом, АГ и СД), патогенетических механизмов (низкоинтенсивное хроническое воспаление, ЭД, гиперактивность профибротических веществ) и, конечно, результаты проведенных исследований, демонстрирующих прогностическую значимость повреждения канальцевого аппарата почек у больных с ХСНсФВ. Необходимость выявления маркеров канальцевой дисфункции обусловлена возможностью расширения профилактических возможностей по замедлению этапов кардиоренального континуума — снижению фильтрационной функции и дальнейшего ремоделирования миокарда и сосудистого русла.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Ташкенбаева Э. Н., Насырова З. А., Яхёев А. А. и др. Хроническая сердечная недостаточность как ведущая медико-социальная и экономическая проблема. Журнал кардиореспираторных исследований. 2021;2(3):18-21. doi:10.26739/2181-0974-2021-3-3.
2. Khajavi A, Moshki M, Minaee S, et al. Chronic heart failure health-related quality of life questionnaire (CHFQOLQ-20): development and psychometric properties. BMC Cardiovasc Disord. 2023; 23:165. doi:10.1186/s12872-023-03197-9.
3. Гаврюшина С. В., Агеев Ф. Т. Сердечная недостаточность с сохраненной ФВ ЛЖ: эпидемиология, "портрет" больного, клиника, диагностика. Кардиология. 2018;58(S4):55-64. doi:10.18087/cardio.2467.
4. Канорский С. Г., Борисенко Ю. В. Хроническая сердечная недостаточность с сохраненной фракцией выброса: возможно ли эффективное лечение? Кардиология. 2018;58(6):85-89. doi:10.18087/cardio.2018.6.10154.
5. Цыганкова О. В., Евдокимова Н. Е., Латынцева Л. Д. Хроническая сердечная недостаточность с сохраненной фракцией выброса на фоне предиабета и абдоминального ожирения: компартменты жировых депо и кардиометаболические маркеры. РМЖ. Медицинское обозрение. 2023;7(1): 22-9. doi:10.32364/2587-6821-2023-7-1-22-29.
6. Кузьменко А. А., Соколова А. А., Напалков Д. А. Хроническая сердечная недостаточность с сохраненной фракцией выброса: оптимальная медикаментозная терапия. Обзор литературы. Сеченовский вестник. 2022;13(3):4-13. doi:10.47093/2218-7332.2022.13.3.4-13.
7. Harper AR, Patel HC, Lyon AR. Heart failure with preserved ejection fraction. Clin Med. 2018;18(2):s24-9. doi:10.7861/clinmedicine.18-2-s24.
8. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42:3599-726. doi:10.1093/eurheartj/ehab368.
9. Jasinska-Piadlo A, Campbell P. Management of patients with heart failure and preserved ejection fraction. Heart. 2023;109: 874-83. doi:10.1136/heartjnl-2022-321097.
10. Камышникова Л. А., Горбачевская К. С., Ефремова О. А. и др. Биомаркеры развития нежелательных сердечно-сосудистых событий при заболеваниях почек. Архивъ внутренней медицины. 2023;13(4):253-62. doi:10.20514/2226-6704-2023-13-4-253-262.
11. Khan MS, Shahid I, Anker SD, et al. Albuminuria and Heart Failure: JACC State-of-the-Art Review. J Am Coll Cardiol. 2023; 81(3):270-282. doi:10.1016/j.jacc.2022.10.028.
12. Mullens W, Damman K, Testani JM, et al. Evaluation of kidney function throughout the heart failure trajectory — a position statement from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2020;22:584-603. doi:10.1002/ejhf.1697.
13. Patel RN, Sharma A, Prasad A, et al. Heart Failure With Preserved Ejection Fraction With CKD: A Narrative Review of a Multispecialty Disorder. Kidney Med. 2023;5(12):100705. doi:10.1016/j.xkme. 2023.100705.
14. Chen Z, Lin Q, Li J, et al. Estimated Glomerular Filtration Rate Is Associated With an Increased Risk of Death in Heart Failure Patients With Preserved Ejection Fraction. Front Cardiovasc Med. 2021;8:643358.doi:10.3389/fcvm.2021.643358.
15. Арутюнов А. Г., Башкинов Р. А., Батлук Т. И. и др. Острое повреждение почек у пациентов с хронической сердечной недостаточностью. Южно-Российский журнал терапевтической практики. 2021; 2(3):6-17. doi:10.21886/2712-8156-2021-2-3-6-17.
16. Левицкая Е. С., Батюшин М. М. Канальцевый аппарат почек — научное и прикладное значение. Архивъ внутренней медицины. 2022;12(6):405-21. doi:10.20514/2226-6704-2022-12-6-405-421.
17. Снеткова А. А., Тимофеева Н. Ю., Задионченко В. С. Новые аспекты патогенеза и диагностики хронической сердечной недостаточности с сохранённой фракцией выброса в сочетании с сахарным диабетом 2 типа. Архивъ внутренней медицины. 2014;(2):46-50. doi:10.20514/2226-6704-2014-0-2-46-50.
18. Youn J-C, Ahn Y, Jung HO. Pathophysiology of Heart Failure with Preserved Ejection Fraction. Heart Fail Clin. 2021;17(3):327-35. doi:10.1016/j.hfc.2021.02.001.
19. Maaten JM, Damman K, Verhaar MC, et al. Connecting heart failure with preserved ejection fraction and renal dysfunction: the role of endothelial dysfunction and inflammation. Eur J Heart Fail. 2016;18(6):588-98. doi:10.1002/ejhf.497.
20. Pugliese NR, Pellicori P, Filidei F, et al. Inflammatory pathways in heart failure with preserved left ventricular ejection fraction: implications for future interventions. Cardiovasc Res. 2022; 118(18):3536-55. doi:10.1093/cvr/cvac133.
21. Matsubara J, Sugiyama S, Nozaki T, et al. Pentraxin 3 is a new inflammatory marker correlated with left ventricular diastolic dysfunction and heart failure with normal ejection fraction. J Am Coll Cardiol. 2011;57(7):861-9. doi:10.1016/j.jacc.2010.10.018.
22. Collier P, Watson CJ, Voon V, et al. Can emerging biomarkers of myocardial remodelling identify asymptomatic hypertensive patients at risk for diastolic dysfunction and diastolic heart failure? Eur J Heart Fail. 2011;13(10):1087-95. doi:10.1093/eurjhf/hfr079.
23. Cornuault L, Rouault P, Duplaa C, et al. Endothelial Dysfunction in Heart Failure With Preserved Ejection Fraction: What are the Experimental Proofs? Front Physiol. 2022;13:906272. doi:10.3389/fphys.2022.906272.
24. De Luca M, Crisci G, Armentaro G, et al. Endothelial Dysfunction and Heart Failure with Preserved Ejection Fraction — An Updated Review of the Literature. Life. 2024;14(1):30. doi:10.3390/life14010030.
25. Shah SJ, Borlaug BA, Kitzman DW, et al. Research Priorities for Heart Failure With Preserved Ejection Fraction. Circulation. 2020;141(12):1001-26. doi:10.1161/CIRCULATIONAHA.119.041886.
26. Shah AM, Claggett B, Sweitzer NK, et al. Prognostic importance of impaired systolic function in heart failure with preserved ejection fraction and the impact of spironolactone. Circulation. 2015;132:402-14. doi:10.1161/CIRCULATIONAHA.115.015884.
27. Гасанов М. З., Коломыйцева М. Н., Батюшин М. М. Роль уремической интоксикации в развитии сердечно-сосудистого ремоделирования у пациентов с хронической болезнью почек 3А-5Д стадий. Архивъ внутренней медицины. 2021;11(5):370-9. doi:10.20514/2226-6704-2021-11-5-370-379.
28. Bazzi C, Seccia TM, Napodano P, et al. High Blood Pressure Is Associated with Tubulointerstitial Damage along with Glomerular Damage in Glomerulonephritis. A large Cohort Study. J Clin Med. 2020;9(6):1656. doi:10.3390/jcm9061656.
29. Ofstad J, Iversen BM. Glomerular and tubular damage in normotensive and hypertensive rats. Am J Physiol Renal Physiol. 2005;288:F665-72. doi:10.1152/ajprenal.00226.2004.
30. Streng KW, Hillege HL, ter Maaten JM, et al. Urinary Marker Profiles in Heart Failure with Reduced Versus Preserved Ejection Fraction. J Cardiovasc Trans Res. 2024;17:3-12. doi:10.1007/s12265-023-10356-y.
31. Luther JM, Fogo AB. The role of mineralocorticoid receptor activation in kidney inflammation and fibrosis. Kidney Int Suppl. 2022;12(1):63-8. doi:10.1016/j.kisu.2021.11.006.
32. Shibata S, Ishizawa K, Uchida S. Mineralocorticoid receptor as a therapeutic target in chronic kidney disease and hypertension. Hypertens Res. 2017:40;221-5. doi:10.1038/hr.2016.137.
33. Mullens W, Martens P, Testani JM, et al. Renal effects of guideline-directed medicaltherapies in heart failure: a consensus document from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2022;24:603-19. doi:10.1002/ejhf.2471.
34. Gewin LS. Sugar or Fat? Renal Tubular Metabolism Reviewed in Health and Disease. Nutrients. 2021;13(5):1580. doi:10.3390/nu13051580.
35. Damman K, Testani JM. The kidney in heart failure: an update. Eur Heart J. 2015;36(23):1437-44. doi:10.1093/eurheartj/ehv010.
36. Bonacchi G, Rossi VA, Garofalo M, et al. Pathophysiological Link and Treatment Implication of Heart Failure and Preserved Ejection Fraction in Patients with Chronic Kidney Disease. Biomedicines. 2024;12(5):981. doi:10.3390/biomedicines12050981.
37. Boorsma EM, ter Maaten JM, Voors AA, et al. Renal Compression in Heart Failure. The Renal Tamponade Hypothesis. JACC: Heart Fail. 2022;10(3):175-83. doi:10.1016/j.jchf.2021.12.005.
38. Никифорова Т. А., Щекочихин Д. Ю., Копылов Ф. Ю. и др. Прогностическое значение биомаркеров при хронической сердечной недостаточности с сохраненной фракцией выброса левого желудочка. Терапевтический архив. 2016;88(9):102-5. doi:10.17116/terarkh2016889102-105.
39. Salman O, Qian C, Cohen J, et al. Prognostic Significance of Tubular Injury Biomarkers in Heart Failure With Preserved Ejection Fraction (HFpEF). Circulation. 2022;146:A12661. doi:10.1161/circ.146.suppl_1.12661.
40. Brouwers FP, de Boer RA, van der Harst P, et al. Incidence and epidemiology of new onset heart failure with preserved vs. reduced ejection fraction in a community-based cohort: 11-year follow-up of PREVEND. Eur Heart J. 2013;34(19):1424-31. doi:10.1093/eurheartj/eht066.
41. Xu CC, Fu GX, Liu QQ, et al. Association between cystatin C and heart failure with preserved ejection fraction in elderly Chinese patients. Z Gerontol Geriatr. 2018;51(1):92-7. doi:10.1007/s00391-016-1058-5.
42. Chirinos JA, Orlenko A, Zhao L, et al. Multiple Plasma Biomarkers for Risk Stratification in Patients With Heart Failure and Preserved Ejection Fraction. J Am Coll Cardiol. 2020;75(11):1281-95. doi:10.1016/j.jacc.2019.12.069.
43. Carrasco-Sánchez FJ, Galisteo-Almeda L, Páez-Rubio I, et al. Prognostic value of cystatin C on admission in heart failure with preserved ejection fraction. J Card Fail. 2011;17(1):31-8. doi:10.1016/j.cardfail.2010.07.248.
44. Otaki Y, Watanabe T, Shimizu M, et al. Renal tubular damage and clinical outcome in heartfailure with preserved ejection fraction and chronickidney disease. ESC Heart Fail. 2023;10:2458-68. doi:10.1002/ehf2.14378.
45. Zhao T, Chen G, Zhu S, et al. Prognostic Value of Urinary N-Acetyl-β-d-Glucosaminidase as a Marker of Tubular Damage in Patients with Heart Failure and Mitral Regurgitation. Rev Cardiovasc Med. 2023;24(8):219. doi:10.31083/j.rcm2408219.
Об авторах
Е. С. ЛевицкаяРоссия
Екатерина Сергеевна Левицкая — д.м.н., доцент, зав. кафедрой медицинской реабилитации, спортивной медицины и физического воспитания с курсом медико-социальной экспертизы, профессор кафедры внутренних болезней № 2.
Ростов-на-Дону
М. М. Батюшин
Россия
Батюшин Михаил Михайлович — д.м.н., профессор, профессор кафедры внутренних болезней № 2.
Ростов-на-Дону
Д. И. Закусилов
Россия
Закусилов Дмитрий Игоревич — старший преподаватель кафедры медицинского права, общественного здоровья и здравоохранения.
Ростов-на-Дону
А. М. Батюшина
Россия
Батюшина Алла Михайловна — студентка 4 курса педиатрического факультета.
Ростов-на-Дону
Дополнительные файлы
Что известно о предмете исследования?
- Хроническая сердечная недостаточность с сохраненной фракцией выброса (ХСНсФВ) характеризуется высокими распространенностью и смертностью, риском развития сердечно-сосудистых осложнений и коморбидными клиническими состояниями.
- В патогенезе формирования ХСНсФВ главное значение принадлежит хроническому низкоинтенсивному воспалению, эндотелиальной дисфункции.
- Маркерами кардиоренального континуума при ХСНсФВ являются показатели нарушения фильтрационной функции почек, альбуминурия.
Что добавляют результаты исследования?
- На основании общих процессов повреждения сердечно-сосудистой системы и канальцевого аппарата выделены единые патогенетические механизмы кардиоренального континуума при ХСНсФВ с научным обоснованием представленных данных.
- В результате анализа баз данных российских и зарубежных источников представлены маркеры канальцевой дисфункции при ХСНсФВ.
- Перспективное использование в клинической практике маркеров канальцевой дисфункции при ХСНсФВ может расширить профилактические возможности замедлению этапов кардиоренального континуума — снижение фильтрационной функции и дальнейшее ремоделирование миокарда и сосудистого русла.
Рецензия
Для цитирования:
Левицкая Е.С., Батюшин М.М., Закусилов Д.И., Батюшина А.М. Кардиоренальный континуум: клинико-патогенетические взаимосвязи между хронической сердечной недостаточностью с сохраненной фракцией выброса и дисфункцией канальцев почек. Кардиоваскулярная терапия и профилактика. 2024;23(9):4063. https://doi.org/10.15829/1728-8800-2024-4063. EDN: SIBHQX
For citation:
Levitskaya E.S., Batyushin M.M., Zakusilov D.I., Batyushina A.M. Cardiorenal continuum: clinical and pathogenetic relationships between heart failure with preserved ejection fraction and renal tubular dysfunction. Cardiovascular Therapy and Prevention. 2024;23(9):4063. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4063. EDN: SIBHQX
JATS XML

























































