Перейти к:
Маммографическая плотность молочной железы и сердечно-сосудистые заболевания у женщин. Обзор литературы
https://doi.org/10.15829/1728-8800-2024-4064
Аннотация
В мире ведется поиск новых простых и экономически доступных гендер-специфических маркеров для улучшения стратификации сердечно-сосудистого риска у женщин. Целью настоящего обзора является анализ связи маммографической плотности (МП) с сердечнососудистыми заболеваниями (ССЗ). Показано, что при низкой МП, т.е. высоком относительном содержании жира в молочной железе, наблюдается более высокая частота основных факторов риска ССЗ: артериальной гипертонии, гиперлипидемии, гипергликемии, избыточной массы тела, а также увеличение объема жировых депо, висцерального и эктопического жира. Низкая МП связана с более высоким 10-летним риском таких неблагоприятных сердечно-сосудистых событий, как ишемическая болезнь сердца, инсульт, заболевания периферических артерий, реваскуляризация, сердечная недостаточность, и может служить предиктором их развития. Включение МП в модель оценки риска ССЗ Framingham Risk Score повышает ее точность. Выявление низкой МП, как маркера высокого сердечно-сосудистого риска, позволяет использовать маммографию для раннего выявления и профилактики двух наиболее опасных заболеваний среди женского населения — рака молочной железы и ССЗ.
Ключевые слова
Для цитирования:
Бочкарева Е.В., Рожкова Н.И., Бутина Е.К., Ким И.В., Молчанова О.В., Микушин С.Ю., Ипатов П.В., Драпкина О.М. Маммографическая плотность молочной железы и сердечно-сосудистые заболевания у женщин. Обзор литературы. Кардиоваскулярная терапия и профилактика. 2024;23(8):4064. https://doi.org/10.15829/1728-8800-2024-4064
For citation:
Bochkareva E.V., Rozhkova N.I., Butina E. K E.K., Kim I.V., Molchanova O.V., Mikushin S.Yu., Ipatov P.V., Drapkina O.M. Mammographic breast density and cardiovascular disease in women. A literature review. Cardiovascular Therapy and Prevention. 2024;23(8):4064. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4064
Введение
Сердечно-сосудистые заболевания (ССЗ) являются ведущей причиной смерти в женской популяции [1], но, к сожалению, службы здравоохранения до сих пор не располагают эффективными и действенными методологиями для проведения широкомасштабного скрининга этих заболеваний среди женщин, что приводит к недооценке уровня риска и позднему началу профилактических мероприятий [2][3]. Ведется поиск новых подходов к повышению точности прогнозирования ССЗ у женщин, среди которых в последние годы активно обсуждается проблема использования с указанной целью некоторых маммографических параметров. Накоплены многочисленные данные о связи легко выявляемого при маммографии кальциноза артерий молочной железы (МЖ) с высокой заболеваемостью и смертностью от ССЗ среди женского населения [4-6]. В самые последние годы появились сведения о том, что еще один маммографический показатель — плотность МЖ может служить суррогатным маркером риска ССЗ [7, 8]. Результаты этих исследований дают основания рассматривать маммографию в качестве инструмента для совместного скрининга рака МЖ и ССЗ в женской популяции. Преимуществом такого подхода является отсутствие необходимости в дополнительных экономических затратах и увеличении лучевой нагрузки на пациента.
Цель обзора — проанализировать данные литературы о связи маммографической плотности (МП) МЖ с риском ССЗ у женщин, включая патофизиологические механизмы и проблемы визуализации.
Методологические подходы
Представлен несистематический обзор по проблеме выявления связи МП МЖ с риском ССЗ у женщин. Для достижения цели обзора проведен поиск оригинальных статей из баз данных PubMed и eLibrary без ограничения срока публикации. Поиск данных выполнен в марте 2024г по ключевым словам: маммография (mammography), плотность молочной железы (breast density), сердечно-сосудистые заболевания (cardiovascular diseases), сердечно-сосудистый риск (cardiovascular risk). Не включались публикации, содержащие сведения только о факторах риска ССЗ, без информации о конкретных заболеваниях. В результате поиска были найдены 4 оригинальные статьи, из которых 2 статьи содержали данные одномоментных исследований и 2 статьи — данные проспективных исследований. Помимо этого, в обзоре представлены первоисточники по вопросам оценки МП МЖ, связи этого показателя с объемом и распределением жировой ткани (ЖТ) в организме, патофизиологической роли висцеральной и эктопической ЖТ.
Результаты
MП обусловлена соотношением в МЖ железистой и ЖТ [9]. ЖТ, в отличие от железистой, рентгенологически прозрачна, поэтому чем выше доля ЖТ, тем меньше МП МЖ [10]. МП является признанным независимым фактором риска рака МЖ (рисунок 1). Действительно, у женщин с плотной МЖ риск развития рака МЖ > в 4 раза по сравнению с женщинами с невысокой плотностью МЖ [11]. Помимо этого, высокая МП является ограничением маммографии, снижающим ее чувствительность, поскольку оказывает маскирующий эффект при выявлении рака МЖ [12].
Плотность МЖ визуально оценивается и классифицируется рентгенологами в соответствии с различными системами оценки, среди которых наиболее распространенной является 4-категорийная шкала BI-RADS (Breast Imaging Reporting And Dated System) Американской коллегии радиологов (American College of Radiology — ACR) [13]. По данной шкале в зависимости от соотношения ЖТ и железистой ткани выделяют 4 категории плотности МЖ: ACR A – МЖ практически полностью представлена ЖТ и имеет наименьшую МП (от 0 до 25%); ACR B — преимущественно состоит из ЖТ, есть небольшие зоны железистой ткани (25-50%), ACR C — преимущественно состоит из железистой ткани (50-75%), ACR D — очень плотная МЖ, практически полностью состоит из железистой ткани и имеет самую высокую плотность (>75%) (рисунок 1). Реже применяются также 6-категорийная шкала Бойда (Boyd NF) [14] и 5-категорийная система Табара (Tabar L) [15].
К настоящему времени известно 4 крупных исследования по сопоставлению МП МЖ с риском ССЗ [16-19] (таблица 1).
Наиболее крупное по числу наблюдений исследование Tran TXМ, et al. (2023) [16], выполненное на основе Национальной базы данных медицинской информации Национальной службы медицинского страхования Республики Корея, охватывает 4268578 женщин ≥40 лет, прошедших скрининговую маммографию (популяционный скрининг рака МЖ) в 2009-2010гг, с последующим наблюдением до 2020г (таблица 1). Параметры МП МЖ по BI-RADS были сопоставлены с уровнем сердечно-сосудистого риска (ССР) по Фремингемской шкале риска (Framingham Risk Score, FRS) и 10-летним инцидентом сердечно-сосудистых событий (ССС), включающим ишемическую болезнь сердца, цереброваскулярную болезнь, заболевания периферических артерий, сердечную недостаточность. Оказалось, что в группе женщин с высоким ССР МП категории ACR А (МЖ, состоящая преимущественно из ЖТ) встречалась достоверно чаще, чем в группах умеренного и низкого риска: 51,0, 49,2 и 23,2%, соответственно. Всего за период наблюдения (в среднем, 10,9 лет) зарегистрировано 135475 ССС, при этом, чем ниже была МП на начальном этапе наблюдения, тем выше был риск неблагоприятных исходов. По сравнению с группой женщин с чрезвычайно плотной МЖ (МП категории ACR D), отношение рисков (hazard ratio — HR) c 95% доверительным интервалом (ДИ) развития ССС составило при MП категории ACR C — 1,12 (1,09-1,14), при МП категории ACR B — 1,19 (1,17-1,22) и MП категории ACR A (МЖ преимущественно состоит из ЖТ) — 1,29 (1,26-1,32), соответственно.
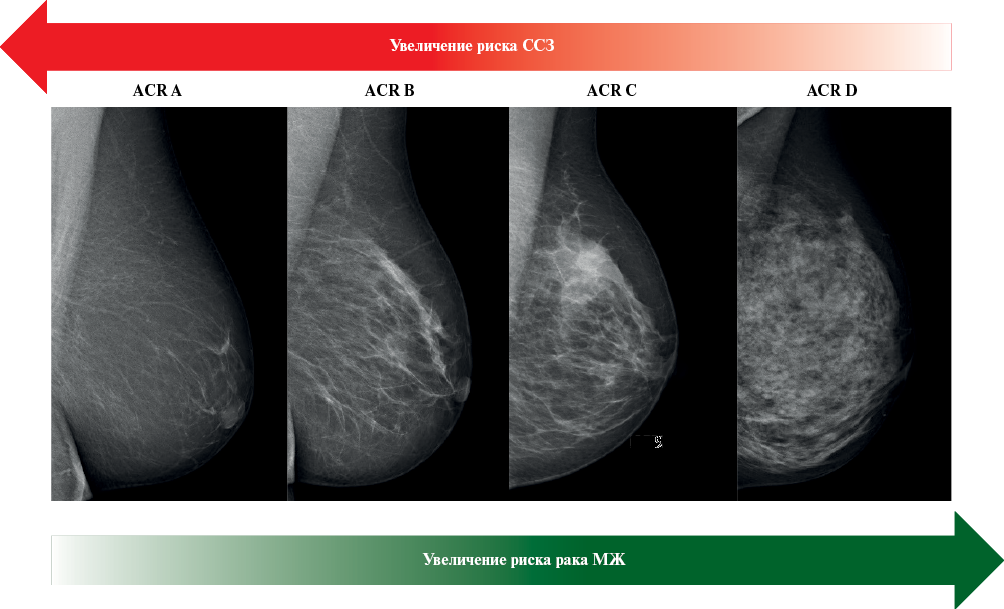
Рис. 1 Связь плотности МЖ (категории по ACR BI-RADS) с риском ССЗ и рака МЖ.
Примечание: МЖ — молочная железа, ССЗ — сердечно-сосудистые заболевания, ACR — American College of Radiology, BI-RADS — Breast Imaging Reporting and Dated System, ACR A — жировая ткань, ACR B — небольшие зоны железистой ткани, ACR C — преимущественно железистая ткань, ACR D — железистая ткань.
Таблица 1
Исследования по проблеме связи между МП МЖ с риском ССЗ
Исследование, год, ссылка, страна, дизайн, длительность наблюдения, название* | Пациенты (n), возраст, лет, критерии исключения | Методы | Основные результаты и выводы | |
Определение МП | Стандартизация | |||
Tran TX, et al., 2023 [16], Республика Корея, Ретроспективное когортное, 10,9 лет | n=4268578, 52,5±8,3 лет, без ИБС, инсульта, онкологических заболеваний | Визуально, ACR [13] | По компонентам FRS† | В общей популяции женщины с МП категории ACR А имели наиболее высокий кумулятивный инцидент ССЗ за весь период наблюдения (p<0,001). Женщины с менее плотной МЖ по сравнению с женщинами с наиболее плотной МЖ (ACR D), имели более высокий риск ССЗ: HR (95% ДИ) составляло, соответственно, при MП категории C — 1,12 (1,09-1,14), категории B — 1,19 (1,17-1,22), категории A — 1,29 (1,26-1,32). Добавление категории MП к FRS сопровождалось увеличением NRI на 7,15%; 95% ДИ: 6,85-7,69 (p<0,001). Наибольшим показатель NRI был в группе низкого сердечно-сосудистого риска. Резюме: МП МЖ является независимым предиктором возникновения ССЗ среди женщин. Добавление МП МЖ к FRS повышает точность прогноза ССЗ, особенно у лиц с низким риском. |
Al-Mohaissen M, et al., 2022 [17], Саудовская Аравия, Одномоментное | n=1406, 53,8 лет, без рака МЖ | Визуально, ACR | Возраст, ИМТ, статус ожирения | При МП наиболее низкой категории ACR А по сравнению с ACR В, C, D чаще встречалась АГ: 56,1 vs 46,3; 30,8; 20,6%; СД: 43,6 vs 37,9; 27,6; 9,3%; гиперхолестеринемия (ХС ≥4,9 ммоль/л): 65,4 vs 51,7; 42,2; 32,0%; имелись более высокий ИМТ: 34,5 vs 33,5; 30,9; 26,8 кг/м2 и уровень триглицеридемии (p<0,001 для всех показателей). При ACR А вероятность наличия гиперхолестеринемии увеличивается в 1,6 раза (OR=1,60; 95% ДИ: 1,00-2,54, р=0,048). При сочетании "ожирения с ACR А" вероятность АГ увеличивается > чем в 5 раз: OR=5,37; 95% ДИ 2,77-10,43 (р<0,001) Резюме: Низкая плотность МЖ (ACR А) ассоциирована с увеличением ИМТ и имеет такой же характер связи с факторами риска ССЗ, что и ожирение. Предлагается рассматривать MП категории ACR A, как новый неантропометрический индекс/маркер ожирения или нарушенного распределения жира в организме. |
Sardu C, et al., 2021 [18], Италия, Проспективное, 10 лет, BRECARD | n=3272, 47,4±4,2 лет, отобрано методом PSM из 16763 чел. по 818 чел. категорий ACR A-D, без менопаузы, ССЗ/ЦВЗ, хронических воспалительных, онкологических, неопластических заболеваний, кальциноз артерий МЖ | Компьютеризированный планиметрический метод расчета плотности МЖ в % с последующим определением категории ACR | ИМТ, отношение окружность талии/бедер, СД, гиперлипидемия, глюкоза, гликозилированный гемоглобин, курение, ЧСС, фолликулостимулирующий гормон, маркеры воспаления | Частота БНСС в группе ACR А составила 19,6% и была выше, чем женщин с ACR B — 7,6%; ACR C — 3,3%; ACR D — 2% (p<0,05 для всех показателей). Наличие до наступления менопаузы ACR А ассоциируется с более высокой 10-летней вероятностью БНСС: HR=3,234; 95% ДИ: 1,259-7,889 (р=0,004). Женщины с ACR А имели более высокий 10-летний кумулятивный риск БНСС: χ2=225,28 (р<0,01) (лог-ранговый тест Мантела-Кокса). Женщины с ACR А имели более высокий ИМТ, отношение окружности талии/бедер; среди них чаще выявлялась дислипидемия, АГ, СД или предиабет, курение; маркеры воспаления; более низкий уровень эстрадиола, фолликулостимулирующего гормона (p<0,05 для всех показателей). Резюме: Женщины в пременопаузе с МП МЖ ACR А имеют более высокий риск БНСС, чем женщины с более плотной МЖ. Авторы рекомендуют проводить маммографию женщинам с избыточным весом для определения плотности МЖ с целью прогнозирования вероятности БНСС. |
Исследование, год, ссылка, страна, дизайн, длительность наблюдения, название* | Пациенты (n), возраст, лет, критерии исключения | Методы | Основные результаты и выводы | |
Определение МП | Стандартизация | |||
Grassman F, et al., 2021 [19], Швеция, Проспективное, многоцентровое, 6,7 лет, KARMA | n=57867, 55,6 лет, без рака МЖ исходно, пластических операций на МЖ | Автоматическое определение плотности МЖ в % по методу STRATUS [20] | Возраст, курение, ИМТ, липид-снижающие, антигипертензивные, гормон-заместительные, контрацептивные препараты, физическая активность, алкоголь, возраст первых родов, менопауза, образование | Изучена связь МП МЖ с наличием и исходами кардиометаболических заболеваний, коды по МКБ-10: I20-I25 (ИБС), I34, I52.0 (другие болезни сердца). При наибольшей МП МЖ риск кардиометаболической смерти был ниже по сравнению с группами с меньшей МП: HR=0,64 (95% ДИ: 0,46-0,90) (р=0,010). Высокая исходная МП связана с более низкой вероятностью новых случаев СД — OR=0,67 (95% ДИ: 0,52-0,85), АГ — OR=0,85; 95% ДИ: 0,78-0,94; неспецифической боли в груди — OR=0,88; 95% ДИ: 0,81-0,97; заболеваний периферических артерий — OR=0,70; 95% ДИ: 0,56-0,88 (p<0,01 для всех показателей). Резюме: Маммографические особенности МЖ могут быть новым и доступным инструментом для оценки кардиометаболического здоровья женщин, проходящих маммографический скрининг. |
Примечание: * — при наличии, † — компоненты FRS: возраст, ИМТ, систолическое и диастолическое артериальное давление, холестерин общий и липопротеинов высокой плотности, глюкоза, антигипертензивная, липид-снижающая, сахароснижающая терапия, курение. АГ — артериальная гипертония, БНСС — большое неблагоприятное сердечно-сосудистое событие (ишемическая болезнь сердца, заболевания периферических артерий, инсульт/транзиторная ишемическая атака, реваскуляризация, госпитализация по поводу сердечно-сосудистых заболеваний), ДИ — доверительный интервал, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, МЖ — молочная железа, МКБ-10 — международная классификация болезней 10 пересмотра, МП — маммографическая плотность, СД — сахарный диабет 2 типа, ССЗ — сердечно-сосудистые заболевания, ЦВЗ — цереброваскулярные заболевания, ЧСС — частота сердечных сокращений, ACR — American College of Radiology, FRS — Framingham Risk Score, HR — hazard ratio (отношение рисков), NRI — Net Reclassification Improvement, OR — odds ratio (отношение шансов), PSM — Propensity Score Matching; BRECARD — BREast Density in Premenopausal Women is Predictive of CARdiovascular Outcomes at 10 Years of Follow-up, KARMA — The Karolinska Mammography Project for Risk Prediction of Breast Cancer.
Добавление категории МП МЖ к FRS показало увеличение индекса улучшения реклассификации (Net Reclassification Improvement — NRI) на 7,15%; 95% ДИ: 6,85-7,69 (p<0,001), при этом наиболее значимое улучшение реклассификации было отмечено в группе низкого ССР. В работе делается заключение, что МП МЖ является независимым предиктором возникновения ССЗ среди женщин.
В одномоментном исследовании [17], включающем значительную по численности группу женщин (n=1406), установлена связь низкой плотности МЖ с наличием артериальной гипертонии (АГ), а также с увеличением частоты факторов риска ССЗ — гиперхолестеринемии (уровень холестерина ≥4,9 ммоль/л), сахарного диабета (СД), избыточной массы тела, с более высоким уровнем триглицеридов в крови (p<0,001 для всех факторов) (таблица 1). У женщин с ожирением и наличием МП категории ACR А наблюдалось 5-кратное увеличение риска АГ: отношение шансов (odds ratio, OR)=5,37; 95% ДИ: 2,77-10,43 (р<0,001). Поскольку низкая плотность МЖ была связана с увеличением индекса массы тела и при этом имела аналогичный ожирению характер связи с другими факторами риска ССЗ, авторы предлагают рассматривать МП категории ACR А как новый неантропометрический индекс/маркер ожирения или нарушенного распределения жира в организме.
Наиболее убедительная доказательная база, подтверждающая целесообразность использования показателя МП МЖ в качестве предиктора ССЗ, представлена в многоцентровом методически четко спланированном исследовании BRECARD (BREast Density in Premenopausal Women is Predictive of CARdiovascular Outcomes at 10 Years of Follow-up) [18], включающем большую когорту женщин (n=3272), не имеющих менопаузы на начальном этапе наблюдения, и сформированную методом Propensity Score Matching из 4-х подгрупп, равных по численности (по n=818), женщин с категорией МП ACR A, B, C и D (таблица 1). Длительность проспективного наблюдения составила 10 лет.
Показано, что у женщин, имеющих до наступления менопаузы наименее плотную МЖ (МП категории ACR А), т.е. практически полностью состоящую из ЖТ, 10-летняя частота больших неблагоприятных ССС (БНСС) составила 19,6%, что в несколько раз превышало этот показатель у женщин с более плотной МЖ: 7,6, 3,3 и 2% для МП категорий ACR B, C и D, соответственно (p<0,05). Наличие до наступления менопаузы МП категории ACR А ассоциировалось с 3-кратным увеличением 10-летнего риска БНСС: HR=3,234; 95% ДИ: 1,259-7,889 (р=0,004).
На начальном этапе наблюдения у женщин с МП категории ACR А имелись также: более высокая частота факторов риска ССЗ — повышенное артериальное давление, дислипидемия, СД 2 типа, предиабет, курение; глюкозы, гликированного гемоглобина (HbA1с), маркеров воспаления (лейкоциты, гранулоциты, С-реактивный белок, интерлейкин-1, 6, фактор некроза опухоли альфа); более низкий уровень гормонов репродуктивной системы — эстрадиола, фолликулостимулирующего гормона (p<0,05 для всех показателей), что указывает на связь низкой плотности (параметров плотности) МЖ с основными патогенетическими механизмами ССЗ. Наличие высокого риска БНСС у женщин с преимущественно "жировой грудью" обосновывает, по мнению авторов, возможность использования маммографии вне рамок онкомаммоскрининга, со специальной целью — для прогнозирования риска БНСС у женщин с избыточным весом в зависимости от категории МП.
В проспективном исследовании [19], включающем большую когорту женщин, прошедших скрининговую маммографию и не имеющих на начальном этапе рака и пластических операций на МЖ (n=57867), изучена связь МП с развитием кардиометаболических заболеваний в соответствии с кодами международной классификации болезней 10 пересмотра (МКБ-10): I20-I25 (ишемическая болезнь сердца), I34, I52.0 (другие болезни сердца). В отличие от исследований [16-18], в данной скрининговой программе определяли относительную вероятность развития ССЗ у женщин с наиболее плотной МЖ (МП категории ACR D) по сравнению с женщинами, имеющими менее плотную МЖ (категории ACR A, B, C). Высокая МП была связана с более низкой вероятностью смерти от кардиометаболических заболеваний: HR=0,64 (95% ДИ: 0,46-0,90) (р=0,010), а также с наиболее низкой вероятностью новых случаев (низким инцидентом) АГ, заболеваний периферических артерий, СД 2 типа и неспецифических болей в грудной клетке (p<0,01 для всех показателей).
Таким образом, в исследовании [19] был выявлен такой же характер связи между плотностью МЖ, как и в других исследованиях по данной проблеме [16-18][20]: более высокий риск ССЗ наблюдался при низкой МП и наименьший риск ССЗ — у женщин с плотной МЖ.
В исследовании Grassmann F, et al. [19] парадоксальной находкой явилась более высокая частота нарушений ритма сердца у женщин с наиболее плотной МЖ: OR=1,19 (p<0,01). Потенциальным объяснением этой связи может быть частый прием в период менопаузы женщинами с плотной МЖ гормон-заместительной терапии [21], повышающей риск аритмий [22].
Связь более высокого риска ССЗ с низкой плотностью МЖ, т.е. с преобладанием объема ЖТ над железистой в структуре данного органа, может быть обусловлена несколькими патогенетическими механизмами. Так, уменьшение с возрастом плотности ("старение") ткани МЖ, особенно при переходе к менопаузе, является следствием общего биологического процесса — снижения уровня циркулирующих половых гормонов [23], приводящего к дольковой инволюции, постепенному уменьшению площади протокового эпителия и, как следствие, к уменьшению объема плотной железистой ткани [24][25]. Параллельно с этим вызванное менопаузой снижение уровня гормонов репродуктивной системы приводит к сосудистой дисфункции и нарушениям липидного обмена, оказывая негативное влияние на состояние сердечно-сосудистой системы [26].
Установлена связь низкой МП МЖ с увеличением объема жировых депо и распределением жира в организме. Имеется выраженная положительная корреляция между неплотной МЖ, обусловленной преобладанием ЖТ, и индексом массы тела [27], а также с гиноидным типом ожирения у молодых женщин [28].
Особенно важно, что объем ЖТ в МЖ и низкая МП положительно коррелируют с объемом не только подкожного, но также эктопического и висцерального жира [29, 30]. При этом необходимо учитывать, что избыточное накопление жира в висцеральных депо (висцеральное ожирение), является наиболее значимым фактором, определяющим негативное влияние ожирения на здоровье человека [31]. Висцеральное ожирение приводит к нарушениям метаболизма печени: снижению связывания инсулина, увеличению продукции липопротеинов, богатых триглицеридами, и выработки глюкозы в печени [32]. Избыток висцерального жира сопровождается увеличением продукции провоспалительных цитокинов (фактор некроза опухоли альфа и интерлейкин-6) и сниженным образованием защитного адипокина адипонектина — антиатерогенного, антидиабетического и противовоспалительного белка [33]. В целом, увеличение объема висцеральной ЖТ связано с хроническим вялотекущим воспалением и нарушением регуляции эндокринной и иммунной системы, что приводит к инсулинорезистентности, протромботическому и провоспалительному состояниям, приводящим к повреждению эндотелия, развитию атеросклероза и, следовательно, к возникновению и прогрессированию ССЗ [34][35].
Высказывается предположение [18], что большой объем ЖТ в МЖ, по аналогии с висцеральным жиром, может обладать метаболической активностью, и благодаря этому механизму являться специфическим для женщин независимым патогенетическим фактором развития ССЗ, что требует дальнейшего изучения.
Таким образом, представленные крупные исследования показали, что повышенное содержание жира в МЖ, оцениваемое по показателю МП, имеет патогенетическую связь с ССЗ и может служить предиктором их развития (рисунок 1). На примере FRS показано, что включение плотности МЖ в модель оценки риска ССЗ повышает её прогностическую точность [16], особенно в группе низкого ССР. Эти данные имеют важное практическое значение для совершенствования инструментов прогнозирования ССЗ у женщин, поскольку недооценка уровня риска среди женского населения является серьезной проблемой для профилактической кардиологии и клинической медицины.
Важный организационно-методический аспект использования МП в качестве маркера риска ССЗ — необходимость внедрения в скрининговые программы методов автоматического определения этого показателя на основе технологий искусственного интеллекта, поскольку оценка плотности МЖ в высшей степени субъективна и зависит от опыта и привычек рентгенологов, что приводит к существенной межоператорской вариабельности получаемых данных [36][37]. Уже разработан ряд полностью автоматизированных программ, которые могут применяться в качестве дополнений к маммографическим системам, и обеспечивать надежную и воспроизводимую оценку этого показателя [38][39].
В настоящее время при проведении маммографии показатель МП обычно учитывается только как фактор риска для рака МЖ, а кальциноз артерий МЖ вообще рассматривается как случайная доброкачественная находка, редко упоминаемая во врачебном заключении. Вместе с тем, эти два биомаркера, определяемые с помощью маммографии, могут быть использованы для улучшения стратификации ССР, что особенно важно у женщин в период до наступления менопаузы, и исследования в этом направлении должны быть продолжены. Использование этих маркеров открывает новые возможности для разработки методологии проведения популяционного скрининга ССЗ среди женщин; в связи с этим следует добиваться систематического и стандартизированного представления информации о МП и кальцинозе артерий МЖ, как части рутинной интерпретации данных маммографии.
Заключение
Результаты представленных исследований демонстрируют новые аспекты использования маммографии как скрининговой методики, а также большой потенциал научно-практического сотрудничества между кардиологами и специалистами по визуализации МЖ в области профилактики и лечения двух наиболее распространенных и опасных заболеваний среди женского населения — рака МЖ и ССЗ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Timmis A, Townsend N, Gale CP, et al. European Society of Cardiology: Cardiovascular Disease Statistics 2019. Eur Heart J. 2019;20(41):12-85. doi:10.1093/eurheartj/ehz859.
2. DeFilippis AP, Young R, Carrubba CJ, et al. An analysis of calibration and discrimination among multiple cardiovascular risk scores in a modern multiethnic cohort. Ann Intern Med. 2015;162:266-75. doi:10.7326/M14-1281.
3. Koh TJW, Tan HJH, Ravi PRJ, Sng JWZ, et al. Association Between Breast Arterial Calcifications and Cardiovascular Disease: A Systematic Review and Meta-analysis. Can J Cardiol. 2023; 39(12):1941-50. doi:10.1016/j.cjca.2023.07.024.
4. Бочкарева Е.В., Бутина Е.К., Байрамкулова Н.Х. и др. Ассоциация кальциноза артерий молочной железы и атеросклероза сонных артерий — маркера сердечнососудистого риска. Рациональная Фармакотерапия в Кардиологии. 2023;19(5):435-43. doi:10.20996/1819-6446-2023-2950.
5. Amin NP, Martin SS, Blaha MJ, et al. Headed in the right direction but at risk for miscalculation: a critical appraisal of the 2013 ACC/AHA risk assessment guidelines. J Am Coll Cardiol. 2014; 63:2789-94. doi:10.1016/j.jacc.2014.04.0102-7.
6. Lee SC, Phillips M, Bellinge J, et al. Is breast arterial calcification associated with coronary artery disease? A systematic review and meta-analysis. PLoS One. 2020;15(7):e0236598. doi:10.1371/journal.pone.0236598.
7. Margolies LR. Mammography, Breast Density, and Major Adverse Cardiac Events: Potential Buy-One-Get-One-Free Lifesaving Bonus Finding. JACC Cardiovasc Imaging. 2021;14(2):439-41. doi:10.1016/j.jcmg.2020.09.008.
8. Magni V, Capra D, Cozzi A, et al. Mammography biomarkers of cardiovascular and musculoskeletal health: A review. Maturitas. 2023;167:75-81. doi:10.1016/j.maturitas.2022.10.001.
9. Pettersson A, Graff RE, Ursin G, et al. Mammographic density phenotypes and risk of breast cancer: a meta-analysis. J Natl Cancer Inst. 2014;106(5):dju078. doi: 10.1093/jnci/dju078.
10. Nazari SS, Mukherjee P. An overview of mammographic density and its association with breast cancer. Breast Cancer. 2018; 25(3):259-67. doi:10.1007/s12282-018-0857-5.
11. McCormack VA, dos Santos Silva I.Breast density and parenchymal patterns as markers of breast cancer risk: a meta-analysis. Cancer Epidemiol Biomarkers Prev. 2006;15(6):1159-69. doi:10.1158/1055-9965.EPI-06-0034.
12. Freer PE. Mammographic breast density: impact on breast cancer risk and implications for screening. Radiographics. 2015; 35(2):302-15. doi:10.1148/rg.352140106.
13. Sickles EA, D’Orsi CJ, Bassett LW. ACR BI-RADS® Mammography. ACR BI-RADS® Atlas, 5th, American College of Radiology, Reston, VA, USA, 2013. https://www.acr.org/Clinical-Resources/Reporting-and-Data-Systems/Bi-Rads.
14. Boyd NF, Byng JW, Jong RA, et al. Quantitative classification of mammographic densities and breast cancer risk: results from the Canadian National Breast Screening Study. J Natl Cancer Inst. 1995;87(9):670-5. doi:10.1093/jnci/87.9.670.
15. Gram IT, Funkhouser E, Tabár L. The Tabár classification of mammographic parenchymal patterns. Eur J Radiol. 1997;24(2): 131-6. doi:10.1016/s0720-048x(96)01138-2.
16. Tran TXM, Chang Y, Kim S, et al. Mammographic breast density and cardiovascular disease risk in women. Atherosclerosis. 2023;387:117392. doi:10.1016/j.atherosclerosis.2023.117392.
17. Al-Mohaissen M, Alkhedeiri A, Al-Madani O, et al. Association of mammographic density and benign breast calcifications individually or combined with hypertension, diabetes, and hypercholesterolemia in women ≥40 years of age: a retrospective study. J Investig Med. 2022;70(5):1308-15. doi:10.1136/jim-2021-002296.
18. Sardu C, Gatta G, Pieretti G, et al. Pre-Menopausal Breast Fat Density Might Predict MACE During 10 Years of Follow-Up: The BRECARD Study. JACC Cardiovasc Imaging. 2021;14(2):426-38. doi:10.1016/j.jcmg.2020.08.028.
19. Grassmann F, Yang H, Eriksson M, et al. Mammographic features are associated with cardiometabolic disease risk and mortality. Eur Heart J. 2021;42(34):3361-70. doi:10.1093/eurheartj/ehab502.
20. Eriksson M, Li J, Leifland K, et al. A comprehensive tool for measuring mammographic density changes over time. Breast Cancer Res Treat. 2018;169(2):371-9. doi:10.1007/s10549-018-4690-5.
21. Azam S, Lange T, Huynh S, et al. Hormone replacement therapy, mammographic density, and breast cancer risk: a cohort study. Cancer Causes Control. 2018;29(6):495-505. doi:10.1007/s10552-018-1033-0.
22. Barber M, Nguyen LS, Wassermann J, et al. Cardiac arrhythmia considerations of hormone cancer therapies. Cardiovasc Res. 2019;115(5):878-94. doi:10.1093/cvr/cvz020.
23. Burton A, Maskarinec G, Perez-Gomez B, et al. Mammographic density and ageing: A collaborative pooled analysis of crosssectional data from 22 countries worldwide. PLoS Med. 2017;14(6):e1002335. doi:10.1371/journal.pmed.1002335.
24. Henson DE, Tarone RE, Nsouli H. Lobular involution: the physiological prevention of breast cancer. J Natl Cancer Inst. 2006; 98(22):1589-90. doi:10.1093/jnci/djj454.
25. Boyd NF, Stone J, Martin LJ, et al. The association of breast mitogens with mammographic densities. Br J Cancer. 2002;87(8): 876-82. doi:10.1038/sj.bjc.6600537.
26. Maas AHEM, Rosano G, Cifkova R, et al. Cardiovascular health after menopause transition, pregnancy disorders, and other gynaecologic conditions: a consensus document from European cardiologists, gynaecologists, and endocrinologists. Eur Heart J. 2021;42(10):967-84. doi:10.1093/eurheartj/ehaa1044.
27. Hudson S, Vik Hjerkind K, Vinnicombe S, et al. Adjusting for BMI in analyses of volumetric mammographic density and breast cancer risk. Breast Cancer Res. 2018;20(1):156. doi:10.1186/s13058-018-1078-8.
28. Dorgan JF, Klifa C, Shepherd JA, et al. Height, adiposity and body fat distribution and breast density in young women. Breast Cancer Res. 2012;14(4):R107. doi:10.1186/bcr3228.
29. Schautz B, Later W, Heller M, et al. Associations between breast adipose tissue, body fat distribution and cardiometabolic risk in women: cross-sectional data and weight-loss intervention. Eur J Clin Nutr. 2011;65(7):784-90. doi:10.1038/ejcn.2011.35.
30. Janiszewski PM, Saunders TJ, Ross R.Breast volume is an independent predictor of visceral and ectopic fat in premenopausal women. Obesity (Silver Spring). 2010;18(6):1183-7. doi:10.1038/oby.2009.336.
31. Neeland IJ, Ross R, Després JP, et al. International Atherosclerosis Society; International Chair on Cardiometabolic Risk Working Group on Visceral Obesity. Visceral and ectopic fat, atherosclerosis, and cardiometabolic disease: a position statement. Lancet Diabetes Endocrinol. 2019;7(9):715-25. doi:10.1016/S2213-8587(19)30084-1.
32. Neeland IJ, Hughes C, Ayers CR, et al. Effects of visceral adiposity on glycerol pathways in gluconeogenesis. Metabolism. 2017;67:80-9. doi:10.1016/j.metabol.2016.11.008.
33. Ouchi N, Parker JL, Lugus JJ, Walsh K.Adipokines in inflammation and metabolic disease. Nat Rev Immunol. 2011;11(2):85-97. doi:10.1038/nri2921.
34. Després JP. Body fat distribution and risk of cardiovascular disease: an update. Circulation. 2012;126(10):1301-13. doi:10.1161/CIRCULATIONAHA.111.067264.
35. Manrique-Acevedo C, Chinnakotla B, Padilla J, et al. Obesity and cardiovascular disease in women. Int J Obes (Lond). 2020;44(6): 1210-26. doi:10.1038/s41366-020-0548-0.
36. Ooms EA, Zonderland HM, Eijkemans MJ, et al. Mammography: interobserver variability in breast density assessment. Breast. 2007;16(6):568-76. doi:10.1016/j.breast.2007.04.007.
37. Alomaim W, O'Leary D, Ryan J, et al. Variability of Breast Density Classification Between US and UK Radiologists. J Med Imaging Radiat Sci. 2019;50(1):53-61. doi:10.1016/j.jmir.2018.11.002.
38. Lehman CD, Yala A, Schuster T, et al. Mammographic Breast Density Assessment Using Deep Learning: Clinical Implementation. Radiology. 2019;290(1):52-8. doi:10.1148/radiol.2018180694.
39. Magni V, Interlenghi M, Cozzi A, et al. Development and Validation of an AI-driven Mammographic Breast Density Classification Tool Based on Radiologist Consensus. Radiology. Artif Intell. 2022;4(2):e210199. doi:10.1148/ryai.210199.
Об авторах
Е. В. БочкареваРоссия
Бочкарева Елена Викторовна — д.м.н., руководитель лаборатории медикаментозной профилактики в первичном звене здравоохранения
Moscow
Н. И. Рожкова
Россия
Рожкова Надежда Ивановна — д.м.н., профессор, зав. Национальным центром онкологии репродуктивных органов, профессор кафедры клинической маммологии, лучевой диагностики, лучевой терапии
Moscow
Е. К. Бутина
Россия
Бутина Екатерина Кронидовна — к.м.н., с.н.с. лаборатории медикаментозной профилактики в первичном звене здравоохранения
Moscow
И. В. Ким
Россия
Ким Ирина Витальевна — к.м.н., н.с. лаборатории медикаментозной профилактики в первичном звене здравоохранения
Moscow
О. В. Молчанова
Россия
Молчанова Ольга Викторовна — к.м.н., в.н.с. лаборатории медикаментозной профилактики в первичном звене здравоохранения
Moscow
С. Ю. Микушин
Россия
Микушин Сергей Юрьевич — к.м.н., н.с. отделения комплексной диагностики и интервенционной радиологии в маммологии, доцент кафедры клинической маммологии, лучевой диагностики и лучевой терапии
Moscow
П. В. Ипатов
Россия
Д.м.н., профессор, г.н.с., в.н.с. научно-организационного отдела
Moscow
О. М. Драпкина
Драпкина Оксана Михайловна — д.м.н., профессор, академик РАН, директор
Moscow
Дополнительные файлы
Что известно о предмете исследования?
- В мире ведется разработка подходов по использованию маммографии не только для диагностики рака молочной железы (МЖ), но и для определения риска сердечно-сосудистых заболеваний (ССЗ) у женщин. В качестве одного из потенциальных маммографических маркеров сердечно-сосудистого риска в последние несколько лет рассматривается маммографическая плотность (МП) МЖ.
- МП МЖ зависит от относительного содержания жира в этом органе, при низкой МП МЖ преимущественно состоит из жировой ткани.
Что добавляют результаты исследования?
- Современные литературные данные свидетельствуют о том, что низкая МП связана с более высоким 10-летним риском серьезных неблагоприятных сердечно-сосудистых событий (ишемическая болезнь сердца, инсульт, заболевания периферических артерий, реваскуляризация, сердечная недостаточность).
- При низкой МП наблюдается более высокая частота основных факторов риска ССЗ, в т.ч. увеличение объема жировых депо, висцерального и эктопического жира.
- Включение МП в модель оценки риска ССЗ Framingham Risk Score повышает ее точность.
Рецензия
Для цитирования:
Бочкарева Е.В., Рожкова Н.И., Бутина Е.К., Ким И.В., Молчанова О.В., Микушин С.Ю., Ипатов П.В., Драпкина О.М. Маммографическая плотность молочной железы и сердечно-сосудистые заболевания у женщин. Обзор литературы. Кардиоваскулярная терапия и профилактика. 2024;23(8):4064. https://doi.org/10.15829/1728-8800-2024-4064
For citation:
Bochkareva E.V., Rozhkova N.I., Butina E. K E.K., Kim I.V., Molchanova O.V., Mikushin S.Yu., Ipatov P.V., Drapkina O.M. Mammographic breast density and cardiovascular disease in women. A literature review. Cardiovascular Therapy and Prevention. 2024;23(8):4064. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4064
JATS XML

























































