Перейти к:
Ассоциация уровней микроРНК плазмы крови с различной выраженностью коллатерального кровообращения при хронической окклюзии коронарной артерии у пациентов с ишемической болезнью сердца: пилотное исследование
https://doi.org/10.15829/1728-8800-2024-4086
EDN: WZQZCK
Аннотация
Цель. Изучение ассоциации 9 микроРНК плазмы крови и выраженности коллатерального кровообращения (КК) при наличии хронической окклюзии коронарной артерии (ХОКА) у пациентов с ишемической болезнью сердца (ИБС).
Материал и методы. Измерение уровня экспрессии 9 циркулирующих микроРНК в плазме было проведено с помощью полимеразной цепной реакции в режиме реального времени с использованием технологии Taqman на выборке из 43 человек. В исследование были включены пациенты с ИБС и ХОКА с хорошо (n=13) или плохо (n=10) развитым КК на основе классификации Rentrop, а также контрольная группа пациентов без значимого стенозирования коронарных артерий (n=20).
Результаты. Статистически значимые различия в уровне экспрессии были получены для 7 циркулирующих микроРНК у пациентов с ХОКА и хорошим КК и для 5 микроРНК в общей группе пациентов с ХОКА по сравнению с контрольной группой. Из 7 микроРНК была выявлена сниженная экспрессия hsa-miR-126-5p, hsa-miR-146a-5p, hsa-miR-155-5p, hsa-miR-15b-5p, hsa-miR-21-5p, hsa-miR-23a-3p и повышенная экспрессия hsa-miR-451a. Впервые показано, что уровень 2-х микроРНК (hsa-miR-23a-3p, hsa-miR-21-5p) существенно снижен, а уровень hsa-miR-451a повышен у пациентов с ИБС с достаточной функцией коллатеральных артерий.
Заключение. МикроРНК плазмы, для которых были получены статистически значимые различия, могут быть использованы для дальнейших исследований на выборке большего размера как кандидаты в биомаркеры для оценки выраженности КК при наличии ХОКА.
Ключевые слова
Для цитирования:
Киселева А.В., Васильев Д.К., Сопленкова А.Г., Шукуров Ф.Б., Сотникова Е.А., Фещенко Д.А., Куценко В.А., Араблинский Н.А., Скирко О.П., Жарикова А.А., Ершова А.И., Покровская М.С., Мешков А.Н., Драпкина О.М. Ассоциация уровней микроРНК плазмы крови с различной выраженностью коллатерального кровообращения при хронической окклюзии коронарной артерии у пациентов с ишемической болезнью сердца: пилотное исследование. Кардиоваскулярная терапия и профилактика. 2024;23(7):4086. https://doi.org/10.15829/1728-8800-2024-4086. EDN: WZQZCK
For citation:
Kiseleva A.V., Vasilyev D.K., Soplenkova A.G., Shukurov F.B., Sotnikova E.A., Feshchenko D.A., Kutsenko V.A., Arablinsky N.A., Skirko O.P., Zharikova A.A., Ershova A.I., Pokrovskaya M.S., Meshkov A.N., Drapkina O.M. Association of plasma microRNA levels with different collateral circulation degree in chronic total occlusion patients with coronary artery disease: a pilot study. Cardiovascular Therapy and Prevention. 2024;23(7):4086. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4086. EDN: WZQZCK
Введение
Коронарное коллатеральное кровообращение (КК) формируется за зоной хронической окклюзии коронарной артерии (ХОКА), играя жизненно важную роль в поддержании функционирования сердца, предотвращении некроза миокарда, уменьшении частоты желудочковых аневризм, обеспечении времени для реперфузионной терапии и в целом увеличении выживаемости пациентов [1]. Хорошо развитое КК и ангиогенез имеют решающее значение для улучшения симптомов и прогноза пациентов с ишемической болезнью сердца (ИБС) и при других неблагоприятных сердечных событиях [2][3].
Несмотря на наличие таких показателей коронарного ангиогенеза, как хроническое воспаление и факторы роста эндотелия сосудов, все еще не хватает биомаркеров, позволяющих различать пациентов с плохим или хорошим КК [4][5]. Предыдущие исследования показали различия в экспрессии генов на уровне матричной (мРНК) рибонуклеиновой кислоты (РНК) у пациентов с ИБС с плохо и хорошо развитым КК [6]. Недавно в качестве потенциального биомаркера для различных заболеваний были предложены микроРНК [7].
МикроРНК — это класс малых некодирующих высококонсервативных одноцепочечных РНК длиной ~22 нуклеотидов, которые подавляют экспрессию генов-мишеней либо за счет деградации мРНК, либо за счет ингибирования трансляции в зависимости от степени комплементарности микроРНК и мРНК [8].
Изменения в уровне экспрессии микроРНК играют фундаментальную роль в физиологических и в патологических состояниях, а стабильные микроРНК в биологических жидкостях (в т.ч. плазме или сыворотке крови) могут стать новыми биомаркерами, пригодными для клинической диагностики [7]. Но несмотря на то, что недавние исследования циркулирующих микроРНК в крови свидетельствуют об их возможном потенциале в качестве новых неинвазивных биомаркеров многих заболеваний, включая сердечно-сосудистые заболевания (ССЗ), одного биомаркера может быть недостаточно для диагностики ИБС, поскольку профиль экспрессии циркулирующих микроРНК может меняться в зависимости от стадии ССЗ пациента, его развития и методов лечения. Вероятно, комбинация различных микроРНК может оказаться полезной в диагностике и прогнозировании ССЗ [9].
МикроРНК играют важную роль в регуляции различных аспектов сосудистой биологии, включая ангиогенез [2][3][5], однако информация об экспрессии микроРНК у пациентов с ИБС с различной степенью формирования коллатеральных артерий крайне ограничена.
На основе анализа литературных источников, в рамках настоящего пилотного исследования были выбраны 5 микроРНК, описанных в исследованиях пациентов с ХОКА с плохим или хорошим КК: hsa-miR-146a-5p, hsa-miR-126-5p, hsa-miR-15b-5p, hsa-miR-155-5p [2][3][5][10][11], а также 4 микроРНК (hsa-miR-210-5p, hsa-miR-23a-3p, hsa-miR-21-5p, hsa-miR-451a), для которых ранее была показана ассоциация с ИБС [7][12] и участие в ангиогенезе [13-18]. Однако работ по изучению ассоциаций этих микроРНК с КК, насколько известно из доступной нам литературы, пока не было опубликовано.
Целью настоящего исследования было изучить ассоциации 9 микроРНК плазмы крови и выраженности КК при наличии ХОКА у пациентов с ИБС.
Материал и методы
Выборка. В исследование были включены 43 пациента, проходившие обследование в ФГБУ "НМИЦ ТПМ" Минздрава России (г. Москва), которые были разделены на 3 группы: пациенты с ИБС и ХОКА крупной эпикардиальной артерии (диаметр >2,5 мм) с хорошим (n=13) и плохим (n=10) КК на основе классификации Rentrop [19][20], и контрольная группа, куда входили пациенты без значимого стенозирования коронарных артерий (n=20).
Всем участникам исследования проводилась коронарная ангиография (ангиографическая установка General Electric, США). Исследование одобрено Независимым этическим комитетом ФГБУ "НМИЦ ТПМ" Минздрава России (протоколы № 05-05/15 от 09.06.2015, № 02-02/22 от 17.03.2022). Все участники дали письменное информированное согласие.
Критериями включения были: 1) для группы контроля — возраст >18 лет; предполагаемое наличие ИБС; отсутствие значимого стенозирования коронарных артерий (<50%); 2) для группы ХОКА с хорошим КК — возраст >18 лет; наличие клиники стенокардии; наличие известной ХОКА и планируемое чрескожное коронарное вмешательство; наличие ХОКА крупной эпикардиальной артерии (диаметр >2,5 мм) с развитием хорошего КК — 3 класс по классификации Rentrop; 3) для группы ХОКА с плохим КК — возраст >18 лет; наличие клиники стенокардии; наличие известной ХОКА и планируемое чрескожное коронарное вмешательство; наличие ХОКА крупной эпикардиальной артерии (диаметр >2,5 мм) с плохим КК — 0 класс по классификации Rentrop.
Критерии невключения: острый коронарный синдром (ОКС) за последние 6 мес.; хроническая инфекция, онкологическое заболевание в анамнезе, воспалительные заболевания, психические расстройства, беременность, отказ от подписания информированного согласия.
Выделение микроРНК. Кровь собирали в пробирки с этилендиаминтетрауксусной кислотой (ЭДТА) и хранили при комнатной температуре не >1 ч до выделения плазмы. Далее кровь центрифугировали 15 мин при 1200 g при +4о С, отбирали плазму и хранили при -70о С в биобанке ФГБУ "НМИЦ ТПМ" Минздрава России (г. Москва) [21]. Образцы плазмы перед выделением РНК размораживали на льду и центрифугировали при 14000 g в течение 15 мин при +4о С, после чего супернатант переносили в чистые пробирки, свободные от нуклеаз. Супернатант использовали для выделения тотальной РНК, включая микроРНК, с помощью miRNeasy Serum/Plasma Advanced Kit (Qiagen, Германия) согласно протоколу производителя. Каждый образец РНК был разделен на аликвоты, хранящиеся при -70о С до дальнейшего анализа. Время хранения плазмы до выделения микроРНК составило 2 [ 0,2; 25] мес.
Выбор микроРНК. В исследование были включены 9 микроРНК, ассоциированных с ИБС, и одна микроРНК для нормализации полученных данных (таблица 1).
Таблица 1
Список анализируемых микроРНК
МикроРНК | Название зонда | Последовательность зрелой микроРНК | Источник |
hsa-miR-126-5p | 477888_mir | CAUUAUUACUUUUGGUACGCG | [2][3][7][11] |
hsa-miR-146a-5p | 478399_mir | UGAGAACUGAAUUCCAUGGGUU | [5][7] |
hsa-miR-155-5p | 483064_mir | UUAAUGCUAAUCGUGAUAGGGGUU | [7][22] |
hsa-miR-15b-5p | 478313_mir | UAGCAGCACAUCAUGGUUUACA | [3][7] |
hsa-miR-16-5p | 477860_mir | UAGCAGCACGUAAAUAUUGGCG | [23] |
hsa-miR-21-5p | 477975_mir | UAGCUUAUCAGACUGAUGUUGA | [7][12][15][16] |
hsa-miR-210-5p | 478765_mir | AGККCUGККACCGCACACUG | [7][18] |
hsa-miR-23a-3p | 478532_mir | AUCACAUUGCCAGGGAUUUCC | [7][12-14] |
hsa-miR-451a | 478107_mir | AAACCGUUACCAUUACUGAGUU | [7][17][24] |
hsa-miR-503-5p | 478143_mir | UAGCAGCGGGAACAGUUCUGCAG | [10][25] |
Примечание: РНК — рибонуклеиновая кислота.
Полимеразная цепная реакция (ПЦР) в режиме реального времени. Для анализа экспрессии микроРНК использовался метод количественной ПЦР в режиме реального времени (кПЦР), которая проводилась с помощью TaqMan Advanced miRNA cDNA Synthesis Kit, TaqMan Advanced miRNA assays, TaqMan Fast Advanced Master Mix (Thermo Fisher Scientific, Waltham, MA, USA) на амплификаторе 7500 Fast Real-Time PCR System (Thermo Fisher Scientific, Waltham, MA, USA) согласно протоколам производителя. Нормализацию данных кПЦР для каждой микроРНК проводили с использованием значения пороговых циклов Cq (cycle of quantification) для hsa-miR-16-5p [23]. Степень гемолиза образцов определяли по соотношению в Cq независимой от гемолиза hsa-miR-23a-3p и гемолиз-зависимой микроРНК hsa-miR-451a, содержащейся в эритроцитах [23][26]. Для каждого зонда в качестве отрицательного контроля была проведена ПЦР без матрицы.
Статистический анализ. Для анализа полученных данных применяли метод относительной количественной оценки 2-ΔΔCq [27]. Определение значений пороговых циклов Cq проводили в одной технической повторности для каждой мишени микроРНК в отдельном образце. Если значение Cq анализируемой микроРНК не было получено в течение 40 циклов ПЦР, ее Cq считали равным 40. Статистический анализ проведен в среде R 4.2. Непрерывные параметры представлены в виде медианы и интерквартильного размаха: Me [Q25; Q75]; дискретные — при помощи абсолютных и относительных частот. Вычисление главных компонент проводилось для центрированных и нормированных данных. Различия между двумя независимыми выборками для уровней экспрессии оценивали критерием Стьюдента, для остальных непрерывных параметров — критерием Манна-Уитни, для дискретных — точным критерием Фишера. Различия между тремя независимыми выборками для непрерывных параметров оценивали критерием Краскела-Уоллиса, для дискретных — точным критерием Фишера. Поправка на множественные сравнения на уровне различных микроРНК не проводилась, т.к. уровни экспрессии микроРНК ассоциированы между собой — две главные компоненты объясняют 78% дисперсии. Поправку на множественные сравнения для 4-х сравнений подвыборок между собой провели методом Холма-Бонферрони. Различия считались статистически значимыми при p<0,05.
Результаты
В исследование были включены пациенты, составившие 3 группы: с ХОКА с хорошим (n=13) и плохим (n=10) КК, а также группа контроля, включающая пациентов без значимого стенозирования коронарных артерий (n=20). Клиническая характеристика выборки представлена в таблице 2. Размер выборки — 43 участника, доля мужчин в выборке — 65%, медиана возраста — 63 года.
Оценка гемолиза образцов плазмы проводилась с помощью кПЦР для всех образцов, включенных в исследование, по разнице в пороговом числе циклов двух микроРНК (hsa-miR-23a-3p и hsa-miR-451a). Согласно исследованию, использовавшему те же микроРНК того же производителя для оценки гемолиза, образцы с ΔCq (hsa-miR-23a-3p и hsa-miR-451a) >14 должны были бы быть исключены из анализа из-за возможного влияния гемолиза на уровни микроРНК в плазме [23]. В результате проведенного анализа было показано, что все образцы плазмы имели значение ΔCq ниже порогового значения и находились в диапазоне от 5,3 до 10,4.
hsa-miR-210-5p была обнаружена только в 26% образцов (n=11) и поэтому исключена из дальнейшего анализа. По частоте выявления hsa-miR-210-5p группы не различалась (p=0,153). Анализ главных компонент на основе 9 микроРНК свидетельствует об однородности полученных данных (рисунок 1).
Статистически значимых различий в уровне экспрессии исследуемых микроРНК между группами ХОКА с хорошим и плохим КК, а также между группой ХОКА с плохим КК и группой контроля выявлено не было. Возможно, это вызвано "промежуточным" положением группы с плохим КК и, как следствие, недостаточным размером эффекта. Поэтому в дальнейшем анализе группы с ХОКА
были объединены. Анализ экспрессии 8 микро-РНК между объединенной группой пациентов с ХОКА и группой контроля, а также между груп-
пой ХОКА с хорошим КК и группой контроля представлен в таблице 3. Достоверные различия в уровнях экспрессии 5 микроРНК (hsa-miR-126-5p, hsa-miR-155-5p, hsa-miR-15b-5p, hsa-miR-23a-3p, hsa-miR-451a) были выявлены между объединенной группой случая и группой контроля и 7 микроРНК (hsa-miR-126-5p, hsa-miR-146a-5p, hsa-miR-155-5p, hsa-miR-15b-5p, hsa-miR-21-5p, hsa-miR-23a-3p, hsa-miR-451a) между группой ХОКА с хорошим КК и группой контроля. Ни в одной из групп сравнения не было выявлено достоверных различий в уровне экспрессии микроРНК hsa-miR-503-5p. Направление изменения уровня экспрессии 6 микроРНК (hsa-miR-126-5p, hsa-miR-146a-5p, hsa-miR-155-5p, hsa-miR-15b-5p, hsa-miR-21-5p, hsa-miR-23a-3p), по которым имелись достоверные различия, было в сторону уменьшения экспрессии, для hsa-miR-451a — в сторону увеличения.
На рисунке 2 представлены относительные уровни изучаемых микроРНК в плазме крови представителей исследуемых групп.
Помимо анализа экспрессии микроРНК был проведен анализ ассоциаций с другими клиническими показателями, такими как хроническая сердечная недостаточность, фибрилляция предсердий, постинфарктный кардиосклероз. Значимых ассоциаций выявлено не было.
Таблица 2
Характеристика выборки
Показатель | ХОКА с хорошим КК | ХОКА с плохим КК | Контрольная группа | p |
Мужской пол, n (%) | 9/13 (69,2%) | 9/10 (90,0%) | 10/20 (50,0%) | 0,091 |
Возраст, лет, Ме [Q25; 75] | 64,0 [ 56,0; 74,0] | 62,5 [ 54,5; 69,8] | 62,5 [ 58,8; 69,2] | 0,51 |
ИМТ, кг/м2, Ме [Q25; 75] | 28,5 [ 25,0; 30,0] | 31,2 [ 28,6; 31,8] | 28,1 [ 24,2; 30,6] | 0,38 |
Курение, n (%) | 3/13 (23,1%) | 5/10 (50,0%) | 5/20 (25,0%) | 0,33 |
Семейная наследственность по ССЗ, n (%) | 9/13 (69,2%) | 3/10 (30,0%) | 9/20 (45,0%) | 0,17 |
Хроническая сердечная недостаточность, n (%) | 5/13 (38,5%) | 7/10 (70,0%) | 6/20 (30,0%) | 0,13 |
Стенокардия, n (%) | 13/13 (100%) | 10/10 (100%) | 14/20 (70,0%) | 0,028 |
Фибрилляция предсердий, n (%) | 4/13 (30,8%) | 1/10 (10,0%) | 2/20 (10,0%) | 0,28 |
Нарушение ритма сердца, n (%) | 3/13 (23,1%) | 3/10 (30,0%) | 10/20 (50,0%) | 0,31 |
ХОБЛ-БА, n (%) | 0/13 (0%) | 1/10 (10,0%) | 3/20 (15,0%) | 0,34 |
Артериальная гипертония, n (%) | 11/13 (84,6%) | 10/10 (100%) | 17/20 (85,0%) | 0,58 |
Постинфарктный кардиосклероз, n (%) | 7/13 (53,8%) | 8/10 (80,0%) | 2/20 (10,0%) | <0,001 |
Мультифокальный атеросклероз, n (%) | 7/13 (53,8%) | 5/10 (50,0%) | 8/20 (40,0%) | 0,73 |
Сахарный диабет, n (%) | 0/13 (0%) | 0/10 (0%) | 2/20 (10,0%) | 0,49 |
Хроническая болезнь почек, n (%) | 3/13 (23,1%) | 2/10 (20,0%) | 2/20 (10,0%) | 0,57 |
Прием статинов, n (%) | 13/13 (100%) | 10/10 (100%) | 8/13 (61,5%) | 0,007 |
Общий ХС, ммоль/л, Ме [Q25; 75] | 5,2 [ 3,8; 5,4] | 3,9 [ 3,2; 4,6] | 4,6 [ 3,4; 4,9] | 0,24 |
ХС ЛНП, ммоль/л, Ме [Q25; 75] | 2,5 [ 2,2; 3,5] | 2,5 [ 1,6; 3,2] | 2,4 [ 1,6; 3,0] | 0,52 |
ХС ЛВП, ммоль/л, Ме [Q25; 75] | 1,1 [ 0,9; 1,3] | 1,0 [ 0,8; 1,1] | 1,3 [ 1,2; 1,4] | 0,11 |
Триглицериды, ммоль/л, Ме [Q25; 75] | 1,1 [ 1,0; 1,5] | 1,5 [ 1,2; 1,9] | 1,1 [ 0,9; 1,7] | 0,27 |
Примечание: ИМТ — индекс массы тела, КК — коллатеральное кровообращение, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ССЗ — сердечно-сосудистые заболевания, ХОБЛ-БА — хронический обструктивный бронхит, эмфизема легких, бронхиальная астма тяжелого течения, ХОКА — хроническая окклюзия коронарной артерии, ХС — холестерин, Ме — медиана, Q — квартиль.
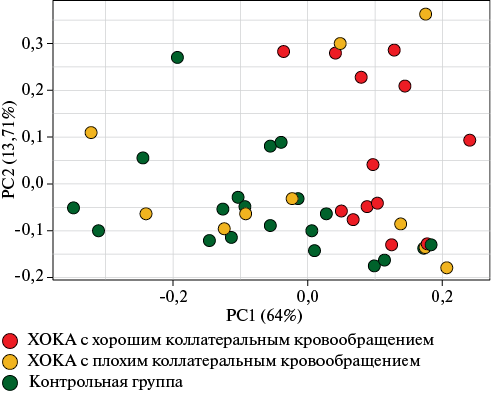
Рис. 1 Анализ с помощью методов главных компонентов экспрессии изучаемых микроРНК.
Примечание: PC — главная компонента, ХОКА — хроническая окклюзия коронарной артерии.
Таблица 3
Сравнение уровней экспрессии исследуемых микроРНК между группами
МикроРНК | Отношение экспрессий в группе ХОКА с хорошим КК к группе контроля | p значение для сравнения группы ХОКА с хорошим КК и группы контроля | Отношение экспрессий в общей группе с ХОКА к группе контроля | p значение для сравнения общей группы пациентов с ХОКА и группы контроля | Направление изменения уровня экспрессии по сравнению с группой контроля |
hsa-miR-126-5p | 0,3726 | <0,001*# | 0,48 | 0,003*# | снижение |
hsa-miR-146a-5p | 0,5397 | 0,016* | 0,73 | 0,08 | снижение |
hsa-miR-155-5p | 0,4056 | 0,003*# | 0,73 | 0,026* | снижение |
hsa-miR-15b-5p | 0,5331 | 0,001*# | 0,70 | 0,018* | снижение |
hsa-miR-21-5p | 0,4907 | 0,024* | 0,62 | 0,12 | снижение |
hsa-miR-23a-3p | 0,3247 | <0,001*# | 0,48 | 0,002*# | снижение |
hsa-miR-451a | 1,2337 | 0,002*# | 1,18 | 0,017* | увеличение |
hsa-miR-503-5p | 0,7818 | 0,21 | 1,08 | 0,80 | – |
Примечание: * — статистически значимые различия, # — статистически значимые различия с учетом поправки на множественные сравнения, РНК — рибонуклеиновая кислота, КК — коллатеральное кровообращение, ХОКА — хроническая окклюзия коронарной артерии.
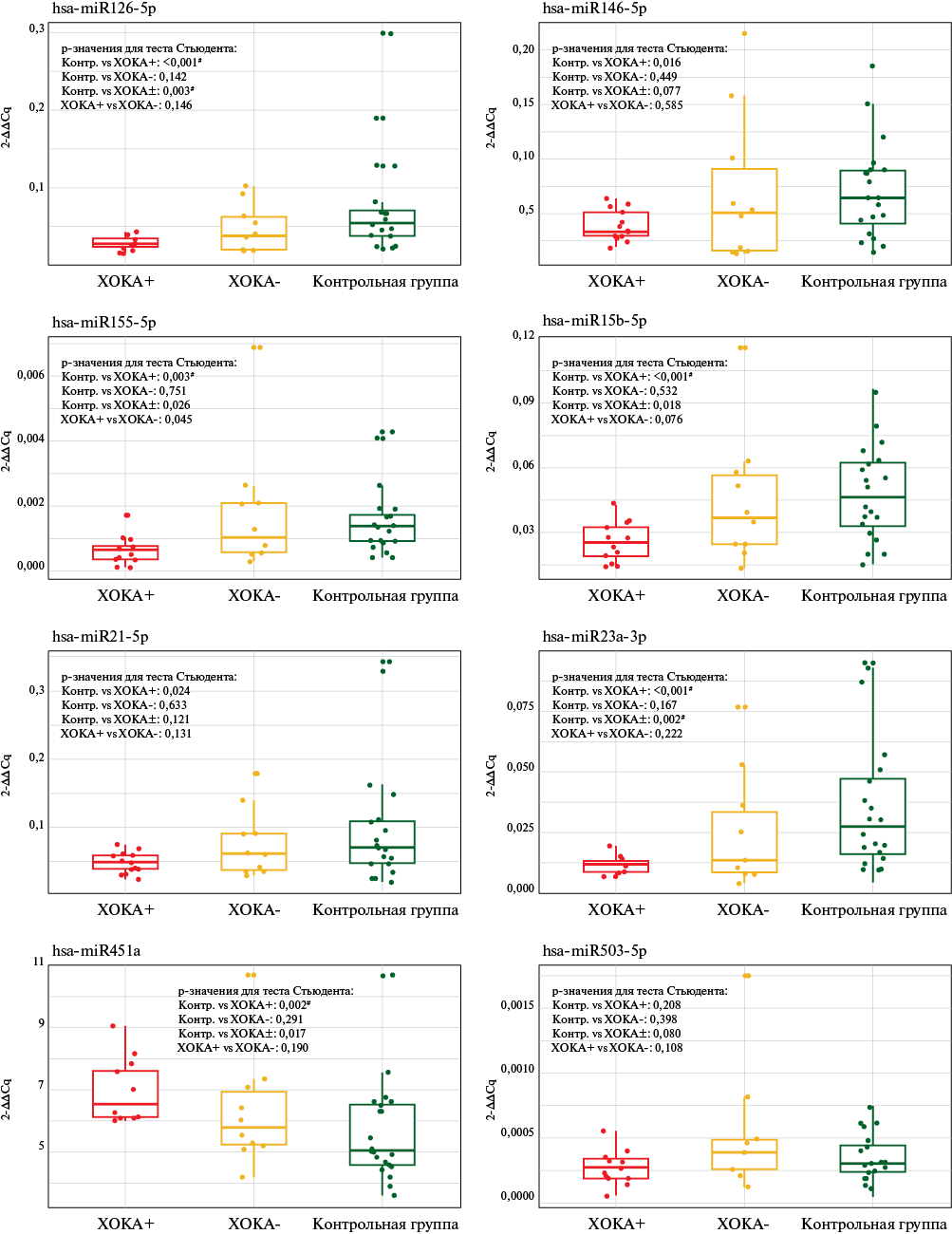
Рис. 2 Сравнение экспрессии hsa-miR-126-5p, hsa-miR-146a-5p, hsa-miR-155-5p, hsa-miR-15b-5p, hsa-miR-21-5p, hsa-miR-23a-3p, hsa-miR-451a, hsa-miR-503-5p у пациентов с ХОКА и группой контроля.
Примечание: + — хорошее коронарное коллатеральное кровообращение, - — плохое коронарное коллатеральное кровообращение, # — статистически значимые различия с учетом поправки на множественные сравнения, ХОКА — хроническая окклюзия коронарной артерии, Cq — cycle of quantification (пороговый цикл).
Обсуждение
В рамках проведенного исследования были выявлены достоверные различия в уровне экспрессии 5 микроРНК между объединенной группой пациентов с ХОКА и группой контроля, а также 7 микроРНК между группой пациентов с ХОКА с хорошим КК и группой контроля. Отсутствие различий между группой с ХОКА с плохим КК и группой контроля может объясняться небольшим размером реального эффекта. Для его детекции понадобится группа большего размера, чем в текущем исследовании. Небольшой размер выборки и список анализируемых микроРНК, как и отсутствие валидации на другой независимой выборке являются ограничениями данного исследования.
Для 6 микроРНК (hsa-miR-126-5p, hsa-miR-146a-5p, hsa-miR-155-5p, hsa-miR-15b-5p, hsa-miR-21-5p, hsa-miR-23a-3p) наблюдалось снижение экспрессии, для одной микроРНК hsa-miR-451a — повышение в группе пациентов с хорошим КК по сравнению с группой контроля (таблица 3). Эти данные носят противоречивый характер, подтверждая [3][11] либо не подтверждая [2][3][5][22] данные предыдущих исследований на пациентах с ХОКА. В большинстве случаев полученные различия могут быть объяснены разными методиками категоризации КК, выделения и определения уровней микроРНК, а также с различными формами изучаемых микроРНК.
Для 4 микроРНК ранее были показаны ассоциации уровня экспрессии со степенью развития коллатеральных артерий у пациентов с ХОКА (hsa-miR-146a-5p, hsa-miR-126-5p, hsa-miR-15b-5p, hsa-miR-155-5p), но для 3 микроРНК (hsa-miR-23a-3p, hsa-miR-21-5p, hsa-miR-451a), таких публикаций нет. В настоящей работе у пациентов с ХОКА по сравнению с лицами без значимого стенозирования коронарных артерий была выявлена сниженная экспрессия для 6 микроРНК и повышенная для одной микроРНК.
Несмотря на клиническую важность изучения новых путей и инструментов для профилактики и лечения ИБС, а также растущее количество исследований микроРНК, полученные на сегодняшний день доказательства все еще недостаточны для того, чтобы сделать однозначные выводы об использовании изученных в настоящей работе микроРНК в клинической практике. В большинстве исследований по данной теме отсутствует стандартизация в выборе контрольной выборки, времени отбора проб, источника циркулирующих микроРНК, протокола выделения, внутреннего и эндогенного контроля, методов количественного определения микроРНК, и параметров нормализации микроРНК [9][28][29]. Кроме того, большое влияние на статистическую мощность и обобщаемость полученных результатов оказывают небольшие размеры выборок и отсутствие валидации на другой независимой выборке, а также различия в исходных характеристиках когорт, влияющих на уровень экспрессии микроРНК, таких как, возраст, пол, сопутствующие заболевания, фармакологическая терапия [9][28]. Это дополнительно подтверждается тем фактом, что одна и та же микроРНК оказывает разное действие по данным разных исследований [9][28]. Таким образом, только более крупные многоцентровые исследования, основанные на различных популяциях пациентов и с использованием стандартизированных процедур обработки образцов и выделения РНК, дадут нам информацию о том, будут ли микроРНК успешными в качестве биомаркеров ИБС [9].
hsa-miR-146a-5p. МикроРНК miR-146a участвует в регуляции развития различных воспалительных заболеваний, включая атеросклероз [30, 31]. Хотя сообщалось о повышенном уровне экспрессии miR-146a у пациентов с ИБС [32-34], атеросклерозом [35][36], ОКС [37], ряд исследований подтверждают снижение уровня экспрессии miR-146a при более тяжелых формах атеросклероза, включая коронарный атеросклероз, связанный с плохим КК [5], ОКС по сравнению со стабильной ИБС [38] и мультифокальный атеросклероз [39].
В работе Wang J, et al. [5] было показано, что микроРНК hsa-miR-146a-5p в плазме может быть потенциальным биомаркером плохого КК у пациентов с ИБС [5]. Было выявлено, что уровни экспрессии hsa-miR-146a-5p в плазме были значительно ниже в группе с плохим КК (n=44) и значительно выше в группе с хорошим КК (n=34) по сравнению с таковым в контрольной группе, включающей здоровых участников без ИБС (n=34) [5]. Несмотря на похожий дизайн исследования, эти данные не согласуются с нашими результатами, в которых сниженная экспрессия этой микроРНК была выявлена как в общей группе ХОКА, так и в группе с ХОКА с хорошим КК, а достоверных различий в группе с ХОКА с плохим КК выявлено не было.
hsa-miR-126-5p. Одной из ключевых микроРНК, регулирующих ангиогенез, является miR-126 [40], играющая важную роль в неоваскуляризации и стабилизации кровеносных сосудов [40]. В ряде исследований было показано, что уровень экспрессии miR-126 значительно снижен у пациентов с ИБС [41-43], однако в других работах была продемонстрирована повышенная экспрессия miR-126 у пациентов с ИБС [44][45].
Экспрессия hsa-miR-126-3p в плазме была выше в группе пациентов с плохим КК (n=20) по сравнению с группой с хорошим КК (n=18) [3]. Был показан статистически значимо повышенный уровень miR-126 плазмы у пациентов с недостаточным развитием коллатеральной сети (n=27), по сравнению с пациентами с высокой пропускной способностью коронарных коллатеральных артерий (n=14), а также повышенный уровень экспрессии miR126 у пациентов с ХОКА по сравнению со здоровыми людьми (n=19) [2]. В другом исследовании уровень miR-126 в плазме был значительно ниже у пациентов с ИБС (n=120), чем у здоровых контролей (n=30), а также значительно выше в группе с хорошим КК (n=64), чем в группе с плохим КК (n=56) [11]. В настоящем исследовании экспрессия hsa-miR-126-5p у пациентов с ХОКА по сравнению со здоровыми людьми была снижена.
hsa-miR-15b-5p. miR-15b-5p является ключевым регулятором артериогенеза и ангиогенеза [3]. Согласно данным литературы, уровень экспрессии miR-15b-5p у пациентов с ИБС снижен [46][47].
В одном из исследований было показано, что уровень циркулирующей hsa-miR-15b-5p существенно снижен у пациентов с ИБС с хорошим КК и подходит для различия пациентов с хорошо и плохо развитым КК [3]. Более высокая экспрессия hsa-miR-15b-5p наблюдалась в плазме пациентов с плохим КК (n=20) по сравнению с пациентами с хорошим КК (n=18), в то же время экспрессия hsa-miR-15b-5p в плазме как при хорошем, так и при плохом КК была значимо снижена по сравнению с таковой у здоровых людей из контрольной группы (n=18) [3]. Результаты, полученные в этом исследовании, несмотря на разную методологию определения уровня экспрессии изучаемой микроРНК, согласуются с данными нашего исследованием, где также была выявлена сниженная экспрессия hsa-miR-15b-5p в группе пациентов с ХОКА по сравнению с группой здоровых пациентов.
hsa-miR-155-5p. miR-155 выполняет множество функций, включая роль в дифференцировке гемопоэтических клеток, формировании иммунитета, ремоделировании сосудов и регуляции путей передачи воспалительных сигналов [48]. В исследованиях на пациентах с ИБС была выявлена сниженная экспрессия miR-155 по сравнению со здоровыми [42][49][50].
Уровень miR-155 в плазме был в 11,5 и 1,8 раза выше у пациентов с плохим КК (n=44) и хорошим КК (n=34), соответственно, по сравнению с контрольной группой (n=34) [22]. Уровни miR-155 в группе с плохим КК значимо отличались от таковых в группе контроля и у пациентов с хорошим КК. Однако по уровню miR-155 в плазме группы хорошего КК и контроля существенно не различались [22]. Эти результаты отличаются от полученных в нашем исследовании, где экспрессия hsa-miR-155-5p была снижена у пациентов с ХОКА по сравнению со здоровыми людьми. Полученные различия могут объясняться разными методиками категоризации КК, выявления микроРНК и различными формами изучаемой микроРНК.
hsa-miR-23a-3p, hsa-miR-21-5p, hsa-miR-451a. В настоящем исследовании впервые показана сниженная экспрессия hsa-miR-23a-3p, hsa-miR-21-5p и повышенная hsa-miR-451a у пациентов с ХОКА по сравнению с лицами без значимого стенозирования коронарных артерий. Согласно ранее опубликованным данным, сниженная экспрессия miR-23a была выявлена у пациентов с ИБС по сравнению со здоровыми [12]. В образцах плазмы крови пациентов с ИБС сообщалось как о повышенных [12][34][44], так и о сниженных [51] уровнях циркулирующей miR-21. Повышенный уровень miR-451 был выявлен в плазме пациентов c ИБС и с нестабильной стенокардией по сравнению с людьми с несердечной болью в груди [44].
Заключение
В рамках настоящего исследования у пациентов с ХОКА с хорошим КК была идентифицирована сниженная экспрессия 6-и циркулирующих микроРНК и повышенная для одной по сравнению с контрольной группой. Впервые было показано, что уровень 2 циркулирующих микро-
РНК (hsa-miR-23a-3p, hsa-miR-21-5p) существенно снижен, а уровень hsa-miR-451a увеличен у пациентов с ИБС с хорошим КК. В данной работе не было выявлено циркулирующих микроРНК для различия пациентов с хорошо и плохо развитым КК.
Таким образом, поскольку возможность определять емкость коронарной коллатеральной артерии у пациентов без необходимости инвазивной катетеризации имеет большое клиническое значение, полученные результаты требуют дальнейшего исследования на более крупных когортах пациентов с ХОКА, а также изучения прогностической силы (клинической диагностической ценности) этих микроРНК у пациентов с ИБС.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Li Y, Xue J-Y, Chen S, et al. LncRNA PVT1 is a novel mediator promoting the angiogenesis response associated with collateral artery formation. Int J Biochem Cell Biol. 2022;151:106294. doi:10.1016/j.biocel.2022.106294.
2. Hakimzadeh N, Nossent AY, van der Laan AM, et al. Circulating MicroRNAs Characterizing Patients with Insufficient Coronary Collateral Artery Function. PLoS One. 2015;10:e0137035. doi:10.1371/journal.pone.0137035.
3. Zhu L-P, Zhou J-P, Zhang J-X, et al. MiR-15b-5p Regulates Collateral Artery Formation by Targeting AKT3 (Protein Kinase B-3). Arterioscler Thromb Vasc Biol. 2017;37:957-68. doi:10.1161/ATVBAHA.116.308905.
4. Elsman P, van ’t Hof AWJ, de Boer MJ, et al. Role of collateral circulation in the acute phase of ST-segment-elevation myocardial infarction treated with primary coronary intervention. Eur Heart J. 2004;25:854-8. doi:10.1016/j.ehj.2004.03.005.
5. Wang J, Yan Y, Song D, et al. Reduced Plasma miR-146a Is a Predictor of Poor Coronary Collateral Circulation in Patients with Coronary Artery Disease. Biomed Res Int. 2016;2016:4285942. doi:10.1155/2016/4285942.
6. Schirmer SH, Fledderus JO, Bot PTG, et al. Interferon-beta signaling is enhanced in patients with insufficient coronary collateral artery development and inhibits arteriogenesis in mice. Circ Res. 2008;102:1286-94. doi:10.1161/CIRCRESAHA.108.171827.
7. Fazmin IT, Achercouk Z, Edling CE, et al. Circulating microRNA as a Biomarker for Coronary Artery Disease. Biomolecules. 2020;10. doi:10.3390/biom10101354.
8. Hans FP, Moser M, Bode C, et al. MicroRNA regulation of angiogenesis and arteriogenesis. Trends Cardiovasc Med. 2010; 20:253-62. doi:10.1016/j.tcm.2011.12.001.
9. Bergami M, Fabin N, Cenko E, et al. MicroRNAs as Potential Biomarkers in Coronary Artery Disease. Curr Top Med Chem. 2023; 23:454-69. doi:10.2174/1568026623666221221124530.
10. Fei Y, Hou J, Xuan W, et al. The relationship of plasma miR-503 and coronary collateral circulation in patients with coronary artery disease. Life Sci. 2018;207:145-51. doi:10.1016/j.lfs.2018.06.001.
11. Nie X, Su L, Zhou Y, et al. Association between plasma levels of microRNA-126 and coronary collaterals in patients with coronary artery disease. Zhonghua Xin Xue Guan Bing Za Zhi. 2014;42:561-5.
12. Han H, Qu G, Han C, et al. MiR-34a, miR-21 and miR-23a as potential biomarkers for coronary artery disease: a pilot microarray study and confirmation in a 32 patient cohort. Exp Mol Med. 2015;47:e138. doi:10.1038/emm.2014.81.
13. Zhou Q, Gallagher R, Ufret-Vincenty R, et al. Regulation of angiogenesis and choroidal neovascularization by members of microRNA-23~27~24 clusters. Proc Natl Acad Sci USA. 2011;108:8287-92. doi:10.1073/pnas.1105254108.
14. Ferguson SW, Wang J, Lee CJ, et al. The microRNA regulatory landscape of MSC-derived exosomes: a systems view. Sci Rep. 2018;8:1419. doi:10.1038/s41598-018-19581-x.
15. Kura B, Kalocayova B, Devaux Y, et al. Potential Clinical Implications of miR-1 and miR-21 in Heart Disease and Cardioprotection. Int J Mol Sci. 2020;21. doi:10.3390/ijms21030700.
16. Chang W-T, Lin Y-W, Huang P-S, et al. Deletion of MicroRNA-21 Impairs Neovascularization Following Limb Ischemia: From Bedside to Bench. Front Cardiovasc Med. 2022;9:826478. doi:10.3389/fcvm.2022.826478.
17. Liu J, Wang Y, Akamatsu Y, et al. Vascular remodeling after ischemic stroke: mechanisms and therapeutic potentials. Prog Neurobiol. 2014;115:138-56. doi:10.1016/j.pneurobio.2013.11.004.
18. Wu F, Yang Z, Li G. Role of specific microRNAs for endothelial function and angiogenesis. Biochem Biophys Res Commun. 2009;386:549-53. doi:10.1016/j.bbrc.2009.06.075.
19. Rentrop KP, Cohen M, Blanke H, et al. Changes in collateral channel filling immediately after controlled coronary artery occlusion by an angioplasty balloon in human subjects. J Am Coll Cardiol. 1985;5:587-92. doi:10.1016/s0735-1097(85)80380-6.
20. Khoo V, Shen L, Zhao L, et al. Determination of the severity of underlying lesions in acute myocardial infarction on the basis of collateral vessel development. Coron Artery Dis. 2014;25:493-7. doi:10.1097/MCA.0000000000000115.
21. Копылова О. В., Ершова А. И., Покровская М. С. и др. Популяционно-нозологический исследовательский биобанк "НМИЦ ТПМ": анализ коллекций биообразцов, принципы сбора и хранения информации. Кардиоваскулярная терапия и профилактика. 2021;20(8):3119. doi:10.15829/1728-8800-2021-3119.
22. Wang J, Yan Y, Song D, et al. The association of plasma miR-155 and VCAM-1 levels with coronary collateral circulation. Biomark Med. 2017;11:125-31. doi:10.2217/bmm-2016-0282.
23. Zhelankin AV, Vasiliev SV, Stonogina DA, et al. Elevated Plasma Levels of Circulating Extracellular miR-320a-3p in Patients with Paroxysmal Atrial Fibrillation. Int J Mol Sci. 2020;21. doi:10.3390/ijms21103485.
24. Li S, Lee C, Song J, et al. Circulating microRNAs as potential biomarkers for coronary plaque rupture. Oncotarget. 2017;8:48145-56. doi:10.18632/oncotarget.18308.
25. Wong LM, Phoon LQ, Wei LK. Epigenetics Modifications in Large-Artery Atherosclerosis: A Systematic Review. J Stroke Cerebrovasc Dis. 2021;30:106033. doi:10.1016/j.jstrokecerebrovasdis.2021.106033.
26. Blondal T, Jensby Nielsen S, Baker A, et al. Assessing sample and miRNA profile quality in serum and plasma or other biofluids. Methods. 2013;59:S1-6. doi:10.1016/j.ymeth.2012.09.015.
27. Livak KJ, Schmittgen TD. Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2−ΔΔCT Method. Methods. 2001;25:402-8. doi:10.1006/meth.2001.1262.
28. Nik Mohamed Kamal NNSB, Shahidan WNS. Non-Exosomal and Exosomal Circulatory MicroRNAs: Which Are More Valid as Biomarkers? Front Pharmacol. 2019;10:1500. doi:10.3389/fphar.2019.01500.
29. de Gonzalo-Calvo D, Pérez-Boza J, Curado J, et al. Challenges of microRNA-based biomarkers in clinical application for cardiovascular diseases. Clin Transl Med. 2022;12:e585. doi:10.1002/ctm2.585.
30. Li J, Li K, Chen X. Inflammation-regulatory microRNAs: Valuable targets for intracranial atherosclerosis. J Neurosci Res. 2019;97: 1242-52. doi:10.1002/jnr.24487.
31. Chu T, Xu X, Ruan Z, et al. miR-146a contributes to atherosclerotic plaque stability by regulating the expression of TRAF6 and IRAK-1. Mol Biol Rep. 2022;49:4205-16. doi:10.1007/s11033-022-07253-z.
32. Xiong X-D, Cho M, Cai X-P, et al. A common variant in pre-miR-146 is associated with coronary artery disease risk and its mature miRNA expression. Mutat Res. 2014;761:15-20. doi:10.1016/j.mrfmmm.2014.01.001.
33. Chang T-Y, Tsai W-C, Huang T-S, et al. Dysregulation of endothelial colony-forming cell function by a negative feedback loop of circulating miR-146a and -146b in cardiovascular disease patients. PLoS One. 2017;12:e0181562. doi:10.1371/journal.pone.0181562.
34. Ghafouri-Fard S, Gholipour M, Taheri M. Role of MicroRNAs in the Pathogenesis of Coronary Artery Disease. Front Cardiovasc Med. 2021;8:632392. doi:10.3389/fcvm.2021.632392.
35. Huang S-F, Zhao G, Peng X-F, et al. The Pathogenic Role of Long Non-coding RNA H19 in Atherosclerosis via the miR-146a-5p/ANGPTL4 Pathway. Front Cardiovasc Med. 2021;8:770163. doi:10.3389/fcvm.2021.770163.
36. Gao W, Li R, Yu J, et al. LncRNA SCIRT is downregulated in atherosclerosis and suppresses the proliferation of human aortic smooth muscle cells (HAOSMCs) by sponging miR-146a in cytoplasm. J Cardiothorac Surg. 2021;16:324. doi:10.1186/s13019-021-01700-x.
37. Zhelankin AV, Stonogina DA, Vasiliev SV, et al. Circulating Extracellular miRNA Analysis in Patients with Stable CAD and Acute Coronary Syndromes. Biomolecules. 2021;11. doi:10.3390/biom11070962.
38. Rizzacasa B, Morini E, Mango R, et al. MiR-423 is differentially expressed in patients with stable and unstable coronary artery disease: A pilot study. PLoS One. 2019;14:e0216363. doi:10.1371/journal.pone.0216363.
39. Pereira-da-Silva T, Napoleão P, Costa MC, et al. Circulating miRNAs Are Associated with the Systemic Extent of Atherosclerosis: Novel Observations for miR-27b and miR-146. Diagnostics (Basel). 2021;11. doi:10.3390/diagnostics11020318.
40. Wang S, Aurora AB, Johnson BA, et al. The endothelial-specific microRNA miR-126 governs vascular integrity and angiogenesis. Dev Cell. 2008;15:261-71. doi:10.1016/j.devcel.2008.07.002.
41. Zampetaki A, Kiechl S, Drozdov I, et al. Plasma microRNA profiling reveals loss of endothelial miR-126 and other microRNAs in type 2 diabetes. Circ Res. 2010;107:810-17. doi:10.1161/CIRCRESAHA.110.226357.
42. Fichtlscherer S, De Rosa S, Fox H, et al. Circulating microRNAs in patients with coronary artery disease. Circ Res. 2010;107:677-84. doi:10.1161/CIRCRESAHA.109.215566.
43. Wang X, Lian Y, Wen X, et al. Expression of miR-126 and its potential function in coronary artery disease. Afr Health Sci. 2017;17:474-80. doi:10.4314/ahs.v17i2.22.
44. Ren J, Zhang J, Xu N, et al. Signature of circulating microRNAs as potential biomarkers in vulnerable coronary artery disease. PLoS One. 2013;8:e80738. doi:10.1371/journal.pone.0080738.
45. Xue S, Liu D, Zhu W, et al. Circulating MiR-17-5p, MiR-126-5p and MiR-145-3p Are Novel Biomarkers for Diagnosis of Acute Myocardial Infarction. Front Physiol. 2019;10:123. doi:10.3389/fphys.2019.00123.
46. Su M, Niu Y, Dang Q, et al. Circulating microRNA profiles based on direct S-Poly(T)Plus assay for detection of coronary heart disease. J Cell Mol Med. 2020;24:5984-97. doi:10.1111/jcmm.15001.
47. Zhu Y, Yang T, Duan J, et al. MALAT1/miR-15b-5p/MAPK1 mediates endothelial progenitor cells autophagy and affects coronary atherosclerotic heart disease via mTOR signaling pathway. Aging. 2019;11:1089-109. doi:10.18632/aging.101766.
48. Knoka E, Trusinskis K, Mazule M, et al. Circulating plasma microRNA-126, microRNA-145, and microRNA-155 and their association with atherosclerotic plaque characteristics. Transl Res. 2020;5:60-7. doi:10.18053/jctres.05.201902.002.
49. Weber M, Baker MB, Patel RS, et al. MicroRNA Expression Profile in CAD Patients and the Impact of ACEI/ARB. Cardiol Res Pract. 2011;2011:532915. doi:10.4061/2011/532915.
50. Faccini J, Ruidavets J-B, Cordelier P, et al. Circulating miR-155, miR-145 and let-7c as diagnostic biomarkers of the coronary artery disease. Sci Rep. 2017;7:42916. doi:10.1038/srep42916.
51. Huică I, Iancu I, Botezatu A, et al. Circulating miR-21 and TGF-b1 expression levels in patients with cardiovascular diseases. Transl Res. 2015;20:132. doi:10.21614/JTMR-20-3-44.
Об авторах
А. В. КиселеваРоссия
Киселева Анна Витальевна — к.б.н., в.н.с., руководитель лаборатории молекулярной генетики Института персонализированной терапии и профилактики.
Москва
Д. К. Васильев
Россия
Васильев Дмитрий Константинович — к.м.н., руководитель отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний.
Москва
А. Г. Сопленкова
Россия
Сопленкова Анна Глебовна — лаборант лаборатории биостатистики отдела эпидемиологии хронических неинфекционных заболеваний.
Москва
Ф. Б. Шукуров
Россия
Шукуров Фирдавс Баходурович — к.м.н., руководитель лаборатории интервенционной радиологии отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний.
Москва
Е. А. Сотникова
Россия
Сотникова Евгения Андреевна — с.н.с. лаборатории молекулярной генетики Института персонализированной терапии и профилактики.
Москва
Д. А. Фещенко
Россия
Фещенко Дарья Анатольевна — н.с. отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний.
Москва
В. А. Куценко
Россия
Куценко Владимир Александрович — к.ф.-м.н., с.н.с. лаборатории биостатистики отдела эпидемиологии хронических неинфекционных заболеваний.
Москва
Н. А. Араблинский
Россия
Араблинский Никита Александрович — м.н.с. отдела инновационных эндоваскулярных методов профилактики и лечения сердечно-сосудистых заболеваний.
Москва
О. П. Скирко
Россия
Скирко Ольга Петровна — м.н.с. лаборатории молекулярной генетики Института персонализированной терапии и профилактики.
Москва
А. А. Жарикова
Россия
Жарикова Анастасия Александровна — к.б.н., в.н.с. лаборатории молекулярной генетики Института персонализированной терапии и профилактики, старший преподаватель факультета биоинженерии и биоинформатики.
Москва
А. И. Ершова
Россия
Ершова Александра Игоревна — д.м.н., руководитель лаборатории клиномики, зам. директора по фундаментальной науке.
Москва
М. С. Покровская
Россия
Покровская Мария Сергеевна — к.б.н., в.н.с. лаборатории "Банк биологического материала" Института персонализированной терапии и профилактики.
Москва
А. Н. Мешков
Россия
Мешков Алексей Николаевич — д.м.н., руководитель Института персонализированной терапии и профилактики.
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — д.м.н., профессор, академик РАН, директор.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Коронарное коллатеральное кровообращение формируется за зоной хронической окклюзии коронарной артерии и играет жизненно важную роль в поддержании функционирования сердца.
- МикроРНК играют важную роль в регуляции различных аспектов сосудистой биологии, включая ангиогенез.
Что добавляют результаты исследования?
- МикроРНК плазмы крови, для которых в настоящем исследовании были получены статистически значимые различия, могут быть использованы для дальнейших исследований на вы-
борке большего размера как кандидаты в биомаркеры для оценки выраженности коллатерального кровообращения при наличии хронической окклюзии коронарной артерии.
Рецензия
Для цитирования:
Киселева А.В., Васильев Д.К., Сопленкова А.Г., Шукуров Ф.Б., Сотникова Е.А., Фещенко Д.А., Куценко В.А., Араблинский Н.А., Скирко О.П., Жарикова А.А., Ершова А.И., Покровская М.С., Мешков А.Н., Драпкина О.М. Ассоциация уровней микроРНК плазмы крови с различной выраженностью коллатерального кровообращения при хронической окклюзии коронарной артерии у пациентов с ишемической болезнью сердца: пилотное исследование. Кардиоваскулярная терапия и профилактика. 2024;23(7):4086. https://doi.org/10.15829/1728-8800-2024-4086. EDN: WZQZCK
For citation:
Kiseleva A.V., Vasilyev D.K., Soplenkova A.G., Shukurov F.B., Sotnikova E.A., Feshchenko D.A., Kutsenko V.A., Arablinsky N.A., Skirko O.P., Zharikova A.A., Ershova A.I., Pokrovskaya M.S., Meshkov A.N., Drapkina O.M. Association of plasma microRNA levels with different collateral circulation degree in chronic total occlusion patients with coronary artery disease: a pilot study. Cardiovascular Therapy and Prevention. 2024;23(7):4086. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4086. EDN: WZQZCK
JATS XML

























































