Перейти к:
Клиническое наблюдение раннего развития ишемической болезни сердца у пациента с комбинированным лечением лимфогранулематоза в анамнезе
https://doi.org/10.15829/1728-8800-2025-4104
EDN: VSLCLW
Аннотация
Введение. Онкологические заболевания занимают одну из лидирующих позиций в перечне наиболее распространенных причин смерти в мире. Широкое использование в клинической практике химио-, таргетной, иммунной и лучевой терапии повысило выживаемость онкологических больных. Однако при этом значительно выросло количество кардиотоксических осложнений противоопухолевой терапии, которые могут проявляться спустя много лет после наступления ремиссии онкозаболевания.
Краткое описание. Представлен клинический случай раннего развития ишемической болезни сердца (ИБС) у 40-летнего пациента М., которому в связи с лимфогранулематозом в 22 года была проведена полихимиотерапия в сочетании с лучевой терапией на медиастинальные лимфатические узлы. В 2021г на фоне стрессовой ситуации больной впервые отметил появление жжения за грудиной, которое купировалось спонтанно, и повышение артериального давления до 145/90 мм рт.ст. После обращения к кардиологу было проведено клинико-инструментальное обследование (электрокардиография и эхокардиография в покое), но патологии не обнаружено, медикаментозное лечение не назначалось. В течение 3-х последующих лет периодически отмечались кратковременные сжимающие боли за грудиной, возникающие при быстрой ходьбе, которые купировались при остановке. В апреле 2024г пациент был госпитализирован в кардиологическое отделение Университетской клиники НОИ клинической медицины им. Н. А. Семашко Российского университета медицины для проведения углубленного кардиологического обследования. В процессе анализа жалоб и анамнестических данных, клинико-инструментального и лабораторного обследования у него была диагностирована ИБС, стенокардия напряжения III функционального класса, которая была расценена как позднее проявление кардиотоксичности химиотерапии в сочетании с лучевой терапией на область средостения, проведенной в 22-летнем возрасте по поводу лимфогранулематоза. Пациенту была проведена селективная коронарография, выявлено наличие множественных стенозов коронарных артерий. Для проведения реваскуляризации миокарда пациент был направлен в ГКБ им. И. В. Давыдовского Департамента здравоохранения Москвы, где ему было установлено 4 стента с лекарственным напылением. Динамическое наблюдение за состоянием сердечно-сосудистой системы у пациента М. не проводилось. При обращении к кардиологу с типичными для коронарной недостаточности жалобами ИБС не была диагностирована.
Заключение. Представленный клинический случай иллюстрирует затруднения, возникающие у врачей при диагностике поздних проявлений кардиотоксичности в виде ускоренного развития ИБС. Необходимо проведение дополнительных образовательных мероприятий и внедрение современных технологических продуктов для повышения эффективности первичной профилактики, диагностики и лечения кардиотоксичности противоопухолевой терапии.
Ключевые слова
Для цитирования:
Васюк Ю.А., Шупенина Е.Ю., Выжигин Д.А., Манчуров В.Н., Скрыпник Д.В., Костин А.В., Щербак М.М. Клиническое наблюдение раннего развития ишемической болезни сердца у пациента с комбинированным лечением лимфогранулематоза в анамнезе. Кардиоваскулярная терапия и профилактика. 2025;24(2):4104. https://doi.org/10.15829/1728-8800-2025-4104. EDN: VSLCLW
For citation:
Vasyuk Yu.A., Shupenina E.Yu., Vyzhigin D.A., Manchurov V.N., Skrypnik D.V., Kostin A.V., Shcherbak M.M. Premature coronary artery disease in a patient with a history of combined treatment for lymphogranulomatosis: a case report. Cardiovascular Therapy and Prevention. 2025;24(2):4104. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4104. EDN: VSLCLW
Введение
Онкологические заболевания занимают одну из лидирующих позиций в перечне наиболее распространенных причин смерти в мире, большее количество летальных исходов вызывает только сердечно-сосудистая патология [1][2].
Активное использование в клинической практике разнообразных методов противоопухолевого лечения: химио- таргетной, иммунной, лучевой терапии позволило повысить выживаемость онкологических больных. Однако при этом значительно выросло количество кардиотоксических осложнений противоопухолевой терапии, которые могут проявляться спустя много лет после наступления ремиссии злокачественного новообразования [3].
Проведенное противоопухолевое лечение, особенно лучевая терапия, способствует ускоренному развитию сердечно-сосудистых заболеваний, в т.ч. ишемической болезни сердца (ИБС) [4]. Такие пациенты при наличии высокого и очень высокого риска кардиотоксичности, даже после выздоровления или стойкой ремиссии онкозаболевания, должны находиться под наблюдением кардиолога.
Клинический случай
Информация о пациенте. В апреле 2024г на кафедру госпитальной терапии № 1 Научно-образовательного института клинической медицины им. Н. А. Семашко Российского университета медицины обратился пациент М. 40 лет, проживающий в Подмосковье, для проведения углубленного кардиологического обследования с жалобами на общую слабость, чувство сдавления, жжения за грудиной, с иррадиацией в левую руку и шею, возникающее при физических нагрузках, быстрой ходьбе до 200 м, купирующееся в покое в течение 5-10 мин.
Из анамнестических данных стало известно, что пациенту в 2005-2006гг проводилось лечение по поводу лимфогранулематоза. Заболевание манифестировало в ноябре 2005г в виде регулярного повышения температуры до 38,5 ºС, увеличения шейных лимфатических узлов (таблица 1). Амбулаторно была назначена антибактериальная терапия с краткосрочным положительным эффектом. В декабре 2005г состояние снова ухудшилось, рецидивировала лимфаденопатия. После выполнения биопсии шейных узлов диагностирован лимфогранулематоз III Bb+ ст., смешанно-клеточный вариант. С февраля по октябрь 2006г получал комбинированное лечение: 4 курса полихимиотерапии по схеме ABVD (Доксорубицин 50 мг внутривенно (в/в), капельно, 1, 14 дни, Дакарбазин 700 мг, в/в, капельно, 1, 14 дни, Винбластин 10 мг в/в струйно, Блеомицитин 20 мг в/в струйно), дистанционная гамма-терапия на подмышечные, медиастинальные лимфатические узлы (суммарная очаговая доза, СОД =30 грей), на надключичные лимфатические узлы (СОД =44 грей), достигнута устойчивая ремиссия. Постоянно лекарственные препараты не принимает.
Таблица 1
Временнáя шкала
|
Декабрь 2005г |
Диагностирован лимфогранулематоз IIIBb+ стадии, смешанно-клеточный вариант |
|
Февраль-октябрь 2006г |
Комбинированное лечение лимфогранулематоза: 4 курса полихимиотерапии по схеме ABVD (Доксорубицин 50 мг в/в капельно, 1, 14 дни, Дакарбазин 700 мг в/в капельно, 1, 14 дни, Винбластин 10 мг в/в струйно, Блеомицитин 20 мг в/в струйно), дистанционная гамма-терапия на подмышечные, медиастинальные лимфатические узлы (СОД =30 грей), на надключичные лимфатические узлы (СОД =44 грей) с достижением устойчивой ремиссии |
|
Март 2021г |
Впервые появились ангинозные боли, обращение к кардиологу, лечение не назначено |
|
Март 2024г |
Прогрессирование ангинозных болей, обследование у гастроэнтреролога, по данным гастроэзофагодуоденоскопии выявлен эрозивный рефлюкс-эзофагит, хронический поверхностный гастрит, недостаточность кардии, проведен курс антисекреторной терапии без существенного эффекта |
|
Апрель 2024г |
Выполнен нагрузочный тредмил-тест, диагностирована ИБС: стенокардия напряжения, III функциональный класс |
|
Май 2024г |
Выполнена селективная КАГ, выявлено множественное стенотическое поражение коронарных артерий |
|
Июнь 2024г |
Проведено ЧКВ под контролем внутрисосудистой визуализации |
Примечание: в/в — внутривенно, ИБС — ишемическая болезнь сердца, КАГ — коронароангиография, СОД — суммарная очаговая доза, ЧКВ — чрескожное коронарное вмешательство, ABVD — доксорубицин, дакарбазин, винбластин, блеомицитин (20 мг в/в струйно).
В марте 2021г пациент М. впервые на фоне стрессовой ситуации отметил появление жжения за грудиной, эпизодическое повышение артериального давления (АД) до 145/90 мм рт.ст. Обратился в частную клинику, было проведено клинико-инструментальное обследование (электрокардиограмма (ЭКГ) и эхокардиография (ЭхоКГ) в покое), патологических отклонений не обнаружено. В последующем загрудинные боли беспокоили периодически, с постепенным снижением толерантности к физическим нагрузкам. В марте 2024г отметил ухудшение состояния, ангинозные боли стали возникать при быстрой ходьбе. Обратился в частную клинику к гастроэнтерологу. Выполнена гастроэзофагодуоденоскопия, при этом выявлен эрозивный рефлюкс-эзофагит, хронический поверхностный гастрит, недостаточность кардии. Проведен курс антисекреторной терапии без существенного эффекта.
При осмотре. Состояние удовлетворительное. Кожные покровы бледно-розовые. Частота дыхательных движений 17/мин, насыщение кислородом (SpO2) 99% на атмосферном воздухе. Дыхание везикулярное, хрипов нет, перкуторный звук ясный, легочный. АД 119/72 мм рт.ст., частота сердечных сокращений (ЧСС) 66 уд./мин. На языке налет белого цвета. Размеры живота не увеличены. Живот участвует в акте дыхания, при пальпации мягкий, безболезненный. Стул без патологических изменений. Печень не выступает из-под края реберной дуги.
С учетом характера описываемых жалоб, в амбулаторном порядке был проведен ряд диагностических исследований.
Биохимический анализ крови: уровень общего холестерина (ХС) 5,24 ммоль/л, ХС липопротеинов высокой плотности 0,98 ммоль/л, ХС липопротеинов низкой плотности 2,91 ммоль/л, триглицеридов 1,23 ммоль/л.
ЭКГ в покое (рисунок 1): без патологических изменений.
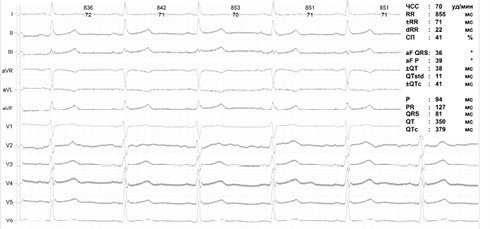
Рис. 1 Электрокардиограмма в покое пациента М., 40 лет.
Примечание: ЧСС — частота сердечных сокращений.
ЭхоКГ исследование: Полости сердца не увеличены. Глобальная систолическая функция левого желудочка (ЛЖ) в норме: фракция выброса ЛЖ (метод mod. Simpson biplane) =59%, его глобальная продольная систолическая деформация (рисунок 2) на нижней границе нормы (глобальная продольная деформация ЛЖ =-18,4%).
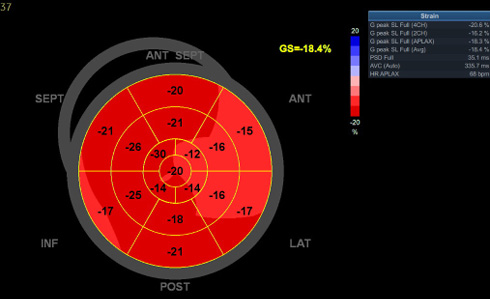
Рис. 2 Полярная диаграмма глобальной продольной систолической деформации ЛЖ пациента М., 40 лет.
Примечание: ЛЖ — левый желудочек. Цветное изображение доступно в электронной версии журнала.
12-канальное суточное мониторирование ЭКГ (рисунок 3): Зарегистрирован 1 эпизод косонисходящей депрессии сегмента ST в отведениях II, III, aVF, V3-V6 продолжительностью 10 мин, максимально до 3,1 мм, согласно дневнику, пациент в это время совершал прогулку быстрым шагом, при этом отмечалась боль в груди, одышка.
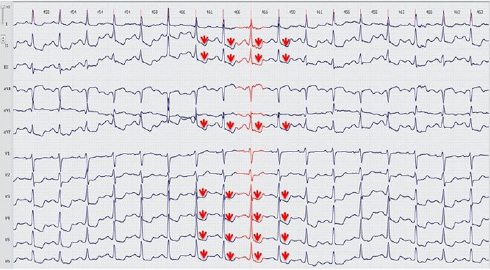
Рис. 3 Эпизод косонисходящей депрессии сегмента ST во время проведения 12-канального суточного мониторирования ЭКГ у пациента М., 40 лет.
Примечание: ЭКГ — электрокардиограмма. Цветное изображение доступно в электронной версии журнала.
Суточное мониторирование АД (рисунок 4): зарегистрирована пограничная диастолическая артериальная гипертензия в ночные часы.
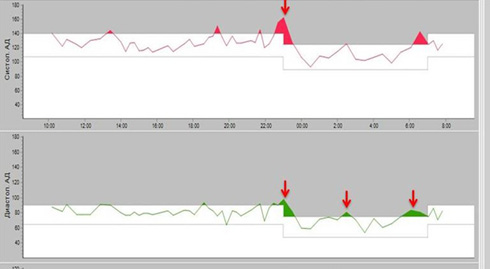
Рис. 4 Показатели нагрузки давлением во время проведения СМАД у пациента М., 40 лет.
Примечание: СМАД — суточное мониторирование артериального давления. Цветное изображение доступно в электронной версии журнала.
Ультразвуковое исследование брахиоцефальных артерий (рисунок 5): Ультразвуковые признаки стенозирующего атеросклероза брахиоцефальных артерий: гемодинамически незначимый стеноз подключичной артерии справа (до 26%), общей сонной артерии в области бифурации слева (до 30%).

Рис. 5 Атеросклеротическая бляшка в просвете правой подключичной артерии (26%), полуциркулярная атеросклеротическая бляшка в просвете бифуркации левой каротидной артерии (30%).
Тредмил-тест (рисунок 6): Проба прекращена в связи с возникновением и нарастанием давящих болей за грудиной (4/4 Borg), сопровождающихся горизонтальной депрессией сегмента ST до 2,1 мм продолжительностью >0,08 сек в V4-V6. Достигнутая ЧСС 127 уд./мин (70% от макс. ЧСС). Проба положительная. Толерантность к нагрузке низкая (4,6 МЕТS). Оценка прогноза: индекс Duke — 14 (высокий риск сердечно-сосудистых осложнений — ССО).
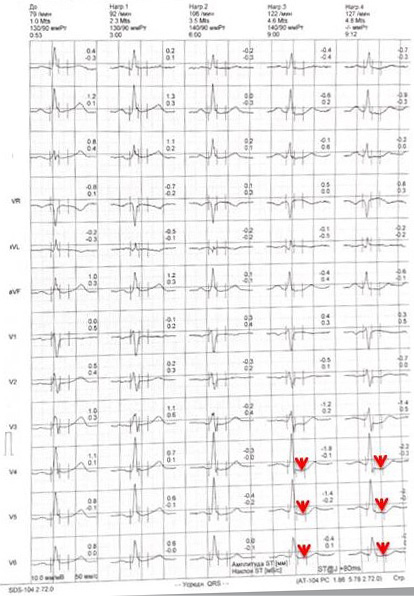
Рис. 6 Горизонтальная депрессия сегмента ST до 2,1 мм в отведениях V4-V6 на фоне физической нагрузки.
Примечание: цветное изображение доступно в электронной версии журнала.
Согласно результатам лабораторно-инструментальных исследований, у пациента М. были выявлены признаки дислипидемии, которая является значимым фактором риска ишемической болезни сердца (ИБС). Обнаруженный при выполнении 12-канального суточного мониторирования ЭКГ эпизод косонисходящей депрессии сегмента ST в сочетании с умеренной, несмотря на молодой возраст, предтестовой вероятностью ИБС (рисунок 7), явился основанием для проведения тредмил-теста. Положительная проба с дозированной физической нагрузкой позволила сформулировать клинический диагноз:
Основное заболевание: ИБС: стенокардия III функционального класса.
Фоновые заболевания: гипертоническая болезнь III стадии, 1 ст., риск ССО 4 (очень высокий), дислипидемия, атеросклероз брахиоцефальных артерий.
Сопутствующие заболевания: лимфогранулематоз III Bb+ ст., смешанно-клеточный вариант, комбинированное лечение: 4 курса полихимиотерапии по схеме ABVD (Доксорубицин, Дакарбазин, Винбластин, Блеомицитин), дистанционная гамма-терапия на подмышечные, надключичные, медиастинальные лимфоузлы, ремиссия. Гастроэзофагеальная рефлюксная болезнь, ремиссия. Недостаточность кардии. Хронический гастрит, ремиссия.
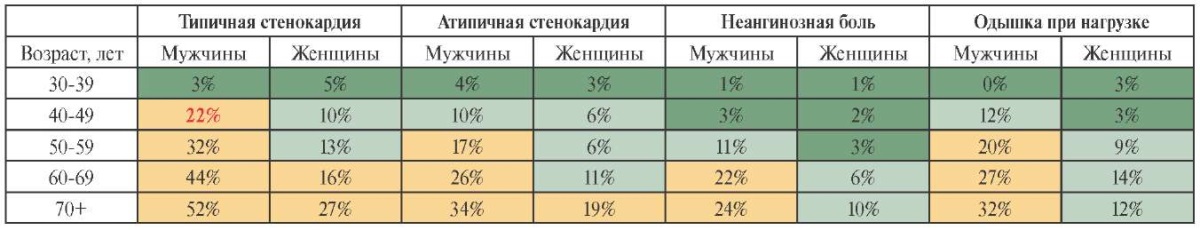
Рис. 7 Предтестовая вероятность ИБС у пациента М.
Примечание: ИБС — ишемическая болезнь сердца. Цветное изображение доступно в электронной версии журнала.
Пациенту назначена консервативная терапия (таблица 2), без существенного эффекта.
Таблица 2
Консервативная терапия, проводимая пациенту М.
|
Назначенная терапия |
Принимаемые препараты |
Режим приема |
|
Антиишемическая терапия |
Бисопролол 2,5 мг |
1 раз/сут., утром, после еды, перорально (с последующей титрацией дозы до достижения целевых уровней ЧСС и АД) |
|
Антигипертензивная терапия |
Периндоприл 2 мг |
1 раз/сут., утром, после еды, перорально (с последующей титрацией дозы до достижения целевых уровней АД) |
|
Антиагрегантная терапия |
Ацетилсалициловая кислота 75 мг |
1 раз/сут., вечером, после еды, перорально |
|
Гиполипидемическая терапия |
Аторвастатин 10 мг |
1 раз/сут., вечером, перед сном, перорально (с последующей титрацией дозы до достижения целевого уровня ХС ЛНП) |
|
Гастропротективная терапия |
Пантопразол 20 мг |
1 раз/сут., за 30 мин. до еды, утром, перорально |
|
Симптоматическая терапия |
При проявлении загрудинных болей стенокардитического характера — нитроглицерин спрей |
Одно распыление (1 доза, 0,4 мг) подъязычно |
Примечание: АД — артериальное давление, ХС ЛНП — холестерин липопротеинов низкой плотности, ЧСС — частота сердечных сокращений.
Медицинские вмешательства
В мае 2024г пациент был госпитализирован в кардиологическое отделение Университетской клиники Научно-образовательного института клинической медицины им. Н. А. Семашко Российского университета медицины для выполнения селективной коронароангиографии; при этом исследовании было выявлено множественное стенотическое поражение коронарных артерий, включая окклюзии в среднем отделе передней межжелудочковой артерии (ПМЖА) и в проксимальной трети ветви тупого края огибающей артерии и 70-80% стенозы в проксимальных отделах ветвей левой коронарной артерии (рисунок 8). Показатель Syntax Score составил 41,5 балла. Пациент был обсужден в рамках междисциплинарного консилиума в Университетской клинике кардиологии Российского университета медицины на базе ГБУЗ "ГКБ им. И. В. Давыдовского" Департамента здравоохранения Москвы. Учитывая наличие признаков постлучевого фиброза органов грудной клетки, принято решение о проведении реваскуляризации эндоваскулярными методами. В июне 2024г пациенту была проведено чрескожное коронарное вмешательство под контролем внутрисосудистой визуализации в объеме бифуркационного стентирования огибающей артерии и ветви тупого края по методике Double-kissing mini-crush, стентирования зоны окклюзии в среднем отделе ПМЖА и провизорного бифуркационного стентирования проксимального отдела ПМЖА и ствола левой коронарной артерии. Был достигнут хороший ангиографический результат, подтвержденный данными контрольного внутрисосудистого ультразвукового исследования (рисунок 9).
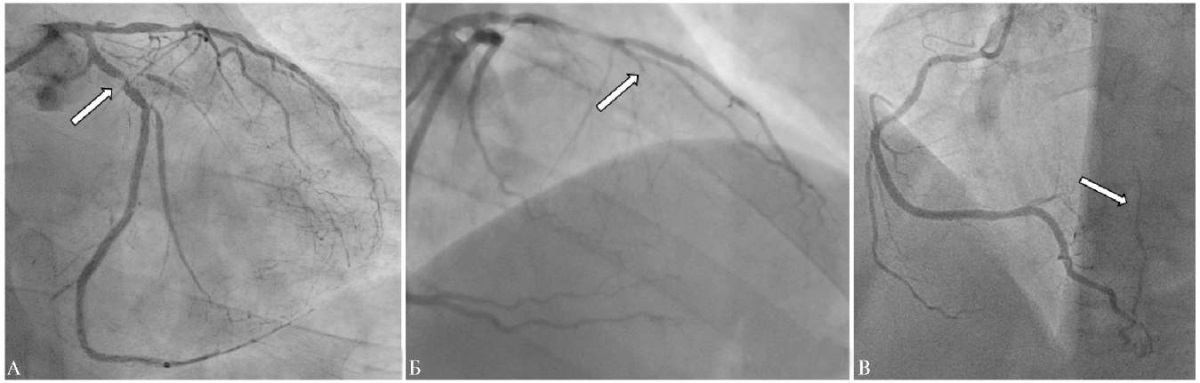
Рис. 8 Коронарная ангиограмма пациента М., демонстрирующая бифуркационный стеноз в проксимальном отделе ОА с вовлечением устья ветви тупого края (панель А — левая КА, зона стеноза в ОА помечена стрелкой), окклюзию ПМЖА (панель Б — левая КА, окклюзия ПМЖА помечена стрелкой) и выраженную эпикардиальную коллатераль из правой КА в бассейн ПМЖА (панель В — правая КА, коллатераль помечена стрелкой).
Примечание: КА — коронарная артерия, ОА — огибающая артерия, ПМЖА — передняя межжелудочковая артерия.
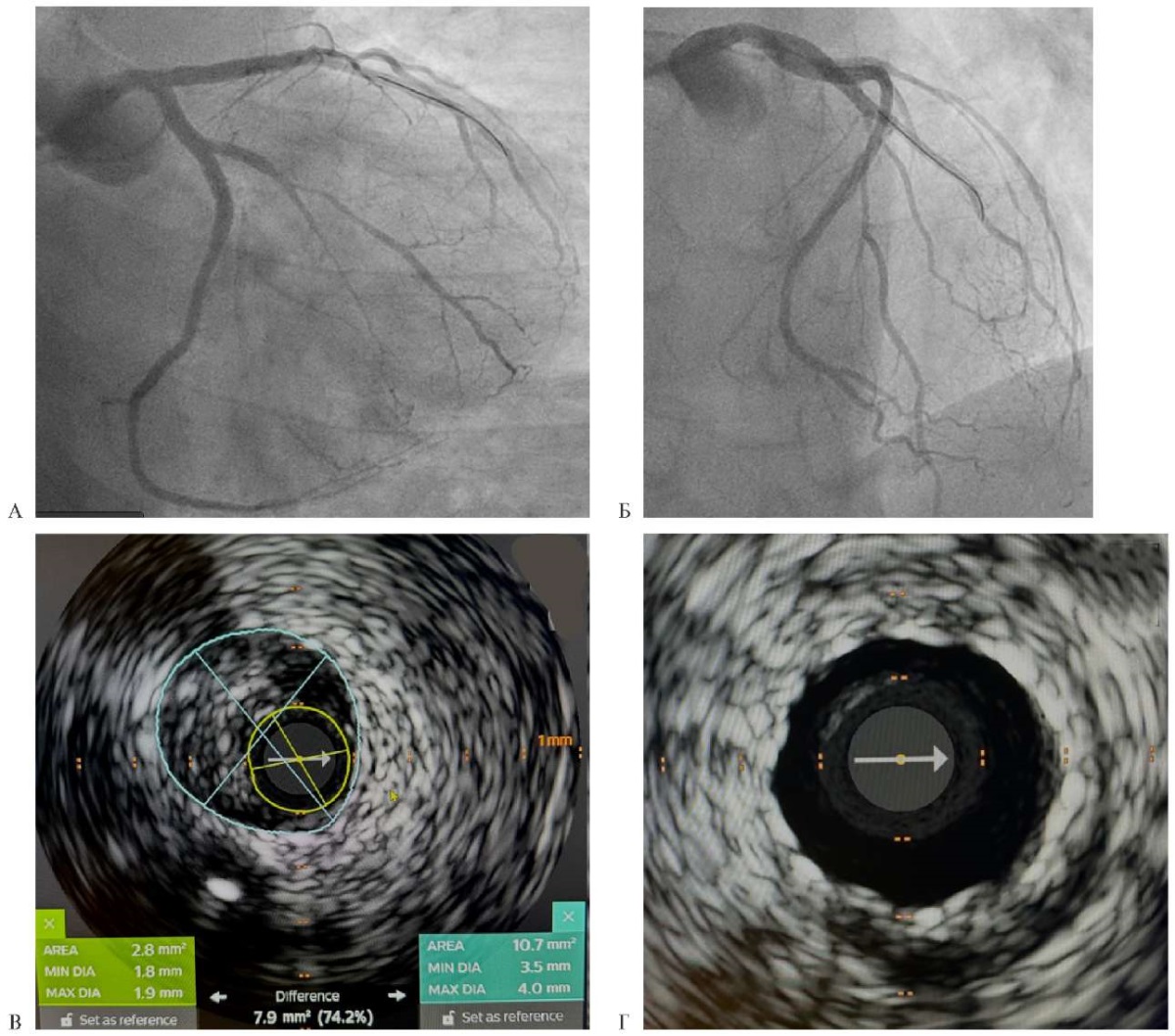
Рис. 9 Панели А и Б — ангигорафический результат стентирования ОА, ветви тупого края, ПМЖА и ствола левой КА; панели В и Г — данные внутрисосудистого ультразвукового исследования демонстрируют 74,2% стеноз в проксимальном отделе ПМЖА с выраженным фиброзным компонентом (В) и тот же сегмент ПМЖА после стентирования (Г).
Примечание: КА — коронарная артерия, ОА — огибающая артерия, ПМЖА — передняя межжелудочковая артерия. Цветное изображение доступно в электронной версии журнала.
После проведения чрескожного коронарного вмешательства ангинозные боли не рецидивировали, госпитальный период протекал без осложнений. К терапии был добавлен тикагрелор в дозе 90 мг 2 раза/сут. Пациент выписан из стационара на 4-й день в удовлетворительном состоянии.
Обсуждение
Согласно эпидемиологическим данным, стабильная стенокардия выявляется у 4-7% мужчин в возрасте 45-64 лет [5]. Однако ранняя манифестация ИБС в молодом возрасте может быть результатом облучения области средостения во время проведения лучевой терапии, а также химиотерапии антрациклинами, что также усиливает поражающее влияние лучевой терапии на миокард [6-8]. Представленный клинический случай служит типичным примером позднего развития кардиотоксичности.
Обращает на себя внимание, что после завершения противоопухолевого лечения пациент М. соответствовал группе высокого риска кардиотоксичности, как по шкале клиники Mayo [9], так и по шкале АСК-МОК (Ассоциации сердечной недостаточности — Международного общества кардиоонкологии), подробно рассматриваемой в европейских клинических рекомендациях по кардиоонкологии [2]. Пациентам, закончившим лечение по поводу онкологического заболевания, с высоким риском кардиотоксичности, необходима ежегодная оценка сердечно-сосудистого риска, регистрация ЭКГ и определение уровня натрийуретических пептидов. Также необходимо проведение ЭхоКГ исследования с периодичностью 1 раз/2 года [10]. Однако пациенту не проводился регулярный мониторинг сердечно-сосудистой системы с целью выявления ранних, доклинических проявлений кардиотоксичности проведенной противоопухолевой терапии, что объясняется отсутствием в тот момент соответствующих рекомендаций по кардиоонкологии. Пациент через несколько лет после завершения химио- и лучевой терапии стал отмечать ангинозные боли, обращался за медицинской помощью, но заболевание не было своевременно диагностировано, что указывает на недостаточный уровень знаний о потенциальных ССО противоопухолевого лечения. Эффективность оценки риска кардиотоксических осложнений может быть повышена при внедрении разработанных специализированных приложений для персонального компьютера или смартфона, облегчающих определение риска кардиотоксичности, уменьшающих временные затраты на необходимые расчеты и вероятность врачебной ошибки при выборе метода и тактики лечения онкобольных1.
Заключение
Представленное клиническое наблюдение иллюстрирует затруднения, возникающие у терапевтов и кардиологов при диагностике поздних проявлений кардиотоксичности в виде ускоренного развития ИБС в молодом возрасте. Необходимо проведение дополнительных образовательных мероприятий и внедрение современных технологических продуктов для повышения эффективности первичной медикаментозной профилактики, диагностики и лечения кардиотоксичности противоопухолевой терапии.
Информированное согласие. От пациента получено письменное добровольное информированное согласие на публикацию результатов обследования и лечения.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Свидетельство о государственной регистрации программы для ЭВМ № 2023687737. "РКВТХ-калькулятор: заявл.: 01.12.2023: опубл. 18.12.2023. Муслов С. А., Выжигин Д. А., Васюк Ю. А., Шупенина Е. Ю. [и др.]; правообладатели: Васюк Ю. А., Завьялова А. И., Шупенина Е. Ю., Выжигин Д. А., Муслов С. А. [и др.]. Свидетельство о государственной регистрации программы для ЭВМ № 2024613769. Андроид-калькулятор риска кардио- и вазотоксичности химиотерапии онкологических больных для мобильных устройств "АРКВТХ-2.0": заявлено: 06.02.2024: опубликовано 15.02.2024 года/Васюк Ю. А., Муслов С. А., Шупенина Е. Ю., Завьялова А. И., Выжигин Д. А.; правообладатель ФГБОУ ВО "Российский университет медицины" Минздрава России.
Список литературы
1. Под ред. Каприна А. Д., Старинского В. В., Шахзадовой А. О. Состояние онкологической помощи населению России в 2021 году М.: МНИОИ им. П. А. Герцена — филиал ФГБУ "НМИЦ радиологии" Минздрава России, 2022. илл.с. 239. ISBN: 978-5-85502-275-9.
2. Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS): Developed by the task force on cardio-oncology of the European Society of Cardiology (ESC). Eur Heart J. 2022;23(10):e333-465. doi:10.1093/ehjci/jeac106.
3. Cardinale D, Zaninotto M, Cipolla CM, et al. Cardiotoxic effects and myocardial injury: the search for a more precise definition of drug cardiotoxicity. Clin Chem Lab Med. 2020;59(1):51-7. doi:10.1515/cclm-2020-0566.
4. Mitchell JD, Cehic DA, Morgia M, et al. Cardiovascular manifestations from therapeutic radiation: a multidisciplinary expert consensus statement from the International Cardio-Oncology Society. JACC CardioOncology. 2021;3(3):360-80. doi:10.1016/j.jaccao.2021.06.003.
5. Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4076. doi:10.15829/1560-4071-2020-4076.
6. Lyon AR, Dent S, Stanway S, et al. Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies: a position statement and new risk assessment tools from the Cardio-Oncology Study Group of the Heart Failure Association of the European Society. Eur J Heart Fail. 2020;22:1945-60. doi:10.1002/ejhf.1920.
7. Виценя М. В., Агеев Ф. Т., Гиляров М. Ю. и др. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии. Злокачественные опухоли. 2021; 11(3s2-2):78-98. doi:18027/2224-5057-2021-11-3s2-41.
8. Васюк Ю. А., Ющук Е. Н., Несветов В. В. Кардиоонкология: новый вызов нашего времени. Сердечно-сосудистые осложнения противоопухолевого лечения. М.: Клинмедконсалтинг; 2019. c. 100. ISBN: 978-5-904148-04-1.
9. Herrmann J, Lerman A, Sandhu NP, et al. Evaluation and management of patients with heart disease and cancer: cardio-oncology. Mayo Clin Proc. 2014;89(9):1287-306. doi:10.1016/j.mayocp. 2014.05.013.
10. Васюк Ю. А., Гендлин Г. Е., Емелина Е. И. и др. Согласованное мнение российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Российский кардиологический журнал. 2021;26(9):4703. doi:10.15829/1560-4071-2021-4703.
Об авторах
Ю. А. ВасюкРоссия
д.м.н., профессор, заведующий кафедрой госпитальной терапии № 1
Москва
Е. Ю. Шупенина
Россия
к.м.н., доцент, профессор кафедры госпитальной терапии № 1
Москва
Д. А. Выжигин
Россия
ассистент кафедры госпитальной терапии № 1
Москва
В. Н. Манчуров
Россия
к.м.н., доцент, кафедра кардиологии; зав. отделением рентгенохирургических методов диагностики и лечения
Москва
Д. В. Скрыпник
Россия
д.м.н., зав. кафедрой кардиологии; зав. отделением, главный внештатный специалист ДЗМ по рентгенэндоваскулярным методам диагностики и лечения
Москва
А. В. Костин
Россия
ассистент кафедры кардиологии;, врач по рентгенэндоваскулярным методам диагностики и лечения, врач по рентгенэндоваскулярным методам диагностики и лечения
Москва
М. М. Щербак
Россия
к.м.н., доцент, кафедра клинической функциональной диагностики
Москва
- Цель публикации — описание клинического случая раннего развития ишемической болезни сердца у 40-летнего пациента после полихимио- и лучевой терапии на медиастинальные лимфатические узлы, проведенной в юношеском возрасте в связи с лимфогранулематозом.
- Развившаяся у больного ишемической болезнью сердца, стабильная стенокардия III функционального класса была расценена как позднее проявление кардиотоксичности.
- Представленный клинический случай иллюстрирует затруднения, возникающие у врачей при диагностике поздних проявлений кардиотоксичности.
Рецензия
Для цитирования:
Васюк Ю.А., Шупенина Е.Ю., Выжигин Д.А., Манчуров В.Н., Скрыпник Д.В., Костин А.В., Щербак М.М. Клиническое наблюдение раннего развития ишемической болезни сердца у пациента с комбинированным лечением лимфогранулематоза в анамнезе. Кардиоваскулярная терапия и профилактика. 2025;24(2):4104. https://doi.org/10.15829/1728-8800-2025-4104. EDN: VSLCLW
For citation:
Vasyuk Yu.A., Shupenina E.Yu., Vyzhigin D.A., Manchurov V.N., Skrypnik D.V., Kostin A.V., Shcherbak M.M. Premature coronary artery disease in a patient with a history of combined treatment for lymphogranulomatosis: a case report. Cardiovascular Therapy and Prevention. 2025;24(2):4104. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4104. EDN: VSLCLW
JATS XML

























































