Перейти к:
Модуляция сердечной сократимости у пациентов с хронической сердечной недостаточностью со сниженной фракцией выброса: метаанализ данных российских клинических исследований
https://doi.org/10.15829/1728-8800-2025-4191
EDN: BONOUT
Аннотация
Цель. При проведении метаанализа данных российских клинических исследований изучить ассоциации модуляции сердечной сократимости у пациентов с хронической сердечной недостаточностью со сниженной фракцией выброса (ФВ) левого желудочка (ЛЖ).
Материал и методы. В метаанализе в качестве исхода были выбраны баллы по опроснику MLWHFQ (Minnesota Living With Heart Failure Questionnaire); результаты теста 6-минутной ходьбы (ТШХ); наличие улучшения функционального класса хронической сердечной недостаточности; данные эхокардиографии: ФВ ЛЖ; конечносистолический и конечно-диастолические объёмы ЛЖ; а также показатели выживаемости на сроках 12 и 24 мес.
Результаты. Результаты статей; включенных в метаанализ; показали значительное улучшение дистанции; пройденной при проведении ТШХ (n=216) (средняя разница -38;19; 95% доверительный интервал (ДИ): от -65;46 до -10;91 м; p=0;006); показателя MLWHFQ (средняя разница 7;28; 95% ДИ: 2;87-11;69; р=0;001); прироста ФВ ЛЖ (средняя разница -4;02; 95% ДИ: от -5;83 до 2;20; р<0;0001) и улучшение объемных параметров ЛЖ (значение конечно-диастолического объема ЛЖ — средняя разница 19;99; 95% ДИ: 7;56-32;42; р=0;002; и конечно-систолического объема ЛЖ: средняя разница 22;68; 95% ДИ: 12;85-32;51; р<0;001 через 24 мес. в группе модуляции сердечной сократимости по сравнению с группой контроля. Выживаемость оценивалась через 12 и 24 мес. наблюдения в группах наблюдения; различия были статистически незначимы.
Заключение. Результаты данных 3 российских клинических нерандомизированных исследований; включенных в метаанализ; позволяют предположить; что модуляция сердечной сократимости ассоциирована со значимым улучшением качества жизни; дистанции; пройденной при выполнении ТШХ; и обратным ремоделированием миокарда ЛЖ.
Ключевые слова
Для цитирования:
Сафиуллина А.А., Ускач Т.М., Сапельников О.В., Михайлов Е.Н., Артюхина Е.А., Лебедев Д.С., Ситникова М.Ю., Образцов И.В., Амирасланов А.Ю., Лясникова Е.А., Трукшина М.А., Галенко В.Л., Аманатова В.А., Гришин И.Р., Черкашин Д.И., Акчурин Р.С., Терещенко С.Н. Модуляция сердечной сократимости у пациентов с хронической сердечной недостаточностью со сниженной фракцией выброса: метаанализ данных российских клинических исследований. Кардиоваскулярная терапия и профилактика. 2025;24(3):4191. https://doi.org/10.15829/1728-8800-2025-4191. EDN: BONOUT
For citation:
Safiullina A.A., Uskach T.M., Sapelnikov O.V., Mikhailov E.N., Artyukhina E.A., Lebedev D.S., Sitnikova M.Yu., Obraztsov I.V., Amiraslanov A.Yu., Lyasnikova A.E., Trukshina M.A., Galenko V.L., Amanatova V.A., Grishin I.R., Cherkashin D.I., Akchurin R.S., Tereshchenko S.N. Cardiac contractility modulation in patients with heart failure with reduced ejection fraction: a meta-analysis of Russian clinical trials. Cardiovascular Therapy and Prevention. 2025;24(3):4191. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4191. EDN: BONOUT
Введение
Несмотря на достижения в области фармакологических, хирургических и интервенционных стратегий лечения, сердечная недостаточность остается серьезной проблемой и тяжелым бременем для системы здравоохранения в России и во всем мире [1]. В последние десятилетия отмечается рост применения интервенционных методов лечения у пациентов с хронической сердечной недостаточностью (ХСН), которые представляет собой многообещающую альтернативу пациентам, у которых традиционные фармакологические методы терапии неэффективны. Доказано, что сердечная ресинхронизирующая терапия (СРТ) улучшает качество жизни (КЖ) и показана пациентам с широким комплексом QRS ≥130 мс и при сохранении клиники ХСН [2][3]. Однако, как указано в показаниях к этой процедуре, лишь небольшая часть пациентов с ХСН являются подходящими кандидатами на СРТ, и примерно треть пациентов не отвечают на лечение [4]. По результатам шведского регистра около 70% пациентов с ХСН имеют длительность QRS <120 мс [5]. Исследование ECHO-CRT (Echocardiography Guided Cardiac Resynchronization Therapy) доказало неэффективность СРТ у пациентов с шириной комплекса QRS ≤130 мс, несмотря на наличие эхокардиографических признаков диссинхронии миокарда [6]. В настоящее время пациентам с узким комплексом QRS ≤130 мс при сохранении клинических симптомов ХСН возможна имплантация устройства для модуляции сердечной сократимости (МСС). МСС — это электрофизиологический метод лечения, в основе которого лежит нанесение двухфазного электрического импульса в абсолютно рефрактерный период фазы деполяризации кардиомиоцита, через 30 мс после обнаружения комплекса QRS [7]. Действие МСС отличается от других имплантируемых устройств (устройства для СРТ, имплантируемый кардиовертер-дефибриллятор) тем, что не влияет на сердечный ритм. В результате работы МСС улучшается сократительная способность миокарда, увеличивается толерантность к физическим нагрузкам, повышается КЖ пациентов [8].
На сегодняшний день в зарубежной литературе опубликовано 4 систематических обзора и метаанализа, посвящённых МСС. Настоящий метаанализ выполнен на основе российских клинических исследований по МСС.
Цель данной работы — объединение и анализ данных, полученных в центрах с наибольшим опытом имплантации МСС в Российской Федерации для оценки эффективности и безопасности метода.
Материал и методы
Алгоритм поиска информации был разработан в соответствии с требованиями и положениями протокола систематических обзоров и метаанализов PRISMA (Preferred Reporting Items for Systematic review and Meta-Analysis Protocols) [9]. Поиск данных проводился в базах научных публикаций PubMed и РИНЦ (российский индекс научного цитирования). Для поиска в базе данных PubMed использовали следующее ключевое слово: cardiac contractility modulation. Для поиска в базе данных РИНЦ применяли следующие ключевые слова: модуляция сердечной сократимости, кардиомодулирующая терапия. Отбор подходящих исследований для включения в настоящий систематический обзор с последующим метаанализом проводился двумя авторами независимо друг от друга; были подробно изучены абстракты и полнотекстовые статьи на соответствие критериям включения. Последний поиск данных для включения в данный анализ был проведен 10.10.2023. Критериями включения исследований в систематический обзор с последующим метаанализом были: исследования, выполненные в Российской Федерации с использованием устройства МСС (Optimizer IVs и Optimizer Smart, Impulse Dynamics, США) на мужчинах и женщинах >18 лет с ишемической и неишемической ХСН II-III функционального класса, с синусовым ритмом и различными формами фибрилляции предсердий, исследования должны были включать только российскую выборку пациентов. Проведено сравнение МСС с оптимальной медикаментозной терапией (ОМТ) ХСН, в качестве исхода были выбраны баллы по опроснику MLWHFQ (Minnesota Living With Heart Failure Questionnaire), результаты теста 6-минутной ходьбы (ТШХ), наличие улучшения течения ХСН, данные эхокардиографии: фракция выброса (ФВ) левого желудочка (ЛЖ), конечно-систолический и конечно-диастолический объемы (КСО и КДО) ЛЖ, а также показатели выживаемости на сроках 12 и 24 мес.
Статистический анализ. Статистическую гетерогенность исследований оценивали с помощью критерия χ² с нулевой гипотезой о равном эффекте во всех включенных в метаанализ исследованиях; также рассчитывали индекс гетерогенности I². В качестве порогового значения критерия χ² для оценки гетерогенности выбрали значение 0,1, т.е. значение р<0,1 указывает на наличие статистически значимой гетерогенности. Кроме того, результаты исследований признавали гетерогенными при значениях индекса гетерогенности I² >40%. Для обобщения результатов исследований использовали модель случайных эффектов, если была обнаружена статистически значимая гетерогенность в исследованиях (р<0,1 в тесте χ² и I² >40%), и модель фиксированного эффекта при отсутствии статистически значимой гетерогенности. Модель случайных эффектов предполагает, что эффективность изучаемого вмешательства в разных исследованиях может быть разной. Данная модель учитывает дисперсию не только внутри одного исследования, но и между разными исследованиями. В этом случае суммируются дисперсии внутри исследований и дисперсия между исследованиями. В то же время, модель фиксированного эффекта подразумевает, что эффективность изучаемого вмешательства в разных исследованиях одинакова.
Обобщённую величину эффекта для дихотомических исходов (выживаемость, улучшение функционального класса (ФК) ХСН) вычисляли на основании отношения шансов (OR — odds ratio), взвешивание проводили методом Кохрана-Мантеля-Хензеля. Оценка эффекта для непрерывных исходов выполнена на основании нестандартизированной разницы средних, взвешивание проводили по методу обратной дисперсии, где каждая случайная величина имеет вес, обратно пропорциональный ее дисперсии, т.е. прямо пропорциональный ее точности. Публикационное смещение не оценивали в связи с малым количеством исследований, включённых в метаанализ. Метаанализ выполнен в пакете Review Manager (RevMan) 5.4.1 в соответствии с рекомендациями [9].
Результаты
В результате поиска по ключевым словам в базе данных PubMed и РИНЦ было найдено 306 публикаций; после удаления дубликатов число публикаций составило 301. Всего было найдено 5 исследований, 2 исследования исключены в связи с высокой вероятностью систематических ошибок, построенной на основании методики шкалы Ньюкасл-Оттава и в связи с отсутствием группы контроля [10] (таблица 1). Таким образом, окончательно в настоящий обзор отобрано 3 исследования согласно критериям включения. Процесс отбора релевантных исследований показан на рисунке 1.
Таблица 1
Баллы русскоязычной версии шкалы Ньюкасл-Оттава для исследований
|
Исследование (автор, год) |
Балл |
Риск систематических ошибок |
|
Сафиуллина А. А., 2023 [11][12] |
9 |
Низкий |
|
Амирасланов А. Ю., 2022 [13] |
7 |
Средний |
|
Вандер М. А., 2021 |
7 |
Средний |
|
Чугунов И. А., 2021 [14] |
3 |
Высокий |
|
Мамчур С. Е., 2018 [15] |
3 |
Высокий |
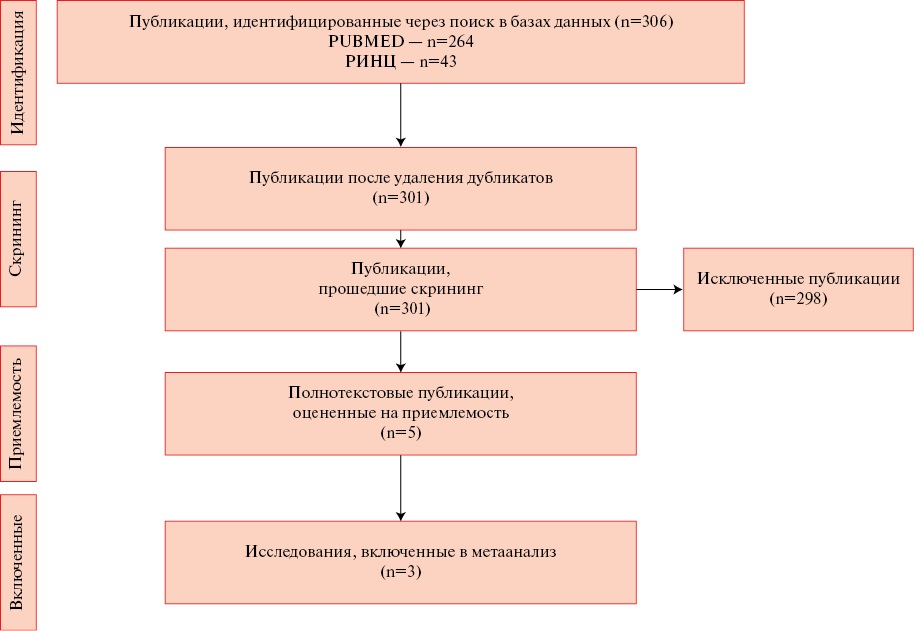
Рис. 1 Выборка исследований представлена в виде блок-схемы, как показано в протоколе PRISMA.
Три включенные клинические исследования были выполнены в рамках клинических апробаций Министерства здравоохранения Российской Федерации № 2016-19-16 и № 2018-027. Критерии включения и исключения в настоящих работах были одинаковыми. Группа контроля в клинических апробациях не была обязательной, а была набрана по усмотрению исследовательских центров. Все три включённых исследования были нерандомизированными.
ОМТ согласно действующим рекомендациям по ХСН [16] включала ингибиторы ангиотензинпревращающего фермента/блокаторы рецепторов ангиотензина II/ингибиторы рецепторов ангиотензина и неприлизина, β-блокаторы, антагонисты минералокортикоидных рецепторов, диуретики и антикоагулянты. Пациенты групп сравнения в исследованиях получали только ОМТ; пациентам исследуемых групп было имплантировано устройство МСС — двухэлектродное или трехэлектродное.
Характеристика исследований
В исследование Сафиуллиной А. А. и др. было включено 200 пациентов, все пациенты имели пароксизмальную или постоянную форму фибрилляции предсердий. 100 пациентам были имплантированы двухэлектродные устройства МСС (Optimizer Smart, Impulse Dynamics, США), 100 пациентов в группе сравнения получали только ОМТ ХСН (таблица 2) [11][12].1
Таблица 2
Характеристика исследований, включённых в метаанализ
|
Первый автор |
Сафиуллина А. А., 2023 [11][12]1 |
Амирасланов А. Ю., 2022 [13] |
Вандер М. А., 20212 |
|||
|
Показатель |
Группа |
|||||
|
МСС |
ОМТ |
МСС |
ОМТ |
МСС |
ОМТ |
|
|
Общее количество пациентов, n |
100 |
100 |
61 |
50 |
55 |
37 |
|
Возраст, лет, M±SD |
59±0,7 |
59±1 |
60,4±13,8 |
62,2±12,5 |
52,3±10,4 |
56±11 |
|
Мужчины, n (%) |
81 (81) |
83 (83) |
47 (77) |
41 (82) |
46 (84) |
30 (81) |
|
Ишемическая/неишемическая этиология, n (%) |
54 (54)/46 (46) |
51 (51)/49 (49) |
41 (67,2)/20 (32,8) |
38 (76,0)/12 (24,0) |
40 (73)/15 (27) |
28 (76)/9 (24) |
|
ФП, n (%) — постоянная — пароксизмальная синусовый ритм |
50 (50) 50 (50) – |
51 (51) 49 (49) – |
8 (13) 25 (41) 28 (46) |
6 (12) 29 (58) 15 (30) |
– 8 (14) 47 (76) |
– 7 (19) 30 (81) |
|
ФК ХСН, n (%) II III |
41 (41) 59 (59) |
43 (43) 57 (57) |
– – |
– – |
42 (76) 13 (24) |
24 (65) 13 (35) |
|
Опросник MLWHFQ, баллы, M±SD |
40±21 |
42,4±13,5 |
46,1±9,4 |
43,9±13,1 |
– |
– |
|
ТШХ, м, M±SD |
331±66 |
300,4±72 |
265±103 |
306±73,4 |
383±98 |
378±93 |
|
QRS, мс, M±SD |
112,4±14,6 |
106,2±18,9 |
117±27,2 |
119±15,6 |
112,2±16,4 |
115±19 |
|
ФВ ЛЖ, %, M±SD |
31,9±5,6 |
30±6 |
32,2±6,1 |
30,7±6,2 |
26±6 |
28±6 |
|
КСО ЛЖ, мл, M±SD |
145,5±54,6 |
165±56 |
150,3±61,9 |
165,1±62,0 |
187±54 |
176±60 |
|
КДО ЛЖ, мл, M±SD |
217,9±69 |
222±63 |
219,6±81 |
238,3±65,4 |
257±58 |
242±68 |
|
Вмешательство, n Имплантация 2-электродного устройства МСС Имплантация 3-электродного устройства МСС |
100
– |
–
– |
34
27 |
–
– |
–
55 |
–
– |
|
ОМТ, n (%) ИАПФ/БРА/АРНИ ББ АМКР ИНГЛТ2 Диуретики Антикоагулянты |
100 (100) 100 (100) 100 (100) 25 (25) 100 (100) 100 (100) |
100 (100) 99 (99) 100 (100) 27 (27) 100 (100) 100 (100) |
61 (100) 60 (98) 55 (90,2) – 57 (93,4) 33 (54) |
50 (100) 50 (100) 48 (96) – 49 (98) 26 (52) |
54 (98) 55 (100) 52 (95) – 55 (100) 8 (14) |
32 (86) 37 (100) 32 (86) – 36 (97) 7 (19) |
|
СД 2 типа, n (%) |
30 (30) |
29 (29) |
17 (28) |
12 (24) |
8 (14) |
6 (16) |
|
ИКД, n (%) |
25 (25) |
27 (27) |
23 (37,7) |
20 (40) |
12 (22) |
23 (62) |
|
Число смертельных исходов, n (%) 12 мес. 24 мес. |
9 (9) 15 (15) |
14 (14) 22 (22) |
2 (3,3) 7 (11,5) |
5 (10) 8 (16) |
3 (5) 11 (20) |
1 (3) 4 (11) |
|
Длительность наблюдения, мес. |
24 |
24 |
25 |
25 |
24 |
24 |
Примечание: АМКР — антагонисты минералокортикоидных рецепторов, АРНИ — ингибиторы рецепторов ангиотензина и неприлизина, ББ — бета-блокаторы, БРА — блокаторы рецепторов ангиотензина II, ИАПФ — ингибиторы ангиотензинпревращающего фермента, ИКД — имплантируемый кардиовертер-дефибриллятор, ИНГЛТ2 — ингибиторы натрий глюкозного котранспортера 2 типа, КДО — конечно-диастолический объем, КСО — конечно-систолический объем, ЛЖ — левый желудочек, МСС — модуляция сердечной сократимости (устройство), ОМТ — оптимальная медикаментозная терапия, СД — сахарный диабет, ТШХ — тест шестиминутной ходьбы, ФВ — фракция выброса, ФК — функциональный класс, ФП — фибрилляция предсердий, ХСН — хроническая сердечная, недостаточность, MLWHFQ — Minnesota Living With Heart Failure Questionnaire.
В исследование Амирасланова А. Ю. и др. было включено всего 111 пациентов, из них 61 пациенту были имплантированы МСС устройства: Optimizer IVs — 27 и Optimizer Smart — 34 (Impulse Dynamics, США), 50 пациентов в группе сравнения находились только на ОМТ (таблица 2) [13].
В исследовании Вандер М. А. и др. участвовали 92 пациента, из них 55 пациентам были имплантированы устройства МСС: 50 аппаратов Optimizer IV поколения и 5 аппаратов Optimizer Smart, Impulse Dynamics, США)2, 37 пациентов в группе сравнения получали только ОМТ.
В трех проспективных клинических сравнительных исследованиях, включенных в настоящий обзор, всего участвовали 403 человека. Средняя продолжительность периода наблюдения составляла 24,33±0,58 мес.
Исходные характеристики включенных в анализ исследований были схожими: преимущественно включены мужчины, наиболее распространенная этиология ХСН — ишемическая, большинство участников относились ко II ФК ХСН, находились на ОМТ, треть пациентов страдали сахарным диабетом 2 типа (таблица 2).
Пациентам были имплантированы двухэлектродные (n=134) и трехэлектродные системы МСС (n=82). Группа сравнения и группа интервенционного вмешательства находились на ОМТ, которая была исходно сопоставимой (таблица 2). Каждое из исследований было одноцентровым.
Дистанция ТШХ
В исследовании Амирасланова А. Ю. и др. [13] наблюдалось улучшение дистанции, пройденной при ТШХ в группе МСС с 259±110 до 343±102 м (р=0,029), а в группе ОМТ увеличения расстояния, пройденного при ТШХ, не отмечено — 329±73,4 vs 335±75 м (р=0,07).
В работах Сафиуллиной А. А. и др., 2023 [11][12]1 отмечалось значимое повышение толерантности к физической нагрузке у пациентов на фоне имплантации устройства МСС, что проявлялось в виде увеличения расстояния, пройденного при ТШХ (с 331±66 до 383±72 м, р<0,05), в то время как в группе ОМТ динамики не наблюдалось (333,4±91 vs 335±83 м, р=0,116).
В работе Вандер М. А. и др. (2021)2 наблюдалось статистически значимое увеличение дистанции, пройденной при ТШХ (с 383±98 до 462±90 м, р=0,005) в группе МСС и в группе ОМТ (с 378±93 до 405±87 м, р=0,02).
Данные метаанализа показали значительное улучшение дистанции, пройденной при проведении ТШХ в группе МСС (n=216) по сравнению с группой контроля (n=187) (средневзвешенная разница -38,19, 95% доверительный интервал (ДИ): от -65,46 до -10,91 м, p=0,006) (рисунок 2).
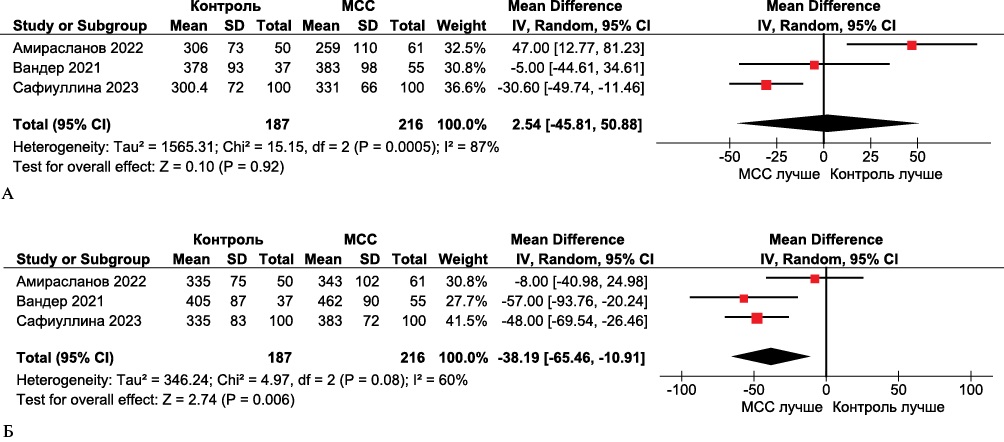
Рис. 2 Forest plot дистанции ТШХ в группах МСС по сравнению с контрольными группами. Forest plot построен на основе доступных 3 клинических исследований, оценивавших ТШХ в группах МСС и группах сравнения. А. Исходно; Б. Через 24 мес. после лечения получена статистически значимая разница в пользу МСС.
Примечание: МСС — модуляция сердечной сократимости (устройство), ТШХ — тест шестиминутной ходьбы.
КЖ
В исследовании Амирасланова А. Ю. и др. [13] показатель MLWHFQ изменился с 46,1±9,4 до 36±7,0 баллов (р=0,042) через 25 нед. после имплантации устройства МСС, в группе контроля значимой динамики не наблюдалось — 44±13 vs 41±16 (р=0,057).
В работах Сафиуллиной А. А. и др. [11][12]1 баллы MLWHFQ значимо снизились с 40±21 до 32,7±16,8 (р<0,05) в группе МСС, тогда как в группе ОМТ значимого снижения баллов не выявлено — 42,4±13,5 vs 42,2±16,9 (р=0,739).
Параметр MLWHFQ в работе Вандер М. А. и др.2 не оценивался, в связи с чем метаанализ выполнен только на основаниях двух исследований.
Данные метаанализа показали значительные изменения в показателе MLWHFQ (средневзвешенная разница 7,28, 95% ДИ: 2,87-11,69, р=0,001) (рисунок 3).
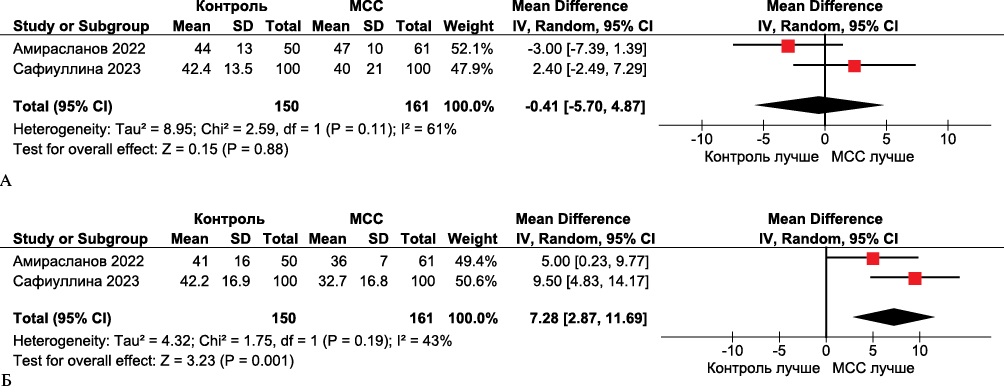
Рис. 3 Forest plot MLWHFQ в группах МСС по сравнению с контрольными группами. Forest plot построен на основе доступных 2 клинических исследований, оценивавших MLWHFQ в группах МСС и группах сравнения. А. Исходно; Б. Через 24 мес. после лечения получена статистически значимая разница в пользу МСС.
Примечание: МСС — модуляция сердечной сократимости (устройство), MLWHFQ — Minnesota Living With Heart Failure Questionnaire.
ФВ ЛЖ
Во всех клинических исследованиях, включенных в метаанализ, отмечено значимое повышение ФВ ЛЖ после имплантации устройства: в работе Амирасланова А. Ю. и др. [13] ФВ ЛЖ увеличилась с 31,0±8,0 до 38±5% (р=0,026), в работе Сафиуллиной А. А. и др. [11][12]1 ФВ ЛЖ повысилась с 31,9±5,6 до 38,6±8,1% (р<0,05), в исследовании Вандер М. А. и др.2 повышение ФВ ЛЖ наблюдалось с 26±6 до 34±7% (р<0,001).
В группе ОМТ в работах Амирасланова А. Ю. и др. (34±6 vs 35±7%, р=0,065) и Сафиуллиной А. А. и др.1 (30±6 vs 33±6,8%, р=0,234) значимого прироста ФВ ЛЖ не отмечено [11-13]. В исследовании Вандер М. А.2 в группе ОМТ наблюдалось повышение ФВ ЛЖ в группе ОМТ: с 28±6 до 31±7%, р=0,022).
По результатам метаанализа параметр ФВ ЛЖ значимо увеличился через 24 мес. после имплантации устройства МСС (средняя разница -4,02, 95% ДИ: -5,83-2,20, р<0,0001) (рисунок 4).
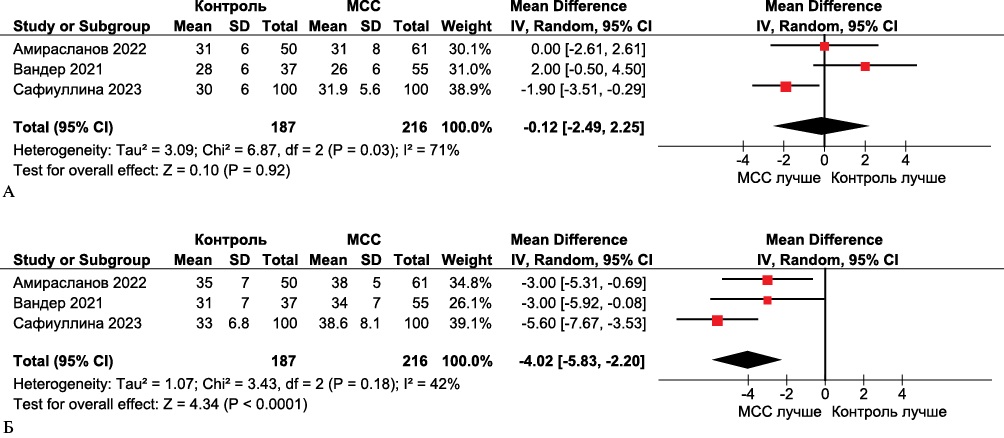
Рис. 4 Forest plot ФВ ЛЖ в группах МСС по и в группах сравнения. Forest plot построен на основе доступных 3 клинических исследований, оценивавших ФВ ЛЖ у пациентов в группах МСС и группах сравнения: А. Исходно; Б. Через 24 мес. после лечения получена статистически значимая разница в пользу МСС.
Примечание: МСС — модуляция сердечной сократимости (устройство), ФВ ЛЖ — фракция выброса левого желудочка, CI — доверительный интервал.
КДО ЛЖ и КСО ЛЖ
По результатам метаанализа отмечалось значимое улучшение объемных параметров ЛЖ, значение КДО ЛЖ (средневзвешенная разница -19,99, 95% ДИ: -7,56-32,42, р=0,002) и КСО ЛЖ (средневзвешенная разница -22,05, 95% ДИ: -13,29-30,81, р<0,00001) уменьшились статистически значимо через 24 мес. после оперативного вмешательств (рисунки 5 и 6).
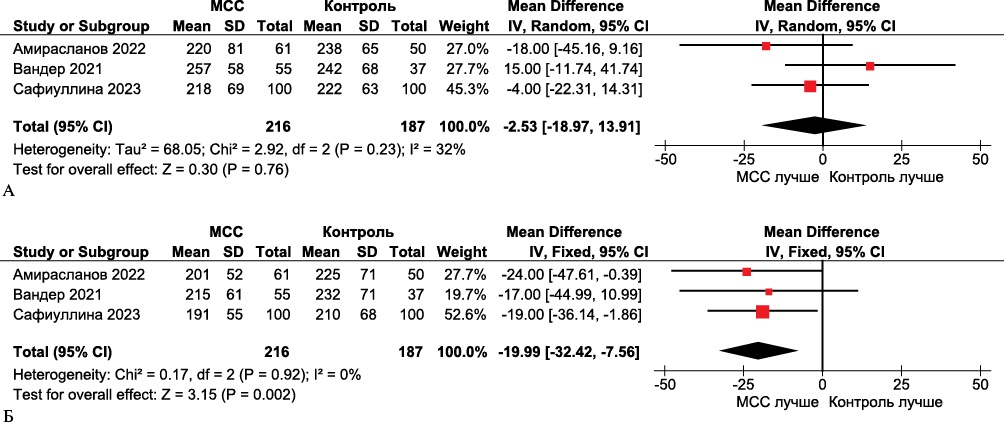
Рис. 5 Forest plot КДО ЛЖ в группах МСС по сравнению с контрольными группами. Forest plot построен на основе доступных 3 клинических исследований, оценивавших КДО ЛЖ в группах МСС и группах сравнения. А. Исходно; Б. Через 24 мес. после лечения получена статистически значимая разница в пользу МСС.
Примечание: КДО ЛЖ — конечно-диастолический объем левого желудочка, МСС — модуляция сердечной сократимости (устройство), CI — доверительный интервал.
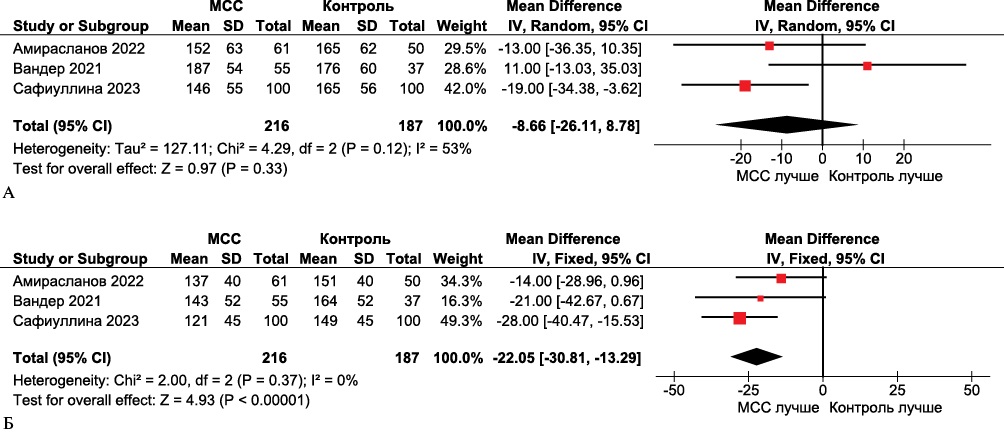
Рис. 6 Forest plot КСО ЛЖ в группах МСС по сравнению с контрольными группами. Forest plot построен на основе доступных 3 клинических исследований, оценивавших КСО ЛЖ в группах МСС и группах сравнения. А. Исходно; Б. Через 24 мес. после лечения получена статистически значимая разница в пользу МСС.
Примечание: КСО ЛЖ — конечно-систолический объем левого желудочка, МСС — модуляция сердечной сократимости (устройство), CI — доверительный интервал.
Смертельные исходы
Смертельные исходы оценивались через 12 и 24 мес. наблюдения. Метаанализ частоты наступления смерти от всех причин через 12 мес. наблюдения, включал данные трех исследований. Смерть от всех причин зарегистрирована у 14 (6,5%) из 216 испытуемых в группах МСС и у 20 (10,7%) из 187 участника в контрольных группах. Различия не достигли статистической значимости (OR 0,61, 95% ДИ: 0,30-1,25, р=0,18; рисунок 7).

Рис. 7 Forest plot смерти от всех причин в группах МСС по сравнению с контрольными группами через 12 мес. Forest plot построен на основе 3-х доступных клинических исследований, оценивавших смерть от всех причин у пациентов в группах МСС и группах сравнения. Статистически значимых различий не получено.
Примечание: МСС — модуляция сердечной сократимости (устройство), CI — доверительный интервал.
Метаанализ случаев смерти от всех причин через 24 мес. наблюдения также включал данные трех исследований. Смерть от всех причин наблюдалась у 33 (15,3%) из 216 испытуемых в группах МСС и у 34 (18,2%) из 187 участников в контрольных группах. Разница была статистически незначимой (OR 0,82, 95% ДИ: 0,48-1,39, р=0,46; рисунок 8).
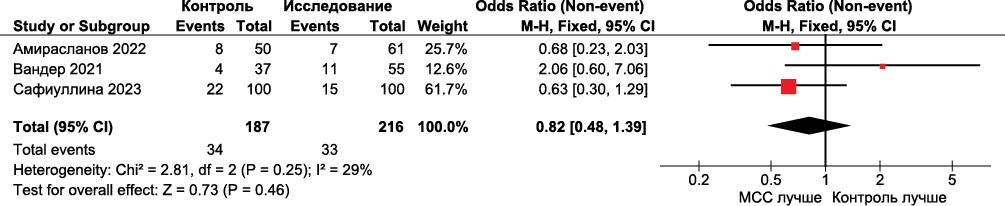
Рис. 8 Forest plot смерти от всех причин в группах МСС по сравнению с контрольными группами через 24 мес. Forest plot построен на основе доступных 3 клинических исследований, оценивавших смерть от всех причин у пациентов в группах МСС и группах сравнения. Статистически значимая разница не получена.
Примечание: МСС — модуляция сердечной сократимости (устройство), CI — доверительный интервал.
Важно отметить, что в исследованиях Сафиуллиной А. А. и др. [11][12] получены данные о положительном влиянии МСС на комбинированную конечную точку (сердечно-сосудистую смерть и/или госпитализации по причине декомпенсации ХСН). В работах Амирасланова А. Ю. [13] и Вандер М. А.2 настоящие данные не представлены, в связи с чем провести метаанализ по комбинированной конечной точке не представлялось возможным
Обсуждение
Настоящий метаанализ, включающий 3 клинических сравнительных исследования на территории Российской Федерации, показал, что МСС ассоциирована со значимым повышением КЖ (по данным MLWHFQ) и функциональных возможностей пациентов (по данным ТШХ), а кроме этого связана со статически значимым обратным ремоделированием ЛЖ (ассоциирована с повышением ФВ ЛЖ, снижением КДО и КСО ЛЖ). Не получено значимого влияния МСС на смертельные исходы от всех причин по данным метаанализа.
Результаты настоящего метаанализа подтверждают результаты зарубежных метаанализов, посвященных МСС. Так, метаанализ от 2011г, представленный Kwong JSW, et al. [17] и включающий 641 пациента из 3 рандомизированных клинических исследования (РКИ), показал, что по сравнению с контролем МСС существенно не улучшала выживаемость (n=629, RR (risk ratio, отношение рисков) 1,19, 95% ДИ: 0,50-2,86, р=0,69), также не было отмечено благоприятного эффекта при госпитализации по всем причинам.
В другом метаанализе Giallauria F, et al. 2014г [18], включающем 3 РКИ с общим количеством участников 641 человек, было показано, что по сравнению с контрольной группой МСС значительно улучшила пиковое потребление кислорода (средняя разница +0,71, 95% ДИ: 0,20-1,21 мл/кг/мин, р=0,006), дистанцию ТШХ (средняя разница +13,92, 95% ДИ: -0,08-27,91 м, р=0,05) и КЖ, оцениваемое с помощью Миннесотского опросника (средняя разница -7,17, 95% ДИ: от -10,38 до -3,96, р<0,001).
В метаанализе Liu X, et al. [19], в который были включены 4 клинических исследования (n=723), по сравнению с контрольной группой МСС существенно не улучшила показатели смерти от всех причин или госпитализации по всем причинам, но значительно улучшил пиковое потребление кислорода (стандартная средняя разница 0,233, 95% ДИ: 0,065-0,401 мл/кг/мин, р=0,006) и дистанцию ТШХ (стандартизованная разность средних 0,924, 95% ДИ: 0,001-0,334 м, р=0,049).
В метаанализе Giallauria F, et al. 2020г [20], в который было включено 5 клинических исследований (4 РКИ и 1 нерандомизированное исследование FIX-HF-5C2 (Evaluation of the Safety and Efficacy of the 2-lead OPTIMIZER® Smart System) с участием 801 пациента, было показано что, по сравнению с контролем МСС значительно улучшила пиковое потребление кислорода (стандартизованная разность средних +0,93, 95% ДИ: 0,56-1,30 мл/кг/мин, р<0,001), дистанцию, пройденную при ТШХ (стандартизованная разность средних +17,97, 95% ДИ: 5,48-30,46 м, р=0,005) и КЖ, оцениваемое с помощью MLWHFQ (стандартизованная разность средних 7,85, 95% ДИ: 10,76-4,94, р<0,001).
Заключение
Таким образом, МСС ассоциирована со статистически значимым улучшением функциональной способности, КЖ и параметров ЛЖ у пациентов с ХСН как с синусовым ритмом, так и с фибрилляцией предсердий. Отсутствие данных о положительном влиянии на клинические исходы на фоне имплантации устройства МСС свидетельствуют о необходимости проведения крупных хорошо спланированных исследований, чтобы подтвердить его роль во влиянии на прогноз у пациентов с ХСН, которым показана МСС терапия.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Сафиуллина А. А. Модуляция сердечной сократимости в комплексной терапии хронической сердечной недостаточности со сниженной фракцией выброса левого желудочка и различными формами фибрилляции предсердий. с. 354, 2023. Номер государственной регистрации: 523092900058-1. Докторская диссертация. Москва.
2. Вандер М. А. Предикторы обратного ремоделирования сердца и клинического течения хронической сердечной недостаточности с низкой фракцией выброса левого желудочка на фоне кардиомодулирующей терапии. С. 116. 2021. Номер государственной регистрации: 421092700071-5. Кандидатская диссертация. Санкт-Петербург.
Список литературы
1. Поляков Д. С., Фомин И. В., Белен¬ков Ю. Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА-ХСН. Кардиология. 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
2. Glikson M, Nielsen JC, Kronborg MB, et al. ESC scientific document group. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization. Eur Heart J. 2021;35(342):3427-520. doi:10.1093/eurheartj/ehab364.
3. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42;36:3599-726. doi:10.1093/eurheartj/ehab368.
4. Zhang Q, Yu C.-M. Could exercise unveil the mystery of non-response to cardiac resynchronization therapy? Europace. 2011; 13(6):768-9. doi:10.1093/europace/eur044.
5. Lund LH, Jurga J, Edner M, et al. Prevalence, correlates, and prognostic significance of QRS prolongation in heart failure with reduced and preserved ejection fraction. Eur Heart J. 2013; 34(7):529-39. doi:10.1093/eurheartj/ehs305.
6. Ruschitzka F, Abraham WT, Singh JP, et al. Cardiac-Resyn-chronization Therapy in Heart Failure with a Narrow QRS Complex. N Engl J Med. 2013;369(15):1395-405. doi:10.1056/NEJMoa1306687.
7. Butter C, Rastogi S, Minden HH, et al. Cardiac Contractility Mo-dulation Electrical Signals Improve Myocardial Gene Expression in Patients With Heart Failure. J Am Coll Cardiol. 2008; 51(18):1784-9. doi:10.1016/j.jacc.2008.01.036.
8. Imai M, Rastogi S, Gupta RC, et al. Therapy With Cardiac Con-tractility Modulation Electrical Signals Improves Left Ventricular Function and Remodeling in Dogs With Chronic Heart Failure. J Am Coll Cardiol. 2007;49(21):2120-8. doi:10.1016/j.jacc.2006.10.082.
9. Омельяновский В. В., Авксентьева М. В., Сура М. В. и др. Методические рекомендации по проведению метаанализа. Федеральное государственное бюджетное учреждение "Центр экспертизы и контроля качества медицинской помощи" Министерства здравоохранения России, 2017. 28 c. EDN PRPXHH.
10. Реброва О. Ю., Федяева В. К. Вопросник для оценки риска система¬ти¬ческих ошибок в нерандомизированных сравнительных исследованиях: русскоязычная версия шкалы Ньюкасл-Оттава. Медицинские технологии. Оценка и выбор. 2016;(3):14-9.
11. Сафиулли¬на А. А., Ускач Т. М., Образцов И. В. и др. Ожидаемая продолжительность жизни у пациентов с хронической сердечной недостаточностью и фибрилляцией предсердий с имплантированными устройствами модуляции сердечной сократимости. Кардиологический вестник. 2023;18(1):38-48. doi:10.17116/Cardiobulletin20231801138.
12. Сафиуллина А. А., Ускач Т. М., Сапельников О. В. и др. Эффективность модуляции сердечной сократимости у пациентов с хронической сердечной недостаточностью и фибрилляцией предсердий: результаты 12-месячного наблюдения. Терапевтический архив. 2022;94(9):1078-84. doi:10.26442/00403660.2022.09.201840.
13. Амирасланов А. Ю., Васковский В. А., Артюхина Е. А. и др. Отдаленные результаты хирургического лечения пациентов с хронической сердечной недостаточностью с помощью имплантации кардиомодулирующих устройств. Вестник аритмологии. 2022;29(1):17-23. doi:10.35336/VA-2022-1-03.
14. Чугунов И. А., Давтян К. В., Топчян А. Г. и др. Опыт применения модуляции сердечной сократимости у пожилых пациентов с сердечной недостаточностью со сниженной фракцией выброса левого желудочка: результаты 12-месячного наблюдения. Вестник аритмологии. 2021;28(2):5-10. doi:10.35336/VA-2021-2-5-10.
15. Мамчур С. Е., Хоменко Е. А., Чистюхин О. М. и др. Влияние модуляции сердечной сократимости на синхронизацию контрактильности и деформацию миокарда левого желудочка: пилотное исследование. Вестник аритмологии. 2018;93:24-9. doi:10.25760/VA-2018-93-24-29.
16. Мареев В. Ю., Фомин И. В., Агеев Ф. Т. и др. Клинические рекомендации ОССН — РКО — РНМОТ. сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). диагностика, профилактика и лечение. Кардиология. 2018;58(6S):8-164. doi:10.18087/cardio.2475.
17. Kwong JSW, Sanderson JE, Yu C. Cardiac Contractility Modulation for Heart Failure: A Meta‐Analysis of Randomized Controlled Trials. Pacing Clin Electrophysiol. 2012;35(9):1111-8. doi:10.1111/j.1540-8159.2012.03449.x.
18. Giallauria F, Vigorito C, Piepoli MF, et al. Effects of cardiac con-tractility modulation by non-excitatory electrical stimulation on exercise capacity and quality of life: An individual patient’s data meta-analysis of randomized controlled trials. Int J Cardiol. 2014;175;2:352-7. doi:10.1016/j.ijcard.2014.06.005.
19. Liu X, Yang HJ, Ping HQ, et al. The safety and efficacy of cardiac contractility modulation in heart failure. Herz. 2017;42(8):766-75. doi:10.1007/s00059-016-4514-5.
20. Giallauria F, Cuomo G, Parlato A, et al. A comprehensive individual patient data meta‐analysis of the effects of cardiac contractility modulation on functional capacity and heart failure‐related quality of life. ESC Hear Fail. 2020;7(5):2922-32. doi:10.1002/ehf2.12902.
Об авторах
А. А. СафиуллинаРоссия
Сафиуллина Альфия Ахатовна — д.м.н., с.н.с. отдела заболеваний миокарда и сердечной недостаточности
Москва
Т. М. Ускач
Россия
Ускач Татьяна Марковна — д.м.н., профессор, в.н.с. отдела заболеваний миокарда и сердечной недостаточности
Москва
О. В. Сапельников
Россия
Сапельников Олег Валерьевич — д.м.н., г.н.с. лаборатории хирургических и рентгенхирургических методов лечения
Москва
Е. Н. Михайлов
Россия
Михайлов Евгений Николаевич — д.м.н., профессор, руководитель НИЛ нейромодуляции НИО аритмологии, декан факультета послевузовского и дополнительного образования Института медицинского образования
Москва
Е. А. Артюхина
Россия
Артюхина Елена Александровна — д.м.н., зав. отделением электрофизиологических рентгенэндоваскулярных методов диагностики и лечения аритмий
Москва
Д. С. Лебедев
Россия
Лебедев Дмитрий Сергеевич — д.м.н., профессор, профессор РАН, руководитель НИО аритмологии, руководитель образовательного центра "Академия аритмологии"
Санкт-Петербург
М. Ю. Ситникова
Россия
Ситникова Мария Юрьевна — д.м.н., профессор, руководитель НИО сердечной недостаточности
Санкт-Петербург
И. В. Образцов
Россия
Образцов Игорь Владимирович — к.м.н., медицинский статистик, врач аллерголог-иммунолог Центра аллергологии и иммунологии
Москва
А. Ю. Амирасланов
Россия
Амирасланов Анар Юсифович — к.м.н., с.н.с., отдел электрофизиологических рентгенэндоваскулярных методов диагностики и лечения аритмий
Москва
Е. А. Лясникова
Россия
Лясникова Елена Анатольевна — к.м.н., доцент кафедры факультетской терапии с клиникой Института медицинского образования, в.н.с. НИО сердечной недостаточности
Санкт-Петербург
М. А. Трукшина
Россия
Трукшина Марина Александровна — н.с. НИО сердечной недостаточности
Санкт-Петербург
В. Л. Галенко
Россия
Галенко Виктория Леонидовна — м.н.с. НИО сердечной недостаточности
Санкт-Петербург
В. А. Аманатова
Россия
Аманатова Валерия Александровна — к.м.н., н.с. отдела заболеваний миокарда и сердечной недостаточности
Москва
И. Р. Гришин
Россия
Гришин Игорь Романович — к.м.н., с.н.с. лаборатории хирургических и рентгенхирургических методов лечения нарушений ритма сердца
Москва
Д. И. Черкашин
Россия
Черкашин Дмитрий Игоревич — к.м.н., сердечно-сосудистый хирург лаборатории хирургических и рентгенхирургических методов лечения нарушений ритма сердца
Москва
Р. С. Акчурин
Россия
Акчурин Ренат Сулейманович — д.м.н., профессор, академик РАН, зам. ген. директора по хирургии, руководитель отдела сердечно-сосудистой хирургии
Москва
С. Н. Терещенко
Россия
Терещенко Сергей Николаевич — д.м.н., профессор, руководитель отдела заболеваний миокарда и сердечной недостаточности
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Модуляция сердечной сократимости (МСС) — это электрофизиологический метод лечения пациентов с хронической сердечной недостаточностью и с узким комплексом QRS, который улучшает качество жизни и функциональный статус пациентов.
Что добавляют результаты исследования?
- Метаанализ данных российских клинических исследований с целью изучения метода лечения МСС у пациентов с хронической сердечной недостаточностью со сниженной фракцией выброса показал, что МСС ассоциирована со статистически значимым улучшением функциональной способности, качества жизни и параметров левого желудочка у пациентов как с синусовым ритмом, так и с фибрилляцией предсердий.
Рецензия
Для цитирования:
Сафиуллина А.А., Ускач Т.М., Сапельников О.В., Михайлов Е.Н., Артюхина Е.А., Лебедев Д.С., Ситникова М.Ю., Образцов И.В., Амирасланов А.Ю., Лясникова Е.А., Трукшина М.А., Галенко В.Л., Аманатова В.А., Гришин И.Р., Черкашин Д.И., Акчурин Р.С., Терещенко С.Н. Модуляция сердечной сократимости у пациентов с хронической сердечной недостаточностью со сниженной фракцией выброса: метаанализ данных российских клинических исследований. Кардиоваскулярная терапия и профилактика. 2025;24(3):4191. https://doi.org/10.15829/1728-8800-2025-4191. EDN: BONOUT
For citation:
Safiullina A.A., Uskach T.M., Sapelnikov O.V., Mikhailov E.N., Artyukhina E.A., Lebedev D.S., Sitnikova M.Yu., Obraztsov I.V., Amiraslanov A.Yu., Lyasnikova A.E., Trukshina M.A., Galenko V.L., Amanatova V.A., Grishin I.R., Cherkashin D.I., Akchurin R.S., Tereshchenko S.N. Cardiac contractility modulation in patients with heart failure with reduced ejection fraction: a meta-analysis of Russian clinical trials. Cardiovascular Therapy and Prevention. 2025;24(3):4191. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4191. EDN: BONOUT
JATS XML

























































