Перейти к:
Лабораторные маркеры осложненного атеросклеротического поражения коронарных артерий у пациентов с инфарктом миокарда без подъема сегмента ST
https://doi.org/10.15829/1728-8800-2025-4253
EDN: RXGTGE
Аннотация
Цель. Изучить наличие ассоциаций между уровнем маркеров системного воспаления у пациентов с инфарктом миокарда без подъема сегмента ST (ИМбпST) и тяжестью поражения инфарктответственной артерии (ИОА) по данным коронароангиографии.
Материал и методы. Проанализированы данные 236 пациентов, госпитализированных с диагнозом ИМбпST в региональный сосудистый центр г. Одинцово с апреля 2021г по февраль 2023г. Всем больным выполнялся объем обследований, соответствующий клиническим рекомендациям. По данным лабораторных исследований оценивался уровень маркеров воспаления — лейкоциты, С-реактивный белок, определенный высокочувствительным способом (вчСРБ), фибриноген. В ходе коронароангиографии определялась морфология поражения ИОА по классификации ACC/AHA (American College of Cardiology/American Heart Association). Связь маркеров воспаления с осложненным поражением оценивалась в модели бинарной логистической регрессии.
Результаты. В зависимости от тяжести поражения ИОА пациенты разделены на 2 группы: в 1 группу вошло 166 пациентов с осложненным поражением ИОА (тип В-С), во 2 группу — 70 пациентов без осложненного поражения (тип А). По уровню тропонина I при поступлении пациенты обеих групп были сопоставимы (p>0,05). Маркеры воспаления были статистически значимо выше в группе 1 (p≤0,05). Летальный исход отмечался в 4,2% (n=7) случаев в группе 1 и в 2,9% (n=2) в группе 2 (p=0,62). Уровни вчСРБ (OR — odds ratio (отношение шансов) 1,19) и фибриногена (OR 7,96) ассоциировались с вероятностью наличия поражения ИОА типа В-С (р<0,001).
Заключение. Для пациентов с ИМбпST и осложненным поражением ИОА характерны повышенные уровни маркеров системного воспаления. Более высокие уровни вчСРБ и фибриногена достоверно ассоциировалось с визуализацией поражения типа В и С.
Ключевые слова
Для цитирования:
Стрелкова А.В., Чащин М.Г., Горшков А.Ю., Юрин А.В., Шабанов Д.В., Драпкина О.М. Лабораторные маркеры осложненного атеросклеротического поражения коронарных артерий у пациентов с инфарктом миокарда без подъема сегмента ST. Кардиоваскулярная терапия и профилактика. 2025;24(3):4253. https://doi.org/10.15829/1728-8800-2025-4253. EDN: RXGTGE
For citation:
Strelkova A.V., Chashchin M.G., Gorshkov A.Yu., Yurin A.V., Shabanov D.V., Drapkina O.M. Laboratory markers of complicated coronary atherosclerosis in patients with non-ST-elevation myocardial infarction. Cardiovascular Therapy and Prevention. 2025;24(3):4253. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4253. EDN: RXGTGE
Введение
Сердечно-сосудистые заболевания остаются основной причиной смерти во всем мире. В частности, на долю ишемической болезни сердца (ИБС) приходится до 16% летальных исходов [1]. По разным данным смертность от острых форм ИБС варьирует от 6,5 до 11,6% [2][3].
В настоящее время отмечается тенденция к увеличению числа госпитализаций пациентов с острым коронарным синдромом (ОКС) без подъема сегмента ST (ОКСбпST). Так, в 2020г соотношение госпитализированных с диагнозом ОКСбпST к госпитализированным с диагнозом ОКС с подъемом сегмента ST (ОКСпST) составило 2:1 [4]. По данным консенсуса Американского колледжа кардиологов ОКСбпST диагностируется у 70% пациентов ежегодно, тогда как на долю ОКСпST приходится только 30% случаев [5].
Одной из ключевых причин развития ОКСбпST является неокклюзирующий атеросклероз коронарных артерий (КА), в ряде случаев сопровождающийся осложнением атеросклеротической бляшки (АСБ) [6][7]. Осложненные АСБ характеризуются бóльшим объемом воспалительного инфильтрата, в составе которого присутствуют моноциты, макрофаги, нейтрофилы и Т-клетки [8][9]. В результате персистирующего системного воспаления, повреждения сосудистой стенки свободными радикалами, турбулентности тока крови и эндотелиальной дисфункции в местах стенозирования КА происходит постепенное истончение покрышки АСБ с последующим ее разрушением, а активация системы гемостаза создает оптимальные условия для развития атеротромбоза [10].
Использование биохимических показателей в качестве косвенных маркеров выраженности коронарного атеросклероза и прогнозирования неблагоприятных сердечно-сосудистых событий является актуальной исследовательской задачей [11][12]. В современной медицинской парадигме атеросклероз КА рассматривается не столько как заболевание, обусловленное нарушением метаболизма липопротеинов, но и как хроническое воспаление эндотелия с периодами стабильного течения и обострения [13]. В связи с этим в ряде исследований представлены данные, свидетельствующие о более выраженном системном воспалении у пациентов с острой формой ИБС, по сравнению с хронической [14-16].
В 1988г Ryan TJ [17] опубликовал одну из первых классификаций морфологии поражения КА, которая впоследствии вошла в клиническую практику как классификация атеросклеротического поражения Американской коллегии кардиологов/Американской ассоциации сердца (ACC/АНА — American College of Cardiology/American Heart Association). Согласно данной классификации все поражения коронарного русла были разделены на 3 типа: тип А — концентрические стенозы <10 мм по протяженности, с ровными контурами бляшки, тип В — эксцентрические стенозы либо стенозы, имеющие умеренный кальциноз, неровные контуры или признаки пристеночного тромбоза, и тип С — стенозы протяженностью >20 мм, имеющие изъязвленную поверхность, а также диффузные поражения и хронические окклюзии коронарного русла [17].
Однако данные о наличии связи между воспалительными маркерами по данным биохимического исследования крови и наличием осложненного атеросклеротического поражения КА, визуализируемого по данным коронароангиографии (КАГ), по-прежнему, ограничены. По мнению ряда авторов, для пациентов с ОКСбпST характерен парадокс "риск-лечение", обусловленный несоответствием объективно рассчитанного риска неблагоприятных ишемических событий применяемым подходам в лечении [18][19]. По данным Azzahhafi J, et al. (2021), проанализировавших годовую летальность 2524 пациентов из регистра FORCE-ACS (Future Optimal Research and Care Evaluation in patients with Acute Coronary Syndrome), показатели летальности в группе пациентов с оптимальным объемом лечения, соответствующим рассчитанному риску по шкале GRACE (Global Registry of Acute Coronary Events), были значительно ниже, чем в группе пациентов с несоответствием рассчитанного риска (5,7 vs 15,6%, соответственно, p<0,05) [20]. В соответствии с действующими клиническими рекомендациями [2] сроки реваскуляризации пациентов с ОКСбпST регламентируются на основании величины риска по шкале GRACE и клиническим статусом больного, вследствие чего для пациентов низкого и среднего рисков с неблагоприятным типом коронарного поражения реальный риск может оставаться недооцененным. Поэтому поиск потенциальных маркеров системного воспаления у пациентов с инфарктом миокарда (ИМ) без подъема сегмента ST (ИМбпST) представляется весьма актуальным.
Цель работы — изучить наличие ассоциаций между уровнем маркеров системного воспаления у пациентов с ИМбпST и тяжестью поражения ИОА по данным КАГ.
Материал и методы
В ретроспективный анализ вошли данные 236 пациентов, госпитализированных в Региональный сосудистый центр (РСЦ) г. Одинцово с подтвержденным диагнозом ИМбпST за период с апреля 2021г по февраль 2023г.
Критерием включения в исследование являлся факт госпитализации в РСЦ с подтвержденным диагнозом ИМбпST (наличие остро возникших клинических признаков или симптомов ишемии миокарда, когда на электрокардиограмме (ЭКГ) отсутствует стойкий (длительностью >20 мин) подъем сегмента ST как минимум в двух смежных отведениях и нет остро возникшей блокады левой ножки пучка Гиса, а также повышение уровня сердечного тропонина I (Tn I) >99-го перцентиля верхней референсной границы. Все пациенты подписывали добровольное информированное согласие на проведение медицинских вмешательств. Протокол исследования был одобрен независимым этическим комитетом ФГБУ "НМИЦ терапии и профилактической медицины" Минздрава России (06-04/23 от 12.12.2023).
Критериями невключения являлись подтвержденные диагнозы ОКСпST или нестабильная стенокардия, а также недостаточное количество данных в истории болезни. Из дальнейшего анализа исключались пациенты без гемодинамически значимых стенозов и/или с признаками вазоспазма по данным КАГ, пациенты с острым окклюзирующим поражением инфаркт-ответственной артерии (ИОА), инфаркт-связанным поражением ствола левой КА, а также при выявлении нарушений кровотока или острого тромбоза аортокоронарного шунта. В связи с тем, что набор пациентов осуществлялся в период пандемии новой коронавирусной инфекции, из исследования также исключались пациенты с подтвержденными документально признаками острой респираторной вирусной инфекции или положительным тестом полимеразной цепной реакции (ПЦР-тестом) на рибонуклеиновую кислоту (РНК) коронавируса 2, вызывающего тяжелый острый респираторный дистресс-синдром — SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2), выявленного в текущую госпитализацию.
Всем пациентам выполнялся полный объем лечебных и диагностических мероприятий, в соответствии с актуальными клиническими рекомендациями по ведению пациентов с ОКСбпST [21]. У всех пациентов были проанализированы клинико-анамнестические данные, результаты лабораторных (общий и биохимический анализы крови) и инструментальных (эхокардиография (ЭхоКГ) и КАГ с выполненными чрескожными коронарными вмешательствами по показаниям) исследований.
Взятие венозной крови выполнялось из кубитальной вены при поступлении в РСЦ до проведения КАГ. Общий анализ крови проводили на автоматическом гематологическом анализаторе XT-2000i (Sysmex, Япония) с дополнительной микроскопией мазка для подсчета лейкоцитарной формулы на микроскопе Asiolab 5 (Carl Zeiss, Германия). Повышенный уровень лейкоцитов определялся при их содержании в плазме крови >9×10⁹/л. Концентрацию С-реактивного белка (вчСРБ) определяли высокочувствительным иммунотурбидиметрическим методом с использованием аналитических наборов "С-reactive protein hs" ("BioSystem", Испания) на полуавтоматическом анализаторе открытого типа "Clima MC-15" ("RAL Tecnica para el Labaratorio", Испания). В качестве референсных значений вчСРБ принимались концентрации <5 мг/л. Содержание фибриногена определяли в цитратной плазме крови на автоматическом коагулометре STA Compact Max (Diagnostica Stago S. A.S., Германия) с использованием оригинальных реактивов. Референсные значения уровня фибриногена были в диапазоне 2-4 г/л. В качестве маркера повреждения миокарда анализировался уровень Tn I в сыворотке крови, который определяли электрохемилюминесцентным методом на автоматическом иммунохимическом анализаторе "Сobas e 411" (Roche, Швейцария) с использованием тест-системы Troponin I Elecsys (Roche, Швейцария).
КАГ выполнялась на аппарате Artis Zee ("Siemens", Германия) по методике Judkins правым или левым трансрадиальным или бедренным доступами. По данным диагностической КАГ определялась морфология атеросклеротического поражения ИОА в соответствии с классификацией ACC/AHA: "осложненным" считалось поражение, классифицируемое как типы В (эксцентрические стенозы, либо стенозы, имеющие умеренный кальциноз, неровные контуры или признаки пристеночного тромбоза) или С (стенозы протяженностью >20 мм, стенозы, имеющие изъязвленную поверхность, а также диффузные поражения и хронические окклюзии коронарного русла), а "неосложненным" — поражение типа А (концентрические стенозы <10 мм по протяженности, с ровными контурами бляшки)1.
У пациентов с многососудистым поражением коронарного русла ИОА определялась на основании клинической картины, локализации ишемии по данным ЭКГ, ЭхоКГ и результатам КАГ (наличие признаков пристеночного тромбоза, изъязвления АСБ). В спорных случаях, к примеру, при сочетании хронической окклюзии с другим поражением, использовались результаты ЭхоКГ: учитывалось наличие зон акинеза и гипокинеза миокарда. Среди пациентов после аортокоронарного шунтирования с сохраненным кровотоком по шунтам ИОА считалась иная некровоснабжаемая шунтом пораженная КА, соответствующая локализации ишемии по данным ЭКГ и ЭхоКГ.
Стратификация риска летального исхода на госпитальном этапе основывалась на подсчете баллов по двум шкалам: GRACE2 и TIMI-UA/NSTEMI (Thrombolysis In Myocardial Infarction Risk Score for Unstable Angine/Non-ST-segment elevation myocardial infarction)3.
Статистическая анализ данных выполнялся с помощью программного обеспечения Excel 2019 ("Microsoft", США) и JMP Pro 17 ("SAS", США). Для проверки распределения количественных показателей на нормальность применялся критерий Колмогорова-Смирнова с коррекцией Лиллиефорса. Показатели, соответствующие нормальному распределению, описывались средним значением и стандартным отклонением (M±SD), а показатели с распределением, отличным от нормального, в виде медианы и интерквартильного размаха — Me [ Q25%; Q75%]. Качественные признаки представлены в виде абсолютных значений и долей — n (%). Сопоставление двух групп по количественным показателям осуществлялось с помощью критерия U-Манна-Уитни, по качественным показателям — с использованием критерия χ² Пирсона. Анализ связи отдельных факторов с осложненным типом поражения выполнялся в модели бинарной логистической регрессии. Для оценки эффективности диагностических тестов и определения порогового значения для классификации признаков применялся ROC-анализ с оценкой площади под кривой (Area Under Curve, AUC). Пороговое значение определялось исходя из наивысшего значения индекса Юдена. Уровень статистической значимости был зафиксирован на уровне p<0,05.
Результаты
Средний возраст пациентов, включенных в исследование, составил 65,1±11,5 лет. Подавляющее число больных было мужского пола — 67% (n=158). Клинико-анамнестические характеристики представлены в таблице 1.
Таблица 1
Клинико-анамнестическая характеристика пациентов, включенных в исследование
|
Показатель |
n=236 |
|
Возраст, лет, M±SD |
65,1±11,5 |
|
Мужской пол, n (%) |
158 (67,0) |
|
ИМТ, кг/м², Me [ Q25; Q75] |
27,7 [ 25,4; 30,7] |
|
Курение, n (%) |
59 (25,0) |
|
Артериальная гипертензия, n (%) |
235 (99,6) |
|
Стенокардия напряжения в анамнезе, n (%) |
65 (27,5) |
|
ПИКС, n (%) |
52 (22,0) |
|
ЧКВ в анамнезе, n (%) |
29 (12,3) |
|
АКШ в анамнезе, n (%) |
5 (2,1) |
|
Дислипидемия, n (%) |
49 (20,8) |
|
Сахарный диабет, n (%) |
60 (25,4) |
|
Систолическое АД при поступлении, мм рт.ст., Me [ Q25; Q75] |
140,0 [ 130,0; 150,0] |
|
Диастолическое АД при поступлении, мм рт.ст., Me [ Q25; Q75] |
80,0 [ 80,0; 90,0] |
|
ОСН при поступлении, n (%): – Killip I – Killip II – Killip III-IV |
181 (76,7) 37 (15,7) 18 (7,6) |
Примечание: M±SD — среднее ± стандартное отклонение; здесь и во всех таблицах: Me [ Q25; Q75] — медиана [ интерквартильный размах], n (%) — количество пациентов (% от выборки). АД — артериальное давление, АКШ — аортокоронарное шунтирование, ИМТ — индекс массы тела, ОСН — острая сердечная недостаточность, ПИКС — постинфарктный кардиосклероз, ЧКВ — чрескожное коронарное вмешательство.
Более 75% пациентов исследуемой выборки имели избыточную массу тела. Артериальная гипертензия в анамнезе отмечалась практически у всех больных. ИМ ранее перенесли 52 (22,0%) больных. Сахарный диабет как 1-го, так и 2-го типов, а также курение отмечены у четверти пациентов, включенных в настоящее исследование.
По результатам проведенной КАГ преобладал правый тип коронарного кровоснабжения — 75,9% (n=179). У 44,1% (n=104) пациентов инфаркт-ответственным являлось поражение передней межжелудочковой ветви, у 27,5% (n=65) — правой КА. Средний балл по шкале SYNTAX Score составил 8,0 [ 5,0; 13,0] баллов. Из 236 пациентов, включенных в исследование, однососудистое поражение КА было выявлено у 36,4% (n=86) больных, поражение двух сосудов отмечалось у 37,3% (n=88) больных, ≥3-х у 26,3% (n=62). У 1,7% (n=4) больных визуализировалось поражение ствола левой КА, однако оно не являлось гемодинамически значимым и не расценивалось в качестве инфаркт-ответственного. В соответствии с классификацией ACC/AHA1 у 29,7% (n=70) пациентов поражение соответствовало типу А, у 55,9% (n=132) пациентов поражение типу В и у 14,4% (n=34) пациентов поражение типу С (рисунок 1). Результаты КАГ пациентов, включенных в исследование, представлены в таблице 2.
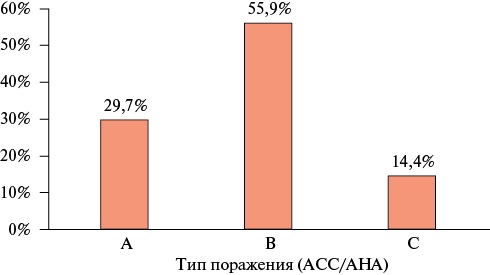
Рис. 1 Распределение пациентов с ИМбпST по типу атеросклеротического поражения ИОА в соответствии с классификацией ACC/AHA.
Примечание: ИМбпST — инфаркт миокарда без подъема сегмента ST, ИОА — инфаркт-ответственная артерия, ACC/AHA — American College of Cardiology/American Heart Association.
Таблица 2
Результаты КАГ пациентов, включенных в исследование
|
Показатель, n (%) |
n=236 |
|
Тип коронарного кровоснабжения |
|
|
Правый |
179 (75,9) |
|
Левый |
26 (11,0) |
|
Сбалансированный |
31 (13,1) |
|
ИОА |
|
|
ПМЖВ |
104 (44,1) |
|
ДВ |
1 (0,4) |
|
ПВ |
3 (1,3) |
|
ОВ |
39 (16,5) |
|
ВТК |
24 (10,2) |
|
ПКА |
65 (27,5) |
|
SYNTAX Score, балл, Me [ Q25; Q75] |
8,0 [ 5,0; 13,0] |
Примечание: ВТК — ветвь тупого края, ДВ — диагональная ветвь, ИОА — инфаркт-ответственная артерия, ОВ — огибающая ветвь, ПВ — промежуточная ветвь, ПКА — правая коронарная артерия, ПМЖВ — передняя межжелудочковая ветвь.
Для дальнейшего исследования пациенты были разделены на 2 группы: в 1 группу вошло 166 пациентов с признаками осложненного атеросклеротического поражения (ACC/AHA тип В-С), во 2 группу — 70 пациентов без признаков осложненного поражения (ACC/AHA тип А).
Клинико-анамнестическая характеристика пациентов в исследуемых группах представлена в таблице 3. По основным изученным характеристикам, анамнестическим данным и клиническому статусу пациенты обеих групп оказались сопоставимы (p>0,05). Среди пациентов 1 группы отмечалась статистически значимо бóльшая доля курильщиков по сравнению со 2 группой (р=0,07).
Таблица 3
Клинико-анамнестическая характеристика пациентов по группам
|
Показатель |
1 группа (тип В-С ACC/AHA) (n=166) |
2 группа (тип A ACC/AHA) (n=70) |
p |
|
Мужской пол, n (%) |
111 (66,9) |
47 (67,1) |
0,97 |
|
Возраст, лет, Me [ Q25; Q75] |
65,1 [ 58; 72] |
64,9 [ 56,3; 74,8] |
0,97 |
|
ИМТ, кг/м², Me [ Q25; Q75] |
28,5 [ 25,7; 30,4] |
28,8 [ 25,3; 30,7] |
0,58 |
|
Курение, n (%) |
47 (28,3) |
12 (17,1) |
0,07 |
|
Артериальная гипертензия, n (%) |
165 (99,4) |
70 (100) |
0,52 |
|
Стенокардия напряжения в анамнезе, n (%) |
43 (25,9) |
22 (31,4) |
0,39 |
|
ПИКС, n (%) |
41 (24,7) |
11 (15,7) |
0,13 |
|
ЧКВ в анамнезе, n (%) |
18 (10,8) |
11 (15,7) |
0,30 |
|
АКШ в анамнезе, n (%) |
5 (3,0) |
0 |
0,14 |
|
Дислипидемия, n (%) |
32 (19,3) |
17 (24,3) |
0,39 |
|
Сахарный диабет любого типа, n (%) |
47 (28,3) |
13 (18,6) |
0,12 |
|
Систолическое АД при поступлении, мм рт.ст., Me [ Q25; Q75] |
137,5 [ 130,0; 150,0] |
140,0 [ 125,8; 150,0] |
0,75 |
|
Диастолическое АД при поступлении, мм рт.ст., Me [ Q25; Q75] |
80,0 [ 75,0; 90,0] |
80,0 [ 80,0; 90,0] |
0,94 |
|
ОСН при поступлении, n (%): — Killip I — Killip II — Killip III-IV |
123 (74,1) 30 (18,1) 13 (7,8) |
58 (82,9) 7 (10) 5 (7,1) |
0,01 |
|
GRACE, балл, Me [ Q25; Q75] |
108,0 [ 88,0; 128,0] |
106,2 [ 83,3; 129,8] |
0,72 |
|
TIMI-UA/NSTEMI, балл, Me [ Q25; Q75] |
2,6 [ 2,0; 3,0] |
2,5 [ 2,0; 3,0] |
0,59 |
Примечание: АД — артериальное давление, АКШ — аортокоронарное шунтирование, ВТК — ветвь тупого края, ДВ — диагональная ветвь, ИМТ — индекс массы тела, ОВ — огибающая ветвь, ОСН — острая сердечная недостаточность, ПВ — промежуточная ветвь, ПИКС — постинфарктный кардиосклероз, ПКА — правая коронарная артерия, ПМЖВ — передняя межжелудочковая ветвь, ACC/AHA — American College of Cardiology/American Heart Association, GRACE — Global Registry of Acute Coronary Events, TIMI-UA/NSTEMI — Thrombolysis In Myocardial Infarction Risk Score for Unstable Angine/Non-ST-segment elevation myocardial infarction.
Медианный балл по шкале GRACE 1.0 составил 108,0 [ 88,0; 128,0] и 106,2 [ 83,3; 129,8] баллов в 1 и 2 группах, соответственно (p=0,72). Результаты оценки по шкале TIMI-UA/NSTEMI в исследуемых группах также оказались сопоставимы (p=0,59).
Результаты инструментальных исследований пациентов представлены в таблице 4. Передняя локализация ИМ по данным ЭКГ преобладала в обеих группах. Согласно результатам ЭхоКГ, показатели фракции выброса левого желудочка были статистически значимо ниже в 1 группе пациентов по сравнению со 2 группой (48,6±9,9 vs 52,4±5,9%, p=0,02). Уровень систолического давления в легочной артерии составлял 35,3 [ 30; 39] мм рт.ст. в 1 группе и 31,0 [ 26,3; 32,8] мм рт.ст. во 2 группе (p<0,01).
Таблица 4
Результаты инструментальных исследований пациентов по группам
|
Показатель |
1 группа (тип В-С ACC/AHA) (n=166) |
2 группа (тип A ACC/AHA) (n=70) |
p |
|
ЭКГ |
|||
|
ЧСС, уд./мин, Me [ Q25; Q75] |
79,6 [ 68; 88,8] |
78,3 [ 70; 80,8] |
0,61 |
|
Локализация ИМбпST, n (%): — Передняя — Нижняя — Боковая |
74 (44,6) 47 (28,3) 45 (27,1) |
36 (51,4) 17 (24,3) 17 (24,3) |
0,63 |
|
Депрессия сегмента ST, n (%) |
71 (42,8) |
25 (35,7) |
0,31 |
|
Отрицательный зубец T, n (%) |
60 (36,1) |
34 (48,6) |
0,07 |
|
БЛНПГ (известная ранее), n (%) |
15 (9,0) |
9 (12,9) |
0,38 |
|
ЭхоКГ |
|||
|
Фракция выброса левого желудочка, %, Me [ Q25; Q75] |
48,6 [ 40; 57,5] |
52,4 [ 46,5; 60] |
0,02 |
|
Степень нарушения сократимости, n (%): — Нормокинез — Гипокинез — Акинез — Дискинез |
27 (21,3) 57 (44,9) 40 (31,5) 3 (2,4) |
16 (29,1) 23 (41,8) 16 (29,1) 0 |
0,48 |
|
КДР ЛЖ, мм, Me [ Q25; Q75] |
52,6 [ 48; 55,8] |
50,4 [ 46; 55] |
0,05 |
|
КСР ЛЖ, мм, Me [ Q25; Q75] |
39,0 [ 33; 43] |
35,8 [ 31; 40] |
0,02 |
|
Толщина МЖП, мм, Me [ Q25; Q75] |
12,1 [ 11; 13] |
12,0 [ 11; 13] |
0,92 |
|
Толщина ЗСЛЖ, мм, Me [ Q25; Q75] |
10,6 [ 9; 12] |
10,8 [ 10; 11,8] |
0,47 |
|
СДЛА, мм рт.ст., Me [ Q25; Q75] |
35,3 [ 30; 39] |
31,0 [ 26,3; 32,8] |
<0,01 |
Примечание: БЛНПГ — блокада левой ножки пучка Гиса, ЗСЛЖ — задняя стенка левого желудочка, ИМбпST — инфаркт миокарда без подъема сегмента ST, КДР ЛЖ — конечный диастолический размер левого желудочка, КСР ЛЖ — конечный систолический размер левого желудочка, МЖП — межжелудочковая перегородка, СДЛА — систолическое давление легочной артерии ЧСС — частота сердечных сокращений, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография, ACC/AHA — American College of Cardiology/American Heart Association.
Результаты лабораторной диагностики представлены в таблице 5. По уровню Tn I при поступлении группы оказались сопоставимы (128,1±35,8 и 52,3±13,0 нг/мл, p=0,14). Биохимические маркеры системного воспаления (количество лейкоцитов, уровни вчСРБ и фибриногена) были статистически значимо выше в 1 группе пациентов по сравнению со 2 группой (p≤0,05).
Таблица 5
Результаты лабораторных исследований пациентов по группам
|
Показатель, Me [ Q25; Q75] |
1 группа (тип В-С ACC/AHA) (n=166) |
2 группа (тип A ACC/AHA) (n=70) |
p |
|
Общий анализ крови |
|||
|
Эритроциты, 10¹²/л |
4,51 [ 4,2; 4,8] |
4,49 [ 4,2; 4,7] |
0,80 |
|
Гемоглобин, г/л |
137,9 [ 127; 150] |
135,2 [ 124,5; 147] |
0,41 |
|
Тромбоциты, 10⁹/л |
242,4 [ 196; 271] |
279,0 [ 212,8; 338,8] |
0,02 |
|
Лейкоциты, 10⁹/л |
8,9 [ 7,1; 10,4] |
7,4 [ 6,1; 9,4] |
0,05 |
|
Моноциты, % |
5,3 [ 3,4; 6,8] |
4,8 [ 3,9; 5,2] |
0,32 |
|
Лимфоциты, % |
25,6 [ 20,1; 32,2] |
24,9 [ 21; 31,2] |
0,91 |
|
СОЭ, мм/ч |
16,0 [ 10; 20] |
15,2 [ 7; 20] |
0,92 |
|
Биохимический анализ крови |
|||
|
Общий белок, г/л |
68,4 [ 64; 73] |
69,2 [ 64; 73,3] |
0,39 |
|
вчСРБ, мг/л |
39,8 [ 11,1; 41] |
24,7 [ 7,8; 28] |
0,04 |
|
Креатинин, мкмоль/л |
99,6 [ 81; 111] |
97,2 [ 87,5; 104] |
0,98 |
|
Мочевина, ммоль/л |
6,5 [ 5; 7,2] |
5,9 [ 4,7; 7,2] |
0,30 |
|
Общий билирубин, мкмоль/л |
14,4 [ 9,1; 16] |
15,6 [ 9,7; 19,3] |
0,35 |
|
Общий холестерин, ммоль/л |
5,1 [ 3,9; 6,2] |
5,2 [ 4,2; 6,1] |
0,69 |
|
Глюкоза, ммоль/л |
7,4 [ 5,1; 8,2] |
6,1 [ 4,9; 6,6] |
0,09 |
|
КФК, МЕ/л |
183 [ 138; 263] |
146 [ 89; 254,5] |
0,46 |
|
КФК-МВ, МЕ/л |
21,5 [ 15,5; 23,5] |
26,1 [ 23,5; 28,8] |
0,04 |
|
СКФ, мл/мин |
61,5 [ 44,1; 74] |
68,7 [ 54,1; 78] |
0,21 |
|
Тропонин I при поступлении, нг/мл |
128,1 [ 54; 478,3] |
52,3 [ 21; 268] |
0,14 |
|
Коагулограмма |
|||
|
АЧТВ, с |
31,8 [ 26,1; 37,5] |
27,8 [ 20,9; 34,8] |
0,47 |
|
ПТИ, % |
87,3 [ 66,8; 112,2] |
88,2 [ 61,5; 109,6] |
0,90 |
|
МНО |
1,2 [ 0,95; 1,3] |
1,1 [ 0,96; 1,3] |
0,93 |
|
Фибриноген, г/л |
3,7 [ 2,6; 5,9] |
2,8 [ 1,8; 3,0] |
0,03 |
Примечание: АЧТВ — активированное частичное тромбопластиновое время, вчСРБ — С-реактивный белок, определенный высокочувствительным способом, КФК — креатинфосфокиназа, КФК-МВ — миокардиальный изофермент креатинфосфокиназы, МНО — международное нормализованное отношение, ПТИ — протромбиновый индекс, СКФ — скорость клубочковой фильтрации, СОЭ — скорость оседания тромбоцитов, ACC/AHA — American College of Cardiology/American Heart Association.
По данным КАГ в обеих группах преобладал правый тип коронарного кровоснабжения. Поражение передней межжелудочковой ветви являлось инфаркт-ответственным у 40,9% (n=67) пациентов 1 группы и у 52,9% (n=37) пациентов 2 группы (p=0,43).
Средний балл по шкале SYNTAX Score был статистически значимо выше у пациентов 1 группы, по сравнению с пациентами 2 группы (11,1 [ 5,0; 15,0] vs 8,4 [ 5,0; 11,5] баллов, p=0,02). По частоте развития периоперационных осложнений группы оказались сопоставимы (p>0,05). Результаты КАГ и течение операционного периода представлены в таблице 6.
Таблица 6
Результаты КАГ и течение операционного периода у пациентов по группам
|
Показатель, n (%) |
Тип В-С ACC/AHA (n=166) |
Тип A ACC/AHA (n=70) |
p |
|
Тип коронарного кровоснабжения |
|||
|
Правый |
126 (75,9) |
53 (75,7) |
0,99 |
|
Левый |
22 (13,3) |
9 (12,9) |
|
|
Сбалансированный |
18 (10,8) |
8 (11,4) |
|
|
Поражение КА |
|||
|
ИОА |
|||
|
ПМЖВ |
67 (40,9) |
37 (52,9) |
0,43 |
|
ДВ |
1 (0,6) |
0 |
|
|
ПВ |
3 (1,8) |
0 |
|
|
ОВ |
28 (17,1) |
9 (12,9) |
|
|
ВТК |
16 (9,8) |
8 (11,4) |
|
|
ПКА |
49 (29,9) |
16 (22,9) |
|
|
SYNTAX Score, балл, Me [ Q25; Q75] |
11,1 [ 5,0; 15,0] |
8,4 [ 5,0; 11,5] |
0,02 |
|
Периоперационные осложнения |
|||
|
Феномен No/Slow-reflow |
8 (4,8) |
4 (5,7) |
0,78 |
|
Использование ингибиторов IIb/IIIa |
2 (1,2) |
1 (1,4) |
0,89 |
Примечание: ВТК — ветвь тупого края, ДВ — диагональная ветвь, ИОА — инфаркт-ответственная артерия, КА — коронарная артерия, КАГ — коронароангиография, ОВ — огибающая ветвь, ПВ — промежуточная ветвь, ПКА — правая коронарная артерия, ПМЖВ — передняя межжелудочковая ветвь, ACC/AHA — American College of Cardiology/American Heart Association.
Средний срок госпитализации составил 6,0 [ 5,0; 7,0] дней в 1 группе и 6,0 [ 5,0; 7,0] дней во 2 группе (p=0,95). По частоте летального исхода на госпитальном этапе группы оказались сопоставимы — 4,2 и 2,9%, соответственно (p=0,62).
В полиноминальной модели бинарной логистической регрессии был проведен анализ факторов, ассоциированных с поражением КА типа В-С. Уровни вчСРБ и фибриногена статистически значимо ассоциировались с вероятностью наличия поражения типа В-С — отношение шансов (OR — odds ratio) 1,19; 95% доверительный интервал (ДИ): 1,12-1,27 (р<0,001) и OR 7,96; 95% ДИ: 4,33-14,62 (р<0,001), значение R² Кокса и Снелла 0,499, Нэйджелкерка 0,709. С целью оценки прогнозных характеристик показателей и поиска их отрезных точек проведен ROC-анализ. AUC для показателя вчСРБ составила 0,816 (95% ДИ: 0,761-0,863, p<0,001) (рисунок 2). Значение индекса Юдена J (=0,59) позволило определить оптимальный пороговый критерий ≥26,7 мг/л, при котором чувствительность теста составила 66,3%, а специфичность — 92,9%.
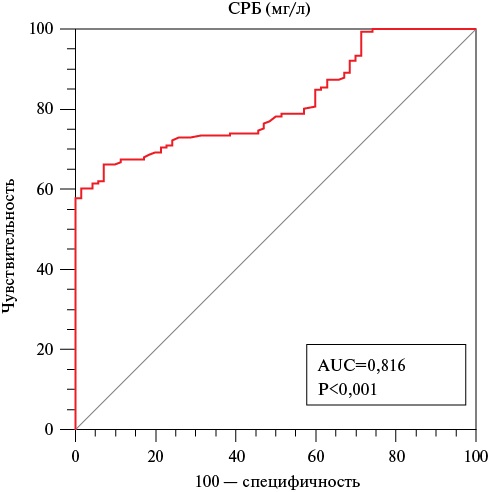
Рис. 2 ROC-кривая, характеризующая ассоциацию уровня вчСРБ с вероятностью наличия поражения ИОА типа В-С.
Примечание: ИОА — инфаркт-ответственная артерия, вчСРБ — С-реактивный белок, определенный высокочувствительным способом, AUC — Area Under the ROC Curve (площадь под ROC-кривой), р — уровень значимости.
AUC для уровня фибриногена составила 0,861 (95% ДИ: 0,810-0,902, p<0,001) (рисунок 3). Значение индекса Юдена J (=0,60) позволило определить оптимальный пороговый критерий ≥3,1 г/л, при котором чувствительность теста составила 72,9%, а специфичность — 87,1%.
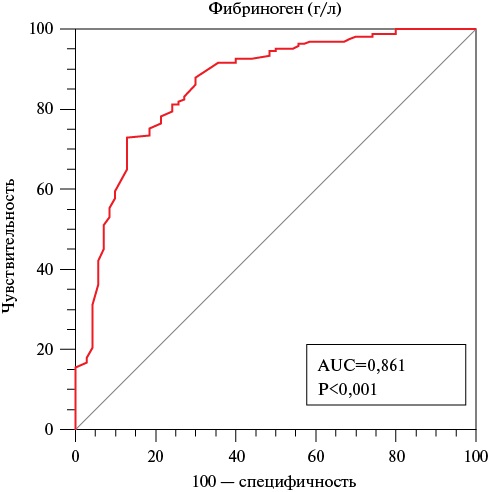
Рис. 3 ROC-кривая, характеризующая ассоциацию уровня фибриногена с вероятностью наличия поражения ИОА типа В-С.
Примечание: ИОА — инфаркт-ответственная артерия, AUC — Area Under the ROC Curve (площадь под ROC-кривой), р — уровень значимости.
Обсуждение
Системное воспаление способствует не только инициации и прогрессированию атеросклеротического процесса, но может приводить к дестабилизации и разрыву АСБ [9][22]. Установлено, что повышение уровня биохимических маркеров воспаления в плазме крови характерно для пациентов с ИМбпST [23]. Так, по мнению Nunez J, et al. (2006), повышение уровня лейкоцитов в данной группе пациентов обусловлено запуском системного воспалительного каскада в ответ на развивающиеся некротические изменения миокардиальной ткани [24]. При этом в исследовании Dharma S, et al. (2015) риск развития MACE (major adverse cardiovascular events, основные неблагоприятные сердечно-сосудистые события) на госпитальном этапе при ИМбпST был в 3 раза выше у пациентов с лейкоцитозом: HR (hazard ratio, отношение рисков) 3,178, 95% ДИ: 1,81-5,57, p<0,001) [25].
Схожие данные были получены Циванюк М. М. и др. (2022), проанализировавших лабораторные и ангиографические данные 600 пациентов с ОКСбпST и разработавших прогностический алгоритм выраженности атеросклеротического ремоделирования КА у пациентов с ОКСбпST до проведения инвазивной КАГ. У пациентов с повышением уровня лейкоцитов >10×10⁹/л вероятность визуализации гемодинамически значимого стенозирующего поражения КА возрастала в 2 раза (OR 2,2; 95% ДИ: 1,3-3,7, p=0,004) [26]. Полученные в настоящем исследовании данные подтвердили связь между повышенным уровнем лейкоцитов (>9×10⁹/л) и осложненным поражением коронарного русла (типы В и С по классификации ACC/AHA). Медианный уровень лейкоцитов в группе с осложненным поражением был на 20% выше, чем в группе с неосложненным поражением, что статистически значимо (p≤0,05). Данные результаты согласуются с выводами зарубежных и отечественных исследований, демонстрирующих роль лейкоцитоза как маркера системного воспаления, связанного с прогрессированием и дестабилизацией АСБ [25][26].
Взаимосвязь между содержанием в крови фибриногена и выраженностью атеросклероза была отмечена в работе Ковш Е. В. и др. (2007), где уровень фибриногена был статистически значимо выше у пациентов с ИМ, а по данным многофакторного анализа повышение данного показателя значимо ассоциировалось с неблагоприятным течением ИБС (β — 0,38±0,147, р=0,02) [27]. Схожие данные были опубликованы в отчете Erdogan G, et al. (2021), где на основании данных 330 пациентов с ИМбпST было установлено, что увеличение соотношения уровня фибриногена к уровню альбумина являлось независимым предиктором большого объема поражения коронарного русла, оцениваемого по шкале SYNTAX Score (OR 1,478; 95% ДИ: 1,089-2,133, p=0,002) [28]. Изменение показателя фибриногена плазмы крови в зависимости от характера атеросклеротического поражения также было продемонстрировано в работе Стахнёвой Е. М. и др. (2022). В результате протеомного анализа 40 образцов крови пациентов с верифицированным коронарным атеросклерозом было установлено, что у пациентов с нестабильной АСБ, подтвержденной гистологически, уровень фибриногена был в 2,5 раза выше по сравнению с пациентами со стабильным поражением [29]. Gao X, et al. (2017) отметили прогностическую значимость уровня фибриногена у пациентов с ИМ и возрастом <35 лет и выраженностью коронарного атеросклероза по классификации Gensini (r=0,242, p<0,001). Повышение уровня фибриногена выше нормальных значений в 2 раза увеличивало риск визуализации тяжелого поражения КА по Gensini (OR 2,173; 95% ДИ: 1,011-4,670, p=0,047) [30]. В нашем исследовании был установлен уровень фибриногена >3,1 г/л, ассоциированный с осложненными типами поражений КА. Полученные результаты сопоставимы с данными, представленными в отчете Gao X, et al. (2017), где уровень фибриногена >3,475 г/л значимо ассоциировался с тяжестью поражения коронарного русла (AUC 0,656) [30]. Однако в исследовании Wang J, et al. (2019) по данным ОКТ (оптическая когерентная томография)-визуализации 154 пациентов с ИБС взаимосвязи между уровнем сывороточного фибриногена и уязвимостью коронарной АСБ (визуализация тонкой капсулы фиброатеромы или надрыва покрышки АСБ) выявлено не было [31].
В настоящее время установлена значимая ассоциация уровня вчСРБ с проатерогенным и провоспалительным эффектами, начиная с момента образования АСБ вплоть до развития гемодинамически значимых атеросклеротических поражений [32]. Кузьмичев К. Ю. и др. (2018) указывают, что уровень вчСРБ коррелирует со степенью выраженности коронарного атеросклероза [33]. В исследовании Mustafic C, et al. (2022), при сравнении уровня вчСРБ у пациентов со стабильной формой ИБС и пациентов с ИМбпST было отмечено, что данный показатель был выше нормальных значений в обеих группах, однако более высокий уровень отмечался в группе пациентов с ИМ (10,3±12,1 vs 2,3±1,9 мг/л, p=0,002) [22]. По мнению Ablij H, et al. (2002) на основании уровня вчСРБ можно оценить степень уязвимости АСБ: чем выше концентрация данного белка, тем выше риск разрыва АСБ, в особенности АСБ с осложненной морфологией [34]. В нашем исследовании также была подтверждена связь уровня вчСРБ с осложненным поражением коронарного русла.
Основными ограничениями настоящего исследования являлись отсутствие верификации осложненного типа поражения с помощью внутрисосудистой визуализации, относительно небольшой объем выборки пациентов, а также потенциальная недооценка вклада "третьих" переменных в формирование связи между анализируемыми показателями и тяжестью поражения КА, вследствие ретроспективного характера исследования. Однако несмотря на то, что выбор классификации ACC/AHA для разделения исследуемой когорты пациентов на группы был продиктован отсутствием данных внутрисосудистой визуализации, полученные результаты были интерпретированы с учетом современных подходов к морфологии АСБ.
Заключение
Пациенты с ИМбпST и осложненным поражением коронарного русла характеризуются более выраженным уровнем системного воспаления. По результатам лабораторной диагностики значимые ассоциации с поражениями типа В и С установлены для таких показателей, как вчСРБ и фибриноген плазмы. Дальнейшее изучение взаимосвязей морфологии АСБ и биохимических показателей плазмы крови позволит оценить вероятность развития дестабилизации АСБ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Классификация атеросклеротического поражения ACC/AHA. http://interventionalradiology.ru/classifications/classification-coronary-arteries/31-classification-acc-aha.html. (Дата обращения: 24.10.2024г).
2. Шкала Grace — онлайн-калькулятор. https://medsoftpro.ru/kalkulyatory/grace-scale.html. (Дата обращения: 24.10.2024г).
3. Шкала TIMI UA/NSTEMI для нестабильной стенокардии и инфаркта миокарда без элевации сегмента ST — онлайн-калькулятор. https://clincasequest.org/timi-ua-nstemi. (Дата обращения: 24.10.2024г).
Список литературы
1. Timmis A, Townsend N, Gale CP, et al. European Society of Cardiology: cardiovascular disease statistics 2019. Eur Heart J. 2020;41(1):12-85. doi:10.1093/eurheartj/ehz859.
2. Барбараш О. Л., Комаров А. Л., Панченко Е. П., и др. Евразийские клинические рекомендации по диагностике и лечению острого коронарного синдрома без подъема сегмента ST (ОКСбпST) (2021). Евразийский кардиологический журнал. 2021;4:6-59. doi:10.38109/2225-1685-2021-4-6-59.
3. Глущен¬ко В. А., Ирклиенко Е. К. Сердечно-¬сосудистая заболеваемость — одна из важнейших проблем здравоохранения. Медицина и организация здравоохранения. 2019;4(1):56-63. EDN KNGYDV.
4. Стаценко И. Ю., Сергеев В. С., Стаценко В. И. Медикаментозная терапия наиболее частых осложнений при остром коронарном синдроме с подъемом сегмента ST. Лекарственный вестник. 2020;14(4):3-8. EDN YBVTOR.
5. Gulati M, Levy PD, Mukherjee D, et al. 2021 AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR Guideline for the Evaluation and Diagnosis of Chest Pain: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2021;78(22):2218-61. doi:10.1016/j.jacc.2021.07.052.
6. Миленькин Б. И., Миленькина С. Г., Гаврил¬ко А. Д. и др. Кардиоатлас. Клинические случаи острого коронарного синдрома. М.: Умный доктор, 2022. с. 152. ISBN: 978-5-6043769-6-6.
7. Митьковская Н. П., Ласкина О. В., Тифи П. Нестабильная стенокардия или нестабильные коронарные синдромы? Неотложная кардиология и кардиоваскулярные риски. 2020;4(2):944-77. doi:10.51922/2616-633X.2020.4.2.944.
8. Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. New Engl J Med. 2005;352(16):1685-95. doi:10.1056/NEJMra043430.
9. Нозадзе Д. Н., Бурмистенко О. С., Семенова А. Е. и др. Инструментальные и лабораторные методы в выявлении нестабильных атеросклеротических бляшек. Атеросклероз и дислипидемии. 2013;3(12):4-10. EDN QYVGIJ.
10. Цибулькин Н. А., Тухватуллина Г. В., Цибулькина В. Н. и др. Воспалительные механизмы в патогенезе атеросклероза. Практическая медицина. 2016;2(4(96)):165-9. EDN WKBHFJ.
11. Helfand M, Buckley DI, Freeman M, et al. Emerging risk factors for coronary heart disease: a summary of systematic reviews con¬ducted for the US Preventive Services Task Force. Ann Intern Med. 2009;151(7):496-507. doi:10.7326/0003-4819-151-7-200910060-00010.
12. Surma S, Banach M. Fibrinogen and Atherosclerotic Cardiovascular Diseases-Review of the Literature and Clinical Studies. Int J Mol Sci. 2021;23(1):193. doi:10.3390/ijms23010193.
13. Астрейко А. В. Степень поражения коронарных артерий у пациентов с ишемической болезнью сердца: причинно--следственные связи. Медицинские новости. 2020;6(309):9-12. EDN IDLKDJ.
14. Kamińska J, Koper OM, Siedlecka-Czykier E, et al. The utility of in-flammation and platelet biomarkers in patients with acute co¬ronary syndromes. Saudi J Biol Sci. 2018;25(7):1263-71. doi:10.1016/j.sjbs.2016.10.015.
15. Чаулин А. М., Дупляков Д. В. Биомаркеры острого инфаркта миокарда: диагностическая и прогностическая ценность. Часть 2 (обзор литературы). Клиническая практика. 2020;11(4):70-82. doi:10.17816/clinpract48893.
16. Ковальская А. Н., Дупляков Д. В. Биомаркеры в оценке уязвимости атеросклеротических бляшек: нарративный обзор. Рациональная фармакотерапия в кардиологии. 2023;19(3):282-8. doi:10.20996/1819-6446-2023-2878.
17. Ryan TJ. Guidelines for percutaneous transluminal coronary angioplasty: A report of the American College of Cardiology/American Heart Association Task Force on Assessment of Diagnostic and Therapeutic Cardiovascular Procedures (Subcommittee on Percutaneous Transluminal Coronary Angioplasty). J Am Coll Cardiol. 1988;12(2):529-45. doi:10.1016/0735-1097(88)90431-7.
18. Worrall-Carter L, McEvedy S, Kuhn L, et al. Systematic Review and Meta-analyses Investigating Whether Risk Stratification Explains Lower Rates of Coronary Angiography Among Women With Non-ST-Segment Elevation Acute Coronary Syndrome. J Cardiovasc Nurs. 2017;32(2):112-24. doi:10.1097/JCN.0000000000000300.
19. Bing R, Goodman SG, Yan AT, et al. Use of clinical risk stratification in non-ST elevation acute coronary syndromes: an analysis from the CONCORDANCE registry. Eur Heart J Qual Care Clin Outcomes. 2018;4(4):309-17. doi:10.1093/ehjqcco/qcy002.
20. Azzahhafi J, van der Sangen N, Chan Pin Yin D, et al. TCT-314 The Risk-Treatment Paradox in Acute Coronary Syndrome Patients: Insights From The FORCE-ACS Registry. J Am Coll Cardiol. 2021;78(19S):B128-9. doi:10.1016/j.jacc.2021.09.1167.
21. Барбараш О. Л., Дупляков Д. В., Затейщиков Д. А. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(4):4449. doi:10.15829/1560-4071-2021-4449.
22. Mustafic S, Ibralic AM, Loncar D. Association of Inflammatory and Hemostatic Parameters With Values of High Sensitive Troponin in Patients With Acute Coronary Syndrome. Med Arch. 2022;76(2):84-9. doi:10.5455/medarh.2022.76.84-89.
23. Eggers KM, Lindahl B. Prognostic biomarkers in acute coronary syndromes: risk stratification beyond cardiac troponins. Curr Cardiol Rep. 2017;19(4):29. doi:10.1007/s11886-017-0840-3.
24. Núñez J, Núñez E, Sanchis J, et al. Prognostic value of leukocytosis in acute coronary syndromes: the cinderella of the inflammatory markers. Curr Med Chem. 2006;13(18):2113-8. doi:10.2174/092986706777935221.
25. Dharma S, Hapsari R, Siswanto BB, et al. Blood leukocyte count on admission predicts cardiovascular events in patients with acute non-ST elevation myocardial infarction. Int J Angiol. 2015;24(2):127-32. doi:10.1055/s-0035-1544178.
26. Циванюк М. М., Гельцер Б. И., Шахгельдян К. И. и др. Показатели клинического анализа крови, липидного спектра и их соотношений в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема ST. Российский кардиологический журнал. 2022;27(8):5079. doi:10.15829/1560-4071-2022-5079.
27. Ковш Е. В., Лешкевич К. Ф., Де¬нисевич Т. Л. Варианты течения ишемической болезни сердца и факторы его определяющие. Проблемы здоровья и экологии. 2007;3:27-32. doi:10.51523/2708-6011.2007-4-3-5.
28. Erdoğan G, Arslan U, Yenercağ M, et al. Relationship Between the Fibrinogen-to-Albumin Ratio and SYNTAX Score in Patients with Non--St-Elevation Myocardial Infarction. Rev Invest Clín. 2021;73(3):182-9. doi:10.24875/RIC.20000534.
29. Стахнёва Е. М., Каштанова Е. В., Полонская Я. В. и др. Изучение ассоциаций белков в крови с наличием нестабильных атеросклеротических бляшек в коронарных артериях методом количественной протеомики. Бюллетень сибирской медицины. 2022;21(4):121-9. doi:10.20538/1682-0363-2022-4-121-129.
30. Gao X, Zhou B, Zhang M, et al. Association between fibrinogen level and the severity of coronary stenosis in 418 male patients with myocardial infarction younger than 35 years old. Oncotarget. 2017;8(46):81361-8. doi:10.18632/oncotarget.18578.
31. Wang J, Jia L, Li X, et al. New Insights into the Association between Fibrinogen and Coronary Atherosclerotic Plaque Vulnerability: An Intravascular Optical Coherence Tomography Study. Cardiovasc Ther. 2019;1:8563717. doi:10.1155/2019/8563717.
32. Damen SAJ, Cramer GE, Dieker HJ, et al. A multi-site coro¬nary sampling study on CRP in non-STEMI: Novel insights into the inflammatory process in acute coronary syndromes. Atherosclerosis. 2018;278:117-23. doi:10.1016/j.atherosclerosis.2018.09.024.
33. Кузьмичев К. Ю., Кузьмичев Б. Ю., Липницкая Е. А. и др. Маркеры воспаления при остром коронарном синдроме. Астрахань: Астраханский государственный медицинский университет, 2018. с. 52. ISBN: 978-5-4424-0363-3.
34. Ablij H, Meinders A. C-reactive protein: history and revival. Eur J In-tern Med. 2002;13(7):412-22. doi:10.1016/s0953-6205(02)00132-2.
Об авторах
А. В. СтрелковаРоссия
М.н.с. лаборатории микроциркуляции и регионарного кровообращения отдела фундаментальных и прикладных аспектов ожирения ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» Минздрава России; врач по рентгенэндоваскулярным диагностике и лечению ГБУЗ МО Одинцовская областная больница
Москва, Одинцово
М. Г. Чащин
Россия
к.м.н., зав. отделением Липидная клиника
Москва
А. Ю. Горшков
Россия
К.м.н., руководитель лаборатории микроциркуляции и регионарного кровообращения отдела фундаментальных и прикладных аспектов ожирения, заместитель директора по научной и амбулаторно-поликлинической работе
Москва
А. В. Юрин
Россия
Врач по рентгенэндоваскулярным диагностике и лечению
Одинцово
Д. В. Шабанов
Россия
Врач по рентгенэндоваскулярным диагностике и лечению
Одинцово
О. М. Драпкина
Россия
Д.м.н., профессор, академик РАН, директор
Москва
Что известно о предмете исследования?
- У пациентов с инфарктом миокарда без подъема сегмента ST отмечается увеличение уровней лабораторных маркеров воспаления.
- Показатели летальности в данной группе пациентов значительно выше при обнаружении несоответствия рассчитанного риска неблагоприятного исхода по шкале GRACE (Global Registry of Acute Coronary Events) с тяжестью поражения коронарного русла.
Что добавляют результаты исследования?
- Выявлен более выраженный уровень системного воспаления у пациентов с инфарктом миокарда без подъема сегмента ST и осложненным поражением инфаркт-ответственной артерии.
- Установлены значимые ассоциации между уровнями фибриногена плазмы и С-реактивного белка и наличием сложной морфологии атеросклеротической бляшки в инфаркт-ответственном сосуде.
Рецензия
Для цитирования:
Стрелкова А.В., Чащин М.Г., Горшков А.Ю., Юрин А.В., Шабанов Д.В., Драпкина О.М. Лабораторные маркеры осложненного атеросклеротического поражения коронарных артерий у пациентов с инфарктом миокарда без подъема сегмента ST. Кардиоваскулярная терапия и профилактика. 2025;24(3):4253. https://doi.org/10.15829/1728-8800-2025-4253. EDN: RXGTGE
For citation:
Strelkova A.V., Chashchin M.G., Gorshkov A.Yu., Yurin A.V., Shabanov D.V., Drapkina O.M. Laboratory markers of complicated coronary atherosclerosis in patients with non-ST-elevation myocardial infarction. Cardiovascular Therapy and Prevention. 2025;24(3):4253. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4253. EDN: RXGTGE
JATS XML

























































