Перейти к:
Анализ показателей артериальной жесткости у больных раком молочной железы на фоне комбинированной антрациклин-содержащей химиотерапии
https://doi.org/10.15829/1728-8800-2025-4272
EDN: ICJVWB
Аннотация
Цель. Выявление возможных изменений показателей артериальной жесткости (АЖ) и анализ их характера у больных раком молочной железы (РМЖ) на фоне комбинированной антрациклин-содержащей химиотерапии (АСХТ).
Материал и методы. 50 женщин в возрасте 46,7±7 лет с верифицированным РМЖ, имеющих показания к комбинированной АСХТ, проходили оценку АЖ (каротидно-феморальная скорость пульсовой волны — кфСПВ (м/с); сердечно-лодыжечный сосудистый индекс; сердечно-лодыжечная скорость пульсовой волны (м/с); индекс жесткости β, новые отечественные индексы жесткости Stelari и haStart) на 4-х визитах: исходно до АСХТ, через 8-12, 20-24 и 48 нед. от начала АСХТ.
Результаты. Выявлено достоверное снижение кфСПВ на визите 2 (7,48±1,51, p<0,05) и визите 3 (8,34±1,66, p<0,05) с дальнейшим статистически значимым ростом на визите 4 при сравнении с исходными данными. Аналогичная достоверная динамика продемонстрирована и для индекса Stelari. Динамика показателя — сердечно-лодыжечный сосудистый индекс — характеризовалась его снижением на визитах 2 и 3 с достоверным отличием от значений на визитах 1 и 4. Достоверных изменений индексов жесткости β и haStart на протяжении периода наблюдения не получено.
Заключение. У больных РМЖ, перенесших комбинированную АСХТ, выявлено увеличение кфСПВ на 0,95 м/с в год, что свидетельствует об ускоренном старении сосудистой стенки и возможном увеличении сердечно-сосудистого риска у данной категории больных.
Ключевые слова
Для цитирования:
Медведева Е.Г., Ющук Е.Н., Иванова С.В., Филоненко Д.А., Жукова Л.Г., Трофименко О.С. Анализ показателей артериальной жесткости у больных раком молочной железы на фоне комбинированной антрациклин-содержащей химиотерапии. Кардиоваскулярная терапия и профилактика. 2025;24(4):4272. https://doi.org/10.15829/1728-8800-2025-4272. EDN: ICJVWB
For citation:
Medvedeva E.G., Yushchuk E.N., Ivanova S.V., Filonenko D.A., Zhukova L.G., Trofimenko O.S. Analysis of arterial stiffness parameters in breast cancer patients undergoing combination anthracycline-containing chemotherapy. Cardiovascular Therapy and Prevention. 2025;24(4):4272. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4272. EDN: ICJVWB
Введение
Увеличение продолжительности жизни пациенток с диагнозом рак молочной железы (РМЖ) является одним из важнейших достижений медицинского сообщества в противоопухолевой терапии данного заболевания: действительно, РМЖ остается самым часто регистрируемым онкологическим заболеванием женского населения экономически развитых стран [1]. Согласно данным международного агентства по изучению рака (МАИР), РМЖ занимает второе место (11,6%) по частоте выявления среди всех видов рака на 2022г и 4-ое место по смертности (6,9%) среди онкозаболеваний [2]. В РФ ежегодно выявляется >70 тыс. новых случаев РМЖ [1]. Подтверждением повышения эффективности терапии РМЖ и улучшения выживаемости на ее фоне могут являться данные [3], согласно которым отмечается увеличение доли больных РМЖ, состоящих на учете в онкологических учреждениях, в течение ≥5 лет от момента постановки диагноза (от числа состоявших на учете) при сравнении периодов 2013г (58,5%) и 2023г (68,4%), а также позитивный тренд в виде снижения показателя летальности в течение первого года с момента установления диагноза РМЖ: 7,4% в 2013г и 4,4% в 2023г. Несмотря на позитивные тенденции лечения РМЖ, в отдаленном периоде наблюдается проблема сердечно-сосудистых осложнений, ассоциированных с кардио- и васкулотоксичностью применяемой противоопухолевой терапии, в особенности антрациклин-содержащей химиотерапии (АСХТ), которая, несмотря на снижение частоты ее назначений, в 70% случаев входит в неоадъювантные и адъювантные схемы лечения РМЖ [4].
Для регулирования алгоритмов ведения и долгосрочного наблюдения за категорией пациентов, имеющих противоопухолевое лечение в анамнезе, в 2022г Европейским обществом кардиологов (ESC — European Society of Cardiology) совместно с Международным кардио-онкологическим обществом (IC-OS — The International Cardio-Oncology Society) были опубликованы клинические рекомендации, освещающие вопросы диагностики, профилактики и лечения кардиотоксических осложнений противоопухолевого лечения [5]. Кроме определения критериев кардиотоксичности, контроль за которыми должен осуществляться как на фоне лечения, так и после перенесенной химиотерапии (ХТ), было инициировано еще одно направление в оценке сердечно-сосудистого риска данной категории больных — васкулотоксичность. Однако четкие критерии васкулотоксичности в настоящее время не определены. В качестве маркеров поражения сосудистой стенки, в т.ч. васкулотоксических влияний противоопухолевой терапии, могут рассматриваться показатели артериальной жесткости (АЖ), увеличение которых ассоциировано с ростом неблагоприятных сердечно-сосудистых событий [6].
В соответствии с вышеизложенным, целью настоящей работы явилось выявление возможных изменений показателей АЖ и анализ их характера у больных РМЖ на фоне комбинированной АСХТ.
Материал и методы
Исследование является наблюдательным проспективным несравнительным, дизайн одобрен заседанием Межвузовского комитета по этике (протокол № 03-20 от 19.03.2020). Критериями включения в исследование были возраст 30-65 лет, наличие гистологически верифицированного диагноза РМЖ и подписанное добровольное информированное согласие. Критериями невключения были наличие в анамнезе других раннее выявленных онкологических заболеваний, перенесенная ранее ХТ, вторичная (симптоматическая) артериальная гипертензия (АГ), хронические соматические заболевания тяжелого течения и/или в стадии декомпенсации. Критериями исключения являлись отказ от дальнейшего участия в исследовании, выявление в процессе наблюдения любых отдаленных метастазов.
Всем пациенткам, включенным в исследование, была назначена комбинированная АСХТ: 4 курса доксорубицин 60 мг/м2 + циклофосфамид 600 мг/м2 каждые 2-3 нед., затем 12 еженедельных либо 4 введения с интервалом в 3 нед. препарата из группы таксанов (паклитаксел — 33 человека/доцетаксел — 17 человек). Периодичность контрольных визитов для динамического наблюдения определялась в соответствии с получаемыми схемами терапии: визит 1 — включение, до начала ХТ; визит 2 — по окончании 4-х курсов доксорубицина (8-12 нед. от включения); визит 3 — по окончании таксанового компонента (20-24 нед. от включения); визит 4 — через 48 нед. от визита включения. Кроме клинического и лабораторного исследований, проводимых в соответствии с клиническими рекомендациями Минздрава России от 2021г по ведению больных РМЖ1, на каждом из 4-х визитов всем пациентам проводилась оценка АЖ, а также трансторакальная эхокардиография для мониторинга потенциальных кардиотоксических осложнений согласно рекомендациям 2019г [7].
В качестве метода "золотого стандарта" определялась скорость пульсовой волны (СПВ) на каротидно-феморальном сегменте (кфСПВ) (Pulse Trace PWV, Micromedical, Великобритания): параллельно с записью I отведения электрокардиограммы (ЭКГ) последовательно регистрировалась пульсовая волна в течение 10 сек.: в точке проекции общей сонной артерии — уровень нижнего края щитовидного хряща по передней поверхности грудинно-ключично-сосцевидной мышцы с ориентацией датчика по направлению к сердцу, затем в точке проекции бедренной артерии — отступ медиальнее середины паховой складки. Расстояние между точками измерялось сантиметровой лентой и умножалось на коэффициент 0,8 [6], данные вводились в прибор, на основании чего после окончания регистрации пульсовых волн в двух точках, автоматически рассчитывалась кфСПВ по формуле V=0,8×D/∆t, где t — время запаздывания между появлением основания волны в первой точке регистрации и во второй, D — расстояние в миллиметрах между точками регистрации. В качестве методик сравнения проводилась объемная сфигмография (VaSera 1500, Fukuda Denshi, Япония) с расчетом сердечно-лодыжечного сосудистого индекса CAVI (Cardio-ankle vascular index) и сердечно-лодыжечной СПВ (слСПВ) для правой (R) и левой сторон (L). При проведении объемной сфигмографии пациенткам накладывались пневматические манжеты для регистрации артериального давления (АД) и записи плетизмограмм — 2 манжеты на верхние конечности в области плеч и 2 на нижние конечности в области лодыжек, для записи акустических феноменов на аортальном клапане устанавливался фонокардиографический датчик во 2-ом межреберье справа парастернально, электроды стандартных отведений ЭКГ располагались в области запястий. Индекс жесткости β, отражающий способность артериальной стенки противостоять деформации, рассчитывался на основании уравнения Ln(Ps/Pd)×Dd/(Ds-Dd) [8], где Ln — натуральный логарифм, Ps и Pd — систолическое и диастолическое АД, Ds и Dd — систолический и диастолический диаметры общей сонной артерии, измерявшиеся в трех последовательных циклах при ультразвуковом сканировании брахиоцефальных артерий в M-режиме с синхронной регистрацией ЭКГ (Vivid 7, General Electric, США). Наряду с этим были рассчитаны новые отечественные индексы жесткости Stelari и haStart, использующиеся для коррекции влияния повышенного АД на получаемые результаты, оцениваемые по СПВ. Для расчета этих индексов за основу применяются формулы индекса жесткости β и произведенного от него с помощью уравнения Браумвелла-Хилла индекса CAVI, которые были скорректированы авторами методики с учетом известных недостатков, основными из которых являются влияние АД в момент измерения для индекса жесткости β и наличие эмпирических коэффициентов a и b для индекса CAVI [9]. Для расчета значения индекса Stelari использовался показатель кфСПВ, полученный на приборе Pulse Trace PWV, а для получения индекса haStart использовалась СПВ на сердечно-лодыжечном сегменте (прибор VaSera 1500). Значения индексов Stelari и haStart рассчитывались с использованием онлайн калькулятора2.
Все запланированные методики оценки АЖ проводились в один день: объемная сфигмография, затем ультразвуковое сканирование брахиоцефальных артерий и допплерография в точках каротидно-феморального сегмента; в одном кабинете, с соблюдением температурного режима 20-24 оС, без источников холодного воздуха, после 5-10 мин отдыха пациента перед проведением исследований. Обследуемые принимали положение лежа на спине, без дальнейшего перемещения в другое положение. Все пациентки предупреждались о необходимости воздерживаться от курения, употребления кофеин-содержащих напитков и интенсивной физической нагрузки за 30 мин до исследования. Индексы Stelari и haStart рассчитывали после получения показателей кфСПВ и слСПВ в рамках пост-обработки данных.
Статистическая обработка результатов исследования проводилась c использованием статистического пакета программ IBM SPSS Statistics 26 [Rus]. Для оценки характера распределения использовался Z-критерий Колмогорова-Смирнова. При нормально распределенных величинах рассчитывали средние значения и стандартные отклонения (М±SD), для качественных данных рассчитывали частоты (%). При отклонении распределения от нормального для переменной использовались непараметрические критерии статистики, при описании использовались медиана (Me) и интерквартильный размах (Q25; Q75). При нормальном распределении статистическая значимость различий в зависимых выборках оценивалась с помощью дисперсионного анализа с повторными измерениями и применением t-критерия Стьюдента. Для определения значимости различий в зависимых выборках при распределении, отличном от нормального, использовали χ2 Фридмена и Т-критерий Уилкоксона.
Результаты
Обследовано 50 женщин, средний возраст которых составил 46,7±7 лет. Неоадъювантная ХТ была назначена 33 (66,0%), а адъювантная ХТ — 17 (34,0%) пациенткам. Все пациентки (n=50) имели отрицательный статус HER2-рецептора. BRCA-ассоциированный РМЖ был выявлен у 6 (12,0%), положительный статус рецепторов к эстрогену (ER+) у 29 (58,0%) пациенток. Распределение по стадиям РМЖ представлено на рисунке 1. Наиболее часто регистрируемым клиническим подтипом РМЖ являлся люминальный тип В (рисунок 2).
По данным клинического осмотра средний показатель индекса массы тела (ИМТ) составил 24,0 (21,2; 29,3) кг/м2 (таблица 1). Пациенток, страдающих сахарным диабетом 1 или 2 типов, в выборке не было.
Среднее систолическое АД составило 125,0 (115,0; 140,0) мм рт.ст., диастолическое АД 82,0 (75,0; 90,0) мм рт.ст., частота сердечных сокращений (ЧСС) — 67,0 (61,0; 71,5) уд./мин. У 14 (28,0%) пациенток имелась АГ. Антигипертензивная терапия назначалась согласно рекомендациям Российского кардиологического общества (РКО) 2020г, актуальным на момент включения пациенток в исследование [10]. При включении в исследование значимых отклонений от нормы показателей клинического анализа крови и мочи, биохимического анализа крови, а также стандартной ЭКГ не выявлено.
Динамика показателей АД и ЧСС (таблица 2), влияние которых нельзя исключить при оценке некоторых показателей АЖ, показала значимое снижение систолического и диастолического АД и значимое увеличение ЧСС на визите 2, которые не сохранялись к визиту 4: при сравнении значений визита 4 с визитом 1 достоверные различия показателей отсутствовали.
Анализ динамики показателей АЖ выявил значимые различия таких параметров, как кфСПВ и индекс Stelari, CAVI для правой (R-CAVI) и левой сторон (L-CAVI), слСПВ для R и L (таблица 3).
Динамическое наблюдение за индексом CAVI выявило его достоверное снижение по сравнению с исходными данными на этапе завершения применения доксорубицина (визит 2), с сохранением данного тренда на этапе использования таксанового компонента (визит 3) с последующим достоверным ростом данного показателя. Значение CAVI на 4 визите достоверно превышало его значение на этапе завершения таксана (визит 3), при этом достоверно не отличалось от визита включения.
Показатели, отражающие слСПВ (R) и слСПВ (L), достоверно снижались на визите 2 (завершение введения доксорубицина) и визите 3 (введение таксанового компонента) при сравнении с исходными значениями до начала ХТ (визит 1). При динамическом анализе на визите 3 и визите 4 выявлен тренд к увеличению показателя слСПВ (L) в виде достоверно более высоких значений, чем на визите 2.
При анализе кфСПВ, выявлена статистически значимая динамика в виде ее увеличения от визита 1 к визиту 4 (рисунок 3). Также обнаружено промежуточное достоверное снижение кфСПВ на визите 2 по сравнению с результатами и 1-го и 3-го визитов, которое являлось обратимым. Схожую динамику обнаружил новый отечественный показатель Stelari: его значение на визите 4 было значимо выше, чем на визите 1 до начала ХТ, с аналогичным промежуточным достоверным его снижением на визите 2 (окончание антрациклинового компонента ХТ).
Для таких показателей, как индекс haStart и индекс жесткости β значимых различий между визитами обнаружено не было. Вышеописанные тренды динамических изменений показателей жесткости наглядно представлены на рисунке 3.
Таблица 1
Клиническая характеристика группы обследованных пациенток
Показатель | Количество n, (%) n=50 | |
ИМТ, кг/м2 | Нормальная масса тела (ИМТ от 18,5 до 24,9) | 25 (50,0) |
Избыточная масса тела (ИМТ от 25 до 29,9) | 13 (26,0) | |
Ожирение I ст. (ИМТ от 30 до 34,9) | 7 (14,0) | |
Ожирение II ст. (ИМТ от 35 до 39,9) | 1 (2,0) | |
Ожирение III ст. (ИМТ ≥40) | 4 (8,0) | |
Курение | Некурящие | 34 (68) |
Курящие | 5 (10,0) | |
Курение в анамнезе | 11 (22,0) | |
Отягощенный семейный анамнез | По онкологическим заболеваниям | 28 (56,0) |
По ранним ССЗ | 16 (32,0) | |
Дислипидемия | 24 (48,0) | |
АГ | Установленная ранее | 8 (16,0) |
Впервые выявленная | 6 (12,0) | |
Примечание: АГ — артериальная гипертензия (установленная ранее — по данным анамнеза; впервые выявленная — при повышении систолического артериального давления (АД) ≥140 мм рт.ст., диастолического АД ≥90 мм рт.ст. как минимум на двух разных визитах и/или по результатам суточного мониторирования АД), ИМТ — индекс массы тела, ССЗ — сердечно-сосудистые заболевания, дислипидемия (уровень общего холестерина ≥5 ммоль/л и/или уровень холестерина липопротеинов низкой плотности ≥3 ммоль/л и/или гипертриглицеридемия ≥1,7 ммоль/л и/или уровень холестерина липопротеинов высокой плотности <1,2 ммоль/л).
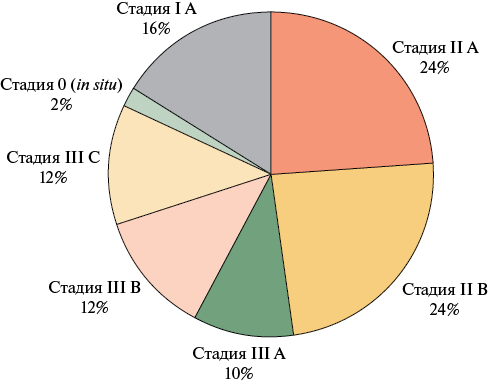
Рис. 1 Стадии РМЖ при включении в исследование.
Примечание: РМЖ — рак молочной железы.
Таблица 2
Динамика АД и ЧСС
Показатель, Me (Q25; Q75) | Визит 1, включение | Визит 2, 8-12 нед. | Визит 3, 20-24 нед. | Визит 4, 48 нед. |
САД, мм рт.ст. | 125 (115; 140) | 120 (110; 134,3)* | 125 (114,3; 138)^ | 122 (115; 135)^ |
ДАД, мм рт.ст. | 82 (75; 90) | 77,5 (70; 85)* | 80 (72; 88)*^ | 80 (73; 85)^ |
ЧСС, уд./мин | 67 (61; 71,5) | 74 (68; 78,5)* | 73 (67; 81,5)* | 64 (61; 71,5)^# |
Примечание: различия достоверны (p<0,05): * — по сравнению с визитом 1, ^ — по сравнению с визитом 2, # — по сравнению с визитом 3. АД — артериальное давление, САД — систолическое АД, ДАД — диастолическое АД, ЧСС — частота сердечных сокращений.
Таблица 3
Показатели АЖ на различных этапах наблюдения
Показатель | Визит 1, включение | Визит 2, 8-12 нед. | Визит 3, 20-24 нед. | Визит 4, 48 нед. |
CAVI (R), M±SD | 6,86±0,97 | 6,53±0,97* | 6,67±1,24 | 6,84±0,92 |
CAVI (L), M±SD | 6,94±0,94 | 6,53±0,98* | 6,55±1,07* | 6,86±0,9# |
слСПВ (R), м/с, Me (Q25; Q75) | 6,90 (6,44; 7,24) | 6,54 (6,14; 6,95)* | 6,50 (6,17; 7,37)* | 6,87 (6,37; 7,31) |
слСПВ (L), м/с, M±SD | 7,18±0,72 | 6,54±0,8* | 6,78±0,65*^ | 6,94±0,67^ |
кфСПВ, м/с, M±SD | 8,31±1,31 | 7,48±1,51* | 8,34±1,67^ | 9,26±2,21*^# |
Индекс Stelari, Me (Q25; Q75) | 8,55 (6,58; 12,35) | 7,80 (5,9; 10,48) | 9,85 (7,85; 12,03)^ | 10,90 (6,8; 17,2)*^# |
Индекс haStart, Me (Q25; Q75) | 6,6 (6,0; 7,7) | 6,0 (4,9; 7,0) | 6,1 (5,4; 7,0) | 6,6 (5,3; 7,5) |
SI b (R), Me (Q25; Q75) | 3,85 (3,01; 5,10) | 3,63 (3,21; 4,83) | 4,16 (3,51; 5,23) | |
SI b (L), Me (Q25; Q75) | 3,83 (2,79; 4,72) | 3,97 (3,13; 4,96) | 4,1 (3,3; 5,27) |
Примечание: различия достоверны (p<0,05): * — по сравнению с визитом 1, ^ — по сравнению с визитом 2, # — по сравнению с визитом 3. АЖ — артериальная жесткость, кфСПВ — каротидно-феморальная скорость пульсовой волны, Me (Q25; Q75) — медиана (интерквартильный размах), слСПВ — сердечно-лодыжечная скорость пульсовой волны, CAVI — сердечно-лодыжечный индекс, SI b — индекс жесткости β: (R) — справа и (L) — слева, Stelari и haStart — новые отечественные индексы жесткости.
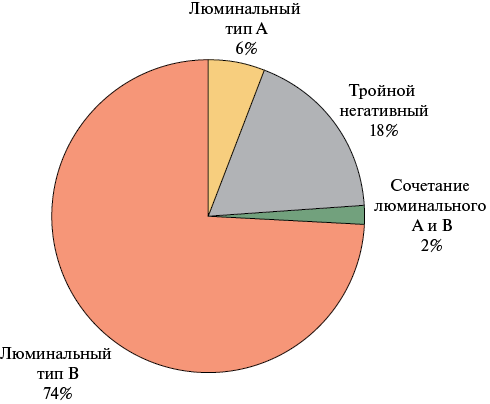
Рис. 2 Клинические подтипы РМЖ при включении в исследование.
Примечание: РМЖ — рак молочной железы.
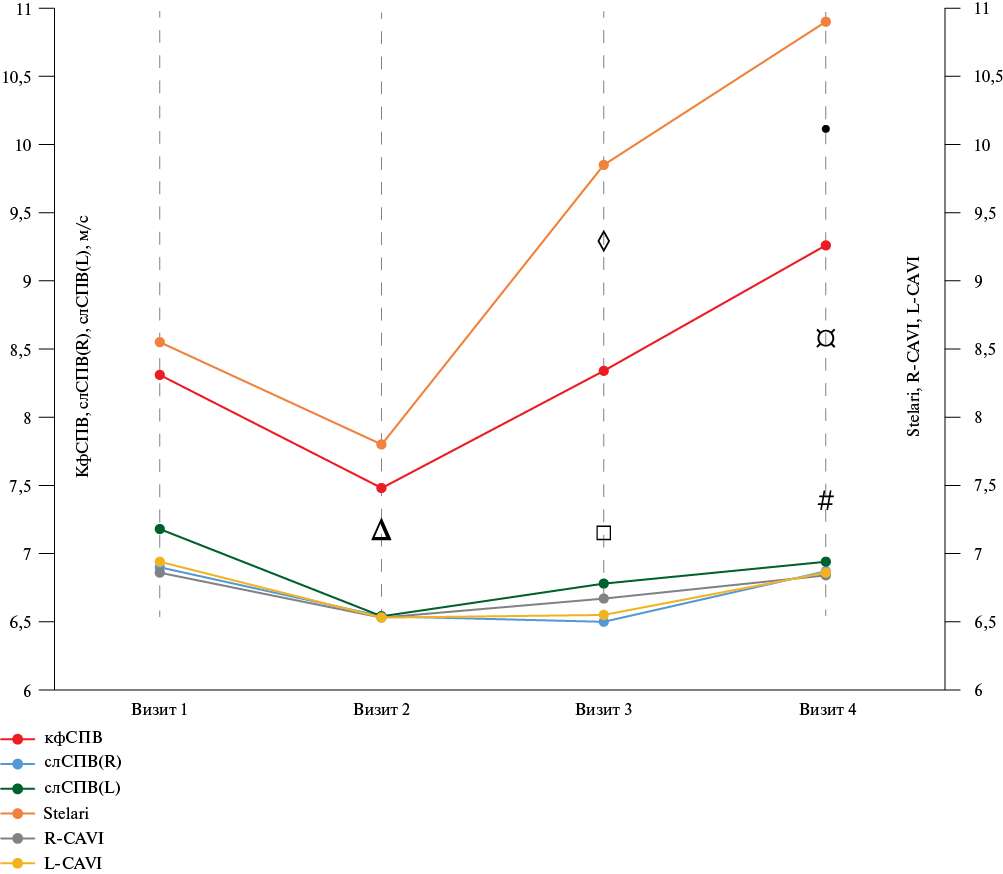
Рис. 3 Динамика показателей АЖ на всех этапах наблюдения.
Примечание: различия достоверны: ∆ — между визитами 1 и 2 для всех показателей, кроме Stelari; □ — между визитами 1 и 3 для L CAVI, слСПВ (R) и слСПВ (L); ◊ — между визитами 2 и 3 для кфСПВ и Stelari; ● — между визитами 1 и 4 для кфСПВ и Stelari; ¤ — между визитами 2 и 4 для кфСПВ, Stelari, слСПВ (L); # — между визитами 3 и 4 для кфСПВ, Stelari, L-CAVI.
АЖ — артериальная жесткость, кфСПВ — каротидно-феморальная скорость пульсовой волны, CAVI — сердечно-лодыжечный индекс, слСПВ — сердечно-лодыжечная скорость пульсовой волны: (R) — справа и (L) — слева, Stelari — новый отечественный индекс жесткости. Цветное изображение доступно в электронной версии журнала.
Обсуждение
Имеющиеся немногочисленные литературные источники свидетельствуют о том, что определение особенностей реагирования сосудистой стенки на противоопухолевое лечение является перспективным направлением, требующим детального изучения. Так, в исследовании случай-контроль выборка больных РМЖ (n=52) наблюдалась на протяжении 15 мес. от начала ХТ и проходила оценку на предмет изменения эндотелиальной функции и АЖ [11]. Исходно достоверных различий между исследуемой группой РМЖ и практически здоровыми добровольцами (n=104) не отмечалось, а в конечной точке наблюдения у исследуемой группы в сравнении с контролем значимо ухудшились показатели кфСПВ и поток-опосредованной вазодилатации плечевой артерии, что отмечалось и при сравнении данных показателей внутри самой группы РМЖ в динамике между точками T0 (до начала ХТ) и T3 (15 мес. от начала ХТ): для СПВ с 7,43±1,68 м/с в точке Т0 до 8,18±2,00 м/с в точке Т3 (p=0,01), для поток-опосредованной дилатации с 6,95±2,86% в точке Т0 до 5,03±2,83% в точке Т3 (p=0,006).
В систематическом обзоре [12] проанализированы 16 исследований с участием больных РМЖ, которым проводились ХТ (в т.ч. и АСХТ), таргетная, лучевая и гормонотерапия, а также в нескольких точках оценивались различные показатели, отражающие артериальное ремоделирование. Сравнение показателей проводилось как внутри самой группы РМЖ (сравнение до/после лечения), так и с группами контроля. Была выявлена связь между противоопухолевым лечением (за исключением гормонотерапии тамоксифеном) и негативным сосудистым ремоделированием (рост СПВ, увеличение толщины комплекса интима-медиа, ухудшение эндотелий-зависимой и поток-опосредованной вазодилатации плечевой артерии).
Полученные нами данные дополняют результаты собственной ранее опубликованной работы, в которой было выявлено промежуточное снижение показателя кфСПВ (сопровождавшееся достоверным снижением показателей АД и ростом ЧСС), на визите соответствовавшем завершению введения доксорубицина [13]. Дальнейшее отслеживание динамики изменения сосудистой жесткости привело к выявлению достоверного увеличения кфСПВ в точке визита 4 через 48 нед. от начала ХТ при возвращении показателей АД и ЧСС к исходным значениям до начала ХТ (отсутствие достоверной разницы между визитом 1 и визитом 4), что может отражать как кумулятивный васкулотоксический эффект ХТ, так и возможную репаративную реакцию сосудистой стенки на воздействие агрессивного ХТ-компонента и свидетельствует об истинном повышении АЖ, а не об изменениях СПВ, обусловленных возможными изменениями АД. Отмеченное ранее промежуточное снижение показателей АЖ может быть обусловлено как влиянием достоверного снижения АД, так и возможным изменением сосудистой стенки в результате повреждения и частичной гибели клеток сосудистого матрикса под воздействием химиотерапевтического агента, что было показано в единичных экспериментальных исследованиях [14]. Для обоих классов препаратов характерно негативное воздействие на эндотелиальные клетки, провоцирующее их дисфункцию, что подтверждается исследованием, описывающим снижение показателей поток-опосредованной и нитрат-опосредованной вазодилатации у пациентов, получавших терапию паклитакселом [15]. Рассматривая отдельно каждую группу препаратов, важно упомянуть, что антрациклины помимо прямого повреждающего воздействия на эндотелий и активации механизмов апоптоза и слущивания эндотелиальных клеток, провоцируют снижение пролиферативного потенциала оставшихся, "выживших" клеток [16], угнетают функцию сосудистых гладкомышечных клеток, важных участников матрикса сосудистой стенки, в т.ч. имеющих разные фенотипы и участвующих в регуляции АЖ [14]. Препараты группы таксанов способны индуцировать экспрессию генов, отвечающих за выработку провоспалительных цитокинов, которые также участвуют в каскаде эндотелиальной дисфункции [17]. Экспериментальные работы зарубежных коллег демонстрируют негативные последствия введения антрациклинов лабораторным животным, выражающиеся в виде повышения проницаемости сосудистой стенки, нарушении NO (оксид азота)-зависимых механизмов регуляции сосудистого тонуса, усиления фенилэфрин-опосредованной вазоконстрикции [14][18]. В контексте обнаруженных изменений нельзя не упомянуть и о липофильных свойствах как антрациклинов так и таксанов, способности антрациклинов накапливаться в миокарде, печени и костном мозге, таксанов — в жировой ткани и в органах с высоким ее содержанием (а также в ткани печени, легких, костном мозге) и сохраняться в организме дольше плазменного периода выведения — до нескольких недель при многократном применении, даже несмотря на снижение плазменной концентрации. Данные кумулятивные свойства способствуют замедленному высвобождению метаболитов препаратов и, соответственно, некоторому пролонгированию токсических эффектов [19][20]. Таким образом, пациенты, имеющие более высокие значения ИМТ, и, соответственно, большее содержание жировой ткани, получали бóльшую нагрузочную дозу обоих препаратов, рассчитывавшуюся по площади поверхности тела, и имели больший субстрат для накопления препарата, пролонгации его высвобождения и реализации токсических эффектов. В настоящем исследовании каждая вторая пациентка при включении в исследование имела избыточную массу тела или ожирение, что также может объяснять полученные нами тренды динамики АЖ со снижением ряда показателей на этапах введения ХТ и последующим ускоренным их ростом.
Таким образом, полученные нами результаты согласуются с приведенными выше работами коллег, несмотря на наличие некоторой разнородности в выборках пациентов с точки зрения сердечно-сосудистого анамнеза, режимов ХТ и периодичности оценки показателей АЖ.
Согласно литературным данным, среднее увеличение показателя кфСПВ в популяции составляет ~0,1 м/с в год, что эквивалентно увеличению на 1 м/с каждые 10 лет [21][22]. Рост кфСПВ на 1 м/с соответствует увеличению смертности от сердечно-сосудистых заболеваний и событий на ~15% [23]. Это подчеркивает важность обнаруженного нами ускорения роста СПВ на 0,95±2,57 м/с за 48 нед. наблюдения, т.е. на ~1 м/с в год. Соответственно, в данной категории больных в сравнении с сопоставимыми по возрасту, полу и факторам риска представителями популяции будет иметь место ускоренное сосудистое старение и более высокие риски развития сердечно-сосудистых осложнений в результате получения ими ранее АСХТ.
В работе зарубежных коллег [24], оценивающей прогностическую ценность определения АЖ для выявления ассоциированной с ХТ кардиотоксичности на выборке из 67 больных РМЖ, получивших антрацикилин-содержащую и анти-HER2-терапию, на основании ROC-анализа приводятся следующие данные: значение кфСПВ 9,2 м/с предсказывало ассоциированную с ХТ кардиотоксичность с чувствительностью 94% и специфичностью 73% (положительная прогностическая ценность 67% (95% доверительный интервал: 0,56-0,77) и отрицательная прогностическая ценность 95,2% (95% доверительный интервал: 0,76-0,97)). Этот результат представляет большой интерес, т.к. скрининг популяции пациентов, получавших АСХТ, и выявление лиц, имеющих и/или пересекающих указанное в исследовании пороговое значение кфСПВ, позволит более прицельно отслеживать их после завершения противоопухолевого лечения в периоде ремиссии и своевременно проводить углубленные диагностические и лечебные мероприятия.
Существует понятие субклинической кардиотоксичности, соответствующей снижению фракции выброса левого желудочка (ФВ ЛЖ) ≥10% от исходного уровня или <53% и/или снижению показателя глобальной продольной деформации (GLS) >15% [25] от исходного уровня без сопутствующих клинических признаков. Вероятно, можно предположить и наличие субклинического поражения артериальной стенки как органа-мишени на фоне ХТ, эквивалентом которой могло бы являться выявление повышения показателей АЖ при сравнении с исходными их значениями до начала противоопухолевого лечения и/или превышения показателями установленного порогового уровня в течение года от начала лечения. Так, полученная нами динамика ФВ ЛЖ, оценка которой проводилась у всех обследованных пациенток, не обнаружила статистически значимого различия на всех этапах наблюдения. Выявлена лишь тенденция к снижению данного показателя при сравнении исходных значений визита 1 — 64,5% и визита 4 через 48 нед. — 62,6%, которая, однако, не достигла статистической значимости (p=0,06). Полученные нами результаты в совокупности с результатами коллег [24], подчеркивающими важность оценки АЖ в отношении риска развития сердечной недостаточности с сохраненной ФВ ЛЖ, свидетельствуют о значимости реагирования артериальной стенки и возможности с ее помощью выявления пациентов группы риска.
Определение АЖ у группы пациентов, получавших ХТ и не проявивших признаки кардиотоксичности, т.е. имеющих низкий риск ее развития, также представляет собой особую зону интереса ввиду потенциального ухода этих "пациентов из поля зрения" терапевта/врача общей практики в периоде ремиссии онкозаболевания.
Ограничения исследования. Малый размер выборки обследованных пациентов.
Заключение
Динамическое наблюдение за состоянием АЖ у больных РМЖ на фоне комбинированной АСХТ позволило выявить увеличение кфСПВ на 0,95 м/с в год, что превышает средние значения данного показателя в популяции и свидетельствует об ускорении сосудистого старения и возрастании сердечно-сосудистого риска. Учитывая схожую динамику и сопоставимость трендов изменения различных показателей АЖ, оптимально ее оценку следует проводить исходно с дальнейшим ежегодным анализом. Все представленные в исследовании методы оценки АЖ продемонстрировали свою информативность у больных РМЖ после курса комбинированной АСХТ. Выбор метода в большей степени будет определяться возможностями и технической оснащенностью лечебного учреждения. Однако в качестве предпочтительного метода в соответствии с рекомендациями, по-прежнему, остается определение кфСПВ, динамика которой имела наиболее выраженный тренд и в нашем исследовании. Контроль состояния АЖ у пациентов, получающих противоопухолевое лечение, в особенности препараты антрациклинового ряда, может явиться перспективным методом обнаружения бессимптомного поражения сосудистой стенки и позволит оптимизировать протоколы ведения данной группы больных для эффективной профилактики развития сердечно-сосудистых последствий противоопухолевого лечения.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Ассоциация онкологов России, Российское общество клинической онкологии, Российское общество онкомаммологов. Клинические рекомендации. Рак молочной железы. 2021.
2. Stelari Start. Национальный индекс артериальной жесткости. https://stelari-start.com/ (19 декабря 2024).
Список литературы
1. Мерабишвили В. М., Семиглазов В. Ф., Комяхов А. В. и др. Состояние онкологической помощи в России: рак молочной железы. Эпидемиология и выживаемость больных. Влияние эпидемии бета-варианта коронавируса SARS-CoV-2 (клинико-популяционное исследование). Опухоли женской репродуктивной системы. 2023;19(3):16-24. doi:10.17650/1994-4098-2023-19-3-16-24.
2. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024;74:229-63. doi:10.3322/caac.21834.
3. Шахзадова А. О., Старинский В. В., Лисичникова И. В. и др. Состояние онкологической помощи населению России в 2022 году. Сибирский онкологический журнал. 2023;22(5):5-13. doi:10.21294/1814-4861-2023-22-5-5-13.
4. Giordano SH, Lin Y-L, Kuo YF, et al. Decline in the use of anthracyclines for breast cancer. JCO. 2012;30:2232-9. doi:10.1200/JCO.2011.40.1273.
5. Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;43:4229-361. doi:10.1093/eurheartj/ehac244.
6. Васюк Ю. А., Иванова С. В., Школьник Е. Л. и др. Согласованное мнение российских экспертов по оценке артериальной жесткости в клинической практике. Кардиоваскулярная терапия и профилактика. 2016;15(2):4-19. doi:10.15829/1728-8800-2016-2-4-19.
7. Чазова И. Е., Агеев Ф. Т., Аксенова А. В. и др. Евразийские клинические рекомендации по диагностике, профилактике и лечению сердечно-сосудистых осложнений при противоопухолевой терапии (2022). Евразийский кардиологический журнал. 2022;(1):6-79. doi:10.38109/2225-1685-2022-1-6-79.
8. Жирнова О. А., Ткаченко С. Б., Пестовская О. Р. Качественный и количественный анализ движения артериальной стенки методом тканевой допплерографии. Регионарное кровообращение и микроциркуляция. 2010;(9):25-31. doi:10.24884/1682-6655-2010-9-1-25-31.
9. Бахолдин И. Б., Милягин В. А., Талов А. В. и др. Индекс Stelari Start — новый перспективный показатель сосудистой жесткости. Вестник Смоленской государственной медицинской академии. 2022;21:96-103. doi:10.37903/vsgma.2022.3.11.
10. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
11. Anastasiou M, Oikonomou E, Theofilis P, et al. Prolonged impact of anti-cancer therapy on endothelial function and arterial stiffness in breast cancer patients. Vascul Pharmacol. 2023;152:107195. doi:10.1016/j.vph.2023.107195.
12. Bonsignore A, Brahmbhatt P, Mina DS, et al. Adverse vascular functional and structural changes secondary to breast cancer and its treatments with adjuvant therapy: A systematic review. SN Compr Clin Med. 2021;3:1561-74. doi:10.1007/s42399-021-00859-7.
13. Ющук Е. Н., Медведева Е. Г., Филоненко Д. А. и др. Особенности динамики артериальной жесткости на фоне проведения химиотерапии рака молочной железы. Терапевтический Архив. 2023;95(8):621-6. doi:10.26442/00403660.2023.08.202327.
14. Vassilakopoulou M, Mountzios G, Papamechael C, et al. Paclitaxel chemotherapy and vascular toxicity as assessed by flow-mediated and nitrate-mediated vasodilatation. Vascul Pharmacol. 2010;53:115-21. doi:10.1016/j.vph.2010.05.002.
15. Narezkina A, Narayan HK, Zemljic-Harpf AE. Molecular mechanisms of anthracycline cardiovascular toxicity. Clin Sci (Lond). 2021;135: 1311-32. doi:10.1042/cs20200301.
16. Bosman M, Favere K, Neutel CHG, et al. Doxorubicin induces arterial stiffness: A comprehensive in vivo and ex vivo evaluation of vascular toxicity in mice. Toxicol Lett. 2021;346:23-33. doi:10.1016/j.toxlet.2021.04.015.
17. Fitzpatrick FA, Wheeler R. The immunopharmacology of paclitaxel (Taxol), docetaxel (Taxotere), and related agents. Int Immunopharmacol. 2003;3:1699-714. doi:10.1016/j.intimp.2003.08.007.
18. Ivanova GT. Effect of doxorubicin on the reactivity of rat mesenteric arteries. J Evol Biochem Phys. 2022;58:1914-25. doi:10.1134/s0022093022060205.
19. Nicoletto RE, Ofner CM. Cytotoxic mechanisms of doxorubicin at clinically relevant concentrations in breast cancer cells. Cancer Chemother Pharmacol. 2022;89:285-311. doi:10.1007/s00280-022-04400-y.
20. Stage TB, Bergmann TK, Kroetz DL. Clinical pharmacokinetics of paclitaxel monotherapy: An updated literature review. Clin Pharmacokinet. 2018;57:7-19. doi:10.1007/s40262-017-0563-z.
21. Parikh JD, Hollingsworth KG, Kunadian V, et al. Measurement of pulse wave velocity in normal ageing: Comparison of vicorder and magnetic resonance phase contrast imaging. BMC Cardiovasc Disord. 2016; 16:50. doi:10.1186/s12872-016-0224-4.
22. Agbaje AO, Barker AR, Tuomainen TP, et al. Cumulative muscle mass and blood pressure but not fat mass drives arterial stiffness and carotid intima-media thickness progression in the young population and is unrelated to vascular organ damage. Hypertens Res. 2023;46: 984-99. doi:10.1038/s41440-022-01065-1.
23. Vlachopoulos C, Aznaouridis K, Stefanadis C. Prediction of cardiovascular events and all-cause mortality with arterial stiffness. J Am Coll Cardiol. 2010;55:1318-27. doi:10.1016/j.jacc.2009.10.061.
24. Şahin M, Kazaz SN, Kartaler F, et al. Arterial stiffness may predict subsequent cancer therapy-related cardiac dysfunction in breast cancer patients. Cardiovasc Toxicol. 2024;24:375-84. doi:10.1007/s12012-024-09841-w.
25. Dobson R, Ghosh AK, Ky B, et al. BSE and BCOS guideline for transthoracic echocardiographic assessment of adult cancer patients receiving anthracyclines and/or trastuzumab. JACC Cardio Oncol. 2021;3:1-16. doi:10.1016/j.jaccao.2021.01.011.
Об авторах
Е. Г. МедведеваРоссия
Медведева Елизавета Георгиевна — ассистент кафедры клинической функциональной диагностики.
Москва
Е. Н. Ющук
Россия
Ющук Елена Николаевна — д.м.н., профессор, зав. кафедрой клинической функциональной диагностики.
Москва
С. В. Иванова
Россия
Иванова Светлана Владимировна — д.м.н., профессор кафедры клинической функциональной диагностики.
Москва
Д. А. Филоненко
ГБУЗ "Московский клинический научно-практический центр им. А.С. Логинова" Департамента здравоохранения города Москвы
Россия
Филоненко Дарья Александровна — к.м.н., зав. дневным стационаром ГБУЗ.
Москва
Л. Г. Жукова
Россия
Жукова Людмила Григорьевна — д.м.н., профессор, член-корр. РАН, зам. директора по онкологии.
Москва
О. С. Трофименко
Россия
К.м.н., доцент кафедры клинической функциональной диагностики.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Кардиотоксичность является известным эффектом химиотерапии (ХТ); опубликованы протоколы профилактики, наблюдения и лечения данного осложнения. Васкулотоксическое действие ХТ и методы его диагностики остаются до конца неизученными, определение артериальной жесткости представляется перспективным маркером потенциальных васкулотоксических реакций.
Что добавляют результаты исследования?
- Проведено исследование артериальной жесткости различными методами у больных раком молочной железы, получающих комбинированную ХТ, включая антрациклины.
- Обнаружено увеличение каротидно-феморальной скорости пульсовой волны через 12 мес. от начала ХТ при сравнении с исходными показателями до лечения, что свидетельствует об ускоренном сосудистом старении у данной категории больных.
Рецензия
Для цитирования:
Медведева Е.Г., Ющук Е.Н., Иванова С.В., Филоненко Д.А., Жукова Л.Г., Трофименко О.С. Анализ показателей артериальной жесткости у больных раком молочной железы на фоне комбинированной антрациклин-содержащей химиотерапии. Кардиоваскулярная терапия и профилактика. 2025;24(4):4272. https://doi.org/10.15829/1728-8800-2025-4272. EDN: ICJVWB
For citation:
Medvedeva E.G., Yushchuk E.N., Ivanova S.V., Filonenko D.A., Zhukova L.G., Trofimenko O.S. Analysis of arterial stiffness parameters in breast cancer patients undergoing combination anthracycline-containing chemotherapy. Cardiovascular Therapy and Prevention. 2025;24(4):4272. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4272. EDN: ICJVWB
JATS XML

























































