Перейти к:
Ассоциация деформации левого предсердия и факторов воспаления у пациентов с артериальной гипертонией, работающих вахтовым методом в Арктике
https://doi.org/10.15829/1728-8800-2025-4277
EDN: WKDJEQ
Аннотация
Цель. Изучить ассоциацию деформации левого предсердия (ЛП) и факторов воспаления у больных с артериальной гипертонией (АГ) без поражения органов-мишеней, работающих вахтовым методом в условиях Арктики.
Материал и методы. Набор пациентов осуществлялся в 20222023гг непосредственно на месторождении Новый Порт ООО "Газпромнефть-ЯМАЛ", расположенном в Арктике. Во время экспедиционного выезда на месторождение осмотрено 335 человек. В исследование включено 86 пациентов с АГ и практически здоровых лиц в возрасте 18-60 лет, работающих методом экспедиционной вахты. В сыворотке крови определяли маркеры воспаления, такие как интерлейкин (ИЛ)-1b, ИЛ-6, ИЛ-8, фактор некроза опухоли альфа (ФНО-a), С-реактивный белок, определенный высокочувствительным методом (вчСРБ). Клинико-инструментальное обследование включало проведение трансторакальной ЭхоКГ с применением метода отслеживания движения пятен (speckle tracking echo), использованного для оценки деформации резервуарной фазы левого предсердия (left atrial reservoir strain, LASr) на аппарате Vivid S70, США, и определение показателей тканевой цветовой допплерографии.
Результаты. Все пациенты, включенные в исследование, были разделены на 2 группы: 1 группа — 49 больных АГ 1 стадии, преимущественно мужчин (89,8%), среднего возраста (45,07±8,1 лет), 2 группа — 37 практически здоровых лиц, средний возраст составил 43,24±7,6 года, мужчин 86,5%. В группе больных АГ выделили подгруппу пациентов с уменьшением показателя деформации ЛП по стрейну резервуара (LASr) по сравнению с нормативным показателем (<39%) и с увеличением LASr (>39%). Пациенты с показателем LASr ≤23% отсутствовали, что позволило исключить сердечную недостаточность. Около половины пациентов c АГ, работающих вахтовым методом, имели LASr между 23 и 39%, т.е. относились к "серой зоне". Уровни провоспалительных цитокинов (ИЛ-1, ИЛ-6, ИЛ-8) у больных АГ не отличались от параметров практически здоровых лиц, а параметры ранней диастолической скорости движения септальной части кольца митрального клапана и латеральной части кольца митрального клапана (TDI e' lat и TDI e' sept) были достоверно ниже в условиях арктической вахты по сравнению с таковыми у практически здоровых лиц. Изучены корреляционные связи между деформацией ЛП и цитокинами, обнаружена обратно пропорциональная корреляционная связь между показателями TDI e' lat и TDI e' sept и уровнем ИЛ-6.
Заключение. Анализ подгруппы пациентов АГ без гипертрофии левого желудочка показал обратно пропорциональную зависимость между уровнем цитокинов и показателями TDI e' lat и TDI e' sept, что позволяет предполагать ассоциацию факторов воспаления и деформации ЛП у больных АГ, работающих вахтовым методом в Арктике.
Для цитирования:
Гапон Л.И., Самойлова Е.П., Нистряну Д.Н., Калугин А.В., Широков Н.Е., Мусихина Н.А., Ярославская Е.И., Петелина Т.И., Шаповалова Е.М., Авдеева К.С. Ассоциация деформации левого предсердия и факторов воспаления у пациентов с артериальной гипертонией, работающих вахтовым методом в Арктике. Кардиоваскулярная терапия и профилактика. 2025;24(5):4277. https://doi.org/10.15829/1728-8800-2025-4277. EDN: WKDJEQ
For citation:
Gapon L.I., Samoylova E.P., Nistryanu D.N., Kalugin A.V., Shirokov N.E., Musikhina N.A., Yaroslavskaya E.I., Petelina T.I., Shapovalova E.M., Avdeeva K.S. Association of left atrial strain and inflammatory factors in hypertensive patients working in the Arctic. Cardiovascular Therapy and Prevention. 2025;24(5):4277. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4277. EDN: WKDJEQ
Введение
Артериальная гипертония (АГ) и ее осложнения играют ключевую роль среди причин высокой смертности индустриально развитых стран [1]. Прогрессирование АГ приводит к ремоделированию миокарда и формированию гипертрофии (ГЛЖ) левого желудочка (ЛЖ). Термин ремоделирование сердца включает весь комплекс изменений размеров, формы, структуры и функциональных свойств миокарда под влиянием различных факторов, в т.ч. и АГ. Ремоделирование сердца при АГ, с одной стороны, является компенсаторной реакцией, дающей сердцу возможность работать в условиях повышенного давления, с другой представляет собой один из этапов прогрессирования изменений сердца с формированием дисфункции ЛЖ и развития хронической (ХСН) сердечной недостаточности (СН) [2].
В последнее время вызывает интерес ХСН с сохраненной фракцией выброса (ФВ) (ХСНсФВ), причиной которой чаще всего является АГ. По последним данным, 78% пациентов, обращающихся в поликлиники, страдают ХСНсФВ [3].
Анализ факторов, принимающих участие в ремоделировании миокарда при АГ, привлекает внимание к медиаторам межклеточного взаимодействия: цитокинам и факторам роста. Результаты ряда зарубежных и отечественных работ свидетельствуют об участии механизмов воспаления в патогенезе СН. Известно, что с развитием диастолической дисфункции ЛЖ в крови достоверно увеличивается содержание С-реактивного белка (СРБ) и провоспалительных цитокинов — фактора некроза опухоли альфа (ФНО-α), интерлейкинов (ИЛ)-1β, ИЛ-6 [4][5]. В то же время вклад провоспалительных цитокинов в развитие ремоделирования миокарда и формирования диастолической дисфункции у пациентов с АГ изучен недостаточно.
Современные методы ультразвуковой диагностики позволяют зарегистрировать более ранние признаки поражения сердца при повышении артериального давления (АД). Перспективным в этом отношении представляется метод отслеживания движения пятен "speckle tracking echo (STE)" при проведении эхокардиографии (ЭхоКГ), позволяющий количественно и комплексно описать функциональный статус левого предсердия (ЛП) на основе оценки фазового анализа ЛП [6]. Описаны фазы функционального состояния ЛП в течение сердечного цикла: фаза "резервуара" (reservoir) в период систолы ЛЖ и изоволюмического расслабления, представляющая собой накопление крови, поступающей из легочных вен; фаза "кондуита" (conduit) во время ранней диастолы ЛЖ, осуществляющая функцию переноса крови в ЛЖ после открытия митрального клапана за счет градиента давления между полостями; фаза "контрактильности", отражающая собственно сокращение ЛП (contractile) [7]. Соответственно, кривые деформации ЛП позволяют выделить деформацию фазы резервуара (LASr), которая наилучшим образом отражает глобальную функцию ЛП; деформацию фазы кондуита (LAScd); деформацию фазы сокращения (LASct). Глобальная продольная деформация ЛП является основным интегральным показателем и соответствует деформации ЛП в фазу накопления. Следовательно, LASr, отражает податливость камеры и может быть весьма эффективным показателем дисфункции ЛП и ранним маркером диастолической дисфункции (ДД) ЛЖ [8][9]. Значение пиковой LASr <23% [10][11] позволяет с чувствительностью 80% и специфичностью 77% идентифицировать ДД тяжелой степени; это вдвое превышает информативность увеличения индекса объема ЛП [12, 13].
Поскольку фазовый анализ ЛП можно считать наиболее точным инструментом для характеристики функциональных изменений ЛП при проведении ЭхоКГ покоя, представляется актуальным рассмотреть изменения его компонентов в период отсутствия традиционных ранних маркеров ДД ЛЖ.
Для более полного использования показателей деформации предсердий в клинике необходимо ориентироваться на ее нормальные значения [14]. В настоящее время показатели функции предсердий с помощью STE у практически здоровых лиц наиболее полно представлены в метаанализе Pathan F, et al. [15]. Метаанализ выявил нормальный контрольный диапазон для деформации ЛП по LASr, равный 39% (95% доверительный интервал (ДИ): 38-41%, из 40 статей), для LASc контрольный диапазон составил 23% (95% ДИ: 21-25%, из 14 статей), и фазы сокращения для LASct — 17% (95% ДИ: 16-19%, из 18 статей). Большинство авторов придерживается этих нормативов. Так, Miranda-Aquino T, et al. обозначили в своем исследовании, что у пациентов с нормальной диастолической функцией LASr составлял 38,7±11%, в то время как у пациентов с ДД LASr составлял 23% [16]. Таких же нормативов придерживаются Джиоева О. Н. и др. в описании протокола ЭхоКГ-исследования у больных ожирением [17].
В настоящее время доказана значимость глобальной продольной деформации ЛП в диагностике и прогнозировании ХСНсФВ [18], описаны параметры деформации ЛП у практически здоровых лиц.
Новая классификация СН придает большое значение первичной профилактике с акцентом на начальные этапы сердечно-сосудистого континуума и выделяет предстадию ХСН (предсердечную недостаточность), которая характеризуется отсутствием симптомов и признаков СН в настоящем и прошлом и наличием признаков структурного и/или функционального поражения сердца и/или повышение уровня мозгового натрийуретического пептида [19].
Цель исследования — у больных АГ с отсутствием ГЛЖ в условиях арктической вахты, используя метод спекл-трекинг ЭхоКГ, определить начальные морфологические изменения ЛП на основании снижения глобальной продольной деформации ЛП и провести ассоциацию с факторами воспаления. Особого внимания заслуживали пациенты так называемой "серой зоны" — больные АГ, у которых не было СН, но стрейн резервуара у них был <39% (ниже нормы).
Материал и методы
Одномоментное исследование выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации, одобрено этическим комитетом Тюменского кардиологического научного центра (№ 183 06.02.2023г). Все пациенты подписали информированное согласие на участие в исследовании. База данных зарегистрирована ClinicalTrials.gov Identifier: NCT05839028.
Набор пациентов осуществлялся в 2022-2023гг непосредственно на месторождении Новый Порт ООО "Газпромнефть-ЯМАЛ", расположенном в Арктике.
Обследование было выполнено группой исследователей филиала Томского НИМЦ Российской академии наук, Тюменского кардиологического научного центра. Во время экспедиционного выезда на месторождение осмотрено 335 человек. В исследование включено 86 пациентов с АГ и практически здоровых лиц в возрасте 18-60 лет, работающих методом экспедиционной вахты. Критерии включения: АГ 1 стадии, отсутствие ГЛЖ. Критерии невключения: АГ с ГЛЖ по данным электрокардиографии и трансторакальной ЭхоКГ, снижение ФВ, клапанной патологии сердца. Традиционно не включались пациенты, перенесшие острые нарушения мозгового кровообращения, инфаркт миокарда, имеющие нарушения ритма сердца, ишемическую болезнь сердца, и пациенты с тяжелой соматической патологией, прогностическая выживаемость которых не превышает 1 года.
Стандартное обследование пациентов включало запись электрокардиографии, выполнение трансторакальной ЭхоКГ и проведение биохимических исследований крови (аланинаминотрансфераза (АЛТ) — референсное значение (РЗ) 0-31 Ед/л, аспартатаминотрансфераза (АСТ) — РЗ 0-34 Ед/л, креатинин — РЗ 44-88 мкмоль/л, скорость клубочковой фильтрации (СКФ) Modification of diet in renal disease (MDRD), уровни билирубина общего — РЗ 2,2-2,65 ммоль/л, общего холестерина (ХС) для пациентов, не имеющих сердечно-сосудистых заболеваний (ССЗ), — РЗ 5,0 ммоль; ХС липопротеинов низкой плотности (ЛНП) 3,0 ммоль/л; РЗ для общего ХС для пациентов с АГ — 4,5 ммоль/л; ХС ЛНП — 2,5 ммоль/л [20].
Забор крови осуществляли непосредственно во время осмотра на промысле из вены в вакуумные пробирки для взятия образцов крови, с SiO2, с гепарином натрия, с цитратом натрия; каждая пробирка переворачивалась 5-8 раз и ставилась в штатив на 30 мин, после центрифугировалась на центрифуге М-6М ELMI в течение 15 мин при 3000 об./мин. Сыворотку аликвотировали в микропробирки типа Эппендорф ПМЗК-13-40-ПП, затем подвергали шоковой заморозке при температуре -70 оС в морозильной камере ARCTICO ULTF-420. Транспортировали замороженные биообразцы в сумках-холодильниках с хладагентами и сухим льдом. Перелет авиасудном составил 2 ч, по прибытию биообразцы помещались в морозильную камеру SANYO ULTRA-LOW MDF-U4186S. Перед анализом разморозка осуществлялась при комнатной температуре в течение 1 ч.
В сыворотке крови определяли ИЛ-1β, ИЛ-6, ИЛ-8 на микропланшетном фотометре (ридере) Stat Fax 4200 (CША) с использованием наборов Вектор Бест (Россия). РЗ в сыворотке крови: ИЛ-1β — 0-11 пг/мл; ИЛ-6 — 0-10 пг/мл; ИЛ-8 — 0-10 пг/мл; РЗ для ФНО-α до 6,0 пг/мл, для С-реактивного белка, определенного высокочувствительным методом (вчСРБ), — РЗ <5 МЕ/л; РЗ ультразвукового исследования сердца: ФВ до 50%; ЛП до 40 мл; конечно-диастолический объем ЛЖ 58-154 мл; индекс массы миокарда для мужчин ≤115, для женщин ≤95; ЛП ≤40 мл; LaSr >30%; TDI e' sept (left ventricular annular velocity assessed by tissue Doppler imaging, peak e' septal, ранняя диастолическая скорость движения септальной части кольца митрального клапана) <10 см/с; TDI e' lat (left ventricular annular velocity assessed by tissue Doppler imaging, peak e' lateral, ранняя диастолическая скорость движения латеральной части кольца митрального клапана) <7 см/с.
Твердофазный иммуноферментный анализ осуществляли ручным методом считывание оптической плотности проводили на микропланшетном фотометре, использовали вспомогательное оборудование шейкеры-инкубаторы shake-thermostat ELMI, промывочные устройства START FAX 2600.
Рутинные биохимические показатели определялись на химическом анализаторе BS-480 "Mindray" (Shenzhen Mindray Bio-Medical Electronics Co., Ltd, Китай).
Клинико-инструментальное обследование включали проведение трансторакальной ЭхоКГ с применением метода отслеживания движения пятен STE, использованного для оценки LASr, и TDI e' sept и TDI e' lat на аппарате GE Vivid iQ, США.
Статистический анализ проведен с помощью программного пакета Statistica 12.0 и IBM SPSS Statistics 23. При нормальном распределении результаты представлены в виде среднего и стандартного отклонения (М±SD); при распределении, отличном от нормального, значения представлены медианой и интерквартильным размахом: Me [Q25; Q75]. Взаимосвязи между количественными переменными определены при помощи корреляционного анализа Спирмена. Распределение количественных переменных определяли с помощью критерия Колмогорова-Смирнова. При сравнении двух групп при нормальном распределении количественных данных использовали t-критерий Стьюдента, при распределении, отличном от нормального, применяли критерий Манна-Уитни. Различия считали статистически значимыми при р<0,05. Для расчёта необходимого количества пациентов для данного исследования использовали Simple Science.
Результаты
Все пациенты, включенные в исследование, были разделены на 2 группы: 1 группа включала 49 больных АГ 1 стадии преимущественно мужчины (89,8%), средний возраст — 45,07±8,1 лет, 2 группа — 37 практически здоровых лиц, 86,5% мужчин, средний возраст составил 43,24±7,6 года; различия между группами по полу и возрасту отсутствовали.
Различия между группами по количеству пациентов с разным индексом массы тела оказались статистически незначимы (р=0,1): избыточную массу тела в 1 группе имели 19 человек (45,2%) vs 20 (45,5%) во 2-й; 1 степень ожирения — 20 человек (47%) в 1 группе vs — 9 (20,5%) во 2-й; 2 степень ожирения в 1 группе была у 1 человека (2,4%), во 2-й — у 4 (9,1%); 3 степень ожирения в 1 группе также была у 1 человека 1 (2,4%), во-2-й группе такие пациенты отсутствовали.
Согласно результатам, представленным в таблице 1, изучаемые группы были сопоставимы по биохимическим и функциональным показателям.
По данным ЭхоКГ, ФВ, объем ЛП в обеих группах находился в пределах допустимых значений. Показатель продольного стрейна ЛП у всех пациентов превышал 23%. Показатели ЭхоКГ и деформации ЛП представлены в таблице 2. Показатели деформации левого предсердия достоверно ниже в группе с АГ относительно группы практически здоровых.
По уровню провоспалительных цитокинов ИЛ-1β, ИЛ-6, ИЛ-8, ФНО-α и вчСРБ больные АГ не отличались от практически здоровых лиц, работающих в условиях арктической вахты.
В настоящей работе проведено исследование ассоциации цитокинов и деформации ЛП у практически здоровых лиц и у больных АГ 1 стадии с отсутствием ГЛЖ в условиях арктической вахты. Результаты анализа уровня маркеров воспаления в группе АГ представлены на рисунке 1. Достоверных различий между группами не выявлено.
Сопоставляя результаты определения провоспалительных цитокинов и показатели допплеркардиографии, следует отметить, что при отсутствии статистически значимых различий между цитокинами в группах больных АГ и практически здоровых лиц, показатели TDI e' lat и TDI e' sept у больных АГ были достоверно ниже.
При проведении корреляционного анализа с вычислением рангового коэффициента корреляции Спирмена установили наличие статистически значимой корреляционной связи обратной направленности средней силы между уровнем ИЛ-6 и значениями показателя TDI e' lat (r=-0,321, р=0,023) и TDI e' sept (r=-0,350, р=0,038). Результаты корреляционного анализа представлены на рисунке 2.
Таблица 1
Уровни провоспалительных маркеров и биохимических показателей крови
Показатель, M±SD | Пациенты с АГ (n=49) | Практически здоровые (n=37) | р |
ИЛ-1β, пг/мл | 6,29±1,93 | 5,76±1,29 | 0,346 |
ИЛ-6, пг/мл | 4,68±2,54 | 6,15±1,49 | 0,356 |
ИЛ-8, пг/мл, Me [Q25; Q75] | 20,6 [ 3; 38,2] | 21,56 [ 1,4; 86,1] | 0,291 |
ФНО-α, пг/мл | 6,19±2,49 | 6,99±2,96 | 0,192 |
вчСРБ, МЕ/л, Me [Q25; Q75] | 4,02 [ 0,1; 8] | 2,86 [ 0,1; 5,3] | 0,231 |
АЛТ, Ед/л | 16,03±13,09 | 18,82±10,16 | 0,08 |
АСТ, Ед/л | 17,26±6,65 | 22,10±6,39 | 0,12 |
Общий билирубин, ммоль/л | 6,39±3,39 | 7,44±4,04 | 0,12 |
Креатинин, ммоль/л | 76,27±6,65 | 85,42±13,81 | 0,8 |
ХС ЛНП, ммоль/л | 3,86±0,17 | 3,86±0,17 | 0,12 |
Общий ХС, ммоль/л | 5,15±0,83 | 4,61±0,92 | 0,15 |
Примечание: АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, вчСРБ — С-реактивный белок, определенный высокочувствительным методом, ИЛ — интерлейкин, ЛНП — липопротеины низкой плотности, ФНО-α — фактор некроза опухоли альфа, ХС — холестерин, Me [Q2; Q3] — медиана [интерквартильный размах], M±SD — среднее±стандартное отклонение.
Таблица 2
Показатели ЭхоКГ и деформации ЛП
Показатель, M±SD | Пациенты с АГ (n=49) | Практически здоровые (n=37) | р |
Фракция выброса, % | 66,71±2,1 | 68,09±0,1 | 0,08 |
Левое предсердие, мл | 38,78±4,24 | 37,58±3,4 | 0,230 |
КДО ЛЖ, мл | 117,13±22,6 | 105,33±18,5 | 0,26 |
Индекс массы миокарда, г/м2 | 93,8±20,13 | 85,6±13,0 | 0,26 |
Левое предсердие, мл | 38,78±4,24 | 37,58±3,4 | 0,230 |
LASr, % | 36,5±7,8 | 40,3±7,7 | 0,090 |
LAScd, % | 22,8±7,8 | 26,7±7,6 | 0,037 |
LASct, % | 12,5±5,8 | 10,6±6,2 | 0,176 |
ПикЕ, см/с | 76,0±14,0 | 85,0±13,8 | 0,020 |
ПикА, см/с | 65,0±12,7 | 60,0±12,6 | 0,094 |
TDI e' lat, см/с | 14,0±3,5 | 16,0±3,5 | 0,016 |
TDI e' sept, см/с | 10,0±2,3 | 11,0±2,6 | 0,007 |
Примечание: КДО ЛЖ — конечный диастолический объем левого желудочка, ПикЕ — трикуспидальный поток, раннее диастолическое наполнение желудочка, ПикА — позднее систолическое наполнение или систола предсердий, LASr — деформация фазы резервуара, LAScd — деформация фазы кондуита, LASct — деформация фазы сокращения, M±SD — среднее±стандартное отклонение, TDI e' sept — ранняя диастолическая скорость движения септальной части кольца митрального клапана, TDI e' lat — ранняя диастолическая скорость движения латеральной части кольца митрального клапана.
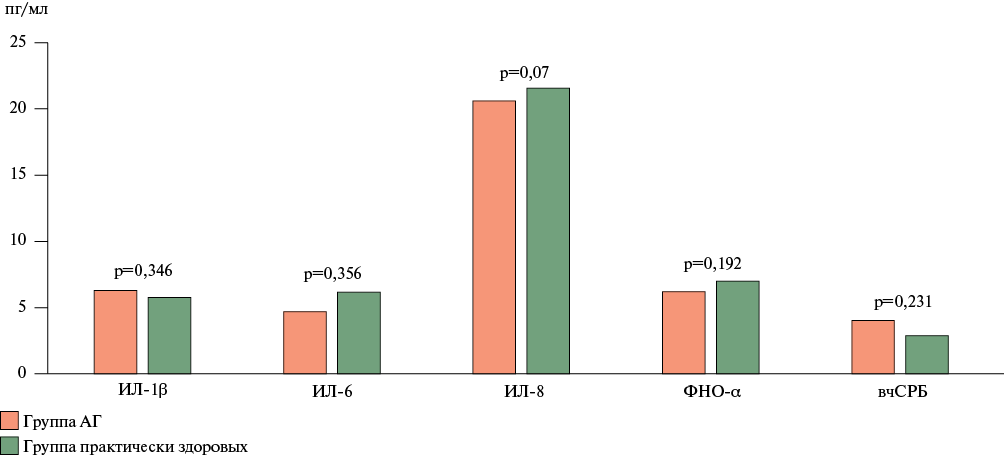
Рис. 1 Показатели воспалительных маркеров у пациентов с АГ.
Примечание: АГ — артериальная гипертония, ИЛ-1β — интерлейкин 1 бета, ИЛ-6 — интерлейкин 6, ИЛ-8 — интерлейкин 8, ФНО-α — фактор некроза опухоли альфа, вчСРБ (МЕ/л) — С-реактивный белок, определенный высокочувствительным способом.
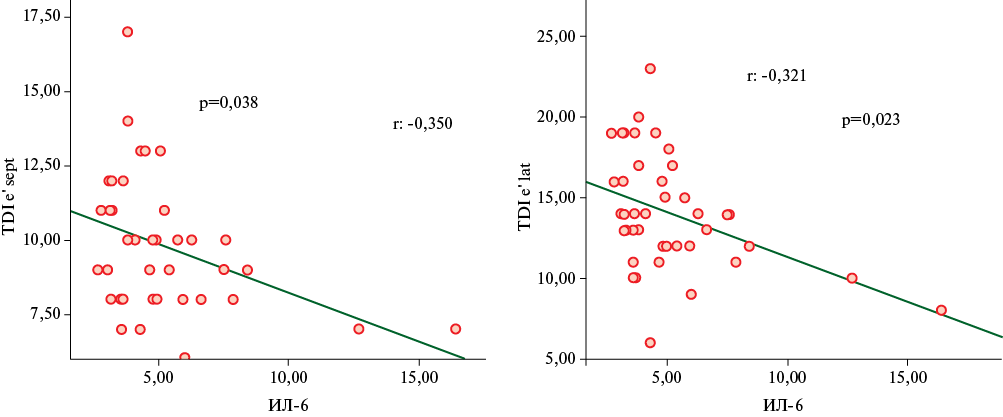
Рис. 2 Корреляционный анализ показателей TDI e' sept и TDI e' lat и ИЛ-6.
Примечание: ИЛ-6 — интерлейкин 6, TDI e' sept — показатель ранней диастолической скорости движения септальной части кольца митрального клапана, TDI e' lat — показатель ранней диастолической скорости движения латеральной части кольца митрального клапана.
Обсуждение
Распространенность АГ в высоких широтах значительно выше, чем в средних, при этом ее частота нарастает с увеличением стажа проживания на Севере. Особенностями АГ у больных, практикующих вахтовый метод труда в Арктике, является невысокий уровень АД при более выраженном формировании ГЛЖ и быстром прогрессировании заболевания, а основным патогенетическим механизмом выступает хроническое психоэмоциональное перенапряжение — дистресс, вегетативный дисбаланс с абсолютным или относительным преобладанием активности симпатической нервной системы в сочетании с активацией ренин-ангиотензин-альдостероновой системы [21]. ГЛЖ оказывает существенное влияние на характер течения и прогноз АГ, ее развитие ассоциируется с увеличением риска сердечно-сосудистых осложнений, заболеваний и смерти по сравнению с больными без ГЛЖ, сопоставимых по уровню АД. ГЛЖ является также основным звеном в развитии ХСНсФВ в цепи сердечно-сосудистого континуума.
Литературные данные свидетельствуют о снижении LASr у больных АГ с ГЛЖ [12]. Мазур Е. С. и др. провели исследование LASr у больных АГ с ГЛЖ в сопоставление со шкалами диагностики ХСНсФВ и диастолического стресс-теста, и обнаружили, что снижение LASr до ≤21,5% хорошо согласуется с диагностическим заключением, сделанным на основании оценки вероятности ХСНсФВ по шкале H2FPEF и результатов диастолического стресс-теста.
Особенностью представленной работы явилось включение в исследование больных АГ с отсутствием ГЛЖ с акцентом на выявление более ранних, чем гипертрофия, структурно-функциональных изменений сердца при повышении АД, что позволило бы по-новому взглянуть на профилактику прогрессирования АГ в условиях Арктики и развития ее осложнений.
Пациенты с показателем LASr ≤23% в обследуемой когорте отсутствовали, что позволяет исключить СН. Около половины пациентов АГ, работающих вахтовым методом, имели LASr между 23 и 39% т.е. относились к "серой зоне".
Традиционные показатели ЭхоКГ у больных АГ, практикующих арктическую вахту (объем ЛП, конечно-диастолический объем ЛЖ, индекс массы миокарда, ФВ), не отличались от аналогичных параметров у практически здоровых лиц. Показатель деформация ЛП по LASr в группе больных АГ составил 36,5±7,8% и находится в диапазоне 23-38%, а в группе практически здоровых лиц — 40,3±7,7%, что превышает верхнее значение указанного диапазона (38%, р=0,003).
Анализ данных допплеркардиографии показал достоверно более низкие значения LASr (р<0,090) и LAScd (р<0,037) у больных АГ по сравнению с практически здоровыми лицами, более низкие значения TDI e' sept и TDI e' lat у больных АГ по сравнению с практически здоровыми лицами.
По данным литературы у пациентов с ДД и повышенным давлением заполнения ЛЖ с ФВ >50%, подтвержденной проведением инвазивной методики — катетеризации ЛЖ, обнаружено уменьшение не только LASr, но и LAScd [22]. Выявлено среднее значение нормы для LAScd (23%) [14]. При отсутствии ССЗ отмечено снижение LAScd с увеличением возраста (от 25,3 до 15,2% при сравнении людей в возрасте 20-60 лет и у больных с ожирением (до 20,1%) [23]. Показатели LAScd и LASr имеют наибольшую ценность в прогнозировании появления ДД у лиц без ССЗ, что подтверждает исследование больных с АГ без ДД на момент включения с длительным 7-летним сроком наблюдения [23]. Неоднократно описывается влияние цитокинов на прогрессирование ХСН и деформацию ЛЖ [4].
Ранее в нашей лаборатории были проведены исследования по применению шкалы H2FPEF для диагностики ХСНсФВ у больных АГ (вахтовиков) в заполярном поселке Ямбург; было обнаружено, что около половины больных АГ относятся по баллам к промежуточной вероятности СН [24].
Прилет пациента в Арктику сопровождается влиянием на организм прежде всего климатогеографического стресса [25], который на уровне клеточных мембран реализуется в виде окислительного стресса, провоцирующего воспаление [26]. В формировании АГ важное значение придается воспалению за счет сложного взаимодействия между симпатоадреналовой и ренин-ангиотензиновой системами и окислительным стрессом [25]. Метаанализ с включением 21 исследования, в т.ч. 14 проспективных, продемонстрировал зависимость риска развития АГ от повышения уровня маркеров воспаления в крови [27]. Связь воспалительных маркеров и ГЛЖ доказана в многочисленных исследованиях [28][29].
Наши предыдущие исследования показали, что в экстремальных условиях Арктики, являющихся наиболее важными факторами стресса, у больных АГ, практикующих экспедиционную вахту, в сравнении с пациентами умеренной климатической зоны, имеет место более выраженная активация процессов перекисного окисления липидов клеточных мембран тромбоцитов и эритроцитов, проявляющаяся повышением начальных и промежуточных продуктов, при снижении антиоксидантной защиты. Это приводит к модификации липидного слоя клеточных мембран и отражается на их функциональной активности. Выявленные на клеточном уровне изменения взаимосвязаны с клиническими проявлениями заболевания и поражением органов мишеней (ГЛЖ) [30][31].
Для уточнения механизмов снижения деформации предсердия у больных АГ в условиях Арктики проведено определение показателей воспаления, прежде всего цитокинов (ИЛ-1β, -6, -8), ФНО-α и вчСРБ. Уровень провоспалительных цитокинов был одинаковым как у практически здоровых лиц, так и у больных АГ. Тем не менее, обратно пропорциональные корреляционные связи между цитокинами и TDI e' lat и TDI e' sept подтвердили ассоциацию повышенного уровня цитокинов с деформации ЛП.
Ограничения исследования. Исследование носит одномоментный характер с относительно небольшим объемом выборки. Вместе с тем, полученные результаты могут служить обоснованием дальнейших более крупных исследований в данной когорте больных.
Заключение
У больных АГ без ГЛЖ, работающих в режиме экспедиционной вахты в Арктике, определяются начальные морфологические изменения в виде деформации ЛП по методу спекл-трекинг ЭхоКГ и по данным тканевой цветовой допплерографии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации МЗ РФ. Российский кардиологический журнал. 2024;29(9):6117. doi:10.15829/1560-4071-2024-6117.
2. Шляхто Е.В., Конради А.О. Ремоделирование сердца при гипертонической болезни — патогенетические факторы и прогностическое значение. Кардиология СНГ. 2003;1(1):20-32.
3. Галявич А. С., Терещенко С.Н., Ускач Т.М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6162. doi:10.15829/1560-4071-2024-6162.
4. Токмачев Р.Е., Будневский А.В., Кравченко А.Ю. Роль воспаления в патогенезе хронической сердечной недостаточности. Терапевтический архив. 2016;88(9):106-10. doi:10.17116/terarkh2016889106-110.
5. Самойлова Е.В., Коротаева А.А., Жиров И.В. и др. Пути передачи сигнала интерлейкина-6 при сердечной недостаточности с сохраненной и сниженной фракцией выброса левого желудочка. Кардиология. 2024;64(3):34-9. doi:10.18087/cardio.2024.3.n2534.
6. Алехин М. Н., Калинин А.О. Диастолическая функция левого желудочка: значение глобальной продольной деформации левого предсердия. Ультразвуковая и функциональная диагностика. 2020;3:91-104. doi:10.24835/1607-0771-2020-3-91-104.
7. Калинин А.О., Алехин М.Н., Бахс Г и др. Оценка состояния миокарда предсердий в режиме двухмерной серошкальной деформации у больных артериальной гипертензией с небольшой гипертрофией левого желудочка. Кардиология. 2010;50(8):13-20.
8. Morris DA, Belyavskiy E, Aravind-Kumar R, et al. Potential usefulness and clinical relevance of adding left atrial strain to left atrial volume index in the detection of left ventricular diastolic dysfunction. JACC: Cardiovascular Imaging. 2018;11(10):1405- 15. doi:10.1016/j.jcmg.2017.07.029.
9. Ye Z, Miranda WR, Yeung DF, et al. Left atrial strain in evaluation of heart failure with preserved ejection fraction. J Am Soc Echocardiogr. 2020;33(12):1490-9. doi:10.1016/j.echo.2020.07.020.
10. Reddy YNV, Obokata M, Egbe A, et al. Left atrial strain and compliance in the diagnostic evaluation of heart failure with preserved ejection fraction. Eur J Heart Fail. 2019;21:891-900. doi:10.1002/ejhf.1464.
11. Перуцкий Д. Н., Обрезан А. Г., Осипова О.А. и др. Функция левого предсердия у больных хронической сердечной недостаточностью. Кардиоваскулярная терапия и профилактика. 2022;21(6): 3265. doi:10.15829/1728-8800-2022-3265.
12. Мазур Е.С., Мазур В.В., Баженов Н. и др. Деформация левого предсердия в оценке сердечной недостаточности с сохраненной фракцией выброса у больных артериальной гипертензией. Российский кардиологический журнал. 2022;27(8):5099. doi:10.15829/1560-4071-2022-5099.
13. Frydas A, Morris DA, Belyavskiy E, et al. Left atrial strain as sensitive marker of left ventricular diastolic dysfunction in heart failure. ESC Heart Fail. 2020;7(4):1956-65. doi:10.1002/ehf2.12820.
14. Hoit BD. Left Atrial Reservoir Strain. Its Time Has Come. JACC Cardiovasc Imaging. 2022;15(3):392-4. doi:10.1016/j.jcmg.2021.10.003.
15. Pathan F, D'Elia N, Nolan MT, et al. Normal ranges of left atrial strain by speckle-tracking echocardiography: a systematic review and meta-analysis. J Am Soc Echocardiogr. 2017;30(1):59-70.e8. doi:10.1016/j.echo.2016.09.007.
16. Miranda-Aquino T, Araújo M, Sampaio F, et al. Impact of the diastolic dysfunction in the left atrial strain in patients with ischemic heart disease. A cross-sectional study. Rev Port Cardiol (Engl Ed). 2019;38(11):789-804. English, Portuguese. doi:10.1016/j.repc.2019.03.007.
17. Джиоева О. Н., Максимова О. А., Рогожкина Е. А. и др. Особенности протокола трансторакального эхокардиографического исследования у пациентов с ожирением. Российский кардиологический журнал. 2022;27(12):5243. doi:10.15829/1560-4071-2022-5243.
18. Сережина Е. К., Обрезан А.Г. Новые визуализирующие методики в диагностике сердечной недостаточности с сохранной фракцией выброса. Русский медицинский журнал. Медицинское обозрение. 2019;3(1-2):52-6.
19. Шляхто Е.В. Классификация сердечной недостаточности: фокус на профилактику. Российский кардиологический журнал. 2023;28(1):5351. doi:10.15829/1560-4071-2023-5351.
20. Ежов М. В., Кухарчук В.В., Сергиенко И.В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471.
21. Гапон Л.И., Шуркевич Н.П., Ветошкин А. С. и др. Артериальная гипертония в условиях Тюменского Севера. Десинхроноз и гиперреактивность организма как факторы формирования болезни. Тюмень. ISBN: 978-5-86093-277-4.
22. Fan JL, Su B, Zhao X, et al. Correlation of left atrial strain with left ventricular end-diastolic pressure in patients with normal left ventricular ejection fraction. Int J Cardiovasc Imaging. 2020;36(9):1659-66. doi:10.1007/s10554-020-01869-7.
23. Brand A, Romero Dorta E, Wolf A, et al. Phasic left atrial strain to predict worsening of diastolic function: Results from the prospective Berlin Female Risk Evaluation follow-up trial. Front Cardiovasc Med. 2023;10:1070450. doi:10.3389/fcvm.2023.1070450.
24. Шуркевич Н.П. Ветошкин А.С., Симонян А.А. и др. Факторы, ассоциированные с промежуточной вероятностью сердечной недостаточности с сохраненной фракцией выброса у бессимптомных пациентов в условиях вахты в Арктике, гендерные различия. Российский кардиологический журнал. 2023;28(8):5400. doi:10.15829/1560-4071-2023-5400.
25. Корчин В. И., Корчина Т.Я., Терникова Е.М. и др. Влияние климатогеографических факторов Ямало-Ненецкого автономного округа на здоровье населения. Журнал медико-биологических исследований. 2021;77-88: doi:10.37482/2687-1491-Z046.
26. Бессонова М.И., Петелина Т.И., Гапон Л.И. Кардиология в Арктике: коллективная монография. Москва: ГЭОТАР-Медиа, 2024. р. 317 с. ISBN: 978-5-91409-589-2.
27. Jayedi A, Rahimi K, Bautista LE, et al. Inflammation markers and risk of developing hypertension: a meta-analysis of cohort studies. Heart. 2019;105(9):686-92. doi:10.1136/heartjnl-2018-314216.
28. Мooney L, Jackson CE, Adamson C, et al. Adverse outcomes associated with interleukin-6 in patients recently hospitalized for heart failure with preserved ejection fraction. Circ Heart Fail. 2023;16(4):e010051. doi:10.1161/CIRCHEARTFAILURE.122.010051.
29. Павлова О.С., Ясюкайть Н.В., Барбук О.А. и др. Ассоциация показателей воспаления и гематологических индексов с гипертрофией левого желудочка у пациентов с артериальной гипертензией. Артериальная гипертензия. 2024;30(1):108-20. doi:10.18705/1607-419X-2024-2405.
30. Kouzu H, Yuda S, Muranaka A, et al. Left ventricular hypertrophy causes different changes in longitudinal, radial, and circumferential mechanics in patients with hypertension: a two-dimensional speckle tracking study. J Am Soc Echocardiogr. 2011;24(2):192-9. doi:10.1016/j.echo.2010.10.020.
31. Stefani LD, Trivedi SJ, Ferkh A, et al. Changes in left atrial phasic strain and mechanical dispersion. Effects of age and gender. Echocardiography. 2021;38(3):417-26. doi:10.1111/echo.14997.
Об авторах
Л. И. ГапонРоссия
Гапон Людмила Ивановна — д.м.н., руководитель отдела клинической кардиологии
Томск
Е. П. Самойлова
Россия
Самойлова Елена Петровна — к.м.н., н.с.
Томск
Д. Н. Нистряну
Россия
Нистряну Дарья Николаевна — младший научный сотрудник отдела клинической кардиологии, аспирант
Томск
А. В. Калугин
Россия
Калугин Алексей Владимирович — лаборант исследователь
Томск
Н. Е. Широков
Россия
Широков Никита Евгеньевич — к.м.н., н.с.
Томск
Н. А. Мусихина
Россия
Мусихина Наталья Алексеевна — к.м.н., научный руководитель отделения неотложной кардиологии
Томск
Е. И. Ярославская
Россия
Ярославская Елена Ильинична — д.м.н., научный руководитель лаборатории инструментальной диагностики
Томск
Т. И. Петелина
Россия
Петелина Татьяна Ивановна — д.м.н., научный руководитель лаборатории инструментальной диагностики
Томск
Е. М. Шаповалова
Россия
Шаповалова Елена Михайловна — д.м.н. профессор кафедры химии и фармакогнозии
Тюмень
К. С. Авдеева
Россия
Авдеева Ксения Сергеевна — к.м.н., научный руководитель лаборатории инструментальной диагностики
Томск
Что известно о предмете исследования?
- Факторы воспаления играют важную роль в развитии артериальной гипертонии (АГ) и хронической сердечной недостаточности с сохраненной фракцией выброса. Для больных с сердечной недостаточностью с сохраненной фракцией выброса и АГ с гипертрофией левого желудочка характерно снижение деформации левого предсердия.
Что добавляют результаты исследования?
- У больных АГ без гипертрофии левого желудочка, работающих в режиме экспедиционной вахты в Арктике, определяются начальные морфологические изменения в виде деформации левого предсердия по методу спекл-трекинг эхокардиографии. Получена обратная корреляционная связь между факторами воспаления (цитокины) и TDI e' sept (ранняя диастолическая скорость движения септальной части кольца митрального клапана) и TDI e' lat (ранняя диастолическая скорость движения латеральной части кольца митрального клапана) у этих пациентов.
Рецензия
Для цитирования:
Гапон Л.И., Самойлова Е.П., Нистряну Д.Н., Калугин А.В., Широков Н.Е., Мусихина Н.А., Ярославская Е.И., Петелина Т.И., Шаповалова Е.М., Авдеева К.С. Ассоциация деформации левого предсердия и факторов воспаления у пациентов с артериальной гипертонией, работающих вахтовым методом в Арктике. Кардиоваскулярная терапия и профилактика. 2025;24(5):4277. https://doi.org/10.15829/1728-8800-2025-4277. EDN: WKDJEQ
For citation:
Gapon L.I., Samoylova E.P., Nistryanu D.N., Kalugin A.V., Shirokov N.E., Musikhina N.A., Yaroslavskaya E.I., Petelina T.I., Shapovalova E.M., Avdeeva K.S. Association of left atrial strain and inflammatory factors in hypertensive patients working in the Arctic. Cardiovascular Therapy and Prevention. 2025;24(5):4277. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4277. EDN: WKDJEQ
JATS XML

























































