Перейти к:
Церебральные микрокровоизлияния у гериатрических пациентов с неклапанной фибрилляцией предсердий
https://doi.org/10.15829/1728-8800-2025-4328
EDN: RDLIHV
Аннотация
Цель. Изучить частоту и структуру церебральных микрокровоизлияний (ЦМК) у пациентов ≥80 лет с неклапанной фибрилляцией предсердий в реальной клинической практике.
Материал и методы. Обследовано 80 пациентов (медиана возраста 83 (81; 86) лет, 72,5% женщин). Всем пациентам была выполнена магнитно-резонансная томография головного мозга на аппарате MAGNETOM Skyra 3 Тесла (Siemens) при первичном обследовании и повторно, через год.
Результаты. При первичном осмотре частота выявления ЦМК составила 48,8% и значимо не различалась в зависимости от принимаемого прямого орального антикоагулянта (p=0,738). Количество ЦМК составило 161 у 39 пациентов, в среднем на одного пациента — 4,1±3,6 ЦМК. При повторном обследовании новые ЦМК возникли у 21,6%. В структуре ЦМК при первичном осмотре преобладала смешанная локализация (43,6%), преимущественно в лобной доле (25,5%). При повторном осмотре — лобарная локализация (54,5%) и также преимущественно в лобной доле (43,5%).
Заключение. Высокая частота выявления ЦМК у пациентов ≥80 лет с неклапанной фибрилляцией предсердий, как при первичном осмотре, так и через год, особенно в лобарной локализации, свидетельствует о высоком риске развития внутричерепного кровоизлияния, для профилактики которого необходим мультидисциплинарный подход к ведению таких пациентов.
Ключевые слова
Для цитирования:
Черняева М.С., Погодина А.А., Прохорова Е.А., Моисеева Е.А., Рожкова М.А., Трифонов М.И., Егорова Л.А., Масленникова О.М., Ломакин Н.В., Сычев Д.А. Церебральные микрокровоизлияния у гериатрических пациентов с неклапанной фибрилляцией предсердий. Кардиоваскулярная терапия и профилактика. 2025;24(5):4328. https://doi.org/10.15829/1728-8800-2025-4328. EDN: RDLIHV
For citation:
Chernyaeva M.S., Pogodina A.A., Prokhorova E.A., Moiseeva E.A., Rozhkova M.A., Trifonov M.A., Egorova L.A., Maslennikova O.M., Lomakin N.V., Sychev D.A. Cerebral microbleeds in geriatric patients with non-valvular atrial fibrillation. Cardiovascular Therapy and Prevention. 2025;24(5):4328. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4328. EDN: RDLIHV
Введение
В настоящее время предполагаемая распространенность фибрилляции предсердий (ФП) в общей популяции составляет от 2 до 4%, а среди пациентов в возрасте 80 лет — от 5 до 15%, что позволяет назвать ФП одной из наиболее часто встречаемых сердечных аритмий в мире. Высокие цифры выявляемости ФП обусловлены увеличением средней продолжительности жизни, а также появлением сопутствующих заболеваний, предрасполагающих к ФП [1][2]. ФП является основным фактором риска острого ишемического инсульта (ИИ), для профилактики которого используются оральные антикоагулянты (ОАК) [1][2]. Однако их применение может быть связано с риском возникновения кровотечений, особенно у пациентов старшего возраста, что связано с полиморбидностью, полипрагмазией и снижением скорости элиминации лекарственных средств (ЛС) [3].
Одним из серьезных кровотечений является внутричерепное кровоизлияние (ВЧК) — жизнеугрожающее осложнение, приводящее к инвалидизации и летальному исходу. У пациентов старшего возраста в силу развития церебральной амилоидной ангиопатии (ЦАА) или гипертензивной церебральной микроангиопатии (гЦМА) риск развития ВЧК более высок [4]. Причем, существует настороженность научного сообщества в отношении возобновления приема ОАК у пациентов после ВЧК, связанного с ЦАА [1][5]. В настоящее время одними из основных маркеров ЦАА и гЦМА являются церебральные микрокровоизлияния (ЦМК), которые представляют собой скопление гемосидерина вокруг сосудов головного мозга (ГМ) вследствие нарушения их проницаемости [5]. Изменения гемостаза, происходящие на фоне приема ОАК в сочетании с вышеуказанными ангиопатиями, повышают риск развития новых ЦМК. Таким образом, ЦМК могут предсказывать риск ВЧК у пациентов с ФП на фоне ОАК, что подтверждается данными ряда исследований [6-17].
Различие в патогенезе ЦАА и гЦМА обуславливают локализацию ЦМК для каждой патологии. Ведущую роль в развитии гЦМА играет повышение артериального давления, в результате чего гипертрофируются крупные пиальные (от лат. pia — мягкий) сосуды мягкой мозговой оболочки. Однако сосуды более мелкого калибра — пенетрирующие и отходящие от них паренхиматозные сосуды — архитектонически не изменяются, потому испытывают повышенную нагрузку, что вызывает ослабление контакта между эндотелиальными клетками и проявляется возникновением ЦМК в глубоких отделах ГМ. При ЦАА в пиальных сосудах происходит отложение амилоида, вследствие чего происходит некроз и, в дальнейшем, микроразрыв некротизированной стенки, что проявляется лобарно (поверхностно) расположенными ЦМК. Согласно результатам ряда исследований, лобарное расположение ЦМК ассоциировано с бóльшим риском развития ВЧК [18-22]. Значение имеет и количество ЦМК; в нескольких исследованиях риск ВЧК повышался с ростом количества ЦМК [23][24].
Известно, что распространенность ЦМК на фоне ОАК у пациентов с ФП варьирует от 17,1 до 30% [6][8][13][15][16][25], а у пациентов с ФП и ИИ на фоне ОАК — от 21 до 25% [7][10][14], с наибольшими значениями для обеих выборок по данным метаанализов [13-15]. Однако в большинстве исследований [6-14][25] представлены данные о пациентах на фоне ОАК, включающей либо смешанную терапию антагонистами витамина К (АВК) и прямыми ОАК (ПОАК), либо терапию только АВК, что свидетельствует о недостаточной изученности вопроса распространенности ЦМК у пациентов, принимающих только ПОАК. Кроме того, возраст пациентов в исследованиях варьировал от 72,6±9,7 до 78,1±9,2 лет при известных данных о том, что пожилой возраст является ведущим фактором риска для возникновения ЦМК [23] и ФП [1][2].
Таким образом, цель настоящего исследования — изучить частоту и структуру ЦМК у пациентов ≥80 лет с неклапанной ФП в реальной клинической практике.
Материал и методы
Это наблюдательное проспективное исследование в рамках реальной клинической практики 80 пациентов ≥80 лет с неклапанной ФП (медиана возраста 83 (81; 86) лет, 72,5% женщин), набранных с января 2020г по декабрь 2023г. Для профилактики тромбоэмболических осложнений все пациенты принимали ПОАК (ривароксабан 57,5%, апиксабан 35% и дабигатрана этексилат 7,5%). Исследование было одобрено этическим комитетом ФГБУ ДПО "Центральная государственная медицинская академия" Управления делами Президента РФ (Протокол № 1-Л/19 от 05.02.2019) и оно было проведено в соответствии с Хельсинкской декларацией и соблюдением правил надлежащей клинической практики. Устное и письменное информированное согласие было получено от всех участников, включенных в исследование.
Исследование проведено на клинической базе кафедры клинической фармакологии и терапии имени академика Б. Е. Вотчала ФГБОУ ДПО РМАНПО Минздрава России (г. Москва). Пациенты находились на лечении в многопрофильном стационаре г. Москвы, а в дальнейшем под наблюдением врача кардиолога/общей врачебной практики в поликлиниках Юго-Восточного адми- нистративного округа г. Москвы. Пациенты были последовательно включены в исследование, если они соответствовали критериям включения.
Критерии включения в исследование:
1) пациенты с неклапанной ФП обоего пола;
2) возраст на момент включения в исследование ≥80 лет;
3) регулярный прием ПОАК с продолжительностью не <1 года от момента включения в исследование;
4) отсутствие противопоказаний для проведения магнитно-резонансной томографии (МРТ);
5) подписание добровольного информированного согласия на участие в исследование.
Основные критерии невключения:
1) возраст <80 лет;
2) клинически значимые заболевания сердца, в т.ч. кардиогенный шок, недавно перенесенный (<1 мес. назад) инфаркт миокарда с осложнениями, атриовентрикулярная блокада III ст. без искусственного водителя ритма, гипертрофическая кардиомиопатия, выраженный аортальный и митральный стеноз; выраженные заболевания печени, в т.ч. цирроз печени с асцитом; пациенты, получающие заместительную почечную терапию (программный гемодиализ, перитонеальный диализ, трансплантация почки в анамнезе); клинически значимое иммунологическое заболевание; неврологические заболевания, в т.ч. острое нарушение мозгового кровообращения (ОНМК) и транзиторная ишемическая атака в анамнезе <3 мес. назад;
3) хирургическая операция (за исключением стоматологических или косметических операций), травмы, переломы в течение предыдущих 3 мес.;
4) наличие клинически значимых изменений лабораторных показателей, свидетельствующих о недиагностированном заболевании и требующих дополнительного обследования;
5) нарушение пациентом процедур плана обследования и лечения;
6) появление у пациента противопоказаний для проведения МРТ;
7) отказ пациента от участия в исследовании и отзыв информированного согласия.
Оценивались основные популяционные параметры (половой и возрастной состав групп, индекс массы тела), риск развития ишемического инсульта по шкале CHA2DS2-VASc (Congestive heart failure, hypertension, age ≥75 years (2 points), diabetes mellitus, prior stroke or TIA or thromboembolism (2 points), vascular disease, age 65-74 years, sex category), риск развития кровотечения по шкале HAS-BLED (Hypertension, Abnormal renal/liver function, Stroke, Bleeding history or predisposition, Labile international normalized ratio, Elderly (>65 years), Drugs/alcohol concomitantly (score), сопутствующая патология, индекс коморбидности Charlson, количество принимаемых ЛС.
Для оценки частоты и структуры ЦМК всем пациентам было выполнена МРТ ГМ на аппарате MAGNETOM Skyra 3 Тесла (Siemens) в отделении лучевой диагностики Университетской клинической больницы № 3 Клинического Центра Сеченовского Университета при первичном обследовании и повторно, через год (МРТ ГМ было выполнено при поддержке исследовательского Гранта компании "Пфайзер").
Статистический анализ и визуализация полученных данных проводились с использованием среды для статистических вычислений R 4.4.1 (R Foundation for Statistical Computing, Вена, Австрия). Описательные статистики представлены в виде абсолютной и относительной частот для качественных переменных, среднего±стандартного отклонения (M±SD) для количественных переменных. Для сравнения групп в отношении категориальных показателей использовались тест χ2 Пирсона и точный тест Фишера (при минимальном ожидаемом количестве наблюдений в ячейках таблицы сопряженности <5). Для сравнения двух групп в отношении количественных и порядковых показателей использовался тест Манна-Уитни. 95% доверительные интервалы (95% ДИ) для биномиальных пропорций оценивались с использованием модифицированного метода Уилсона.
Результаты
По данным МРТ ГМ при первичном осмотре частота выявления ЦМК в исследуемой когорте составила 48,8%, 95% ДИ: 37,2-60,3. Группа пациентов с ЦМК в сравнении с группой пациентов без ЦМК были сопоставимы по основным базовым характеристикам (таблица 1). Статистически значимых различий по частоте выявления ЦМК в зависимости от принимаемого ПОАК не обнаружено: ЦМК были выявлены у 47,8% пациентов, принимавших ривароксабан, у 46,4% пациентов, принимавших апикасабан, и у 66,7% пациентов, принимавших дабигатрана этексилат (p=0,738) (рисунок 1). Количество ЦМК составило 161 у 39 пациентов, в среднем на одного пациента приходилось 4,1±3,6 ЦМК (таблица 2). При анализе структуры ЦМК было выявлено, что в большинстве случаев у пациентов имели место смешанные ЦМК — у 43,6% пациентов, чуть реже — лобарные ЦМК — у 35,9% пациентов и меньше всего у пациентов возникли глубокие ЦМК — у 20,5% пациентов (таблица 2, рисунок 2). Среди всех ЦМК, преобладающее число было также смешанной локализации — 64% (103/161), меньше — лобарной 26% и реже всего встречались ЦМК глубокой локализации — 10% ЦМК) (таблица 2, рисунок 3). При анализе анатомического расположения ЦМК, было выявлено, что наиболее часто встречающаяся локализация ЦМК — лобная доля 25,5%, реже ЦМК встречались в височной доле 14,3%, а с одинаковой частотой 11,2% — в теменной доле, мозжечке и таламусе (таблица 2, рисунок 4).
Повторная МРТ ГМ через 1 год выполнена 63,7% пациентам. Выбывание пациентов из исследования может объясняться особенностью изучаемой выборки, критериями отбора которой были пожилой возраст (>80 лет) и наличие неклапанной ФП на фоне ПОАК. Наиболее частой причиной выбывания пациентов из исследования был отказ от исследования для 48,3% пациентов, реже — смерть для 20,7% и неизвестные факторы для 13,8% (таблица 3). Среди пациентов, которым была выполнена повторная МРТ ГМ через 1 год — 66,7% принимали ривароксабан, 25,5% — апиксабан и 7,8% дабигатрана этексилат. Причем, новые ЦМК возникли у 23,5% пациентов на фоне приема ривароксабан, у 23,1% пациентов на фоне приема апиксабан, на фоне приема дабигатрана этексилат новые ЦМК обнаружены не были (p=0,752). Эти результаты свидетельствуют об отсутствии влияния типа ПОАК на развитие ЦМК.
По данным МРТ ГМ при повторном осмотре через 1 год было выявлено 107 ЦМК у 36 пациентов, в среднем на одного пациента приходилось 3±2,7 ЦМК. Новые ЦМК возникли у 21,6% пациентов, были ЦМК и остались у 49% пациентов и у 29,4% пациентов ЦМК не было и не появились. Количество новых ЦМК составило 23 у 11 пациентов, из них в среднем на одного пациента приходилось 2,1±1,5 ЦМК. При анализе структуры ЦМК среди пациентов было выявлено, что в большинстве случаев встречались лобарные и смешанные ЦМК и меньше всего у пациентов возникли глубокие ЦМК. В то же время анализ структуры всех новых ЦМК показал, что преобладающее число ЦМК имело смешанную и лобарную локализацию, а самой редкой локализацией являлась глубокая (таблица 4). При анализе анатомического расположения новых ЦМК по данным МРТ ГМ при повторном осмотре через 1 год было выявлено, что 43,5% от общего числа ЦМК локализовалось в лобной доле, 17,4% ЦМК локализовались в базальных ганглиях, а 13% ЦМК — в глубоком перивентрикулярном веществе ГМ (рисунок 5).
Таблица 1
Базовая характеристика участников исследования
Показатель | Все пациенты, n=80 | Нет ЦМК, n=41 | Есть ЦМК, n=39 | р* |
Женщины, n (%) | 58 (72,5) | 30 (73,2) | 28 (71,8) | 0,890 |
Возраст (лет), M±SD | 83,8±3,3 | 83,4±3,2 | 84,2±3,5 | 0,325 |
Ривароксабан, n (%) | 46 (57,5) | 24 (58,5) | 22 (56,4) | 0,848 |
Апиксабан, n (%) | 28 (35) | 15 (36,6) | 13 (33,3) | 0,761 |
Дабигатрана этексилат, n (%) | 6 (7,5) | 2 (4,9) | 4 (10,3) | 0,426 |
Индекс массы тела (кг/м2), M±SD | 29,2±5 | 28,7±4,9 | 29,7±5,2 | 0,554 |
CHA2DS2-VASc (баллы), M±SD | 5,2±1,1 | 5,2±1,1 | 5,3±1,2 | 0,964 |
HAS-BLED (баллы), M±SD | 1,9±0,9 | 1,9±0,9 | 1,9±0,9 | 0,661 |
HAS-BLED ≥3, n (%) | 16 (20) | 9 (22) | 7 (17,9) | 0,655 |
Индекс Charlson, M±SD | 9,1±1,7 | 9±1,5 | 9,3±2 | 0,503 |
Количество ЛС, принимаемых одновременно, M±SD | 7,4±1,9 | 7,4±1,9 | 7,5±1,9 | 0,837 |
≥5 ЛС, принимаемых одновременно, n (%) | 75 (93,8) | 38 (92,7) | 37 (94,9) | >0,999 |
≥10 ЛС, принимаемых одновременно, n (%) | 11 (13,8) | 5 (12,2) | 6 (15,4) | 0,679 |
Ишемическая болезнь сердца в анамнезе, n (%) | 53 (66,3) | 27 (65,9) | 26 (66,7) | 0,939 |
Артериальная гипертензия в анамнезе, n (%) | 80 (100) | 41 (100) | 39 (100) | – |
Хроническая сердечная недостаточность >2А стадии в анамнезе, n (%) | 70 (87,5) | 38 (92,7) | 32 (82,1) | 0,188 |
Постинфарктный кардиосклероз, n (%) | 12 (15) | 5 (12,2) | 7 (17,9) | 0,471 |
ОНМК в анамнезе, n (%) | 14 (17,5) | 6 (14,6) | 8 (20,5) | 0,489 |
Сахарный диабет 2 типа в анамнезе, n (%) | 18 (22,5) | 10 (24,4) | 8 (20,5) | 0,678 |
Хроническая болезнь почек в анамнезе, n (%) | 56 (70) | 30 (73,2) | 26 (66,7) | 0,526 |
Злокачественные новообразования в анамнезе, n (%) | 5 (6,3) | 1 (2,4) | 4 (10,3) | 0,195 |
Статус курения: не курит, n (%) | 69 (86,3) | 34 (82,9) | 35 (89,7) | 0,738 |
Статус курения: курил, но бросил, n (%) | 9 (11,3) | 6 (14,6) | 3 (7,7) | |
Статус курения: курит, n (%) | 2 (2,5) | 1 (2,4) | 1 (2,6) | |
Уровень систолического артериального давления (мм рт.ст.), M±SD | 131,5±19,8 | 130,4±21,8 | 132,6±17,6 | 0,563 |
Уровень диастолического артериального давления (мм рт.ст.), M±SD | 80,7±12,5 | 80,1±13,6 | 81,3±11,3 | 0,644 |
Креатинин (мкмоль/л), M±SD | 99,5±32,1 | 99,1±32,8 | 100±31,9 | 0,904 |
Тромбоциты (×109/л), M±SD | 192,3±53,3 | 193,7±49,2 | 190,7±57,9 | 0,897 |
Наличие очаговых изменений белого вещества ГМ по шкале Фазекас, n (%) | 54 (67,5) | 26 (63,4) | 28 (71,8) | 0,424 |
Шкала Фазекас: нет очаговых изменений белого вещества ГМ, n (%) | 26 (32,5) | 15 (36,6) | 11 (28,2) | 0,7 |
Шкала Фазекас: 1 ст., n (%) | 15 (18,8) | 6 (14,6) | 9 (23,1) | |
Шкала Фазекас: 2 ст., n (%) | 34 (42,5) | 18 (43,9) | 16 (41) | |
Шкала Фазекас: 3 ст., n (%) | 5 (6,3) | 2 (4,9) | 3 (7,7) |
Примечание: * — р — значимость различий между группой пациентов с ЦМК в сравнении с группой пациентов без ЦМК, ГМ — головной мозг, ЛС — лекарственное(-ые) средство(-а), ОНМК — острое нарушение мозгового кровообращения в анамнезе, ЦМК — церебральное микрокровоизлияние; CHA2DS2-VASc — Congestive heart failure, hypertension, age ≥75 years (2 points), diabetes mellitus, prior stroke or TIA or thromboembolism (2 points), vascular disease, age 65-74 years, sex category, HAS-BLED — Hypertension, Abnormal renal/liver function, Stroke, Bleeding history or predisposition, Labile international normalized ratio, Elderly (>65 years), Drugs/alcohol concomitantly (score), M±SD — среднее±стандартное отклонение.
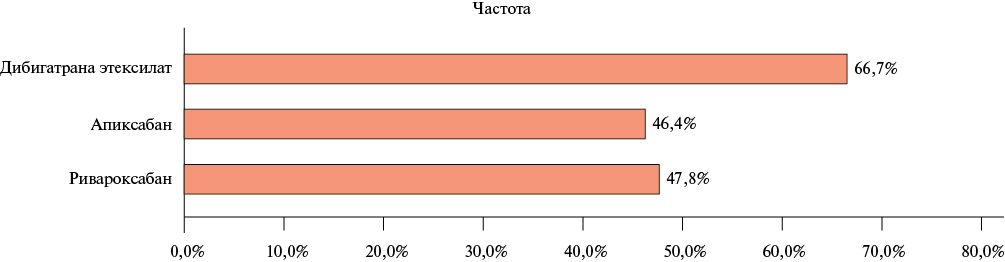
Рис. 1 Частота выявления ЦМК в зависимости от принимаемого ПОАК при первичном осмотре (n=80).
Примечание: ЦМК — церебральное микрокровоизлияние, ПОАК — прямой оральный антикоагулянт.
Таблица 2
Характеристика ЦМК по данным МРТ ГМ при первичном осмотре (n=39)
Показатель | Характеристика |
Количество пациентов с ЦМК, n | 39 |
Количество всех ЦМК, n | 161 |
Среднее количество ЦМК на 1 пациента, M±SD | 4,1±3,6 |
Количество пациентов с глубокими ЦМК, n (%) | 8/39 (20,5) |
Количество глубоких ЦМК, n (%) | 16/161 (9,9) |
Среднее количество глубоких ЦМК на 1 пациента, M±SD | 2±1,4 |
Анатомическое расположение глубоких ЦМК | |
Глубокое перивентрикулярное вещество ГМ, n (%), M±SD на 1 пациента | 4/8 (50) 1,8±1 |
Таламус, n (%), M±SD на 1 пациента | 3/8 (37,5) 1±1 |
Ствол ГМ, M±SD на 1 пациента | 2/8 (25) 1,5±0,7 |
Базальные ганглии, n (%) | 0/8 (0) |
Инсула, n (%) | 0/8 (0) |
Внешняя капсула, n (%) | 0/8 (0) |
Мозжечок, n (%) | 1/8 (12,5) |
Количество пациентов с лобарными ЦМК, n (%) | 14/39 (35,9) |
Количество глубоких ЦМК, n (%) | 42/161 (26,1) |
Среднее количество лобарных ЦМК на 1 пациента, M±SD | 3±2,5 |
Анатомическое расположение лобарных ЦМК | |
Височная доля, n (%) | 4/14 (28,6) |
Лобная доля, n (%), M±SD на 1 пациента | 9/14 (64,3) 1,9±1,7 |
Теменная доля, n (%), M±SD на 1 пациента | 5/14 (35,7) 1,4±0,9 |
Затылочная доля, n (%), M±SD на 1 пациента | 5/14 (35,7) 2±0,7 |
Количество пациентов со смешанными ЦМК, n (%) | 17/39 (43,6) |
Количество смешанных ЦМК, n (%) | 103/161 (64) |
Среднее количество смешанных ЦМК на 1 пациента, M±SD | 6,1±4,1 |
Анатомическое расположение смешанных ЦМК | |
Глубокое перивентрикулярное вещество ГМ, n (%), M±SD на 1 пациента | 3/17 (17,6) 2,7±1,2 |
Таламус, n (%), M±SD на 1 пациента | 7/17 (41,2%) 2,1±1,2 |
Ствол ГМ, n (%) | 1/17 (5,9) |
Базальные ганглии, n (%) | 4/17 (23,5) |
Инсула, n (%) | 1/17 (5,9) |
Внешняя капсула, n (%) | 2/17 (11,8) |
Мозжечок, n (%), M±SD на 1 пациента | 10/17 (58,8%) 1,5±1 |
Височная доля, n (%), M±SD на 1 пациента | 8/17 (47,1) 1,9±1,1 |
Лобная доля, n (%), M±SD на 1 пациента | 14/17 (82,4) 1,7±1,6 |
Теменная доля, n (%), M±SD на 1 пациента | 4/17 (23,5) 2,8±1,5 |
Затылочная доля, n (%), M±SD на 1 пациента | 5/17 (29,4) 1,4±0,5 |
Примечание: ГМ — головной мозг, МРТ — магнитно-резонансная томография, ЦМК — церебральное микрокровоизлияние, M±SD — среднее±стандартное отклонение.
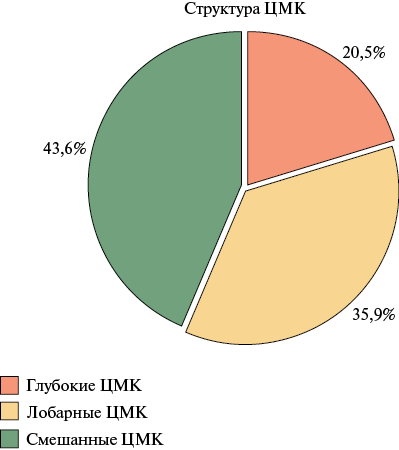
Рис. 2 Структура ЦМК по данным МРТ ГМ при первичном осмотре среди пациентов (n=39).
Примечание: ГМ — головной мозг, МРТ — магнитно-резонансная томография, ЦМК — церебральное микрокровоизлияние.
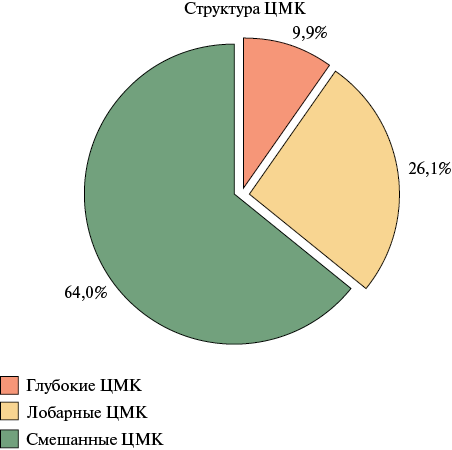
Рис. 3 Структура ЦМК по данным МРТ ГМ при первичном осмотре среди всех ЦМК (n=161).
Примечание: ГМ — головной мозг, МРТ — магнитно-резонансная томография, ЦМК — церебральное микрокровоизлияние.
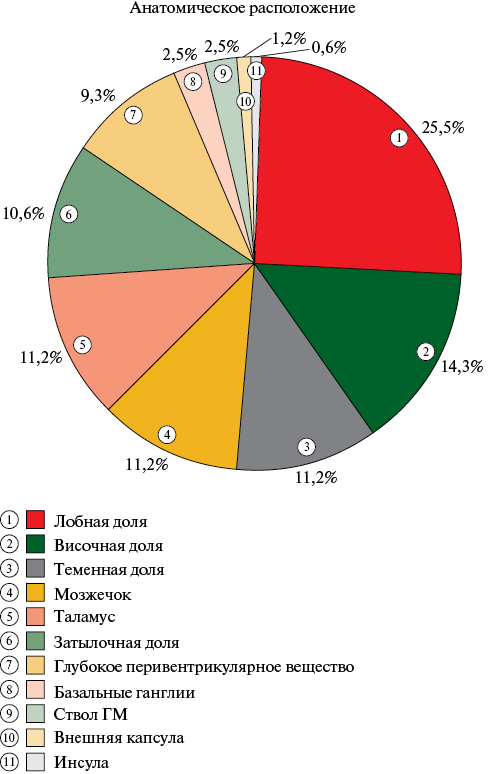
Рис. 4 Анатомическое расположение ЦМК по данным МРТ ГМ при первичном осмотре (n=161).
Примечание: ГМ — головной мозг, МРТ — магнитно-резонансная томография, ПВВ — перивентрикулярное вещество, ЦМК — церебральное микрокровоизлияние.
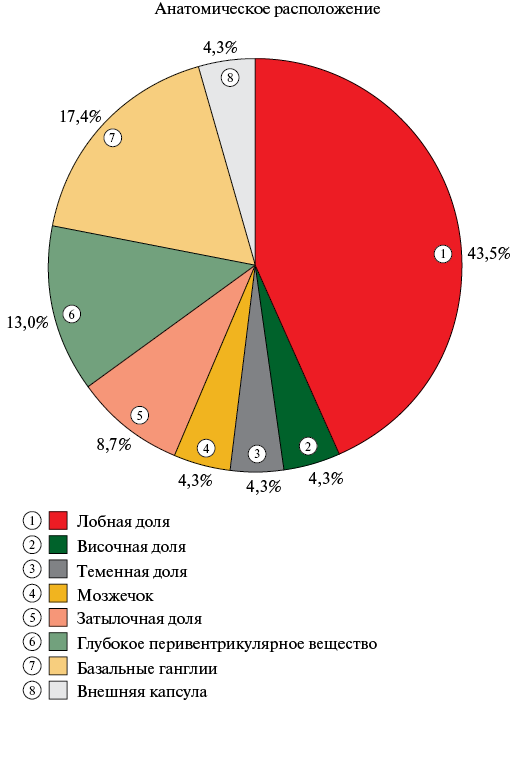
Рис. 5 Анатомическое расположение новых ЦМК по данным МРТ ГМ при повторном осмотре через 1 год (n=23).
Примечание: ГМ — головной мозг, МРТ — магнитно-резонансная томография, ПВВ — перивентрикулярное вещество, ЦМК — церебральное микрокровоизлияние.
Таблица 3
Структура причин выбывания пациентов из исследования через 1 год (n=80)
Характеристика причин, n (%) | Все пациенты, n=80 | Нет ЦМК, n=41 | Есть ЦМК, n=39 | р* |
Прошел исследование | 51 (63,7) | 26 (63,4) | 25 (64,1) | 0,949 |
Не посмотрели повторно | 29 (36,3) | 15 (36,6) | 14 (35,9) | 0,949 |
Умер | 6/29 (20,7) | 3/15 (20,0) | 3/14 (21,4) | >0,999 |
Установка электрокардиостимулятора | 2/29 (6,9) | 2/15 (13,3) | 0/14 (0) | 0,483 |
Отмена прямого орального антикоагулянта | 1/29 (3,4) | 1/15 (6,7) | 0/14 (0) | >0,999 |
Отказ от исследования | 14/29 (48,3) | 7/15 (46,7) | 7/14 (50) | 0,858 |
Невозможность выполнить исследование по тяжести состояния | 2/29 (6,9) | 1/15 (6,7) | 1/14 (7,1) | >0,999 |
Неизвестно | 4/29 (13,8) | 1/15 (6,7) | 3/14 (21,4) | 0,330 |
Примечание: * — р — значимость различий между группой пациентов с ЦМК в сравнении с группой пациентов без ЦМК, ЦМК — церебральное микрокровоизлияние.
Таблица 4
Характеристика новых ЦМК по данным МРТ ГМ при повторном осмотре через 1 год
Характеристика | Пациенты | ЦМК |
Новые ЦМК, n | 11 | 23 |
Среднее количество ЦМК на 1 пациента, M±SD | 2,1±1,5 | – |
Глубокие ЦМК, n (%) | 1/11 (9,1) | 2/23 (8,7) |
Лобарные ЦМК, n (%) | 6/11 (54,5) | 7/23 (30,4) |
Смешанные ЦМК, n (%) | 4/11 (36,4) | 14/23 (60,9) |
Примечание: ГМ — головной мозг, МРТ — магнитно-резонансная томография, ЦМК — церебральное микрокровоизлияние, M±SD — среднее±стандартное отклонение.
Обсуждение
Изучение частоты ЦМК у пациентов ≥80 лет с неклапанной ФП показало достаточно высокую встречаемость: по данным МРТ ГМ при первичном осмотре ЦМК имел каждый второй пациент, а при повторном осмотре через 1 год новые ЦМК, по данным МРТ, возникли у каждого пятого пациента. В структуре ЦМК на МРТ у пациентов при первичном осмотре преобладала смешанная локализация (лобарная и глубокая), в то время как на МРТ при повторном осмотре через 1 год преобладала лобарная локализация. При этом на МРТ при первичном осмотре анализ анатомического расположения выявил большее количество ЦМК в лобной, височной, теменной долях, мозжечке и таламусе. В то же время новые ЦМК на МРТ при повторном осмотре через 1 год располагались в лобной доле, базальных ганглиях и глубоком перивентрикулярном веществе ГМ. Преимущественно лобарное расположение ЦМК у наших пациентов как при первичном осмотре, так и при повторном осмотре через 1 год, свидетельствует о высоком риске развития ВЧК в данной когорте пациентов.
Полученные нами результаты отличаются от результатов других исследований. Так, в наблюдательном проспективном одноцентровом исследовании STRAT-AF study (Stratification of cerebral bleeding risk in AF) [25], включившем 170 пациентов (средний возраст 77,7±6,8 лет, 34,7% женщин) с ФП на фоне ОАК (ПОАК — 69,4%, АВК — 30,6%), частота ЦМК составила 17,1%. В крупном многоцентровом наблюдательном исследовании CROMIS-2 (Clinical Relevance of Microbleeds in Stroke) [10], которое включало в себя 1447 пациентов (средний возраст 76±10 лет, женщины 42%) с ФП и ИИ или транзиторной ишемической атакой на фоне ОАК (ПОАК — 37%, АВК — 62%), частота ЦМК достигала 21%, из них глубокой локализации у 38,6% (120/311) пациентов, лобарной локализации у 37,3% пациентов и смешанной у 24,1%.
По данным одноцентрового когортного исследования, выполненного Choi Н, et al. [7] в когорте 1742 пациентов (средний возраст 72,6±9,7 лет) с ФП и острым ИИ в анамнезе на фоне ОАК (ПОАК — 31,6%, АВК — 68,4%), частота ЦМК составила 22,6%, из них 1 ЦМК было выявлено у 10,7%, от 2 до 4 ЦМК у 8,6%, ≥5 ЦМК у 3,2% пациентов. Распределение ЦМК по структуре характеризовалось следующим образом: строго лобарной локализации у 56,7% пациентов, строго глубокой у 21,1% и смешанной у 22,1%.
В наблюдательном исследовании Umemura T, et al. [8] у 81 пациента (средний возраст 73,2±8,2 года, 46,7% женщин) с ФП и кардиоэмболическим инсультом на фоне приема ОАК (55,5% — ПОАК, 44,4% — АВК) была выявлена исходная частота ЦМК у 23,5% пациентов, при этом 1 ЦМК было обнаружено у 16% пациентов, а ≥2 ЦМК у 7,4% пациентов. Среднее количество исходных ЦМК составило 1 (диапазон 1-8). Распределение ЦМК по структуре характеризовалось следующим образом: лобарной локализации у 42,1% пациентов, глубокой у 31,6% (6/19) и смешанной у 26,3%. Новые ЦМК при повторном МРТ (Me интервала между исследованиями 31 (17-50) мес. в группе ПОАК, 37 (20-59) мес. в группе АВК) появились у 22,2% пациентов и были лобарной локализации у 66,7% пациентов, смешанной у 22,2% и глубокой локализации у 11,1% пациентов. Среднее число новых ЦМК среди этих пациентов составило 2 (диапазон 1-3). При последующем наблюдении только 1 ЦМК было выявлено у 13,6% пациентов, а ≥2 ЦМК у 21% пациентов.
В другом наблюдательном одноцентровом когортном исследовании, выполненном Wagner B, et al. [6], при анализе 310 пациентов (средний возраст 78,1±9,2 лет, 46,1% женщин) с ФП и ИИ на фоне ОАК (ПОАК –75%, АВК — 25%) частота ЦМК составила 28%. В ретроспективном одноцентровом исследовании Das A, et al. [16], все пациенты которого находились на терапии ПОАК, согласно результатам исследования, изучившего 180 пациентов (средний возраст 76±11, женщины 40%) на фоне ПОАК, часть из которых с ВЧК в анамнезе, а другая часть — с ФП, частота ЦМК составила 28,3%.
По данным метаанализов ЦМК у пациентов на фоне ОАК встречались несколько чаще. Так, в работе Charidimou A, et al. [14], где проанализировано 4 исследования, включивших 990 пациентов (возраст пациентов варьировал от 69 до 80 лет) с ФП и ИИ на ОАК (3 исследования — АВК; 1 исследование — ПОАК (24%) + варфарин (64%) + переход с ПОАК на варфарин и обратно (12%). По результатам данного метаанализа частота ЦМК составила 25%, 95% ДИ: 17%-33%. В метаанализе Corica B, et al. [15], включившем 17 исследований и 6978 пациентов (возраст пациентов варьировал от 65,5 до 80,2 лет) с ФП, часть пациентов с ИИ, часть принимала ОАК (данные о типе ОАК недоступны), частота ЦМК составила 28,3%, 95% ДИ: 12,2-52,9. В другом метаанализе Charidimou A, et al. [13] при изучении 9 когорт, включивших 1552 пациентов (возраст пациентов варьировал от 67 до 80 лет) с ФП на фоне ОАК (5 исследований — только АВК, 4 — смешанная терапия АВК и ПОАК) частота ЦМК составила 30%, 95% ДИ: 25-36, при этом частота ≥5 ЦМК — 7%, 95% ДИ: 4-10.
В представленной работе частота выявления ЦМК при первичном МРТ составила 48,8%, что выше, чем клинических исследованиях (от 17,1 до 28,3%) и чем в метаанализах (от 25 до 30%). Это различие могло быть обусловлено следующими факторами: более страшим возрастом пациентов, которые участвовали в нашем исследовании (83,8±3,3 лет vs максимального среднего возраста 78,1±9,2 лет в клинических исследованиях и 80,2 лет в метаанализах), неоднородностью выборки пациентов — в нашем исследовании принимали участие пациенты с ФП, из которых только 17,5% имели в анамнезе перенесенное ОНМК (без уточнения его типа), тогда как в других исследованиях, выборки состояли по большей части из пациентов после перенесенного ОНМК (ишемического или геморрагического), а также разницей в типе используемого ОАК — в нашем исследовании все пациенты принимали ПОАК, тогда как в других исследованиях, пациенты принимали смешанную терапию (АВК и ПОАК).
В проведенном нами исследовании, по данным МРТ ГМ при первичном осмотре в структуре ЦМК преобладало смешанное расположение и имело место у 43,6% пациентов, тогда как в исследованиях других авторов чаще было лобарное расположение и глубокая локализация. Данное различие могло быть обусловлено теми же факторами: возрастом, неоднородностью выборки пациентов и смешанной терапией ОАК.
Тем не менее, в нашем исследовании на МРТ при повторном осмотре через 1 год в структуре новых ЦМК преобладало лобарное расположение и было у 54,5% пациентов, что сопоставимо с наблюдательным исследованием Umemura T, et al. [8].
Заключение
В настоящем исследовании у пациентов >80 лет с неклапанной ФП была выявлена достаточно высокая частота ЦМК, как при первичном осмотре, так и через 1 год. В структуре ЦМК при первичном МРТ преобладала смешанная локализация, при МРТ через 1 год — лобарная, что свидетельствует о высоком риске ВЧК у данной когорты пациентов. С учетом того, что ЦМК можно считать нейровизуализационным маркером ВЧК, раннее выявление ЦМК на МРТ у пациентов с ФП, регулярно принимающих ПОАК, является важным компонентом в профилактике ВЧК. Для таких пациентов необходим более регулярный осмотр с целью выявления и коррекции модифицируемых факторов риска кровотечений, а также работа в мультидисциплинарной команде, с включением врача лучевой диагностики для осуществления мониторинга появления новых ЦМК и определения их локализации.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Van Gelder IC, Rienstra M, Bunting KV, et al. 2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2024;45(36):3314-414. doi:10.1093/eurheartj/ehae176.
2. Аракелян М. Г., Бокерия Л.А., Васильева Е.Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. doi:10.15829/1560-4071-2021-4594.
3. Ткачева О.Н., Воробьёва Н.М., Котовская Ю.В. и др. Антитромботическая терапия в пожилом и старческом возрасте: согласованное мнение экспертов Российской ассоциации геронтологов и гериатров и Национального общества профилактической кардиологии. Кардиоваскулярная терапия и профилактика. 2021;20(3):2847. doi:10.15829/1728-8800-2021-2847.
4. Martí-Fàbregas J, Medrano-Martorell S, Merino E, et al. MRI predicts intracranial hemorrhage in patients who receive long-term oral anticoagulation. Neurology. 2019;92(21):e2432-e2443. doi:10.1212/WNL.0000000000007532.
5. Shoamanesh A.Anticoagulation in patients with cerebral amyloid angiopathy. Lancet. 2023;402:1418-9. doi:10.1016/S0140-6736(23)02025-1.
6. Wagner B, Hert L, Polymeris AA, et al. Impact of type of oral anticoagulants in patients with cerebral microbleeds after atrial fibrillation-related ischemic stroke or TIA: Results of the NOACISP-LONGTERM registry. Front Neurol. 2022;13:964723. doi:10.3389/fneur.2022.964723.
7. Choi HH, Kim JH, Lee K, et al. Microcirculation and outcome in patients with acute ischemic stroke and atrial fibrillation taking anticoagulants. Stroke. 2020;51(12):3514-22. doi:10.1161/STROKEAHA.120.030300.
8. Umemura T, Mashita S, Kawamura T. Oral anticoagulant use and the development of new cerebral microbleeds in cardioembolic stroke patients with atrial fibrillation. PLoS One. 2020;15(9): e0238456. doi:10.1371/journal.pone.0238456.
9. Badi MK, Vilanilam GK, Gupta V, et al. Pharmacotherapy for Patients with Atrial Fibrillation and Cerebral Microbleeds. J Stroke Cerebrovasc Dis. 2019;28(8):2159-67. doi:10.1016/j.jstrokecerebrovasdis.
10. Wilson D, Ambler G, Shakeshaft C, et al. Cerebral microbleeds and intracranial haemorrhage risk in patients anticoagulated for atrial fibrillation after acute ischaemic stroke or transient ischaemic attack (CROMIS-2): a multicentre observational cohort study. Lancet Neurol. 2018;17(6):539547. doi:10.1016/S1474-4422(18)30145-5.
11. Cheng Y, Wang Y, Song Q, et al. Use of anticoagulant therapy and cerebral microbleeds: a systematic review and meta-analysis. J Neurol. 2021;268(5):1666-79. doi:10.1007/s00415-019-09572-x.
12. Liang Y, Song Q, Jiao Y, et al. Cerebral Microbleeds and the Safety of Anticoagulation in Ischemic Stroke Patients: A Systematic Review and Meta-Analysis. Clin Neuropharmacol. 2018; 41(6):202-9. doi:10.1097/WNF.0000000000000306.
13. Charidimou A, Karayiannis C, Song TJ, et al. Brain microbleeds, anticoagulation, and hemorrhage risk: Meta-analysis in stroke patients with AF. Neurology. 2017;89(23):2317-26. doi:10.1212/WNL.0000000000004704.
14. Charidimou A, Boulouis G, Shams S, et al. Intracerebral haemorrhage risk in microbleed-positive ischaemic stroke patients with atrial fibrillation: Preliminary meta-analysis of cohorts and anticoagulation decision schema. J Neurol Sci. 2017; 378:102-9. doi:10.1016/j.jns.2017.04.042.
15. Corica B, Romiti GF, Raparelli V, et al. Epidemiology of cerebral microbleeds and risk of adverse outcomes in atrial fibrillation: a systematic review and meta-analysis. Europace. 2022; 24(9):1395-403. doi:10.1093/europace/euac028.
16. Das AS, Gökçal E, Regenhardt RW, et al. Clinical and neuroimaging risk factors associated with the development of intracerebral hemorrhage while taking direct oral anticoagulants. J Neurol. 2022;269(12):6589-96. doi:10.1007/s00415-022-11333-2.
17. Zeng Z, Chen J, Qian J, et al. Risk Factors for AnticoagulantAssociated Intracranial Hemorrhage: A Systematic Review and Meta-analysis. Neurocrit Care. 2023;38(3):812-20. doi:10.1007/s12028-022-01671-4.
18. Greenberg SM, Eng JA, Ning M, et al. Hemorrhage burden predicts recurrent intracerebral hemorrhage after lobar hemorrhage. Stroke J Cereb Circ. 2004;35(6):1415-20. doi:10.1161/01.STR.0000126807.69758.0e.
19. Viswanathan A, Rakich SM, Engel C, et al. Antiplatelet use after intracerebral hemorrhage. Neurology. 2006;66(2):206-9. doi:10.1212/01.wnl.0000194267.09060.77.
20. Passero S, Burgalassi L, D’Andrea P, et al. Recurrence of bleeding in patients with primary intracerebral hemorrhage. Stroke J Cereb Circ. 1995;26(7):1189-92. doi:10.1161/01.str.26.7.1189.
21. Neau JP, Ingrand P, Couderq C, et al. Recurrent intracerebral hemorrhage. Neurology. 1997;49(1):106-13. doi:10.1212/wnl.49.1.106.
22. Eckman MH, Rosand J, Knudsen KA, et al. Can patients be anticoagulated after intracerebral hemorrhage? A decision analysis. Stroke J Cereb Circ. 2003;34(7):1710-6. doi:10.1161/01.STR.0000078311.18928.16.
23. Lee J, Song E, Oh E, Lee Ai. Characteristics of Сerebral Microbleeds. Neurocognition disorder in dementia. 2018;17(3):73-82. doi:10.12779/dnd.2018.17.3.73.
24. Wilson D, Jäger HR, Werring DJ. Anticoagulation for Atrial Fibrillation in Patients with Cerebral Microbleeds. Curr Atheroscler Rep. 2015;17(8):47. doi:10.1007/s11883-015-0524-7.
25. Alfano F, Cesari F, Gori AM, et al. The Role of Extracellular Matrix and Inflammation in the Stratification of Bleeding and Thrombotic Risk of Atrial Fibrillation on Oral Anticoagulant Therapy: Insights from Strat-Af Study. J Clin Med. 2023;12(21):6866. doi:10.3390/jcm12216866.
Об авторах
М. С. ЧерняеваРоссия
Черняева Марина Сергеевна — к.м.н., доцент кафедры клинической фармакологии и терапии им. акад. Б. Е. Вотчала, ФГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" Минздрава России; доцент кафедры внутренних болезней и профилактической медицины, ФГБУ ДПО "Центральная государственная медицинская академия" Управления делами Президента Российской Федерации; зав. отделением гериатрии, главный внештатный специалист по гериатрии ГБУЗ "Госпиталь для ветеранов войн № 2 Департамента здравоохранения города Москвы"
Москва
А. А. Погодина
Россия
Погодина Анастасия Алексеевна — студент 6 курса
Москва
Е. А. Прохорова
Россия
Прохорова Екатерина Алексеевна — к.м.н., с.н.с. отдела клинической физиологии, инструментальной и лучевой диагностики, врач-рентгенолог отделения рентгендиагностики и компьютерной томографии Научно-клинического центра
Москва
Е. А. Моисеева
Россия
Моисеева Екатерина Александровна — врач-терапевт консультативного отделения
Москва
М. А. Рожкова
Россия
Рожкова Мария Александровна — врач-терапевт
Москва
М. И. Трифонов
Россия
Трифонов Михаил Игоревич — врач гериатр, заведующий терапевтическим отделением
Москва
Л. А. Егорова
Россия
Егорова Лариса Александровна — д.м.н., профессор кафедры внутренних болезней и профилактической медицины
Москва
О. М. Масленникова
Россия
Масленникова Ольга Михайловна — д.м.н., заведующий кафедрой внутренних болезней и профилактической медицины
Москва
Н. В. Ломакин
Россия
Ломакин Никита Валерьевич — д.м.н., зав. кафедрой кардиологии, ФГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" Минздрава России; зав. кардиологическим отделением № 2, ФГБУ "Центральная клиническая больница с поликлиникой" Управления делами Президента Российской Федерации
Москва
Д. А. Сычев
Россия
Сычев Дмитрий Алексеевич — д.м.н., профессор, профессор РАН, академик РАН, заслуженный деятель науки РФ, зав. кафедрой клинической фармакологии и терапии им. акад. Б. Е. Вотчала
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Применение оральных антикоагулянтов у гериатрических пациентов может быть связано с повышенным риском кровотечений.
- Церебральные микрокровоизлияния (ЦМК) можно считать нейровизуализационным маркером внутричерепного кровоизлияния.
- Частота встречаемости ЦМК у гериатрических пациентов с фибрилляцией предсердий, регулярно принимающих прямые оральные антикоагулянты изучена недостаточно.
Что добавляют результаты исследования?
- Работа является первым наблюдательным исследованием по изучению частоты встречаемости и анатомического расположения ЦМК у пациентов ≥80 лет с фибрилляцией предсердий, регулярно принимающих прямые оральные антикоагулянты.
- Высокая частота встречаемости ЦМК в лобарной локализации при первичном осмотре и через год, свидетельствует о высоком риске развития внутричерепного кровоизлияния в данной когорте пациентов.
- Ведение пациентов гериатрического профиля требует мультидисциплинарного подхода с включением врача лучевой диагностики для осуществления мониторинга появления новых ЦМК и определения их локализации.
Рецензия
Для цитирования:
Черняева М.С., Погодина А.А., Прохорова Е.А., Моисеева Е.А., Рожкова М.А., Трифонов М.И., Егорова Л.А., Масленникова О.М., Ломакин Н.В., Сычев Д.А. Церебральные микрокровоизлияния у гериатрических пациентов с неклапанной фибрилляцией предсердий. Кардиоваскулярная терапия и профилактика. 2025;24(5):4328. https://doi.org/10.15829/1728-8800-2025-4328. EDN: RDLIHV
For citation:
Chernyaeva M.S., Pogodina A.A., Prokhorova E.A., Moiseeva E.A., Rozhkova M.A., Trifonov M.A., Egorova L.A., Maslennikova O.M., Lomakin N.V., Sychev D.A. Cerebral microbleeds in geriatric patients with non-valvular atrial fibrillation. Cardiovascular Therapy and Prevention. 2025;24(5):4328. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4328. EDN: RDLIHV
JATS XML

























































