Перейти к:
Идентификация патогенной делеции c.925_931del гена рецептора липопротеинов низкой плотности (LDLR), характерной для финской Карелии, в семье с семейной гиперхолестеринемией в Петрозаводске. Клинический случай
https://doi.org/10.15829/1728-8800-2025-4353
EDN: IIKOTK
Аннотация
Семейная гиперхолестеринемия (СГХС) — одно из самых частых моногенных заболеваний человека, чаще всего вызываемое дефектами гена рецептора липопротеинов низкой плотности (LDLR). Своевременная диагностика СГХС позволяет проводить профилактику сосудистой патологии. Представлено клиническое наблюдение по выявлению делеции семи нуклеотидов c.925_931del в гене LDLR в семье из Петрозаводска; эта делеция ассоциирована с высоким уровнем общего холестерина плазмы крови и холестерина липопротеинов низкой плотности. Второй вариант нуклеотидной последовательности гена LDLR c.58G>A, обнаруженный в той же семье, не сегрегировал с гиперхолестеринемией. Обнаруженная делеция является причиной СГХС, а проведенный каскадный анализ позволил установить диагноз СГХС у сестры, племянника, дочки и внучки пробанда и исключить этот диагноз у внука.
Ключевые слова
Для цитирования:
Корнева В.А., Мандельштам М.Ю., Орлов А.В., Кузнецова Т.Ю., Захарова Ф.М. Идентификация патогенной делеции c.925_931del гена рецептора липопротеинов низкой плотности (LDLR), характерной для финской Карелии, в семье с семейной гиперхолестеринемией в Петрозаводске. Клинический случай. Кардиоваскулярная терапия и профилактика. 2025;24(7):4353. https://doi.org/10.15829/1728-8800-2025-4353. EDN: IIKOTK
For citation:
Korneva V.A., Mandelstam M.Yu., Orlov A.V., Kuznetsova T.Yu., Zakharova F.M. Identification of pathogenic deletion c.925_931del of the low-density lipoprotein receptor (LDLR) gene, characteristic of Finnish Karelia, in a family with familial hypercholesterolemia in Petrozavodsk. A case report. Cardiovascular Therapy and Prevention. 2025;24(7):4353. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4353. EDN: IIKOTK
Введение
Частота семейной гиперхолестеринемии (СГХС) в Российской Федерации составляет 1:173 [1]. Несмотря на распространенность этого заболевания и доступность эффективных методов лечения, СГХС часто остается не диагностированной и без должного лечения. Роль генетической диагностики чрезвычайно велика, поскольку она позволяет поставить более точный диагноз, помогает определить риск развития сердечно-сосудистых осложнений и начать раннюю терапию для пациентов высокого риска, а также провести каскадный скрининг родственников. Чаще всего патогенные изменения нуклеотидной последовательности при СГХС локализуются в гене рецептора липопротеинов низкой плотности (LDLR) [2].
Клинический случай
Информация о пациенте
Пациент И., (1955 г.р.) 65 лет, пробанд. С 44 лет знает о повышенном уровне холестерина (ХС), по этому поводу за медицинской помощью не обращался, гиполипидемическая терапия не проводилась.
Ишемическая болезнь сердца (ИБС) дебютировала в возрасте 48 лет клиникой стенокардии напряжения II функционального класса (ФК). По коронароангиографии диагностирован стенозирующий коронарный атеросклероз, выполнено аортокоронарное шунтирование (АКШ) в возрасте 55 лет.
В возрасте 56 лет у пациента была диагностирована СГХС, определенная форма — 26 баллов согласно критериям DLCN (Dutch Lipid Clinic Network), показатели липидного спектра: общий ХС 14 ммоль/л, ХС липопротеинов низкой плотности (ЛНП) до 11 моль/л.
Анамнез жизни: не курит. Наследственность отягощена по сердечно-сосудистой патологии (отец умер в возрасте 48 лет от инфаркта миокарда). С 2005г диагностирован сахарный диабет (СД) 2 типа, постоянный прием метформина.
Результаты физикального осмотра
При осмотре: состояние удовлетворительное, рост 176 см, вес 83 кг. Сухожильные ксантомы, ксантелазмы век, липоидная дуга роговицы (выявлялась до 45 лет). Артериальное давление 125/80 мм рт.ст. Пульс 67 уд./мин, ритмичный. Размеры относительной сердечной тупости на 1,5 см кнаружи в V межреберье. Тоны сердца отчетливые, первый тон больше второго, патологических шумов нет. Над легкими ясный легочный звук, дыхание везикулярное, патологических шумов нет. Живот мягкий, безболезненный, печень не пальпируется. Отеков нет.
Предварительный диагноз: ИБС. Стенокардия I ФК. Состояние после АКШ (2010г). СГХС.
Временнáя шкала
На рисунке 1 представлено описание ключевых событий клинического случая, расположенных в хронологическом порядке.

Рис. 1 Пациент И., временнáя шкала.
Примечание: АКШ — аортокоронарное шунтирование, ИБС — ишемическая болезнь сердца, ЛНП — липопротеины низкой плотности, ЛП(а) — липопротеин(а), ПЭКС — постоянная кардиостимуляция, СГХС — семейная гиперхолестеринемия, СД — сахарный диабет, ФК — функциональный класс, ХС — холестерин, ЧКВ — чрескожное коронарное вмешательство.
Диагностическая оценка
За время наблюдения за пациентом было проведено обследование его семьи. Показатели липидного спектра пациента и членов его семьи представлены в таблице 1.
Таблица 1
Клинические и биохимические проявления СГХС в семье пациента И.
|
Возраст, лет |
Общий ХС, ммоль/л |
ХС ЛНП, ммоль/л |
ХС ЛВП, ммоль/л |
ТГ, ммоль/л |
ЛП(а), г/л |
ИБС |
|
|
Пробанд И. |
65 |
14,0 |
11,0 |
1,0 |
2,3 |
0,5 |
Стенокардия напряжения и АКШ в возрасте 48 лет |
|
Сестра пробанда |
69 |
8,6 |
6,5 |
0,6 |
2,5 |
0,8 |
Стенокардия напряжения, АКШ, ОИМ, ЧКВ |
|
Дочь пробанда |
35 |
7,8 |
6,3 |
1,1 |
0,9 |
0,3 |
Клиники ИБС нет |
|
Внучка М. пробанда |
12 |
7,7 |
6,2 |
1,3 |
0,7 |
0,1 |
Клиники ИБС нет |
|
Внук А. пробанда |
9 |
3,5 |
2,0 |
1,2 |
0,8 |
0,2 |
Клиники ИБС нет |
|
Племянник пробанда |
36 |
7,9 |
6,1 |
1,1 |
1,0 |
Клиники ИБС нет |
Примечание: АКШ — аортокоронарное шунтирование, ИБС — ишемическая болезнь сердца, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ЛП(а) — липопротеин(а), ОИМ — острый инфаркт миокарда, ТГ — триглицериды, ХС — холестерин, ЧКВ — чрескожное коронарное вмешательство.
Дочь пробанда (35 лет) — повышение общего ХС до 7,8 ммоль/л, ХС ЛНП до 6,3 ммоль/л; ксантом, ксантелазм, липоидной дуги не выявлено, клиники ИБС нет, толщина интима-медиа сонных артерий 0,7 мм. Принимает розувастатин 10 мг/сут., на этом фоне уровень ХС ЛНП 4,5 ммоль/л, липопротеин(а) (ЛП(а)) в норме. Диагностирована СГХС, определенная форма.
Сестра пробанда (69 лет) — в возрасте 63 лет диагностирована СГХС, ксантом, ксантелазм, липоидной дуги при осмотре не выявлено. Показатели липидного спектра представлены в таблице 1. В анамнезе — СД 2 типа, постоянный прием гипогликемических препаратов, артериальная гипертензия с постоянным приемом гипотензивных препаратов. Клиника стенокардии напряжения II ФК в течение 10 лет, в возрасте 61 года выполнена коронароангиография и операция (маммарокоронарный шунт передней нисходящей артерии, АКШ правой коронарной артерии, после чего — клиника стенокардии I-II ФК. Принимала аторвастатин в дозе 20 мг/сут., уровень ХС ЛНП 4 ммоль/л. В марте 2023г перенесла острый инфаркт миокарда, выполнено чрескожное коронарное вмешательство шунта к огибающей артерии. На фоне терапии аторвастатином 80 мг/сут. и эзетимибом 10 мг/сут. ХС ЛНП до 2,4 ммоль/л.
Племянник пробанда (сын сестры, 37 лет) — выявлено повышение общего ХС до 7,9 ммоль/л, ХС ЛНП до 6,1 ммоль/л. Ксантом, ксантелазм, липоидной дуги при осмотре не выявлено.
Клиники ИБС, признаков стенозирующего атеросклероза каротидных артерий нет. Начата терапия розувастатином в дозе 20 мг/сут. Клинически диагностирована СГХС.
Внучка пробанда (12 лет) — клинически диагностирована СГХС, определенная форма.
Клинический диагноз
Клинический диагноз пациента И. (пробанда): СГХС. ИБС. Стенокардия I ФК. Состояние после АКШ (2010г).
Медицинские вмешательства
Всем членам семьи выполнен молекулярно-генетический анализ. Варианты нуклеотидной последовательности (ВНП) гена LDLR идентифицировали путем секвенирования всех экзонов гена после их амплификации методом полимеразной цепной реакции [3]; при семейном анализе гетерозиготную делецию c.925_931del детектировали по образованию гетеродуплексов.
Динамика и исходы
На фоне терапии статинами (розувастатин 40 мг/сут.) уровни ХС сохранялись высокими (общий ХС 7,6 ммоль/л, ХС ЛНП 3,4 ммоль/л).
После АКШ сохранялась стенокардия II ФК. В 2020г в связи с появлением полной атриовентрикулярной блокады был имплантирован электрокардиостимулятор (Adapta DR). Показатели липидного спектра: общий ХС 6,5-7,2 ммоль/л, ХС ЛНП 2,8-3,4 ммоль/л, ХС липопротеинов высокой плотности 0,97 ммоль/л, триглицериды 2,3 ммоль/л, ЛП(а) 0,5 г/л.
В 2017г диагностирован рак нисходящего отдела ободочной кишки. Проводилось медикаментозное и хирургическое лечение. Умер в возрасте 65 лет в 2020г в связи с прогрессированием онкопатологии.
Обсуждение
Генетический анализ выявил два ВНП в гене LDLR в семье пробанда. Пробанд имеет патогенную делецию c.925_931del [p.(Pro309fs)] (FH-North Karelia) [4] в последовательности гена LDLR, приводящую к утрате семи нуклеотидов в последовательности шестого экзона гена. Данный ВНП приводит к сдвигу рамки трансляции в 309 кодоне для пролина и синтезу укороченного рецепторного белка (вследствие образования стоп-кодона в восьмом экзоне гена LDLR) [4]. Функциональные тесты с использованием культивируемых фибробластов от пациентов показали, что ВНП FH-North Karelia приводит к отсутствию рецептора на клеточной поверхности или к синтезу рецептора, неспособного связывать ЛНП. Носители ВНП FH-North Karelia характеризовались типичным течением СГХС с развитием ксантом и выраженной дислипидемией с повышением уровня ХС ЛНП. Этот ВНП характерен для восточной Финляндии, где им обусловлено ~79% всех случаев СГХС [4]. Он был обнаружен в неродственных семьях в Санкт-Петербурге [5] и в Петрозаводске [6]. Исследование родственников пробанда из Петрозаводска показало, что кроме него обсуждаемый ВНП имеется также у его дочери и внучки, а также у сестры и племянника пробанда (рисунок 2). Делецию у пробанда идентифицировали секвенированием дезоксирибонуклеиновой кислоты (ДНК), а наследование делеции в семье прослеживали по образованию гетеродуплексов, образующихся при спаривании амплификатов мутантного и нормального аллелей. У всех членов семьи с делецией были повышены уровни общего ХС и ХС ЛНП.
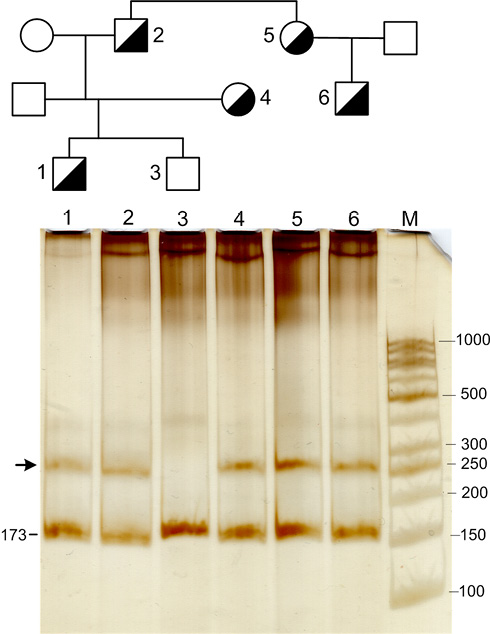
Рис. 2 Наследование делеции c.925_931del7 в семье пробанда. На дорожках № 1-6 представлены ПЦР-продукты экзона 6 гена LDLR пробанда (дорожка 2), его дочери (дорожка 4), его двух внуков (дорожки 1 и 3), его сестры (дорожка 5) и племянника (дорожка 6). Дополнительная зона гетеродуплексов, присутствующая на дорожках № 1, 2, 4, 5, 6 (отмечена стрелкой), помимо зоны основного амплификата (173 п.н.), свидетельствует о наличии в данных образцах делеции в гетерозиготном состоянии. М — маркер молекулярного веса, цифры справа от рисунка указывают размер фрагментов маркера в парах нуклеотидов.
Примечание: ПЦР — полимеразная цепная реакция.
В той же семье, помимо делеции c.925_931del, в гене LDLR у дочери и внука пробанда была обнаружена еще одна нуклеотидная замена с. 58G>A [p.(Gly20Arg)] в кодирующей области гена [7]. Мы заключили, что данный ВНП не связан с заболеванием, т.к. присутствует у здорового внука пробанда и отсутствует у большинства членов семьи с гетерозиготной СГХС. Несмотря на то, что ВНП приводит к замене глицина на аргинин в сигнальном пептиде рецептора ЛНП, в настоящее время база данных ClinVar рассматривает этот вариант как доброкачественный, а не патогенный, что подтверждено и функциональными тестами на активность рецептора ЛНП [8].
Следует отметить, что, несмотря на проводимую гиполипидемическую терапию у пробанда, целевых уровней ХС ЛНП достичь не удалось. Уровень ХС ЛНП у пробанда значимо выше, чем у родственников, что может быть связано с сопутствующим СД 2 типа. Описание случая является ретроспективным, лечение первых пациентов с применением ингибиторов PCSK9 в республике стало возможным в 2018-2019гг, поэтому у пробанда их не применяли. Кроме того, выбор режима гиполипидемической терапии был ограничен сопутствующей онкопатологией кишечника у пробанда, которая в последующем привела к его гибели. Дочь пробанда от усиления режима гиполипидемической терапии в данный момент категорически отказывается. Информация о проводимой терапии у сестры пробанда отсутствует в связи с ее переездом в другой регион после перенесенной операции АКШ.
Пациенты с СГХС имеют 2,5-10-кратно увеличенный риск ССЗ атеросклеротического генеза по сравнению с группой контроля, однако в тех случаях, когда СГХС диагностирована в раннем возрасте и приняты меры по ее лечению, риск ССЗ существенно снижается (приблизительно на 80%) [9]. Каскадный анализ при СГХС, включая генетическое тестирование, когда оно доступно, или определение уровня ХС ЛНП, когда генетическое тестирование недоступно, показал экономическую эффективность для идентификации новых случаев СГХС [10], чему в настоящее время способствует снижение стоимости генетических анализов при использовании секвенирования нового поколения [9].
Течение СГХС может характеризоваться вариабельностью клинических проявлений даже у лиц, имеющих мутации. Следует отметить, что у пробанда и его сестры, имеющих в анамнезе ИБС, имеется также повышенный уровень ЛП(а): у пробанда 0,52 г/л, у его сестры 0,8 г/л, что значимо повышает вероятность развития ССЗ у пациентов с СГХС [11]. Носители 7-нуклеотидной делеции характеризовались типичным для СГХС липидным профилем.
Несомненный интерес представляет и факт наличия внутри одной семьи сразу двух мутаций в последовательности гена рецептора LDLR, а также тот факт, что несмотря на то, что оба ВНП приводят к изменению аминокислотной последовательности экспрессирующегося с этих аллелей рецептора, только один из них является патогенным.
В обследуемой семье была диагностирована СГХС у нескольких ее членов, что позволило своевременно начать терапию с целью профилактики и лечения сердечно-сосудистых заболеваний.
Заключение
Представленный пример демонстрирует возможность и реальное практическое значение проведения каскадного скрининга при СГХС. Нами было обследовано пять членов семьи пробанда. У четырех из них выявлен ВНП в гене рецептора LDLR, сегрегированный с ДЛП. Клиника ИБС была у самого пробанда и у его сестры. В исследованной семье после идентификации пробанда и семейного анализа начато лечение племянника и сестры пробанда статинами, а также выявлено наличие заболевания у внучки, что позволит модифицировать ее образ жизни и своевременно применить медикаментозную терапию.
Список литературы
1. Meshkov AN, Ershova AI, Kiseleva AV, et al. The prevalence of heterozygous familial hypercholesterolemia in selected regions of the Russian Federation: The FH-ESSE-RF study. J Pers Med. 2021;11(6):464. doi:10.3390/jpm11060464.
2. Defesche JC, Gidding SS, Harada-Shiba M, et al. Familial hypercholesterolaemia. Nat Rev Dis Primers. 2017;3:17093. doi:10.1038/nrdp.2017.93.
3. Hobbs HH, Brown MS, Goldstein JL. Molecular genetics of the LDL receptor gene in familial hypercholesterolemia. Hum Mutat. 1992;1(6):445-66. doi:10.1002/humu.1380010602.
4. Koivisto UM, Turtola H, Aalto-Setälä K, et al. The familial hypercholesterolemia (FH)-North Karelia mutation of the low density lipoprotein receptor gene deletes seven nucleotides of exon 6 and is a common cause of FH in Finland. J Clin Invest. 1992;90(1):219-28. doi:10.1172/JCI115839.
5. Zakharova FM, Damgaard D, Mandelshtam MY, et al. Familial hypercholesterolemia in St-Petersburg: the known and novel mutations found in the low density lipoprotein receptor gene in Russia. BMC Med Genet. 2005;6:6. doi:10.1186/1471-2350-6-6.
6. Комарова Т. Ю., Головина А. С., Грудинина Н. А. и др. "Финские" мутации в гене рецептора липопротеинов низкой плотности — редкая причина семейной гиперхолестеринемии в Санкт-Петербурге и в Петрозаводске. Бюллетень экспериментальной биологии и медицины. 2013;155(3):359-62. EDN: PXUXDF.
7. Komarova TYu, Korneva VA, Kuznetsova TYu, et al. Familial hypercholesterolemia mutations in Petrozavodsk: no similarity to St. Petersburg mutation spectrum. BMC Med Genet. 2013; 14(1):128. doi:10.1186/1471-2350-14-128.
8. Pavloušková J, Réblová K, Tichý L, et al. Functional analysis of the p.(Leu15Pro) and p.(Gly20Arg) sequence changes in the signal sequence of LDL receptor. Atherosclerosis. 2016;250:9-14. doi:10.1016/j.atherosclerosis.2016.04.022.
9. Knowles JW, Rader DJ, Khoury MJ. Cascade screening for familial hypercholesterolemia and the use of genetic testing. JAMA. 2017;318(4):381-2. doi:10.1001/jama.2017.8543.
10. Wonderling D, Umans-Eckenhausen MA, Marks D, et al. Costeffectiveness analysis of the genetic screening program for familial hypercholesterolemia in the Netherlands. Semin Vasc Med. 2004;4(1):97-104. doi:10.1055/s-2004-822992.
11. Vuorio A, Raal FJ, Kovanen PT. Elevated levels of lipoprotein(a) and low density lipoprotein cholesterol in familial hypercholesterolemia patients: is dual primary prevention already in sight? Front. Cardiovasc. Med. 2025;12:1624049. doi:10.3389/fcvm.2025.1624049.
Об авторах
В. А. КорневаРоссия
Виктория Алексеевна Корнева — доцент кафедры факультетской терапии, фтизиатрии, инфекционных болезней и эпидемиологии медицинского института им. проф. А. П. Зильбера.
Петрозаводск
М. Ю. Мандельштам
Россия
Михаил Юрьевич Мандельштам — в.н.с. отдела молекулярной биологии, генетики и фундаментальной медицины.
Санкт-Петербург
А. В. Орлов
Россия
Артемий Владимирович Орлов — н.с. лаборатория физиологии кардиореспираторной системы и баромедицины.
Москва
Т. Ю. Кузнецова
Россия
Татьяна Юрьевна Кузнецова — зав. кафедрой факультетской терапии, фтизиатрии, инфекционных болезней и эпидемиологии медицинского института им. проф. А. П. Зильбера.
Петрозаводск
Ф. М. Захарова
Россия
Фаина Михайловна Захарова — с.н.с. отдела молекулярной биологии, генетики и фундаментальной медицины.
Санкт-Петербург
Дополнительные файлы
- Частота встречаемости семейной гиперхолестеринемии (СГХС) в России достигает 1:173, но подавляющее число случаев ее своевременно не диагностируется.
- Спектр патогенных вариантов нуклеотидной последовательности, ведущих к СГХС, является специфичным для каждой популяции.
- ДНК-диагностика СГХС и каскадный анализ в семье пробанда с идентифицированным патогенным вариантом нуклеотидной последовательности позволяют выявить заболевание до развития атеросклероза и его осложнений.
Рецензия
Для цитирования:
Корнева В.А., Мандельштам М.Ю., Орлов А.В., Кузнецова Т.Ю., Захарова Ф.М. Идентификация патогенной делеции c.925_931del гена рецептора липопротеинов низкой плотности (LDLR), характерной для финской Карелии, в семье с семейной гиперхолестеринемией в Петрозаводске. Клинический случай. Кардиоваскулярная терапия и профилактика. 2025;24(7):4353. https://doi.org/10.15829/1728-8800-2025-4353. EDN: IIKOTK
For citation:
Korneva V.A., Mandelstam M.Yu., Orlov A.V., Kuznetsova T.Yu., Zakharova F.M. Identification of pathogenic deletion c.925_931del of the low-density lipoprotein receptor (LDLR) gene, characteristic of Finnish Karelia, in a family with familial hypercholesterolemia in Petrozavodsk. A case report. Cardiovascular Therapy and Prevention. 2025;24(7):4353. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4353. EDN: IIKOTK

























































