Перейти к:
Эндоваскулярная реваскуляризация миокарда у пациентки, перенесшей транскатетерную имплантацию аортального клапана. Клинический случай
https://doi.org/10.15829/1728-8800-2025-4461
EDN: OVJZVY
Аннотация
Транскатетерная имплантация аортального клапана (ТИАК) — эффективный и безопасный метод лечения аортального стеноза (АС), особенно у пациентов высокого хирургического риска. Очевидно, что с повышением качества и увеличением продолжительности жизни населения в клинической практике все чаще будут встречаться коморбидные пациенты с критическим АС, у которых основным методом хирургического лечения будет ТИАК. Несмотря на достигнутые успехи в ведении пациентов с сердечно-сосудистыми заболеваниями, их непрерывное прогрессирование может привести к развитию de novo атеросклеротического поражения или рестеноза в ранее стентированном артериальном сегменте коронарного русла. Конструкция протезов аортального клапана, используемых при ТИАК, может наложить ряд технических ограничений при необходимости повторных интервенций на коронарных артериях. В настоящей статье представлен клинический случай успешного эндоваскулярного лечения многососудистого поражения коронарного русла под контролем внутрисосудистого определения показателей коронарного кровотока у коморбидной пациентки, ранее перенесшей ТИАК.
Ключевые слова
Для цитирования:
Васильев Д.К., Араблинский Н.А., Замятин Р.А., Шукуров Ф.Б., Фещенко Д.А., Талиуридзе М.Т. Эндоваскулярная реваскуляризация миокарда у пациентки, перенесшей транскатетерную имплантацию аортального клапана. Клинический случай. Кардиоваскулярная терапия и профилактика. 2025;24(7):4461. https://doi.org/10.15829/1728-8800-2025-4461. EDN: OVJZVY
For citation:
Vasiliev D.K., Arablinsky N.A., Zamyatin R.A., Shukurov F.B., Feshchenko D.A., Taliuridze M.T. Endovascular myocardial revascularization in a patient after transcatheter aortic valve implantation: a case report. Cardiovascular Therapy and Prevention. 2025;24(7):4461. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4461. EDN: OVJZVY
Введение
Транскатетерная имплантация (ТИАК) аортального клапана (АК) в настоящее время представляет собой эффективный и безопасный метод хирургического лечения аортального стеноза (АС) [1]. Основными преимуществами данной методики по сравнению со стандартным открытым хирургическим протезированием АК являются малотравматичность и малоинвазивность процедуры, а также возможности ранней выписки из стационара и быстрые сроки возвращения к повседневной деятельности. Кроме того, последние данные показали сопоставимые результаты ТИАК и открытого протезирования АК у пациентов низкого хирургического риска <75 лет, что может привести к более широкому использованию ТИАК в рутинной клинической практике [2]. Таким образом, уникальная операция отчаяния, которой была ТИАК на заре становления методики, стала в настоящее время полноценной альтернативой традиционному открытому протезированию АК.
Ввиду общих факторов риска и во многом схожих механизмов патогенеза, сочетание АС и ишемической болезни сердца (ИБС) встречается в клинической практике достаточно часто [3]. К сожалению, несмотря на достигнутые успехи в профилактике, лечении и диспансерном наблюдении за пациентами с ИБС, непрерывное прогрессирование атеросклероза в коронарных артериях (КА) может привести к необходимости проведения повторных интервенций для лечения как внутристентового рестеноза, так и de novo возникших поражений КА. Наличие же протеза АК может создать ряд технических трудностей при катетеризации КА [4].
Конструктивно протезы для ТИАК можно разделить на 2 большие группы: самораскрывающиеся и баллон-расширяемые. Каждая группа обладает своими сильными и слабыми сторонами, а выбор того или иного клапана во многом диктуется анатомо-морфологическими особенностями нативного клапана и его поражения. Независимо от типа имплантированного протеза доступ к КА будет затруднен в любом случае, что продемонстрировано на рисунке 1 [5]. Результатом этого может стать увеличение времени "дверь-баллон" при остром коронарном синдроме, повышение частоты технической неудачи чрескожного коронарного вмешательства и увеличение частоты развития неблагоприятного исхода у пациентов с острым коронарным синдромом после ТИАК, что было показано в исследовании Faroux L, et al. [4].
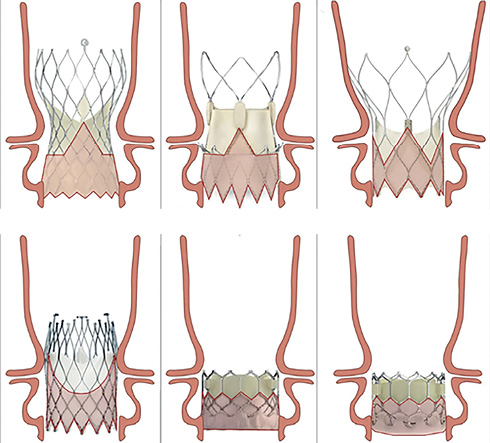
Рис. 1 Отношение устьев КА и положения протеза АК после ТИАК. Самораскрывающиеся клапаны: A) Evolut R/PRO/PRO+; B) ACURATE neo/neo2; C) Portico; D) ALLEGRA. Баллон-расширяемые клапаны: E) SAPIEN 3/ULTRA; F) Myval. (Адаптировано из работы Valvo R, et al. [5]).
Золотым стандартом диагностики ИБС служит коронароангиография (КАГ), которая позволяет оценить анатомию, наличие и степень выраженности поражения КА. Однако, как и любой другой диагностический метод, КАГ имеет ряд ограничений. Двумерное изображение, получаемое по результатам КАГ, не может показать функциональную значимость атеросклеротического поражения, в связи с чем при принятии решения о необходимости реваскуляризации миокарда необходимо учитывать результаты нагрузочного теста с верификацией ишемии или результаты применения методов внутрисосудистой визуализации, в т.ч. с определением физиологии коронарного кровотока. Наиболее распространенными и удобными в клинической практике методами определения физиологии коронарного кровотока являются: фракционный резерв кровотока (ФРК) и моментальный резерв кровотока (МРК). Для проведения данных обследований необходим коронарный проводник с датчиком давления на конце. ФРК выполняется на фоне максимальной гиперемии, которая достигается посредством внутрикоронарного введения лекарственных средств, что является аналогом гиперемии при проведении нагрузочного теста. МРК же, в свою очередь, не требует введения препаратов, вызывающих гиперемию [6]. Значения ФРК ≤0,80 и МРК ≤0,89 считаются пограничными для принятия решения о необходимости реваскуляризации миокарда.
В работе представлен клинический случай успешной эндоваскулярной реваскуляризации КА под внутрисосудистым контролем физиологии коронарного кровотока у коморбидной пациентки, ранее перенесшей ТИАК.
Описание клинического случая
Информация о пациентке: Пациентка В., 87 лет, была госпитализирована в отделение рентгенхирургических методов диагностики и лечения ФГБУ "НМИЦ ТПМ" Минздрава России в ноябре 2024г с жалобами на давящую боль за грудиной и одышку при ходьбе на дистанцию до 50 м, купирующиеся в покое в течение 1-2 мин. Из анамнеза заболевания известно, что подобные жалобы пациентка впервые отметила в 2014г. Тогда была выполнена КАГ с баллонной ангиопластикой (БАП) и стентированием ствола левой КА (ЛКА) (ОСЛКА) с переходом на огибающую ветвь (ОВ). В дальнейшем (в 2017г) отмечала возобновление клинической картины стенокардии напряжения. Вновь проводилась КАГ, по результатам которой выполнена БАП со стентированием передней межжелудочковой ветви (ПМЖВ). Однако, несмотря на проведенное эндоваскулярное лечение, пациентка отмечала сохранение одышки при физической нагрузке с постепенным прогрессированием. В 2019г по данным трансторакальной эхокардиографии (ЭхоКГ) установлен диагноз АС тяжелой степени. В том же году была проведена ТИАК протезом Core Valve 26 мм (Medtronic, USA). В 2023г пациентка вновь отметила рецидив клиники стенокардии напряжения с постепенным прогрессированием. В 2024г была консультирована кардиологом, по результатам чего направлена на плановую госпитализацию в ФГБУ "НМИЦ ТПМ" Минздрава России.
Из анамнеза жизни известно, что с 2000г пациентка страдает сахарным диабетом 2 типа, и с 2019г находится на инсулинотерапии, уровень гликированного гемоглобина в настоящее время — 8,2%. В 2010г перенесла острое нарушение мозгового кровообращения по ишемическому типу, тогда же во время госпитализации впервые выявлен пароксизм фибрилляции предсердий (ФП), в динамике — постоянная форма ФП с тактикой контроля частоты сердечных сокращений. В 2019г по поводу гонартроза III ст. перенесла операцию эндопротезирования левого коленного сустава.
На момент госпитализации регулярно принимала: ривароксабан 20 мг/сут., аторвастатин 20 мг/сут., эналаприл 10 мг/сут., спиронолактон 50 мг/сут., бисопролол 2,5 мг/сут., дапаглифлозин 10 мг/сут., инсулин гларгин 35 ЕД/сут., хумулин регуляр под контролем гликемии.
При проведении предоперационного обследования: на электрокардиограмме ритм ФП с частотой желудочковых сокращений 40-75-115 уд./мин. В общем анализе крови и мочи без клинически значимых отклонений. В биохимическом анализе крови недостижение целевых уровней общего холестерина (4,36 ммоль/л) и холестерина липопротеинов низкой плотности (2,61 ммоль/л); гипергликемия до 6,2 ммоль/л; уровень креатинина 67 мкмоль/л, скорость клубочковой фильтрации — 71 мл/мин/1,73 м2. По данным ЭхоКГ — увеличение объема левого предсердия до 54 мл/м2, гипертрофия межжелудочковой перегородки 1,5 см, индекс массы миокарда левого желудочка 167 г/м2. Параметры гемодинамики на протезе АК: средний трансклапанный градиент — 16 мм рт.ст., скорость кровотока — 274 см/с.
На основании данных жалоб, анамнеза, физикального и инструментального обследований был выставлен предварительный диагноз:
Основное заболевание: Ишемическая болезнь сердца: стенокардия напряжения III функционального класса. БАП со стентированием ОСЛКА с переходом на ОВ от 2015г. БАП со стентированием ПМЖВ от 2017г.
Сочетанное заболевание: Приобретенный порок сердца — стеноз устья аорты тяжелой степени. Операция транскатетерной имплантации аортального клапана Core Valve 26 от 2019г.
Фоновые заболевания: Гипертоническая болезнь III стадии, контролируемая артериальная гипертония, риск сердечно-сосудистых осложнений 4. Атеросклероз аорты, КА. Дислипидемия. Сахарный диабет 2 типа, целевой уровень гликированного гемоглобина <8,0%. Экзогенно-конституциональное ожирение 1 ст.
Осложнения основного заболевания: Нарушение ритма сердца: постоянная форма ФП, нормосистолический вариант. Риск по шкале CHA2DS2-VASc — 9 баллов, риск по HAS-BLED — 3 балла.
Сопутствующие заболевания: Цереброваскулярная болезнь. Хроническая ишемия головного мозга. Острое нарушение мозгового кровообращения по ишемическому типу от 2010г. Вестибулоатактический синдром. Хроническая болезнь почек С2. Двусторонний гонатроз 4 ст., коксартроз 3 ст. Операция эндопротезирования левого коленного сустава от 2019г.
Медицинские вмешательства
В связи с невозможностью проведения нагрузочной пробы для верификации стресс-индуцированной ишемии миокарда была принята стратегия проведения КАГ. Сосудистым артериальным доступом была выбрана левая лучевая артерия.
По результатам КАГ, проведенной диагностическими катетерами Judkins Left (JL) (этапы катетеризации представлены на серии стоп-кадров на рисунках 2 и 3) и Judkins Right (JR) 6F, отмечалось наличие этапных рестенозов среднего сегмента ПМЖВ, пограничного стеноза среднего сегмента правой КА (ПКА) (рисунки 4, 5). Направляющими катетерами JL4 и в последующем JR4 выполнена последовательная катетеризация устьев левой и правой коронарных артерий. Для определения гемодинамической значимости поражения коронарного русла было выполнено определение физиологии коронарного кровотока методом МРК. По результатам 3-кратного определения МРК каждого стенозированного участка (COMET II Pressure Guidewire, Boston Scientific) — МРК проксимального рестеноза ПМЖВ 0,69; МРК дистального рестеноза ПМЖВ 0,91; МРК стеноза среднего сегмента ПКА — 0,63. На основании этих данных выполнена реваскуляризация в бассейне пораженных КА: БАП со стентированием среднего сегмента ПМЖВ и БАП со стентированием среднего сегмента ПКА. Финальные ангиограммы представлены на рисунке 6. В стабильном состоянии пациентка была переведена в отделение реанимации и интенсивной терапии для дальнейшего наблюдения.
В дальнейшем боли ангинозного характера и одышка не рецидивировали. Пациентка была выписана на 3 сут. после операции под диспансерное наблюдение терапевта и кардиолога по месту жительства. Были даны рекомендации по диете, соблюдению режима труда и отдыха. В качестве оптимальной медикаментозной терапии назначены: ривароксабан 20 мг/сут., клопидогрел 75 мг/сут., аторвастатин 80 мг/сут., бисопролол 5 мг/сут., эналаприл 20 мг/сут., амлодипин 10 мг/сут., дапаглифлозин 10 мг/сут., метформин 1000 мг/сут., инсулин гларгин 35 ед/сут., хумулин регуляр под контролем гликемии. В дальнейшем через 6 мес. при телефонном контроле состояния пациентки: ангинозных болей, одышки не отмечает, физические нагрузки переносит удовлетворительно.
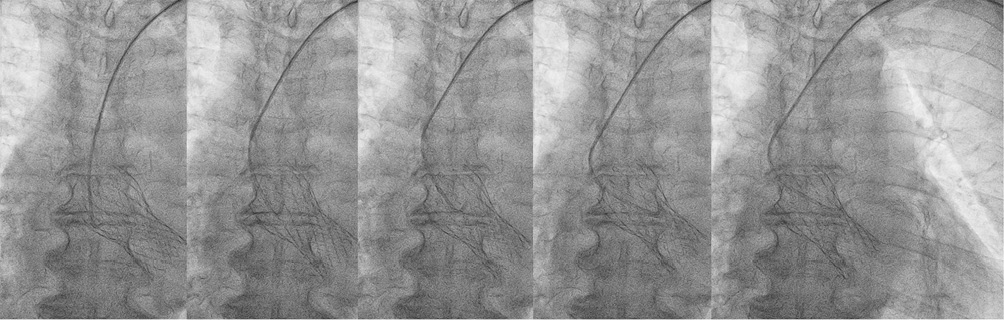
Рис. 2 Этапы катетеризации устья ЛКА: A — позиционирование катетера JL4 в восходящей аорте; B — разворот катетера в восходящей аорте; C, D — поиск оптимальной ячеи протеза для катетеризации левого коронарного синуса; E — селективная катетеризация устья ЛКА.
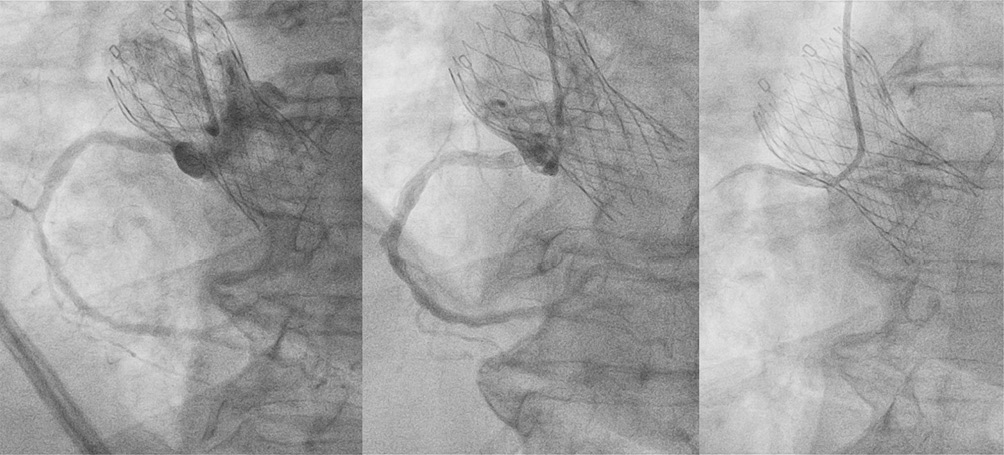
Рис. 3 Этапы катетеризации устья ПКА: A — неселективная съемка для определения взаимоотношения ячеек протеза и устья ПКА; B — поиск оптимальной ячеи протеза; C — селективная катетеризация устья ПКА.
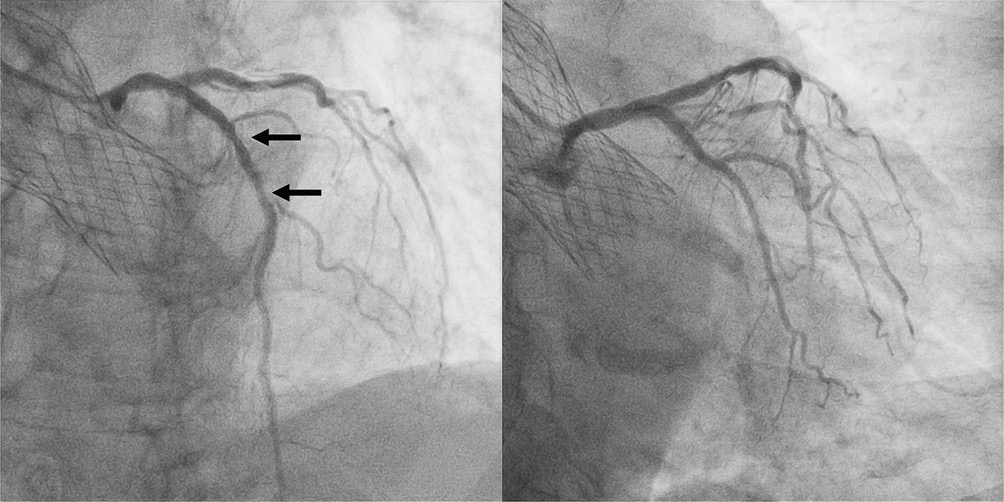
Рис. 4 Ранее имплантированный стент в ОСЛКА-ОВ проходим, этапные рестенозы в ПМЖВ (отмечены красными стрелками), система ОВ интактна.
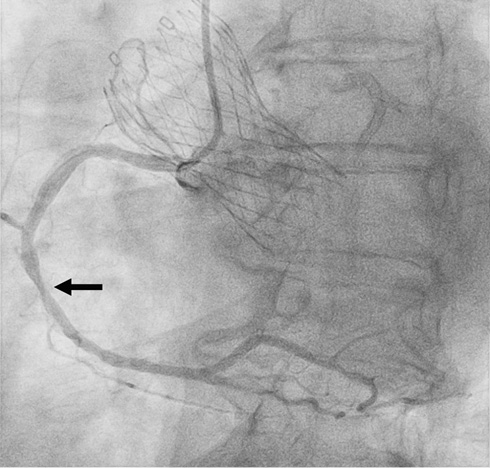
Рис. 5 Стеноз среднего сегмента ПКА (отмечен красной стрелкой).
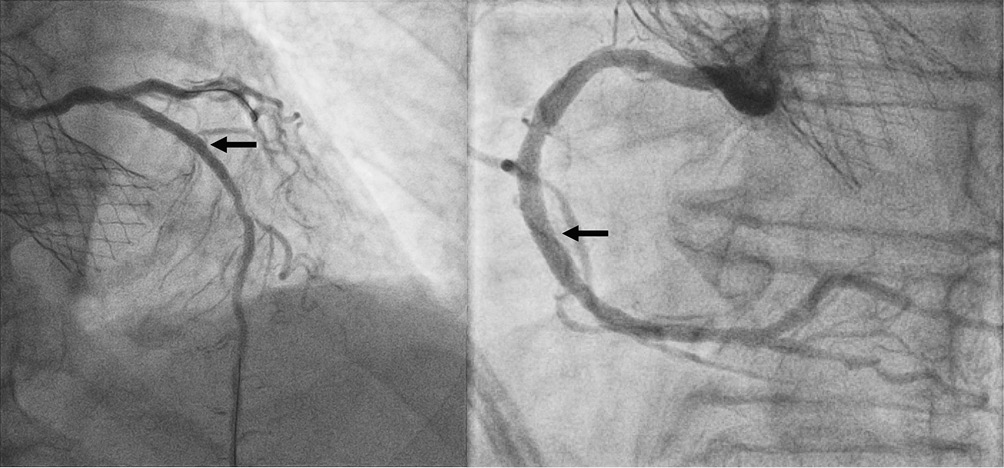
Рис. 6 Финальный результат (имплантированные стенты отмечены зелеными стрелками).
Обсуждение
Сочетание АС и ИБС встречается достаточно часто, что обусловлено общими факторами риска и патогенеза развития этих заболеваний. Согласно исследованию [7], до 80% пациентов, которым была проведена ТИАК, имеют сопутствующую ИБС различных градаций. Исторически пациентам, имевшим данное коморбидное состояние, выполнялось одномоментное протезирование АК и аортокоронарное шунтирование. Однако ввиду все большей распространенности ТИАК при лечении АС, в т.ч. и у молодых пациентов, вопрос повторных коронарных интервенций будет стоять все более остро.
С учетом сложности катетеризации при наличии протеза наиболее предпочтительными сосудистыми доступами являются бедренная или левая лучевая артерии, что обусловлено анатомической легкостью направления положения катетера. Катетеризацию рекомендуется проводить в коаксиальном направлении, часто с использованием катетера меньшего размера ввиду более узкого поперечного диаметра протеза по сравнению с нативным диаметром аорты [5].
Возможность селективной катетеризации устья КА после ТИАК зависит от ряда параметров; это: 1) соотношение стенки аорты и протеза, 2) положение створок протеза, 3) положение комиссур протеза к устьям коронарных артерий, 4) конструктивная особенность протеза. Например, при наличии узкого синуса Вальсальвы может не хватить пространства для маневрирования катетером между устьем артерии и стенкой протеза. Аналогичная ситуация имеет место при имплантации нового протеза АК в ранее имплантированный протез при его дисфункции. Крайне важной особенностью при ТИАК является высота позиционирования протеза: при высокой имплантации существует риск обструкции устьев КА; при низкой же имплантации увеличивается риск развития нарушений проводимости сердца и выраженной парапротезной регургитации, что ухудшает долгосрочные результаты после вмешательства [8][9]. В отличие от открытого протезирования АК, комиссуральная ориентация при ТИАК является случайной, ввиду отсутствия в настоящее время общепризнанного надежного метода выравнивания комиссур клапана с нативной комиссурой. Наличие же биопротезной комиссуры перед устьем КА, очевидно, является физическим препятствием к селективной катетеризации.
Подводя итог вышеописанным проблемам и эмпирически найденным решениям части из них, командой исследователей [5] из университетской клиники "G. Rodolico-San Marco" (Catania, Italy) был разработан собственный алгоритм проведения чрескожного коронарного вмешательства после ТИАК, представленный на рисунке 7. Использование данного алгоритма в практике позволит пошагово определить и разрешить возможные трудности при проведении повторных вмешательств на КА после ТИАК.
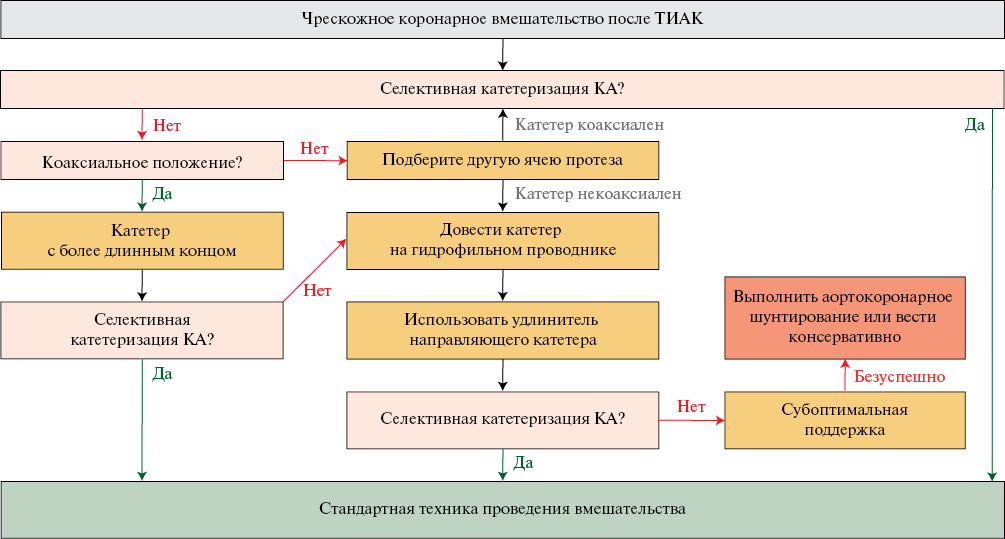
Рис. 7 Алгоритм проведения чрескожного коронарного вмешательства после ТИАК. (Адаптировано из работы Valvo R, et al. [5]).
Примечание: ТИАК — транскатетерная имплантация аортального клапана.
В представленном клиническом случае, согласно перечисленным рекомендациям, сосудистым доступом была выбрана левая лучевая артерия. Диагностические и направляющие катетеры семейства Judkins позволили коаксиально и селективно выполнить катетеризацию ПКА и ЛКА, а также выполнить стентирование с оптимальной поддержкой инструментария. Пошаговый поиск оптимальной ячеи протеза для селективной катетеризации представлен на рисунках 2 и 3. В свою очередь, использование МРК позволило определить гемодинамически значимые поражения у данной пациентки и выполнить вмешательства в бассейне именно тех поражений, которые определяют наличие стенокардии напряжения.
Заключение
Учитывая общность патогенеза развития ИБС и АС, стоит принимать во внимание возможность развития значимого поражения КА после проведенной ТИАК. Доступ к устьям КА может быть технически затруднен, что может увеличить время вмешательства, количество контрастного вещества и объем лучевой нагрузки.
Информированное согласие: информированное согласие пациента на публикацию своих данных получено 16.01.2025.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022; 43(7):561-632. doi:10.1093/eurheartj/ehab395.
2. Modine T, Tchétché D, Van Mieghem N, et al. Three-Year Outcomes Fol lowing TAVR in Younger (<75 Years) Low Surgical Risk Severe Aortic Stenosis Patients. Circ Cardiovasc Interv. 2024;(11):e014018. doi:10.1161/CIRCINTERVENTIONS.124.014018.
3. Stefanini GG, Panico C. CAD in TAVI patients: relevance of disease complexity. EuroIntervention. 2015;(4):373-5. doi:10.4244/EIJV11I4A76.
4. Faroux L, Lhermusier T, Vincent F, et al. ST-Segment Elevation Myocardial Infarction Following Transcatheter Aortic Valve Replacement. JACC. 2021;77(17):2187-99. doi:10.1016/j.jacc.2021.03.014.
5. Valvo R, Costa G, Tamburino C, Barbanti M. Coronary artery can nulation after transcatheter aortic valve Implantation. EuroIntervention. 2021;17:835-47. doi:10.4244/EIJ-D-21-00158.
6. Барбараш О. Л., Карпов Ю. А., Панов А. В. и др. Стабильная ишемическая болезнь сердца. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(9):6110. doi:10.15829/1560-4071-2024-6110.
7. Stefanini GG, Stortecky S, Meier B, et al. Severe aortic stenosis and coronary artery disease. EuroIntervention. 2013;9 Suppl:S63-8. doi:10.4244/EIJV9SSA12.
8. Nazif TM, Dizon JM, Hahn RT, et al. Predictors and clinical outcomes of permanent pacemaker implantation after transcatheter aortic valve replacement: the PARTNER (Placement of AoRtic TraNscathetER Valves) trial and registry. JACC Cardiovasc Interv. 2015;8(1 Pt A):60-9. doi:10.1016/j.jcin.2014.07.022.
9. Hahn RT, Kodali S, Généreux P, et al. Paravalvular regurgitation following transcutaneous aortic valve replacement: predictors and clinical significance. Curr Cardiol Rep. 2014;16(5):475. doi:10.1007/s11886-014-0475-6.
Об авторах
Д. К. ВасильевРоссия
Дмитрий Константинович Васильев — к.м.н., руководитель отдела рентгенэндоваскулярной и сердечно-сосудистой хирургии им. проф. В. П. Мазаева, врач по РЭВДиЛ.
Москва
Н. А. Араблинский
Россия
Никита Александрович Араблинский — м.н.с. отдела рентгенэндоваскулярной и сердечно-сосудистой хирургии им. проф. В. П. Мазаева, врач-кардиолог, врач по РЭВДиЛ.
Москва
Р. А. Замятин
Россия
Роман Александрович Замятин — аспирант по специальности кардиология.
Москва
Ф. Б. Шукуров
Россия
Фирдавс Баходурович Шукуров — к.м.н., с.н.с., руководитель лаборатории интервенционной радиологии, врач по РЭВДиЛ.
Москва
Д. А. Фещенко
Россия
Дарья Анатольевна Фещенко — м.н.с. лаборатории интервенционной радиологии, врач по РЭВДиЛ, зав. операционным блоком.
Москва
М. Т. Талиуридзе
Россия
Марьям Темуровна Талиуридзе — м.н.с. лаборатории интервенционной радиологии, врач по РЭВДиЛ.
Москва
- Транскатетерная имплантация аортального клапана (АК) прочно вошла в арсенал методов лечения аортального стеноза, особенно у пациентов высокого хирургического риска.
- Конструкция протеза для транскатетерной имплантации АК может создать ряд технических трудностей при проведении повторных интервенций на коронарных артериях.
- В статье представлено описание клинического случая успешной эндоваскулярной реваскуляризации коронарных артерий под внутрисосудистым контролем физиологии коронарного кровотока у коморбидной пациентки, ранее перенесшей транскатетерную имплантацию АК.
Рецензия
Для цитирования:
Васильев Д.К., Араблинский Н.А., Замятин Р.А., Шукуров Ф.Б., Фещенко Д.А., Талиуридзе М.Т. Эндоваскулярная реваскуляризация миокарда у пациентки, перенесшей транскатетерную имплантацию аортального клапана. Клинический случай. Кардиоваскулярная терапия и профилактика. 2025;24(7):4461. https://doi.org/10.15829/1728-8800-2025-4461. EDN: OVJZVY
For citation:
Vasiliev D.K., Arablinsky N.A., Zamyatin R.A., Shukurov F.B., Feshchenko D.A., Taliuridze M.T. Endovascular myocardial revascularization in a patient after transcatheter aortic valve implantation: a case report. Cardiovascular Therapy and Prevention. 2025;24(7):4461. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4461. EDN: OVJZVY
JATS XML

























































