Перейти к:
Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции. Междисциплинарный консенсус
https://doi.org/10.15829/1728-8800-2025-4466
EDN: MIARUF
Аннотация
Разработан экспертами Российского научного медицинского общества терапевтов (РНМОТ), Российского общества профилактики неинфекционных заболеваний (РОПНИЗ), Национальной ассоциации нефрологов (НАН), Профессиональной ассоциации нефрологов (ПАН), Российского кардиологического общества (РКО), Российского медицинского общества по артериальной гипертонии (РМОАГ), Общества специалистов по сердечной недостаточности (ОССН), Национального общества по изучению атеросклероза (НОА), Российской ассоциации эндокринологов (РАЭ), Российской ассоциации геронтологов и гериатров (РАГГ).
Согласованное мнение экспертов составлено на основании соответствующих разделов национальных и международных клинических рекомендаций по хронической болезни почек, профилактике и лечению атеросклероза, артериальной гипертонии, сахарного диабета и сердечной недостаточности.
Ключевые слова
Для цитирования:
Драпкина О.М., Кобалава Ж.Д., Шестакова М.В., Бобкова И.Н., Ефремовцева М.А., Виллевальде С.В., Батюшин М.М., Беленков Ю.Н., Ватазин А.В., Галявич А.С., Ежов М.В., Козловская Н.Л., Котенко О.Н., Котовская Ю.В., Лысенко Л.В., Моисеев С.В., Недогода С.В., Терещенко С.Н., Ткачева О.Н., Фомин В.В., Чазова И.Е., Чесникова А.И., Шамхалова М.Ш., Шилов Е.М., Шутов А.М. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции. Междисциплинарный консенсус. Кардиоваскулярная терапия и профилактика. 2025;24(6):4466. https://doi.org/10.15829/1728-8800-2025-4466. EDN: MIARUF
For citation:
Drapkina O.M., Kobalava Zh.D., Shestakova M.V., Bobkova I.N., Efremovtseva M.A., Villevalde S.V., Batyushin M.M., Belenkov Yu.N., Vatazin A.S., Galyavich A.S., Yezhov M.V., Kozlovskaya N.L., Kotenko O.N., Kotovskaya Yu.V., Lysenko L.V., Moiseyev S.V., Nedogoda S.V., Tereshchenko S.N., Tkacheva O.N., Fomin V.V., Chazova I.E., Chesnikova A.I., Shamkhalova M.Sh., Shilov E.M., Shutov A.M. Cardiovascular risk and chronic kidney disease: strategies for cardiac and renal protection. Interdisciplinary consensus. Cardiovascular Therapy and Prevention. 2025;24(6):4466. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4466. EDN: MIARUF
Предисловие
Представляемый междисциплинарный консенсус "Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции" является логическим продолжением ранее опубликованных рекомендаций "Функциональное состояние почек и прогнозирование сердечно-сосудистого риска" (2008) и "Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции" (2014) [1][2].
За прошедшие 10 лет объем наших знаний о кардиоренальных взаимоотношениях, в т.ч. и на фоне метаболических нарушений, значительно увеличился, стали понятны многие патогенетические механизмы этого взаимодействия и появились новые классы лекарственных препаратов, обладающих кардионефропротективными свойствами.
Концепция хронической болезни почек (ХБП) признана во всем мире, однако, несмотря на то что диагностика ее проста, разработаны методы профилактики и лечения, способные замедлить прогрессирование, а в некоторых случаях и предотвратить развитие патологии почек, распространенность ХБП и ассоциированная с ней смертность растут, в отличие от других неинфекционных заболеваний. Исследование "Глобальное бремя болезней" (2020) прогнозирует дальнейший рост количества лиц с заболеваниями почек в мире и увеличение связанной с ними смертности, прежде всего, сердечно-сосудистой смертности [3]. В качестве определяющих факторов этого рассматриваются старение населения, эпидемия ожирения и сахарного диабета (СД) 2 типа, изменение климата, экологические проблемы, однако не последнюю роль играет невыполнение (по разным причинам) врачами рекомендаций по первичной профилактике и раннему выявлению ХБП. Именно недооценке важности проблемы роста распространенности ХБП в мире и связанному с этим увеличению риска сердечно-сосудистых осложнений (ССО), проблеме не только медицинской, но и экономической, посвящено недавнее заявление Международного общества нефрологии, Европейской почечной ассоциации и Американского общества нефрологии (2024), поддержанное региональными нефрологическими сообществами [4]. Мы полностью поддерживаем это заявление, основные положения которого отражены и в междисциплинарном консенсусе "Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции".
Введение
ХБП занимает особое место среди хронических неинфекционных болезней, поскольку, сочетаясь с другими, чаще всего сердечно-сосудистыми, заболеваниями (ССЗ), утяжеляет их течение, при этом выраженность поражения почек зачастую является одним из наиболее значимых факторов, влияющих на исход заболевания1 [1-6].
Несмотря на то, что ХБП в значительной степени поддается профилактике и лечению, бремя ее (распространенность, ассоциированная с ней смертность, затраты системы здравоохранения) неуклонно возрастает, в т.ч. из-за старения населения. ХБП ассоциирована с неблагоприятным вариантом старения, ассоциированным с преждевременным/ускоренным развитием гериатрических синдромов (старческой астении, саркопении, недостаточности питания, когнитивных нарушений, падений), их более тяжелым течением вследствие ХБП и ее осложнений, полипрагмазией с повышением риска почечных и не почечных неблагоприятных эффектов лекарственной терапии [7].
Общая распространенность ХБП в мире по данным эпидемиологических исследований составляет от 9,1 до 13,4% (850 млн человек), сопоставима с распространенностью артериальной гипертонии (АГ), СД, ишемической болезни сердца (ИБС), ожирения и хронической обструктивной болезни легких (ХОБЛ), увеличивается при наличии сердечно-сосудистой патологии и СД. При этом частота ХБП может быть занижена из-за отсутствия программ раннего выявления заболеваний почек во многих регионах мира, что приводит к массовой неосведомленности о бремени и распространенности ранних стадий ХБП. Распространенность ХБП увеличивается с возрастом, составляет для людей 40-49 лет 12%, 50-59 лет — 16%, 60-69 лет — 27,6%, а в возрасте 70-79 лет достигает 34,3%2 [8][9].
В 2017г в мире от ХБП умерло 1,2 млн человек, еще 1,4 млн случаев смерти от ССЗ были в той или иной степени обусловлены поражением почек, что в сумме составило 4,6% (95% доверительный интервал (ДИ): 4,3-5,0%) от общей смертности. С 1990 по 2017гг распространенность ХБП в мире увеличилась на 29,3%, уровень общей смертности при этой патологии — на 41,5%, и ХБП переместилась с 17 на 12 место среди основных причин смерти. При этом уровень смертности, стандартизированной по возрасту, снизился при ХБП всего на 2,8%, в то время как при ССЗ — на 30,4%, ХОБЛ — на 41,3%, онкологических заболеваниях — на 14,9%, а в 2021г заболевания почек заняли 9 место в списке основных причин смерти. Согласно исследованию "Глобальное бремя болезней", к 2040г ХБП станет пятой по распространенности причиной смерти в мире, а годы жизни, потерянные из-за этой патологии, удвоятся. Это представляет собой самый быстрый прогнозируемый рост среди основных причин смерти после болезни Альцгеймера3 [3][10][11].
Крупных исследований, позволяющих оценить распространенность ХБП в российской популяции, не проводилось, однако по данным исследований в отдельных группах населения с повышенным риском поражения почек также отмечается увеличение количества больных ХБП с возрастом (36% у лиц старше 60 лет) и при наличии ССЗ (26%), среди трудоспособного населения ХБП встречается в 16% случаев [12][13].
В исследовании "Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации" (ЭССЕ-РФ) частота случаев снижения расчетной скорости клубочковой фильтрации (рСКФ) составила 26,5%, при этом у пациентов с АГ такое снижение встречалось в 2 раза чаще [14][15].
В неинтервенционной наблюдательной открытой многоцентровой программе "Получение дополнительных данных о распространенности сниженной скорости клубочковой фильтрации и альбуминурии у пациентов с АГ с или без СД 2 типа в Российской Федерации" (ХРОНОГРАФ) было показано, что сочетание двух маркеров ХБП (снижение рСКФ <60 мл/мин/1,73 м² и отношение альбумин/креатинин (Ал/Кр) в моче >30 мг/г) при сочетании АГ и СД было выявлено у 49,4% больных, у пациентов с СД по сравнению с пациентами без СД чаще выявляли снижение скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,73 м² (38 и 31%), высокую и очень высокую альбуминурию (36,6 и 28,1%) [16][17]. По данным Базы данных клинико-эпидемиологического мониторинга СД на территории Российской Федерации (РФ), при СД 1 типа ХБП выявляется в 22,8% случаев, при СД 2 типа — в 19,1% [18].
Результаты промежуточного анализа проспективного наблюдательного многоцентрового регистрового исследования пациентов с хронической сердечной недостаточностью (ХСН) в РФ (ПРИОРИТЕТ-ХСН) свидетельствуют о высокой частоте (43,2%) репортирования ХБП у амбулаторных пациентов с ХСН [19].
По данным Регистра Российского диализного общества, в 2018г различные виды заместительной почечной терапии (ЗПТ) получали почти 55 тыс. человек, а ежегодный прирост числа этих пациентов в среднем составил 6,4% [20].
Распространенность ХБП в РФ по данным Глобального атласа здоровья почек Международного общества нефрологии (ISN-GKHA) составила 19,2% (95% ДИ: 17,8-20,9%), что значительно выше глобальной медианы распространенности 9,5% (интерквартильный размах 5,9-11,7%), а смертность, ассоциированная с ХБП, составила всего лишь 0,62% (95% ДИ: 0,61-0,63%), что ниже мировых данных — 2,4% (интерквартильный размах 1,6-3,9%) [21], вероятно, вследствие особенностей статистического учета причин смерти в нашей стране, не учитывающего вклад дисфункции почек.
Высокая и неуклонно увеличивающаяся распространенность ХБП является не только медицинской, но и серьезной экономической проблемой даже в развитых странах. Затраты на лечение пациентов с ХБП увеличиваются по мере прогрессирования, зависят от сопутствующей патологии, а при необходимости проведения ЗПТ, возрастают в десятки раз по сравнению с затратами на лечение пациентов с риском развития или начальными стадиями ХБП. По данным Medicare расходы на оказание помощи больным с ХБП в 2017г составили >120 млрд долларов, что составляет 33,8% от общих расходов Medicare на оплату услуг. Интересно, что при количестве больных с терминальной почечной недостаточностью (ТПН) в системе Medicare, не превышающем 1%, затраты только на этих пациентов составили 7,2% [22]. Предполагается, что популяционные изменения в возрастном и расовом составе, распространенность ожирения и СД, снижение смертности среди больных ТПН приведут к увеличению количества пациентов с ТПН в США на 29-68% к 2030г [23].
Количество больных, нуждающихся в ЗПТ, увеличивается и в России. Основной причиной этого роста является высокая распространенность в российской популяции СД, АГ, ССЗ и ожирения, при этом обеспеченность различными вариантами ЗПТ в России ниже, чем в развитых странах. Средние затраты на проведение гемодиализа и перитонеального диализа в РФ составляют 16447 и 26126 долларов в год, соответственно. Смертность в течение первого года ЗПТ у пациентов с ТПН в РФ варьирует в пределах 1-10%, а наиболее распространенной причиной смерти были ССЗ [21].
Наиболее целесообразным решением этой экономической проблемы является, наряду с развитием трансплантологии и сети диализных центров, внедрение в реальную клиническую практику основных принципов нефропротективной стратегии: регулярный скрининг на наличие ХБП в группах высокого риска ее развития и раннее начало оптимальной нефро- и кардиопротективной терапии, что позволит значительно снизить скорость прогрессирования ХБП, уменьшить смертность в этой популяции и отодвинуть начало или предотвратить ЗПТ.
1. Определение, диагностические критерии и классификация хронической болезни почек
1.1. Определение, диагностические критерии и классификация хронической болезни почек
ХБП — наднозологическое понятие, объединяющее всех пациентов с сохраняющимися в течение ≥3 мес. признаками повреждения почек, выявленными при лабораторном, инструментальном или морфологическом исследованиях1 [5][6].
При сохранной функции почек (СКФ ≥90 мл/мин/1,73 м²), а также при начальном ее снижении (60≤ СКФ <89 мл/мин/1,73 м²) для диагноза ХБП необходимо наличие маркеров повреждения почек (альбуминурия, стойкие изменения мочевого осадка и др.), которые представлены в таблице 1.1.1. При выявляемой >3 мес. СКФ <60 мл/мин/1,73 м² ХБП диагностируется даже в отсутствие других маркеров повреждения почек. Диагностические критерии ХБП не зависят от возраста, при этом у пожилых пациентов следует обращать внимание в т.ч. и на скорость снижения СКФ [7].
Таблица 1.1.1
Маркеры повреждения почек [6]
|
• Альбуминурия/протеинурия, отношение альбумин/креатинин в моче • Изменения мочевого осадка (эритроцитурия, лейкоцитурия, цилиндрурия) • Канальцевые дисфункции (снижение относительной плотности мочи, глюкозурия без СД, нарушения кислотно-основного или электролитного баланса) • Необратимые структурные изменения почек при визуализации • Морфологические изменения (по данным биопсии почки) • Трансплантация почки в анамнезе • СКФ <60 мл/мин/1,73 м² (стадии СКФ 3а-5) |
Примечание: СД — сахарный диабет, СКФ — скорость клубочковой фильтрации.
Критерии диагноза ХБП1
- Наличие любых клинических признаков, указывающих на повреждение почек и персистирующих не менее 3 мес. и/или;
- Снижение СКФ <60 мл/мин/1,73 м², сохраняющееся в течение ≥3 мес., вне зависимости от наличия других признаков повреждения почек и/или;
- Наличие признаков необратимых структурных изменений органа, выявленных однократно при прижизненном патологоанатомическом исследовании органа или при его визуализации.
При наличии у пациента признаков поражения почек необходимо провести полное клинико-лабораторное и инструментальное обследование для подтверждения или исключения ХБП.
ХБП классифицируют на основании уровня СКФ, рассчитанной по формуле CKD-EPI или определенной клиренсовым методом (таблица 1.1.2), и уровня альбуминурии (таблица 1.1.3), поскольку СКФ и экскреция альбумина с мочой имеют самостоятельное диагностическое и прогностическое значение в оценке рисков общей и сердечно-сосудистой смертности, развития ТПН, острого повреждения почек (ОПП) и прогрессирования ХБП1 [6][24][25]. В российских рекомендациях выделяется четыре градации альбуминурии, четвертая градация (А4) соответствует нефротическому уровню альбуминурии/протеинурии1.
Таблица 1.1.2
Классификация ХБП по уровню СКФ
|
Стадия |
СКФ (мл/мин/1,73 м²) |
Описание |
|
С1 |
>90 |
высокая или оптимальная |
|
С2 |
60-89 |
незначительно сниженная |
|
С3а |
45-59 |
умеренно сниженная |
|
С3б |
30-44 |
существенно сниженная |
|
С4 |
15-29 |
резко сниженная |
|
С5 |
<15 |
терминальная почечная недостаточность (Д/Т) |
Примечание: СКФ — скорость клубочковой фильтрации, С — стадия хронической болезни почек, Д/Т — диализ/трансплантация.
Таблица 1.1.3
Градация ХБП по уровню альбуминурии/протеинурии1
|
Норма/незначительно повышен (А1) |
Высокая (А2) |
Очень высокая (А3)* |
Нефротическая (А4)** |
|
|
Альбумин в моче |
||||
|
СЭА (мг/сут.) |
<30 |
30-299 |
300-1999 |
>2000 |
|
Ал/Кр мочи (мг/г) |
<30 |
30-299 |
300-999 |
>2000 |
|
Ал/Кр мочи (мг/ммоль) |
<3 |
3-29 |
30-99,9 |
>200 |
|
Общий белок в моче |
||||
|
СЭБ (мг/cут.) |
<150 |
150-500 |
>500 |
>3500 |
|
ОБ/Кр мочи (мг/г) |
<150 |
150-500 |
>500 |
>3500 |
Примечание: * — соответствует суточной протеинурии >0,5 г; ** — соответствует суточной протеинурии >3,5 г. При альбуминурии уровня А3-4 можно использовать определение суточной протеинурии или отношение ОБ/Кр в утренней порции мочи. СЭА — суточная экскреции альбумина, Ал/Кр — отношение альбумин/креатинин, СЭБ — суточная экскреция белка, ОБ/Кр — отношение общий белок/креатинин.
Разделение 3 стадии ХБП по уровню СКФ на стадии 3а и 3б связано с разным сердечно-сосудистым и почечным прогнозом: в подгруппе лиц с СКФ от 59 до 45 мл/мин/1,73 м² весьма высоки сердечно-сосудистые риски при умеренных темпах прогрессирования ХБП, а у пациентов с уровнем СКФ от 44 до 30 мл/мин/1,73 м², напротив, риск развития ТПН оказывается выше, чем риск летальных ССО [26-28].
Если пациент получает ЗПТ, следует указывать ее вид — диализ (Д) и трансплантация (Т) после стадии ХБП.
У каждого пациента с ХБП необходимо проводить диагностику конкретной причины развития повреждения почек для определения этиологического диагноза и выбора терапии, направленной на устранение или коррекцию этиологического фактора и основные элементы патогенеза.
В медицинской документации пациентов с установленной ХБП после нозологического диагноза (уточняющего причину(ы) поражения почек) следует ставить аббревиатуру "ХБП" с указанием стадии в зависимости от значений СКФ и градации выраженности альбуминурии/протеинурии для стратификации рисков, определения прогноза пациента, выработки тактики лечения и диспансерного наблюдения1 [6].
Примеры диагностических заключений
- Гипертоническая болезнь 3 стадии, риск 4. Гипертонический нефросклероз. ХБП С3б А2.
- СД 2 типа. Диабетическая нефропатия. АГ 2 ст., риск 3. Целевой HbА1с <7,0%. ХБП С2 А2.
В 2007г понятие ХБП было введено в Международную классификацию болезней 10-го пересмотра, а термин "хроническая почечная недостаточность" был из нее изъят как устаревший. Для обозначения стадий ХБП следует использовать коды N18.1-N18.5, а код N18.9 — для ХБП с неуточненной стадией.
На основании категорий СКФ и альбуминурии больных ХБП стратифицируют по риску почечных исходов (снижение СКФ, прогрессирование ХБП, развитие ОПП, ТПН) и других осложнений (сердечно-сосудистая заболеваемость и смертность, эндокринные и метаболические нарушения, лекарственная токсичность) (таблица 1.1.4).
Таблица 1.1.4
Стадии и прогноз ХБП (риск смерти от всех причин, сердечно-сосудистой смерти, прогрессирования ХБП, ТПН, развития ОПП)1
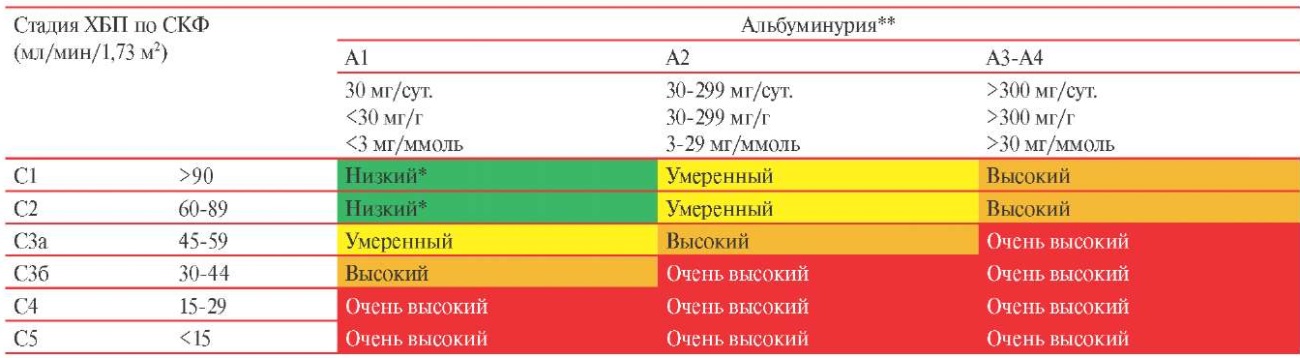
Примечание: * — низкий риск — сравним с общей популяцией, в отсутствие признаков повреждения почек категории СКФ С1 или С2 не удовлетворяют критериям ХБП; ** — альбуминурия — определяется как экскреция за 24 ч или отношение альбумин/креатинин в разовой (предпочтительно утренней) порции мочи. ХБП — хроническая болезнь почек, СКФ — скорость клубочковой фильтрации.
Пациентов с ХБП умеренной тяжести (СКФ 30-44 мл/мин/1,73 м² и Ал/Кр <30 мг/г или СКФ 45-59 мл/мин/1,73 м² и Ал/Кр 30-300 мг/г или СКФ ≥60 мл/мин/1,73 м² и Ал/Кр >300 мг/г) относят к группе с высоким риском сердечно-сосудистых и почечных событий, а пациентов с тяжелой ХБП (СКФ <30 мл/мин/1,73 м² или СКФ 30-44 мл/мин/1,73 м² и Ал/Кр >30 мг/г) — к группе с очень высоким риском.
1.2. Методы оценки скорости клубочковой фильтрации как индекса дисфункции почек
Согласно современным рекомендациям с целью диагностики и классификации ХБП необходимо определение СКФ, которая может быть измерена клиренсовыми методами, либо рассчитана при помощи специальных формул по концентрации в сыворотке крови креатинина или других веществ, которые выводятся из организма путем клубочковой фильтрации. Расчетный метод определения СКФ является предпочтительным для широкой практики как более простой и доступный.
Расчетные методы определения СКФ
Рекомендуемой для расчета СКФ (рСКФ) у взрослых является формула CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration), которая по сравнению с другими формулами (Cockcroft-Gault, MDRD) демонстрирует результаты, наиболее точно сопоставимые с данными, полученными при оценке клиренса ⁹⁹mTc-DTPA (меченная технецием⁹⁹ диэтилентриаминпентауксусная кислота) (золотой стандарт оценки СКФ), причем в широком диапазоне СКФ, включающем сохранную и сниженную функцию почек. В формуле CKD-EPI (2009) учитываются креатинин сыворотки, пол, возраст, раса (негроидная/ненегроидная), что позволяет преодолеть влияние различий в мышечной массе у мужчин и женщин, у молодых и пожилых лиц, сводит к минимуму систематические различия между людьми разной расы [29]. Целесообразность включения последнего показателя в уравнения оценки СКФ явилась предметом изучения, особенно в США, и неоднократно обсуждалась экспертами KDIGO (Кidney disease Initiative Global Outcome). В 2021г США, а следом и другие страны на основании анализа ряда национальных исследований признали, что следует избегать использования расовой принадлежности при расчете рСКФ. В настоящее время рекомендуется формула CKD-EPI 2021г, не включающая расу1 [6].
Первоначальным тестом для оценки функции почек является расчет СКФ на основе креатинина с помощью формулы CKD-EPI 2021г (CKD-EPIкр), который доступен в большинстве случаев, поскольку определение сывороточного креатинина входит в базисное обследование пациентов с ХБП и пациентов с факторами риска ХБП. В качестве альтернативного маркера для оценки функционального состояния почек и сердечно-сосудистого риска в последние годы рассматривается цистатин С, который производится ядросодержащими клетками с постоянной скоростью, свободно фильтруется клубочками, не реабсорбируется и не секретируется в почечных канальцах (т.е. соответствует критериям "идеального" маркера функции почек). Образование цистатина С не зависит от мышечной массы, особенностей диеты, его продукция не меняется существенно при воспалении. Уровень цистатина С в сыворотке крови более динамично меняется по сравнению с креатинином при остром нарушении функции почек, что дает ему преимущества в ранней диагностике ОПП. Разработаны формулы для расчета СКФ на основании цистатина С (CKD-EPIцис), при этом измерение концентрации цистатина С в клинической лаборатории должно быть проведено методами анализа с калибровкой по отношению к международным стандартным образцам для повышения точности оценки функции почек1 [6]. В тех клинических случаях, когда точность расчета СКФ по формуле CKD-EPI на основании сывороточной концентрации креатинина может быть существенно снижена (в частности, при низкой мышечной массе, мышечной атрофии, иммобилизации, геми- и тетрапарезах, ампутации конечностей, соблюдении низко- и высокобелковой, вегетарианской и кетодиеты, потреблении креатиновых добавок, голодании, у пожилых с саркопенией, больных СД, ожирением, беременных женщин, при приеме лекарственных препаратов, изменяющих канальцевую секрецию креатинина (циметидин, триметоприм, фенофибрат) или экстраренальную экскрецию креатинина (например, широкий спектр антибиотиков и др.), то, при наличии возможности, следует определить сывороточную концентрацию цистатина С и рассчитать СКФ по усредненной формуле CKD-EPIкр-цис (2021)1 [6].
Ошибочные значения рСКФ, полученные при использовании усредненной формулы CKD-EPIкр-цис (2021), могут наблюдаться при состояниях, сочетающих мальнутрицию и высокий уровень воспаления, при значительной потере мышечной массы, высоком катаболизме (туберкулез, СПИД, гематологические злокачественные новообразования и тяжелые кожные заболевания), при применении экзогенных стероидов (анаболики, стероидные гормоны). В таких ситуациях, если для принятия клинических решений требуются точные значения СКФ, целесообразно измерение СКФ с помощью клиренсовых методов.
Представляется целесообразным сделать обязательным для клинических лабораторий автоматический расчет СКФ при определении креатинина в сыворотке крови. Для расчета СКФ по формулам можно также воспользоваться калькуляторами, представленными в интернете, специальными приложениями для мобильных устройств, номограммами.
Клиренсовые методы оценки СКФ
Существуют ситуации, когда использование формул дает некорректные значения рСКФ (беременность, нестандартные размеры тела, тяжелая белково-энергетическая недостаточность, заболевания скелетных мышц, параплегия и тетраплегия, вегетарианская диета, быстро меняющаяся функция почек и др.), а для решения клинических задач требуется особо точная оценка функционального состояния почек, например, для определения безопасной дозы нефротоксичных лекарственных препаратов или средств, необходимых для проведения диагностической процедуры, для решения вопроса о начале ЗПТ. В такой ситуации следует использовать клиренсовые методы определения СКФ.
Наиболее доступным клиренсовым методом оценки СКФ является определение клиренса эндогенного креатинина с помощью пробы Реберга-Тареева. Несмотря на некоторые ограничения (связанные, главным образом, с использованием в качестве маркера креатинина, и высокой вероятностью ошибок при сборе суточной мочи), она по сей день сохраняет свое значение как метод оценки фильтрационной функции почек при первичном и/или стационарном обследовании, в том случае, если нет других вариантов дополнительных тестов для оценки СКФ. Выполнение пробы в контролируемых условиях может уменьшить погрешность оценки, условием правильного проведения пробы является точное измерение объема мочи, который должен быть не менее 1000 мл.
На сегодняшний день наиболее точными являются методы измерения СКФ, основанные на измерении клиренса экзогенных веществ, таких как [⁵¹Cr]-EDTA (меченная хромом⁵¹ этилендиаминтетрауксусная кислота), [⁹⁹mTc]-DTPA, [¹²⁵I]-йоталамат (йоталамат с меткой йодом¹²⁵), йогексол, которые вводятся внутривенно. Данные методы измерения СКФ являются референсными для всех остальных методов. Однако в связи со сложностью и трудоемкостью проведения анализов, их высокой стоимостью и необходимостью введения экзогенного, меченого радионуклидами вещества в кровь, их использование ограничивается научными исследованиями, а также теми клиническими случаями, когда требуется максимально точное определение СКФ.
Радиоизотопное исследование (визуализация почек после инъекции индикатора, выводимого почками, например, сцинтиграфия ⁹⁹mTc-DTPA) позволяет раздельно оценить функцию каждой почки, что имеет большое значение при односторонних поражениях.
1.3. Оценка альбуминурии/протеинурии
- Для обследования лиц с подозрением на ХБП, но с отсутствием факторов риска ХБП могут использоваться тест-полоски, дающие качественное или полуколичественное определение альбумина/общего белка (ОБ) в моче, что позволяет существенно снизить стоимость исследования.
- Лицам с положительными результатами исследования при помощи тест-полосок необходимо провести точное количественное определение альбумина/ОБ в моче.
- Обследование лиц с высоким риском развития ХБП целесообразно начинать сразу с количественных методов.
- Пациентам с выраженной потерей белка (>0,5 г/сут.) целесообразно, с точки зрения экономии бюджета, вместо определения альбуминурии проводить исследование ОБ в суточной моче или отношения ОБ/Кр в утренней порции мочи.
- Для исследований, требующих повышенной точности (уточнение диагноза, выбор терапии и оценка эффективности лечения, оценка прогноза, экспертиза и т.д.), применяется количественное определение альбумина или ОБ в суточной моче, однако это требует правильного сбора и измерения объема мочи, поэтому больше подходит для стационарного этапа обследования.
- Анализ разовых порций мочи дает приблизительный результат, поскольку на концентрацию белка влияют случайные факторы (в частности, водный режим). Исследование утренней пробы мочи дает более воспроизводимые результаты, чем в случайной порции, взятой в течение суток.
- Методом, повышающим точность оценки степени протеинурии/альбуминурии в разовой или утренней порции мочи, является поправка на уровень креатинина мочи (расчет отношения Ал/Кр), которая нивелирует искажения результатов, связанные с водным режимом.
- При оценке альбуминурии/протеинурии необходимо учитывать внепочечные факторы, влияющие на их уровень (интенсивная физическая нагрузка, лихорадка, злоупотребление белковой пищей), целесообразно соблюдение условий, минимизирующих вариабельность показателя альбуминурии/протеинурии.
- Впервые выявленная повышенная альбуминурия/протеинурия нуждается в подтверждении 1-2 повторными анализами с интервалом в 1-2 нед.
1.4. Алгоритм выявления хронической болезни почек у больных с высоким риском ее развития
- К пациентам высокого риска развития ХБП относятся, прежде всего, пациенты с СД, АГ, ССЗ, ожирением, дислипидемией, отягощенной наследственностью, пациенты пожилого возраста.
- Следует обследовать пациентов из группы риска развития ХБП, используя как определение альбумина в моче, так и оценку СКФ.
- После выявления альбуминурии, протеинурии, повышенного отношения Ал/Кр в моче, гематурии или снижения СКФ следует повторить тесты для подтверждения через 1-2 нед.
- У взрослых с риском развития ХБП рекомендуется использовать формулу CKD-EPI на основе креатинина (CKD-EPIкр).
- Рекомендуется использовать формулу CKD-EPIкр-цис для расчета СКФ в клинических ситуациях, когда формула с использованием креатинина (CKD-EPIкр) менее точна и величина СКФ влияет на принятие клинических решений (1C).
- Для подтверждения хронического характера выявленных изменений (клинические симптомы должны сохраняться в течение ≥3 мес. или должны быть однократно выявлены морфологические/структурные признаки фибропластических изменений почек) следует проанализировать:
— предыдущие результаты измерений/расчета СКФ,
— предшествующие результаты измерений альбуминурии/протеинурии и микроскопического исследования осадка мочи,
— результаты визуализирующих исследований (уменьшение размеров почек, уменьшение толщины паренхимы кортикального слоя, характер контура и аномалии строения почек),
— результаты морфологического исследования ткани почки (если проводилась нефробиопсия или аутопсия): соотношение активных и хронических гистологических изменений, наличие признаков гломерулосклероза, тубулоинтерстициального фиброза и атрофии канальцев, артериоло- и артериосклероза,
— анамнез болезни, сопутствующие заболевания, которые вызывают или способствуют развитию ХБП,
— результаты повторных лабораторных исследований в течение и после 3-мес. периода наблюдения.
- Следует установить причину ХБП, используя клиническую картину, личный и семейный анамнез, социальные факторы и факторы окружающей среды, принимаемые лекарства, данные лабораторных и визуализирующих исследований, а также генетический и гистологический диагнозы, при их наличии.
Использование простого алгоритма (Приложение 2) может значительно улучшить раннее выявление и лечение ХБП. Следует подчеркнуть, что другие маркеры поражения почек, кроме альбуминурии, также могут использоваться для диагностики ХБП, но отношение Ал/Кр мочи и СКФ необходимы для определения стадии и оценки риска прогрессирования ХБП1 [6].
2. Факторы риска развития и прогрессирования хронической болезни почек
Факторы риска развития ХБП по многим позициям совпадают с факторами риска развития сердечно-сосудистой патологии, важнейшими из которых являются АГ и такие метаболические нарушения, как СД, дислипидемия, гиперурикемия и ожирение, не последнюю роль в повреждении почек играют лекарственные воздействия (нестероидные противовоспалительные средства, нефротоксичные антибиотики, рентгенконтрастные препараты и т.д.)1 [6].
При уже существующей ХБП, особенно на поздних стадиях (С3б-5), действуют и так называемые "нетрадиционные", почечные факторы (гипергидратация, анемия, нарушения фосфорно-кальциевого обмена, системное воспаление, гиперкоагуляция, уремические токсины), которые, в свою очередь, повышают риск развития ССЗ и сердечно-сосудистых событий. В большинстве случаев как традиционные, так и нетрадиционные факторы риска не только увеличивают риск развития ХБП, но и влияют на скорость ее прогрессирования, сокращая время до формирования потребности в начале ЗПТ. Основные факторы риска ХБП приведены в таблице 2.1.
Таблица 2.1
Основные факторы риска развития и прогрессирования ХБП1
|
Немодифицируемые |
Модифицируемые |
|
Пожилой возраст Исходно низкое число нефронов (низкая масса тела при рождении) Расовые и этнические особенности Наследственные факторы (в т.ч. семейный анамнез по хронической болезни почек) Перенесенное острое повреждение почек |
Сахарный диабет Артериальная гипертония Дислипопротеидемия Табакокурение Ожирение/метаболический синдром Неалкогольная жировая болезнь печени Гиперурикемия Аутоиммунные болезни Хроническое воспаление/системные инфекции Инфекции и конкременты мочевых путей Обструкция нижних мочевых путей Лекарственная токсичность Высокое потребление белка Беременность с осложнениями |
Важнейшими модифицируемыми факторами риска и прогрессирования ХБП являются гипергликемия, АГ и другие ССЗ, ожирение и метаболический синдром (МС). Результаты многочисленных популяционных исследований свидетельствуют о существовании тесной связи кардиоренальных взаимодействий и обменных нарушений, а также о ведущей роли обменных нарушений в сочетании с АГ в неуклонном увеличении популяции больных с сердечно-сосудистой и почечной патологией. Частота сердечно-сосудистых событий среди пациентов без СД и ХБП была более, чем в 3 раза ниже в сравнении с больными, имеющими это сочетание, а при наличии ХСН частота осложнений возрастала драматически [30].
2.1. Сахарный диабет
В мире СД является одной из наиболее частых причин развития ХБП и наиболее частой причиной ТПН, распространенность ХБП среди пациентов с СД составляет 34,5-42,3%, при этом большинство случаев идентифицировано как ранняя стадия ХБП, на больных СД приходится 30-40% всех случаев ТПН в США. Согласно Базе данных клинико-эпидемиологического мониторинга СД на территории РФ при СД 1 типа ХБП выявляется в 23% случаев, при СД 2 типа — в 19,1% [19]. Частота развития диабетической нефропатии зависит от длительности течения диабета: при СД 2 типа длительностью до 5 лет ХБП выявляется у 3,5% пациентов, а при длительности диабета до 30 лет — у 20,3%4 [30-33].
2.2. Артериальная гипертония
В общей популяции признаки поражения почек при отсутствии ССЗ и СД встречаются в 6,8% случаев, при наличии АГ — в 15,2%, а при сочетании АГ и СД частота возрастает до 43% [34]. Еще более высокая распространенность почечной патологии среди пациентов с АГ, оцененная по альбуминурии и составившая 53-71%, отмечалась в многоцентровом исследовании i-SEARCH (Survey for Evaluating Microalbuminuria Routinely by Cardiologists in patients with Hypertension) [35]. При неконтролируемой АГ функция почек прогрессивно ухудшается, а темп снижения СКФ может достигать 13% в год [25]. Следует также учитывать, что АГ может быть как причиной развития и прогрессирования ХБП, так и ее следствием.
В ряде исследований было показано, что более интенсивный режим антигипертензивной терапии с целевым систолическим артериальным давлением (АД) <120 мм рт.ст. ассоциирован со снижением протеинурии, замедлением темпа прогрессирования ХБП, а также со снижением общей смертности и количества сердечно-сосудистых событий [36][37].
2.3. Сердечно-сосудистые заболевания
Почечная дисфункция ассоциирована с более частым развитием осложнений и повышением риска сердечно-сосудистой смерти при остром коронарном синдроме (ОКС), инфаркте миокарда (ИМ), тромболитической терапии, чрескожном коронарном вмешательстве и аортокоронарном шунтировании, сердечной недостаточности (СН). В настоящее время ХБП рассматривается как самостоятельный стратификационный фактор риска у пациентов с ССЗ, в частности у пациентов с АГ и при принятии решения о липидснижающей терапии [38][39].
Даже незначительное ухудшение функции почек ассоциировано с увеличением риска сердечно-сосудистой заболеваемости и смерти независимо от других факторов риска. Распространенность ССЗ в популяции больных с нарушенной функцией почек на 64% выше, чем у лиц с сохранной их функцией. Выявлена независимая обратная связь между СКФ <60 мл/мин/1,73 м² и увеличением риска смерти, ССО и госпитализаций [26][40-43], является независимым предиктором смерти от ИМ, рецидива ИМ, развития СН, инсульта и кровотечений при ОКС как с подъемом, так и без подъема сегмента ST [44-48]. При СН уровень смертности обратно пропорционален СКФ, которая оказалась таким же значимым прогностическим фактором, как и величина фракции выброса (ФВ) левого желудочка (ЛЖ) или функциональный класс СН [49][50].
Риск развития неблагоприятных сердечно-сосудистых исходов у пациентов на диализе или у реципиентов почечного трансплантата в десятки раз выше, чем в общей популяции [50]. Частота новых сердечно-сосудистых событий составляет 4,8% у больных со 2 стадией ХБП и возрастает почти вдвое при 3-4 стадиях. При этом сочетание любых двух традиционных факторов ССР увеличивает вероятность снижения СКФ до уровня <60 мл/мин/1,73 м² почти в 4 раза, а у трети больных, перенесших ИМ, диагностируют ХБП 3-5 стадии [50-53].
Альбуминурия также тесно связана со смертностью от ССЗ и развитием серьезных сердечно-сосудистых событий у пациентов с и без ХБП, а у последних ассоциирована с повышенным риском прогрессирования ХБП и развитием ТПН. По данным недавних исследований даже у лиц без серьезных сердечно-сосудистых факторов риска и уровнем альбуминурии в пределах нормальных значений (Ал/Кр <30 мг/г) каждое удвоение отношения Ал/Кр в моче связано с повышением риска сердечно-сосудистой смерти на 36%, а скорректированные кумулятивные показатели смертности от ССЗ за 15 лет составили 0,91, 0,99 и 2,1% при уровнях Ал/Кр в моче <4,18, 4,18 — <6,91 и ≥6,91 мг/г, соответственно. Необходимы дальнейшие исследования, чтобы определить, насколько широко и часто следует обследовать пациентов на альбуминурию, является ли экономически эффективным лечение альбуминурии низкой степени (10-30 мг/г) и насколько оправдано применение новых антипротеинурических методов лечения для всего спектра сердечно-сосудистых, почечных и метаболических заболеваний [54-56].
Распространенность нарушения функции почек при СН по данным различных исследований колеблется от 25% до 60% [52], а по данным испанского регистра СН 70% пациентов имели признаки заболевания почек. В то же время у 17-21% больных с ХБП развивается СН de novo [52][57][58]. В исследовании ARIC заболеваемость СН была в 3 раза выше при рСКФ <60 мл/мин/1,73 м² по сравнению с пациентами с сохранной функцией почек [59]. ХБП чаще встречается при СН с сохранной ФВ ЛЖ, однако неблагоприятные исходы ассоциированы обычно со сниженной ФВ [60].
У пациентов с хронической почечной недостаточностью и сохранной систолической функцией ЛЖ риск смерти возрастает в 2,9 раза, а сниженная систолическая функция ЛЖ увеличивает этот риск в 3,8 раза. При выраженных нарушениях сократимости миокарда ЛЖ снижение СКФ, как правило, совпадает с появлением другого неблагоприятного маркера — увеличением плазменной концентрации натрийуретических пептидов [50][61-65].
У трети больных с острой СН и в 25-70% случаев острой декомпенсации ХСН развивается ОПП, ~30% пациентов, поступающих в стационар в связи с острой декомпенсацией СН, имеют признаки ОПП и/или ХБП. Распространенность ХБП выше у пациентов с острой СН (53%) по сравнению с пациентами с ХСН (42%). У больных с острой декомпенсацией СН развитие ОПП ассоциировано с более продолжительной госпитализацией и большей частотой повторных госпитализаций по поводу ХСН, прогрессированием ХБП, повышением риска сердечно-сосудистой и общей смертности [66-68].
В недавнем исследовании было показано, что лица с генетической предрасположенностью к СН имеют повышенный риск развития ХБП: отношение шансов составило 1,12 (95% ДИ: 1,03-1,21), p=0,009. Эта причинно-следственная связь оставалась устойчивой даже после поправок на эффекты СД и АГ [62].
Фибрилляция предсердий (ФП) выявляется у 15-20% пациентов с ХБП, и напротив, 40-50% пациентов с ФП имеют признаки ХБП. Сочетание этих двух состояний увеличивает риск эмболических событий, смерти и темп прогрессирования ХБП. ХБП, независимо от ФП, является протромботическим и прогеморрагическим состоянием, а снижение клиренса креатинина расценивается как важный независимый предиктор ишемического инсульта, системной эмболии и кровотечений [58].
2.4. Кардио-рено-метаболический синдром
Изучение взаимосвязей ХБП с МС позволяет утверждать, что высокая распространенность снижения СКФ в популяции определяется, главным образом, нефропатиями метаболического генеза (диабетического, уратного, ассоциированного с ожирением), а также гипертоническим нефроангиосклерозом. Факторы, приводящие к их развитию, во многом связаны с особенностями образа жизни, их своевременное и, по возможности, полное устранение представляет собой один из основных подходов к глобальной профилактике ХБП [69]. МС увеличивает вероятность развития ХБП не менее чем в 2,6 раза, однако и каждая из его составляющих ассоциирована с повышенным риском развития альбуминурии и снижением СКФ, сочетание же пяти компонентов увеличивает риск почти в 6 раз [70].
Гиперурикемия встречается с высокой частотой у больных с ХБП, АГ, СД, МС, ожирением. Повышение уровня мочевой кислоты чаще всего бывает следствием снижения функции почек, с другой стороны, гиперурикемия per se может приводить к хроническим заболеваниям почек (хронический интерстициальный нефрит, мочекаменная болезнь) и ОПП (уратный криз). Повреждающее действие повышенных уровней мочевой кислоты связано с инициацией эндотелиальной дисфункции и хронического системного воспаления, замедлением окислительного метаболизма, адгезией тромбоцитов, нарушением реологии крови и агрегации тромбоцитов [71-73]. При этом сегодня нет однозначного ответа на вопрос, является ли гиперурикемия маркером вышеперечисленных изменений или повреждающим фактором.
Ожирение, особенно абдоминальное, является самостоятельным фактором риска необратимого ухудшения функции почек: увеличение индекса массы тела на 10% обусловливает увеличение вероятности стойкого снижения СКФ в 1,27 раза, что связано с развитием относительной олигонефронии при ожирении [74]. Патогенетические механизмы поражения органов-мишеней при ожирении реализуются через воздействие адипокинов и, прежде всего, лептина, на миокард, сосудистую стенку и почечную ткань с развитием генерализованной эндотелиальной дисфункции. При этом ожирение у пациентов на поздних стадиях ХБП ассоциировано с более благоприятным прогнозом [75].
Дислипидемия у пациентов с ХБП характеризуется гипертриглицеридемией, низким уровнем холестерина липопротеидов высокой плотности, повышенными уровнями холестерина липопротеидов низкой плотности (ХС ЛНП) и липопротеида(а). Метаболизм липопротеидов высокой, низкой, промежуточной и очень низкой плотности изменяется при ХБП, что повышает их атерогенный потенциал [63].
В 2023г Американская ассоциация сердца (AHA) определила эту сложную структуру взаимосвязанных состояний как кардио-рено-метаболический синдром (КРМС) [76].
При КРМС поражаются почти все основные системы органов, что сопровождается сопутствующими клиническими проблемами, включая почечную недостаточность, преждевременное снижение когнитивных функций, стеатотические заболевания печени, связанные с метаболической дисфункцией (ранее неалкогольная жировая болезнь печени), обструктивное апноэ во сне и повышенный риск развития рака. КРМС влияет на структурно-функциональное состояние сосудов, атерогенез, функцию миокарда, гемостаз и проводящую систему сердца, что значительно повышает риск развития ССЗ.
Взаимосвязь между ожирением, СД 2 типа, ССЗ и ХБП с развитием КРМС является признанной проблемой в промышленно развитых странах. Молекулярные механизмы, лежащие в основе этих заболеваний, содержат спектр взаимосвязанных факторов, включая гипергликемию, инсулинорезистентность, повышенную активность ренин-ангиотензин-альдостероновой системы (РААС), образование конечных продуктов гликирования, окислительный стресс, липотоксичность, стресс эндоплазматического ретикулума, нарушения фосфорно-кальциевого обмена, нарушение функции митохондрий и выработки энергии, а также стойкое хроническое воспаление [70, 77]. КРМС приводит к полиорганной дисфункции и ассоциирован с высокой частотой неблагоприятных сердечно-сосудистых исходов.
Понятие КРМС распространяется как на лиц с риском ССЗ из-за наличия метаболических факторов риска, ХБП или того и другого, так и на лиц с уже имеющимися ССЗ, которые потенциально связаны с метаболическими нарушениями или осложняют их.
КРМС представляет собой прогрессирующее состояние, которое обычно начинается в раннем возрасте с биологических, социальных и экологических воздействий, приводящих к накоплению избыточной и дисфункциональной жировой ткани с последующим развитием воспаления, окислительного стресса и резистентности к инсулину. Со временем эти часто сосуществующие изменения приводят к развитию субклинического коронарного атеросклероза, кальцификации коронарных артерий и субклинических нарушений структуры и функции миокарда, СН, а также прогрессирующему повреждению почек [76][77].
Предлагается выделять 4 стадии КРМС (таблица 2.4.1).
Таблица 2.4.1
Классификация КРМС [76]
|
Стадия КРМС |
Определение стадии |
|
Стадия 0: нет ФР КРМС |
Лица с нормальным ИМТ и окружностью талии, нормогликемией, нормотензией, нормальным липидным профилем и без признаков ХБП или субклинических или клинически явных ССЗ |
|
Стадия 1: избыточное или дисфункциональное ожирение |
Лица с избыточным весом/ожирением, абдоминальным ожирением или дисфункцией жировой ткани без наличия других метаболических ФР или ХБП ИМТ ≥25 кг/м² (или ≥23 кг/м² при азиатском происхождении), окружность талии ≥88/102 см у женщин/мужчин (при азиатском происхождении ≥80/90 см у женщин/мужчин), или Уровень глюкозы в крови натощак ≥5,6-6,9 ммоль/л (100-124 мг/дл) или HbA1c 5,7-6,4% |
|
Стадия 2: метаболические ФР и ХБП |
Лица с метаболическими ФР: гипертриглицеридемия ≥1,5 ммоль/л (≥135 мг/дл), АГ, метаболическим синдромом, СД или ХБП |
|
Стадия 3: субклинические ССЗ при КРМС |
Субклиническое АССЗ или субклиническая СН у лиц с ожирением/избыточным весом/дисфункцией жировой ткани, другими метаболическими ФР или ХБП Субклиническое АССЗ в основном диагностируется по кальцинозу коронарных артерий (субклинический атеросклероз при коронарной катетеризации/КТ-ангиографии также соответствует критериям) Субклиническая СН, диагностированная по повышенным уровням сердечных биомаркеров (NT-proBNP ≥125 пг/мл, вч-тропонин T ≥14 нг/л для женщин и ≥22 нг/л для мужчин, вч-тропонин I ≥10 нг/л для женщин и ≥12 нг/л для мужчин) или по ЭхоКГ параметрам, при этом комбинация двух значений указывает на самый высокий риск СН Эквиваленты риска субклинических ССЗ: ХБП очень высокого риска (ХБП стадии 4-5, или очень высокий риск по классификации KDIGO) Высокий прогнозируемый 10-летний риск ССЗ |
|
Стадия 4: клинически явные ССЗ при КРМС |
Клинически явные ССЗ (ИБС, СН, инсульт, заболевание периферических артерий, ФП) среди лиц с избыточным/дисфункциональным ожирением, другими ФР КРМС или ХБП Стадия 4а: нет почечной недостаточности Стадия 4b: есть почечная недостаточность |
Примечание: АГ — артериальная гипертония, AССЗ — атеросклеротическое сердечно-сосудистое заболевание, вч — высокочувствительный, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, КРМС — кардио-рено-метаболический синдром, КТ — компьютерная томография, СД — сахарный диабет, СН — сердечная недостаточность, ССЗ — сердечно-сосудистые заболевания, ФП — фибрилляция предсердий, ФР — факторы риска, ХБП — хроническая болезнь почек, ЭхоКГ — эхокардиография, HbA1c — гликированный гемоглобин, KDIGO — KidneyDiseaseImproving Global Outcomes, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Предложенная классификация КРМС подчеркивает прогрессирующий характер синдрома, увеличение абсолютного риска ССЗ на более поздних стадиях, важность как можно более раннего выявления изменений, связанных с КРМС, и своевременной инициации профилактических и кардионефропротективных терапевтических стратегий.
2.5. Острое повреждение почек
Риск развития ОПП повышается как в присутствии факторов риска ОПП (сепсис, шок, травмы и ожоги, нефротоксичные и рентгенконтрастные препараты, отравления, критическое состояние больного, кардиохирургические и абдоминальные вмешательства) [78-80], так и при наличии состояний, повышающих восприимчивость пациента к факторам риска ОПП (дегидратация, пожилой возраст, женский пол, черная раса, ХБП, ССЗ, СД, рак, анемия, проводимая терапия) [81][82]. ОПП является значимым фактором риска развития и ускорения прогрессирования ХБП. Пациенты с риском развития ОПП нуждаются в тщательном контроле уровня креатинина и диуреза, при этом частота и длительность мониторинга определяется индивидуально в зависимости от степени риска и конкретной клинической ситуации [83][84].
Диагностическими критериями ОПП являются повышение сывороточного креатинина хотя бы на >0,3 мл/дл (26,5 мкмоль/л) в течение 48 ч либо в 1,5 раза в течение предшествующих 7 дней от исходного уровня и/или снижение диуреза <0,5 мл/кг/ч за минимум 6 ч. Стадия ОПП определяется на основании уровня креатинина и/или диуреза (таблица 2.5.1)5 [85]. Вероятность развития ОПП у больных с острой сердечно-сосудистой патологией может быть оценена по шкале оценки риска ОПП (Приложение 2, таблица 1) при поступлении в стационар5.
Таблица 2.5.1
Стадии ОПП5 [85]
|
Стадия |
Критерии креатинина сыворотки* |
Критерии диуреза* |
|
1 |
Повышение Кр в 1,5-1,9 раза от исходного уровня за 7 дней или на >0,3 мг/дл (>26,5 мкмоль/л) за 48 ч |
<0,5 мл/кг/ч в течение 6-12 ч |
|
2 |
Повышение Кр в 2,0-2,9 раза от исходного уровня за 7 дней |
<0,5 мл/кг/ч в течение >12 ч |
|
3 |
Повышение Кр в 3,0 раза от исходного уровня за 7 дней или Кр >4,0 мг/дл (>353,6 мкмоль/л) или начало ЗПТ |
<0,3 мл/кг/ч за >24 ч или анурия >12 ч |
Примечание: * — ОПП диагностируется при наличии хотя бы одного из критериев. ЗПТ — заместительная почечная терапия, Кр — креатинин сыворотки, СКФ — скорость клубочковой фильтрации.
Причина ОПП должна быть установлена во всех случаях, когда это возможно. Кроме того, следует помнить об острой болезни почек, которая может развиться как один из возможных исходов ОПП. Пациенты с ОПП и острой болезнью почек должны наблюдаться, по крайней мере, в течение 3 мес. для оценки степени восстановления функции почек или ухудшения течения имевшейся ранее ХБП.
3. Особенности наблюдения пациентов при хронической болезни почек с разным риском прогрессирования
У пациентов с ХБП необходимо оценивать уровень СКФ и альбуминурии не реже одного раза в год, чаще следует мониторировать функцию почек у больных с высоким риском прогрессирования и в тех случаях, когда величины этих показателей следует учитывать при назначении терапии (таблица 3.1)1 [6].
Таблица 3.1
Частота обследований в год в зависимости от степени риска прогрессирования ХБП (снижения СКФ и выраженности альбуминурии)1 [6]
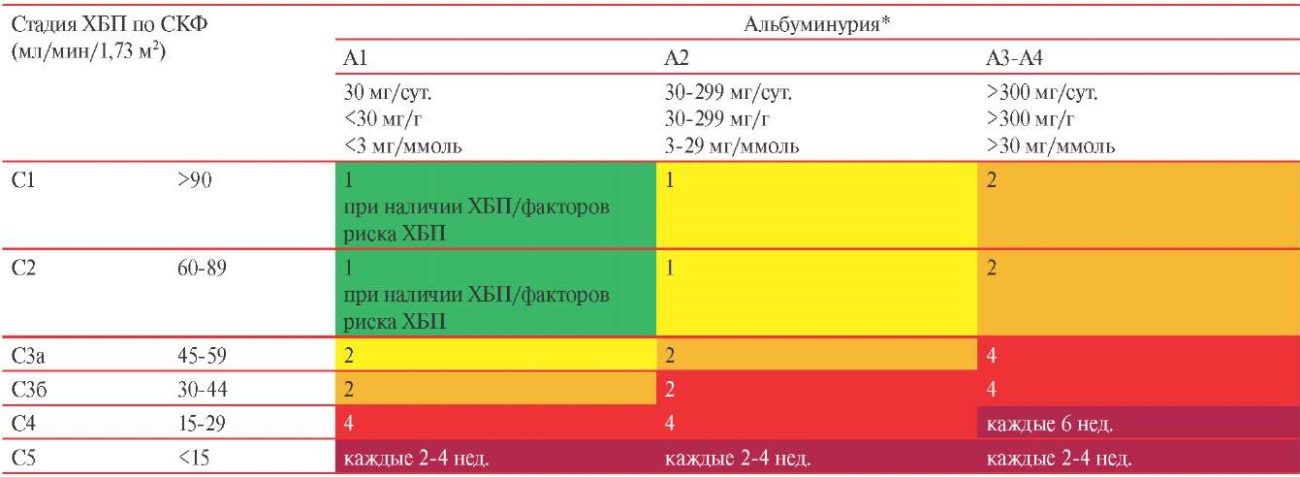
Примечание: интенсивность окраски ячеек отражает повышение риска прогрессирования хронической болезни почек: низкий, умеренный, высокий и очень высокий риск. Цифры в ячейках указывают частоту контроля СКФ и альбуминурии в год. * — определяется отношение Ал/Кр в разовой (предпочтительно утренней) порции мочи, СКФ рассчитывается по формуле CKD-EPI. СКФ — скорость клубочковой фильтрации, ХБП — хроническая болезнь почек.
Оценка прогрессирования ХБП по уровню СКФ и альбуминурии [6]
- Контроль альбуминурии и СКФ у взрослых пациентов с ХБП следует проводить не реже 1 раза в год.
- Оценивать альбуминурию и СКФ следует чаще у лиц с более высоким риском прогрессирования ХБП, у которых измерение будет влиять на терапевтические решения.
- У лиц с ХБП снижение рСКФ >20% от исходного уровня превышает ожидаемую вариабельность и требует оценки (включая дифференциальную диагностику обратимых состояний: вариантов ОПП, гипоперфузии почек, лекарственных эффектов и др., а также прогрессирования ХБП).
- Среди пациентов с ХБП, которые начинают гемодинамически активную терапию, снижение СКФ >30% при последующем исследовании превышает ожидаемую вариабельность и требует оценки.
- При мониторинге альбуминурии у лиц с ХБП удвоение отношения Ал/Кр в моче при последующем исследовании превышает лабораторную вариабельность и требует оценки.
Прогрессирование ХБП определяется при наличии хотя бы одного из следующих признаков:
- Прогрессирование ХБП определяется как необратимое снижение рСКФ не менее, чем на 25% от предыдущего значения;
- Прогрессированием ХБП следует считать абсолютные темпы снижения рСКФ >2 мл/мин/1,73 м²/год, а ускоренным прогрессированием — >5 мл/мин/1,73 м²/год (физиологическое снижение СКФ с возрастом составляет ~1 мл/мин/1,73 м²/год).
Чем чаще мониторируется рСКФ и дольше период наблюдения, тем выше вероятность выявления прогрессирования ХБП и точность оценки последнего.
Пациентам с прогрессирующим течением ХБП необходима коррекция проводимой терапии, а также дополнительное обследование для выявления обратимых причин ухудшения функции почек. Лица с СКФ >30 мл/мин/1,73 м² должны находиться под наблюдением терапевтов, за исключением пациентов, имеющих заболевание почек или его осложнения, требующие оказания специализированной помощи. Наблюдение нефролога показано всем пациентам с СКФ <30 мл/мин/1,73 м² (ХБП С4-5) и альбуминурией уровня А3-А4 (таблица 3.2).
Таблица 3.2
Наблюдение пациентов с ХБП
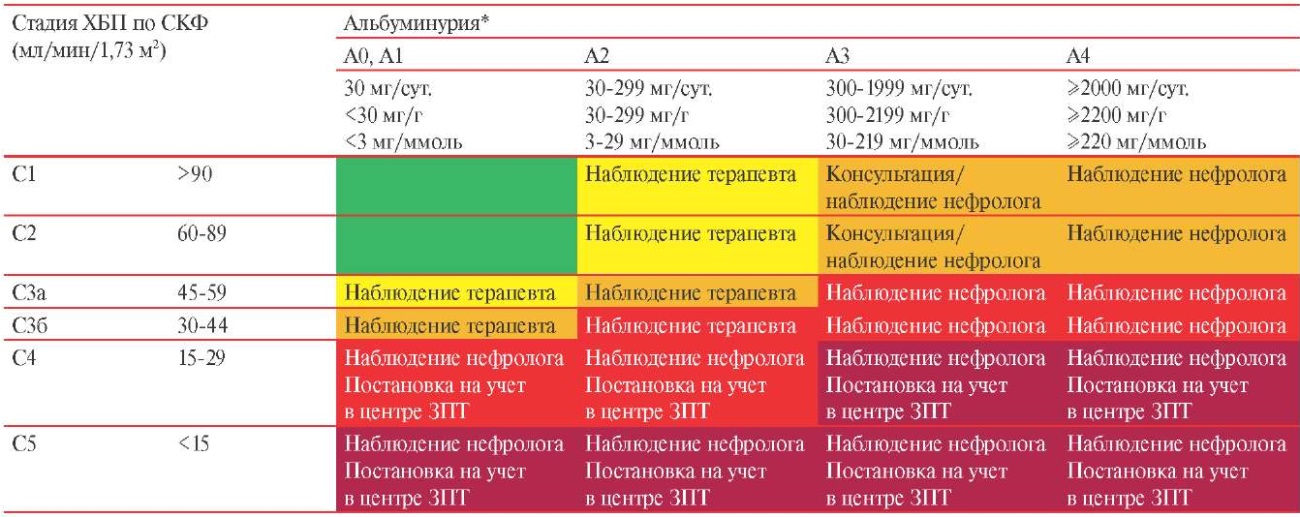
Примечание: интенсивность окраски ячеек отражает повышение риска прогрессирования хронической болезни почек: низкий, умеренный, высокий и очень высокий риск. * — определяется как отношение Ал/Кр в разовой (предпочтительно утренней) порции мочи, СКФ рассчитывается по формуле CKD-EPI. ЗПТ — заместительная почечная терапия, СКФ — скорость клубочковой фильтрации, ХБП — хроническая болезнь почек.
У пациентов с ХБП 3-5 стадии рекомендуется использовать формулы для оценки риска развития ТПН (1A) [6].
- 5-летний риск развития ТПН 3-5% может быть использован для определения времени направления к нефрологу в дополнение к критериям, основанным на рСКФ или отношении Ал/Кр мочи, а также другим клиническим критериям.
- 2-летний риск развития ТПН >10% может быть использован для определения необходимости оказания специализированной нефрологической помощи в дополнение к критериям, основанным на рСКФ, и другим клиническим критериям.
- Порог риска ТПН в течение 2 лет >40% может быть использован для определения сроков подготовки к ЗПТ, включая планирование сосудистого доступа или направление на трансплантацию, в дополнение к критериям, основанным на рСКФ, и другим клиническим критериям.
- Следует иметь в виду, что формулы прогнозирования риска, разработанные для использования у пациентов с ХБП 3-5 стадии, могут быть неприменимы для использования у лиц с ХБП 1-2 стадии.
Формула расчета риска развития ТПН KFRE (Kidney Failure Risk Equation) для пациентов с ХБП 3-5 стадии — это точная, хорошо проверенная модель, которая оценивает 2- и 5-летний риск наступления почечной недостаточности с использованием возраста, пола, рСКФ и Ал/Кр мочи [86]. Разработаны калькуляторы на основе этой формулы, которые представлены в интернете (https://www.kidney.org/glomerular-filtration-rate-gfr).
4. Сердечно-сосудистый риск и хроническая болезнь почек
Метаанализ данных 114 глобальных когорт показал, что более низкая рСКФ, рассчитанная по уровню сывороточного креатинина, по уровням креатинина и цистатина С в сыворотке крови, более выраженная альбуминурия были связаны с увеличением частоты 10 неблагоприятных исходов, включая неблагоприятные почечные исходы, ССЗ, и госпитализации. Полученные данные были скорректированы по возрасту, полу, статусу курения, АД, липидному спектру, индексу массы тела, антигипертензивной терапии, а также наличию СД, ИБС, инсульта, СН, ФП, заболеванию периферических артерий, раку и ХОБЛ в анамнезе [50]. На рисунке 4.1 представлен категориальный анализ связи рСКФ на основе креатинина и альбуминурии с неблагоприятными исходами в популяции.
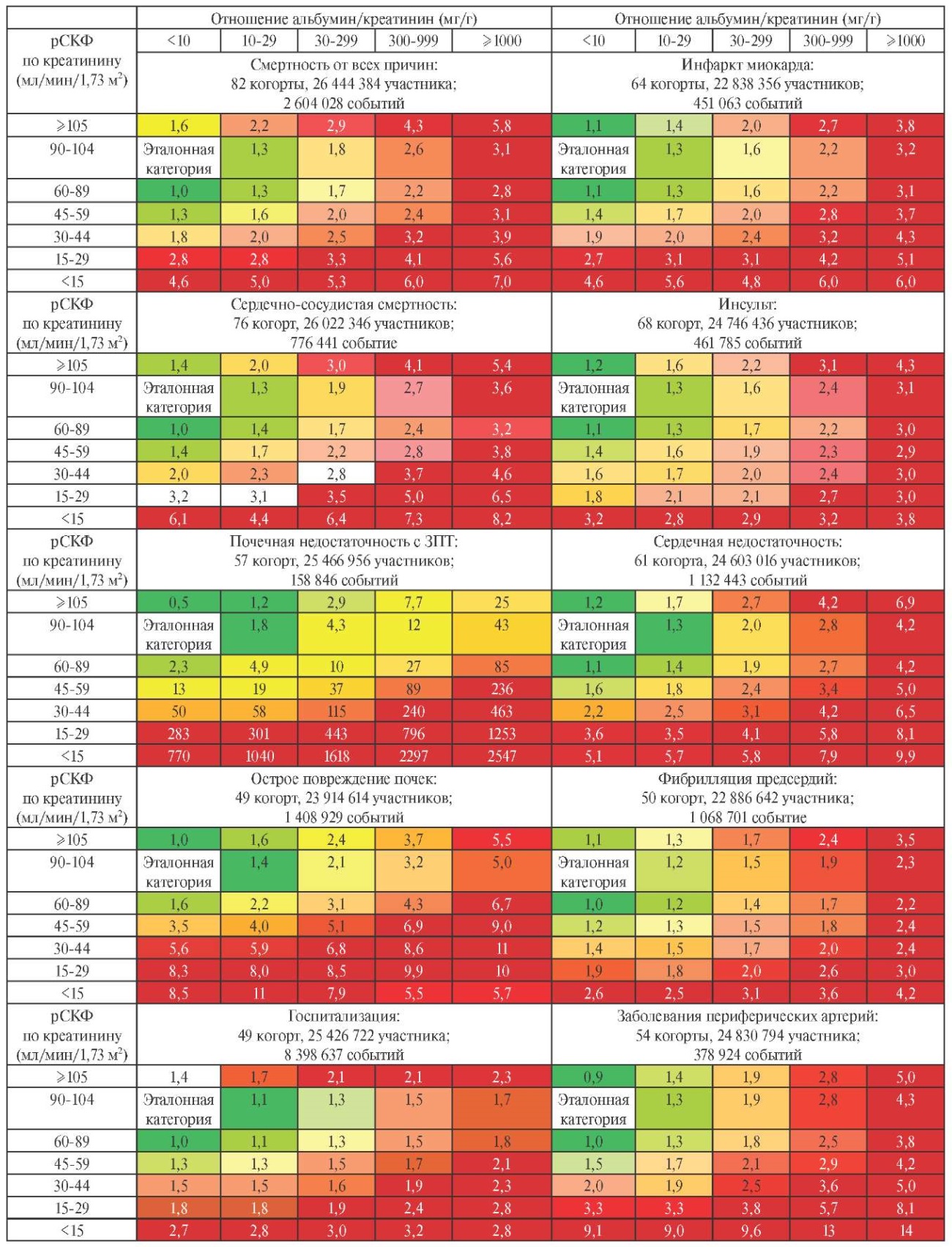
Рис. 4.1 Категориальный анализ связи рСКФ на основе креатинина и альбуминурии с неблагоприятными исходами в популяции.
Примечание: цифры в ячейках отражают скорректированное соотношение рисков по сравнению с эталонной категорией. Процентиль, окрашенный самым темным зеленым цветом, соответствует доле ячеек в таблице без ХБП, а процентиль, окрашенный самым темным красным цветом, соответствует доле ячеек, которая, как ожидается, превзойдет самый высокий риск неблагоприятных исходов. ЗПТ — заместительная почечная терапия, рСКФ — расчетная скорость клубочковой фильтрации.
ИМ и инсульт являются основными причинами сердечно-сосудистой смерти у пациентов с ХБП, в этой популяции наблюдается снижение выживаемости. Кроме того, при ХБП повышен риск развития СН, ФП и внезапной сердечной смерти, что связывают с формированием уремической кардиомиопатии и электрической дисрегуляции сердца на поздних стадиях ХБП [28][63][87].
Смерть, обусловленная ССЗ, в 10-20 раз чаще встречается среди больных с ХБП, чем в общей популяции, а вероятность развития ССО в 25-100 раз выше, чем риск ТПН [24][49][63].
5. Кардионефропротективная стратегия и тактика ведения больных с сердечно-сосудистыми заболеваниями и хронической болезнью почек
В основе кардионефропротекции лежат как немедикаментозные подходы к коррекции образа жизни пациентов, так и фармакологические методы влияния на основные факторы риска развития и прогрессирования ХБП (Приложение 3, рисунок 1).
Пациентов с ХБП С3 и С4-С5 относят к группе высокого и очень высокого сердечно-сосудистого риска, соответственно. Пациенты с ХБП должны получать лечение по поводу кардиальной патологии в полном объеме в соответствии с национальными и международными рекомендациями, если нет противопоказаний (таблица 5.1). В то же время при проведении терапии следует строго контролировать состояние больных с ХБП и мониторировать уровни креатинина, СКФ и электролитов сыворотки крови1 [6]. Кардионефропротективные стратегии, обсуждаемые ниже, в полной мере применимы и к пациентам старших возрастных групп, однако у этой категории пациентов следует учитывать наличие и тяжесть синдрома старческой астении, саркопении, недостаточности питания и других гериатрических синдромов с целью обеспечение всеобъемлющего пациент-ориентированного подхода [7][88].
Таблица 5.1
Терапевтические стратегии у пациентов с ССЗ и ХБП [6]
|
Рекомендации |
Класс рекомендаций |
Уровень доказательств |
|
Пациентов с ХБП следует относить к группе высокого/очень высокого риска ССЗ |
I |
А |
|
При лечении ИБС у пациентов с ХБП следует исходить из существующих рекомендаций при отсутствии противопоказаний* |
I |
А |
|
Антитромбоцитарная терапия может назначаться пациентам с ХБП с высоким риском сердечно-сосудистых осложнений, если не повышен риск кровотечения* |
II |
В |
|
Лечение СН при ХБП следует проводить в том же объеме, что и у пациентов без ХБП* |
II |
А |
|
При болях в грудной клетке пациенты с ХБП должны обследоваться так же, как и пациенты без ХБП |
I |
В |
Примечание: * — необходима коррекция дозы препаратов с учетом СКФ. ИБС — ишемическая болезнь сердца, СКФ — скорость клубочковой фильтрации, СН — сердечная недостаточность, ССЗ — сердечно-сосудистые заболевания, ХБП — хроническая болезнь почек.
Следует иметь в виду, что при СКФ <60 мл/мин/1,73 м² (ХБП С3а-С5) сывороточные уровни тропонина и натрийуретических пептидов могут быть повышены и должны оцениваться с учетом функционального состояния почек и клинической картины [6].
Дозирование лекарственных препаратов у пациентов с ХБП следует осуществлять с учетом уровня СКФ и избегать, по возможности, назначения нефротоксичных препаратов. Всем пациентам, принимающим потенциально нефротоксичные препараты, независимо от уровня СКФ и наличия ХБП, необходимо проводить регулярный контроль уровня креатинина, СКФ, электролитов и, при возможности, сывороточной концентрации препарата. Недопустим прием каких-либо препаратов, в т.ч. биологических добавок и трав, без предварительной консультации с врачом.
При необходимости точного дозирования препарата из-за его высокой токсичности или узкого терапевтического окна, рекомендуется использовать клиренсовые методы оценки функции почек.
Основной целью медикаментозной терапии больных с ХБП и высоким риском ее развития является воздействие на модифицируемые факторы риска (гипергликемия, АГ, дислипидемия, ожирение, анемия, гиперурикемия и др.) для предотвращения развития повреждения почек или замедления прогрессирования ХБП, а также предупреждения развития ССО. Основные направления нефропротективной терапии ХБП у пациентов с высоким риском ее развития представлены в таблице 5.21 [6][33][35][38][39][87].
Таблица 5.2
Терапевтические подходы к воздействию на традиционные факторы риска при ХБП
|
Фактор риска |
Терапевтические подходы |
|
Модификация образа жизни |
Отказ от курения Снижение массы тела Физические нагрузки ≥30 мин × 5 раз в нед. Питание DASH |
|
Артериальная гипертония |
Целевые значения САД <120 мм рт.ст. при отсутствии противопоказаний (KDIGO) Целевые значения САД <130 мм рт.ст., ДАД <80 мм рт.ст. (ESH) Целевые значения САД до 130-139 мм рт.ст. при АУ А1-А2, до 120-130 мм рт.ст. при АУ А3-А4 при отсутствии противопоказаний (КР ХБП) Блокада РААС (максимально переносимая доза) + диуретик и/или блокатор кальциевых каналов Не комбинировать препараты из группы блокаторов РААС |
|
Гликемия |
Целевой HbA1c 7,0-8,0% Целевой HbA1c <6,5% у молодых пациентов при отсутствии тяжелой сопутствующей патологии Модификация образа жизни Терапия первой линии: ингибиторы НГЛТ-2 |
|
Дислипидемия |
Ингибиторы ГМГ-КоА (статины) Эзетимиб Ингибиторы PCSK-9 (рСКФ >20 мл/мин/1,73 м²) Целевые значения ХС ЛНП: — Пациенты с АССЗ и пациенты с очень высоким риском: уровень ХС ЛНП <1,4 ммоль/л (55 мг/дл) и снижение уровня ХС ЛНП на ≥50% по сравнению с исходным уровнем — Высокий сердечно-сосудистый риск: уровень ХС ЛНП <1,8 ммоль/л (70 мг/дл) и снижение на ≥50% по сравнению с исходным уровнем — Умеренный/низкий сердечно-сосудистый риск: уровень ХС ЛНП <3,0 ммоль/л (116 мг/дл) |
Примечание: АССЗ — атеросклеротические сердечно-сосудистые заболевания, АУ — альбуминурия, ГМГ-КоА — 3-гидрокси-3-метилглютарил-кофермент А редуктаза, ДАД — диастолическое артериальное давление, НГЛТ-2 — натрий-глюкозный ко-транспортер 2 типа, РААС — ренин-ангиотензин-альдостероновая система, САД — систолическое артериальное давление, ХБП — хроническая болезнь почек, ХС ЛНП — холестерин липопротеидов низкой плотности, DASH — Dietary Approaches to Stop Hypertension/диетические подходы к борьбе с гипертонией, HbA1с — гликированный гемоглобин, PCSK-9 — пропротеиновая конвертаза субтилизин-кексинового типа 9, КР ХБП — клинические рекомендации Хроническая болезнь почек, ESH — рекомендации European Society of Hypertension/Европейское общество по артериальной гипертонии, KDIGO — рекомендации Kidney Disease: Improving Global Outcomes/Инициатива по улучшению глобальных исходов заболеваний почек.
Первая линия кардионефропротективной терапии у пациентов с ХБП
В течение многих лет блокаторы РААС были основой кардионефропротективной стратегии. По данным проспективных рандомизированных исследований снижение протеинурии при использовании препаратов, подавляющих РААС, ведет к достоверному снижению скорости прогрессирования ХБП, что позволяет считать их основным компонентом кардионефропротективной терапии. Ингибиторы ангиотензинпревращающего фермента (иАПФ) и блокаторы рецепторов ангиотензина II 1 типа (БРА), более эффективны в снижении альбуминурии по сравнению с плацебо или другими антигипертензивными препаратами у пациентов с диабетической и недиабетической нефропатией, ССЗ, а также эффективны в предотвращении нарастания альбуминурии [42][89-92].
Оптимальная блокада РААС в сочетании со строгим контролем гликемии и АД может снизить скорость снижения рСКФ при протеинурической ХБП с 10-12 до 2-3 мл/мин/1,73 м² в год, однако риск развития ОПП и гиперкалиемии зачастую препятствуют использованию препаратов этой группы в повседневной клинической практике [92][93].
Возможности комбинированного назначения двух блокаторов РААС (иАПФ + БРА, БРА + ингибитор ренина, иАПФ + ингибитор ренина, иАПФ/БРА + ангиотензиновых рецепторов и неприлизина ингибитор (АРНИ)) с целью достижения более полного ренопротективного эффекта активно изучались в нескольких исследованиях, однако, хотя при высокой протеинурии эти комбинации оказывали более выраженный антипротеинурический эффект по сравнению с монотерапией, но и значительно повышали риск ОПП и гиперкалиемии, особенно у пожилых пациентов. Все современные рекомендации выступают против комбинированного использования блокаторов РААС при лечении АГ и с целью снижения прогрессирования ХБП и протеинурии1 [6][38][57][93].
Вторая линия кардионефропротективной терапии у пациентов с ХБП
В последнее десятилетие появился новый фармакологический класс препаратов с нефро- и кардиопротективными свойствами. Ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) представляют собой класс препаратов (дапаглифлозин, канаглифлозин, эмпаглифлозин и др.), которые были разработаны изначально для лечения СД 2 типа.
В дальнейшем были проведены исследования иНГЛТ-2 у пациентов с ХБП, где были получены убедительные данные кардионефропротективных эффектов данного класса препаратов. Канаглифлозин изучался только у пациентов с ХБП и СД 2 типа, тогда как дапаглифлозин и эмпаглифлозин доказали свою эффективность в популяции пациентов с ХБП как с, так и без СД 2 типа [94-100].
Положительные эффекты иНГЛТ-2 наблюдаются на всех этапах как почечного, так и сердечно-сосудистого континуума, снижая риск развития ХБП и ССЗ, темп прогрессирования ХБП и, независимо от приема блокаторов РААС, приводят к уменьшению альбуминурии [101-104]. У пациентов с ХБП недиабетической этиологии с СКФ ≥20 мл/мин/1,73 м² в дополнение к терапии иАПФ или БРА рекомендуются иНГЛТ-2 с доказанной эффективностью в этой группе (дапаглифлозин, эмпаглифлозин) для снижения рисков прогрессирования ХБП, развития ОПП, сердечно-сосудистой смертности и госпитализаций (1А)1 [6].
У пациентов с СД 2 типа и ХБП подтверждены кардионефропротективные эффекты нестероидного селективного антагониста минералокортикоидных рецепторов (АМКР) финеренона: снижение темпов прогрессирования дисфункции почек в широком диапазоне значений рСКФ, снижение риска неблагоприятных сердечно-сосудистых событий и госпитализаций в связи с СН. Кроме того, финеренон реже приводит к развитию гиперкалиемии, чем селективные антагонисты альдостерона. Финеренон рекомендован к применению у пациентов с СД 2 типа, ХБП и СКФ ≥25 мл/мин/1,73 м² (IA)1 [6][105-108].
5.1. Антигипертензивная терапия
Вопрос о целевом уровне АД у пациентов с ХБП до настоящего времени не имеет однозначного решения. Российские рекомендации по ХБП в качестве целевых значений рекомендуют снижение систолического АД до уровня <130 мм рт.ст. при ХБП и альбуминурии категории А1-А2, а при более высокой протеинурии (А3-А4) — до 120 мм рт.ст. и диастолического АД <80 мм рт.ст.1 Напротив, национальные и европейские рекомендации по АГ не дифференцируют целевые уровни АД в зависимости от степени альбуминурии и предлагают пациентам с диабетической и недиабетической ХБП в качестве первичной цели снижать АД до значений <140/80 мм рт.ст., далее большинству при хорошей переносимости снижать САД до значений 130 мм рт.ст. [38][94]. В то же время рекомендации KDIGO 2021 и 2024гг, американские рекомендации по АГ, основываясь на результатах исследования SPRINT, предлагают добиваться целевого уровня САД <120 мм рт.ст. у пациентов с высокой резистентной АГ после оценки риска развития тяжелой гипотонии [6][34][109].
Препаратами выбора для коррекции АГ, обладающими, кроме антигипертензивной активности, собственной нефропротективной способностью, являются иАПФ или БРА. Эти классы препаратов рекомендуется назначать всем пациентам с диабетическим и недиабетическим генезом ХБП при отсутствии противопоказаний в максимально переносимых дозах с целью снижения протеинурии и торможения прогрессирования дисфункции почек. Для достижения антигипертензивного эффекта рекомендуется комбинация блокаторов РААС с блокаторами кальциевых каналов.
Оптимальная блокада РААС в сочетании со строгим контролем АД позволяет снизить скорость прогрессирования ХБП, лечение иАПФ или БРА рекомендуется всем пациентам с ХБП и альбуминурией. Блокаторы РААС следует титровать до максимально переносимой дозы. Для дополнительного снижения рисков прогрессирования ХБП, развития ОПП, сердечно-сосудистой смертности и госпитализаций у пациентов с ХБП и СКФ ≥20 мл/мин/1,73 м² рекомендуется применение иНГЛТ-2 с доказанной эффективностью в этой популяции1. Бета-адреноблокаторы, агонисты имидазолиновых рецепторов, альфа-адреноблокаторы, альфа-бета адреноблокаторы также могут использоваться при тяжелой АГ в качестве препаратов 3-4 ряда [37][89][110-114].
Антагонисты альдостерона обладают хорошим антигипертензивным эффектом, а также благоприятно воздействуют на процессы ремоделирования миокарда и фиброгенеза в почках и могут назначаться в дополнение к иАПФ или БРА, однако они способны усугублять гиперкалиемию, особенно при СКФ <30 мл/мин/1,73 м². Применение антагониста альдостерона спиронолактона у мужчин ассоциировано с рядом нежелательных явлений со стороны половой сферы, что может ограничивать его длительный прием. Селективный антагонист альдостерона эплеренон более безопасен и не имеет гендерных ограничений по длительности применения1 [38][115].
Основные терапевтические стратегии у больных АГ с ХБП суммированы в таблице 5.1.1.
Таблица 5.1.1
Терапевтические стратегии у больных АГ и ХБП1 [38]
|
Рекомендации |
Класс рекомендаций |
Уровень доказательств |
|
У всех пациентов с ХБП следует снижать систолическое АД <140 мм рт.ст., при хорошей переносимости — <130 мм рт.ст. |
I |
А |
|
Целевое диастолическое АД <80 мм рт.ст. для всех пациентов |
I |
А |
|
При наличии альбуминурии А3-А4 оправдана попытка снижения систолического АД <130 мм рт.ст. при условии мониторирования изменений расчетной СКФ и хорошей переносимости |
IIb |
B |
|
Блокаторы РААС более эффективны в снижении альбуминурии/протеинурии, чем другие антигипертензивные препараты, и показаны пациентам с АГ при наличии повышенной альбуминурии (А2-А3) или явной протеинурии |
I |
A |
|
Блокаторы РААС должны титроваться до максимально возможных дозировок при хорошей переносимости |
I |
B |
|
Достижение целевого АД обычно требует комбинированной терапии, рекомендуется комбинировать блокаторы РААС с другими антигипертензивными препаратами |
I |
A |
|
Комбинация двух блокаторов РААС не рекомендуется |
III |
С |
|
Антагонисты альдостерона не могут быть рекомендованы при СКФ <30 мл/мин/1,73 м² пациентам, которые не получают диализ, особенно в комбинации с блокатором РААС, учитывая риск гиперкалиемии |
III |
C |
|
Антагонисты альдостерона рекомендуются пациентам, находящимся на диализе (ХБП С5Д) (спиронолактон — 12,5-25 мг/сут., 6-36 мес.; эплеренон — 50 мг/сут., не менее 3 мес.) для снижения риска развития основных сердечно-сосудистых событий и смертности |
I |
A |
Примечание: А — градация альбуминурии, АГ — артериальная гипертония, АД — артериальное давление, РААС — ренин-ангиотензин-альдостероновая система, СКФ — скорость клубочковой фильтрации, ХБП — хроническая болезнь почек.
Стратегия антигипертензивной терапии у пациентов с ХБП представлена в Приложении 3, рисунок 2. При этом следует помнить, что у пациентов с ХБП, получающих антигипертензивную терапию, особенно иАПФ или БРА, можно ожидать повышения уровня креатинина как сразу после начала лечения, так и на фоне длительного приема препаратов. Значительное повышение уровня креатинина (>50%) на фоне назначения блокаторов РААС требует отмены препарата и обследования пациента для исключения реноваскулярного генеза АГ.
5.2. Гиполипидемическая терапия
ХБП рассматривается как независимый фактор риска развития ССЗ, а пациенты с ХБП С3-С5 относятся к категории высокого/очень высокого риска развития ССО. Монотерапия статинами или статинами в комбинации с эзетимибом (что позволяет в большей степени снизить ХС ЛНП без увеличения дозы статинов) оказывает положительное влияние на исходы ССЗ при ХБП [116-120]. При отсутствии эффекта на 1-3 стадиях ХБП (рСКФ 30-90 мл/мин/1,73 м²) к терапии могут быть добавлены ингибиторы PCSK-9 [121]. У пациентов высокого риска следует добиваться снижения ХС ЛНП <1,8 ммоль/л (70 мг/дл), а у пациентов очень высокого риска — <1,4 ммоль/л (55 мг/дл) с обязательным снижением ХС ЛНП по крайней мере на 50% от исходного в обеих группах [39]. Пациентам, получающим лечение гемодиализом, начинать гиполипидемическую терапию не рекомендуется, однако ее можно продолжить в том случае, если она была начата ранее, до наступления терминальной стадии ХБП. Достижение целевого уровня ХС ЛНП у большинства пациентов очень высокого риска возможно при использовании высоких доз статинов, что вызывает настороженность в отношении риска развития миопатии и обосновывает применение комбинированной терапии низкими дозами статина и эзетимиба у больных с тяжелым нарушением функции почек1 [6]. Рекомендации по контролю уровня липидов у пациентов с поздними стадиями ХБП представлены в таблице 5.2.1, дозирование липидснижающих препаратов — в Приложении 4 (таблица 2).
Таблица 5.2.1
Рекомендации по лечению нарушений липидного обмена у пациентов с ХБП1 [39]
|
Рекомендации |
Класс рекомендаций |
Уровень доказательств |
|
Рекомендовано использование статинов или комбинации статинов и эзетимиба у пациентов 3-5 стадии ХБП, не нуждающихся в диализе |
I |
A |
|
У пациентов, которые на момент инициации диализа получают терапию статинами или комбинацию статин/эзетимиб, особенно с АССЗ, рекомендовано продолжение терапии |
IIа |
С |
|
Пациентам с ХБП 1-4 стадии и уровнем ТГ ≥1,7 ммоль/л рекомендовано рассмотреть назначение омега-3 ПНЖК с целью снижения уровня ТГ |
IIа |
В |
|
У пациентов с ХБП на диализе, не имеющих АССЗ, инициация терапии статинами не рекомендуется |
III |
A |
Примечание: АССЗ — атеросклеротическое сердечно-сосудистое заболевание, ПНЖК — полиненасыщенные жирные кислоты, ТГ — триглицериды, ХБП — хроническая болезнь почек.
5.3. Сахароснижающая терапия
У пациентов с ХБП и СД контроль гликемии является частью нефро- и кардиопротективной стратегии, наравне с антигипертензивной и гиполипидемической терапией, направленной на предупреждение ССО и замедление прогрессирования ХБП.
Строгий контроль гликемии (HbA1c ≤6,0%) у пациентов с нарушением функции почек ассоциирован с более высокой смертностью от всех причин и сердечно-сосудистой смертностью, в связи с чем для предотвращения гипогликемических эпизодов рекомендации KDIGO 2022г предлагают индивидуальный целевой уровень HbA1c в диапазоне от 6,5 до 8,0% для больных ХБП. У более молодых пациентов с меньшим количеством сопутствующих заболеваний целевой уровень HbA1c может быть ниже, однако требуется тщательный контроль гликемии для предотвращения эпизодов гипогликемии [122].
Для контроля гликемии у пациентов с СД 2 типа и ХБП С1-С3 (СКФ >30 мл/мин/1,73 м²) в качестве терапии первой линии следует использовать метформин и иНГЛТ-2. Агонисты рецепторов глюкагоноподобного пептида-1 обладают доказанным кардионефропротективным действием, используются для лечения морбидного ожирения и могут быть рекомендованы в дополнение к иНГЛТ-2 и метформину при недостаточном контроле гликемии у больных с СД 2 типа и ХБП, или вместо этих групп препаратов, если имеются противопоказания или их непереносимость. Для достижения целевых значений HbA1c могут дополнительно использоваться и другие сахароснижающие препараты [122][123].
Доза многих пероральных противодиабетических препаратов для пациентов с ХБП должна быть скорректирована с учетом снижения функции почек (Приложение 4, таблица 1) или, в случае тяжелого течения нефропатии, их вообще лучше избегать4 [33][108].
6. Лечение сердечно-сосудистых заболеваний при хронической болезни почек
Пациенты с ХБП должны получать лечение по поводу кардиальной патологии в полном объеме в соответствии с национальными и международными рекомендациями, если нет противопоказаний. В то же время при проведении терапии следует строго контролировать состояние больных, мониторировать уровень креатинина, СКФ и электролитов в сыворотке крови.
Следует иметь в виду, что при СКФ <60 мл/мин/1,73 м² (ХБП С3а-С5) сывороточные уровни тропонина и натрийуретических пептидов могут быть повышены и должны оцениваться с учетом функционального состояния почек и клинической картины.
6.1. Острый коронарный синдром
Пациенты с ОКС, имеющие нарушение функции почек, часто не получают адекватную терапию, что объясняется как отсутствием клинических исследований в этой популяции, так и высоким риском осложнений, прежде всего кровотечений и дальнейшего ухудшения функции почек. Данные наблюдательных и регистровых исследований показывают, что пациенты с ОКС и ХБП средней и тяжелой степени (С3-С5) имеют лучший прогноз при ранней реваскуляризации [124][125].
Высокий риск кровотечений у пациентов с ОКС и ХБП обусловлен, прежде всего, выбором неадекватной дозы антитромботических препаратов с преимущественно почечным путем выведения, у таких пациентов необходима коррекция дозы с учетом функционального состояния почек (Приложение 4, таблица 3) [126-129].
Еще одной причиной ухудшения функции почек у данной категории больных является контраст-ассоциированное ОПП (КА-ОПП). КА-ОПП является третьей по частоте причиной ОПП в стационаре (уступая только снижению перфузии почек и применению нефротоксичных средств) и развивается у 3-19% пациентов, подвергаемых коронарным вмешательствам. Развитие ОПП является фактором, ухудшающим общий прогноз и требующим своевременной коррекции модифицируемых факторов риска и проведения превентивных мероприятий [130-133].
Наиболее доказанными протективными свойствами в отношении профилактики развития КА-ОПП обладает адекватная гидратация физиологическим раствором или растворами натрия бикарбоната перед процедурой с контрастным веществом. Значимость гидратации отмечена в крупных сравнительных исследованиях и метаанализах [134-137].
Данные о выборе, сроках и продолжительности внутривенной гидратации до, во время и после реваскуляризации противоречивы, однако ее следует рассматривать как необходимый компонент у пациентов с ОКС и низкой рСКФ, подвергающихся инвазивному лечению с целью минимизировать риск развития КА-ОПП. Профилактика КА-ОПП показана пациентам с уже имеющимся ОПП и всем пациентам с ХБП, которые не находятся на ЗПТ.
В качестве инструмента определения риска КА-ОПП при коронароангиографии и/или чрескожном коронарном вмешательстве у пациентов с ОКС рекомендуется использование шкалы Mehran (Приложение 2, таблица 2) [138].
В ряде исследований продемонстрировано благоприятное влияние мексидола на функциональное состояние почек у больных с острым ИМ с подъемом сегмента ST, а также отмечено уменьшение риска развития КА-ОПП на 65% (отношение шансов 0,35; 95% ДИ: 0,13-0,94; р<0,05) у пациентов с ИБС. Механизм нефропротективного действия мексидола определяется его антиоксидантными и мембранопротекторными свойствами [139][140].
При решении вопроса о необходимости проведения визуализирующих исследований с применением рентгенконтрастных препаратов необходимо тщательно взвесить диагностическую и терапевтическую ценность ожидаемых результатов и риск развития ОПП. Исследования с внутривенным введением йодсодержащих рентгенконтрастных препаратов у пациентов с ХБП С3а-C5 должны проводиться с учетом клинических рекомендаций по ОПП1,5 [85]:
- Избегать применения высокоосмолярных препаратов;
- Использовать минимально возможную дозу рентгенконтрастного препарата;
- Отмена метформина, нестероидных противовоспалительных средств, иНГЛТ-2, иАПФ/БРА, диуретиков (по возможности), потенциально нефротоксичных препаратов за 48 ч до и после исследования;
- Адекватная гидратация пациента с использованием физиологического раствора до, во время и после проведения исследования;
- Оценка уровня креатинина и СКФ через 48-96 ч после исследования.
Применение гадолиний-содержащих контрастных препаратов при ХБП С5 не рекомендуется из-за риска развития нефрогенного системного склероза и допустимо только при невозможности заменить его другими методами исследования (IВ). В этом случае следует использовать гадолиниевые препараты на основе макроциклических хелатных комплексов с проведением диализа у пациентов с ХБП С5Д после исследования.
6.2. Сердечная недостаточность
У пациентов с СН, особенно при уже имеющихся признаках дисфункции почек, прогрессирующее нарастание креатинина сыворотки и развитие гиперкалиемии нередко наблюдают после назначения блокаторов РААС и иНГЛТ-2, зачастую ограничивая применение этих классов препаратов у больных с СН, что всегда приводит к значительному снижению эффективности лечения последней, особенно с позиции улучшения долгосрочного прогноза. Следует подчеркнуть высокий риск дальнейшего ухудшения функции почек при СН, обусловленного назначением блокаторов РААС в больших дозах без должного контроля креатинина и калия сыворотки, а также с возможной передозировкой петлевых или тиазидных диуретиков, применением некоторых антибактериальных препаратов, рентген-контрастных агентов, а также нестероидных противовоспалительных средств [141][142].
У пациентов с ХСН и ХБП проводимая терапия должна соответствовать требованиям современных рекомендаций [57][143][144], однако необходим тщательный контроль функции почек, а лечение следует начинать с назначения минимальных доз препаратов (Приложение 4, таблица 4) с титрованием при хорошей переносимости.
Блокаторы РААС (иАПФ, БРА, АРНИ, АМКР) и иНГЛТ-2 после назначения действительно приводят к снижению рСКФ, однако эти острые изменения чаще всего носят временный характер, а в долгосрочной перспективе эти препараты снижают смертность и заболеваемость у пациентов с СН со сниженной ФВ (СНнФВ), в т.ч. и у пациентов с дисфункцией почек. Кроме того, эти препараты также эффективны при СН с умеренно сниженной ФВ, а иНГЛТ-2 продемонстрировали прогноз модифицирующий эффект при СН с сохраненной ФВ [141].
Актуальные национальные и международные клинические рекомендации по СН делают акцент на необходимости одномоментного или быстрого последовательного назначения четырехкомпонентной (АРНИ/иАПФ/БРА + бета-блокатор + АМКР + иНГЛТ-2) терапии с быстрым титрованием доз препаратов до максимально переносимых у больных СНнФВ [57][143][144].
Применение такой тактики может ассоциироваться с увеличением риска ухудшения функции почек, прежде всего, у пациентов с СНнФВ и ХБП. В реальной клинической практике это часто приводит к использованию прогноз модифицирующих препаратов в необоснованно низких дозах, а иногда и к полной их отмене в данной популяции больных. По данным недавнего наблюдательного исследования частота назначения блокаторов РААС снижается пропорционально тяжести дисфункции почек, а доля пациентов, принимающих эти препараты после госпитализации по поводу острой СН, составляет 15% при рСКФ 45-60 мл/мин/1,73 м², и только 5% при рСКФ 30-45 мл/мин/1,73 м² [68][145-147].
Исследования по эффективности и безопасности применения АРНИ/иАПФ/БРА и АМКР у пациентов с СН продемонстрировали, что транзиторное ухудшение функции почек на 20-30% после начала приема этих препаратов не приводит, в большинстве случаев, к структурному повреждению почек, не связано с неблагоприятными клиническими исходами и не ассоциировано со снижением эффективности этих препаратов [148-150].
Современные рекомендации допускают повышение креатинина в сыворотке до 50%, если его уровень в сыворотке крови остается ниже 266 мкмоль/л (3 мг/дл) и рСКФ остается выше >25 мл/мин/1,73 м² при титровании иАПФ/БРА/АРНИ. Конечно, необходим тщательный мониторинг таких пациентов. Если уровень креатинина в сыворотке повышается более, чем на 50% или выше 310 мкмоль/л (3,5 мг/дл), лечение следует временно прекратить и попытаться возобновить назначение препарата после обнаружения и ликвидации причины ухудшения функции почек (инфекция, гипер-/гиповолемия, кровопотеря/анемия и т.д.)1 [6][57][143][144].
Наряду с изменениями функции почек частой причиной отмены блокаторов РААС является гиперкалиемия, которая развивается в 0,4-10% случаев. Рекомендуется снизить дозу блокаторов РААС при уровне калия от 5,5 до 6 ммоль/л, временно прекратить прием при повышении уровня калия >6 ммоль/л, с повторным назначением препарата при уровне калия <5,5 ммоль/л1 [57][143]. В клинических исследованиях при назначении АМКР уровень калия оценивался через 7 дней, и, дополнительно, через 72 ч, если выявлялась гиперкалиемия, потребовавшая снижения дозы препарата. В исследованиях по эффективности и безопасности применения иАПФ/БРА/АРНИ и иНГЛТ-2 при СН лабораторная оценка креатинина, мочевины, рСКФ и электролитов обычно проводилась спустя 14 дней от начала терапии (во время титрования дозы препарата) и в дальнейшем каждые 4 мес. Однако у пациентов с ХБП 4-5 стадии контроль этих показателей желательно проводить чаще, особенно в период повышения доз [151-154].
Алгоритм назначения и титрования доз препаратов для лечения СНнФВ у пациентов с ХБП в зависимости от функционального состояния почек представлен в Приложении 3, рисунок 31 [6][57][143][144].
6.3. Фибрилляция предсердий
Решение вопроса о лечении антикоагулянтами пациентов с ХБП, имеющих ФП, должно основываться на оценке риска тромбоэмболических осложнений и риска кровотечения. Целесообразно использовать шкалу CHA2DS2-VASc для оценки риска инсульта и системных тромбоэмболий, а также шкалу HAS-BLED для оценки риска кровотечений. В рандомизированных клинических исследованиях по использованию пероральных антикоагулянтов для профилактики инсульта при ФП функция почек обычно оценивалась с использованием формулы Кокрофта-Голта для определения клиренса креатинина6 [155].
У пациентов с клиренсом креатинина <15 мл/мин данные об эффективности и безопасности применения антагонистов витамина К или прямых оральных антикоагулянтов (ПОАК) ограничены и противоречивы. Варфарин может использоваться у пациентов с ХБП 1-4 стадий, основываясь на соотношении тромбоэмболический риск/риск кровотечения. Крупных многоцентровых клинических исследований эффективности варфарина у больных с ХБП 5 стадии и ФП нет, однако предполагается, что он может быть использован у больных с ФП, получающих лечение гемодиализом, в случае явного преобладания риска тромбоэмболий над риском кровотечения. Данных по применению оральных антикоагулянтов у пациентов с ФП после трансплантации почки нет.
У пациентов с легкой и умеренной ХБП (клиренс креатина 30-49 мл/мин) безопасность и эффективность ПОАК по сравнению с варфарином соответствовала таковой у пациентов без ХБП. Принципы дозирования ПОАК у пациентов с ХБП представлены в Приложении 4, таблица 5.
Заключение
Частота сочетанного поражения почек и сердца, часто на фоне имеющегося нарушения углеводного обмена и/или ожирения, неуклонно увеличивается в последние десятилетия, прогнозируется и дальнейший рост распространенности этих коморбидных состояний. Результаты многочисленных эпидемиологических, клинических и фундаментальных исследований проливают свет на тесные кардиоренальные и метаболические взаимосвязи на патофизиологическом уровне при сочетании ССЗ, ХБП, СД и ожирения. Такие коморбидные состояния описываются новыми нозологическими терминами "кардиоренальная болезнь" и "кардио-рено-метаболическая болезнь" и, зачастую, являются не только медицинской, но и значимой социально-экономической проблемой.
Признание важности этой проблемы как на медицинском, так и на общегосударственном уровне будет способствовать развитию целостного подхода к пациентам со сложным коморбидным фоном, позволит разработать специализированные алгоритмы ранней диагностики, лечения и профилактики сердечно-сосудистых, почечных и метаболических заболеваний. Междисциплинарный командный подход, направленный на предоставление скоординированной и специализированной помощи приведет к улучшению результатов лечения пациентов с кардиоренальной и кардио-рено-метаболической патологией и оптимизации ресурсов здравоохранения.
Приложение 1
Большинство российских медицинских объединений специалистов аффилированы с соответствующими международными профессиональными сообществами, а российские клинические рекомендации разрабатываются на основе международных рекомендаций с учетом национальных особенностей населения РФ и стандартов оказания медицинской помощи в нашей стране. Учитывая вышесказанное, в нашей работе мы использовали определения классов рекомендаций и уровней доказательства Европейского общества кардиологов (ESC) (таблицы 1, 2) и Международного общества нефрологии (ISN) (таблицы 3, 4).
Таблица 1
Уровни доказательности (ESC)
|
Уровень доказательности А |
Данные многочисленных рандомизированных клинических исследований или метаанализов |
|
Уровень доказательности В |
Данные одного рандомизированного клинического исследования или крупных нерандомизированных клинических исследований |
|
Уровень доказательности С |
Согласованное мнение экспертов и/или небольшие исследования, ретроспективные исследования, регистры |
Таблица 2
Классы рекомендаций (ESC)

Таблица 3
Сила рекомендаций (ISN/KDIGO)
|
Уровень |
Определение |
||
|
Пациенты |
Врачи-клиницисты |
Политика |
|
|
Уровень 1 |
Большинство людей в вашей ситуации хотели бы следовать рекомендованному курсу действий, и лишь небольшая часть — нет |
Большинству пациентов следует пройти рекомендованный курс действий |
Рекомендация может быть оценена как кандидат на разработку политики или показателя эффективности |
|
Уровень 2 |
Большинство людей в вашей ситуации хотели бы следовать рекомендованному курсу действий, но многие — нет |
Разным пациентам будут подходить разные варианты. Каждому пациенту нужна помощь, чтобы принять решение, соответствующее его ценностям и предпочтениям |
Эта рекомендация, вероятно, потребует серьезных обсуждений и участия заинтересованных сторон, прежде чем можно будет определить политику |
Таблица 4
Достоверность подтверждающих доказательств (ISN/KDIGO)
|
Класс |
Достоверность доказательств |
Значение |
|
A |
Высокая |
Мы уверены, что истинный эффект близок к расчетному эффекту |
|
B |
Средняя |
Истинный эффект, скорее всего, будет близок к расчетному эффекту, но существует вероятность того, что он существенно отличается |
|
C |
Низкая |
Истинный эффект может существенно отличаться от предполагаемого эффекта |
|
D |
Очень низкая |
Оценка эффекта весьма неопределенна и часто бывает далека от истинного эффекта |
Приложение 2
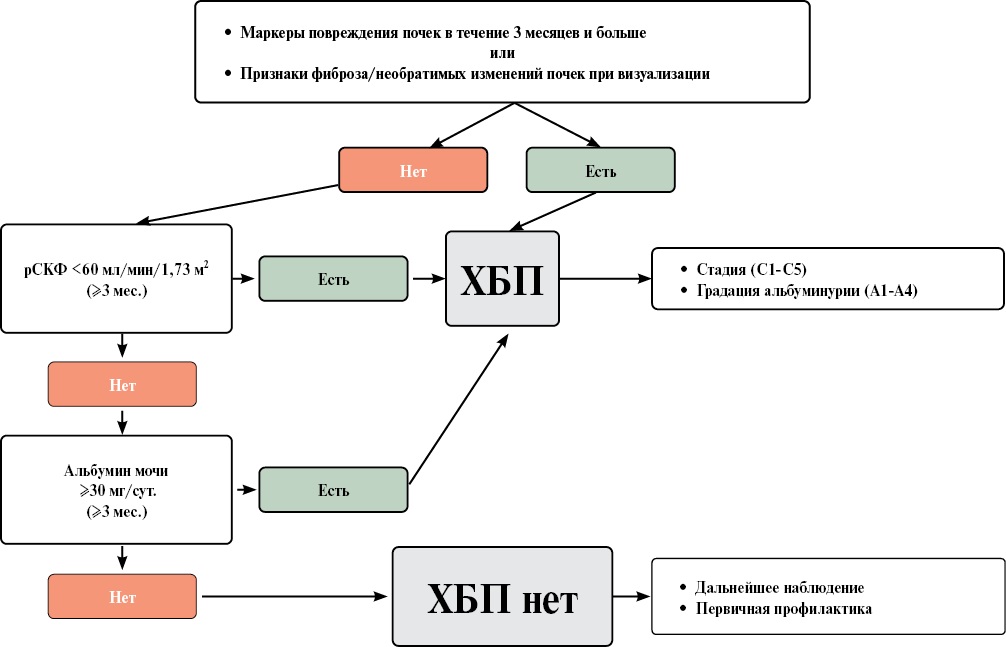
Рис. 1 Алгоритм первичной диагностики ХБП1.
Примечание: рСКФ — расчетная скорость клубочковой фильтрации, ХБП — хроническая болезнь почек.
Таблица 1
Шкала оценки риска ОПП у пациентов с острой сердечно-сосудистой патологией при поступлении в стационар [86]
|
Независимые переменные |
Баллы* |
|
Клинико-демографические характеристики |
|
|
Мужской пол |
6 |
|
Злоупотребление алкоголем |
7 |
|
Сахарный диабет |
1 |
|
Клиническая картина при поступлении в стационар |
|
|
Инфаркт миокарда |
5 |
|
ОСН/ОДХСН |
9 |
|
САД <120 мм рт.ст. САД <110 мм рт.ст. САД <90 мм рт.ст. |
10 15 27 |
|
Функциональное состояние почек при поступлении в стационар |
|
|
СКр >98 мкмоль/л СКр >128 мкмоль/л СКФCKD-EPI <45 мл/мин/1,73 м² СКФCKD-EPI <15 мл/мин/1,73 м² |
14 22 7 14 |
|
Глюкоза >7 ммоль/л при поступлении |
4 |
|
Амбулаторная терапия |
|
|
Прием иАПФ |
4 |
|
Отсутствие верошпирона |
1 |
Примечание: * — диагностически значимая сумма баллов — более 30. ОСН/ОДХСН — острая сердечная недостаточность/острая декомпенсация хронической сердечной недостаточности, САД — систолическое артериальное давление, СКр — сывороточный креатинин, СКФCKD-EPI — расчетная скорость клубочковой фильтрации по формуле CKD-EPIкр, иАПФ — ингибиторы ангиотензинпревращающего фермента.
Таблица 2
Шкала ранжирования риска развития КА-ОПП после коронарных вмешательств [138]
|
Фактор риска |
Балл |
||
|
Гипотония (САД <80 мм рт.ст. в течение часа инотропной поддержки) |
5 |
||
|
Внутриаортальная баллонная контрпульсация |
5 |
||
|
Хроническая сердечная недостаточность III-IV NYHA |
5 |
||
|
Возраст >75 лет |
4 |
||
|
Анемия (гематокрит <39%) |
3 |
||
|
Сахарный диабет |
3 |
||
|
Объем контрастного препарата |
1 балл на каждые 100 мл |
||
|
Креатинин сыворотки >1,5 мг/дл или рСКФ <60 мл/мин/1,73 м² |
4
2 балла для 40-60 мл/мин/1,73 м² 4 балла для 20-40 мл/мин/1,73 м² 6 баллов для <20 мл/мин/1,73 м² |
||
|
Оценка риска по шкале |
|||
|
Балл |
Частота развития КА-ОПП |
Необходимость диализа |
|
|
Низкий риск (≤5 баллов) |
7,5% |
0,04% |
|
|
Средний риск (6-10 баллов) |
14% |
0,12% |
|
|
Высокий риск (11-15 баллов) |
26,1% |
1,09% |
|
|
Очень высокий риск (≥16 баллов) |
57,3% |
12,6% |
|
Примечание: САД — систолическое артериальное давление, рСКФ — расчетная скорость клубочковой фильтрации, КА-ОПП — контраст-ассоциированное острое повреждение почек.
Приложение 3
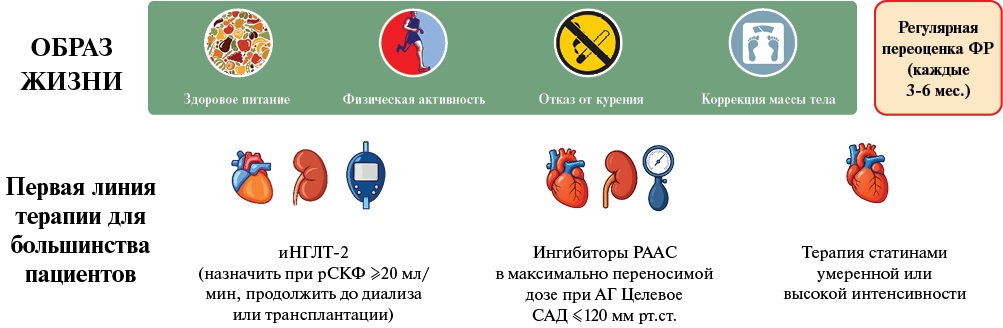
Рис. 1 Терапия ХБП и управление факторами риска [122]*.
Примечание: * — адаптировано из: KDIGO (Diabetes Work Group. Kidney Int. 2022;102:S1-S127). иНГЛТ-2 — ингибитор натрий-глюкозного котранспортера 2 типа, РААС — ренин-ангиотензин-альдостероновая система, САД — систолическое артериальное давление, ФР — фактор риска.
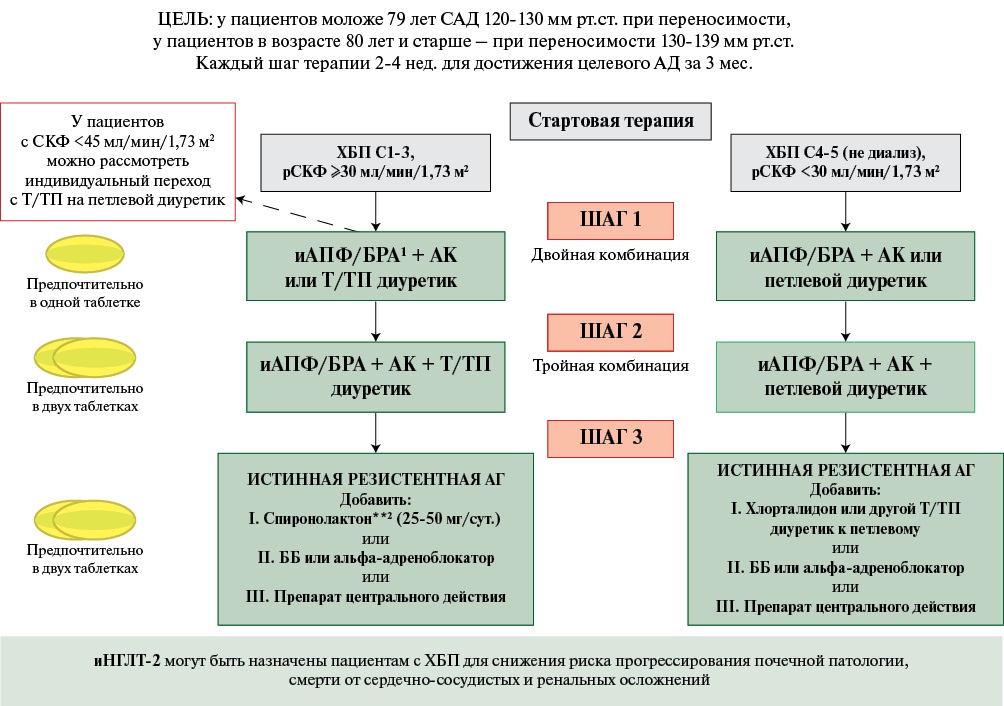
Рис. 2 Стратегия лекарственной терапии при сочетании ХБП и АГ [38].
Примечание: ¹ — у пациентов с ХБП, получающих антигипертензивную терапию, особенно иАПФ или БРА, можно ожидать повышения уровня креатинина. Значительное повышение уровня креатинина на фоне назначения иРААС требует обследования пациента для исключения реноваскулярного заболевания; ² — риск гиперкалиемии при назначении спиронолактона, особенно при исходной СКФ <45 мл/мин/1,73 м² и уровне калия 4,5 ммоль/л. Во всех случаях титровать до полной дозировки при переносимости. АГ — артериальная гипертензия, АД — артериальное давление, АК — антагонисты кальция, ББ — бета-адреноблокаторы, БРА — блокаторы рецепторов ангиотензина, иАПФ — ингибиторы ангиотензинпревращающего фермента, иНГЛТ-2 — ингибиторы натрий-глюкозного котранспортера 2 типа (ингибиторы натрийзависимого переносчика глюкозы 2 типа), рСКФ — расчетная скорость клубочковой фильтрации, САД — систолическое артериальное давление, СКФ — скорость клубочковой фильтрации, Т/ТП — тиазидный/тиазидоподобный, ХБП — хроническая болезнь почек.
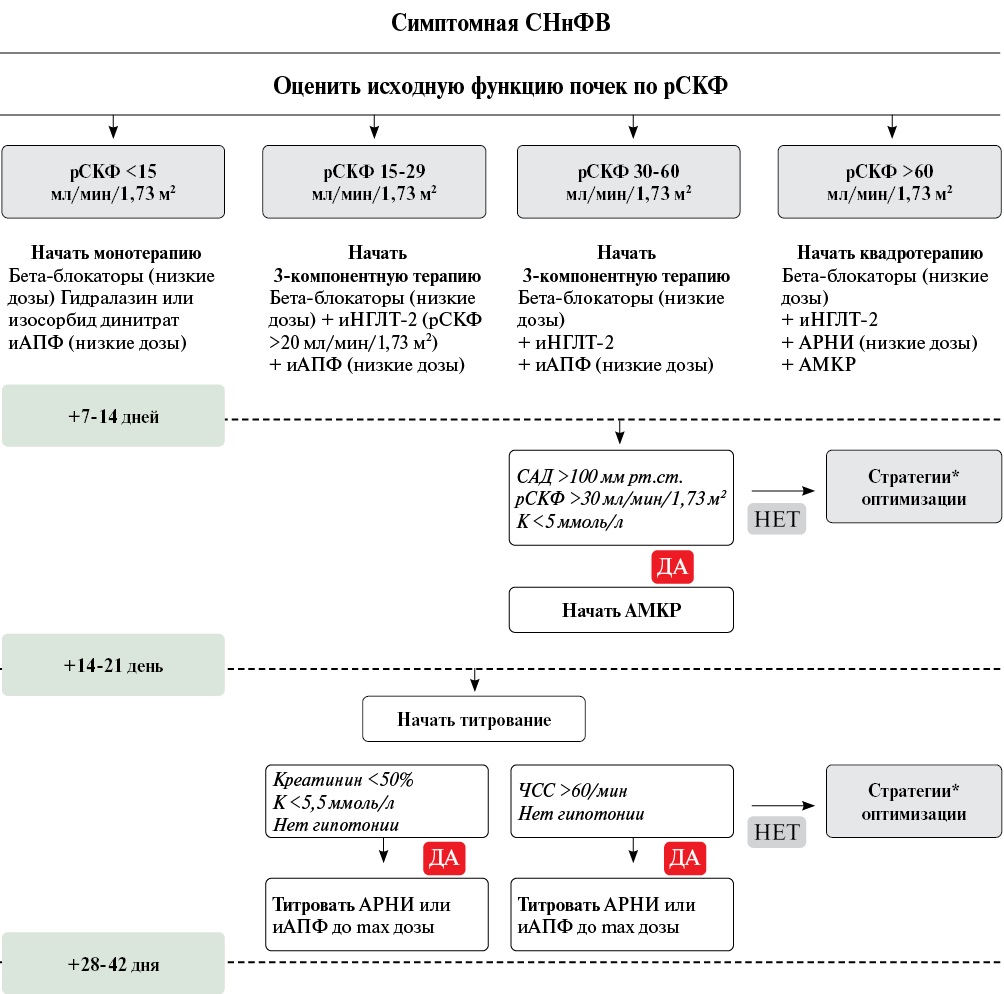
Рис. 3 Алгоритм подбора терапии для пациентов с СНнФВ и ХБП [143].
Примечания:
*Стратегии оптимизации:
• Низкое АД: отменить другие антигипертензивные препараты, оценить выраженность застоя. Оценить наличие синдрома низкого сердечного выброса, кардиомиопатии.
• Низкая рСКФ: отменить нефротоксичные препараты, провести обследование для исключения повреждения почек (стеноз почечной артерии?).
• Высокий уровень калия: выполнить электрокардиографию, отменить калий-содержащие препараты, исключить гиповолемию/гиперволемию, лабораторную ошибку. Рассмотреть назначение калий-связывающих препаратов.
• Низкая частота сердечных сокращений (<50 уд./мин): выполнить электрокардиографию (атриовентрикулярная блокада высокой степени?), отменить препараты, вызывающие брадикардию.
АМКР — антагонист минералокортикоидных рецепторов, АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор, иАПФ — ингибитор ангиотензинпревращающего фермента, иНГЛТ-2 — ингибитор натрий-глюкозного котранспортера 2 типа, рСКФ — расчетная скорость клубочковой фильтрации, СНнФВ — сердечная недостаточность со сниженной фракцией выброса, ЧСС — частота сердечных сокращений.
Приложение 4
Таблица 1
Сахароснижающие препараты, допустимые к применению на различных стадиях ХБП [33]
|
Препараты |
Стадия ХБП |
|
Метформин |
С1-3* |
|
Глибенкламид (в т.ч. микронизированный) |
С1-2 |
|
Гликлазид и гликлазид МВ |
С1-4* |
|
Глимепирид |
С1-4* |
|
Гликвидон |
С1-5 |
|
Глипизид и глипизид ретард |
С1-4* |
|
Репаглинид |
С1-5 |
|
Натеглинид |
С1-3* |
|
Пиоглитазон |
С1-4 |
|
Росиглитазон |
С1-4 |
|
Ситаглиптин |
С1-5* |
|
Вилдаглиптин |
С1-5* |
|
Саксаглиптин |
С1-5* |
|
Линаглиптин |
С1-5 |
|
Алоглиптин |
С1-5* |
|
Гозоглиптин |
С1-3а |
|
Гемиглиптин |
С1-5 |
|
Эвоглиптин |
С1-4 |
|
Эксенатид |
С1-3 |
|
Лираглутид |
С1-4 |
|
Ликсисенатид |
С1-3 |
|
Дулаглутид |
С1-4 |
|
Семаглутид |
С1-4 |
|
Дапаглифлозин |
С1-4** |
|
Эмпаглифлозин |
С1-4*** |
|
Канаглифлозин |
С1-4**** |
|
Ипраглифлозин |
С1-3 |
|
Лусеоглифлозин |
С1-3 |
|
Тирзепатид |
Коррекция дозы при почечной недостаточности не требуется, однако следует соблюдать осторожность, т.к. опыт использования ограничен |
|
Инсулины, включая аналоги |
С1-5* |
Примечание: * — при ХБП С3б-5 необходима коррекция дозы препарата. Необходимо помнить о повышении риска развития гипогликемии у больных на инсулинотерапии по мере прогрессирования заболевания почек от ХБП С1-2 до С3-5, что требует снижения дозы инсулина; ** — не инициировать при рСКФ <25 мл/мин/1,73 м² (можно продолжить у ранее получавших терапию), на диализе противопоказан; *** — не инициировать при рСКФ <20 мл/мин/1,73 м² (можно продолжить у ранее получавших терапию), на диализе противопоказан; **** — не инициировать при рСКФ <30 мл/мин/1,73 м² (можно продолжить при альбуминурии >300 мг/сут. у ранее получавших терапию), на диализе противопоказан.
Таблица 2
Дозирование липидснижающих препаратов при ХБП
|
Препарат |
Нет ХБП или ХБП 1-2 стадии |
ХБП 3 стадии |
ХБП 4-5 стадии |
Почечный трансплантат |
|
Статины (мг/сут.) |
||||
|
Аторвастатин |
10-80 |
10-80 |
10-80 |
10-20 |
|
Флувастатин |
20-80 |
20-80 |
10-80 |
10-80 |
|
Ловастатин |
10-80 |
10-80 |
10-40 |
10-40 |
|
Правастатин |
10-40 |
10-40 |
10-20 |
10-20 |
|
Розувастатин |
5-40 |
5-20 |
5-10 |
5 |
|
Симвастатин |
5-40 |
5-40 |
5-20 |
5-20 |
|
Фибраты (мг/сут.) |
||||
|
Безафибрат |
400-600 |
200 |
противопоказан |
неизвестно |
|
Ципрофибрат |
100-200 |
противопоказан |
||
|
Фенофибрат |
200-400 микронизированная форма 145-200 мг |
с осторожностью |
противопоказан при рСКФ <20 мл/мин/1,73 м² |
|
|
Ингибиторы PCSK-9 (мг) |
||||
|
Эволокумаб |
п/к 140 мг/2 нед. 420 мг/мес. |
не показан при рСКФ <20 мл/мин/1,73 м² |
неизвестно |
|
|
Алирокумаб |
п/к 75-150 мг/2 нед. |
|||
|
Инклисиран |
п/к 284 мг/3 → 6 мес. |
|||
|
Другие (мг/сут.) |
||||
|
Эзетимиб |
10 |
10 |
10 |
неизвестно |
|
Никотиновая кислота |
2000 |
2000 |
1000 |
неизвестно |
|
Бемпедовая кислота |
180 |
180 |
неизвестно |
неизвестно |
Примечание: рСКФ — расчетная скорость клубочковой фильтрации, ХБП — хроническая болезнь почек, PCSK-9 — пропротеиновая конвертаза субтилизин-кексинового типа 9.
Таблица 3
Дозирование антитромботических препаратов при ХБП [126]
|
Препарат |
Сохраненная функция почек и ХБП С1-3 (рСКФ ≥30 мл/мин/1,73 м²) |
ХБП С4 (рСКФ 15-29 мл/мин/1,73 м²) |
ХБП С5 (рСКФ <15 мл/мин/1,73 м²) |
|
Ацетилсалициловая кислота |
Нагрузочная доза 150-300 мг перорально с последующей поддерживающей дозой 75-100 мг/сут. |
Без коррекции дозы |
Без коррекции дозы |
|
Клопидогрел |
Нагрузочная доза 300-600 мг перорально с последующей дозой 75 мг/сут. |
Без коррекции дозы |
Неизвестно |
|
Тикагрелор |
Нагрузочная доза 180 мг перорально, затем по 90 мг 2 раза/сут. |
Без коррекции дозы |
Не рекомендуется |
|
Прасугрел |
Нагрузочная доза 60 мг перорально с последующей дозой 10 мг/сут. |
Без коррекции дозы |
Не рекомендуется |
|
Эноксапарин |
1 мг/кг п/к, 2 раза/сут. 0,75 мг/кг п/к, 2 раза/сут. у пациентов >75 лет |
1 мг/кг п/к, 1 раз/сут. |
Не рекомендуется |
|
Нефракционированный гепарин |
Перед коронарографией: болюсно 60-70 МЕ/кг в/в (максимум 5000 МЕ) и инфузионно (12-15 МЕ/кг/ч, максимум 1000 МЕ/ч), целевое активированное частичное тромбопластиновое время 1,5-2,5 × контроль Во время ЧКВ: по активированному времени свертывания крови или 70-100 МЕ/кг в/в у пациентов, не получающих антикоагулянты (50-70 МЕ/кг при одновременном применении ингибиторов гликопротеиновых рецепторов IIb/IIIa) |
Без коррекции дозы |
Без коррекции дозы |
|
Фондапаринукс |
2,5 мг п/к, 1 раз/сут. |
Не рекомендуется при рСКФ <20 мл/мин/1,73 м² и для пациентов надиализе |
Не рекомендуется |
|
Бивалирудин |
Болюсно 0,75 мг/кг в/в, инфузия 1,75 мг/кг/ч Если рСКФ ≥30 и ≤60 мл/мин/1,73 м², снизить дозу инфузии до 1,4 мг/кг/ч |
Не рекомендуется |
Не рекомендуется |
|
Эптифибатид |
Болюс 180 мкг/кг в/в с последующей инфузией 2,0 мкг/кг/мин в течение до 18 ч Если рСКФ <50 мл/мин/1,73 м², снизить до 1,0 мкг/кг/мин |
Не рекомендуется |
Не рекомендуется |
|
Тирофибан |
Болюс 25 мкг/кг в/в, затем 0,15 мкг/кг/мин |
Снизить скорость инфузии до 50%, если рСКФ <30 мл/мин/1,73 м² |
Не рекомендуется |
Примечание: в/в — внутривенно, п/к — подкожно, рСКФ — расчетная скорость клубочковой фильтрации, ХБП — хроническая болезнь почек, ЧКВ — чрескожное коронарное вмешательство.
Таблица 4
Дозирование прогнозмодифицирующих препаратов при ХСН c коррекцией по СКФ
|
Препарат |
Начальная доза (мг) |
Целевая доза (мг) |
Коррекция дозы (%) по СКФ (мл/мин/1,73 м²) |
||
|
>50 |
10-50 |
<10 |
|||
|
Ингибиторы ангиотензинпревращающего фермента |
|||||
|
Каптоприл |
6,25 мг × 3 раза/сут. |
50 мг × 3 раза/сут. |
100 |
75 |
50 |
|
Эналаприл |
2,5 мг × 2 раза/сут. |
10-20 мг × 2 раза/сут. |
100 |
75-100 |
50 |
|
Лизиноприл |
2,5-5,0 мг/сут. |
20-35 мг/сут. |
100 |
50-75 |
25-50 |
|
Рамиприл |
2,5 мг/сут. |
5 мг/сут. |
100 |
50-75 |
25-50 |
|
Трандолаприл |
0,5 мг/сут. |
4 мг/сут. |
100 |
50-100 |
50 |
|
Блокаторы рецепторов ангиотензина II |
|||||
|
Кандесартан |
4-8 мг/сут. |
32 мг/сут. |
коррекции дозы не требуется |
||
|
Валсартан |
40 мг × 2 раза/сут. |
160 мг × 2 раза/сут. |
|||
|
Лозартан |
50 мг/сут. |
150 мг/сут. |
|||
|
Ангиотензиновых рецепторов и неприлизина ингибитор Сакубитрил/Валсартан |
100 мг × 2 раза/сут. |
200 мг × 2 раза/сут. |
инициация с 50% начальной дозы при рСКФ <30 мл/мин/1,73 м² |
||
|
Бета-блокаторы |
|||||
|
Бисопролол |
1,25 мг/сут. |
10 мг/сут. |
100 |
75 |
50 |
|
Карведилол |
3,125 мг × 2 раза/сут. |
25-50 мг × 2 раза/сут. |
коррекции дозы не требуется |
||
|
Метопролол (CR/XL) |
12,5-25 мг/сут. |
200 мг/сут. |
|||
|
Небиволол |
1,25 мг/сут. |
10 мг/сут. |
100 |
100 |
50 |
|
Антагонисты минералокортикоидных рецепторов |
|||||
|
Эплеренон |
25 мг/сут. |
50 мг/сут. |
не показан при рСКФ <30 мл/мин/1,73 м² при додиализной ХБП |
||
|
показан пациентам на диализе (ХБП С5Д) в дозе 50 мг/сут. |
|||||
|
Спиронолактон |
25 мг/сут. |
25-50 мг/сут. |
не показан при рСКФ <30 мл/мин/1,73 м² при додиализной ХБП |
||
|
показан пациентам на диализе (ХБП С5Д) в дозе 12,5-25 мг/сут. |
|||||
|
Финеренон |
10 мг/сут. |
20 мг/сут. |
при рСКФ ≥25 — <60 мл/мин/1,73 м² — 10 мг |
||
|
не показан при рСКФ <25 мл/мин/1,73 м² |
|||||
|
Ингибиторы натрий-глюкозного котранспортера 2 типа |
|||||
|
Дапаглифлозин |
10 мг/сут. |
10 мг/сут. |
не показан для инициации при рСКФ <20 мл/мин/1,73 м² |
||
|
Эмпаглифлозин |
10 мг/сут. |
10 мг/сут. |
не показан для инициации при рСКФ <20 мл/мин/1,73 м² |
||
Примечание: рСКФ — расчетная скорость клубочковой фильтрации, ХБП — хроническая болезнь почек.
Таблица 5
Дозирование ПОАК у пациентов с ХБП6
|
Препарат Категория |
Дабигатран |
Ривароксабан |
Апиксабан |
Эдоксабан |
|
>95 мл/мин |
150 мг × 2 раза/сут. |
20 мг/сут. |
5 мг × 2 раза/сут./ 2,5 мг × 2 раза/сут. |
60* мг/сут. |
|
50-94 мл/мин |
60 мг/сут. (снижение дозы смотри ниже) |
|||
|
30-49 мл/мин |
150 мг × 2 раза/сут./ 110 × 2 раза/сут. (высокий риск кровотечений, сопутствующая терапия верапамилом) |
15 мг/сут. |
30 мг/сут. (снижение дозы смотри ниже) |
|
|
15-29 мл/мин |
не использовать |
15 мг/сут. (использовать с осторожностью) |
2,5 мг × 2 раза/сут. (использовать с осторожностью) |
30 мг/сут. (использовать с осторожностью) |
|
Диализ |
не использовать |
Не использовать |
Не использовать |
Не использовать |
Примечание: * — эдоксабан назначается пациентам с высоким клиренсом креатинина только после индивидуальной оценки рисков тромбоэмболии и кровотечений.
Приложение 5
Критерии оценки качества первичной медико-санитарной помощи взрослым при ХБП
|
№ п/п |
Критерии оценки качества |
Оценка выполнения |
|
1. |
Выполнено ультразвуковое исследование почек пациенту с подозрением на ХБП |
Да/Нет |
|
2. |
Выполнено исследование уровня креатинина в крови для последующего расчета СКФ пациентам с ХБП С1-С5 или у лиц с подозрением на ХБП |
Да/Нет |
|
3. |
Выполнено определение альбумина в моче и количества белка в суточной моче или определение альбуминурии/протеинурии в моче и исследование уровня креатинина в моче с расчетом отношения альбумин/креатинин у пациентов с ХБП или факторами риска ХБП |
Да/Нет |
|
4. |
Выполнено исследование общего (клинического) анализа крови; общего (клинического) анализа крови развернутого; исследование уровня общего гемоглобина в крови; определение среднего содержания и средней концентрации гемоглобина в эритроцитах; определение размеров эритроцитов; исследование уровня ретикулоцитов в крови; исследование уровня лейкоцитов в крови; дифференцированный подсчет лейкоцитов (лейкоцитарная формула); исследование уровня железа сыворотки крови; исследование уровня ферритина в крови; исследование насыщения трансферрина железом; исследование кала на скрытую кровь всем пациентам с установленным диагнозом ХБП С3-С5Д |
Да/Нет |
|
5. |
Выполнено исследование уровня натрия в крови; исследование уровня калия в крови всем пациентам с установленным диагнозом ХБП С3-С5Д |
Да/Нет |
|
6. |
Выполнено исследование кислотно-основного состояния и газов крови всем пациентам с установленным диагнозом ХБП С3-С5Д |
Да/Нет |
|
7. |
Выполнено исследование уровня альбумина в крови всем пациентам с установленным диагнозом ХБП С3-С5Д |
Да/Нет |
|
8. |
Выполнено исследование уровня холестерина в крови; исследование уровня холестерина липопротеидов низкой плотности; исследование уровня холестерина липопротеидов высокой плотности в крови; исследование уровня триглицеридов в крови всем пациентам с установленным диагнозом ХБП С3-С5Д |
Да/Нет |
|
9. |
Выполнено исследование уровня мочевой кислоты в крови всем пациентам с установленным диагнозом ХБП С3-С5Д |
Да/Нет |
|
10. |
Выполнено исследование уровня неорганического фосфора в крови; исследование уровня общего кальция в крови; исследование уровня паратиреоидного гормона в крови; определение активности щелочной фосфатазы в крови всем пациентам с установленным диагнозом ХБП С3-С5Д |
Да/Нет |
|
11. |
Выполнено исследование уровня С-реактивного белка в сыворотке крови |
Да/Нет |
|
12. |
Выполнена эхокардиография пациентам с ХБП С3-С5Д |
Да/Нет |
|
13. |
Выполнено ультразвуковое исследование паращитовидных желез пациентам с ХБП с прогрессирующим гиперпаратиреозом при ХБП С5Д |
Да/Нет |
|
14. |
Выполнено лечение ингибитором ангиотензинпревращающего фермента или антагонистом рецепторов к ангиотензину II или/и ингибиторами натрийзависимого переносчика глюкозы 2-го типа |
Да/Нет |
|
15. |
Выполнено лечение аналогами глюкагоноподобного пептида-1 или/и финереноном (пациентам с ХБП и сахарным диабетом 2 типа с СКФ >25 мл/мин/1,73 м²) |
Да/Нет |
Примечание: СКФ — скорость клубочковой фильтрации, ХБП — хроническая болезнь почек.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Клинические рекомендации. Хроническая болезнь почек (ХБП). Одобрено Научно-практическим Советом Минздрава РФ. 2024. [Электронный ресурс] URL: Рубрикатор КР (https://cr.minzdrav.gov.ru).
2. Centers for Disease Control and Prevention. Chronic Kidney Disease in the United States, 2021 (US Department of Health and Human Services, 2021).
3. World health statistics 2024: monitoring health for the SDGs, sustainable development goals. WHO. 2024.
4. Сахарный диабет 2 типа у взрослых. Клинические рекомендации. Российская ассоциация эндокринологов. Одобрено Научно-практическим Советом Минздрава РФ. 2022. [Электронный ресурс] URL: Рубрикатор КР (https://cr.minzdrav.gov.ru).
5. Клинические рекомендации. Острое повреждение почек. 2020. Россия.
6. Клинические рекомендации. Фибрилляция и трепетание предсердий у взрослых. Одобрено Научно-практическим Советом Минздрава РФ. 2024. [Электронный ресурс] URL: Рубрикатор КР (https://cr.minzdrav.gov.ru).
Список литературы
1. Функциональное состояние почек и прогнозирование сердечно-сосудистого риска. Рекомендации ВНОК и НОНР. Кардиоваскулярная терапия и профилактика. 2008;7(6 S3):1-20. EDN WATIVJ.
2. Моисеев В. С., Мухин Н. А., Смирнов А. В. и др. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардио-нефропротекции. Российский кардиологический журнал. 2014;(8):7-37. doi:10.15829/1560-4071-2014-8-7-37.
3. Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. GBD Chronic Kidney Disease Collaboration. Lancet. 2020;395:709-33. doi:10.1016/S0140-6736(20)30045-3.
4. Francis A, Harhay MN, Ong ACM, et al.; American Society of Nephrology; European Renal Association; International Society of Nephrology. Chronic kidney disease and the global public health agenda: an international consensus. Nat Rev Nephrol. 2024;3. doi:10.1038/s41581-024-00820-6.
5. National Kidney Foundation. K/DOQI Clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis. 2002;39(Suppl 1):SI-266.
6. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2024 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease. Kidney Int. 2024;105(4S):S117-S314. doi:10.1016/j.kint.2023.10.018.
7. Ткачева О. Н., Котовская Ю. В., Бобкова И. Н. и др. Хроническая болезнь почек у пациентов пожилого и старческого возраста. Согласованное мнение экспертов Российской ассоциации геронтологов и гериатров, Научного общества нефрологов России и Евразийской ассоциации терапевтов. Российский журнал гериатрической медицины. 2024;(1):6-20. doi:10.37586/2686-8636-1-2024-6-20.
8. Jager KJ, Kovesdy C, Langham R, et al. A single number for advocacy and communication — worldwide more than 850 million individuals have kidney diseases. Nephrol Dial Transplant. 2019;34:1803-5.
9. Bello AK, Okpechi IG, Levin A, et al.; and the ISN-GKHA Group. An update on the global disparities in kidney disease burden and care across world countries and regions. Lancet Glob Health. 2024;12:e382-95.
10. Sozio SM, Pivert KA, Caskey FJ, Levin A. The state of the global nephrology workforce: a joint ASN-ERA-EDTA-ISN investigation. Kidney International. 2021;100:995-1000. doi:10.1016/j.kint.2021.07.029.
11. Ortiz A, Wanner C, Gansevoort R, ERA Council. Chronic kidney disease as cardiovascular risk factor in routine clinical practice: a position statement by the Council of the European Renal Association. European Journal of Preventive Cardiology. 2022; 29:2211-5. doi:10.1093/eurjpc/zwac186.
12. Смирнов А. В., Каюков И. Г., Есаян A. M. и др. Превентивный подход в современной нефрологии. Нефрология. 2004;8(3):7-14. doi:10.24884/1561-6274-2004-8-3-7-14.
13. Смирнов А. В., Добронравов В. А., Каюков И. Г. и др. Эпидемиология и социально-экономические аспекты хронической болезни почек. Нефрология. 2006;10(1):7-13.
14. Ощепкова Е. В., Долгушева Ю. А., Жернакова Ю. В. и др. Распространенность нарушения функции почек при артериальной гипертонии (по данным эпидемиологического исследования ЭССЕ-РФ). Системные гипертензии. 2015;12(3):19-24.
15. Бойцов С. А., Драпкина О. М., Шляхто Е. В. и др. Исследование ЭССЕ-РФ (Эпидемиология сердечно-сосудистых заболеваний и их факторов риска в регионах Российской Федерации). Десять лет спустя. Кардиоваскулярная терапия и профилактика. 2021;20(5):3007. doi:10.15829/1728-8800-2021-3007.
16. Кобалава Ж. Д., Виллевальде С. В., Боровкова Н. Ю. и др. От имени исследователей программы ХРОНОГРАФ. Распространенность маркеров хронической болезни почек у пациентов с артериальной гипертонией: результаты эпидемиологического исследования ХРОНОГРАФ. Кардиология. 2017;57(10):39-44. doi:10.18087/cardio.2017.10.10041.
17. Кобалава Ж. Д., Виллевальде С. В., Багманова Н. Х. и др. Распространенность маркеров хронической болезни почек у пациентов с артериальной гипертонией в зависимости от наличия сахарного диабета: результаты эпидемиологического исследования ХРОНОГРАФ. Российский кардиологический журнал. 2018;(2):91-101. doi:10.15829/1560-4071-2018-2-91-101.
18. Дедов И. И., Шестакова М. В., Викулова О. К. и др. Сахарный диабет в Российской Федерации: динамика эпидемиологических показателей по данным Федерального регистра сахарного диабета за период 2010 — 2022 гг. Сахарный диабет. 2023;26(2):104-23. doi:10.14341/DM13035.
19. Шляхто Е. В., Беленков Ю. Н., Бойцов С. А. и др. Результаты промежуточного анализа проспективного наблюдательного многоцентрового регистрового исследования пациентов с хронической сердечной недостаточностью в Российской Федерации "ПРИОРИТЕТ-ХСН": исходные характеристики и лечение первых включенных пациентов. Российский кардиологический журнал. 2023;28(10):5593. doi:10.15829/1560-4071-2023-5593.
20. Андрусев А. М., Томилина Н. А., Перегудова Н. Г., Шинкарев М. Б. Заместительная терапия терминальной хронической почечной недостаточности в Российской Федерации 2014-2018 гг. Отчет по данным общероссийского регистра заместительной почечной терапии российского диализного общества. Нефрология и диализ. 2020;22(S1):1-71.
21. Prikhodina L, Komissarov K, Bulanov N, et al.; Regional Board and ISN-GKHA Team Authors. Capacity for the management of kidney failure in the International Society of Nephrology Newly Independent States and Russia region: report from the 2023 ISN Global Kidney Health Atlas (ISN-GKHA). Kidney Int Suppl (2011). 2024;13(1):71-82. doi:10.1016/j.kisu.2024.01.005.
22. Saran R, Robinson B, Abbott KC, et al. US Renal Data System 2019 Annual Data Report: Epidemiology of Kidney Disease in the United States. Am J Kidney Dis. 2020;75(1 Suppl 1): A6-A7. doi:10.1053/j.ajkd.2019.09.003.
23. McCullough KP, Morgenstern H, Saran R, et al. Projecting ESRD Incidence and Prevalence in the United States through 2030. J Am Soc Nephrol. 2019;30:127-35. doi:10.1681/ASN.2018050531.
24. Matsushita K, van der Velde M, Astor BC, et al. Chronic Kidney Disease Prognosis Consortium. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet. 2010;375(9731):2073-81.
25. Levey AS, de Jong PE, Coresh J, et al. The definition, classification, and prognosis of chronic kidney disease: a KDIG0 Controversies Conference report. Kidney int. 2011;80(l):17-28. doi:10.1038/ki.2010.483.
26. Foley R, Murray A, Li S, et al. Chronic kidney disease and the risk for cardiovascular disease, renal replacement, and death in the United States Medicare population, 1998 to 1999. J Am SocNephrol. 2005;16:489-95.
27. Wu B, Bell K, Stanford A, et al. Understanding CKD among patients with T2DM: prevalence, temporal trends, and treatment patterns — NHANES 2007-2012. BMJ Open Diabetes Research and Care. 2016;4:e000154. doi:10.1136/bmjdrc-2015-000154.
28. Visseren FLJ, Mach F, Smulders YM, et al.; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice: Developed by the Task Force for cardiovascular disease prevention in clinical practice with representatives of the European Society of Cardiology and 12 medical societies With the special contribution of the European Association of Preventive Cardiology (EAPC). European Heart Journal. 2021;42(34):3227-337.
29. Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009;150:604-12.
30. Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. 2020; 98(4S):S1-S115.
31. Tuttle KR, Bakris GL, Bilous RW, et al. Diabetic kidney disease: a report from an ADA Consensus Conference. Diabetes Care. 2014;37(10):2864-83. doi:10.2337/dc14-1296.
32. Fox CS, Matsushita K, Woodward M, et al. Associations of kidney disease measures with mortality and end-stage renal disease in individuals with and without diabetes: a meta-analysis. Lancet. 2012;380(9854):1662-73. doi:10.1016/S0140-6736(12)61350-6.
33. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под редакцией И. И. Дедова, М. В. Шестаковой, О. Ю. Сухаревой. 12-й выпуск. М.; 2025. c. 248.
34. Kidney Disease: Improving Global Outcomes (KDIGO) Blood Pressure Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Blood Pressure in Chronic Kidney Disease. Kidney Int. 2021;99(3S):S1-S87.
35. Böhm M, Thoenes M, Danchin N, et al. Association of cardiovascular risk factors with microalbuminuria in hypertensive individuals: the i-SEARCH global study. J Hypertens. 2007;25(11):2317-24.
36. Wright JT Jr, Williamson JD, Whelton PK, et al. SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control. N Engl J Med. 2015;373(22):2103-16. doi:10.1056/NEJMoa1511939.
37. Lopez R, Copeland T, McCulloch C, et al. Additive effects of intensive BP control and ACE inhibition on suppression of proteinuria in patients with CKD. JHumHypertens. 2023;37(5):419-21. doi:10.1038/s41371-023-00823-z.
38. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(9):6117. doi:10.15829/ 1560-4071-2024-6117.
39. Ежов М. В., Кухарчук В. В., Сергиенко И. В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471.
40. Go AS, Chertow GM, Fan D, et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Engl J Med. 2004;351:1296-305.
41. Manjunath G, Tighiouart H, Ibrahim H, et al. Level of kidney function as a risk factor for atherosclerotic cardiovascular outcomes in the community. J Am CollCardiol. 2003;41(1):47-55.
42. Matsushita K, Ballew SH, Wang AY, et al. Epidemiology and risk of cardiovascular disease in populations with chronic kidney disease. Nat Rev Nephrol. 2022;18(11):696-707. doi:10.1038/s41581-022-00616-6.
43. Matsushita K, Coresh J, Sang Y, et al. Estimated glomerular filtration rate and albuminuria for prediction of cardiovascular outcomes: a collaborative meta-analysis of individual participant data. Lancet Diabetes Endocrinol. 2015;3(7):514-25. doi:10.1016/S2213-8587(15)00040-6.
44. Mielniczuk LM, Pfeffer MA, Lewis EF, et al. Estimated glomerular filtration rate, inflammation, and cardiovascular events after an acute coronary syndrome. Am Heart J. 2008;155:725-31.
45. Gibson CM, Dumaine RL, Gelfand EV, et al. Association of glomerular filtration rate on presentation with subsequent mortality in non-ST-segment elevation acute coronary syndrome: Observations in 13,307 patients in five TIMI trials. Eur Heart J. 2004; 25(22):1998-2005.
46. Anavekar NS, McMurray JJ, Velazquez EJ, et al. Relation between renal dysfunction and cardiovascular outcomes after myocardial infarction. N Engl J Med. 2004;351:1285-95.
47. Panchal HB, Zheng S, Devani K, et al. Impact of chronic kidney disease on revascularization and outcomes in patients with ST-elevation myocardial infarction. Am J Cardiol. 2021;150:15-23. doi:10.1016/j.amjcard.2021.03.057.
48. Santopinto JJ, Fox KA, Goldberg RJ, et al. Creatinine clearance and adverse hospital outcomes in patients with acute coronary syndromes: findings from the global registry of acute coronary events (GRACE). Heart. 2003;89:1003-8.
49. Junho CVC, Frisch J, Soppert J, et al. Cardiomyopathy in chronic kidney disease: clinical features, biomarkers and the contribution of murine models in understanding pathophysiology. Clin Kidney J. 2023;16(11):1786-803. doi:10.1093/ckj/sfad085.
50. Grams ME, Coresh J, Matsushita K, et al. Estimated Glomerular Filtration Rate, Albuminuria, and Adverse Outcomes. An Individual-Participant Data Meta-Analysis. JAMA. 2023;330(13):1266-77. doi:10.1001/jama.2023.17002.
51. Collins AJ, Vassalotti JA, Wang C, et al. Who should be targeted for CKD screening? Impact of diabetes, hypertension, and cardiovascular disease. Am J Kidney Dis. 2009;53 (Suppl 3):71-7.
52. Herzog C. Kidney disease in cardiology. Nephrol Dial Transplant. 2008;23(8):42-6.
53. Clase CM, Garg AX, Kiberd BA. Prevalence of low glomerular filtration rate in nondiabetic Americans: Third National Health and Nutrition Examination Survey (NHANES III). J Am SocNephrol. 2002;13(5):1338-49.
54. Nitsch D, Grams M, Sang Y, et al.; Chronic Kidney Disease Prognosis Consortium. Associations of estimated glomerular filtration rate and albuminuria with mortality and renal failure by sex: a meta-analysis. BMJ. 2013;346:f324. doi:10.1136/bmj.f324.
55. Claudel SE, Waikar SS, Schmidt IM, et al. The relationship between low levels of albuminuria and mortality among adults without major cardiovascular risk factors. Eur J Prev Cardiol. 2024; 31(17):2046-55. doi:10.1093/eurjpc/zwae189.
56. Claudel SE, Verma A. Albuminuria in Cardiovascular, Kidney, and Metabolic Disorders: A State-of-the-Art Review. Circulation. 2025;151(10):716-32. doi:10.1161/CIRCULATIONAHA.124.071079.
57. McDonagh TA, Metra M, Adamo M, et al. ESC Scientific Document Group. 2023 Focused Update of the 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2023;44(37): 3627-39. doi:10.1093/eurheartj/ehad195.
58. Marcos MC, Espriella R, Ordás JG, et al. Prevalence and clinical profile of kidney disease in patients with chronic heart failure. Insights from the Spanish cardiorenal registry. Revista Española de Cardiología (English Edition). 2024;77,1:50-9.
59. Kottgen A, Russell SD, Loehr LR, et al. Reduced kidney function as a risk factor for incident heart failure: the atherosclerosis risk in communities (ARIC) study. J Am SocNephrol. 2007;18:1307-15. doi:10.1681/ASN.2006101159.
60. Parmar SS, Muthuppalaniappan V, Debasish B. Gaps in Modern Heart Failure and Chronic Kidney Disease Research, European Cardiology Review. 2023;18:e51. doi:10.15420/ecr.2022.64.
61. Ronco C, McCullough P, Anker S, et al. Cardio-renal syndromes: report from the consensus conference of the Acute Dialysis Quality Initiative. Eur Heart J. 2010;31:703-11.
62. Zhang J, Hu Z, Tan Y, Ye J. Causal relationship from heart failure to kidney function and CKD: A bidirectional two-sample mendelian randomization study. PLoS ONE. 2023;18(12):e0295532. doi:10.1371/journal.pone.0295532.
63. Zoccali C, Mallamaci F, Adamczak M, et al. Cardiovascular complications in chronic kidney disease: a review from the European Renal and Cardiovascular Medicine Working Group of the European Renal Association. Cardiovasc Res. 2023;119(11): 2017-32. doi:10.1093/cvr/cvad083.
64. Löfman I, Szummer K, Evans M, et al. Incidence of, Associations With and Prognostic Impact of Worsening Renal Function in Heart Failure With Different Ejection Fraction Categories. Am. J. Cardiol. 2019;124:1575-83.
65. Heywood JT, Fonarow GC, Costanzo MR, et al.; Committee ASA Investigators (2007). High prevalence of renal dysfunction and its impact on outcome in 118,465 patients hospitalized with acute decompensated heart failure: a report from the ADHERE database. J Card Fail. 2007;13:422-30. doi:10.1016/j.cardfail.2007.03.011.
66. Hillege HL, Nitsch D, Pfeffer MA, et al. Renal function as a predictor of outcome in a broad spectrum of patients with heart failure. Circulation. 2006;113:671-8. doi:10.1161/CIRCULATIONAHA.105.580506.
67. Patel RB, Fonarow GC, Greene SJ, et al. Kidney function and outcomes in patients hospitalized with heart failure. JAmCollCardiol. 2021;78:330-43.
68. Межонов Е. М., Рейтблат О. М., Вялкина Ю. А. и др. Хроническая болезнь почек и хроническая сердечная недостаточность: влияние на прогноз и выбор патогенетической терапии. Терапевтический архив. 2024;96(7):666-74. doi:10.26442/00403660.2024.07.202781.
69. Wilson P, D’Agostino Rb, Parise H, et al. Metabolic syndrome as a precursor of cardiovascular disease and type 2 diabetes mellitus. Circulation. 2005;112:3066-72.
70. Кобалава Ж. Д., Моисеев В. С. Концепция кардиоренальных и метаболических соотношений в современной профилактической кардиологии. Кардиоваскулярная терапия и профилактика. 2008;7(4):4-7.
71. Мухин Н. А., Балкаров И. М., Моисеев В. С. и др. Хронические прогрессирующие нефропатии и образ жизни современного человека. Терапевтический архив. 2004;(9):5-10.
72. Кобалава Ж. Д., Котовская Ю. В., Толкачева В. В., Мильто А. С. Мочевая кислота — ключевой компонент кардиренометаболического континуума. Кардиоваскулярная терапия и профилактика. 2008;7(4):95-100.
73. Desai RJ, Franklin JM, Spoendlin-Allen J, et al. An evaluation of longitudinal changes in serum uric acid levels and associated risk of cardio-metabolic events and renal function decline in gout. PLoS One. 2018;13(2):e0193622. Published online 2018. doi:10.1371/journal.pone.0193622.
74. Despres J-P. Abdominal obesity: the most prevalent cause of the metabolic syndrome and related cardiometabolic risk. Eur Heart J. 2006;8(suppl. B):4-12.
75. Pommer W. Preventive Nephrology: The Role of Obesity in Different Stages of Chronic Kidney Disease. Kidney Dis. 2018;4:199-204. doi:10.1159/000490247.
76. Ndumele CE, Rangaswami J, Chow SL, et al.; on behalf of the American Heart Association. Cardiovascular-kidney-metabolic health: a presidential advisory from the American Heart Association. Circulation. 2023;148:1606-35. doi:10.1161/CIR.0000000000001184.
77. Sebastian SA, Padda I, Johal G. Cardiovascular-Kidney-Metabolic (CKM) syndrome: A state-of-the-art review. CurrProblCardiol. 2024;49(2):102344. doi:10.1016/j.cpcardiol.2023.102344.
78. Roghi A, Savonitto S, Cavallini C, et al. Impact of acute renal failure following percutaneous coronary intervention on long-term mortality. J Cardiovasc Med. 2008;9:375-81.
79. Bagshaw SM, Lapinsky S, Dial S, et al. Acute kidney injury in septic shock: clinical outcomes and impact of duration of hypotension prior to initiation of antimicrobial therapy. Intensive Care Med. 2009;35:871-81.
80. Latchamsetty R, Fang J, Kline-Rogers E, et al. Prognostic value of transient and sustained increase in in-hospital creatinine on outcomes of patients admitted with acute coronary syndrome. Am J Cardiol. 2007;99(7):939-42.
81. Jose P, Skali H, Anavekar N, et al. Increase in creatinine and cardiovascular risk in patients with systolic dysfunction after myocardial infarction. J Am SocNephrol. 2006;17:2886-91.
82. Gottlieb SS, Abraham W, Butler J, et al. The prognostic importance of different definitions of worsening renal function in congestive heart failure. J Card Fail. 2002 8:136-41.
83. Cowie MR, Komajda M, Murray-Thomas T, et al. Prevalence and impact of worsening renal function in patients hospitalized with decompensated heart failure: results of the prospective outcomes study in heart failure (POSH). Eur Heart J. 2006;27:1216-22.
84. Ronco C, Bellomo R, McCullough PA. Cardiorenal syndromes in critical care. ContribNephrol. 2010; Basel, Karger, 2010, vol 165, 366 p.
85. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney inter., Suppl. 2012;2:1-138.
86. Tangri N, Grams ME, Levey AS, et al. Multinational Assessment of Accuracy of Equations for Predicting Risk of Kidney Failure: A Meta-analysis JAMA. 2016; 315(2):1-11. doi:10.1001/jama.2015.18202.
87. Vondenhoff S, Schunk SJ, Noels H. Increased cardiovascular risk in patients with chronic kidney disease. Herz. 2024;49:95-104.
88. Ткачева О. Н., Котовская Ю. В., Рунихина Н. К. и др. Клинические рекомендации "Старческая астения". Российский журнал гериатрической медицины. 2025;(1):6-48. doi:10.37586/2686-8636-1-2025-6-48.
89. Ku E, Sarnak MJ, Toto R, et al. Effect of Blood Pressure Control on Long-Term Risk of End-Stage Renal Disease and Death Among Subgroups of Patients With Chronic Kidney Disease. J Am Heart Assoc. 2019;8(16):e012749. doi:10.1161/JAHA.119.012749.
90. Wright Jr JT, Bakris G, Greene T, et al. Effect of Blood Pressure Lowering and Antihypertensive Drug Class on Progression of Hypertensive Kidney Disease: Results From the AASK Trial. JAMA. 2002;288(19):2421-31. doi:10.1001/jama.288.19.2421.
91. Ruggenenti P, Perna A, Loriga G, et al.; REIN-2 Study Group. Blood-pressure control for renoprotection in patients with non-diabetic chronic renal disease (REIN-2): multicentre, randomised controlled trial. Lancet. 2005;365(9463):939-46. doi:10.1016/S0140-6736(05)71082-5.
92. de Galan BE, Perkovic V, Ninomiya T, et al. ADVANCE Collaborative Group. Lowering blood pressure reduces renal events in type 2 diabetes. J Am SocNephrol. 2009;20:883-92.
93. McEvoy JW, McCarthy CP, Bruno RM, et al.; ESC Scientific Document Group. 2024 ESC Guidelines for the management of elevated blood pressure and hypertension. Eur Heart J. 2024; 45(38):3912-4018. doi:10.1093/eurheartj/ehae178. Erratum in: Eur Heart J. 2025;46(14):1300. doi:10.1093/eurheartj/ehaf031.
94. Wheeler DC, Stefánsson BV, Jongs N, et al. Effects of dapagliflozin on major adverse kidney and cardiovascular events in patients with diabetic and non-diabetic chronic kidney disease: a prespecified analysis from the DAPA-CKD trial. Lancet Diabetes Endocrinol. 2021;9(1):22-31. doi:10.1016/S2213-8587(20)30369-7.
95. Zelniker TA, Wiviott SD, RazfI, et al. SGLT2 inhibitors for primary and secondary prevention of cardiovascular and renal outcomes in type 2 diabetes: a systematic review and meta-analysis of cardiovascular outcome trials. Lancet. 2019;393:31-9.
96. Perkovic V, Jardine MJ, Neal B, et al.; CREDENCE Trial Investigators. Canaglifozin and renal outcomes in type 2 diabetes and nephropathy. N Engl J Med. 2019;380:2295-306.
97. Giugliano D, De Nicola L, Maiorino MI, et al. Preventing major adverse cardiovascular events by SGLT-2 inhibition in patients with type 2 diabetes: the role of kidney. Cardiovasc Diabetol. (2020);19:35. doi:10.1186/s12933-020-01010-x.
98. Bhatt DL, Szarek M, Pitt B, et al. Sotaglifozin in patients with diabetes and chronic kidney disease. N Engl J Med. 2021;384(2): 117-28. doi:10.1056/NEJMoa2030183.
99. Docherty KF, Jhund PS, Anand I, et al. Effect of dapaglifozin on outpatient worsening of patients with heart failure and reduced ejection fraction: a prespecified analysis of DAPA-HF. Circulation. 2020;142:1623-32.
100. Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomes with empaglifozin in heart failure. N Engl J Med. 2020;383: 1413-24.
101. Heerspink HJL, Stefánsson BV, Correa-Rotter R, et al.; for the DAPA-CKD Trial Committees and Investigators. Dapaglifozin in patients with chronic kidney disease. N Engl J Med. 2020; 383:1436-46.
102. Herrington WG, Staplin N, Wanner C, et al. Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2023; 388(2):117-27. doi:10.1056/NEJMoa2204233.
103. Nuffield Department of Population Health Renal Studies Group; SGLT2 inhibitor Meta-Analysis Cardio-Renal Trialists' Consortium. Impact of diabetes on the effects of sodium glucose cotransporter-2 inhibitors on kidney outcomes: collaborative meta-analysis of large placebo-controlled trials. Lancet. 2022; 400(10365):1788-801. doi:10.1016/S0140-6736(22)02074-8.
104. Tsai WC, Hsu SP, Chiu YL, et al. Cardiovascular and renal efficacy and safety of sodium-glucose cotransporter-2 inhibitors in patients without diabetes: a systematic review and meta-analysis of randomised placebo-controlled trials. BMJ Open. 2022;12(10):e060655. doi:10.1136/bmjopen-2021-060655.
105. Pitt B, Filippatos G, Agarwal R, et al.; FIGARO-DKD Investigators. Cardiovascular events with finerenone in kidney disease and type 2 diabetes. N Engl J Med. 2021;385:2252-63.
106. Agarwal R, Filippatos G, Pitt B, et al.; FIDELIO-DKD and FIGARO-DKD investigators. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022;43:474-84.
107. Rossing P, Anker SD, Filippatos G, et al.; FIDELIO-DKD and FIGARO-DKD Investigators. Finerenone in Patients With Chronic Kidney Disease and Type 2 Diabetes by Sodium–Glucose Cotransporter 2 Inhibitor Treatment: The FIDELITY Analysis. Diabetes Care. 2022;45:2991-8. doi:10.2337/dc22-0294.
108. Agarwal R, Fouque D. The foundation and the four pillars of treatment for cardiorenal protection in people with chronic kidney disease and type 2 diabetes. Nephrol Dial Transplant. 2023; 38(2):253-7. doi:10.1093/ndt/gfac331.
109. Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: executive summary: a report of the American College of Cardiology/American Heart Association Task Force on clinical practice guidelines. Hypertension. 2018;71:1269-324.
110. Xie X, Liu Y, Perkovic V, et al. Renin-Angiotensin System Inhibitors and Kidney and Cardiovascular Outcomes in Patients With CKD: A Bayesian Network Meta-analysis of Randomized Clinical Trials. Am J Kidney Dis. 2016;67(5):728-41. doi:10.1053/j.ajkd.2015. 10.011.
111. Huang RS, Cheng YM, Zeng XX, et al. Renoprotective Effect of the Combination of Renin-angiotensin System Inhibitor and Calcium Channel Blocker in Patients with Hypertension and Chronic Kidney Disease. Chin Med J (Engl). 2016;129(5):562-9. doi:10.4103/0366-6999.176987.
112. The ACCORD Study Group. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med. 2010;362:1575-85.
113. Beddhu S, Chertow GM, Greene T, et al. Effects of intensive systolic blood pressure lowering on cardiovascular events and mortality in patients with type 2 diabetes mellitus on standard glycemic control and in those without diabetes mellitus: reconciling results From ACCORD BP and SPRINT. J Am Heart Assoc. 2018;7(18):e9326. doi:10.1161/JAHA.118.009326.
114. Sarafidis PA, Blacklock R, Wood E, et al. Prevalence and factors associated with hyperkalemia in predialysis patients followed in a low-clearance clinic. Clin J Am SocNephrol. 2012;7:1234-41.
115. Sarafidis PA, Georgianos PI, Bakris GL. Advances in treatment of hyperkalemia in chronic kidney disease. Expert OpinPharmacother. 2015;16:2205-15.
116. Baigent C, Landray MJ, Reith C, et al.; SHARP Investigators. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomized placebo-controlled trial. Lancet. 2011;377:2181-92.
117. Herrington WG, Emberson J, Mihaylova B, et al. Impact of renal function on the effects of LDL cholesterol lowering with statin-based regimens: a meta-analysis of individual participant data from 28 randomised trials. Lancet Diabetes Endocrinol. 2016; 4:829-39.
118. Barylski M, Nikfar S, Mikhailidis DP, et al.; Lipid and Blood Pressure Meta Analysis Collaboration Group. Statins decrease all-cause mortality only in CKD patients not requiring dialysis therapy — a meta-analysis of 11 randomized controlled trials involving 21,295 participants. Pharmacol Res. 2013;72:35-44.
119. Charytan DM, Sabatine MS, Pedersen TR, et al.; FOURIER Steering Committee and Investigators. Efficacy and Safety of Evolocumab in Chronic Kidney Disease in the FOURIER Trial. J Am CollCardiol. 2019;73:2961-70.
120. Wanner C, Tonelli M, Kidney Disease: Improving Global Outcomes Lipid Guideline Development Work Group Members. KDIGO Clinical Practice Guideline for Lipid Management in CKD: summary of recommendation statements and clinical approach to the patient. KidneyInt. 2014;85:1303-9.
121. Mach F, Baigent C, Catapano AL, et al.; ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. EurHeart J. 2020;41:111-88.
122. de Boer IH, Khunti K, Sadusky T, et al. Diabetes Management in Chronic Kidney Disease: A Consensus Report by the American Diabetes Association (ADA) and Kidney Disease: Improving Global Outcomes (KDIGO). Diabetes Care. 2022;45(12):3075-90. doi:10.2337/dci22-0027.
123. Giugliano D, Bellastella G, Longo M, et al. Relationship between improvement of glycaemic control and reduction of major cardiovascular events in 15 cardiovascular outcome trials: A meta-analysis with meta-regression. Diabetes Obes Metab. 2020;22:1397-405.
124. Huang HD, Alam M, Hamzeh I, et al. Patients with severe chronic kidney disease benefit from early revascularization after acute coronary syndrome. Int J Cardiol. 2013;168:3741-6. doi:10.1016/j.ijcard.2013.06.013.
125. Szummer K, Lundman P, Jacobson SH, et al. Influence of renal function on the effects of early revascularization in non-ST-elevation myocardial infarction: data from the Swedish Web-System for Enhancement and Development of Evidence-Based Care in Heart Disease Evaluated According to Recommended Therapies (SWEDEHEART). Circulation. 2009;120:851-8. doi:10.1161/circulationaha.108.83816.
126. Szummer K, Lundman P, Jacobson SH, et al. Relation between renal function, presentation, use of therapies and in-hospital complications in acute coronary syndrome: data from the SWEDEHEART register. J Intern Med. 2010;268:40-9. doi:10.1111/j.1365-2796.2009.02204.x.
127. Аверков О. В., Арутюнян Г. К., Дупляков Д. В. и др. Острый инфаркт миокарда без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2024. Российский кардиологический журнал. 2025;30(5):6319. doi:10.15829/1560-4071-2025-6319. EDN CXJUIB.
128. Аверков О. В., Арутюнян Г. К., Дупляков Д. В. и др. Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы. Клинические рекомендации 2024. Российский кардиологический журнал. 2025;30(3):6306. doi:10.15829/1560-4071-2025-6306. EDN IVJCUK.
129. Byrne RA, Rossello X, Coughlan JJ, et al.; ESC Scientific Document Group. 2023 ESC Guidelines for the management of acute coronary syndromes. Eur Heart J. 2023;44(38):3720-3826. doi:10.1093/eurheartj/ehad191. Erratum in: Eur Heart J. 2024; 45(13):1145. doi:10.1093/eurheartj/ehad870.
130. Davenport MS, Perazella MA, Yee J, et al. Use of intravenous iodinated contrast media in patients with kidney disease: consensus statements from the American College of Radiology and the National Kidney Foundation. KidneyMed. 2020;2:85-93. doi:10.1016/j.xkme.2020.01.001.
131. Tsai TT, Patel UD, Chang TI, et al. Contemporary incidence, predictors, and outcomes of acute kidney injury in patients undergoing percutaneous coronary interventions: insights from the NCDR Cath-PCI registry. J Am Coll Card Cardiovasc Interv. 2014;7(1):1-9. doi:10.1016/j.jcin.2013.06.016.
132. Watabe H, Sato A, Hoshi T, et al. Association of contrastinduced acute kidney injury with long-term cardiovascular events in acute coronary syndrome patients with chronic kidney disease undergoing emergent percutaneous coronary intervention. Int J Cardiol. 2014;174(1):57-63.
133. Белопухов В. М., Якупов И. Ф., Айнутдинова И. А., Иванова А. Ю. Нарушения функции почек у больных с инфарктом миокарда и чрескожными коронарными вмешательствами в до– и послеоперационном периоде. Медицинский альманах. 2013;4(28):55-6.
134. Stacul F, Adam A, Becker CR, et al. Strategies to reduсe the risk of contrast — induced nephropathy. Am. J. Cardiol. 2006;98:59-77.
135. Mueller C. Prevention of contrast-induced nephropathy with volume supplementation. Kidney Int. Supplement. 2006;100:16-9.
136. Brar SS, Shen AY, Jorgensen MB, et al. Sodium bicarbonate vs sodium chloride for the prevention of contrast medium-induced nephropathy in patients undergoing coronary angiography: a randomized trial. JAMA. 2008;300(9):1038-46.
137. Кunadian V, Zaman A, Spyridopoulos I, et al. Sodium bicarbonate for the prevention of contrast induced nephronpathy: a meta-analysis of published clinical trials. Eur. J. Radiol. 2011;79:48-55.
138. Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction ofcontrast-induced nephropathy after percutaneous coronary intervention: developmentand initial validation. J Am Coll Cardiol. 2004;44(7):1393-9.
139. Боровкова Н. Ю., Ильина А. С., Спасский А. А. и др. Цитопротективная терапия при почечном повреждении у больных острым инфарктом миокарда с подъемом сегмента ST. Кардиология и сердечно-сосудистая хирургия, 2017:1. doi:10.17116/kardio201710138-41.
140. Сагынбаева Г. А., Калиев Р. Р. Эффективность N-ацетилцистеина и мексидола в профилактике контраст-индуцированной нефропатии у больных коронарной болезнью сердца. Наука, новые технологии и инновации Кыргызстана, 2020:8. doi:10.26104/NNTIK.2019.45.557.
141. Mullens W, Martens P, Testani JM, et al. Renal effects of guideline-directed medical therapies in heart failure: a consensus document from the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2022;24(4):603-19. doi:10.1002/ejhf.2471.
142. Guaricci AI, Sturdà F, Russo R, et al. Assessment and management of heart failure in patients with chronic kidney disease. Heart Fail Rev. 2023. doi:10.1007/s10741-023-10346-x.
143. Галявич А. С., Терещенко С. Н., Ускач Т. М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(11):6162. doi:10.15829/1560-4071-2024-6162. EDN WKIDLJ.
144. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42:3599-726. doi:10.1093/eurheartj/ehab368.
145. Vukadinović D, Lavall D, Vukadinović AN, et al. True rate of mineralocorticoid receptor antagonists related hyperkalemia in placebo-controlled trials: A meta-analysis. Am Heart J. 2017; 188:99-108. doi:10.1016/j.ahj.2017.03.011.
146. Wetmore JB, Yan H, Horne L, et al. Risk of hyperkalemia from reninangiotensin-aldosterone system inhibitors and factors associated with treatment discontinuities in a real-world population. Nephrol Dial Transplant. 2021;36(5):826-39. doi:10.1093/ndt/gfz263.
147. Komajda M, Anker SD, Cowie MR, et al. Physicians’ adherence to guideline-recommended medications in heart failure with reduced ejection fraction: data from the QUALIFY global survey. Eur J Heart Fail. 2016;18(5):514-22. doi:10.1002/ejhf.510.
148. Beldhuis IE, Lam CSP, Testani JM, et al. Evidence-Based Medical Therapy in Patients With Heart Failure With Reduced Ejection Fraction and Chronic Kidney Disease. Circulation. 2022; 145(9):693-712. doi:10.1161/CIRCULATIONAHA.121.052792.
149. Pontremoli R, Borghi C, Perrone Filardi P. Renal protection in chronic heart failure: focus on sacubitril/valsartan. Eur Heart J Cardiovasc Pharmacother. 2021;7(5):445-52. doi:10.1093/ehjcvp/pvab030.
150. Banerjee D, Rosano G, Herzog CA. Management of heart failure patient with CKD. Clin J Am Soc Nephrol. 2021;16(7):1131-9. doi:10.2215/CJN.14180920.
151. Bhatt DL, Verma S, Braunwald E. The DAPA-HF Trial: A Momentous Victory in the War against Heart Failure. Cell Metab. 2019; 30(5):847-9. doi:10.1016/j.cmet.2019.10.008.
152. Ferreira JP, Zannad F, Pocock SJ, et al. Interplay of Mineralocorticoid Receptor Antagonists and Empagliflozin in Heart Failure: EMPEROR-Reduced. J Am Coll Cardiol. 2021;77(11):1397-407. doi:10.1016/j.jacc.2021.01.044.
153. Pardo-Martínez P, Barge-Caballero E, Bouzas-Mosquera A, et al. Real world comparison of spironolactone and eplerenone in patients with heart failure. Eur J Intern Med. 2022;97:86-94. doi:10.1016/j.ejim.2021.12.027.
154. Жиров И. В., Сафронова Н. В., Терещенко С. Н. Антагонисты минералокортикоидных рецепторов у пациентов с хронической сердечной недостаточностью: мифы и реальность. РМЖ. 2024;6:9-14.
155. Hindricks G, Potpara T, Dagres N, et al. ESC Scientific Document Group. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. European Heart Journal. 2021;42(5):373-498.
Об авторах
О. М. ДрапкинаРоссия
Академик РАН, профессор, д.м.н., директор ФГБУ "НМИЦ ТПМ" Минздрава России.
Москва
Ж. Д. Кобалава
Россия
Член-корр. РАН, профессор, д.м.н., зав. кафедрой внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В. С. Моисеева Медицинского института.
Москва
М. В. Шестакова
Россия
Академик РАН, профессор, д.м.н., зам. директора — директор Института диабета, зав. кафедрой диабетологии и диетологии Института высшего и дополнительного профессионального образования ГНЦ РФ ФГБУ "НМИЦ эндокринологии" Минздрава России.
Москва
И. Н. Бобкова
Россия
Профессор, д.м.н., профессор кафедры внутренних, профессиональных болезней и ревматологии.
Москва
М. А. Ефремовцева
Россия
Доцент, д.м.н., профессор кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В. С. Моисеева Медицинского института.
Москва
С. В. Виллевальде
Россия
Профессор, д.м.н., начальник службы анализа и перспективного планирования Управления по реализации федеральных проектов, зав. кафедрой кардиологии факультета послевузовского и дополнительного образования.
Санкт-Петербург
М. М. Батюшин
Россия
Профессор, д.м.н., профессор кафедры внутренних болезней № 2, нефролог-консультант клиники.
Ростов-на-Дону
Ю. Н. Беленков
Россия
Академик РАН, профессор, д.м.н., директор клиники госпитальной терапии им. А. А. Остроумова, зав. кафедрой госпитальной терапии № 1 лечебного факультета.
Москва
А. В. Ватазин
Россия
Профессор, д.м.н., руководитель хирургического отделения трансплантации почки, зав. кафедрой трансплантологии, нефрологии и искусственных органов.
Москва
А. С. Галявич
Россия
Академик Академии наук Республики Татарстан, профессор, д.м.н., профессор, зав. кафедрой кардиологии.
Казань
М. В. Ежов
Россия
Доцент, д.м.н., г.н.с., руководитель лаборатории нарушений липидного обмена, отдел проблем атеросклероза, "Институт клинической кардиологии им. А. Л. Мясникова".
Москва
Н. Л. Козловская
Россия
Профессор, д.м.н., профессор кафедры внутренних болезней с курсом кардиологии и функциональной диагностики им. акад. В. С. Моисеева Медицинского института РУДН им. Патриса Лумумбы, руководитель центра помощи беременным женщинам с патологией почек и мочевыводящих путей ГБУЗ "Городская клиническая больница им. А. К. Ерамишанцева" ДЗМ.
Москва
О. Н. Котенко
Россия
д.м.н., руководитель.
Москва
Ю. В. Котовская
Россия
Профессор, д.м.н., зам. директора по научной работе ОСП Российский геронтологический научно-клинический центр.
Москва
Л. В. Лысенко
Россия
Профессор, д.м.н., профессор кафедры внутренних, профессиональных болезней и ревматологии.
Москва
С. В. Моисеев
Россия
Профессор, д.м.н., зав. кафедрой внутренних, профессиональных болезней и ревматологии, директор клиники им. Е. М. Тареева.
Москва
С. В. Недогода
Россия
Профессор, д.м.н., зав. кафедрой внутренних болезней Института непрерывного медицинского и фармацевтического образования.
Волгоград
С. Н. Терещенко
Россия
Профессор, д.м.н., руководитель отдела заболевания миокарда и сердечной недостаточности, г.н.с.
Москва
О. Н. Ткачева
Россия
Член-корр. РАН, профессор, д.м.н., директор ОСП "Российский геронтологический научно-клинический центр".
Москва
В. В. Фомин
Россия
Академик РАН, профессор, д.м.н., проректор по клинической работе и ДПО, зав. кафедрой факультетской терапии № 1.
Москва
И. Е. Чазова
Академик РАН, профессор, д.м.н., зам. генерального директора по научно-экспертной работе, руководитель отдела гипертонии, "НИИ клинической кардиологии им. А. Л. Мясникова".
Москва
А. И. Чесникова
Россия
Профессор, д.м.н., профессор кафедры внутренних болезней № 1.
Ростов-на-Дону
М. Ш. Шамхалова
Россия
д.м.н., зав. отделением диабетической болезни почек и посттрансплантационной реабилитации.
Москва
Е. М. Шилов
Россия
Профессор, д.м.н., профессор кафедры внутренних, профессиональных болезней и ревматологии ФГАОУ ВО "Первый МГМУ им. И. М. Сеченова" Минздрава России (Сеченовский университет), главный внештатный специалист нефролог Минздрава России.
Москва
А. М. Шутов
Россия
Профессор, д.м.н., зав. кафедрой терапии и профессиональных болезней медицинского факультета им. Т. З. Биктимирова, Института медицины, экологии и физической культуры.
Ульяновск
Рецензия
Для цитирования:
Драпкина О.М., Кобалава Ж.Д., Шестакова М.В., Бобкова И.Н., Ефремовцева М.А., Виллевальде С.В., Батюшин М.М., Беленков Ю.Н., Ватазин А.В., Галявич А.С., Ежов М.В., Козловская Н.Л., Котенко О.Н., Котовская Ю.В., Лысенко Л.В., Моисеев С.В., Недогода С.В., Терещенко С.Н., Ткачева О.Н., Фомин В.В., Чазова И.Е., Чесникова А.И., Шамхалова М.Ш., Шилов Е.М., Шутов А.М. Сердечно-сосудистый риск и хроническая болезнь почек: стратегии кардионефропротекции. Междисциплинарный консенсус. Кардиоваскулярная терапия и профилактика. 2025;24(6):4466. https://doi.org/10.15829/1728-8800-2025-4466. EDN: MIARUF
For citation:
Drapkina O.M., Kobalava Zh.D., Shestakova M.V., Bobkova I.N., Efremovtseva M.A., Villevalde S.V., Batyushin M.M., Belenkov Yu.N., Vatazin A.S., Galyavich A.S., Yezhov M.V., Kozlovskaya N.L., Kotenko O.N., Kotovskaya Yu.V., Lysenko L.V., Moiseyev S.V., Nedogoda S.V., Tereshchenko S.N., Tkacheva O.N., Fomin V.V., Chazova I.E., Chesnikova A.I., Shamkhalova M.Sh., Shilov E.M., Shutov A.M. Cardiovascular risk and chronic kidney disease: strategies for cardiac and renal protection. Interdisciplinary consensus. Cardiovascular Therapy and Prevention. 2025;24(6):4466. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4466. EDN: MIARUF
JATS XML

























































