Перейти к:
Диагностика артериальной жесткости с помощью сердечно-лодыжечного сосудистого индекса. Согласованное мнение экспертов
https://doi.org/10.15829/1728-8800-2025-4481
EDN: FDECVC
Аннотация
Артериальная жесткость, измеряемая с помощью скорости пульсовой волны на каротидно-феморальном сегменте, является независимым предиктором сердечно-сосудистой смертности и рекомендована в качестве эталонного стандарта. Определение сердечно-лодыжечного индекса является простым, хорошо стандартизированным, точным и воспроизводимым методом оценки артериальной жесткости, не зависящим от уровня артериального давления во время измерения. Цель настоящего документа — анализ и систематизация новых фактических данных, разработка экспертного мнения о значимости диагностики артериальной жесткости и применении сердечно-лодыжечного индекса.
Ключевые слова
Для цитирования:
Подзолков В.И., Сафронова Т.А., Васюк Ю.А., Котовская Ю.В., Кисляк О.А., Стародубова А.В., Копылов Ф.Ю., Евсевьева М.Е., Сумин А.Н., Тарзиманова А.И., Остроумова О.Д., Ларина В.Н., Павлова О.С., Иванова С.В., Чулков В.С., Беставашвили А.А., Кочетков А.И., Лискова Ю.В., Лузина А.В., Покровская А.Е., Сергеева О.В., Шупенина Е.Ю., Брагина А.Е. Диагностика артериальной жесткости с помощью сердечно-лодыжечного сосудистого индекса. Согласованное мнение экспертов. Кардиоваскулярная терапия и профилактика. 2025;24(8):4481. https://doi.org/10.15829/1728-8800-2025-4481. EDN: FDECVC
For citation:
Podzolkov V.I., Safronova T.A., Vasyuk Yu.A., Kotovskaya Yu.V., Kislyak O.A., Starodubova A.V., Kopylov F.Yu., Evsevieva M.E., Sumin A.N., Tarzimanova A.I., Ostroumova O.D., Larina V.N., Pavlova O.S., Ivanova S.V., Chulkov V.S., Bestavashvili A.A., Kochetkov A.I., Liskova Yu.V., Luzina A.V., Pokrovskaya A.E., Sergeeva O.V., Shupenina E.Yu., Bragina A.E. Diagnosis of arterial stiffness using the cardio-ankle vascular index. Expert consensus. Cardiovascular Therapy and Prevention. 2025;24(8):4481. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4481. EDN: FDECVC
Жесткость артериальной стенки с возрастом увеличивает скорость пульсовой волны (СПВ), измерение которой является надежным инструментом для прогнозирования сердечно-сосудистых заболеваний (ССЗ) [1]. Старение — естественный процесс, сопровождающий жизнь всех организмов, включая человека. Оно характеризуется постепенным снижением функциональной активности сердечно-сосудистой и других систем организма. Возрастные изменения сосудов включают структурные и функциональные трансформации сосудистой стенки. Структурные изменения, известные как артериолосклероз, могут способствовать развитию ССЗ: артериальной гипертензии (АГ), атеросклероза и ишемического инсульта [2].
Индивидуальные различия в биологическом возрасте артерий значительно варьируются даже при одинаковом хронологическом возрасте из-за генетических факторов, условий окружающей среды и образа жизни [3]. Изучение этих процессов легло в основу концепции "сосудистого старения".
Для оценки жесткости артериальной стенки в основном используются два метода. Один из них основан на измерении изменения диаметра артериального сосуда при определенном давлении. Второй, более распространенный метод, измеряет СПВ по крупным сосудам [4]. Более жесткие артерии характеризуются более высокой СПВ. Большинство исследований, изучающих роль артериальной ригидности в патофизиологии кровообращения, фокусируются на измерении СПВ, особенно в аорте [5][6].
В 2022г медицинскому сообществу были представлены сразу два документа, посвященных жесткости сосудистой стенки: в США опубликован "Экспертный консенсус в отношении применения сердечно-лодыжечного сосудистого индекса" (Clinical Applications Measuring Arterial Stiffness: An Expert Consensus for the Application of Cardio-Ankle Vascular Index) [7] и второй документ "Консенсус экспертов по клиническому использованию скорости распространения пульсовой волны в Азии" (Expert Consensus on the Clinical Use of Pulse Wave Velocity in Asia) [8]. Эксперты были единодушны в мнении, что артериальная жесткость — это не только маркер субклинического поражения органов-мишеней, но и важный независимый предиктор смертности и заболеваемости от ССЗ. Измерение СПВ представляет собой неинвазивный и надежный инструмент для оценки жесткости артерий. Согласно последним рекомендациям Европейского общества по гипертонии (ESH) 2023г, измерение артериальной жёсткости с помощью СПВ включено в перечень базовых скрининговых тестов для оценки повреждений органов-мишеней. В клинических рекомендациях Российского кардиологического общества (РКО) и Российского научного медицинского общества терапевтов (РНМОТ) 2024г "Артериальная гипертензия у взрослых" упоминаются каротидно-феморальная СПВ (кфСПВ) >10 м/с и лодыжечно-плечевой индекс (ЛПИ) <0,9 в ранних субклинических поражениях сосудов. Однако не описано, какие методы и оборудование могут быть использованы для определения этих показателей.
В 2024г была опубликована позиция международной экспертной группы "Измерение артериального давления и оценка структуры и функции артерий: документ с изложением позиции экспертной группы" (Blood pressure measurement and assessment of arterial structure and function: an expert group position paper) [2]. В документе подчеркивается, что в контексте сердечно-сосудистой системы, только СПВ, измеренная на участке, включающем аорту, является ключевым индикатором риска ССЗ.
В настоящее время существуют различия в методах измерения СПВ. В Европе предпочитают кфСПВ [9]. Напротив, в Азии предпочтение отдается плече-лодыжечной СПВ (baPWV) [10] или сердечно-лодыжечному сосудистому индексу (cardio-ankle vascular index, CAVI) [11]. Повышенные значения кфСПВ и baPWV демонстрируют независимую связь с риском сердечно-сосудистых событий (ССС), что подтверждается результатами многочисленных исследований [2]. Исследования кфСПВ проводились преимущественно в западных странах с использованием таких устройств, как Complior и SphygmoCor CVMS. Complior и SphygmoCor CVMS регистрируют пульсовую волну на сонной и бедренной артериях, либо одновременно (Complior), либо последовательно (SphygmoCor CVMS). Однако данные устройства требуют высокой квалификации оператора для обеспечения точности измерений. Даже в версии SphygmoCor XCEL измерение пульсовой волны на сонной артерии остаётся ручным процессом. Таким образом, практическое применение этих устройств ограничено рядом факторов, включая отсутствие необходимого оборудования в настоящее время в нашей стране, социально-экономические условия в отдельных медицинских учреждениях и т.д. В отличие от предыдущих приборов Vasera 1500 и 2000 являются простыми, быстрыми и удобными устройствами для измерения сердечно-лодыжечной СПВ — CAVI отражает жесткость артериального русла от устья аорты до лодыжки.
В Российской Федерации документ, описывающий различные способы определения артериальной жесткости, был создан экспертной группой в 2016г [12], однако с тех пор было проведено большое количество исследований в этой области. Цель настоящего документа — анализ и систематизация новых фактических данных, разработка экспертного мнения о значимости диагностики артериальной жесткости и применении CAVI.
Методика определения CAVI. Преимущества метода по сравнению с другими исследованиями сосудистой жесткости. Нормальные значения CAVI
Артериальная жесткость, измеряемая с помощью кфСПВ, является независимым предиктором сердечно-сосудистой смертности и рекомендована в качестве эталонного стандарта [13]. Однако она не получила широкого распространения в повседневной клинической практике, поскольку получение точной формы волны с помощью этой процедуры несколько затруднено зависимостью от оператора и сопряжено с определенными техническими сложностям [11]. Технически более простой подход к измерению артериальной жесткости представляет собой использование манжет, в частности на плече и лодыжке с определением СПВ на плече-лодыжечном сегменте, что значительно упрощает процедуру [14]. Необходимо напомнить, что основным ограничением использования СПВ на любом сегменте является ее зависимость от давления, оказываемого на артериальную стенку кровью. Было продемонстрировано, что СПВ увеличивается с ростом нагрузки давлением без каких-либо структурных изменений самой сосудистой стенки [15]. Учитывая вышеизложенные проблемы, в качестве более прямого измерения артериальной жесткости был предложен CAVI, обеспечивающий оценку артериальной жесткости "независимую от давления" во время измерения [16]. CAVI — маркер артериальной жесткости, измеряемый от начала аорты до артерий лодыжки, был разработан в Японии в 2004г. Он был получен путем объединения двух индексов: параметра жесткости β, впервые предложенного Hayashi K, et al. [17], и формулы Брамвелла-Хилла [18], которая представляет собой связь СПВ с изменением сосудистого объема (рисунок 1). Итоговое уравнение его определения:
CAVI = a{(2ρ ÷ ∆P) × ln(Ps ÷ Pd) × PWV2} + b,
где a и b — константы [19]; ρ — плотность крови (фиксированная на уровне 1,05); а ∆P — это Ps–Pd [14]. Данное уравнение отражает глобальную жесткость аорты, бедренных артерий и большеберцовой артерии. Поскольку параметр жесткости β представляет собой логарифмическое изменение артериального давления (АД), необходимого для увеличения диаметра артерии, он не зависит от уровня АД во время измерения, то и CAVI в целом перенял этот принцип. Независимость данного показателя от АД была продемонстрирована экспериментальными фармакологическими исследованиями с введением селективного β-блокатора — метопролола, приведшего к значительному снижению систолического АД (САД) и baPWV, тогда как CAVI не изменился [20]. При введении блокатора рецепторов α1-доксазозина CAVI снижался по мере снижения АД, которое было обусловлено снижением тонуса гладких мышц сосудов. Эти результаты свидетельствует, что CAVI отражает артериальную жесткость, обусловленную как тонусом гладкомышечных клеток, так и органическими компонентами артериосклероза (кальцификация, изменение соотношения коллагена и эластина) [21].
На практике получение информации необходимой для расчета CAVI, включая baPWV, САД и диастолическое АД (ДАД), запись и анализ пульсовых волн на 4-х конечностях осуществляется с использованием сфигмоманжет, электрокардиографии и фонографии сердца. Данная методика успешно реализована в автоматизированной системе сердечно-сосудистого скрининга VaSera VS-Series (Fukuda Denshi, Япония). Уникальной особенностью этого оборудования является то, что кроме CAVI, оно одновременно регистрирует АД в четырех точках, таким образом, позволяя определить ЛПИ. Этот индекс имеет решающее значение для подтверждения нормального кровотока на подвздошно-лодыжечном сегменте [22], и обеспечения правильного использования СПВ, которая становится недействительной, если ЛПИ <0,9 (т.е. фактически при наличии стеноокклюзирующих заболеваний артерий нижних конечностей). Использование дополнительных пальцевых манжет с одновременной оценкой АД на пальцах ног дает возможность получения пальце-плечевого индекса (ППИ), который на ряду с ЛПИ позволяет на ранних этапах выявлять поражение периферических артерий [22]. Кроме того, в приборе дополнительно заложена методика расчета сосудистого возраста — биологического маркера раннего старения и выражения сердечно-сосудистого риска (ССР) в годах.
Первые данные о пользе CAVI в оценке и прогнозировании исходов ССЗ были получены в результате исследований популяции стран Азии. А долгосрочные исследования в США и Европе с использованием данной методики отсутствовали, что поначалу в некоторой степени ограничивало ее клиническое применение [23]. В настоящее время опубликованы многочисленные данные, полученные китайскими, корейскими, таиландскими, американскими, европейскими и российскими исследователями, подтверждающие диагностическую и прогностическую значимость CAVI.
Безусловным преимуществом данного метода является его абстрагированность от текущего АД пациента, хорошая воспроизводимость, простота и быстрота получения результата (среднее время необходимое для получения измерений составляет 4-5 мин). В настоящее время более 20000 единиц VaSera, оборудования, используемого для измерения CAVI, используются в клинической практике по всему миру [19]. На территории Российской Федерации, по данным производителя, используется порядка 200 приборов VaSera.
В качестве пороговых предложены значения CAVI 8,0 и 9,0: <8 — норма, ≥8 и <9 — пограничные значения, ≥9 — патологические значения (рисунок 2) [24]. Согласно экспертному консенсусу Комитета по сосудистой недостаточности Японского общества сосудистой недостаточности, пациентов с пограничным значением CAVI необходимо лечить как пациентов с субклиническим поражением органов-мишеней [24]. Значение CAVI ≥9,0 позволяет прогнозировать пациентов с высоким риском ССС. При выявлении у пациента ненормального значения CAVI рекомендована инициация активной оценки состояния и лечение поражения органов-мишеней и/или сердечно-сосудистых осложнений (ССО).
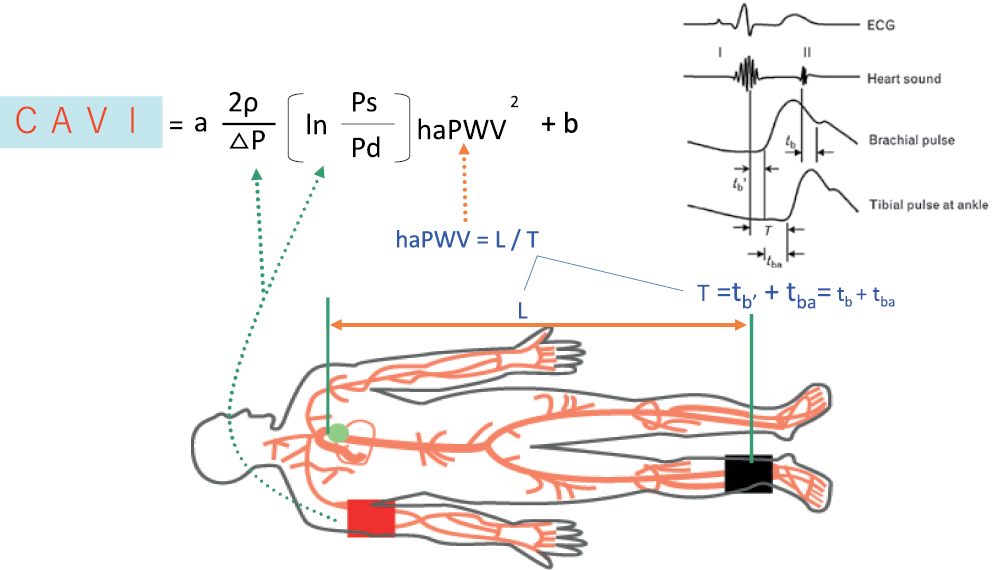
Рис. 1 Определение CAVI.
Примечание: Ps — систолическое артериальное давление плечевой артерии, Pd — диастолическое артериальное давление, haPWV — СПВ от начала аорты до лодыжки при среднем давлении ∆P, Ps–Pd, ρ — плотность крови, a и b — константы преобразования, T — время импульса от аортального клапана до лодыжки, L — длина артериального дерева от начала аорты до лодыжки. Адаптировано из [8].

Рис. 2 Пороговые значения для CAVI. Адаптировано из [24].
CAVI признан суррогатным маркером артериосклероза и увеличивается с возрастом, показывая высокую ценность при старении и различных ССЗ [11]. Продемонстрирована взаимосвязь CAVI с АГ [25][26], метаболическим синдром [27][28], поражением органов-мишеней: массой миокарда левого желудочка (ЛЖ) [29], объемом левого предсердия и его функцией по данным эхокардиографии со спекл-трекингом [30], показателями диастолической дисфункции ЛЖ [31], скоростью клубочковой фильтрации (СКФ) и микроальбуминурией [32], когнитивными нарушениями (КН) и эпизодами деменции [33][34]. Применение блокаторов кальциевых каналов, ингибиторов ренин-ангиотензин-альдостероновой системы (РААС), включая блокаторы рецепторов ангиотензина, ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы минералокортикоидных рецепторов, прямые ингибиторы ренина может улучшить CAVI [11]. Уменьшение артериальной жесткости в ответ на антигипертензивное лечение связывают не столько со снижением АД, сколько с дополнительными эффектами на сосудистую стенку, напрямую независящими от АД. Лекарственные препараты, снижающие уровень триглицеридов, также снижают CAVI [13]. Высокий CAVI наблюдается и у пациентов с сахарным диабетом (СД) 2 типа [23, 35], а его изменение на фоне сахароснижающей терапии во многом зависит от класса принимаемого лекарственного препарата [34]. CAVI повышен у курильщиков и снижается при отказе от курения, повышен у пациентов с синдромом апноэ во сне и снижается после лечения постоянным положительным давлением в дыхательных путях [11].
Повышенный CAVI >8,9 может являться маркером коронарного атеросклероза [37]. У пациентов с ишемической болезнью сердца (ИБС) продемонстрирована связь между изменениями CAVI и уровнем коронарного кальция [35], частотой долгосрочных ССС [38], а также частотой нефатального ишемического инсульта [39] после коронарного вмешательства.
В общей популяции продемонстрирована связь CAVI с будущими ССС, такими как инфаркт миокарда (ИМ), аортокоронарное шунтирование, ангиопластика и инсульт [14]. У пациентов с умеренным или высоким ССР CAVI значительно был связан с сердечно-сосудистой смертью, инсультом, смертностью от всех причин и госпитализацией по поводу сердечной недостаточности (СН) [40]. В российских исследованиях также была продемонстрирована целесообразность использования CAVI как в группах пациентов высокого риска [41, 42], так и в популяционных программах по материалам исследования ЭССЕ-РФ [43].
Сосудистое старение и CAVI. Синдромы EVA и Supernova
Оценка сосудистой жёсткости как главной детерминанты сосудистого старения с помощью CAVI применяется всё шире как с научной, так и клинической целью [7, 11]. Обоснованием к более широкому использованию CAVI служат результаты выполненных проспективных исследований, демонстрирующих наличие солидного прогностического потенциала у этого показателя. По результатам некоторых из этих исследований сообщалось, например, о связи более высокого CAVI со снижением функции почек и нарушением когнитивных функций [32, 34].
В когортном исследовании общей популяции, в котором приняли участие 7249 человек, увеличение CAVI на 1 единицу было связано с будущими ССС, такими как ИМ, аортокоронарное шунтирование, ангиопластика и инсульт, в рамках коэффициента риска 1,70 [15]. Также сообщалось о связи между величиной CAVI и прогнозом у лиц с умеренным и высоким риском ССЗ. На группе из 400 пациентов с ССР продемонстрировано, что у пациентов с повышенным CAVI (≥10) была более высокая частота ССС с коэффициентом риска 2,25 по сравнению с пациентами с низким CAVI (<9,0) [44]. Недавно многоцентровое проспективное когортное исследование, в котором приняли участие 2932 пациента с умеренным или высоким риском ССЗ, показало, что более низкие значения CAVI ассоциированы с менее значительным риском смерти от ССЗ, инсульта, смертности от всех причин и СН с госпитализацией [40] в анамнезе. В другом исследовании оценивалась связь между изменениями CAVI после вмешательства и частотой долгосрочных ССО у пациентов с ИБС [38]. Исследование показало, что частота развития долгосрочных ССЗ была значительно выше в группе без изменений показателя CAVI на фоне лечения по сравнению с группой лиц, у которых регистрировалось улучшение указанного параметра под влиянием терапевтического вмешательства. Метаанализ четырёх проспективных исследований, в которых приняли участие 5214 человек, показал, что скорректированный коэффициент риска ССЗ при увеличении CAVI на 1 стандартное отклонение составил 1,20 (95% доверительный интервал (ДИ): 1,05-1,36) [11]. Таким образом, уже доказана эффективность CAVI в качестве прогностического ФР ССЗ как в общей популяции, так и у пациентов с ФР атеросклероза или ССЗ. Продемонстрировано также наличие прогностических возможностей у показателя CAVI в отношении развития постковидного синдрома [45, 46].
Оказалось также, что показатели артериальной жесткости, включая CAVI, были менее сильно связаны с сердечно-сосудистыми исходами у пожилых людей по сравнению с более молодыми группами населения [47, 48]. Это говорит о том, что оценка CAVI особенно полезна у молодых людей потому, что повышенная артериальная жесткость, выявленная на относительно ранней стадии, может быть связана с преждевременным сосудистым старением в виде синдрома EVA (early vascular aging) и может предрасполагать в дальнейшем к раннему развитию основных ССЗ. Но следует помнить, что указанный синдром EVA у молодёжи следует дифференцировать с проявлением той или иной генетически детерминированной дисфункции соединительной ткани по типу дисплазии, которая всё чаще встречается у современных молодых людей [49].
По этой причине ряд авторов проводит целенаправленное изучение лиц молодого возраста [50, 51] на предмет оценки их артериальной жёсткости как главной детерминанты сосудистого старения и особенностей её связи с основными ФР [52]. Некоторые эксперты выступили недавно со своеобразным призывом к коллегам всего мира срочно объединить усилия и активизировать внедрение системы, нацеленной на массовый скрининг синдрома EVA среди молодёжи с целью его своевременной коррекции в рамках ранней первичной профилактики основных ССЗ [53]. Эксперты считают, что такой подход открывает новые перспективы в борьбе с этими заболеваниями. Уже разработаны референсные значения показателя CAVI для лиц молодого и активного возраста [54]. Определены количественные параметры фенотипов здорового, обычного и раннего сосудистого старения у молодёжи [55] на базе результатов терцильного анализа однородной молодёжной выборки с учетом пола с целью поиска оптимальных путей для проведения массового инструментального скрининга сосудистой жесткости у студенческой молодёжи. Оценка принадлежности к тому или иному фенотипу сосудистого старения представляется весьма перспективной технологией, позволяющей оптимизировать превентивные вмешательства на доклиническом этапе у молодых лиц с различным профилем угроз [56]. Такой подход хорошо согласуется с набирающей обороты современной концепцией субоптимального здоровья [57, 58], нацеливающей на сохранение имеющихся ресурсов пока ещё здорового или относительно здорового организма, что как раз соответствует параметрам сердечно-сосудистого статуса в молодом возрасте.
Преждевременное сосудистое старение или синдром EVA представляет собой измененную способность накапливать повреждения артерий в ответ на воздействия разнообразных негативных факторов. То есть артериальная жесткость, оцениваемая с помощью различных показателей, включая CAVI, служит интегральным параметром всех возможных повреждений. На современном этапе считается, что жесткость аорты как маркер повреждения артериальной стенки в виде артериосклероза объединяет как влияние ФР, так и восприимчивость к этим факторам и продолжительность их воздействия [59]. При этом цель того или иного вмешательства — перевод носителя с синдромом EVA в группу обычного сосудистого старения, а ещё лучше — в группу здорового старения, в рамках которой эксперты сейчас выделяют лиц с максимально благоприятным или супернормальным старением (SUPERNOVA) [60]. Счастливые носители такого сосудистого фенотипа отличаются очень низкими значениями артериальной жесткости даже в присутствии ФР по причине наличия у таких лиц особых защитных механизмов, которые сейчас начинают интенсивно изучаться [61].
Проявление крайних сосудистых фенотипов — EVA или SUPERNOVA — является продуктом взаимодействия между структурными изменениями артериальной стенки, которые обычно связаны с возрастом, и механизмами, которые ускоряют или замедляют этот процесс, соответственно [62]. Расшифровка этих механизмов позволит в дальнейшем формировать комплексные программы эффективного управления сосудистым старением на различных этапах сердечно-сосудистого патогенетического континуума, начиная с внутриутробного периода жизни будущего ребёнка и его мамы в период беременности [63].
Пожилой возраст и артериальная жесткость
Влияние возраста
Возраст является одним из основных факторов, определяющих сосудистую жесткость. Старение связано с повышением жёсткости артерий из-за увеличения количества коллагена и уменьшения количества эластина, большей выраженности субклинического воспаления и окислительного стресса [64]. Артериальная жесткость является наиболее доступным биомаркером биологического возраста человека, что определяет особый интерес к ее определению как у людей молодого и среднего возраста для выделения групп с ускоренным сосудистым старением и высокого ССР, так и в пожилом возрасте для выявления более "биологически старых" пациентов с высоким риском гериатрических проблем [65].
Клиническое значение артериальной жесткости у пациентов пожилого возраста
Популяция людей пожилого и старческого возраста неоднородна. Прогноз для жизни и здоровья в этой категории определяется не только наличием хронических заболеваний, но и наличием гериатрических синдромов. Старческая астения (СА) как основной гериатрический синдром связана с повышенным риском неблагоприятных последствий [66], таких как падения, снижение мобильности, функциональной независимости, когнитивных функций, развития мальнутриции и саркопении, инвалидности и смерти [67][68].
Наибольшая распространённость СА наблюдается среди пожилых пациентов с ССЗ, и была предложена двусторонняя связь между этими двумя клиническими состояниями. Клеточные и молекулярные ФР развития и прогрессирования ССЗ, такие как воспаление, окислительный стресс и метаболическая дисфункция, также связаны с развитием и прогрессированием СА [69]. Связь между СА и жёсткостью артерий продемонстрирована в многочисленных исследованиях [70]. Например, в поперечном исследовании с участием 2171 человека в возрасте 60 лет и старше было отмечено, что жёсткость артерий тесно связана с развитием преастении и СА [71]. В исследовании на китайской популяции с включением 171 пациента в возрасте от 60 до 96 лет были выявлены обратные линейные корреляции между жёсткостью артерий, измеренной с помощью CAVI, и признаками СА, такими как сила сжатия кисти и скорость ходьбы. CAVI представлен как независимый ФР развития СА (отношение шансов (ОШ): 2,013, 95% ДИ: 1,498-2,703, p<0,001) [72].
При анализе взаимосвязей артериальной жесткости, оцененной по CAVI, в исследовании, проведенном в Российском геронтологическом научно-клиническом центре Пироговского университета с включением 160 пациентов в возрасте от 60 до 101 года, были выявлены значимые различия CAVI между группами пациентов с СА и без (10,3±1,6 vs 9,3±1,0, соответственно; р=0,002) [73].
Гемодинамические изменения вследствие повышения артериальной жесткости приводят к изменению кровоснабжения мышц, развитию саркопении с повышением риска нарушения физического функционирования и развития СА [12, 74]. При оценке взаимосвязи между CAVI и показателями физического функционирования было выявлено, что в группе пациентов с преастенией отрицательные взаимосвязи выявлены с силой сжатия кисти, индексом массы тела (ИМТ) и физической активности (Rs=-0,329 (р=0,019), Rs=-0,343 (р=0,015) и Rs=-0,285 (р=0,047), соответственно). У пациентов с СА обратные корреляции выявлены с ИМТ Rs=-0,393 (р=0,002) и прямые с ортостатической гипотензией Rs=0,382 (р=0,003). В общей группе пациентов выявлены отрицательные взаимосвязи CAVI со скоростью ходьбы и временем теста "Встань и иди" (r=-0,311 (р=0,0001) и r=0,293 (р=0,0003), соответственно), с количеством баллов по краткой шкале оценки статуса питания (r=-0,244 (р=0,003)) [73]. Эти данные указывают на патофизиологические механизмы взаимосвязи жесткости артериальной стенки и риском гериатрических синдромов — саркопении, недостаточности питания, СА.
Известно, что как потеря массы скелетных мышц, так и жесткость артерий прогрессируют с возрастом, и что в развитии этих двух процессов лежат единые предрасполагающие факторы и механизмы [75]. Предполагают, что кровоснабжение мышц уменьшается с возрастом и что это связано со степенью выраженности жесткости артериальной стенки [76]. При анализе взаимосвязи между саркопенией (включая массу скелетных мышц, мышечную силу и физическую работоспособность) и СПВ как маркером жесткости артериальной стенки было выявлено, что низкая мышечная масса и сила сжатия кисти отрицательно коррелировали с СПВ (t=-5,807, p=0,000 и t=-3,085, p=0,002) [77].
Взаимосвязь жесткости артериальной стенки с падениями была продемонстрирована в исследовании Turusheva A, et al. В исследовании 163 человек в возрасте от 60 до 89 лет показатель CAVI возрастал с возрастом и был выше у мужчин. CAVI был связан с травмами, полученными в результате падений, даже после поправки на возраст, пол, приём β-адреноблокаторов, перенесённый инсульт и регион проживания (ОШ 3,52 (95% ДИ: 1,03-12,04)) [78]. Возможное объяснение этой связи может быть связано с гемодинамической дисфункцией, которая приводит к снижению мышечного кровотока и функционирования, что может способствовать развитию СА, инвалидности и падений [76]. Повышение артериальной жесткости также может быть причиной нарушения поддержания вертикального положения [79] и ФР падений из-за развития ортостатической гипотензии [80].
Жесткость артериальной стенки связана с поражением мелких сосудов головного мозга и, как следствие, с когнитивным снижением. Была выявлена отрицательная взаимосвязь между жесткостью артерий и когнитивным снижением по результатам краткой шкалы оценки психического статуса (КШОПС (MMSE)) β=-0,03, 95% ДИ: -0,06 — -0,01, n=3947 [81]. Объединенный анализ 6 исследований со средней продолжительностью наблюдения 5 лет, участники, как правило, были пожилого возраста и преимущественного женского пола, показал, что более высокая жесткость артериальной стенки ассоциирована со снижением показателей КШОПС. При возрастании жесткости аорта теряет свою амортизирующую способность, повышая пульсовое давление, которое ведет к повреждению мелких церебральных сосудов [82]. Это, в свою очередь, может привести к атрофии мозга и нарушению когнитивной функции. Оценка жесткости артериальной стенки может улучшить стратификацию риска когнитивного дефицита.
Немедикаментозные меры влияния на артериальную жесткость у пациентов старшего возраста
Немедикаментозные меры — прежде всего физические нагрузки и питание — являются основой ведения пациентов старших возрастных групп и профилактики гериатрических синдромов. Исследования демонстрируют, что применение физических упражнений, основанных на аэробных, комбинированных или изометрических нагрузках, улучшают показатели жесткости артериальной стенки, причем в группе пациентов пожилого возраста этот эффект более значительный [83]. Также отмечено положительное влияние средиземноморской диеты, специально разработанной в соответствии с диетическими рекомендациями для пожилых людей (NU-AGE (Новые диетические стратегии, учитывающие особые потребности пожилых людей для здорового старения в Европе)), включающей повышенное потребление цельнозерновых продуктов и белка (из молочных продуктов и нежирного мяса), низкое потребление натрия и добавки с витамином D на снижение АД и жёсткости артерий [84].
Заключение
Артериальная жёсткость у пациентов пожилого возраста является не только ФР ССС, но и одним из важнейших патофизиологических механизмов развития и прогрессирования гериатрических синдромов, которые отражают патологическое старение и предрасполагают к неблагоприятным исходам. Измерение CAVI у пациентов старшего возраста является простым доступным методом выявления групп пациентов как высокого ССР, так и гериатрического риска.
Артериальная жесткость и беременность
Беременность приводит к адаптации сердечно-сосудистой системы матери, характеризующейся высоким сердечным выбросом и низким системным сосудистым сопротивлением, чтобы реагировать на возросшие метаболические потребности [85]. В случаях беременностей, осложненных преэклампсией, снижается резистентность артерий и повышается жесткость сосудов [86]. Играя ключевую роль в патогенезе преэклампсии, эндотелиальная дисфункция может представлять собой связь между дефектами плаценты и риском ССЗ в более позднем возрасте [87]. Острый атероз, характерный для спиральных артерий во время преэклампсии, похож на ранние стадии атеросклероза [88]. Эндотелиальная дисфункция, по-видимому, связана с плохой плацентацией с сохранением гладкомышечных клеток в сосудистых стенках плацентарного ложа, вазоконстрикцией, гипоксически-ишемическим повреждением и окислительным стрессом [89].
Оценка артериальной жесткости применяется у беременных женщин для прогнозирования неблагоприятных исходов, особенно преэклампсии, задержки роста плода и гестационного СД [90-93]. Однако для высокоэффективной оценки во время беременности сначала следует установить контрольные диапазоны значений CAVI для каждой недели беременности, поскольку артериальная жесткость значительно изменяется во время беременности [94].
В исследовании Poolsin T, et al. (2023) было показано, что значения CAVI значительно снижаются во время беременности как квадратичная функция гестационного возраста, тогда как они значительно коррелируют с возрастом матери как положительная линейная функция [95].
Это исследование также предоставляет референтные диапазоны CAVI на протяжении всей беременности для каждой гестационной недели (таблица 1). Значения CAVI демонстрируют тенденцию снижения в середине беременности, а затем увеличения в конце беременности, неглубокую U-образную форму, что согласуется с результатами оценки жесткости артерий другими методами [96][97].
Таблица 1
Референсные диапазоны CAVI для каждой недели беременности (5-й, 10-й, 50-й, 90-й и 95-й процентили) [95]
|
Срок, недели |
CAVI |
||||
|
5-й |
10-й |
50-й |
90-й |
95-й |
|
|
11 |
5,20 |
5,44 |
6,26 |
7,08 |
7,31 |
|
12 |
5,15 |
5,38 |
6,21 |
7,03 |
7,27 |
|
13 |
5,10 |
5,33 |
6,16 |
6,99 |
7,23 |
|
14 |
5,05 |
5,29 |
6,12 |
6,95 |
7,19 |
|
15 |
5,00 |
5,24 |
6,08 |
6,91 |
7,15 |
|
16 |
4,96 |
5,20 |
6,04 |
6,88 |
7,12 |
|
17 |
4,92 |
5,16 |
6,00 |
6,84 |
7,08 |
|
18 |
4,88 |
5,12 |
5,97 |
6,81 |
7,05 |
|
19 |
4,84 |
5,08 |
5,93 |
6,78 |
7,03 |
|
20 |
4,81 |
5,05 |
5,90 |
6,76 |
7,00 |
|
21 |
4,77 |
5,02 |
5,88 |
6,73 |
6,98 |
|
22 |
4,74 |
4,99 |
5,85 |
6,71 |
6,96 |
|
23 |
4,72 |
4,96 |
5,83 |
6,69 |
6,94 |
|
24 |
4,69 |
4,94 |
5,81 |
6,68 |
6,93 |
|
25 |
4,67 |
4,92 |
5,79 |
6,66 |
6,91 |
|
26 |
4,65 |
4,90 |
5,78 |
6,65 |
6,90 |
|
27 |
4,63 |
4,88 |
5,76 |
6,64 |
6,89 |
|
28 |
4,62 |
4,87 |
5,75 |
6,64 |
6,89 |
|
29 |
4,60 |
4,86 |
5,74 |
6,63 |
6,88 |
|
30 |
4,59 |
4,85 |
5,74 |
6,63 |
6,88 |
|
31 |
4,58 |
4,84 |
5,73 |
6,63 |
6,88 |
|
32 |
4,58 |
4,83 |
5,73 |
6,63 |
6,89 |
|
33 |
4,57 |
4,83 |
5,73 |
6,64 |
6,89 |
|
34 |
4,57 |
4,83 |
5,74 |
6,64 |
6,90 |
|
35 |
4,57 |
4,83 |
5,74 |
6,65 |
6,91 |
|
36 |
4,58 |
4,84 |
5,75 |
6,67 |
6,93 |
|
37 |
4,58 |
4,84 |
5,76 |
6,68 |
6,94 |
|
38 |
4,59 |
4,85 |
5,78 |
6,70 |
6,96 |
|
39 |
4,60 |
4,87 |
5,79 |
6,72 |
6,98 |
Примечание: CAVI — сердечно-лодыжечный индекс.
Основываясь на множественном регрессионном анализе, Poolsin T, et al. (2023) предположили, что референтные диапазоны результатов могут быть функциональными в прогнозировании риска ССЗ во время беременности [95]. Исследование сообщило о корреляции между значениями CAVI и возрастом матери, поскольку с увеличением возраста CAVI также увеличивается. Необходимы дальнейшие исследования для подтверждения этих результатов [98].
Предыдущие исследования также показывают, что у женщин с преэклампсией повышена артериальная жесткость во время беременности по сравнению с беременными женщинами с нормотензией [99][100].
Последствия, вызванные преэклампсией и другими формами АГ у беременных, достаточно серьезны как для матери, так и для плода. Предметом дискуссий остается вопрос, имеется ли прямая ассоциация гипертензивных нарушений беременности и преэклампсии с последующим развитием ССЗ, или эти состояния имеют общие патофизиологические механизмы и ФР [101][102]. Хотя предыдущие исследования продемонстрировали связь между эндотелиальной дисфункцией и преэклампсией [103][104], большинство из них были сосредоточены на ультразвуковом исследовании плечевой артерии, которое считается золотым стандартом для оценки функции эндотелия, измеряя поток-опосредованную дилатацию (ПОД).
Общеизвестно, что артериальная жесткость является маркером повышенных ССР, таких как ИМ, СН и общая смертность [48][105]. Несмотря на имеющиеся исследования об ассоциации артериальной жесткости во время беременности, имеется мало сообщений об этих изменениях после родов у женщин с преэклампсией.
В исследовании Oyama-Kato M, et al. (2006) авторы продемонстрировали, что у женщин с нормотензивной беременностью СПВ, индекс артериальной жесткости снижается во втором триместре, увеличивается в третьем триместре и во время родов и снижается в течение первого месяца после родов [106]. Другое исследование отслеживало изменения СПВ на протяжении всей беременности и через 1 мес. после родов у женщин с нормальной беременностью и показало схожую картину изменений СПВ [107]. С другой стороны, исследования также показали, что у пациенток с АГ во время беременности СПВ не снижалась между первым и вторым триместрами и заметно увеличивалась после родов [106][108].
В исследовании Долгушиной В. Ф. и др. (2024) авторы установили, что у женщин, перенесших преэклампсию, сосудистый возраст был значимо выше в сравнении с группой контроля, при этом у женщин без АГ в анамнезе сосудистый возраст оказался достоверно ниже хронологического [109]. Схожие результаты были получены другими авторами. Так, Benschop L, et al. (2020) в своем исследовании показали, что через год после перенесенной тяжелой преэклампсии у женщин зарегистрирован высокий риск ССЗ, который коррелировал с проявлениями субклинического атеросклероза и сосудистого возраста [110]. Werlang A, et al. (2023) установили, что у женщин с тяжелой преэклампсией в анамнезе шансы возникновения раннего сосудистого старения, которое оценивалось по показателю жесткости аорты, были в 9,23 раза выше по сравнению с контрольной группой (95% ДИ: 1,67-51,06, р=0,011) и в 7,87 раза выше, чем при умеренной преэклампсии (95% ДИ: 1,29-47,77, р=0,025) [111].
Ключевым выводом, который совпадает во всех исследованиях, является увеличение показателей послеродовой артериальной жесткости с 7 нед. до 2-3 лет после родов [112]. Причем только в двух исследованиях изучалась артериальная жесткость после родов с использованием CAVI [113][114].
Предметом дальнейших исследований должны стать вопросы длительности и стойкости сохранения эндотелиальной дисфункции после родов у женщин с преэклампсией и способы их коррекции.
Ожирение и CAVI
Патогенетическая связь сосудистой жесткости и ожирения
Ожирение является одним из ключевых ФР развития ССЗ. Нарушения, происходящие в сосудистой системе на фоне избыточной жировой массы, включая повышение жесткости сосудов, играют важную роль в патогенезе этих заболеваний.
Исследование ученых из Японии Nagayama D, et al. (2013), проводимое на 47 пациентах, страдающих ожирением, продемонстрировало эффективное влияние 12-недельной программы снижения веса, состоящей из диеты и физических нагрузок, на показатели CAVI [115]. Было показано, что CAVI уменьшался после снижения веса и был связан именно со снижением объема висцерального жира, при отсутствии значительных различий в возрасте, уровне АД, уровне гликированного гемоглобина, инсулина, наличия СД и дислипидемии.
В другом исследовании было показано, что резистентность к инсулину связана со снижением эндотелий-зависимой вазодилатации у людей с ожирением [116]. Кроме того, висцеральное ожирение может независимо увеличивать жесткость артерий в следствие хорошо известной связи с традиционными ФР атеросклероза, посредством различных путей дисфункции сосудистого эндотелия, зависимых от оксида азота (NO), фактора роста эндотелия сосудов, нейрогуморальных изменений, воспалительных внутрисосудистых реакции и повышенного системного окислительного стресса [115][117-119].
Таким образом, CAVI может быть хорошим индикатором нарушения жесткости артерий, вызванного висцеральным ожирением, а снижение CAVI может быть маркером улучшения сосудистой жесткости после снижения веса у людей с висцеральным ожирением.
Клиническая значимость
У пациентов с ожирением повышенная жесткость артерий коррелирует с увеличением CAVI, что позволяет использовать этот показатель для раннего выявления сосудистых осложнений. На начальном этапе исследований данного показателя подавляющее большинство работ было проведено в азиатских популяциях, но впоследствии были воспроизведены и на европейской популяции [120][121]. Известно, что у азиатов распределение жировой массы отличается от такового у европейской группы людей. Данные работы Seals D, et al. показали, что у азиатов с большей вероятностью показатели висцеральной жировой массы будут выше, чем у европейцев при тех же значения ИМТ [122].
В крупном исследовании, проведенном учеными из Китая, включающем 5309 участников, в период наблюдения с 2011 по 2018гг, было выявлено увеличение артериальной жесткости в группах с лишним весом и ожирением 1, 2 степени, причем большее увеличение артериальной жесткости наблюдалось в группе с ожирением 2 степени [123]. Помимо этого, показано увеличение 10-летнего ССР в группе с висцеральным ожирением 2 степени, где значения были увеличены в 9,56 раз по сравнению с контрольной группой с нормальным весом и нормальным содержанием висцерального жира (р<0,0001).
Данные многоцентрового европейского исследования, проведенного с участием более 2000 человек в возрасте ≥40 лет с лишним весом (ИМТ 29,3 кг/м2), более 73% из которых страдали метаболическим синдромом, продемонстрировали сильную корреляционную взаимосвязь CAVI (CAVI >9) с возрастом, а также взаимосвязь CAVI с компонентами метаболического синдрома, после корректировки по возрасту. Значительная положительная связь наблюдалась для CAVI с гликемией и АГ, тогда как окружность талии была обратно пропорциональна CAVI. Было показано, что CAVI ассоциируется с повышенным риском сердечно-сосудистой смертности и смертности от всех причин у лиц в возрасте ≥60 лет [120][124]. По данным данного исследования (TRIPLE-A-Stiffness), возраст, среднее АД, антидиабетическая и липидснижающая терапия были независимыми предикторами ежегодного прогрессирования CAVI [124].
Многие эпидемиологические и клинические исследования, оценивающие эластичность артерий у людей с ожирением, показали, что ожирение, особенно в абдоминальной форме, коррелирует с повышенной жесткостью артерий [125-127]. В экспериментальном исследовании, проведенном на мышах, которых кормили продуктами с высоким содержанием жира и сахарозы, ожирение развивалось до или одновременно с повышением жесткости артерий, что позволяет предположить, что артериальные изменения являются следствием ожирения. Более того, нормокалорийная диета вызывала снижение веса и уменьшение жесткости артерий, что указывает на обратимый характер сосудистых изменений [128].
Риск развития ССО, прогностическая значимость
Увеличение CAVI ассоциируется с метаболическим синдромом, инсулинорезистентностью и системным воспалением, которые характерны для ожирения. Повышение CAVI указывает на наличие субклинического атеросклероза и повышенный риск развития ИМ и инсульта.
Ожирение является многофакторным заболеванием, поражающим около трети населения земного шара. По данным эпидемиологический исследований, предполагается, что к 2030г ~40% взрослого населения будут страдать избыточным весом или ожирением [129]. Висцеральное ожирение, связанное с нарушением толерантности к глюкозе, дислипидемией и АГ, способствует атеросклеротическим изменениям сердца и сосудов, повышая риск развития ССС [124].
Данные исследований демонстрируют, что измерение жесткости артерий с помощью CAVI может улучшить прогнозирование заболеваний для снижения риска ССС, расширяя установленные ассоциации CAVI с ССР, а также показывая, что на прогрессирование CAVI влияют факторы, которые потенциально можно модифицировать с помощью лечения.
Влияние нелекарственных/лекарственных методов лечения ожирения на сосудистую жесткость
CAVI используется для оценки изменений жесткости сосудов под воздействием терапевтических вмешательств, включая медикаментозное лечение, снижение массы тела и физическую активность.
Снижение веса является фундаментальной терапией ожирения. Основным немедикаментозным методом лечения является модификация образа жизни, направленная на коррекцию психологического фона, исключения хронического стресса, нормализацию режима сна, но главное, на снижение массы тела с помощью здорового питания и/или индивидуально подобранных режимов физической активности [130].
Результаты исследования Nagayama D, et al. позволяют рассматривать CAVI в качестве маркера улучшения жесткости сосудов после немедикаментозного снижения веса у пациентов с висцеральным ожирением [115].
Однако у значительного числа пациентов с лишним весом имеются ограничения к физическим нагрузкам в силу коморбидности их состояния, сниженной толерантности к нагрузкам, наличия, зачастую, нарушений со стороны опорно-двигательного аппарата, в следствие чего пациентам бывает доступна только низкоинтенсивная нагрузка, не вызывающая существенных изменений иммунологических и физиологических реакций и не приводящая к желаемым эффектам [131]. В ряде исследований продемонстрировано, что низкоинтенсивные физические упражнения в сочетании с гипоксической и/или гипероксической терапией увеличивают метаболическую нагрузку таким же образом, как и более высокоинтенсивные упражнения [132-136]. Было показано, что физические упражнения умеренной интенсивности в гипоксической среде способствуют капилляризации скелетных мышц, снижению артериальной жесткости [134] и приводят к значительному улучшению липидного обмена, метаболизма глюкозы и снижению веса у пациентов с ожирением по сравнению с контрольной группой [136]. В то же время иные обзоры демонстрируют положительные эффекты пассивного гипоксического воздействия, особенно в интервальном режиме, что может быть методом выбора для немедикаментозной коррекции кардиометаболических рисков у пациентов с ожирением. Было показано, что курс пассивных интервальных гипоксических воздействий эффективен для повышения чувствительности к инсулину у пациентов с предиабетом [137], снижения веса за счет жировой массы, снижения уровня АД и коррекции эндотелиальной дисфункции [138][139].
Несмотря на то, что немедикаментозные методы лечения остаются краеугольным камнем в лечении ожирения, при недостаточности эффекта снижения веса необходимым становится начало приема медикаментозной терапии, которая снижает кардиометаболический риск у людей с ожирением [140].
В настоящее время существует шесть препаратов, одобренных как Европейским агентством по лекарственным средствам (EMA), так и Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) для долгосрочного контроля веса у пациентов с ожирением: орлистат, налтрексон пролонгированного высвобождения/бупропион, лираглутид, семаглутид, тирзепатид и сетмеланотид для лечения редких моногенетических нарушений, связанных с ожирением. Одобренные препараты позволяют добиться снижения веса не менее чем на 5% [140].
В исследовании Korakas E, et al. (2024) было показано эффективное влияние терапии семаглутидом у пациентов с СД 2 типа на показатели артериальной жесткости, снижение СПВ, что наблюдалось совместно со снижением САД и улучшением показателей стеатоза и фиброза печени [141].
Эффекты терапии, направленной на снижение веса, на показатели артериальной жесткости ограничиваются недостаточными клиническими исследованиями. Долгосрочные эффекты и безопасность влияния на сердечно-сосудистую систему препаратов для снижения веса требуют дальнейшего изучения.
Прогрессирование артериальной жесткости может представлять собой модифицируемый ФР при комплексном индивидуальном подходе к терапии. Таким образом, своевременное лечение пациентов с ожирением может способствовать предотвращению прогрессирования атеросклероза в будущем.
Курение и жесткость артериальной стенки
Курение сигарет — хорошо известный ФР ССЗ, который способствует прогрессированию атеросклероза и увеличению сердечно-сосудистой смертности. В настоящее время доказано негативное влияние курения на изменение эластичности артерий среднего калибра и на микрососудистое русло, проявляющееся сужением венул и артериол, появлением или усилением сладжа эритроцитов, замедлением кровотока, уменьшением числа функционирующих капилляров. Обсуждается несколько механизмов развития дисфункции эндотелия при курении сигарет: никотин оказывает прямое воздействие на эндотелиоциты, снижает синтез простациклина и NO, ослабляет эндотелий-зависимую вазодилатацию, что приводит к утолщению комплекса интима-медиа [142]. Курение способствует формированию синдрома раннего сосудистого старения у молодых лиц без сердечно-сосудистой патологии.
В ряде клинических исследований было показано влияние острого, хронического и пассивного курения сигарет на изменение жесткости сосудистой стенки. В работе Гусаковской Л. И. и др. продемонстрировано влияние острого курения на СПВ в артериях мышечного типа [143]. В исследовании Hennrikus D, et al. было показано, что пассивное курение сигарет приводит к повышению СПВ и увеличивает жесткость сосудистой стенки [144].
В исследовании Милютиной М. Ю. и др. проводилась оценка влияния длительного курения сигарет на параметры жесткости сосудистой стенки у мужчин. Среднее значение CAVI у курильщиков было достоверно выше, чем у некурящих и составило 7,0±1,2 и 6,3±0,5, соответственно (р=0,02). У 22% курильщиков CAVI был выше возрастной нормы, в группе некурящих отклонений от нормы не наблюдалось. При проведении корреляционного анализа была показана связь CAVI со стажем курения (r=0,67, p<0,0001) и индексом курения (r=0,36, p=0,04). Авторы сделали вывод, что у каждого пятого курящего мужчины наблюдается повышение сосудистой жесткости выше возрастной нормы [142].
Эти данные соотносятся с результатами исследования Винокуровой И. Г. и др., в котором было продемонстрировано значимое увеличение CAVI в группе женщин-курильщиц не только по сравнению с некурящими женщинами, но и по сравнению с группой некурящих женщин, имеющих АГ 1 степени. Повышение показателя жесткости сосудистой стенки выше возрастной нормы у 20% курильщиков свидетельствует о ремоделировании сосудов и может рассматриваться в качестве маркера синдрома раннего сосудистого старения [145].
Kubozono Т, et al. убедительно продемонстрировали, что как при остром, так и при хроническом курении сигарет выявляется значительное повышение жёсткости артерий, измеряемой с помощью CAVI. Результаты исследований позволяют предположить, что CAVI является перспективным параметром для оценки жёсткости артерий у курильщиков [146].
Появившиеся в начале XXIв альтернативные варианты курения — вейпы (vape) пользуются особой популярностью среди молодежи. Их стремительное распространение достигло масштабов эпидемии, сопоставимой и конкурирующей с табакокурением1. Многие считают вейп менее вредным, чем сигареты несмотря на то, что при активации устройства путем нагревания человек ингалирует тот же никотин в сочетании с акролеином, формальдегидом, бензальдегидом, аценафтиленом, оксидом углерода, твердыми частицами и ароматизаторами [147]. Если негативные эффекты никотина, смол и окиси углерода, содержащихся в сигаретах, хорошо изучены, доказаны в многочисленных исследованиях, то влияние курения вейпа и его компонентов на организм только изучаются.
Подзолков В. И. и др. при обследовании 369 молодых людей без ССЗ в возрасте 21 [ 20; 21] года доказали, что курение вейпов способствует достоверному снижению уровня ЛПИ при сравнении с некурящими. Причем медианы ЛПИ у вейп-курящих были ниже, чем у табакокурящих (р<0,001). Авторы сделали вывод, что никотинсодержащие вейпы не только сопоставимы с традиционным табакокурением по уровню вреда, наносимого сосудистой стенке, но и могут представлять большую угрозу в отношении прогрессирования сосудистой жесткости у здоровых молодых людей [50].
За последние годы стало популярным курение кальяна. Предположение о безопасности использования кальяна, базирующееся на утверждении, что "дым фильтруется водой", неверно. В исследовании Пушкиной Я. А. и др. [148] было показано, что у 20% студентов, курящих кальян, CAVI превышал возрастные критерии. При проведении корреляционного анализа была доказана взаимосвязь CAVI со стажем курения кальяна (r=0,46, p<0,01). При проведении повторного исследования через 3 года показатели СAVI у студентов, которые прекратили курение кальяна, достоверно улучшились и достигли возрастной нормы, в отличие от показателей студентов, которые продолжали курить кальян.
Таким образом, курение сигарет, никотинсодержащих вейпов и кальяна негативно влияет на жесткость сосудистой стенки и способствует формированию синдрома раннего сосудистого старения даже у молодых людей без признаков ССЗ. CAVI является современным показателем для оценки жесткости сосудистой стенки при любом виде курения.
Влияние питания на артериальную жесткость/CAVI
Согласно результатам клинических и экспериментальных исследований, крупных метаанализов и систематических обзоров установлено наличие тесной связи между здоровым образом жизни, оптимальным питанием и риском ССЗ. Изучалось влияние различных диетических вмешательств и пищевых веществ на эндотелиальную функцию и артериальную жесткость: моделей питания (типы питания, пищевых паттернов), отдельных пищевых продуктов и их групп, специализированных пищевых продуктов и биологически активных добавок (БАД) к пище.
Среди рационов, отвечающих критериям здорового питания и обладающих доказанным защитным эффектом в отношении профилактики ССЗ и снижения артериальной жесткости, можно выделить "территориальные" модели питания и специально разработанные рационы: диеты средиземноморская, скандинавская, DASH, Portfolio, MIND, растительные рационы с разной степенью ограничения пищевых продуктов животного происхождения [149-154]. В ряде исследований было продемонстрировано гипотензивное и ангиопротективное влияние рационов питания, богатых разнообразными фруктами и овощами, в т.ч. с высоким содержанием калия, такими как листовая зелень, крестоцветные, бобовые и желто-оранжево-красные овощи [155-158]. Анализ результатов двух крупных исследований с включением 1622 и 6628 (China-PAR) участников показал, что высокое потребление фруктов и овощей в детстве/подростковом возрасте связано с более низкой кфСПВ и артериальной жесткостью у взрослых [159][160]. В исследовании ELSA-Brasil с 12892 участников выявлено, что на фоне диеты с высоким содержанием молока и молочных продуктов снижалось АД на -1,3 мм рт.ст. и кфСПВ на -0,13 м/с [161]. При этом по результатам метаанализа 7 других исследований не было продемонстрировано влияние молочных продуктов на артериальную жесткость [162].
Установлены положительные эффекты потребления орехов на артериальную жесткость: ежедневное употребление фисташек в течение 3 мес. сопровождалось улучшением сосудистой жесткости и эндотелиальной дисфункции (снижением кфСПВ, СПВ плечевой артерии и улучшением ПОД плечевой артерии) [163], аналогичные результаты получены и для грецких орехов [164][165].
Потребление красного мяса, такого как говядина, свинина и баранина, ассоциировано с повышенным риском ССЗ и увеличением артериальной жесткости при регулярном длительном приеме, особенно при употреблении в больших количествах, что в настоящее время объясняется высоким содержанием в нем насыщенных жиров и холестерина [166][167], а также увеличением метаболитов, таких как триметиламин N-оксид (также известен как триметиламиноксид). Напротив, потребление рыбы и птицы не было связано с неблагоприятным влиянием на артериальную жесткость [168][169].
В результате многочисленных исследования, в которых изучалось влияние кофе на жесткость сосудистой стенки, получены противоречивые данные: малое и умеренное количество кофе улучшало эндотелиальную функцию у пациентов в одних работах, при этом постоянное потребление кофе в высоких дозах повышало АД, СПВ и индекс аугментации (ИА) в 2 раза [170-173].
Рядом авторов высказана гипотеза о пороговом действии алкоголя на функцию сосудов: незначительный или умеренный прием алкоголя связан с более низкой, чем ожидалось, кфСПВ, в то время как более высокие дозы коррелируют с ускоренным старением артерий и увеличением артериальной жесткости [174-176]. Согласно данным Всемирной организации здравоохранения (2023), не существует безопасного уровня потребления алкоголя [177].
Поступление неорганических нитратов с пищей, например, свекольный сок, листовая зелень, а также специализированные пищевые продукты или БАД, по данным ряда рандомизированных клинических исследований, сопровождалось дозозависимым снижением АД и кфСПВ [178]. Было установлено наличие индивидуальной и групповой вариабельности ответа на добавление нитратов в пищу, зависящей от возраста, состояния здоровья, статуса физической подготовки, пола, генетических факторов и состава микробиома полости рта. У женщин, как оказалось, наблюдается более выраженное снижение жесткости артерий на фоне приема неорганических нитратов с пищей, чем у мужчин [179-182].
Метаанализ 113 рандомизированных клинических исследований установил, что потребление пищевых продуктов и напитков (шоколад, какао, виноград, зеленый чай и др.), богатых флавоноидами (кверцетин, катехины, антоцианы и др.), сопровождалось улучшением показателей АД, ПОД и артериальной жесткости [183-187]. В ряде исследований отмечены благоприятные, но неоднозначные эффекты коэнзима Q10 и куркумина на эндотелиальную функцию и ПОД артерий [188-192]. В работе Imamura HС, et al. (2017) у пациентов с СД 2 типа на фоне потребления ресвератрола CAVI снизился более чем на 0,5 единиц измерения [193]. Данный факт подтвержден двумя независимыми метаанализами, в которых было установлено, что добавление ресвератрола увеличивает показатели ПОД артерий [194, 195]. По данным рандомизированных клинических исследований отмечалось улучшение показателей ПОД, СПВ и толщины интима-медиа сосудов при потреблении омега-3 полиненасыщенных жирных кислот [196-199].
В 10-летнем когортном исследовании, в котором изучались долгосрочные эффекты селена и связь его концентрации в крови со структурно-функциональными показателями крупных артерий, включая сосудистую жесткость, было выявлено, что нормальные уровни селена ассоциированы с низкой артериальной жесткостью, а высокие с ее увеличением [200]. Противоречивые результаты получены при изучении роли приема БАД — источников органического и неорганического магния на артериальную жесткость, несмотря на его ангиопротективное действие, большинство исследователей не выявили значимого снижения параметров артериальной жесткости [201-203]. По данным разных метаанализов прием моновитаминов группы В (В6, В12, В9), С, Е, D или К, или мультивитаминных комплексов не оказывал существенного влияния на параметры СПВ и ПОД [204-208].
Таким образом, результаты современных систематических обзоров и метаанализов свидетельствуют о неоднозначном влиянии различных пищевых веществ и диетических вмешательств на эндотелиальную функцию и артериальную жесткость: от отсутствия или минимальной эффективности до значительной пользы. Это связанно с большой гетерогенностью проведенных клинических исследований, обусловленной различными популяциями, дозировками, режимами, временем вмешательств и отсутствием стандартизации в оценке артериальной жесткости. Для получения надежных результатов, на основе которых можно делать однозначные выводы о доказанной эффективности определенных диетических вмешательств, требуются проведение и получение результатов крупномасштабных проспективных рандомизированных клинических исследований с большим размером выборки, длительным периодом наблюдения, стандартизованными методиками, многоцентровым участием и т.д.
АГ и CAVI
При АГ повышение жесткости артерий происходит в результате структурных изменений сосудистой стенки под влиянием гемодинамической нагрузки и нейрорегуляторных механизмов. Основными патогенетическими механизмами увеличения жесткости артерий в условиях постоянно повышенного АД и механического напряжения являются развитие эндотелиальной дисфункции, активация РААС, прогрессирование низкоинтенсивного воспаления и окислительного стресса, разрушение эластиновых волокон и стимуляция выработки коллагена в артериальной стенке [209]. Поражение артерий при АГ начинается с функциональных изменений эндотелия, при которых происходит вазоконстрикция, нарушается регуляция NO-синтазы со снижением выработки NO, затем появляются морфологические изменения с уменьшением просвета сосудов, связанные с утолщением их медиального слоя [210][211]. Патологические процессы развития артериосклероза при АГ включают не только гипертрофию и гиперплазию гладкомышечных клеток срединного слоя сосудов, но и изменения скорости клеточной пролиферации и апоптоза, а также синтеза факторов фиброза за счет повышения активности матриксных металлопротеиназ. Вследствие перестройки клеточных элементов и экстрацеллюлярного матрикса снижается эластичность артерий и повышается их жесткость. При АГ повреждение сосудистой стенки способствует развитию атеросклероза с поражением интимы и образованием атеросклеротической бляшки.
По мере увеличения артериальной жесткости демпфирующая функция крупных артерий в ответ на колебания АД уменьшается, что приводит к еще большему увеличению САД и пульсового давления. Это происходит потому, что в жесткой артерии пульсовая волна распространяется с большей скоростью и отраженная волна возвращается к сердцу быстрее, в фазу поздней систолы желудочков, а ДАД уменьшается из-за преждевременного слияния быстро отраженной волны с прямой волной. Дальнейшее повышение САД, в свою очередь, может способствовать еще большему увеличению артериальной жесткости и гемодинамической нагрузки на органы-мишени, способствуя их повреждению, а пониженное ДАД приводить к ухудшению их перфузии [210]. Когда аорта становится жесткой и менее растяжимой, она теряет свою способность гасить пульсирующий артериальный кровоток, обусловленный циклическим выбросом из ЛЖ, градиент жесткости между проксимальными эластичными артериями и дистальными мышечными артериями уменьшается, меньше пульсационной энергии отражается в обратном направлении, происходит увеличение передачи пульсирующих колебаний в периферические сосуды, что приводит к функциональным и структурным изменениям мелких резистивных артерий, увеличению общего периферического сопротивления и среднего АД, замыкая порочный круг [209, 212]. Гиперпульсация в дополнение к более высокому среднему АД усиливает повреждения сердца, мозга и почек и приводит к ССО, церебральным и почечным осложнениям [211][212]. Таким образом, связь между артериальной жесткостью и АГ — двунаправленная и представляет собой порочный круг развития патологических изменений сосудистой стенки, поражения органов-мишеней при постоянно повышенном АД и в то же время возрастание риска АГ или дальнейшего прогрессирования заболевания при увеличении артериальной жесткости.
Артериальная жесткость является маркером субклинического поражения артерий и используется для стратификации риска у пациентов с АГ и оценки прогноза развития ССО и смертности [213-215]. Показатели увеличения жесткости артерий включают: повышение пульсового АД ≥60 мм рт.ст. (у пожилых пациентов) при отсутствии недостаточности клапанов аорты, увеличение кфСПВ >10 м/с и плече-лодыжечной >18 м/с [213-215]. Вместе с тем японскими исследователями предложен альтернативный метод измерения жесткости артерий CAVI, широкое применение которого в большей степени распространено в странах Азии [16]. Однако за последние годы накоплен опыт практического использования CAVI в качестве показателя артериальной жесткости и прогностического маркера в странах европейского региона, что отражено в международном экспертном соглашении по клиническому применению измерения артериальной жесткости: CAVI (2022) и в европейском экспертном соглашении по измерению АД и оценке структуры и функции артерий (2024) [3][7].
Показатель CAVI отражает жесткость сосудов на протяжении аорты, бедренной и большеберцовой артерий, и имеет ряд преимуществ в сравнении с определением СРПВ. В первую очередь это заключается в меньшей зависимости от уровня АД во время измерения, что делает его более точным по сравнению с СРПВ. Помимо того, автоматическая методика CAVI легко выполнима в клинических условиях, оператор-независима и демонстрирует высокую воспроизводимость [3, 8].
Увеличение показателя артериальной жесткости CAVI может использоваться в качестве полезного маркера для выявления ночной АГ и оптимизации стратификации ССР пациентов, как показало исследование Cuspidi C, et al. (2024) [216]. Доказана роль увеличения CAVI в качестве независимого индикатора раннего выявления неконтролируемой маскированной АГ и неконтролируемой установленной АГ (Wang N, et al., 2022) [217]. Неэффективный контроль АД у пациентов с АГ даже при приеме антигипертензивных препаратов был независимо ассоциирован с увеличением CAVI >9, что было продемонстрировано в исследовании Kawabata T, et al. (2022) [218].
CAVI может служить независимым маркером наличия гипертрофии ЛЖ у леченных пожилых пациентов с АГ, как показали результаты исследования the Pamela Study, а также у пациентов с АГ и высоким нормальным уровнем АД [29, 219]. Повышение CAVI также ассоциировано с со снижением диастолической функции и субклинической систолической дисфункцией ЛЖ (снижение глобальной продольной деформации) у пациентов с АГ [31, 220, 221].
В российском исследовании Сумина А. Н. и др. по данным ЭССЕ-РФ в Кемеровской области (2016) было получено, что увеличение CAVI отмечалось у 17,5% пациентов с АГ, а независимыми факторами, ассоциированными с его повышением, являлись возраст и повышение уровня креатинина [222].
Прогностическая значимость CAVI независимо от традиционных ФР ССЗ доказана в многоцентровых исследованиях CAVI-J (Miyoshi T, et al., 2021); TRIPLE-A-Stiffness (Bäck M, et al., 2024), проспективном наблюдении Sato Y, et al. (2016), метаанализе Tavolinejad H, et al. (2024) [40, 124, 223, 244].
В многоцентровом проспективном когортном исследовании CAVI-J (Prospective Multicenter Study to Evaluate Usefulness of Cardio-Ankle Vascular Index in Japan) увеличение CAVI было связано с повышением риска сердечно-сосудистой смерти, нефатального инсульта, смертности от всех причин и госпитализации по поводу СН у пациентов с высоким риском ССС, в т.ч. у пациентов с АГ. Распространенность АГ и средний уровень САД увеличивались при более высоком показателе жесткости артерий: в группе с CAVI ≥9,50 доля пациентов с АГ была 90,5% и средний уровень САД — 137,3±16,9 мм рт.ст. в сравнении с группой CAVI ≤7,55 — 86,2% и 130,5±15,4 мм рт.ст., соответственно [40].
В проспективном крупном японском 6-летнем наблюдении за пациентами с метаболическим синдромом было продемонстрировано, что CAVI являлся предиктором развития неблагоприятных ССС независимо от традиционных факторов коронарного риска. Каждое повышение CAVI на 1 сопровождалось увеличением риска развития ССС на 12,6% [28].
В европейском многоцентровом проспективном исследовании TRIPLE-A-Stiffness с участием 18 стран, в т.ч. России и Беларуси, было доказано, что увеличение CAVI связано с повышением риском ССО и смертности на 25%, общей смертности — на 37% у участников исследования старше ≥60 лет, большинство из них были пациенты с АГ [124]. При этом оптимальный прогностический порог CAVI составил 9,25 для пациентов ≥60 лет и 8,30 в возрасте <60 лет.
В систематическом обзоре и метаанализе Tavolinejad H, et al. (2024), включившем 32 исследования и 105845 участников (большинство исследований из стран Восточной Азии), доказана прямая зависимость повышенного CAVI с возрастанием риска развития ССС (смерть, острый коронарный синдром, инсульт, коронарная реваскуляризация, госпитализация по причине СН) на 46% [223]. Также при увеличении CAVI наблюдалось снижение функции почек (развитие/прогрессирование хронической болезни почек (ХБП), снижение СКФ) на 30% в сравнении с нормальным CAVI. Особенно важным являются результаты данного метаанализа, полученные среди участников без исходных ССЗ, у которых более высокий CAVI был связан с увеличением риска впервые развившихся ССС на 60%. Поэтому оценка артериальной жесткости с помощью CAVI в перспективе может шире использоваться в качестве скринингового метода с целью первичной профилактики ССЗ.
Влияние антигипертензивной терапии на снижение CAVI у пациентов с АГ доказано при применении ингибиторов РААС, включая блокаторы рецепторов ангиотензина олмесартан, кандесартан, азилсартан [224-226] и иАПФ периндоприл [227], а также блокаторов кальциевых каналов эфонидипина, амлодипина [228, 229] и блокатора минералокортикоидных рецепторов эплеренона [230]. Следует отметить, что в нескольких из вышеуказанных исследованиях улучшение показателя артериальной жесткости CAVI при лечении кандесартаном, периндоприлом и эплереноном отмечалось независимо от степени достигнутого гипотензивного эффекта у пациентов с АГ [225][227][230].
Таким образом, изначально разработанный для оценки артериальной жесткости CAVI продемонстрировал свою значимость для оценки клинического течения и эффективности терапии АГ, прогноза развития неблагоприятных ССС и смертности, и его более широкое применение может стать перспективным инструментом на этапах лечения и ранней профилактики заболевания.
Атеросклероз и артериальная жесткость: CAVI
Предыдущие эпидемиологические и клинические исследования подчеркивают значимость артериальной жесткости не только как индикатора артериосклероза, но и как прогностического ФР ССС [231]. Артериальная жесткость, обусловленная структурными и функциональными изменениями в артериальной стенке, коррелирует с прогрессированием атеросклероза и является предиктором ССС. Механизмы, способствующие увеличению сосудистой ригидности, включают дегенеративные изменения в коллагеновых и эластиновых волокнах, кальцификацию медиального слоя артерий и дисфункцию эндотелия, вызванную хроническим воспалением и окислительным стрессом [232]. Эти патологические процессы приводят к склерозированию всех слоев стенок крупных и магистральных артерий, что, в сущности, представляет собой артериосклероз [233]. В этом контексте артериальная жесткость является измеримым маркером артериосклероза, аналогично тому, как атеросклеротическая бляшка служит индикатором атеросклероза [234].
Однако, как было отмечено, СПВ чувствительна к изменениям АД в момент измерения, что может искажать результаты, особенно при оценке динамических изменений сосудистой жесткости. В ответ на эти ограничения был разработан индекс жесткости β, который учитывает изменения диаметра сосуда и давления в нем, обеспечивая более точную оценку локальной жесткости сосудистой стенки, независимо от системного АД [21]. Дополнительно, на основе этого параметра был создан CAVI, который интегрирует данные о жесткости от сердца до лодыжек, предоставляя комплексную оценку жесткости аорты и периферических артерий [16]. CAVI отличается от СПВ тем, что его значение не зависит от текущего уровня АД, что делает его особенно полезным для долгосрочного мониторинга. Этот индекс отражает внутреннюю жесткость артерий, включая как структурные, так и функциональные изменения, что позволяет различать физиологические изменения, вызванные, например, симпатической активацией, от патологических изменений, связанных с атеросклерозом или другими сосудистыми заболеваниями [235].
Клиническая значимость CAVI
Таким образом, использование CAVI в клинической практике может значительно улучшить стратификацию риска и оптимизацию терапевтических стратегий у пациентов с повышенным риском ССЗ, обеспечивая более точную и надежную оценку сосудистой жесткости. Оценка сосудистой жёсткости с использованием CAVI представляет собой инновационный метод, позволяющий не только рано диагностировать артериосклероз, но и количественно оценивать его прогрессирование и реакцию на терапевтические вмешательства. Этот индекс, отражающий жесткость артериальной стенки, коррелирует с риском развития ССЗ, включая ИБС и острый коронарный синдром.
Метаанализ, охватывающий 17 исследований, показал, что значения CAVI значительно выше у пациентов с ССЗ по сравнению с лицами без таковых, с объединённой разницей средних значений CAVI в 1,28 (95% ДИ: 0,86-1,70, p<0,001) [47]. Это подтверждает, что CAVI может служить надёжным маркером атеросклеротической болезни.
Дополнительно, исследования выявили, что уровень CAVI коррелирует с количеством стенозированных коронарных артерий, что указывает на его потенциал в оценке степени коронарного атеросклероза. Клиническая значимость CAVI также подтверждается его ассоциацией с Syntax Score, который широко применяется для оценки прогноза у пациентов с острым коронарным синдромом [37]. Интересно, что CAVI также показал свою значимость в выявлении субклинического коронарного атеросклероза у асимптоматических пациентов [236]. Ряд поперечных исследований определили пороговые значения CAVI ≥8,0 и CAVI ≥9,0 ассоциированные со стенозом коронарных артерий на уровне ≥50% и ≥75%, соответственно, что подчёркивает его роль в диагностике ИБС [237].
Кроме того, повышенная жёсткость артериальной стенки, отражаемая высокими значениями CAVI, ассоциируется с увеличением постнагрузки на левые отделы сердца, что может привести к морфологическим изменениям [37], включая увеличение массы миокарда и развитие диастолической дисфункции ЛЖ [31][238]. Эти изменения могут способствовать развитию СН с сохранённой фракцией выброса (ФВ) (СНсФВ) [239].
В контексте цереброваскулярной патологии, CAVI служит независимым маркером, ассоциированным с церебральными микрокровоизлияниями и немой ишемией мозга [11]. Это подчеркивает его потенциал в диагностике субклинических изменений интракраниальных сосудов, хотя и с ограничениями в оценке степени выраженности заболевания.
Для диагностики периферического атеросклероза артерий нижних конечностей CAVI малоинформативен, т.к. наличие гемодинамически значимого стеноза артерий нижних конечностей искажает истинные показатели жесткости сосудистой стенки. Однако аппарат объемной сфигмографии VaSera VS (Fukuda denshi, Япония) автоматически рассчитывает ЛПИ, который служит стандартом постановки диагноза заболевание периферических артерий [240].
Таким образом, CAVI является мощным инструментом в руках клиницистов для оценки и мониторинга сердечно-сосудистого здоровья, предоставляя важную информацию для принятия решений о лечении и профилактике ССЗ.
Прогностическая значимость CAVI
Клиническая ценность информации о сосудистой стенки заключается в том, что она связана с будущими ССС, что позволяет интегрировать эту информацию в процесс оценки ССР. Артериальная жесткость, выступающая в роли прогностического маркера для ССЗ и серьезных ССО, подтвердила свою релевантность в многочисленных научных исследованиях [235]. В двух обширных обзорах были синтезированы результаты одиннадцати проспективных исследований, касающихся прогностической значимости CAVI [47]. Участники данных исследований принадлежали к группе высокого риска развития ССЗ, включая состояния, такие как гипертония, СД, ожирение, хронические нефропатии и анамнез ССЗ. В большинстве случаев исходный уровень CAVI служил надежным предиктором последующих ССС, за исключением одного исследования, где CAVI не смог предсказать ССС у пациентов, находящихся на гемодиализе [241]. Метаанализ четырех исследований показал, что увеличение CAVI на одно стандартное отклонение коррелирует с ростом комбинированного риска ССС на 20% (отношение рисков 1,20; 95% ДИ: 1,05-1,36). Период наблюдения в большинстве случаев был относительно коротким (<5 лет), что, вероятно, связано с относительной новизной метода CAVI [47].
В ряде национальных исследований была продемонстрирована независимая прогностическая значимость CAVI как в общей популяции, так и среди пациентов с ИБС в отдельные периоды наблюдения. Результаты пятилетнего мониторинга случайной популяционной выборки из 1379 человек показали, что значение CAVI >7,8 является критерием риска развития ССС (относительный риск 5,06; 95% ДИ: 2,32-11,06) и сохраняет свою прогностическую ценность даже после коррекции на традиционные ФР [43]. Полученные данные подтверждают необходимость включения измерения CAVI в профилактические и диспансерные осмотры для более точной стратификации риска у пациентов.
Кроме того, выявлено, что высокие показатели CAVI у пациентов с ИБС коррелируют с повышенной частотой развития комбинированной конечной точки как в течение одного года, так и в течение десятилетнего периода наблюдения после проведения операции коронарного шунтирования. Многофакторный анализ показал, что независимым прогностическим фактором у данной категории пациентов является повышение CAVI (ОШ 2,5; 95% ДИ: 1,26-5,08, p=0,008), а также наличие субклинического мультифокального атеросклероза [242][243].
Особое внимание в исследовании уделяется оценке клинического и прогностического значения динамики показателей артериальной жесткости, в частности CAVI. Предыдущие исследования, такие как работа Saiki A, et al., демонстрируют, что у пациентов с дислипидемией и другими сердечно-сосудистыми ФР неблагоприятная динамика CAVI в первый год наблюдения коррелирует с увеличением частоты основных неблагоприятных ССС (major adverse cardiac events, МАСЕ) в течение последующих пяти лет [244]. В недавнем отечественном исследовании было продемонстрировано, что положительная динамика значений CAVI в течение года после реваскуляризации миокарда ассоциировалась со снижением общей смертности и числа МАСЕ в течение последующих 10 лет [245]. Эти результаты подчеркивают потенциал улучшения CAVI у пациентов с ИБС и его благоприятное влияние на долгосрочный прогноз, что может быть использовано в рамках программ вторичной профилактики ССЗ.
Влияние нелекарственных/лекарственных методов на CAVI
Исследования показывают, что нелекарственные/лекарственные методы воздействия способны благоприятно влиять на его динамику. Так, в недавнем обзоре [11] продемонстрировано, что снижение массы тела, прекращение курения, физические тренировки способствуют уменьшению CAVI. Интересно отметить, что методы снижения уровня стресса, такие как выполнение асан йоги, сочетающих элементы растяжки и техники релаксации, значительно уменьшают артериальную жесткость и CAVI (p<0,01) [246]. Предполагается, что релаксация и медитация, характерные для йоги, способствуют уменьшению артериальной жесткости и улучшению эндотелий-зависимой вазодилатации за счет снижения активности симпатических вазоконстрикторов. Однако вопросы о наиболее оптимальных программах тренировок, особенно в различных возрастных категориях, остаются открытыми [247]. Авторы предполагают, что для достижения улучшения состояния артериальной стенки необходимо проводить занятия не менее трех раз в неделю [248]. Оценка влияния различных диетических вмешательств на артериальную жесткость представляет собой более сложную задачу, однако существуют исследования, указывающие на потенциальную эффективность средиземноморской диеты, в то время как диеты с высоким содержанием жиров могут остро нарушить эндотелий-зависимую вазодилатацию [249].
Применение антигипертензивных (антагонисты кальция, ингибиторы РААС, включая блокаторы рецепторов ангиотензина, иАПФ, блокаторы минералокортикоидных рецепторов, прямые ингибиторы ренина), липидснижающих (статины, эйкозапентаеновая кислота) и антидиабетических (ингибирующие SGLT2, ингибиторы α-глюкозидаз, пиоглитазон) препаратов способствует улучшению CAVI [250, 251]. В то время как применение химиотерапевтических препаратов приводит к повышению CAVI [252].
Хроническая СН и артериальная жесткость
Хроническая СН (ХСН) представляет собой финальный этап большинства заболеваний сердечно-сосудистой системы и из-за высокой заболеваемости (64,3 млн человек в мире) рассматривается в качестве неинфекционной "эпидемии" [253][254]. Количество пациентов с ХСН за период с 2002г по 2017г выросло на 2,1%, с ХСН III-IV функционального класса (ФК) — на 1,3% [255], что обусловлено демографическим старением населения, улучшением выживаемости после перенесенного ИМ, а также улучшением лечения пациентов с установленным диагнозом ХСН. СН по-прежнему ассоциирована с высокой частотой госпитализаций и смертностью, что приводит к финансовым затратам, представляющим собой огромное бремя для системы здравоохранения [256]. Около 50% пациентов с ХСН имеют сниженную и около 50% — умеренно сниженную и сохраненную ФВ ЛЖ, при этом более половины пациентов с ХСН — это лица женского пола.
Патогенетическая связь артериальной жесткости и клиническая значимость при ХСН
За последнее десятилетие понимание патофизиологии ХСН улучшилось, но остается ряд вопросов, требующих уточнения, особенно при СНсФВ. Современная парадигма развития этого фенотипа предполагает, что сопутствующие заболевания, такие как ожирение, АГ, СД и хроническая обструктивная болезнь легких, индуцируют системное воспаление, в т.ч. и в эндотелии, в результате чего ослабевает активность внутриклеточной сигнальной оси цГМФ-PKG, играющей ключевую роль в поддержании нормальной диастолической функции миокарда с последующим развитием концентрического ремоделирования ЛЖ, сосудистой жесткости и диастолической дисфункции [257][258]. На основании этих патофизиологических соображений и немногочисленных данных клинических исследований предполагается, что артериальная жесткость, рассматриваемая как часть сложной сети воспалительных и атерогенных путей, способствующих снижению эластичности и податливости артериальной стенки, играет ключевую роль в развитии и прогрессировании СН, в частности, СНсФВ [259-262].
В настоящее время обсуждается негативный вклад артериальной жесткости в развитие и прогрессирование ХСН и в процессы ремоделирования сердца у лиц старшего возраста [12][263].
Выявленные ассоциативные связи между CAVI, тяжестью течения ХСН и ФВ ЛЖ позволяют предположить целесообразность использования этого индекса при стратификации ССР у пациентов с СН [264]. В исследование было включено 120 пациентов (87 женщин, средний возраст 81,3±4,2 лет) с ХСН. АГ зарегистрирована у 99%, ИБС — у 70%, СД 2 типа — у 18,3%, фибрилляция предсердий — у 53% пациентов. В основном пациенты были отнесены к ФК II (52,2%) и III (44,2%). Сохраненная ФВ ЛЖ зарегистрирована у 78%, умеренно сниженная — у 12%, низкая — у 10% пациентов. Наибольшее значение CAVI на правых и левых конечностях выявлялось в группе пациентов с ХСН IV ФК и было выше на 0,57 единиц, чем в группе пациентов с ХСН II ФК (р=0,035), на 1,02 единиц — чем у пациентов с ХСН III ФК (р=0,041). Установлена связь ФК ХСН с CAVI (р=0,001). При проведении сравнительной оценки показателей эхокардиографии в двух группах пациентов, в зависимости от отрезного значения CAVI до 7,8 единиц ("нормальные" сосуды) или >7,8 единиц ("жёсткие" сосуды) обнаружена взаимосвязь ФВ ЛЖ с CAVI (р=0,001).
Значение CAVI было значительно выше у пациентов, госпитализированных по поводу СНсФВ (10,4 (98-110)), по сравнению с пациентами из группы контроля (9,2 (81-100), p<0,001) [265], а отрезной уровень CAVI ≥10 (чувствительность 74,0%, специфичность 72,7%) в 9,76 раз повышал шансы госпитализации пациентов с СНсФВ (ОШ 9,76). Многомерная логистическая модель подтвердила связь госпитализаций пациентов с СНсФВ с повышенным уровнем CAVI (OШ 6,76, 95% ДИ: 2,28-20,10, p<0,001), что может быть использовано в качестве дополнительного предиктора неблагоприятного исхода в этой когорте пациентов.
Риск развития ССО, прогностическая значимость
Крупнейшее на сегодняшний день проспективное исследование (n=2932) предсказательной способности артериальной жесткости в отношении неблагоприятных ССС показало, что значение CAVI ≥9,5 ассоциировано с высоким риском смерти от любой причины и СН при госпитализации (ОШ 3,38, 95% ДИ: 1,42-8,01, р=0,005) [40].
В проспективном наблюдательном исследовании с участием 557 госпитализированных пациентов с ХСН [266] точное пороговое значение CAVI для прогнозирования инсульта составило 9,64. Пациенты с высоким значением индекса (CAVI ≥9,64, n=111, 19,9%) были старше (73,0 vs 65,5 лет, р<0,001), среди них чаще встречались лица мужского пола (73,9% vs 61,4%, р=0,015), пациенты с ИБС (47,7% vs 36,1%, р=0,024) и СД (54,1% vs 37,4%, р=0,001), чем в группе с CAVI <9,64 (n=446, 80,1%). Анализ Каплана-Майера показал, что частота инсультов после выписки из стационара была выше в группе пациентов с высоким, чем в группе с низким значением CAVI (р=0,005). Согласно многофакторному анализу пропорциональных рисков Кокса высокий CAVI оказался независимым предиктором инсульта у пациентов с СН (скорректированное ОШ 3,599).
В исследовании Watanabe K, et al. подтверждена связь повышенного значения CAVI со снижением физической работоспособности и высокой частотой ССС у пациентов (n=223), госпитализированных в связи с декомпенсацией ХСН [267]. Пороговое значение CAVI для прогнозирования пикового потребления кислорода (VO2) <14 мл/кг/мин составило 8,9 (ОШ 2,343, р=0,045). Пациенты с высоким значением индекса (CAVI ≥8,9, n=78) были старше по возрасту (69,0 vs 58,0 лет, р<0,001) и имели более низкий ИМТ (23,0 vs 24,1 кг/м2, р=0,013), чем пациенты с CAVI <8,9 (n=145). Частота ССС (медиана наблюдения 1623 дней) была выше в группе пациентов с высоким, чем с низким CAVI (р=0,004), а высокий CAVI оказался независимым предиктором ССС (ОШ 1,845, р=0,035) у пациентов с СН.
Влияние нелекарственных/лекарственных методов на артериальную жесткость
Для разработки терапевтических подходов активно используется патофизиологическое фенотипирование пациентов с СНсФВ, основанное на наличии: (1) диастолической дисфункции ЛЖ, (2) систолической патологии ЛЖ, (3) артериальной жесткости, (4) предсердной недостаточности, (5) дисфункции правого желудочка, (6) регургитации трикуспидального клапана и (7) хронотропной недостаточности. С учетом каждого конкретного фенотипа изучаются различные потенциальные варианты лечения, такие как антифиброзные препараты, ангиотензиновых рецепторов и неприлизина ингибиторы (АРНИ), ингибиторы натрий-глюкозного ко-транспортера 2 типа, диуретики, почечная денервация и др. [268-270].
Пилотное исследование по оценке влияния АРНИ на сосудистую жесткость показало благоприятный эффект этой группы препаратов на протяжении 12 нед. лечения у пациентов с СН и сниженной ФВ ЛЖ [271]. Улучшение показателей сосудистой жесткости при приеме АРНИ объясняется снижением уровня АД, провоспалительных цитокинов (фактора некроза опухоли (ФНО)-α) и интерлейкина (IL)-18, выработкой эндогенных вазодилатирующих пептидов и восстановлением нейрогуморального дисбаланса [272][273].
Снижение CAVI (р<0,05) наблюдалось и на фоне лечения ингибиторами натрий-глюкозного ко-транспортера 2 типа пациентов (n=184, средний возраст 66,0±14,4 года) с СНсФВ и СД (р<0,05). Кроме того, при множественной регрессии выявлены статистически значимые ассоциации между изменением CAVI и инсулинорезистентностью [274].
Независимая связь между CAVI и саркопенией подтверждена в ретроспективном наблюдательном исследовании с участием 100 пациентов (62 лиц мужского пола) в возрасте 65 лет и старше с СН [275]. Значение CAVI было выше у пациентов с ХСН и саркопенией (11,31±2,58), чем у пациентов без саркопении после поправки на возраст, пол, фибрилляцию предсердий и ишемическую кардиомиопатию. Пациенты с саркопенией были старше (80,0 vs 75,0 лeт, р<0,01) и имели более низкий ИМТ (19,3 кг/м2 vs 22,5 кг/м2, р<0,01), чем без саркопении. Возраст, сила хвата по динамометрии, результат теста с 6-минутной ходьбой (6МТХ) влияли на значение CAVI, а 6МТХ оказался независимым фактором изменения CAVI. Поскольку саркопения рассматривается в качестве маркера неблагоприятного течения при ХСН [276], полученные ассоциации подтверждают вклад низкой физической активности в формирование сосудистой жесткости.
Аналогичные данные, подтверждающие связь значения CAVI с физической активностью и способностью сохранять баланс тела, были получены в исследовании S. Kanzaki, et al. [277] с участием 205 госпитализированных пациентов в возрасте 65 лет и старше (средний возраст 77,0 лет; 140 мужчин). CAVI был выше у пациентов с саркопенией (10,4 [ 9,5; 11,4]), чем без саркопении (9,8 [ 8,9; 10,8]), р=0,004. Возраст, результаты 6МТХ и краткой батареи тестов тесно ассоциировались со значением CAVI (β=-0,142, P=0,047).
Таким образом, изменение сосудистой стенки в виде увеличения ее жесткости возможно рассматривать в качестве усугубляющего фактора неблагоприятного прогноза у пациентов с ХСН, особенно имеющих сохраненную ФВ ЛЖ. Выявленные ассоциативные связи между CAVI, тяжестью течения ХСН и рядом эхокардиографических показателей позволяют предположить целесообразность использования CAVI в качестве маркера сосудистой жесткости для ранней стратификации ССР у пациентов с СН и в качестве предиктора ССС, особенно у пациентов с СНсФВ. В обсуждаемых выше работах использованы разные значения CAVI как для анализа эхокардиографических показателей, так и для оценки неблагоприятных исходов (7,8; 8,9; 9,64; 10 единиц), в связи с чем вопрос о выборе единого значения CAVI, при котором можно утверждать, что сосудистая жесткость превышает норму и ассоциирована с неблагоприятными исходами у пациентов с СН, остается открытым. Снижение функции скелетных мышц и недостаточная физическая активность могут рассматриваться в качестве предикторов сосудистой жесткости у пациентов пожилого возраста с ХСН, а повышение физической активности и упражнения, направленные на тренировку баланса тела, ряд лекарственных препаратов могут способствовать снижению жесткости артерий и улучшению прогноза. В перспективе необходимо проведение крупных контролируемых клинических исследований, которые могут определить значения CAVI, ассоциированного с неблагоприятным течением СН, а также прояснить роль артериальной жесткости у пациентов с СН и сниженной ФВ ЛЖ.
ХБП и артериальная жесткость
В настоящее время заболевания почек признаны одним из основных приоритетов здравоохранения [278]. Согласно проведенным в Российской Федерации эпидемиологическим исследованиям, снижение функции почек у лиц трудоспособного возраста встречается в 16% случаев, а у лиц старше 60 лет — в 36% случаев [279]. ХБП сопряжена с высоким риском развития ИБС, ХСН, различных аритмий и внезапной сердечной смерти [280].
Эндотелиальная дисфункция является основополагающим этапом в патогенезе ССЗ, запуская целый каскад механизмов, приводящих к ремоделированию сосудистой стенки. Многочисленные исследования продемонстрировали тесную связь между эндотелиальной дисфункцией и повышенной жёсткостью артерий и доказали, что одним из основных механизмов развития эндотелиальной дисфункции является системное воспаление [281]. Согласно данным литературы, наиболее значимыми маркерами, ассоциированными с системным воспалением, являются: высокочувствительный С-реактивный белок (СРБ), IL-1β, IL-6, фибриноген, ФНО-α, трансформирующий фактор роста-β. ФНО-α индуцирует выработку IL-6 и способствует повышению уровня СРБ и других белков острой фазы. СРБ влияет на физиологию артериальной стенки и обуславливает развитие эндотелиальной дисфункции в первую очередь за счет ингибирования синтазы NO и повышения выработки эндотелина в эндотелиальных клетках [282]. СРБ стимулирует избыточную выработку молекул клеточной адгезии на эндотелии, активацию фибриногена и синтез эндотелиальными клетками тканевого фактора, влияющего на эластичность сосудистой стенки [283]. Таким образом, благодаря многочисленным вазоактивным свойствам, СРБ способствует усилению жесткости артерий и прогрессированию ССЗ [284]. IL-6 обладает схожим действием и непосредственно стимулирует синтез фибриногена в печени, который способен мигрировать в интиму артерий, что значительно снижает их эластичность. Помимо этого, фибриноген стимулирует пролиферацию гладкомышечных клеток стенки сосудов и миграции в нее макрофагов, что ещё больше усиливает воспалительный процесс [285]. В настоящее время опубликованы результаты многочисленных исследований, согласно которым у пациентов с ХБП наблюдается повышенный уровень маркеров воспаления.
Системное стерильное воспаление при ХБП является многофакторным, возникает из-за накопления уремических токсинов, метаболического ацидоза, снижения почечного клиренса цитокинов; все вышеперечисленное индуцирует окислительный стресс [286]. Уменьшение эластичности сосудистой стенки обусловлено в т.ч. и накоплением в ней асимметричного диметиларгинина (ADMA), являющегося уремическим токсином и обладающим способностью ингибирования всех синтаз NO, что приводит к выработке супероксида, а не NO [286, 287].
Важность активации РААС как фактора, провоцирующего прогрессирование почечных и ССЗ у пациентов с ХБП, очевидна. И ангиотензин II, и альдостерон оказывают множество неблагоприятных воздействий на сердечно-сосудистую систему, в т.ч. способствуя повышению жёсткости артерий [288]. Влияние ангиотензина II на сосудистую стенку обусловлено не только его вазоконстрикторным действием, но и способностью стимулировать продукцию гладкомышечных клеток сосудов, коллагена, матричных металлопротеиназ. Взаимосвязь уровня альдостерона с артериальной ригидностью подтверждена исследованиями, в которых добавление антагонистов минералокортикоидных рецепторов значительно снижало артериальную жесткость [289].
Одним из ключевых аспектов ремоделирования сосудистой стенки при ХБП, особенно на поздних стадиях этого заболевания, является сосудистая кальцификация. Согласно современным данным, кальцификация сосудов широко распространена среди пациентов с ХБП и наблюдается даже у молодых людей с терминальной почечной недостаточностью, у которых отсутствуют типичные ФР ССЗ, такие как дислипидемия и АГ [290]. В основе данного патологического процесса лежит накопление минерального фосфата кальция (гидроксиапатита) в сердечно-сосудистых тканях. Кальцификация сосудов обусловлена сменой фенотипа клеток гладкой мускулатуры сосудов на остеобластоподобные клетки и активацией генов, содействующих минерализации матрицы и отложению кальция. Данный процесс индуцируется гиперкальциемией [291]. Одна из причин сосудистой кальцификации у пациентов с ХБП — это гиперпаратиреоз, который нередко развивается при данной патологии. Согласно данным литературы, чрезмерная активность паращитовидных желез прочно ассоциируется с АГ, миокардиальным фиброзом, повышенной жесткостью артерий и нарушением функции эндотелия [289]. Свой вклад в развитие кальцификации сосудистой стенки вносит и дефицит витамина D. Как известно, активная форма витамина D образуется именно в проксимальных извитых канальцах [292].
Таким образом, с учетом многофакторных патогенетических механизмов, ХБП во многом определяет возникновение и прогрессирование сосудистой жесткости и является ФР преждевременного сосудистого старения. Нужно отметить, что доказано и обратное влияние — сосудистая жесткость способствует развитию ХБП независимо от уровня АД. По данным различных источников, увеличение СПВ на каждый 1 м/с связано с повышением вероятности развития ХБП на 13-36%. В основе патофизиологических механизмов данного явления лежит измененное гемодинамическое воздействие на сосуды почек, которое способствует развитию дисфункции эндотелия и микрососудистой ишемии, приводящих к повреждению почек, что усугубляется имеющимся при повышенной сосудистой жесткости хроническим системным воспалением, окислительным стрессом и активацией РААС (рисунок 3) [293].
Рис. 3 Схема потенциальных патофизиологических процессов развития повышенной сосудистой жесткости у пациентов с ХБП.
Примечание: РААС — ренин-ангиотензин-альдостероновая система, ХБП — хроническая болезнь почек.
Исследование сосудистой жесткости у пациентов с ХБП с помощью определения CAVI в последние годы становится приоритетным направлением. Доказано, что CAVI коррелирует с расчетной СКФ, соотношением альбумина креатинина в моче [37]. Согласно данным Takashi Hitsumoto, при обследовании 460 пациентов в возрасте 74±12 лет с ХБП с СКФ от 15 до 59 мл/мин/1,73 м2 и без анамнеза ССС показано, что за период наблюдения (медиана 60,1 мес.) серьезные неблагоприятные ССС произошли в группе пациентов с CAVI <9 в 8,0% случаев, при значении CAVI от 9 до 10 в 15,6%, а при уровне CAVI >10 в 32,3%. Пороговое значение CAVI равное 9,7 с наибольшей чувствительностью и специфичностью ассоциировано с развитием неблагоприятных ССС [294]. Таким образом, изучение CAVI у пациентов с ХБП является актуальной задачей, позволяющей выявить изменения сосудистой жесткости на раннем этапе, что во многом позволит предупредить развитие и прогрессирование ССЗ.
КН и артериальная жесткость
Патогенетическая связь сосудистой жесткости и КН
В основе взаимосвязи между повышением артериальной жесткости и нарушением когнитивного функционирования могут лежать несколько возможных механизмов [34]. Во-первых, повышение жесткости сосудистой стенки способно вести к поражению вещества головного мозга, ассоциированному с КН, в частности к возникновению зон ишемии и дезорганизации белого вещества [81][295]. Это связано с тем, что ригидные кровеносные сосуды теряют свойства амортизации пульсового давления, в результате чего интенсифицируется повреждающий эффект пульсирующего потока крови на уровне сосудистого ложа мозга, включая сосуды небольшого калибра и капилляры, и приводя в дальнейшем к рарефикации сосудистой сети и снижению перфузии [81]. Так, согласно данным экспериментальных исследований, локально индуцированное изолированное повышение пульсативности кровотока оказывает существенное неблагоприятное влияние на структуру и функцию микрососудов головного мозга [296].
В условиях роста пульсового давления на фоне повышения артериальной жесткости в ответ на гемодинамические сдвиги в просвете сосуда развивается реакция эндотелия, состоящая в продукции свободных радикалов ввиду активации эндотелиальной НАДФ-оксидазы и находящая в дальнейшем своё отражение в оксидативном стрессе, нейродегенерации и формировании очагов глиоза [297, 398]. Как предполагается, данные процессы реализуются при участии паттерн-распознающих рецепторов (pattern recognition receptors, PRRs), к группе которых относятся Toll-подобные (Toll-like receptors, TLRs) и NOD-подобные рецепторы (NOD-like receptors). Паттерн-распознающие рецепторы присутствуют в микроглии и вовлечены в сигнальные пути, ассоциированные с провоспалительным ответом [297, 299]. Такие рецепторы способны взаимодействовать не только с чужеродными структурными элементами патогенных микроорганизмов, поступающих извне, но и с молекулярным материалом собственной внутренней среды организма, который может служить триггером повреждения тканей, а также непосредственно с эндогенными молекулами, высвобождающимися при клеточном разрушении [297]. Данные рецепторы могут связываться, в частности, с активными формами кислорода, образующимися эндотелиоцитами в условиях повышения ригидности артерий и тем самым инициировать дополнительный механизм повреждения непосредственно на уровне вещества головного мозга [297].
Следует отметить, что повышение артериальной жесткости служит одним из проявлений артериолосклероза, заключающегося в патологическом утолщении стенки сосуда за счет гиалиноза и/или фибромышечной гиперплазии, сужении и стенозировании просвета, и на уровне головного мозга рассматривается как один из вариантов болезни малых сосудов [300].
Развитию эндотелиальной дисфункции в условиях повышения артериальной жёсткости [301] сопутствует нарушение проницаемости гематоэнцефалического барьера: по данным экспериментальных исследований, в условиях индуцированной кальцификации сонных артерий повышенная концентрация красителя флуоресцеина натрия обнаруживалась в секционном материале гиппокампа.
Представленные выше потенциальные механизмы взаимосвязи повышенной артериальной жёсткости с КН и поражением вещества головного мозга также в известной степени иллюстрируют сложность и комплексность процессов, которые, взяв своё начало на уровне сосудистой стенки, ведут к глубоким структурно-функциональным нарушениям на уровне вещества головного мозга. Это подтверждается и имеющейся доказательной базой. Так, в Корейском исследовании [302] с участием здоровых лиц в возрасте 30-59 лет жесткость артерий по данным CAVI статистически значимо ассоциировалась с наличием болезни малых сосудов головного мозга, включая наличие очагов гиперинтенсивности белого вещества (по сути зон демиелинизации), церебральные микрокровоизлияния и бессимптомные ("немые") лакунарные инфаркты. В другом исследовании [303] продемонстрировано, что повышенная артериальная ригидность по данным анализа кфСПВ ассоциируется с бóльшим объемом очагов гиперинтенсивности белого вещества и повышенным сосудистым сопротивлением у пожилых лиц. Это позволяет выдвинуть предположение о том, что взаимосвязь между жесткостью аорты и нарушением памяти может опосредоваться микрососудистым ремоделированием и микрососудистым повреждением [303].
Сосудистые нарушения также приводят к появлению дефектов в клиренсе продуктов обмена и токсических веществ в головном мозге, что в конечном счете активирует нейродегенеративные процессы с развитием соответствующего типа КН (нейродегенеративные КН) [304]. Согласно литературным данным [305], артериальная жесткость напрямую ассоциирована с отложением β-амилоида в веществе головного мозга пациентов как у пациентов с болезнью Альцгеймера, так и у больных с легкими КН и лиц без деменции [297].
Таким образом, можно сделать вывод [297] о том, что повышенная жесткость артерий и ассоциированный с ней рост пульсового давления на уровне центральной нервной системы через механизмы окислительного стресса, воспаления, нарушения клиренса продуктов обмена и прямого повреждающего действия, негативно влияют на микроциркуляцию, нарушают перфузию и приводят к дефектам функционирования гематоэнцефалического барьера, в итоге клинически выражаясь в развитии КН.
Клиническая значимость и влияние на прогноз сосудистой жесткости как ФР КН
В литературе имеются работы, доказывающие, что артериальная ригидность, оценивавшаяся по CAVI, оказывает отрицательное влияние на когнитивное функционирование. Во всех подобных исследованиях принимали участие пожилые лица, проживающие вне домов долговременного ухода (домов престарелых). В первом из них [306] в рамках кросс-секционного дизайна анализировалось состояние управляющих функций у 126 лиц японцев (средний возраст 73,2±6,1 лет, 67,5% составляли женщины). Когнитивный статус оценивался посредством тестов категориальных и литеральных ассоциаций (Category Word Fluency Test и Letter Word Fluency Test) и теста замены цифровых символов (Digit Symbol Substitution Test). В унивариантном корреляционном анализе более высокие средние значения CAVI коррелировали с более низкими значениями в тесте категориальных (r= -0,21, p=0,020) и литеральных ассоциаций (r=-0,32, p=0,001) и тесте замены цифровых символов (r= -0,31, p<0,001). При многофакторном линейном регрессионном анализе более высокий средний CAVI ассоциировался с более низкими результатами в тесте литеральных ассоциаций (β=-0,21, p=0,046).
В другом исследовании [34] также кросс-секционном по дизайну анализировались данные 179 пациентов азиатской расы (средний возраст 73-74 года, 84 человека — мужчины). Когнитивное функционирование оценивалось по КШОПС. Все участники были разделены на две группы в соответствии с суммарным баллом по данной шкале (≤26 и >26), после чего выполнялся множественный регрессионный анализ. При многомерном логистическом регрессионном анализе среди прочего было обнаружено, что более низкие значения CAVI статистически значимо ассоциировались с более высоким баллом по КШОПС (ОШ 0,68, 95% ДИ: 0,48-0,96, p=0,03).
В проспективном исследовании Yamamoto N, et al. [307] изучалась взаимосвязь между значениями CAVI и когнитивным функционированием у пожилых больных азиатской расы (n=117, средний возраст 78-81 год). Период наблюдения составлял 4 года. Когнитивные функции оценивались по КШОПС и по опроснику Hasegawa Dementia Scale Revised (HDS-R). Согласно значениям CAVI все участники были поделены на две группы — (1) значения индекса ≥10 (признаки выраженного атеросклеротического поражения сосудистого русла) и (2) значения индекса <10 (признаки тяжелого атеросклероза отсутствуют). В результате установлено, что снижение балла по HDS-R и КШОПС через 4 года было статистически значимо более выражено в группе 1 (исходный CAVI ≥10) по сравнению с группой 2 (исходный CAVI <10) — соответственно, -1,8±4,4 vs 0,3±2,8 баллов (p=0,008) и -1,1±3,0 vs 0,1±2,3 баллов (р=0,03).
Таким образом, опираясь на данные представленных исследований, можно говорить о том, что повышенная жесткость магистральных артерий может ассоциироваться со снижением когнитивных функций, в частности с нарушением управляющих функций.
Влияние терапевтических подходов на сосудистую жесткость в аспекте когнитивного функционирования
При рассмотрении терапевтических подходов по влиянию на сосудистую жесткость, а через неё на КН, следует подчеркнуть, что изолированное влияние только лишь на один из ассоциированных с КН факторов (жесткость артериального русла) в отсутствии контроля над прочими общепризнанными предикторами [308], входящими в группу сосудистых факторов, как то повышенное АД, дислипидемия, отсутствие целевых значений углеводного обмена в условиях сопутствующего СД 2 типа, отсутствие рациональной тактики антикоагулянтной терапии в условиях сопутствующей фибрилляции предсердий, не будет иметь успеха или по крайней мере не позволит достичь той же эффективности, которую имеет комплексный подход реализующий воздействие медикаментозными и немедикаментозными методами на известные ФР когнитивного снижения [308]. Кроме того, на сегодняшний день отсутствуют данные специально спланированных исследований, в которых одновременно оценивалось бы влияние того или иного терапевтического подхода на сосудистую жесткость и когнитивный статус, а также проводился бы анализ возможной взаимосвязи между ними [297][304]. В силу этого представленные ниже данные касаются либо возможностей терапевтических интервенций в настоящее время снижать жёсткость сосудистого русла, либо потенциала подобных подходов в отношении улучшения когнитивного статуса, и при этом следует отметить, что как правило подобные данные были получены в рамках различных исследований, а не одной специально спланированной работы, в связи с чем возможный вклад уменьшения сосудистой жесткости в улучшение когнитивного статуса оценить объективно не представляется возможным.
Антигипертензивные препараты
Антигипертензивные препараты доказали свои возможности в снижении жесткости магистральных артерий. В 2023г был опубликован метаанализ [309] 76 исследований с периодом наблюдения не менее 6 мес. по влиянию антигипертензивных препаратов на жесткость сосудистой стенки у пациентов с АГ. В рамках него показано, что в условиях повышения жесткости артерий благоприятное влияние в виде снижения последней оказывают тиазидные диуретики, иАПФ, блокаторы рецепторов ангиотензина II, комбинация иАПФ или блокатора рецепторов ангиотензина II c антагонистом кальция. Среди разрешенных к применению в настоящее время вариантов комбинированной антигипертензивной терапии наилучшие результаты показало сочетание блокатора рецепторов ангиотензина II и антагониста кальция (авторы рассчитывали показатель SUCRA (surface under cumulative ranking; для подобного варианта терапии SUCRA =78%), а среди монотерапии — использование иАПФ (SUCRA =64%). Следует отметить, что во включенных в данное исследование работах жесткость сосудистого русла в подавляющем большинстве случаев оценивалась по СПВ или ИА, а CAVI использовался лишь в одном исследовании [310], в связи с чем на полученные результаты могли также влиять сопутствующие эффекты на АД.
На сегодняшний день имеются данные, что антигипертензивная терапия в целом способна улучшать когнитивные функции [311-314]. Имеющиеся к настоящему времени результаты исследований позволяют говорить, что на когнитивный статус оказывают благоприятное влияние иАПФ, способные проникать через гематоэнцефалический барьер (каптоприл, фозиноприл, лизиноприл, периндоприл, рамиприл, трандолаприл) [286], антагонисты кальция [316], в особенности нитрендипин [317][318] и диуретики [319-321], в особенности индапамид [322][323]. Однако по всей видимости наибольшим потенциалом в улучшении когнитивного статуса обладают блокаторы рецепторов ангиотензина II, которые по ряду данных [324-327] имеют преимущества над прочими основными классами антигипертензивных препаратов.
Статинотерапия
Эффекты статинов в отношении коррекции жесткости артерий являются предметом дискуссий и заслуживают дальнейшего изучения, но имеющиеся на сегодняшний день данные позволяют говорить о вероятном благоприятном влиянии данных препаратов на жесткость артерий [298][305][328]. В систематический обзор [329] вошли результаты девяти рандомизированных исследований (проведенных в период с 2001 по 2009гг), в которых оценивалось влияние терапии статинами на жесткость артерий, измеряемую по СПВ (как центральной, так периферической). Вместе с тем в исследованиях наиболее часто применялся флувастатин (4 из 9 исследований), а сами работы имели относительно короткий период наблюдения (большинство из них — <1 года) и с небольшим объемом выборки (минимум — 20 человек, максимум — 85). Данный систематический обзор показал, что положительный эффект терапии статинами в виде снижения ригидности артерий наблюдался в большинстве исследований, в которых последняя оценивалась по периферической (плече-лодыжечной) СПВ; однако, когда жесткость артерий измерялась центрально (СПВ в аорте), то статистически значимое снижение жесткости отмечалось только в половине исследований.
В более позднем метаанализе [328] также изучалось влияние статинов на сосудистую жесткость, которая оценивалась по кфСПВ. В метаанализ вошли 6 рандомизированных контролируемых исследований, аналогичным образом с весьма небольшой выборкой пациентов (от 26 до 71 человека) и коротким периодом наблюдения от 0,5 до 6 мес. Из класса статинов пациенты получали симвастатин, розувастатин, ловастатин, флувастатин и аторвастатин. В 5 из 6 исследований было показано статистически значимое благоприятное влияние статинов на жесткость артерий. В результате по итогам метаанализа по сравнению с группой активного контроля или плацебо, в группе терапии статинами наблюдалась более низкая СПВ (стандартизованная разность средних =2,31, 95% ДИ: 1,15-3,45, р для гетерогенности =0,07, I2=93%).
Нейропротективный эффект статинов также является предметом дискуссий: наблюдательные исследования подтверждают положительный эффект применения статинов в отношении снижения риска когнитивного снижения и деменции, в то время как результаты рандомизированных исследований в известной степени недостаточно убедительны [330]. Эти расхождения отчасти объясняются тем, что большинство рандомизированных исследований проводились с участием пожилых лиц и имели относительно короткий период наблюдения. Подобные факты позволяют предполагать, что эффект статинов может быть более выражен при их назначении на более ранних стадиях КН [297].
В 2021г вышел новый систематический обзор [331], посвященный влиянию статинотерапии в отношении когнитивного функционирования. В обзор были включены 24 исследования (21 — проспективное наблюдательное и 3 — рандомизированные контролируемые), объединившие 1404459 участников в возрасте 60 лет и старше. Во всех трех включенных в обзор рандомизированных исследованиях (период наблюдения от 3,2 до 5,6 лет) не было обнаружено статистически значимого влияния препаратов на когнитивный статус. Период наблюдения в обсервационных исследованиях составлял от 3 до 15 лет. 10 обсервационных исследований показали снижение заболеваемости деменцией на фоне применения статинотерапии. В 7 исследованиях не было выявлено статистически значимого влияния данных препаратов на риск возникновения деменции. В 3 исследованиях снижение когнитивных функции было сопоставимым в группе применения статинов и в группе сравнения, в 1 работе — более медленным при применении статинов по сравнению с контрольной группой.
В более позднем систематическом обзоре и метаанализе [332], объединившем в общей сложности 46 наблюдательных исследований (количество участников варьировало от 123 до 2004692), изучалась взаимосвязь между применением статинов и риском деменции и болезни Альцгеймера. В объединенном анализе статины ассоциировались со снижением риска развития деменции (36 исследований, ОШ 0,80, 95% ДИ: 0,75-0,86) и болезни Альцгеймера (21 исследование, ОШ 0,68, 95% ДИ: 0,56-0,81). Авторы не выявили различий в наступлении конечных точек между пациентами, получавшими липофильные статины (аторвастатин, симвастатин, ловастатин и флувастатин) и гидрофильные (розувастатин и правастатин). В отличие от этого применение высокоинтенсивной статинотерапии (с использованием согласно дизайну публикации аторвастатина или розувастатина или симвастатина) демонстрировало тенденцию (р=0,05) к более выраженному снижению риска развития деменции (-20%) по сравнению с использованием низкоинтенсивных стратегий (-16%; иные препараты из класса сатинов).
Новые и разрабатываемые стратегии терапии
К перспективным методам коррекции сосудистой жесткости относится использование ингибиторов ФНО-α, антагонистов рецепторов эндотелина А, препаратов, разрывающих поперечные "сшивки" в конечных продуктах гликирования белков (advanced glycation end product cross-link breakers), однако эффективность подобных стратегий в отношении сосудистой жесткости находится еще на стадии изучения, а их влияние на когнитивный профиль требует проведения специально спланированных исследований, которые в настоящее время отсутствуют [297].
Дополнительные материалы
В доступной литературе имеются исследования, подтверждающие взаимосвязь неблагоприятного влияния сосудистой жесткости на когнитивное функционирование. Вместе с тем среди доступных исследований присутствуют единичные публикации [333-337], где подобной взаимосвязи обнаружено не было либо она прослеживалась у отдельных категорий пациентов. Следует отметить, что в данных работах не использовался CAVI, вместо него в качестве характеристики артериальной жесткости использовалась преимущественно СПВ, а также ЛПИ, ИА и пульсовое давление. Подобные факты диктуют необходимость проведения масштабных специально спланированных исследований с расчетом CAVI как показателя, значимо не зависящего от уровня системного АД и тем самым оценивающего "чистую" сосудистую ригидность, для детальной характеристики предиктивной значимости повышения артериальной жесткости в отношении когнитивного статуса.
В систематическом обзоре и метаанализе Pase МР, et al. [81] изучалась взаимосвязь между жесткостью магистральных артерий и снижением когнитивного функционирования согласно результатам тестирования по КШОПС. В итоговый анализ вошло четыре проспективных исследования (n=3947; средний период наблюдения ~5 лет), в которых в качестве метода оценки артериальной жесткости использовалась кфСПВ. В рассматриваемый метаанализ вошли также данные и Роттердамского исследования [337], в котором за период наблюдения не было продемонстрировано статистически значимых взаимосвязей между артериальной жесткостью и когнитивным статусом, хотя на исходном визите была выявлена статистически значимая ассоциированность между артериальной ригидностью и уровнем когнитивного функционирования. Несмотря на включение в метаанализ [81] данных Роттердамского исследования, по сути с отрицательными результатами, в итоге авторами была обнаружена статистически значимая неблагоприятная предиктивная значимость повышения артериальной жесткости в отношении снижения суммарного балла по КШОПС как при объединенном анализе всех четырех отобранных исследований, включая Роттердамское (β=-0,03, 95% ДИ: -0,06-0,01), так и при исключении одной из работ, формировавших в итоговых результатах выраженную гетерогенность (I2=71,9%, p=0,01), но аналогичным образом с сохранением данных Роттердамского исследования (β=-0,04, 95% ДИ: -0,07 — -0,01, n=3687; I2=9,5%, p=0,33).
Ревматические болезни и сосудистая жесткость
ССЗ являются ведущей причиной смерти при хронических воспалительных (ХВЗ) и аутоиммунных заболеваниях (АИЗ) [338]. При многих таких заболеваниях в популяционных когортных исследованиях выявлено 50% увеличение риска ССС по сравнению с общей популяцией [339-341]. Возможные причины этого в настоящее время обсуждаются. Очевидно, что столь высокую заболеваемость и смертность при этих болезнях невозможно объяснить только значительной распространенностью ФР ССЗ и их вкладом в повышение риска развития ССЗ в целом в популяции [342]. В дополнении к традиционным ФР существенный вклад в развитие ССЗ вносит хроническое воспаление. Наиболее обоснованным является предположение о ведущей роли в прогрессировании сердечно-сосудистого континуума и увеличении риска сердечно-сосудистой заболеваемости и смертности при ХВЗ и АИЗ ускоренного развития атеросклероза сосудов на базе эндотелиальной дисфункции и, особенно, повышенной сосудистой жесткости, являющихся, по сути, обязательными участниками хронического воспалительного и аутоиммунного процессов. Были продемонстрированы основные пути реализации субклинического поражения сосудов при ХВЗ и АИЗ, такие как лейкоцитарная инфильтрация, повышение продукции провоспалительных цитокинов, миграция макрофагов, пролиферация гладкомышечных клеток, секреция протеаз, обнажение коллагена, предрасполагающее к тромбообразованию, а также высвобождение из фагоцитов миелопероксидазы, что приводит к прогрессированию атеросклероза [343]. По результатам UK Biobank study, в котором разными методами оценивалась жесткость сосудистой стенки у 171125 участников, из которых у 5976 пациентов имелись ХВЗ (ревматоидный артрит (РА), системная красная волчанка (СКВ), синдром Шегрена, псориаз, анкилозирующий спондилоартрит, системные васкулиты и воспалительные заболевания кишечника), было показано, что наличие ХВЗ ассоциировано с 14% повышением показателей артериальной жесткости (р=0,002). Средние показатели артериальной жесткости повышались в соответствии с тертилями уровней биомаркеров воспаления, так было отмечено 11% повышение в первой тертили, 17% во второй тертили и 21% в третьей тертили уровня лейкоцитов [344].
Как в этом исследовании, так и во многих других использовались разные методы оценки артериальной жесткости. Чаще всего это была СПВ и ИА, реже определялись индекс жесткости аорты и CAVI. Как известно, именно параметры СПВ определяют наличие повышенной сосудистой жесткости в категории поражения органа-мишени и считаются независимым предиктором развития ССС и общей смертности, что и определило использование этого показателя в подавляющем большинстве исследований. Считается, что CAVI коррелирует с СПВ, но менее зависит от уровня АД [2].
Основные результаты исследований артериальной жесткости при ХВЗ и АИЗ получены в следующих нозологиях: РА, СКВ, синдром Шегрена, псориаз, анкилозирующий спондилит.
РА. Только в 2-х из множества исследований сосудистой жесткости при РА не было обнаружено ее взаимосвязи с заболеванием в сравнении с контролем. В остальных исследованиях такая взаимосвязь была установлена. Так, было показано, что СПВ при РА была достоверно выше, чем в контроле (8,2±2,1 vs 7,4±1,4 м/с, p=0,016) [345]. ИА также был достоверно выше у больных РА по сравнению со здоровыми лицами (32,2±8,6 vs 28,4±8,9%, P=0,02) [346]. Схожие результаты были получены и в других исследованиях [347]. В крупном метаанализе 25 исследований 1472 пациентов с РА и 1583 пациентов в группе контроля СПВ была выше у пациентов с РА на 1,32 м/с (P<0,00001) [348]. В другом метаанализе 38 исследований, включающих 2733 пациента с РА и 2416 в группе контроля, установлено, что пациенты с РА имеют достоверно большие показатели СПВ и ИА [349]. Среди характеристик пациентов, влияющих на артериальную жесткость, авторы выделяют длительность болезни (>2 лет) [350][351], активность процесса [347][355], серонегативный вариант РА [356], категорию ССР [354, 355].
СКВ. Практически во всех, кроме двух исследований сосудистой жесткости при СКВ, были обнаружены достоверно более высокие показатели жесткости по сравнению с группой контроля, даже у пациентов молодого возраста [356]. Из характеристик, влияющих на жесткость при этом заболевании, отмечаются категории ССР, но не активность процесса [357]. Более высокие показатели жесткости выявляются у пациентов с СКВ в сочетании с антифосфолипидным синдромом, а также при наличии антител к β2-гликопротеину 1 [358][359].
Синдром Шегрена. В нескольких публикациях продемонстрирована связь показателей артериальной жесткости и синдрома Шегрена, при котором имеется преимущественное поражение слюнных и слезных желез. В крупном исследовании у женщин с первичным синдромом Шегрена СПВ была достоверно выше, чем в группе контроля (8,2±1,5 vs 7,5±1,4 м/с; p=0,01) [360][361]. При синдроме Шегрена артериальная жесткость была ассоциирована с традиционными ФР (возрастом, АД, липопротеидами низкой плотности), но не с характеристиками самого синдрома и его активностью, что требует дальнейшего изучения [362]. Хотя при синдроме Шегрена поражение сердца бывает крайне редко, тем не менее в этой когорте пациентов удалось выявить диастолическую дисфункцию и левожелудочковую радиальную и продольную деформацию миокарда методом STRAIN, ассоциированные с артериальной жесткостью [363][364].
Псориаз и псориатический артрит. Во всех исследованиях артериальной жесткости у пациентов с псориазом и псориатическим артритом, кроме одного, были выявлены достоверно более высокие параметры артериальной жесткости, чем в группе контроля [364-366]. Особый интерес представляют данные о том, что повышенная артериальная жесткость напрямую была связана не с длительностью самого псориаза, а с длительностью псориатического артрита [367].
Анкилозирующий спондилоартрит. В метаанализе 35 исследований, включавших 1535 пациентов с анкилозирующим спондилоартритом и группу контроля в количестве 1347 человек было выявлено значительное и достоверное повышение значений СПВ у пациентов с данным заболеванием [368], в других исследованиях тот же результат был получен и при определении ИА [369][370]. В отличие от других заболеваний при анкилозирующем спондилоартрите была выявлена ассоциация артериальной жесткости и активности заболевания [369, 371].
Системные васкулиты. Большое число исследований и метаанализов при системных васкулитах (болезнь Такаясу, гигантоклеточный артериит/ревматическая полимиалгия, болезнь Кавасаки, ANCA-ассоциированный васкулит) позволило выявить связь этих заболеваний как с повышенным ССР, так и с выраженностью артериальной жесткости по показателю СПВ [372].
Таким образом, в настоящее время имеются доказательства связи ХВЗ и АИЗ с повышенной артериальной жесткостью. Эту связь невозможно объяснить только наличием ФР ССЗ и поражений органов-мишеней. Не до конца ясно как при этих заболеваниях на формирование повышенной жесткости сосудов и ускоренного сосудистого старения влияет активность заболеваний и их продолжительность. Также недостаточно данных и о других характеристиках воспалительных заболеваний и их взаимоотношений с традиционными ФР, что требует дальнейшего изучения. Тем не менее становится очевидным, что у больных с ХВЗ и АИЗ определение ССР целесообразно проводить не только на основании традиционных ФР, но с определением показателей сосудистой жесткости (СПВ, ИА и CAVI).
Онкологические заболевания
ССЗ и онкологические заболевания занимают лидирующие позиции среди причин смертности взрослого населения в мире. Несмотря на доказанную эффективность, противоопухолевые препараты могут вызывать тяжелые осложнения со стороны сердечно-сосудистой системы. В последнее время появляются данные о потенциальных вазотоксических эффектах противоопухолевых препаратов, что проявляется возникновением и/или прогрессированием АГ, ИБС и заболеваний периферических артерий, развитием микроваскулярной и вазоспастической стенокардии, формированием венозного или артериального тромбоза [373, 374]. При этом важно отметить, что артериальная жесткость все чаще признается суррогатным показателем, повышение которой ассоциируется с ССЗ и важным сосудистым исходом, который следует учитывать [375]. Противоопухолевые препараты, включая антрациклины, алкилирующие агенты и ингибиторы эндотелиального фактора роста сосудов, а также лучевая терапия, ассоциируются с прямым повреждением артерий и повышенным риском неблагоприятных сосудистых исходов, которые могут возникнуть уже после первого курса лечения и сохраняться в течение всей жизни [376]. Результаты недавних исследований по изучению сосудистой токсичности химио- и таргетной терапии позволили выдвинуть на первый план острую необходимость постоянного наблюдения за состоянием артерий во время и после лечения для того, чтобы при необходимости могла быть своевременно предписана эффективная первичная или вторичная медикаментозная профилактика [377]. Поражение сосудов может стать непрямым следствием самого онкологического заболевания, общем воспалительном ответе эндотелия сосудов в ответ на неопластический процесс, и результатом противоопухолевого лечения, а также в связи со снижением физической активности, гиперлипидемией, СД, ожирением, гипотиреозом, ХБП. Эти ФР усугубляют вазотоксичное влияние химиотерапии. Поэтому пациентам, перенесшим онкологическое заболевание, рекомендуется профилактика поражения сосудов [378]. Эти мероприятия должны основываться на Российских национальных рекомендациях по кардиоваскулярной профилактике 2022г [240]. Точные патофизиологические механизмы повышения жесткости артерий после химиотерапии в настоящее время изучены недостаточно; однако можно предположить, что многие из тех же механизмов, которые способствуют жесткости артерий в ответ на старение и различные ССЗ, также встречаются у больных раком, получающих системную противоопухолевую терапию. Как нормальное старение, так и прогрессирование ССЗ связаны с ремоделированием сосудистого матрикса [379-381]. Одним из ключевых механизмов развития вазотоксичности химиопрепаратов является эндотелиальная дисфункция — нарушение синтеза эндотелиальных факторов, приводящее к дисбалансу вазоконстрикторной и вазодилатирующей регуляции сосуда, нарушению сосудистого тонуса, повышению жесткости сосудов [382]. Кроме того, эндотелиальная дисрегуляция тонуса гладкой мускулатуры сосудов в результате увеличения количества свободных радикалов кислорода и гиперэкспрессии воспалительных цитокинов способствует дисбалансу внутриклеточных оксидантов и антиоксидантному дисбалансу, тем самым вызывая окислительный стресс [383, 384]. В ответ на усиление окислительного процесса в сосудистом эндотелии контроль NO в гладких мышцах сосудов снижается. Кроме того, окислительный стресс вызывает внутриклеточное повреждение эндотелия и гладкомышечных слоев сосудов за счет повреждения ДНК, перекисного окисления липидов и изменения ключевых клеточных сигнальных путей. Эти изменения могут вызывать воспаление, некроз и апоптоз, если повреждение достаточно значительное [385][386]. Окислительное повреждение в сочетании с повышением воспалительных цитокинов также приводит к аномальной продукции коллагена и снижению продукции нормального эластина. Такие изменения в балансе сосудистых структурных белков вызывают потерю эластичности и повышение жесткости артерий [387]. В ряде случаев противоопухолевые препараты активируют процессы периваскулярного фиброза, оказывают проатерогенное действие, способствуя развитию бессимптомной периферической артериальной окклюзионной болезни (ПАОБ) нижних конечностей [388]. Кроме того, хорошо известно, что повышенное АД может существенно влиять на жесткость артерий и, следовательно, должно учитываться при интерпретации изменений артериальной жесткости [389]. Повышенная жесткость артерий имеет значение для прогноза у пациентов, поскольку она связана со смертностью от всех причин и фатальными/нефатальными сердечно-сосудистыми исходами (например, ИМ, инсультом, реваскуляризацией, гипертонией и СН) и, таким образом, все чаще используется для модели стратификации риска при ССЗ [2][390].
В некоторых исследованиях изучались возможности потенциальных терапевтических вмешательств для восстановления эластичности артерий у стареющих людей и снижения жесткости у онкологических пациентов. Сообщалось о повышении растяжимости сонных артерий и снижении их жесткости у мужчин и женщин среднего и старшего возраста после занятия аэробикой средней и высокой интенсивности [391, 392] и антиоксидантных добавок, витаминов С и Е [393, 394]. В этих исследованиях показано, что витамин Е и неорганические нитраты снижают СПВ у пациентов с АГ и у пожилых людей с повышенным риском ССЗ. Было доказано, что фармакологические агенты, такие как иАПФ, статины, блокаторы рецепторов ангиотензина, снижают жесткость артерий при АГ и терминальной стадии почечной недостаточности [395][396]. Предполагается, что это снижение связано со снижением уровня окислительного стресса и продукции воспалительных цитокинов, повышением биодоступности NO и снижением АД. Однако необходимы дальнейшие комплексные исследования для изучения терапевтических эффектов физических упражнений, антиоксидантов и сердечно-сосудистых препаратов и определения их влияния на жесткость артерий у выживших онкобольных, принимавших противоопухолевую терапию.
Оценка сосудистого риска перед противоопухолевой терапией у пациента является принципиально важной задачей. Для этого необходимо хорошо знать перечень препаратов, которые могут вызывать сосудистую токсичность, особенности течения злокачественных новообразований, при лечении которых они используются, а также клинико-инструментальные проявления потенциального развития вазотоксичности и критерии эффективности противоопухолевой терапии. Эта информация важна для обсуждения с пациентом соотношения риска и пользы лечения, которое по мере необходимости должно проводиться кардиологом и онкологом. Кроме того, выявление пациентов высокого риска вазотоксичности до начала противоопухолевой терапии принципиально важно для проведения им эффективной первичной профилактики, которая должна обеспечить пациенту полноценное противоопухолевое лечение без ограничений в его объеме и продолжительности.
У онкологических пациентов с высоким риском вазотоксичности [397] характерно наличие сопутствующих ССЗ (АГ, ИБС, в т.ч. перенесенный ранее ИМ, нарушения ритма высоких градаций, тромбозы и тромбоэмболии в анамнезе, болезнь Рейно, атеросклероз периферического сосудистого ложа), возраст ≥65 лет, СД, гипотиреоз, а также повышение кфСПВ >10 м/с, снижение ЛПИ <0,8, увеличение толщины интима-медиа сонных артерий >1,0 мм, нарушение эндотелий-зависимой и эндотелий-независимой вазодилатации плечевой артерии, систолическая дисфункция ЛЖ (ФВ ЛЖ <50%), уровень фактора фон Виллебранда >120%, риск вазотоксичности при оценке по шкале ESC Score ≥5 баллов. Кроме того, предрасположенность к вазотоксичности противоопухолевой терапии ассоциируется с наличием у онкологических пациентов таких традиционных ССР, как курение, ожирение, гиперлипидемия, гиподинамия.
Как было отмечено выше, в идеале пациенты с высоким риском любого из описанных типов артериально-сосудистой токсичности должны быть идентифицированы до начала терапии и подвергнуты эффективному первичному профилактическому лечению. Однако в настоящее время практическим врачам могут быть предоставлены лишь редуцированные практические рекомендации, поскольку существующая доказательная база по профилактике вазотоксичности противоопухолевого лечения до настоящего времени ограничена [397].
Что касается мер первичной медикаментозной профилактики вазоспазма, например, у пациентов, которым планируется терапия фторпиримидинами, отнесенных к группе высокого риска на основании анамнеза ИБС, следует назначать сублингвально нитроглицерин и, возможно, даже нитраты длительного действия. Фактически, такие пациенты часто уже принимают нитраты и блокаторы кальциевых каналов и в этой связи они относятся к группе повышенного ССР [397].
Если побочные вазотоксические эффекты у пациентов с ИБС незначительны, не обязательно начинать терапию сосудорасширяющими средствами. Следует также отметить, что профилактическая сосудорасширяющая терапия не всегда предотвращает вазотоксичность фторпиримидинами, поскольку известно, что ее возникновению способствуют и другие, помимо вазоспазма, патогенетические механизмы [398].
Определение пациентов с высоким риском развития периферического вазоспазма может быть более сложным, если у них в анамнезе нет болезни Рейно. У этих пациентов могут быть полезны оценка вазореактивности в исходном состоянии в сочетании с провокационными маневрами. Одним из простых в использовании методов является Endo-PAT (Peripheral Arterial Tonometry — тонометрия периферических артерий). Суть методики заключается в анализе пульсовой волны артерии указательного пальца до и после сжатия манжетой плечевой артерии. По результатам исследования рассчитывается реактивный гиперемический индекс (Reactive Hyperaemic Index — RHI), отражающий наличие или отсутствие эндотелиальной дисфункции периферических артерий. Этот метод тестирования также можно использовать для отслеживания реакции пациентов на сосудорасширяющую и противоопухолевую терапию. Периферическая и коронарная вазореактивность в некоторой степени коррелируют [399].
Таким образом, опосредованное кровотоком расширение плечевой артерии может служить в качестве общей оценки состояния сосудов.
Одним из важных диагностических методов, позволяющих выявить связанные с эндотелиальной дисфункцией и ремоделированием сосудистой стенки структурные и функциональные изменения крупных и мелких сосудов, является объемная сфигмометрия. В основе метода лежит регистрация и анализ пульсовых волн на артериях 4-х конечностей с использованием сфигмоманжет, фонокардиографии и электрокардиографии. CAVI отражает жесткость всего артериального сегмента, состоящего из аорты, бедренных и большеберцовых артерий. Он рассчитывается на основании данных пульсовых волн и индекса жесткости β [400]. Референтные значения CAVI были получены в крупных клинических исследованиях здоровых лиц. Значения CAVI линейно увеличиваются в возрасте от 20 до 70 лет, у мужчин регистрируются более высокие показатели, чем у женщин. Нормальное значение составляет <8,0, повышенное >9,0, значения 8,0-9,0 считаются пограничными [401]. Литературные данные об использовании CAVI в качестве маркера вазотоксичности противоопухолевой терапии немногочисленны. В статье Shimizu N, et al. показана отрицательная динамика CAVI у пациентки с В-клеточной лимфомой, получавшей полихимиотерапию ритуксимабом, циклофосфамидом, доксорубицином, винкристином, преднизолоном (R-CHOP). За 6 мес. наблюдения авторами статьи было выявлено увеличение L- и R-CAVI, в среднем, с 8,8 до 10,5 с последующим снижением этого показателя до 9,0 через 2 мес. после окончания лечения. Повышение CAVI также сопровождалось прогрессированием атеросклероза и появлением новых атеросклеротических бляшек во внутренних сонных артериях, выявленных по данным позитронно-эмиссионной томографии [252].
Метод одновременного измерения АД в бассейнах верхних и нижних конечностей позволяет рассчитать ЛПИ — маркер атеросклеротического поражения артерий нижних конечностей. Определение ЛПИ для своевременного выявления ПАОБ используется у онкологических пациентов, получающих терапию ингибиторами тирозинкиназы. Рекомендовано анализировать этот показатель у больных с хроническим миелолейкозом до начала, через 3 мес. и каждые 6-12 мес. после окончания терапии такими препаратами, как нилотиниб, понатиниб и др. [373]. Данные о частоте возникновения ПАОБ нижних конечностей у больных с хроническим миелолейкозом, принимавших ингибиторы тирозинкиназы (нилотиниб), были получены в проспективных исследованиях Макеевой Л. М. и др. [402] и Hadzijusufovic E, et al. [403]. В первом случае снижение ЛПИ <0,9 и развитие ПАОБ было выявлено у 11% из 97 включенных пациентов. Во втором случае при более длительном наблюдении (2 года) ПАОБ нижних конечностей развилась у 29% больных хроническим миелолейкозом из включенных 36, а через 3,7 лет — у 47%. Авторы обоих исследований предполагают, что ишемия нижних конечностей возникла вследствие дисфункции эндотелия и прогрессирования атеросклероза.
Наличие манжет для измерения АД на больших и указательных пальцах стоп позволяет рассчитать ППИ и оценить состояние периферических артерий нижних конечностей. Одним из клинических проявлений вазотоксичности противоопухолевой терапии является чувство онемения и потеря чувствительности пальцев стоп, которое беспокоит пациентов на протяжении всего периода лечения. Литературные сведения об эффективности анализа ППИ у онкологических пациентов отсутствуют, однако данные проведенного нами исследования показывают снижение этого индекса <0,7 у онкологических пациентов, получающих алкилирующие агенты, в частности препараты платины, и антиметаболиты, что может быть связано с развитием дисфункции эндотелия и периферического вазоспазма [402].
Таким образом, выявление пациентов высокого риска вазотоксичности до начала противоопухолевой терапии принципиально важно для проведения им эффективной первичной профилактики, которая должна обеспечить пациенту полноценное противоопухолевое лечение без ограничений в его объеме и продолжительности. Цель оценки состояния артериального русла до начала химио-, таргетной и лучевой терапии состоит в том, чтобы выявить пациентов с высоким риском сосудистых заболеваний/событий/вазотоксичности, и не лишать их противоопухолевого лечения, а предпринять как можно больше упреждающих, профилактических усилий, направленных на обеспечение оптимальной терапии рака при адекватном контроле за сосудистой системой.
Новая коронавирусная инфекция
Новая коронавирусная инфекция (COVID-19), вызванная SARS-CoV-2, характеризуется полисистемным поражением различных органов и тканей. Для этого заболевания описано развитие системного эндотелиита с эндотелиальной дисфункцией, активацией системы комплемента и склонностью к повышенному тромбообразованию [404][405].
Поражение сосудистой стенки при COVID-19, по-видимому, имеет двойственное происхождение. С одной стороны, описана связь тяжести течения COVID-19 с ССЗ, в т.ч. с АГ, ХСН, а также СД, ожирением и ХБП [406][407]. В связи с этим значительная часть пациентов еще до развития COVID-19 могут иметь эндотелиальную дисфункцию как компонент сердечно-сосудистой патологии. С другой стороны, само действие вируса SARS-CoV-2 приводит к поражению сердечно-сосудистой системы, вследствие патологического системного воспалительного ответа, кардиотоксического действия вируса с развитием миокардита, поражения сосудов микроциркуляторного русла, прямого повреждающего действия вируса на эндотелий сосудов, в т.ч. коронарных артерий, а также тромботических осложнений [408].
Исследования краткосрочного влияния COVID-19 на артериальную жесткость
В ряде работ показано, что для пациентов с острым течением COVID-19 характерны достоверно более высокие уровни артериальной жесткости. В работе Szeghy R, et al. (2021) и Ratchford S, et al. (2021) выявлено повышение ее маркеров (соответственно, аортального ИА и в небольших группах молодых пациентов с COVID-19 без сопутствующих хронических заболеваний и ССЗ по сравнению со здоровыми добровольцами) [409][410]. В исследованиях Schnaubelt S, et al. (2021) и Faria D, et al. (2023) в небольших выборках пациентов с COVID-19 в сочетании с СД и АГ были зарегистрированы достоверно более высокие показатели по сравнению с группой контроля [411][412]. Эти данные, полученные в небольших выборках, подтверждены в более крупных работах. Так, Stamatelopoulos K, et al. (2021) собрали данные трех крупных исследований, рассчитали СПВ из средних значений АД и возраста, и получили новую выборку из сопоставимых по ССР 233 пар сравнения пациентов COVID-19 с группой контроля без COVID-19. В результате было показано, что расчетные значения СПВ у пациентов COVID-19 были достоверно выше, чем у пациентов без COVID-19 [413]. В проспективное нерандомизированное обсервационное исследование COSEVAST были включены 64 пациента, госпитализированных с диагнозом COVID-19 без значимой сопутствующей патологии. Было отмечено нарастание уровня СПВ с нарастанием тяжести COVID-19 даже после поправок на такие факторы, как масса тела, пол, АД и ЧСС [414].
В ретроспективном исследовании Rodilla E, et al. (2021) проанализированы данные 12170 пациентов с COVID-19 (2606 умерших и 9564 выживших) пожилого возраста (67,5 лет). В качестве конечной точки оценивалась общая смертность в течение 50 дней. Была выявлена связь повышенного пульсового давления (≥60 мм рт.ст.) с наступлением конечной точки ОШ 1,27 (р=0,0001) [415].
CAVI у пациентов с COVID-19 исследовался только в двух работах. В турецком исследовании Aydin E, et al. (2021) обследовано 115 пациентов (возраст 65,7±10,7 лет), из которых 65 пациентов с COVID-19 и 50 человек из группы контроля. Выявлены достоверно более высокие значения CAVI (9,6±2,4) у пациентов с COVID-19 по сравнению с группой контроля (8,5±1,1). Более того, показаны различия уровня CAVI у пациентов с различной тяжестью COVID-19. При умеренно-тяжелом и тяжелом течении заболевания CAVI составил 10,8±3,4, при легком 8,8±0,9 (р=0,008), а точки отсечения >8,5 для CAVI на левой руке и >8,75 на правой руке могут использоваться для прогнозирования тяжелого течения COVID-19 [416]. В одномоментном кросс-секционном исследовании Podzolkov V, et al. (2024) приняли участие 174 пациента среднего возраста со среднетяжелым течением COVID-19 и 94 представителей контрольной группы. Выявлен достоверно более высокий уровень CAVI в группе пациентов с коронавирусной инфекцией, который достигал уровня "серой зоны" (≥8). При проведении множественной логистической регрессии была выявлена достоверная независимая от возраста, наличия АГ и СД, уровня глюкозы в плазме и СКФ взаимосвязь между повышением CAVI и наличием COVID-19 (ОШ 2,41, 95% ДИ: 1,09-5,30, р=0,029) [46].
Механизмы формирования артериальной жесткости при острой COVID-19
Для COVID-19 характерен острый воспалительный ответ с высвобождением множества цитокинов вплоть до развития цитокинового шторма и повреждение эндотелия сосудов. Вирус проникает внутрь клетки посредством связи собственных гликопротеинов с ангиотензинпревращающим ферментом 2 типа, экспрессия которого обнаруживается на поверхности эндотелиоцитов [417, 406]. Это приводит к снижению экспрессии, синтезу ангиотензина 1-7 из ангиотензина II с дальнейшим дисбалансом РААС и калликреин-кининовой системы. Данные процессы способствуют формированию эндотелиальной дисфункции с усилением адгезии лейкоцитов, активации системы комплемента, повышению проницаемости сосудов, агрегации тромбоцитов и гиперкоагуляции, синтеза и секреции провоспалительных цитокинов. Системное воспаление вызывает изменения в гормональном балансе, участвующем в т.ч. в поддержании сосудистого тонуса, к гипореактивности сосудистых адренорецепторов, снижению уровня эндогенного вазопрессина и недостаточности кортикостероидов. В результате всех этих процессов может изменяться тонус сосудов и артериальная жесткость [416][417]. При COVID-19 описано развитие эндотелиита и апоптоза эндотелиальных клеток с участием матриксных металлопротеиназ [418, 419], связь артериальной жесткости, оцененной с помощью CAVI, с провоспалительными адипоцитокинами [420] и маркерами воспаления и тромбообразования [421]. Помимо этого, имеются данные о нарушениях обмена аргинина, кинуренина и гомоцистеина среди пациентов, перенесших COVID-19, что может способствовать нарастанию оксидативного стресса, эндотелиальной дисфункции и артериальной жесткости [422].
Исследования долгосрочного влияния COVID-19 на артериальную жесткость
В исследовании Lambadiari V, et al. (2021) показано сохранение признаков повышенной артериальной жесткости и эндотелиальной дисфункции на протяжении 4 мес. после перенесенной острой COVID-19 [423]. При этом авторами было показано, что степень повышения СПВ и нарушения эндотелий-зависимой вазодилатации была сопоставимой у пациентов с АГ и больных COVID-19 по сравнению со здоровыми лицами из группы контроля. В работе Jud Р, et al. (2021) отмечено сохранение повышенной СПВ на протяжении 6 мес. после перенесенной COVID-19 по сравнению с группой контроля [422].
В ряде работ доказано сохранение повышенной СПВ, ИА и нарушений эндотелиальной дисфункции по крайней мере в течение 1 года после положительного ПЦР-теста на SARS-CoV-2 [424-426].
CAVI использовался только в работе отечественных авторов, в которой было обследовано 113 пациентов, в т.ч. 45 здоровых добровольцев, 44 пациента без ССЗ, перенесшие COVID-19 в течение 3 мес. до включения в исследование, и 24 пациента с АГ, у которых COVID-19 был в течение 6 мес. [427]. Особый интерес представляет группа пациентов без ССЗ (возраст 47,9±9,2 лет), у которых через 3 мес. после перенесенной COVID-19 сохранялись достоверно более высокие уровни CAVI по сравнению с контрольной группой сопоставимого возраста.
Ответ на вопрос о долгосрочной связи перенесенной COVID-19 с жесткостью сосудистой стенки может быть получен в проводимом многоцентровом исследовании CARTESIAN (ARTErial StIffness and Vascular AgeiNg), в котором проводится оценка СПВ, центральной гемодинамики, а также биомаркеров раннего сосудистого старения через 6 и 12 мес. после подтвержденной COVID-19 [428].
Помимо этого, имеются данные о связи повышенной артериальной жесткости во время острой COVID-19 с развитием постковидного синдрома. В проспективном когортном исследовании Подзолкова В. И. и др. (2024) проанализирована связь артериальной жесткости, оцененной по уровню CAVI, с развитием постковидного синдрома у 125 пациентов среднего возраста (57 (45,6%) мужчин и 68 (54,4%) женщин), выписанных из стационара, в котором находились по поводу острой COVID-19. В течение 6 мес. анализировалось появление постковидного синдрома, который диагностировался при сохранении или появлении новых симптомов по крайней мере через 4 нед. после начала острой COVID-19, персистировавших не менее 2 мес. и не имевших других причин. Повышение CAVI >9,5 оказалось достоверно связано с развитием постковидного синдрома (ОШ 2,415, 95% ДИ: 1,023-5,704, p=0,044) [54].
Лечебные вмешательства для коррекции артериальной жесткость при COVID-19
Данные о влиянии терапии на артериальную жесткость и, в частности, CAVI во время острой COVID-19 или в постковидном состоянии в литературе отсутствуют. Однако с этой целью могут быть использованы препараты, обладающие вазопротективными свойствами, такие как ингибиторы РААС. Препараты этой группы (иАПФ и блокаторы рецепторов к ангиотензину II 1 типа) показаны для лечения пациентов с ССЗ во время COVID-192,3, за исключением случаев гипотонии, гиперкалиемии и острого почечного повреждения при COVID-19.
Таким образом, COVID-19 сопровождается повышением жесткости сосудистой стенки, что является значимым ФР ССЗ. Складывается впечатление, что COVID-19 можно рассматривать в качестве немодифицируемого ФР повышения жесткости сосудистой стенки наряду с возрастом, курением, дислипидемией и другими кардиометаболическими факторами, что требует дальнейших исследований.
Заключение
Своевременная идентификация и стратификация ФР ССЗ являются ключевыми приоритетами в профилактике преждевременной смертности в нашей стране. В последние десятилетия измерение артериальной жесткости активно используется как показатель для стратификации риска ССЗ. Многочисленные исследования подтверждают значимость этих параметров как предикторов ССЗ и тяжелых ССО [2]. На сегодняшний день получено большое количество данных по изучению артериальной жесткости и задачей это документа стало объединить все новейшие материалы для формирования общей картины состояния проблемы. Сейчас используются последние модели VS-1500 или VS-2000 аппаратно-диагностического комплекса VaSera (производство Fukuda Denshi, Япония). У данной технологии есть целый ряд несомненных преимуществ. Методика не зависит от оператора, не требует обнажения паховой области (которую некоторые тонометрические методы используют для определения опорной точки бедренного пульса), является надёжной и автоматизированной, что упрощает её использование и повышает воспроизводимость результатов. Помимо крупных периферических артерий ног, при измерении CAVI учитывается вся аорта, в то время как при других измерениях не учитываются значительные участки аорты, особенно восходящая аорта, где наблюдаются самые ранние изменения, связанные со старением. Для оценки CAVI измеряется волна, которая проходит от сердца (аортального клапана) до лодыжки. Кроме того, CAVI не требует утомительного измерения расстояния между двумя точками сосудистого русла, поскольку алгоритм его вычисления использует рост пациента. Параллельное измерение CAVI и ЛПИ экономит время, а также весьма полезно для комплексной диагностики сосудистого статуса. И ещё одно важное преимущество CAVI — его значение, в отличие от СПВ, практически не зависит от уровня АД в момент измерения [429][430], поскольку CAVI учитывает параметр жёсткости β [37]. К настоящему времени определены референсные значения этого показателя для некоторых категорий населения Российской Федерации [54]. Он может быть использован как для клинического изучения сосудистого статуса, так и для скрининга [7][8]. Количество исследований, выполненных с помощью этой методики, позволяет сделать вывод о ее доказанной прогностической значимости в определении риска развития ССЗ. На повестке дня вопрос о рассмотрении возможности включения пороговых значений CAVI в клинические рекомендации.
В настоящее время начались разработки и нашего российского оборудования для оценки артериальной жесткости. Опубликовано несколько работ по сравнению CAVI с новым индексом haStart, которые демонстрируют обнадеживающие результаты [431-434]. В частности, в 2023г был выполнен сравнительный анализ на 928 здоровых добровольцах, который показал, что, несмотря на различие в методиках вычисления, индексы численно взаимосвязаны, а также ведут себя похожим образом в отношении корреляций с различными демографическими и физиологическими показателями, включающими возраст, пол, ДАД, САД, ПД, ЧСС и ИМТ [432].
В задачи ближайшего будущего необходимо включить разработку методики валидации приборов, измеряющих артериальную жесткость в Российской Федерации. Попытка реализовать эту задачу в других странах была предпринята в прошлом году в "Рекомендациях 2024 года по проверке неинвазивных устройств для измерения СПВ", в котором объединены мнения Ассоциации по изучению структуры и физиологии артерий (ARTERY), рабочей группы Европейского общества по изучению гипертонии по крупным артериям, Европейского сотрудничества в области науки и технологий (COST) Action VascAgeNet, Североамериканского общества по изучению артерий, ARTERY LATAM, Pulse of Asia и Общества по изучению жесткости артерий — Германия-Австрия-Швейцария (DeGAG) [435].
Таким образом, для измерения артериальной жесткости рекомендуется определение CAVI. Необходимы дальнейшие исследования как для более глубокого понимания процессов сосудистого старения, так и для разработки новых методов коррекции прогрессирования артериальной жесткости.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 World Health Organization The tobacco atlas [cited by Jun 29, 2021]. Available from: http://www.tobaccoatlas.org.
2 De Simone G. Position Statement of the ESC Council on Hypertension on ACE-Inhibitors and Angiotensin Receptor Blockers. Available at: https://www.escardio.org/Councils/Council-on-Hypertension-(CHT)/News/position-statement-of-the-esc-council-on-hypertension-on-ace-inhibitors-and-ang.
3 Interim Methodological Guidelines. Prevention, Diagnosis, and Treatment of Novel Coronavirus Infection (COVID-19). Version 18 (26.10.2023). Ministry of Health of the Russian Federation. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 18 (26.10.2023). Министерство здравоохранения Российской Федерации. https://static-0..minzdrav.gov.ru/system/attachments/attaches/000/064/610/original/ВМР_COVID-19_V18.pdf.
Список литературы
1. Avolio AP, Kuznetsova T, Heyndrickx GR, et al. Arterial flow, pulse pressure and pulse wave velocity in men and women at various ages. Adv Exp Med Biol. 2018;1065:153-68. doi:10.1007/978-3-319-77932-4_10.
2. Vlachopoulos C, Aznaouridis K, Stefanadis C. Prediction of cardiovascular events and allcause mortality with arterial stiffness: a systematic review and meta-analysis. J Am Coll Cardiol. 2010;55(13): 1318-27. doi:10.1016/j.jacc.2009.10.061.
3. Asmar R, Stergiou G, de la Sierra A, et al. Blood pressure measurement and assessment of arterial structure and function: an expert group position paper. Journal of Hypertension. 2024; 42(9):1465-81. doi:10.1097/HJH.0000000000003787.
4. Cheung AK, Whelton PK, Muntner P, et al. International consensus on standardized clinic blood pressure measurements a call to action. Am J Med. 2023;136:438-45. doi:10.1016/j.amjmed.2022.12.015.
5. Stergiou GS, Kyriakoulis KG, Kollias A.Office blood pressure measurement types: different methodology S different clinical conclusions. J Clin Hypertens. 2018;201683-5. doi:10.1111/jch.13420.
6. Stergiou GS, Parati G, Asmar R, O’Brien E, European Society of Hypertension Working Group on Blood Pressure Monitoring. Requirements for professional office blood pressure monitors. J Hypertens. 2012;30:537-42. doi:10.1097/HJH.0b013e32834fcfa5.
7. Budoff MJ, Alpert B, Chirinos JA, et al. Clinical Applications Measuring Arterial Stiffness: An Expert Consensus for the Application of Cardio-Ankle Vascular Index. Am J Hypertens. 2022; 35(5):441-53. doi:10.1093/ajh/hpab178.
8. Park JB, Sharman JE, Li Y, et al. Expert Consensus on the Clinical Use of Pulse Wave Velocity in Asia. Pulse (Basel). 2022;10(1-4):1-18. doi:10.1159/000528208.
9. Van Bortel LM, Laurent S, Boutouyrie P, et al. Expert consensus document on the measurement of aortic stiffness in daily practice using carotid-femoral pulse wave velocity. J Hypertens. 2012;30(3):445-8. doi:10.1097/HJH.0b013e32834fa8b0.
10. Tomiyama H, Matsumoto C, Shiina K, Yamashina A. Brachial-ankle PWV: current status and future directions as a useful marker in the management of cardiovascular disease and/or cardiovascular risk factors. J Atheroscler Thromb. 2016;23(2):128-46. doi:10.5551/jat.32979.
11. Miyoshi T, Ito H. Arterial stiffness in health and disease: the role of cardio-ankle vascular index. J Cardiol. 2021;78(6):493-501. doi:10.1016/j.jjcc.2021.07.011.
12. Васюк Ю.А., Иванова С.В., Школьник Е.Л. и др. Согласованное мнение российских экспертов по оценке артериальной жесткости в клинической практике. Кардиоваскулярная терапия и профилактика. 2016;15(2):4-19. doi:10.15829/1728-8800-2016-2-4-19.
13. Yamaguchi T, Shirai K, Nagayama D, et al. Bezafibrate ameliorates arterial stiffness assessed by cardio-ankle vascular index in hypertriglyceridemic patients with type 2 diabetes mellitus. J Atheroscler Thromb. 2019;26:659-69. doi:10.5551/jat.45799.
14. Yasuharu T, Setoh K, Kawaguchi T, et al. Nagahama study group. Brachial-ankle pulse wave velocity and cardio-ankle vascular index are ssociated with future cardiovascular events in a general population: The Nagahama study. J Clin Hypertens (Greenwich). 2021;23:1390-8. doi:10.1111/jch.14294.
15. Bergel DH. The static elastic properties of the arterial wall. J Physiol. 1961;156:445-57. doi:10.1113/jphysiol.1961.sp006686.
16. Shirai K, Utino J, Otsuka K, Takata M. A novel blood pressure-independent arterial wall stiffness parameter; cardio-ankle vascular index (CAVI). J Atheroscler Thromb. 2006;13:101-7. doi:10.5551/jat.13.101.
17. Hayashi K, Handa H, Nagasawa S, et al. Stiffness and elastic behavior of human intracranial and extracranial arteries. J Biomech. 1980;13:175-84. doi:10.1016/0021-9290(80)90191-8.
18. Bramwell JC, Hill AV. The velocity of the pulse wave in man. Proc Royal Soc London B Biol Sci. 1922;93:298-306. doi:10.1098/rspb.1922.0022.
19. Takahashi K, Yamamoto T, Tsuda S, et al. Coefficients in the CAVI equation and the comparison between CAVI with and without the coefficients using clinical data. J Atheroscler Thromb. 2019;26:465- 75. doi:10.5551/jat.44834.
20. Shirai K, Song M, Suzuki J, et al. Contradictory Effects of β1- and α1- Aderenergic Receptor Blockers on Cardio-Ankle Vascular Stiffness Index (CAVI). J Ateroscler Tromb. 2011;18:49-55. doi:10.5551/jat.3582.
21. Hayashi K, Yamamoto T, Takahara A, Shirai K. Clinical assessment of arterial stiffness with cardio-ankle vascular index: theory and applications. J Hypertens. 2015;33:1742-57. doi:10.1097/HJH.0000000000000651.
22. Mazzolai L, Gisela TeixidoTura G, Lanzi S, et al. ESC Scientific Document Group, 2024 ESC Guidelines for the management of peripheral arterial and aortic diseases: Developed by the task force on the management of peripheral arterial and aortic diseases of the European Society of Cardiology (ESC) Endorsed by the European Association for Cardio-Thoracic Surgery (EACTS), the European Reference Network on Rare Multisystemic Vascular Diseases (VASCERN), and the European Society of Vascular Medicine (ESVM), European Heart Journal. 2024;45(36):3538-700. doi:10.1093/eurheartj/ehae179.
23. Wang H, Liu J, Zhao H, et al. Arterial stiffness evaluation by cardioankle vascular index in hypertension and diabetes mellitus subjects. J Am Soc Hypertens. 2013;7:426-31. doi:10.1016/j.jash.2013.06.003.
24. Tanaka A, Tomiyama H, Maruhashi T, et al. Physiological diagnostic criteria for vascular failure. Hypertension. 2018;72:1060-71. doi:10.1161/HYPERTENSIONAHA.118.11554.
25. Miyoshi T, Ito H, Horinaka S, et al. Protocol for evaluating the cardioankle vascular index to predict cardiovascular events in Japan: a prospective multicenter cohort study. Pulse (Basel). 2017;4(suppl 1):11-6. doi:10.1159/000448464.
26. Nagayama D, Watanabe Y, Saiki A, et al. Difference in positive relation between cardio-ankle vascular index (CAVI) and each of four blood pressure indices in real-world Japanese population. J Hum Hypertens. 2019;33:210-17. doi:10.1038/s41371-019-0167-1.
27. Yue M, Liu H, He M, et al. Gender-specific association of metabolic syndrome and its components with arterial stiffness in the general Chinese population. PLoS One. 2017;12:e0186863. doi:10.1371/journal.pone.0186863.
28. Sato Y, Nagayama D, Saiki A, et al. Cardio-ankle vascular index is independently associated with future cardiovascular events in outpatients with metabolic disorders. J Atheroscler Thromb. 2016;23:596-605. doi:10.5551/jat.31385.
29. Schillaci G, Battista F, Settimi L, et al. Cardio-ankle vascular index and subclinical heart disease. Hypertens Res. 2015;38:68-73. doi:10.1038/hr.2014.138.
30. Osawa K, Nakanishi R, Miyoshi T, et al. Correlation of arterial stiffness with left atrial volume index and left ventricular mass index in young adults: evaluation by coronary computed tomography angiography. Heart Lung Circ. 2019;28:932-8. doi:10.1016/j.hlc.2018.04.286.
31. Namba T, Masaki N, Matsuo Y, et al. Arterial stiffness is significantly associated with left ventricular diastolic dysfunction in patients with cardiovascular disease. Int Heart J. 2016;57:729-35. doi:10.1536/ihj.16-112.
32. Satirapoj B, Triwatana W, Supasyndh O. Arterial stiffness predicts rapid decline in glomerular filtration rate among patients with high cardiovascular risks. J Atheroscler Thromb. 2020;27:611-9. doi:10.5551/jat.52084.
33. Liu H, Liu J, Zhao H, Wang HBEST research group. Association of brain white matter lesions with arterial stiffness assessed by cardioankle vascular index. The Beijing Vascular Disease Evaluation STudy (BEST). Brain Imaging Behav. 2021;15:1025-32. doi:10.1007/s11682-020-00309-3.
34. Yukutake T, Yamada M, Fukutani N, et al. Arterial stiffness determined according to the Cardio-Ankle Vascular Index (CAVI) is associated with mild cognitive decline in community-dwelling elderly subjects. J Atheroscler Thromb. 2014;21:49-55. doi:10.5551/jat.19992.
35. Chung SL, Yang CC, Chen CC, et al. Coronary artery calcium score compared with cardio-ankle vascular index in the prediction of cardiovascular events in asymptomatic patients with type 2 diabetes. J Atheroscler Thromb. 2015;22:1255-65. doi:10.5551/jat.29926.
36. Ibata J, Sasaki H, Hanabusa T, et al. Increased arterial stiffness is closely associated with hyperglycemia and improved by glycemic control in diabetic patients. J Diabetes Investig. 2013;4:82-7.
37. Saiki А, Ohira M, Yamaguchi T, et al. New Horizons of Arterial Stiffness Developed Using Cardio-Ankle Vascular Index (CAVI) J Atheroscler Thromb. 2020;27(8):732-48. doi:10.5551/jat.RV17043.
38. Otsuka K, Fukuda S, Shimada K, et al. Serial assessment of arterial stiffness by cardio-ankle vascular index for prediction of future cardiovascular events in patients with coronary artery disease. Hypertens Res. 2014;37:1014-20. doi:10.1038/hr.2014.116.
39. Gohbara M, Iwahashi N, Sano Y, et al. Clinical impact of the cardioankle vascular index for predicting cardiovascular events after acute coronary syndrome. Circ J. 2016;80:1420-6. doi:10.1253/circj.CJ15-1257.
40. Miyoshi T, Ito H, Horinaka S, et al. Predictive value of the cardio-ankle vascular index for cardiovascular events in patients at cardiovascular risk. J Am Heart Assoc. 2021;10(16):e020103. doi:10.1161/JAHA.120.020103.
41. Отт М.В., Сумин А.Н., Коваленко А.В. Возможности применения сердечно-лодыжечного сосудистого индекса у больных с цереброваскулярными заболеваниями. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2020;120(8-2):37-44. doi:10.17116/jnevro202012008237.
42. Труш Е.Ю., Иванова С.В., Савин А.А. и др. Жесткость артериальной стенки у больных с ишемическими нарушениями мозгового кровообращения. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2020;120(12-2):16-21. doi:10.17116/jnevro202012012216.
43. Заирова А.Р., Рогоза А.Н., Ощепкова Е.В. и др. Значение показателя артериальной жесткости "сердечно-лодыжечный сосудистый индекс — CAVI" для прогноза сердечно-сосудистых событий в популяционной выборке взрослого городского населения (по материалам исследования ЭССЕ-РФ, Томск). Кардиоваскулярная терапия и профилактика. 2021;20(5):2967. doi:10.15829/1728-8800-2021-2967.
44. Kubota Y, Maebuchi D, Takei M, et al. Cardio-ankle vascular index is a predictor of cardiovascular events. Artery Res. 2011;5:91-6. doi:10.1016/j.artres.2011.03.005.
45. Подзолков В.И., Брагина А.Е., Тарзиманова А.И. и др. Сердечно-сосудистые предикторы течения постковидного периода: результаты когортного исследования. Российский кардиологический журнал. 2024;29(3):5632. doi:10.15829/1560-4071-2024-5632. EDN: REXCGP.
46. Podzolkov V, Bragina A, Tarzimanova A, et al. Association of covid-19 and arterial stiffness assessed using cardiovascular index (CAVI). Current Hypertension Reviews. 2024;20(1):44-51. doi:10.2174/0115734021279173240110095037.
47. Matsushita K, Ding N, Kim ED, et al. Cardio-ankle vascular index and cardiovascular disease: systematic review and meta-analysis of prospective and cross-sectional studies. J Clin Hypertens (Greenwich). 2019;21:16-24. doi:10.1111/jch.13425.
48. Ben-Shlomo Y, Spears M, Boustred C, et al. Aortic pulse wave velocity improves cardiovascular event prediction: an individual participant meta-analysis of prospective observational data from 17,635 subjects. J Am Coll Cardiol. 2014;63:636-46. doi:10.1016/j.jacc.2013.09.063.
49. Евсевьева М.Е., Еремин М.В., Ростовцева М.В. и др. Фенотипы сосудистого старения по данным VaSera-скрининга у молодых людей с наличием артериальной гипертензии. Место дисплазии соединительной ткани. Артериальная гипертензия. 2021;27(2):188-205. doi:10.18705/1607-419X-2021-27-2-188-205.
50. Подзолков В.И., Брагина А.Е., Дружинина Н.А., Мохаммади Л.Н. Курение электронных сигарет (вейпинг) и маркеры поражения сосудистой стенки у лиц молодого возраста без сердечнососудистых заболеваний. Рациональная фармакотерапия в кардиологии. 2021;17(4):521-7. doi:10.20996/1819-6446-2021-08-04.
51. Евсевьева М.Е., Сергеева О.В., Русиди А.В. и др. Сосудистое старение и формирование саногенного мышления у студентов в аспекте оптимизации системы здоровьесбережения молодежи. Профилактическая медицина. 2024;27(9):75-81. doi:10.17116/profmed20242709175.
52. Евсевьева М.Е., Сергеева О.В., Русиди А.В. и др. Молодёжный "парадокс ожирения" с позиций сосудистой жёсткости, уровня артериального давления и метаболического статуса. Российский кардиологический журнал. 2024;29(5):5739. doi:10.15829/1560-4071-2024-5739. EDN: BIOOTS.
53. Climie RE, Park C, Avolio A, et al. Vascular Ageing in Youth: A Call to Action. Heart Lung Circ. 2021;30(11):1613-26. doi:10.1016/j.hlc.2021.06.516.
54. Safronova T, Kravtsova A, Vavilov S, et al. Мodel-based assessment of the reference values of CAVI in healthy Russian population and benchmarking with cavi0. American Journal of Hypertension. 2024;37(1):77-84. doi:10.1093/ajh/hpad082.
55. Евсевьева М. Е., Ерёмин М.В., Ростовцева М.В. и др. Профилактический скрининг молодёжи с позиций фенотипов сосудистого старения: роль массы тела. Рациональная Фармакотерапия в Кардиологии. 2022;18(1):42-8. doi:10.20996/1819-6446-2022-02-14.
56. Ротарь О. П., Бояринова М. А., Толкунова К.М. и др. Фенотипы сосудистого старения в российской популяции — биологические и социально-поведенческие детерминанты Кардиоваскулярная терапия и профилактика. 2021;20(5):2970. doi:10.15829/1728-8800-2021-2970.
57. Wang W, Costigliola V, Golubnitschaja O.Suboptimal Health Management in the Framework of PPP Medicine. In the collective monograph: All Around Suboptimal Health. Advanced Approaches by Predictive, Preventive and Personalised Medicine for Healthy Populations. Cham. 2024:1-7. doi:10.1007/978-3-031-46891-9_1.
58. Evsevieva ME, Sergeeva OV, Eremin MV, et al. Early vascular aging in young adults is instrumental as the screening tool to combat CVD epidemics in the population. In the collective monograph: All Around Suboptimal Health. Advanced Approaches by Predictive, Preventive and Personalised Medicine for Healthy Populations. Cham. 2024: 139-70.
59. Ротарь О.П., Толкунова К.М. Сосудистое старение в концепциях eva и supernova: непрерывный поиск повреждающих и протективных факторов Артериальная гипертензия. 2020;26(2):133-45. doi:10.18705/1607-419X-2020-26-2-133-145.
60. Laurent S, Boutouyrie P, Cunha PG, et al. Concept of Extremes in Vascular Aging. Hypertension. 2019;74(2):218-28. doi:10.1161/HYPERTENSIONAHA.119.12655.
61. Johansson M, Söderberg S, Nilsson PM, Nordendahl M.Vascular ageing in re-lation to chronological and self-perceived age in the general Swedish population. Scand Cardiovasc J. 2024;58(1): 2430078. doi:10.1080/14017431.2024.2430078.
62. Nilsson PM. Early Vascular Aging in Hypertension. Front Cardiovasc Med. 2020;7:6. doi:10.3389/fcvm.2020.00006.
63. Evsevieva M, Sergeeva O, Mazurakova A, et al. Pre-pregnancy check-up of maternal vascular status and associated phenotype is crucial for the health of mother and offspring. EPMA J. 2022;13(3): 351-66. doi:10.1007/s13167-022-00294-1.
64. Paneni F, Diaz Cañestro C, Libby P, et al. The Aging Cardiovas-cular System: Understanding It at the Cellular and Clinical Levels. J Am Coll Cardiol. 2017;69(15):1952-67. doi:10.1016/j.jacc.2017.01.064.
65. Kim HL, Kim SH. Pulse Wave Velocity in Atherosclerosis. Front Cardiovasc Med. 2019;6:41. doi:10.3389/fcvm.2019.00041.
66. Gobbens RJ, Luijkx KG, Wijnen-Sponselee MT, Schols JM. In search of an integral conceptual definition of frailty: opinions of experts. J Am Med Dir Assoc. 2010;11(5):338-43. doi:10.1016/j.jamda.2009.09.015.
67. Siriwardhana DD, Hardoon S, Rait G, et al. Prevalence of frailty and prefrailty among community-dwelling older adults in low-income and middle-income countries: a systematic review and meta-analysis. BMJ Open. 2018;8(3):e018195. doi:10.1136/bmjopen-2017-018195.
68. Ткачева О.Н., Котовская Ю.В., Рунихина Н.К. и др. Клинические рекомендации "Старческая астения". Российский журнал гериатрической медицины. 2020;(1):11-46. doi:10.37586/2686-8636-1-2020-11-46.
69. Ijaz N, Buta B, Xue QL, et al. Interventions for Frailty Among Older Adults With Cardiovascular Disease: JACC State-of-the-Art Review. J Am Coll Cardiol. 2022;79(5):482-503. doi:10.1016/j.jacc.2021.11.029.
70. Mikael LR, Paiva AMG, Gomes MM, et al. Vascular Aging and Arterial Stiffness. Arq Bras Cardiol. 2017;109(3):253-8. doi:10.5935/abc.20170091.
71. Orkaby AR, Lunetta KL, Sun FJ, et al. Cross-Sectional Association of Frailty and Arterial Stiff-ness in Community-Dwelling Older Adults: The Framingham Heart Study. J Gerontol A Biol Sci Med Sci. 2019;74(3):373-9. doi:10.1093/gerona/gly134.
72. Xue Q, Qin MZ, Jia J, et al. Association between frailty and the cardio-ankle vascular index. Clin Interv Aging. 2019;14:735-42. doi:10.2147/CIA.S195109.
73. Лузина А.В., Рунихина Н.К., Ткачева О. Н., Котовская Ю.В. Оценка жесткости сосудистой стенки у пожилых пациентов с артериальной гипертонией во взаимосвязи с гериатрическими синдромами. Российский кардиологический журнал. 2021; 26(4):4187. doi:10.15829/1560-4071-2021-4187.
74. Cesari M, Landi F, Vellas B, et al. Sarcopenia and physical frail-ty: two sides of the same coin. Front Aging Neurosci. 2014;6:192. doi:10.3389/fnagi.2014.00192.
75. Sakuma K, Yamaguchi A. Sarcopenia and cachexia: the adaptations of negative regulators of skeletal muscle mass. J Cachexia Sarcopenia Muscle. 2012;3(2):77-94. doi:10.1007/s13539-011-0052-4.
76. Sampaio RA, Sewo Sampaio PY, Yamada M, et al. Arterial stiffness is associated with low skeletal muscle mass in Japanese communitydwelling older adults. Geriatr Gerontol Int. 2014;14 Suppl 1:109-14. doi:10.1111/ggi.12206.
77. Rong YD, Bian AL, Hu HY, et al. A cross-sectional study of the relationships between different components of sarcopenia and brachial ankle pulse wave velocity in community-dwelling elderly. BMC Geriatr. 2020;20(1):115. doi:10.1186/s12877-020-01525-8.
78. Turusheva A, Frolova E, Kotovskaya Y, et al. Association Between Arterial Stiffness, Frailty and Fall-Related Injuries in Older Adults. Vasc Health Risk Manag. 2020;16:307-16. doi:10.2147/VHRM.S251900.
79. Kobayashi Y, Fujikawa T, Kobayashi H, et al. Relationship between Arterial Stiffness and Blood Pressure Drop During the Sit-to-stand Test in Patients with Diabetes Mellitus. J Atheroscler Thromb. 2017;24(2):147-56. doi:10.5551/jat.34645.
80. Dani M, Dirksen A, Taraborrelli P, et al. Orthostatic hypotension in older people: considerations, diagnosis and management. Clin Med (Lond). 2021;21(3):e275-e282. doi:10.7861/clinmed.2020-1044.
81. Pase MP, Herbert A, Grima NA, et al. Arterial stiffness as a cause of cognitive decline and dementia: a systematic review and metaanalysis. Intern Med J. 2012;42(7):808-15. doi:10.1111/j.1445-5994.2011.02645.x.
82. Rabkin SW. Arterial stiffness: detection and consequences in cognitive impairment and dementia of the elderly. J Alzheimers Dis. 2012;32(3):541-9. doi:10.3233/JAD-2012-120757.
83. Bakali M, Ward TC, Daynes E, et al. Effect of aerobic exercise training on pulse wave velocity in adults with and without long-term conditions: a systematic review and meta-analysis. Open Heart. 2023;10(2):e002384. doi:10.1136/openhrt-2023-002384.
84. Jennings A, Berendsen AM, de Groot LCPGM, et al. MediterraneanStyle Diet Improves Systolic Blood Pressure and Arterial Stiffness in Older Adults. Hypertension. 2019;73(3):578-86. doi:10.1161/HYPERTENSIONAHA.118.12259.
85. Ngene NC, Moodley J. Physiology of blood pressure relevant to managing hypertension in pregnancy. J Matern Fetal Neonatal Med. 2019;32(8):1368-77. doi:10.1080/14767058.2017.1404569.
86. Hale SA, Badger GJ, McBride C, et al. Prepregnancy Vascular Dysfunction in Women who Subsequently Develop Hypertension During Pregnancy. Pregnancy Hypertens. 2013;3(2):140-5. doi:10.1016/j.preghy.2013.01.006.
87. Benagiano M, Mancuso S, Brosens JJ, Benagiano G. Long-Term Consequences of Placental Vascular Pathology on the Maternal and Offspring Cardiovascular Systems. Biomolecules. 2021; 11(11):1625. doi:10.3390/biom11111625.
88. Staff AC, Dechend R, Redman CW. Review: Preeclampsia, acute atherosis of the spiral arteries and future cardiovascular disease: two new hypotheses. Placenta. 2013;34 Suppl:S73-8. doi:10.1016/j.placenta.2012.11.022.
89. Orabona R, Sciatti E, Vizzardi E, et al. Endothelial dysfunction and vascular stiffness in women with previous pregnancy complicated by early or late pre-eclampsia. Ultrasound Obstet Gynecol. 2017;49(1):116-23. doi:10.1002/uog.15893.
90. Osman MW, Nath M, Breslin E, et al. Association between arterial stiffness and wave reflection with subsequent development of placental-mediated diseases during pregnancy: findings of a systematic review and meta-analysis. J Hypertens. 2018; 36(5):1005-14. doi:10.1097/HJH.0000000000001664.
91. Perry H, Gutierrez J, Binder J, et al. Maternal arterial stiffness in hypertensive pregnancies with and without small-for-gestationalage neonate. Ultrasound Obstet Gynecol. 2020;56(1):44-50. doi:10.1002/uog.21893.
92. Rueangjaroen P, Luewan S, Phrommintikul A, et al. The cardioankle vascular index as a predictor of adverse pregnancy outcomes. J Hypertens. 2021;39(10):2082-91. doi:10.1097/HJH.0000000000002907.
93. Savvidou MD, Anderson JM, Kaihura C, Nicolaides KH. Maternal arterial stiffness in pregnancies complicated by gestational and type 2 diabetes mellitus. Am J Obstet Gynecol. 2010;203(3):274.e1-7. doi:10.1016/j.ajog.2010.06.021.
94. Osman MW, Nath M, Khalil A, et al. Longitudinal study to assess changes in arterial stiffness and cardiac output parameters among low-risk pregnant women. Pregnancy Hypertens. 2017;10:256-61. doi:10.1016/j.preghy.2017.10.007.
95. Poolsin T, Sirichotiyakul S, Luewan S, et al. Reference-range of arterial stiffness by cardio-ankle vascular index in normal pregnancy. Pregnancy Hypertens. 2023;34:138-45. doi:10.1016/j.preghy.2023.10.012.
96. Anness AR, Nath M, Melhuish K, et al. Arterial stiffness throughout pregnancy: Arteriograph device-specific reference ranges based on a low-risk population. J Hypertens. 2022;40(5):870-7. doi:10.1097/HJH.0000000000003086.
97. Foo FL, McEniery CM, Lees C, Khalil A; International Working Group on Maternal Hemodynamics. Assessment of arterial function in pregnancy: recommendations of the International Working Group on Maternal Hemodynamics. Ultrasound Obstet Gynecol. 2017;50(3):324-31. doi:10.1002/uog.17565.
98. Saravanan CR, Chowdhury SR, Inban P, et al. Predictive significance of cardio ankle vascular index for the assessment of cardiovascular risk in hypertensive patients: A systematic review. J Clin Hypertens (Greenwich). 2024;26(9):1005-14. doi:10.1111/jch.14878.
99. Namugowa A, Iputo J, Wandabwa J, et al. Comparison of arterial stiffness in preeclamptic and normotensive pregnant women from a semi-rural region of South Africa. Clin Exp Hypertens. 2017;39(3):277-83. doi:10.1080/10641963.2016.1254227.
100. Torrado J, Farro I, Zocalo Y, et al. Preeclampsia is associated with increased central aortic pressure, elastic arteries stiffness and wave reflections, and resting and Recruitable endothelial dysfunction. Int J Hypertens. 2015;2015:720683. doi:10.1155/2015/720683.
101. Чулков В.С., Романюго Г.Д., Тарасова О.А. и др. Возможности профилактики кардиометаболических заболеваний у женщин с неблагоприятными исходами беременности в анамнезе. Профилактическая медицина. 2024;27(3):98-103. doi:10.17116/profmed20242703198.
102. Suvakov S, Bonner E, Nikolic V, et al. Overlapping pathogenic signalling pathways and biomarkers in preeclampsia and cardiovascular disease. Pregnancy Hypertens. 2020;20:131-6. doi:10.1016/j.preghy.2020.03.011.
103. Weissgerber TL, Milic NM, Milin-Lazovic JS, Garovic VD. Impaired Flow-Mediated Dilation Before, During, and After Preeclampsia: A Systematic Review and Meta-Analysis. Hypertension. 2016; 67(2):415-23. doi:10.1161/HYPERTENSIONAHA.115.06554.
104. Pàez O, Alfie J, Gorosito M, et al. Parallel decrease in arterial distensibility and in endothelium-dependent dilatation in young women with a history of pre-eclampsia. Clin Exp Hypertens. 2009;31(7):544-52. doi:10.3109/10641960902890176.
105. Greve SV, Blicher MK, Blyme A, et al. Association between albuminuria, atherosclerotic plaques, elevated pulse wave velocity, age, risk category and prognosis in apparently healthy individuals. J.Hypertens. 2014;32:1034-41. doi:10.1097/HJH.0000000000000147.
106. Oyama-Kato M, Ohmichi M, Takahashi K, et al. Change in pulse wave velocity throughout normal pregnancy and its value in predicting pregnancy-induced hypertension: a longitudinal study. Am J Obstet Gynecol. 2006;195(2):464-9. doi:10.1016/j.ajog.2006.01.104.
107. Robb AO, Mills NL, Din JN, et al. Influence of the menstrual cycle, pregnancy, and preeclampsia on arterial stiffness. Hypertension. 2009;53(6):952-8. doi:10.1161/HYPERTENSIONAHA.109.130898.
108. Christensen M, Kronborg CS, Eldrup N, et al. Preeclampsia and cardiovascular disease risk assessment — do arterial stiffness and atherosclerosis uncover increased risk ten years after delivery? Pregnancy Hypertens. 2016;6(2):110-4. doi:10.1016/j.preghy.2016.04.001.
109. Долгушина В.Ф., Сюндюкова Е.Г., Чулков В.С. и др. Состояние системной и плацентарной гемодинамики при преэклампсии. Акушерство и гинекология. 2024;(9):63-72. doi:10.18565/aig.2024.109.
110. Benschop L, Schelling SJ, Duvekot JJ, Roeters van Lennep JE. Cardiovascular health and vascular age after severe preeclampsia: A cohort study. Atherosclerosis. 2020;(292):136-42. doi:10.1016/j.atherosclerosis.2019.11.023.
111. Werlang A. The EVA Study: Early Vascular Aging in Women With History of Preeclampsia. Journal of the American Heart Association. 2023;12(8):e028116. doi:10.1161/JAHA.122.028116.
112. Kirollos S, Skilton M, Patel S, Arnott C. A Systematic Review of Vascular Structure and Function in Pre-eclampsia: Non-invasive Assessment and Mechanistic Links. Front Cardiovasc Med. 2019;6:166. doi:10.3389/fcvm.2019.00166.
113. Kim S, Lim HJ, Kim JR, et al. Longitudinal change in arterial stiffness after delivery in women with preeclampsia and normotension: a prospective cohort study. BMC Pregnancy Childbirth. 2020;20(1):685. doi:10.1186/s12884-020-03374-0.
114. Рябикина М.Г., Долгушина В.Ф., Сюндюкова Е.Г. и др. Артериальная жесткость и сосудорасширяющий резерв плечевой артерии при преэклампсии. Медицинская наука и образование Урала. 2024;25(3(119)):49- 55. doi:10.36361/18148999_2024_25_3_49.
115. Nagayama D, Endo K, Ohira M, et al. Effects of body weight reduction on cardio-ankle vascular index (CAVI). Obes Res Clin Pract. 2013;7(2):e139-e145. doi:10.1016/j.orcp.2011.08.154.
116. Steinberg HO, Tarshoby M, Monestel R, et al. Elevated circulating free fatty acid levels impair endothelium-dependent vasodilation. J Clin Invest. 1997;100(5):1230-9. doi:10.1172/JCI119636.
117. Aroor AR, Jia G, Sowers JR. Cellular mechanisms underlying obesity-induced arterial stiffness. Am J Physiol Regul Integr Comp Physiol. 2018;314(3):R387-R398. doi:10.1152/ajpregu.00235.2016.
118. Balletshofer BM, Rittig K, Enderle MD, et al. Endothelial dysfunction is detectable in young normotensive first-degree relatives of subjects with type 2 diabetes in association with insulin resistance. Circulation. 2000;101(15):1780-4. doi:10.1161/01.cir.101.15.1780.
119. Saiki A, Oyama T, Endo K, et al. Preheparin serum lipoprotein lipase mass might be a biomarker of metabolic syn-drome. Diabetes Res Clin Pract. 2007;76(1):93-101. doi:10.1016/j.diabres.2006.08.004.
120. Topouchian J, Labat C, Gautier S, et al. Effects of metabolic syndrome on arterial function in different age groups: the Advanced Approach to Arterial Stiffness study. J Hypertens. 2018;36(4):824- 33. doi:10.1097/HJH.0000000000001631.
121. Gomez-Sanchez L, Garcia-Ortiz L, Patino-Alonso MC, et al.; MARK Group. The Association Between the Cardio-ankle Vascular Index and Other Parameters of Vascular Structure and Function in Caucasian Adults: MARK Study. J Atheroscler Thromb. 2015; 22(9):901-11. doi:10.5551/jat.28035.
122. Seals DR, Desouza CA, Donato AJ, Tanaka H. Habitual exercise and arterial aging. J.Appl. Physiol. 2008;1985(105):1323-32. doi:10.1152/japplphysiol.90553.2008.
123. Liu H, Zhang X, Feng X, et al. Effects of metabolic syndrome on cardio-ankle vascular index in middle-aged and elderly Chinese. Metab Syndr Relat Disord. 2011;9(2):105-10.
124. Bäck M, Topouchian J, Labat C, et al. Cardio-ankle vascular index for predicting cardiovascular morbimortality and determinants for its progression in the prospective advanced approach to arterial stiffness (TRIPLE-A-Stiffness) study. EBioMedicine. 2024; 103:105107. doi:10.1016/j.ebiom.2024.105107.
125. Wildman RP, Mackey RH, Bostom A, et al. Measures of obesity are associated with vascular stiffness in young and older adults. Hypertension. 2003;42:468-73. doi:10.1161/01.HYP.0000090360.78539.CD.
126. Safar ME, Czernichow S, Blacher J. Obesity, arterial stiffness, and cardiovascular risk. J. Am. Soc. Nephrol. 2006;17:S109-S111. doi:10.1681/ASN.2005121321.
127. Recio-Rodriguez JI, Gómez-Marcos MA, Patino-Alonso MC, et al. Abdominal obesity vs general obesity for identifying arterial stiffness, subclinical atherosclerosis and wave reflection in healthy, diabetics and hy-pertensive. BMC Cardiovasc. Disord. 2012;12:3. doi:10.1186/1471-2261-12-3.
128. Weisbrod RM, Shiang T, Al Sayah L, et al. Arterial stiffening precedes systolic hypertension in diet-induced obesity. Hypertension. 2013;62:1105-10. doi:10.1161/HYPERTENSIONAHA.113.01744.
129. Hruby A, Hu FB. The Epidemiology of Obesity: A Big Picture. Pharmacoeconomics. 2015;33(7):673-89. doi:10.1007/s40273-014-0243-x.
130. Samson SL, Garber AJ. Metabolic syndrome. Endocrinol Metab Clin North Am. 2014;43(1):1-23. doi:10.1016/j.ecl.2013.09.009.
131. Hemati AY, Rahimi IM, Zilaei BS, et al. Inflammatory immune system response to short term altitude exposure and recreational physical activity. International Journal of Sport Studies. 2014;4(11):1383-7. doi:10.13140/RG.2.1.5072.8807.
132. Balestra C, Lambrechts K, Mrakic-Sposta S, et al. Hypoxic and Hyperoxic Breathing as a Complement to Low-Intensity Physical Exercise Programs: A Proof-of-Principle Study. Int J Mol Sci. 2021;22(17):9600. doi:10.3390/ijms22179600.
133. Urdampilleta A, González-Muniesa P, Portillo MP, Martínez JA. Usefulness of combin-ing intermittent hypoxia and physical exercise in the treatment of obesity. J Physiol Biochem. 2012;68(2):289-304. doi:10.1007/s13105-011-0115-1.
134. Montero D, Lundby C. Effects of Exercise Training in Hypoxia Versus Normoxia on Vascular Health. Sports Med. 2016;46(11):1725-36. doi:10.1007/s40279-016-0570-5.
135. De Groote E, Deldicque L. Is Physical Exercise in Hypoxia an Interesting Strategy to Prevent the Development of Type 2 Diabetes? A Narrative Review. Diabetes Metab Syndr Obes. 2021;14:3603-16. doi:10.2147/DMSO.S322249.
136. Sohee S, Toshio M, Wi-young S. Influences of short-term normobaric hypoxic training on metabolic syndrome-related markers in overweight and normal-weight men. Normobaric Hypoxic Training on Metabolic Syndrome. Journal of Men's Health. 2017;14(1);44-52. doi:10.22347/1875-6859.14.1.5.
137. Serebrovska TV, Portnychenko AG, Portnichenko VI, et al. Effects of intermittent hypoxia training on leukocyte pyruvate dehydrogenase kinase 1 (PDK-1) mRNA expression and blood insulin level in pre-diabetes patients. Eur J Appl Physiol. 2019;119(3):813-23. doi:10.1007/s00421-019-04072-2.
138. Lyamina NP, Lyamina SV, Senchiknin VN, et al. Normobaric hypoxia conditioning reduces blood pressure and normalizes nitric oxide synthesis in patients with arterial hypertension. J Hypertens. 2011;29(11):2265-72. doi:10.1097/HJH.0b013e32834b5846.
139. Bestavashvili A, Glazachev O, Bestavashvili A, et al. Intermittent Hypoxic-Hyperoxic Exposures Effects in Patients with Metabolic Syndrome: Correction of Cardiovascular and Metabolic Profile. Biomedicines. 2022;10(3):566. doi:10.3390/biomedicines10030566.
140. Koskinas KC, Van Craenenbroeck EM, Antoniades C, et al. Obesity and cardiovascular disease: an ESC clinical consensus statement. Eur J Prev Cardiol. 2025;32(3):184-220. doi:10.1093/eurjpc/zwae279. Erratum in: Eur J Prev Cardiol. 2025;32(6):511. doi:10.1093/eurjpc/zwae398.
141. Korakas E, Kountouri A, Pavlidis G, et al. Semaglutide Concurrently Improves Vascular and Liver Indices in Patients With Type 2 Diabetes and Fatty Liver Disease, Journal of the Endocrine Society. 2024;8(8):bvae122. doi:10.1210/jendso/bvae122.
142. Милютина М.Ю., Макарова Е.В., Меньков Н.В. и др. Влияние курения на жесткость сосудистой стенки у мужчин трудоспособного возраста по данным объемной сфигмографии. Клиническая медицина. 2021;99(1):53-7. doi:10.30629/0023-2149-2021-99-1-53-57/.
143. Гусаковская Л.И., Зиборева К.А., Муссаева А.В. и др. Влияние курения на показатели локальной и региональной сосудистой жесткости у здоровых молодых лиц. Вестник Пензенского государственного университета. 2015;2(10):89-94.
144. Hennrikus D, Joseph AM, Lando HA, et al. Effectiveness of a smoking cessation program for peripheral artery disease patients: a randomized controlled trial. J.Am. Coll. Cardiol. 2010;56(25):2105- 12. doi:10.1016/j.jacc.2010.07.031.
145. Винокурова И. Г., Давидович И. М., Воронова Т.А. Влияние артериальной гипертензии и курения на показатели жесткости сосудистой стенки у женщин репродуктивного возраста. Проблемы женского здоровья. 2011;6(4):62.
146. Kubozono T, Miyata M, Ueyama K, et al. Acute and chronic effects of smoking on arterial stiffness. Circ J. 2011;75:698-702. doi:10.1253/circj.cj-10-0552.
147. Miech R, Johnston L, O'Malley PM, et al. Trends in 534 Adolescent Vaping, 2017-2019. N Engl J Med. 2019;381(15):1490-1. doi:10.1056/NEJMc1910739.
148. Пушкина Я.А., Сычев И.В., Сергутова Н.П., Гончарова Л.Н. Влияние курения кальяна на жесткость сосудистой стенки у лиц молодого возраста по данным объемной сфигмографии. Регионарное кровообращение и микроциркуляция. 2024;23(3):43-9. doi:10.24884/1682-6655-2024-23-3-43-49.
149. Стародубова А.В., Чазова И.Е., Тутельян В.А. и др. Евразийские клинические рекомендации по питанию при сердечно-сосудистых заболеваниях (2024). Евразийский Кардиологический Журнал. 2024;(4):6-67. doi:10.38109/2225-1685-2024-4-6-66.
150. Katsiki N, Filippatos T, Vlachopoulos C, et al. Executive summary of the Hellenic Atherosclerosis Society guidelines for the diagnosis and treatment of dyslipidemias — 2023. Atheroscler Plus. 2024;55:74- 92. doi:10.1016/j.athplu.2024.01.004.
151. Cobos-Palacios L, Ruiz-Moreno, MI, Muñoz-Ubeda M, et al. A Healthy Lifestyle Is Associated with Lower Arterial Stiffness in a Metabolically Healthy Elderly Population with Overweight or Obesity. J.Hypertens. 2022;40:1808-14. doi:10.1097/HJH.0000000000003227.
152. Tyrovola D, Soulaidopoulos S, Tsioufis C, Lazaros G.The Role of Nutrition in Cardiovascular Disease: Current Concepts and Trends. Nutrients. 2023;15:1064. doi:10.3390/nu15051064.
153. Lichtenstein AH, Appel LJ, Vadiveloo M, et al. 2021 Dietary Guidance to Improve Cardiovascular Health: A Scientific Statement From the American Heart Association. Circulation. 2021;144:e472-e487. doi:10.1161/CIR.0000000000001031.
154. Wang S, Melnyk JP, Tsao R, Marcone MF. How Natural Dietary Antioxidants in Fruits, Vegetables and Legumes Promote Vascular Health. Food Res. Int. 2011;44:14-22. doi:10.1016/J.FOODRES.2010.09.028.
155. Monsalve B, Concha-Meyer A, Palomo I, Fuentes E. Mechanisms of Endothelial Protection by Natural Bioactive Compounds from Fruit and Vegetables. An.Acad. Bras. Cienc. 2017;89:615-33. doi:10.1590/0001-3765201720160509.
156. Zhan, J, Liu Y-J, Cai L-B, et al. Fruit and Vegetable Consumption and Risk of Cardiovascular Disease: A Meta-Analysis o Prospective Cohort Studies. Crit. Rev. Food Sci. Nutr. 2017;57:1650-63. doi:10.1080/10408398.2015.1008980.
157. Aune D, Giovannucci E, Boffetta P, et al. Fruit and Vegetable Intake and the Risk of Cardiovascular Disease, Total Cancer and All-Cause Mortality — A Systematic Review and Dose-Response MetaAnalysis of Prospective Studies. Int. J.Epidemiol. 2017;46:1029-56. doi:10.1093/ije/dyw319.
158. Blanch N, Clifton PM, Keogh JB. A Systematic Review of Vascular and Endothelial Function: Effects of Fruit, Vegetable and Potassium Intake. Nutr. Metab. Cardiovasc. Dis. 2015;25:253-66. doi:10.1016/j.numecd.2014.10.001.
159. Aatola H, Koivistoinen T, Hutri-Kähönen N, et al. Lifetime Fruit and Vegetable Consumption and Arterial Pulse Wave Velocity in Adulthood. Circulation. 2010;122:2521-8. doi:10.1161/CIRCULATIONAHA.110.969279.
160. Liu S, Liu FC, Li JX, et al. Association between Fruit and Vegetable Intake and Arterial Stiffness: The China-PAR Project. Biomed. Environ. Sci. 2023;36:1113-22. doi:10.3967/bes2023.143.
161. Ribeiro A, Mill J, Cade N, et al. Associations of Dairy Intake with Arterial Stiffness in Brazilian Adults: The Brazilian Longitudinal Study of Adult Health (ELSA-Brasil). Nutrients. 2018;10:701. doi:10.3390/nu10060701.
162. Diez-Fernández A, Álvarez-Bueno C, Martínez-Vizcaíno V, et al. Total Dairy, Cheese and Milk Intake and Arterial Stiffness: A Systematic Review and Meta-Analysis of Cross-Sectional Studies. Nutrients. 2019;11:741. doi:10.3390/nu11040741.
163. Kasliwal RR, Bansal M, Mehrotra, R, et al. Effect of Pistachio Nut Consumption on Endothelial Function and Arterial Stiffness. Nutrition. 2015;31:678-85. doi:10.1016/j.nut.2014.10.019.
164. Neale EP, Tapsell LC, Guan V, Batterham MJ. The Effect of Nut Consumption on Markers of Inflammation and Endothelial Function: A Systematic Review and Meta-Analysis of Randomised Controlled Trials. BMJ Open. 2017;7:e016863. doi:10.1136/bmjopen-2017-016863.
165. Xiao Y, Huang W, Peng C, et al. Effect of Nut Consumption on Vascular Endothelial Function: A Systematic Review and MetaAnalysis of Randomized Controlled Trials. Clin. Nutr. 2018;37:831-9. doi:10.1016/j.clnu.2017.04.011.
166. Shi W, Huang X, Schooling CM, Zhao JV. Red Meat Consumption, Cardiovascu-ar Diseases, and Diabetes: A Systematic Review and Meta-Analysis. Eur. Heart J. 2023;44:2626-35. doi:10.1093/eurheartj/ehad336.
167. Zhong VW, Van Horn L, Greenland P, et al. Associations of Processed Meat, Unprocessed Red Meat, Poultry, or Fish Intake With Incident Cardiovascular Disease and All-Cause Mortality. JAMA Intern. Med. 2020;180;503-12. doi:10.1001/jamainternmed.2019.6969.
168. Wang M, Wang Z, Lee Y, et al. Dietary Meat, Trimethylamine N-Oxide-Related Metabolites, and Incident Cardiovascular Disease Among Older Adults: The Cardiovascular Health Study. Arterioscler. Thromb. Vasc. Biol. 2022;42:E273-E288. doi:10.1161/ATVBAHA.121.316533.
169. Pierce GL, Roy SJ, Gimblet CJ. The Gut-Arterial Stiffness Axis: Is TMAO a Nov-el Target to Prevent Age-Related Aortic Stiffening? Hypertension. 2021;78:512-5. doi:10.1161/HYPERTENSIONAHA.121.17487.
170. Azad BJ, Heshmati J, Daneshzad E, Palmowski A. Effects of Coffee Consumption on Arterial Stiffness and Endothelial Function: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Crit. Rev. Food. Sci. Nutr. 2021;61:1013-26. doi:10.1080/10408398.2020.1750343.
171. Vlachopoulos CV, Vyssoulis GG, Alexopoulos NA, et al. Effect of Chronic Coffee Consumption on Aortic Stiffness and Wave Reflections in Hypertensive Patients. Eur. J. Clin. Nutr. 2007;61:796- 802. doi:10.1038/sj.ejcn.1602577.
172. Noguchi K, Matsuzaki T, Sakanashi M, et al. Effect of Caffeine Contained in a Cup of Coffee on Microvascular Function in Healthy Subjects. J. Pharmacol. Sci. 2015;127:217-22. doi:10.1016/j.jphs.2015.01.003.
173. Buscemi S, Verga S, Batsis JA, et al. Acute Effects of Coffee on Endothelial Function in Healthy Subjects. Eur. J.Clin. Nutr. 2010; 64:483-9.
174. Hwang C-L, Muchira J, Hibner BA, et al. Alcohol Consumption: A New Risk Factor for Arterial Stiffness? Cardiovasc. Toxicol. 2022;22:236-45.
175. Gonzalez-Sanchez J, Garcia-Ortiz L, Rodriguez-Sanchez E, et al. The Relationship Between Alcohol Consumption With Vascular Structure and Arterial Stiffness in the Spanish Population: EVA Study. Alcohol Clin. Exp. Res. 2020;44:1816-24.
176. Sasaki S, Yoshioka E, Saijo Y, et al. Relation between Alcohol Consumption and Arterial Stiffness: A Cross-Sectional Study of Middle-Aged Japanese Women and Men. Alcohol. 2013;47:643-9.
177. The Lancet Rheumatology. Alcohol and health: all, none, or somewhere in-between? Lancet Rheumatol. 2023;5(4):e167. doi:10.1016/S2665-9913(23)00073-5.
178. Kapil V, Milsom AB, Okorie M, et al. Inorganic Nitrate Supplementation Lowers Blood Pressure in Humans. Hypertension. 2010;56:274-81.
179. Bahrami LS, Arabi SM, Feizy Z, Rezvani R. The Effect of Beetroot Inorganic Nitrate Supplementation on Cardiovascular Risk Factors: A Systematic Review and Meta-Regression of Randomized Controlled Trials. Nitric Oxide. 2021;115:8-22.
180. Alasmari AM, Alsulayyim AS, Alghamdi SM, et al. Oral Nitrate Supplementation Improves Cardiovascular Risk Markers in COPD: ON-BC, a Randomised Controlled Trial. Eur. Respir. J. 2024; 63:2202353.
181. Shannon OM, Clifford T, Seals DR, et al. Nitric Oxide, Aging and Aerobic Exercise: Sedentary Individuals to Master’s Athletes. Nitric Oxide. 2022;125-6:31-9.
182. Lau CWZ, Hamers AJP, Rathod KS, et al. Randomised, DoubleBlind, Placebo-Controlled Clinical Trial Investigating the Effects of Inorganic Nitrate in Hypertension Induced Target Organ Damage: Protocol of the NITRATE-TOD Study in the UK. BMJ Open. 2020; 10:e034399.
183. Hooper L, Kroon PA, Rimm EB, et al. Flavonoids, Flavonoid-Rich Foods, and Cardiovascular Risk: A Meta-Analysis of Randomized Controlled Trials. Am.J. Clin. Nutr. 2008;88:38-50.
184. Heiss C, Sansone R, Karimi H, et al. Impact of Cocoa Flavanol Intake on Age-Dependent Vascular Stiffness in Healthy Men: A Randomized, Con-trolled, Double-Masked Trial. Age. 2015;37:56.
185. Sansone R, Rodriguez-Mateos A, Heuel J, et al. Cocoa Flavanol Intake Improves Endothelial Function and Framingham Risk Score in Healthy Men and Women: A Randomised, Controlled, DoubleMasked Trial: The Flaviola Health Study. Br. J. Nutr. 2015;114: 1246-55.
186. Gröne M, Sansone R, Höffken P, et al. Cocoa Flavanols Improve Endothelial Functional Integrity in Healthy Young and Elderly Subjects. J. Agric. Food Chem. 2020;68:1871-6.
187. Garcia-Yu IA, Garcia-Ortiz L, Gomez-Marcos MA, et al. Effects of Cocoa-Rich Chocolate on Blood Pressure, Cardiovascular Risk Factors, and Arterial Stiffness in Postmenopausal Women: A Randomized Clinical Trial. Nutrients. 2020;12(6):1758. doi:10.3390/nu12061758.
188. Gao L, Mao Q, Cao J, et al. Effects of Coenzyme Q10 on Vascular Endothelial Function in Humans: A Meta-Analysis of Randomized Controlled Trials. Atherosclerosis. 2012;221:311-6.
189. Kawashima C, Matsuzawa Y, Konishi M, et al. Ubiquinol Improves Endothelial Function in Patients with Heart Failure with Reduced Ejection Fraction: A Single-Center, Randomized Double-Blind Placebo-Controlled Crossover Pilot Study. Am.J. Cardiovasc. Drugs. 2020;20:363-72.
190. Gao J, Xu Y, Jia H, et al. Associations of Coenzyme Q10 with Endothelial Function in Hemodialysis Patients. Nephrology. 2021;26: 54-61.
191. Alidadi M, Sahebkar A, Eslami S, et al. The Effect of Curcumin Supplementation on Pulse Wave Velocity in Patients with Metabolic Syndrome: A Randomized, Double-Blind, Placebo-Controlled Trial. Adv. Exp. Med. Biol. 2021;1308:1-11.
192. Dehzad MJ, Ghalandari H, Askarpour M. Curcumin/Turmeric Supplementation Could Improve Blood Pressure and Endothelial Function: A Grade-Assessed Systematic Re-view and Dose-Response Meta-Analysis of Randomized Controlled Trials. Clin. Nutr. ES-PEN. 2024;59:194-207.
193. Imamura H, Yamaguchi T, Nagayama D, et al. Resveratrol Ameliorates Arterial Stiffness Assessed by Cardio-Ankle Vascular Index in Patients With Type 2 Diabetes Mellitus. Int Heart J. 2017;58(4):577- 83. doi:10.1536/ihj.16-373.
194. Akbari M, Tamtaji OR, Lankarani KB, et al. The Effects of Resveratrol Supplementation on Endothelial Function and Blood Pressures Among Patients with Metabolic Syndrome and Related Disorders: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. High Blood Press. Cardiovasc. Prev. 2019;26:305-19. doi:10.1007/s40292-019-00324-6.
195. Mohammadipoor N, Shafiee F, Rostami A, et al. Resveratrol Supplementation Efficiently Improves Endothelial Health: A Systematic Review and Meta-Analysis of Ran-domized Controlled Trials. Phytother. Res. 2022;36:3529-39. doi:10.1002/ptr.7562.
196. Lee YS, Park JW, Joo M, et al. Effects of Omega-3 Fat-ty Acids on Flow-Mediated Dilatation and Carotid Intima Media Thickness: A Meta-Analysis. Curr. Atheroscler. Rep. 2023;25:629-41. doi:10.1007/s11883-023-01137-8.
197. Meital LT, Schulze K, Magee R, et al. Long Chain Omega-3 Polyunsaturated Fatty Acids Improve Vascular Stiffness in Abdominal Aortic Aneurysm: A Randomized Controlled Trial. Nutrients. 2020; 13:138. doi:10.3390/nu13010138.
198. Maruyama K, Khairunnisa S, Saito I, et al. Association of Fish and Omega-3 Fatty Acid Intake with Carotid Intima-Media Thickness in Middle-Aged to Elderly Japanese Men and Women: The Toon Health Study. Nutrients. 2022;14:3644. doi:10.3390/nu14173644.
199. Wang Q, Liang X, Wang L, et al. Effect of Omega-3 Fatty Acids Supplementation on Endothelial Function: A Meta-Analysis of Ran-domized Controlled Trials. Atherosclerosis. 2012;221:536-43. doi:10.1016/j.atherosclerosis.2012.01.006.
200. Swart R, Schutte AE, van Rooyen JM, Mels CMC. Selenium and Large Artery Structure and Function: A 10-Year Prospective Study. Eur. J.Nutr. 2019;58:3313-23. doi:10.1007/s00394-018-1875-y.
201. Joris PJ, Plat J, Bakker SJL, Mensink RP. Long-Term Magnesium Supplementation Improves Arterial Stiffness in Overweight and Obese Adults: Results of a Randomized, Double-Blind, PlaceboControlled Intervention Trial. Am.J. Clin. Nutr. 2016;103:1260-6. doi:10.3945/ajcn.116.131466.
202. Schutten JC, Joris PJ, Groendijk I, et al. Effects of Magnesium Citrate, Magnesium Oxide, and Magnesium Sulfate Supplementation on Arterial Stiffness: A Randomized, Double-Blind, PlaceboControlled Intervention Trial. J.Am. Heart Assoc. 2022;11:e021783. doi:10.1161/JAHA.121.021783.
203. Marques BCAA, Klein MRST, da Cunha MR, et al. Effects of Oral Magnesium Supplementation on Vascular Function: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. High Blood Press. Cardiovasc. Prev. 2020;27:19-28. doi:10.1007/s40292-019-00355-z.
204. Ashor AW, Siervo M, Lara J, et al. Effect of Vitamin C and Vitamin E Supplementation on Endothelial Function: A Systematic Review and Meta-Analysis of Randomised Controlled Trials. Br.J. Nutr. 2015;113:1182-94. doi:10.1017/S0007114515000227.
205. Kwok T, Chook P, Qiao M, et al. Vitamin B-12 Supplementation Improves Arterial Function in Vegetarians with Subnormal Vitamin B-12 Status. J.Nutr. Health Aging. 2012;16:569-73. doi:10.1007/s12603-012-0036-x.
206. Rodríguez AJ, Scott D, Srikanth V, Ebeling P. Effect of Vitamin D Supplementation on Measures of Arterial Stiffness: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Clin. Endocrinol. 2016;84:645-57. doi:10.1111/cen.13031.
207. Van Dijk SC, Enneman AW, Swart KMA, et al. Effects of 2-Year Vitamin B12 and Folic Acid Supplementation in Hyperhomocysteinemic Elderly on Arterial Stiffness and Cardiovascular Outcomes within the B-PROOF Trial. J. Hypertens. 2015;33:1897-906. doi:10.1097/HJH.0000000000000647.
208. Theodoridis X, Chourdakis M, Papaemmanouil A, et al. The Association between Food Groups, Nutraceuticals, and Food Supplements Consumption on Vascular Health Outcomes: A Literature Review. Life (Basel). 2024;14(9):1210. doi:10.3390/life14091210.
209. Regnault V, Lacolley P, Laurent S. Arterial Stiffness: From Basic Primers to Integrative Physiology. Annu Rev Physiol. 2024;86:99-121. doi:10.1146/annurev-physiol-042022-031925.
210. Kim HL. Arterial stiffness and hypertension. Clin Hypertens. 2023;29(1):31. doi:10.1186/s40885-023-00258-1.
211. Boutouyrie P, Chowienczyk P, Humphrey JD, Mitchell GF. Arterial Stiffness and Cardiovascular Risk in Hypertension. Circ Res. 2021;128(7):864-86. doi:10.1161/CIRCRESAHA.121.318061.
212. Laurent S, Agabiti-Rosei C, Bruno RM, Rizzoni D. Microcirculation and Macrocirculation in Hypertension: A Dangerous Cross-Link? Hypertension. 2022;79(3):479-90. doi:10.1161/HYPERTENSIONAHA.121.17962.
213. Mancia G, Kreutz R, Brunström M, et al. 2023 ESH Guidelines for the management of arterial hypertension. The Task Force for the management of arterial hypertension of the European Society of Hypertension: Endorsed by the International Society of Hypertension (ISH) and the European Renal Association (ERA). J Hypertens. 2023;41(12):1874-2071. doi:10.1097/HJH.0000000000003480.
214. Павлова О.С. Артериальная гипертензия: клиническое руководство. Под общ. ред. Н.П. Митьковской. Минск: Профессиональные издания, 2023. 68 с. ISBN: 978-985-7291- 37-3.
215. Кобалава Ж. Д., Конради А.О., Недогода С.В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2024. Российский кардиологический журнал. 2024;29(9):6117. doi:10.15829/1560-4071-2024-6117. EDN: GUEWLU.
216. Cuspidi C, Facchetti R, Gherbesi E, et al. Cardio-Ankle Vascular Index and left ventricular mass as markers of nocturnal blood pressure fall in the general population. Clin Res Cardiol. 2024. doi:10.1007/s00392-024-02485-4.
217. Wang N, Guo Y, Li X, et al. Association between Cardio-Ankle Vascular Index and Masked Uncontrolled Hypertension in Hypertensive Patients: A Cross-Sectional Study. J Healthc Eng. 2022; 2022:3167518. doi:10.1155/2022/3167518.
218. Kawabata T, Kubozono T, Ojima S, et al. Insufficient blood pressure control is independently associated with increased arterial stiffness. Hypertens Res. 2022;45(12):1861-8. doi:10.1038/s41440-022-01039-3.
219. Cuspidi C, Facchetti R, Quarti-Trevano F, et al. Cardio-Ankle Vascular Index as a Marker of Left Ventricular Hypertrophy in Treated Hypertensives: Findings From the Pamela Study. Am J Hypertens. 2024;37(6):399-406. doi:10.1093/ajh/hpae022.
220. Zhang X, Li Y, Wang X, et al. Hypertension-specific association of cardio-ankle vascular index with subclinical left ventricular function in a Chinese population: Danyang study. J Clin Hypertens (Greenwich). 2024;26(5):553-62. doi:10.1111/jch.14803.
221. Kim H, Kim HS, Yoon HJ, et al. Association of cardio-ankle vascular index with diastolic heart function in hypertensive patients. Clin Exp Hypertens. 2014;36(4):200-5. doi:10.3109/10641963.2013.804544.
222. Сумин А.Н., Щеглова А.В., Фёдорова Н.В., Артамонова Г.В. Сердечно-лодыжечный сосудистый индекс у больных артериальной гипертензией. Доктор. Ру. 2016;11(128):28-32.
223. Tavolinejad H, Erten O, Maynard H, Chirinos JA. Prognostic Value of Cardio-Ankle Vascular Index for Cardiovascular and Kidney Outcomes: Systematic Review and Meta-Analysis. JACC Adv. 2024; 3(7):101019. doi:10.1016/j.jacadv.2024.101019.
224. Miyashita Y, Saiki A, Endo K, et al. Effects of olmesartan, an angiotensin II receptor blocker, and amlodipine, a calcium channel blocker, on Cardio-Ankle Vascular Index (CAVI) in type 2 diabetic patients with hypertension. J Atheroscler Thromb. 2009;16(5):621-6. doi:10.5551/jat.497.
225. Bokuda K, Ichihara A, Sakoda M, et al. Blood pressure-independent effect of candesartan on cardio-ankle vascular index in hypertensive patients with metabolic syndrome. Vasc Health Risk Manag. 2010;6:571-8. doi:10.2147/vhrm.s11958.
226. Miyoshi T, Suetsuna R, Tokunaga N, et al. Effect of Azilsartan on Dayto-Day Variability in Home Blood Pressure: A Prospective Multicenter Clinical Trial. J Clin Med Res. 2017;9(7):618-23. doi:10.14740/jocmr3050w.
227. Watanabe Y, Takasugi E, Shitakura K, et al. Administration of an angiotensin-converting enzyme inhibitor improves vascular function and urinary albumin excretion in low-risk essential hypertensive patients receiving anti-hypertensive treatment with calcium channel blockers. Organ-protecting effects independent of anti-hypertensive effect. Clin Exp Hypertens. 2011;33(4):246-54. doi:10.3109/10641963.2011.583970.
228. Sasaki H, Saiki A, Endo K, et al. Protective effects of efonidipine, a T- and L-type calcium channel blocker, on renal function and arterial stiffness in type 2 diabetic patients with hypertension and nephropathy. J Atheroscler Thromb. 2009;16(5):568-75. doi:10.5551/jat.1628.
229. Kurata M, Okura T, Watanabe S, et al. Effects of amlodipine and candesartan on arterial stiffness estimated by cardio-ankle vascular index in patients with essential hypertension: A 24-week study. Curr Ther Res Clin Exp. 2008;69(5):412-22. doi:10.1016/j.curtheres.
230. Shibata T, Tsutsumi J, Hasegawa J, et al. Effects of Add-on Therapy Consisting of a Selective Mineralocorticoid Receptor Blocker on Arterial Stiffness in Patients with Uncontrolled Hypertension. Intern Med. 2015;54(13):1583-9. doi:10.2169/internalmedicine.54.3427.
231. Vasan RS, Pan S, Xanthakis V, et al. Arterial Stiffness and Long-Term Risk of Health Outcomes: The Framingham Heart Study. Hypertension. 2022;79(5):1045-56. doi:10.1161/HYPERTENSIONAHA.121.18776.
232. Vatner SF, Zhang J, Vyzas C, et al. Vascular Stiffness in Aging and Disease. Front Physiol. 2021;12:762437. doi:10.3389/fphys.2021.762437.
233. Feola M. The influence of arterial stiffness in heart failure: A clinical review. J Geriatr Cardiol. 2021;18(2):135-40. doi:10.11909/j.issn.1671-5411.2021.02.004.
234. Мкртчян В.Р., Хайкин В.Д., Гудкова А.А. и др. Склеротические изменения артерий: атеросклероз, артериосклероз. Кардиология и сердечно-сосудистая хирургия. 2022;15(3):261-9. doi:10.17116/kardio202215031261.
235. Сумин А.Н., Щеглова А.В. Оценка артериальной жесткости с помощью сердечно-лодыжечного сосудистого индекса — что мы знаем, и к чему стремимся. Рациональная Фармакотерапия в Кардиологии. 2021;17(4):619- 27. doi:10.20996/1819-6446-2021-08-09.
236. Park JB, Park HE, Choi SY, et al. Relation between cardio-ankle vascular index and coronary artery calcification or stenosis in asymptomatic subjects. J Atheroscler Thromb. 2013;20(6):557-67. doi:10.5551/jat.15149.
237. Hu H, Cui H, Han W, et al. A cutoff point for arterial stiffness using the cardio-ankle vascular index based on carotid arteriosclerosis. Hypertens Res. 2013;36(4):334-41. doi:10.1038/hr.2012.192.
238. Сумин А.Н., Осокина А.В., Щеглова А.В. и др. Показатели ЭХОКГ при различном сердечнолодыжечном сосудистом индексе у больных ИБС. Сердце. 2015;14(3):123-30.
239. Lüers C, Trippel TD, Seeländer S, et al. Arterial stiffness and elevated left ventricular filling pressure in patients at risk for the development or a previous diagnosis of HF-A subgroup analysis from the DIASTCHF study. J Am Soc Hypertens. 2017;11(5):303-13. doi:10.1016/j.jash.2017.03.006.
240. Бойцов С. А., Погосова Н.В., Аншелес А.А. и др. Кардиоваскулярная профилактика, 2022. Российские национальные рекомендации. Российский кардиологический журнал. 2023;28(5):5452. doi:10.15829/1560-4071-2023-5452.
241. Sumin AN, Shcheglova AV, Ivanov SV, Barbarash OL. Long-Term Prognosis after Coronary Artery Bypass Grafting: The Impact of Arterial Stiffness and Multifocal Atherosclerosis. J Clin Med. 2022;11(15):4585. doi:10.3390/jcm11154585.
242. Kato A, Takita T, Furuhashi M, et al. Brachial-ankle pulse wave velocity and the cardio-ankle vascular index as a predictor of cardio¬vascular outcomes in patients on regular hemodialysis. Ther Apher Dial. 2012;16(3):232-41. doi:10.1111/j.1744-9987.2012.01058.x.
243. Сумин А. Н., Щеглова А.В., Баштанова Т.Б., Барбараш О. Л. Влияние патологического сердечно-лодыжечного сосудистого индекса на годовые результаты коронарного шунтирования у больных ишемической болезнью сердца. Кардиоваскулярная терапия и профилактика. 2015;14(3):18-24. doi:10.15829/1728-8800-2015-3-18-24.
244. Saiki A, Watanabe Y, Yamaguchi T, et al. CAVI-Lowering Effect of Pitavastatin May Be Involved in the Prevention of Cardiovascular Disease: Subgroup Analysis of the TOHO-LIP. J Atheroscler Thromb. 2021;28(10):1083-94. doi:10.5551/jat.60343.
245. Sumin AN, Shcheglova AV, Barbarash OL. Dynamics of the State of Arterial Stiffness as a Possible Pathophysiological Factor of Unfavorable Long-Term Prognosis in Patients after Coronary Artery Bypass Grafting. Biomedicines. 2024;12(5):1018. doi:10.3390/biomedicines12051018.
246. Wooten SV, Stray-Gundersen S, Tanaka H. Hemodynamic and Pressor Responses to Combination of Yoga and Blood Flow Restriction. Int J Sports Med. 2020;41(11):759-65. doi:10.1055/a-1171-1620.
247. Kobayashi R, Kasahara Y, Ikeo T, et al. Effects of different intensities and durations of aerobic exercise training on arterial stiffness. J Phys Ther Sci. 2020;32(2):104-9. doi:10.1589/jpts.32.104.
248. Mori K, Nomura T, Akezaki Y, et al. Impact of Tai Chi Yuttari-exercise on arteriosclerosis and physical function in older people. Arch Gerontol Geriatr. 2020;87:104011. doi:10.1016/j.archger.2020.104011.
249. Li A, Yan J, Zhao Y, et al. Vascular Aging: Assessment and Intervention. Clin Interv Aging. 2023;18:1373-95. doi:10.2147/CIA.S423373.
250. Laurent S, Chatellier G, Azizi M, et al. SPARTE Study: Normalization of Arterial Stiffness and Cardiovascular Events in Patients With Hypertension at Medium to Very High Risk. Hypertension. 2021;78(4):983-95. doi:10.1161/HYPERTENSIONAHA.121.17579.
251. Schettini IVG, Rios DRA, Figueiredo RC. Effect of Different Classes of Antihypertensive Drugs on Arterial Stiffness. Curr Hypertens Rep. 2023;25(5):61-70. doi:10.1007/s11906-023-01238-4.
252. Shimizu N, Ban N, Watanabe Y, et al. The Elevation of Cardio-Ankle Vascular Index in a Patient With Malignant Lymphoma Treated With a Combination Therapy of Rituximab and Cyclophosphamide, Doxorubicin, Vincristine, and Prednisolone. J Clin Med Res. 2017;9(8):729-32. doi:10.14740/jocmr3071w.
253. Savarese G, Becher PM, Lund LH, et al. Global burden of heart failure: a comprehensive and 313 updated review of epidemiology. Cardiovasc Res. 2023;118(17):3272-87.
254. Groenewegen A, Rutten FH, Mosterd A, Hoes AW. Epidemiology of heart failure. Eur J Heart Fail. 2020;22:1342-56. doi:10.1002/ejhf.1858.
255. Поляков Д.С., Фомин И.В., Беленков Ю.Н. и др. Хроническая сердечная недостаточность в Российской Федерации: что изменилось за 20 лет наблюдения? Результаты исследования ЭПОХА–ХСН. Кардиология. 2021;61(4):4-14. doi:10.18087/cardio.2021.4.n1628.
256. Shahim B, Kapelios CJ, Savarese G, Lund LH. Global Public Health Burden of Heart Failure: An Updated Review. Card Fail Rev. 2023;9:e11. doi:10.15420/cfr.2023.05.
257. Franssen C, Chen S, Hamdani N, Paulus WJ. From comorbidities to heart failure with preserved9 ejection fraction: a story of oxidative stress. 2016;102:320-30.
258. Shim CY, Hong GR, Ha JW. Ventricular stiffness and ventriculararterial coupling in heart failure: what is it, how to assess, and why? Heart Fail Clin. 2019;15:267-74.
259. Weber T. The role of arterial stiffness and central hemodynamics in heart failure. Int J Heart Fail. 2020;2:209-30.
260. Tsao CW, Lyass A, Larson MG, et al. Relation of central arterial stiffness to incident heart failure in the community. J Am Heart Assoc. 2015;4(11):e002189.
261. Spronck B, Lee J, Oldland G, et al. P152 Prediction of Death or Heart Failure-related Hospitalizations by Cardio-ankle Vascular Index (CAVI) and CAVI0. Artery Res. 2019;25 (Suppl 1):189-90. doi:10.2991/artres.k-191224.172.
262. Schott A, Kluttig A, Mikolajczyk R, et al. Association of arterial stiffness and heart failure with preserved ejection fraction in the elderly population — results from the CARLA study. J Hum Hypertens. 2023;37:463-71. doi:10.1038/s41371-022-00703-y.
263. Pandey A, Shah SJ, Butler J, et al. Exercise intolerance in older adults with heart failure with preserved ejection fraction: JACC Stateof-the-Art. J Am Coll Cardiol. 2021;78(11):1166-87. doi:10.1016/j.jacc.2021.07.014.
264. Грачев Д.С., Петров В.С., Намазова К.И. и др. Сосудистая жесткость у пациентов старческого возраста с хронической сердечной недостаточностью. Российский медико-биологический вестник им. акад. И.П. Павлова. 2024;32(1):65-72. doi:10.17816/PAVLOVJ375266.
265. Takagi K, Ishihara S, Kenji N. Clinical significance of arterial stiffness as a factor for hospitalization of heart failure with preserved left ventricular ejection fraction: a retrospective matched case-control study. J Cardiol. 2020;76:171-6.
266. Sato Y, Yoshihisa A, Ichijo Y, et al. Cardio-Ankle Vascular Index Predicts Post-Discharge Stroke in Patients with Heart Failure. J Atheroscler Thromb. 2021;28(7):766-75. doi:10.5551/jat.58727.
267. Watanabe K, Yoshihisa A, Sato Y, et al. Cardio-Ankle Vascular Index Reflects Impaired Exercise Capacity and Predicts Adverse Prognosis in Patients With Heart Failure. Front Cardiovasc Med. 2021;8:631807. doi:10.3389/fcvm.2021.631807.
268. Chirinos JA, Segers P, Hughes T, Townsend R. Large-artery stiffness in health and disease: JACC state-of-the-art review. Journal of the American College of Cardiology. 2019;74(9):1237-63. doi:10.1016/j.jacc.2019.07.012.
269. Sagmeister P, Rosch, S, Fengler K, et al. Running on empty: Factors underpinning impaired cardiac output reserve in heart failure with preserved ejection fraction. Experimental Physiology. 2024:1-14. doi:10.1113/EP091776.
270. Lamacchia O, Sorrentino MR. Diabetes Mellitus, Arterial Stiffness and Cardiovascular Disease: Clinical Implications and the Influence of SGLT2i. Curr Vasc Pharmacol. 2021;19(2):233-40. doi:10.2174/1570161118666200317150359.
271. Nathaniel S, McGinty S, Witman MAH, et al. Impact of angiotensin receptor–neprilysin inhibition on vascular function in heart failure with reduced ejection fraction: A pilot study. Physiological Reports. 2022;10:e15209. doi:10.14814/phy2.15209.
272. Bunsawat K, Ratchford SM, Alpenglow JK, et al. Sacubitril-Valsartan improves conduit vessel function and functional capacity, and reduces inflammation in heart failure with reduced ejection fraction. Journal of Applied Physiology. 2021;130(1):256-68. doi:10.1152/japplphysiol.00454.2020.
273. Bunsawat K, Ratchford SM, Alpenglow JK, et al. Sympathoinhibitory effect of sacubitril-valsartan in heart failure with reduced ejection fraction: A pilot study. Autonomic Neuroscience, 2021;235:102834. doi:10.1016/j.autneu.2021.102834.
274. Sakai T, Miura S. Effects of Sodium-Glucose Cotransporter 2 Inhibitor on Vascular Endothelial and Diastolic Function in Heart Failure With Preserved Ejection Fraction — Novel Prospective Cohort Study. Circ Rep. 2019;1(7):286-95. doi:10.1253/circrep.CR-19-0018.
275. Ogawa A, Shimizu K, Nakagami T, et al. Physical function and cardioankle vascular index in elderly heart failure patients. Int Heart J. 2020;61:769-75. doi:10.1536/ihj.20-058.
276. Springer J.Muscle wasting and sarcopenia in heart failure and beyond: update 2017. ESC Heart Failure. 2017;4(4):492-8. doi:10.1002/ehf2.12237.
277. Kanzaki Sh, Ogawa A, Ikeda Y, et al. Short Physical Performance Battery and Cardio-Ankle Vascular Index Association in Older Patients with Heart Failure, International Heart Journal. 2024; 61(5):866-72. doi:10.1536/ihj.24-378.
278. Cockwell P, Fisher L-A. The global burden of chronic kidney disease. Lancet. 2020;395:662-4. doi:10.1016/S0140-6736(19)32977-0.
279. Клинические рекомендации. Хроническая болезнь почек (ХБП). Нефрология. 2021;25(5):10-82. doi:10.36485/1561-6274-2021-25-5-10-82.
280. Zoccali C, Mallamaci F, Adamczak M, et al. Cardiovascular complications in chronic kidney disease: a review from the European Renal and Cardiovascular Medicine Working Group of the European Renal Association. Cardiovasc Res. 2023;119(11):2017-32. doi:10.1093/cvr/cvad083.
281. Peyster E, Chen J, Feldman HI, et al.; CRIC Study Investigators. In-flammation and Arterial Stiffness in Chronic Kidney Disease: Findings From the CRIC Study. Am J Hypertens. 2017;30(4):400-8. doi:10.1093/ajh/hpw164.
282. Bassuk SS, Rifai N, Ridker PM. High-sensitivity C-reactive protein: clinical importance. Curr Probl Cardiol. 2004;29:439-93.
283. Danenberg HD, Szalai AJ, Swaminathan RV, et al. Increased thrombosis after arterial injury in human C-reactive proteintransgenic mice. Circulation. 2003;108:512-5. doi:10.1161/01.CIR.0000085568.13915.1E.
284. Schumacher W, Cockcroft J, Timpson NJ, et al. Association between C-reactive protein genotype, circulating levels, and aortic pulse wave velocity. Hypertension. 2009;53:150-7. doi:10.1161/HYPERTENSIONAHA.108.117622.
285. Vlachopoulos C, Pietri P, Aznaouridis K, et al. Relationship of fibrinogen with arterial stiffness and wave reflections. J Hypertens. 2007;25:2110-6. doi:10.1097/HJH.0b013e3282dc25da.
286. Xu C, Tsihlis G, Chau K, et al. Novel Perspectives in Chronic Kidney Disease-Specific Cardiovascular Disease. Int J Mol Sci. 2024;25(5):2658. doi:10.3390/ijms25052658.
287. Nemcsik J, Kiss I, Tislér A. Arterial stiffness, vascular calcification and bone metabolism in chronic kidney disease. World J Nephrol. 2012;1(1):25-34. doi:10.5527/wjn.v1.i1.25.
288. Edwards NC, Steeds RP, Stewart PM, et al. Effect of spironolactone on left ventricular mass and aortic stiffness in early-stage chronic kidney disease: a randomized controlled trial. J Am Coll Cardiol. 2009;54(6):505-12. doi:10.1016/j.jacc.2009.03.066.
289. Кобалава Ж.Д., Котовская Ю.В., Виллевальде С.В. и др. Артериальная жесткость и хроническая болезнь почек: причины и последствия. Рациональная Фармакотерапия в Кардиологии. 2014;10(1):83-91. doi:10.20996/1819-6446-2014-10-1-83-91.
290. Düsing P, Zietzer A, Goody PR, et al. Vascular pathologies in chronic kidney disease: pathophysiological mechanisms and novel therapeutic approaches. J Mol Med (Berl). 2021;99(3):335-48. doi:10.1007/s00109-021-02037-7.
291. Vervloet M, Cozzolino M. Vascular calcification in chronic kidney disease: different bricks in the wall? Kidney Int. 2017;91:808-17. doi:10.1016/j.kint.2016.09.024.
292. Chiriac C, Ciurea OA, Lipan M, et al. Vitamin D deficiency, bone turnover markers and arterial calcifications in non-dialysis chronic kidney disease patients. Acta Endocrinol (Buchar). 2024;20(1):12- 20. doi:10.4183/aeb.2024.12.
293. Townsend RR, Anderson AH, Chirinos JA, et al.; CRIC Study Investigators. Association of Pulse Wave Velocity With Chronic Kidney Disease Progression and Mortality: Findings From the CRIC Study (Chronic Renal Insufficiency Cohort). Hypertension. 2018;71(6):1101-7. doi:10.1161/HYPERTENSIONAHA.117.10648.
294. Hitsumoto T. Clinical Usefulness of the Cardio-Ankle Vascular Index as a Predictor of Primary Cardiovascular Events in Patients With Chronic Kidney Disease. J Clin Med Res. 2018;10(12):883-90. doi:10.14740/jocmr3631.
295. Pasquier F, Leys D: Why are stroke patients prone to develop dementia? J Neurol. 1997;244(3):135-42. doi:10.1007/s004150050064.
296. Baumbach GL, Siems JE, Heistad DD. Effects of local reduction in pressure on distensibility and composition of cerebral arterioles. Circ Res. 1991;68(2):338-51. doi:10.1161/01.res.68.2.338.
297. Iulita MF, Noriega de la Colina A, Girouard H.Arterial stiffness, cognitive impairment and dementia: confounding factor or real risk? J Neurochem. 2018;144(5):527-48. doi:10.1111/jnc.14235.
298. Sadekova N, Vallerand D, Guevara E, et al. Carotid calcification in mice: a new model to study the effects of arterial stiffness on the brain. J Am Heart Assoc. 2013;2(3):e000224. doi:10.1161/JAHA.113.000224.
299. Bajramovic JJ. Regulation of innate immune responses in the central nervous system. CNS Neurol Disord Drug Targets. 2011;10(1):4-24. doi:10.2174/187152711794488610.
300. Agrawal S, Schneider JA. Vascular pathology and pathogenesis of cognitive impairment and dementia in older adults. Cereb Circ Cogn Behav. 2022;3:100148. doi:10.1016/j.cccb.2022.100148.
301. Muhire G, Iulita MF, Vallerand D, et al. Arterial Stiffness Due to Carotid Calcification Disrupts Cerebral Blood Flow Regulation and Leads to Cognitive Deficits. J Am Heart Assoc. 2019;8(9):e011630. doi:10.1161/JAHA.118.011630.
302. Choi SY, Park HE, Seo H, et al. Arterial stiffness using cardioankle vascular index reflects cerebral small vessel disease in healthy young and middle aged subjects. J Atheroscler Thromb. 2013;20(2):178-85. doi:10.5551/jat.14753.
303. Cooper LL, Woodard T, Sigurdsson S, et al. Cerebrovascular Damage Mediates Relations Between Aortic Stiffness and Memory. Hypertension. 2016;67(1):176-82. doi:10.1161/HYPERTENSIONAHA.115.06398.
304. Li X, Lyu P, Ren Y, et al. Arterial stiffness and cognitive impairment. J Neurol Sci. 2017;380:1-10. doi:10.1016/j.jns.2017.06.018.
305. Hughes TM, Craft S, Lopez OL. Review of "the potential role of arterial stiffness in the pathogenesis of Alzheimer's disease". Neurodegener Dis Manag. 2015;5(2):121-35. doi:10.2217/nmt.14.53.
306. Sugimoto T, Misu S, Sawa R, et al. Association between the CardioAnkle Vascular Index and Executive Function in CommunityDwelling Elderly People. J Atheroscler Thromb. 2016;23(7):857-64. doi:10.5551/jat.31005.
307. Yamamoto N, Yamanaka G, Ishikawa M, et al. Cardio-ankle vascular index as a predictor of cognitive impairment in community-dwelling elderly people: four-year follow-up. Dement Geriatr Cogn Disord. 2009;28(2):153-8. doi:10.1159/000235642.
308. Ткачева О.Н., Яхно Н.Н., Незнанов Н.Г. и др. Клинические рекомендации "Когнитивные расстройства у лиц пожилого и старческого возраста". Журнал неврологии и психиатрии им. С.С. Корсакова. 2025;125(3-3):7-149. doi:10.17116/jnevro2025125337.
309. Cavero-Redondo I, Saz-Lara A, Lugones-Sánchez C, et al. Comparative effect of antihypertensive drugs in improving arterial stiffness in adults with hypertension (RIGIPREV study). A network meta-analysis. Front Pharmacol. 2023;14:1225795. doi:10.3389/fphar.2023.1225795.
310. Golovanova ED. Vascular remodeling and heart rate variability in different antihypertensive therapies. Rational Pharmacotherapy in Cardiology. 2008;4(1):62-6. doi:10.20996/1819-6446-2008-4-1.
311. Vicario A, Coca A, Gasecki D, et al. Effects of antihypertensive treatment on cognitive decline. ESH Scientific Newsletter. 2019; 20:nr73.
312. Peters R, Yasar S, Anderson CS, et al. Investigation of antihypertensive class, dementia, and cognitive decline: A meta-analysis. Neurology. 2020;94(3):e267-e281. doi:10.1212/WNL.0000000000008732.
313. Hughes D, Judge C, Murphy R, et al. Association of Blood Pressure Lowering With Incident Dementia or Cognitive Impairment: A Systematic Review and Meta-analysis. JAMA. 2020;323(19):1934- 44. doi:10.1001/jama.2020.4249.
314. The SPRINT MIND Investigators for the SPRINT Research Group. Effect of intensive vs standard blood pressure control on probable dementia: a randomized clinical trial. JAMA. 2019;321(6):553-61. doi:10.1001/jama.2018.21442.
315. Sink KM, Leng X, Williamson J, et al. Angiotensin-converting enzyme inhibitors and cognitive decline in older adults with hypertension: results from the Cardiovascular Health Study. Arch Intern Med. 2009;169(13):1195-202. doi:10.1001/archinternmed.2009.175.
316. Peters R, Collerton J, Granic A, et al. Antihypertensive drug use and risk of cognitive decline in the very old: an observational study — the Newcastle 85+ Study. J Hypertens. 2015;33(10):2156-64. doi:10.1097/HJH.0000000000000653.
317. Forette F, Seux ML, Staessen JA, et al. Prevention of dementia in randomized double-blind placebo-controlled Systolic Hypertension in Europe (Syst-Eur) trial. Lancet. 1998;352(9137):1347-51. doi:10.1016/S0140-6736(98)03086-4.
318. Forette F, Seux M-L, Staessen JA, et al. The prevention of dementia with antihypertensive treatment: new evidence from the Systolic Hypertension in Europe (Syst-Eur) study. Arch Intern Med. 2002;162(18):2046-52. doi:10.1001/archinte.162.18.2046.
319. Yasar S, Xia J, Yao W, et al. Antihypertensive drugs decrease risk of Alzheimer disease: Ginkgo Evaluation of Memory Study. Neurology. 2013;81(10):896-903. doi:10.1212/WNL.0b013e3182a35228.
320. Chuang YF, Breitner JCS, Chiu YL, et al. Use of diuretics is associated with reduced risk of Alzheimer's disease: the Cache County Study. Neurobiol Aging. 2014;35(11):2429-35. doi:10.1016/j.neurobiolaging.2014.05.002.
321. Ou YN, Tan CC, Shen XN, et al. Blood Pressure and Risks of Cognitive Impairment and Dementia: A Systematic Review and MetaAnalysis of 209 Prospective Studies. Hypertension. 2020;76(1):217- 25. doi:10.1161/HYPERTENSIONAHA.120.14993.
322. PROGRESS Collaborative Group. Randomised trial of a perindoprilbased blood-pressure-lowering regimen among 6,105 individuals with previous stroke or transient ischaemic attack. Lancet. 2001;358(9287):1033-41. doi:10.1016/S0140-6736(01)06178-5.
323. Tzourio C, Anderson C, Chapman N, et al. Effects of blood pressure lowering with perindopril and indapamide therapy on dementia and cognitive decline in patients with cerebrovascular disease. Arch Intern Med. 2003;163(9):1069-75. doi:10.1001/archinte.163.9.1069.
324. Levi Marpillat N, Macquin-Mavier I, Tropeano AI, et al. Antihypertensive classes, cognitive decline and incidence of dementia: a network meta-analysis. J Hypertens. 2013;31(6):1073-82. doi:10.1097/HJH.0b013e3283603f53.
325. Chiu WC, Ho WC, Lin MH, et al. Angiotension receptor blockers reduce the risk of dementia. Journal of Hypertension. 2014,32:938- 47. doi:10.1097/HJH.0000000000000086.
326. Larsson SC, Markus HS. Does Treating Vascular Risk Factors Prevent Dementia and Alzheimer's Disease? A Systematic Review and Meta-Analysis. J Alz-heimers Dis. 2018;64(2):657-68. doi:10.3233/JAD-180288.
327. Trompet S, Westendorp RG, Kamper AM, de Craen AJ. Use of calcium antagonists and cognitive decline in old age. The Leiden 85-plus study. Neurobiol Aging. 2008;29(2):306-8. doi:10.1016/j.neurobiolaging.2006.10.006.
328. Upala S, Wirunsawanya K, Jaruvongvanich V, Sanguankeo A. Effects of statin therapy on arterial stiffness: A systematic review and metaanalysis of randomized controlled trial. Int J Cardiol. 2017;227:338- 41. doi:10.1016/j.ijcard.2016.11.073.
329. Rizos EC, Agouridis AP, Elisaf MS. The effect of statin therapy on arterial stiffness by measuring pulse wave velocity: a systematic review. Curr Vasc Pharmacol. 2010;8(5):638-44. doi:10.2174/157016110792006950.
330. Power MC, Weuve J, Sharrett AR, et al. Statins, cognition, and dementia — systematic review and methodological commentary. Nat Rev Neurol. 2015;11(4):220-9. doi:10.1038/nrneurol.2015.35.
331. Adhikari A, Tripathy S, Chuzi S, et al. Association between statin use and cognitive function: A systematic review of randomized clinical trials and observational studies. J Clin Lipidol. 2021;15(1):22-32.e12. doi:10.1016/j.jacl.2020.10.007.
332. Olmastroni E, Molari G, De Beni N, et al. Statin use and risk of dementia or Alzheimer's disease: a systematic review and metaanalysis of observational studies. Eur J Prev Cardiol. 2022; 29(5):804-14. doi:10.1093/eurjpc/zwab208.
333. Gustavsson AM, Stomrud E, Abul-Kasim K, et al. Cerebral Microbleeds and White Matter Hyperintensities in Cognitively Healthy Elderly: A Cross-Sectional Cohort Study Evaluating the Effect of Arterial Stiffness. Cerebrovasc Dis Extra. 2015;5(2):41-51. doi:10.1159/000377710.
334. Singer J, Trollor JN, Crawford J, et al. The association between pulse wave velocity and cognitive function: the Sydney Memory and Ageing Study. PLoS One. 2013;8(4):e61855. doi:10.1371/journal.pone.0061855.
335. Sugawara N, Yasui-Furukori N, Umeda T, et al. Comparison of ankle-brachial pressure index and pulse wave velocity as markers of cognitive function in a community-dwelling population. BMC Psychiatry. 2010;10:46. doi:10.1186/1471-244X-10-46.
336. Pase MP, Pipingas A, Kras M, et al. Healthy middle-aged individuals are vulnerable to cognitive deficits as a result of increased arterial stiffness. J Hypertens. 2010;28(8):1724-9. doi:10.1097/HJH.0b013e32833b1ee7.
337. Poels MM, van Oijen M, Mattace-Raso FU, et al. Arterial stiffness, cognitive decline, and risk of dementia: the Rotterdam study. Stroke. 2007;38(3):888-92. doi:10.1161/01.STR.0000257998.33768.87.
338. Escárcega RO, Lipinski MJ, García-Carrasco M, et al. Inflammation and atherosclerosis: Cardiovascular evaluation in patients with autoimmune diseases. Autoimmun Rev. 2018;17(7):703-8. doi:10.1016/j.autrev.2018.01.021.
339. Dregan A, Charlton J, Chowienczyk P, et al. Chronic inflammatory disorders and risk of type 2 diabetes mellitus, coronary heart disease, and stroke: a population-based cohort study. Circulation. 2014;130:837-44. doi:10.1161/CIRCULATIONAHA.114.009990.
340. Ahlehoff O, Gislason GH, Charlot M, et al. Psoriasis is associated with clinically signif-icant cardiovascular risk: a Danish nationwide cohort study. J Intern Med. 2011;270:147-57. doi:10.1111/j.1365-2796.2010.02310.x.
341. Dregan А, Сhowienczyk P, Molokhia M. Cardiovascular and type 2 diabetes morbidity and all-cause mortality among diverse chronic inflammatory disorders. Heart. 2017;103:1867-73. doi:10.1136/heartjnl-2017-311214.
342. Crowson CS, Rollefstad S, Ikdahl E, et al. Impact of risk factors associated with cardiovascular outcomes in patients with rheumatoid arthritis. Ann Rheum Dis. 2018;77(1):48-54. doi:10.1136/annrheumdis-2017-211735.
343. Fan F, Galvin A, Fang l, et al. Comparison of inflammation, arterial stiffness and traditional cardiovascular risk factors between rheumatoid arthritis and inflammatory bowel disease. J Inflamm. 2014;11:29. doi:10.1186/s12950-014-0029-0.
344. Dregan A.Arterial stiffness association with chronic inflammatory disorders in the UK Biobank study. Heart Br Card Soc. 2018;104(15):1257-62. doi:10.1136/heartjnl-2017-312610.
345. Anyfanti P, Triantafyllou A, Gkaliagkousi E, et al. Association of noninvasive hemo-dynamics with arterial stiffness in rheumatoid arthritis. Scand Cardiovasc J. 2018;52(4):171-6. doi:10.1080/14017431.2018.1453943.
346. Maloberti A, Riva M, Tadic M, et al. Association Between Atrial, Ventricular and Vascular Morphofunctional Alterations in Rheumatoid Arthritis. High Blood Press Cardiovasc Prev. 2018;25(1):97-104. doi:10.1007/s40292-017-0246-8.
347. Anyfanti P, Bekiari E, Angeloudi E, et al. Arterial stiffness in rheumatoid arthritis: Current knowledge and future perspectivess. Indian J Rheumatol. 2022;17:157-65. doi:10.4103/injr.injr_254_21.
348. Ambrosino P, Tasso M, Lupoli R, et al. Non-invasive assessment of arterial stiffness in patients with rheumatoid arthritis: A systematic review and meta-analysis of literature studies. Ann Med. 2015;47:457-67. doi:10.3109/07853890.2015.1068950.
349. Wang P, Huang L, Xu Q, et al. Assessment of aortic stiffness in patients with rheumatoid arthritis using pulse wave velocity: An update meta-analysis. Arch Med Res. 2019;50:401-12. doi:10.1016/j.arcmed.2019.10.010.
350. Vázquez-Del Mercado M, Gomez-Bañuelos E, et al. Disease duration of rheumatoid arthritis is a predictor of vascular stiffness: a cross-sectional study in patients without known cardiovascular comorbidities. Medicine (Baltimore). 2017;96(33):e7862. doi:10.1097/MD.0000000000007862.
351. Князева Л.А., Мещерина Н.С., Горяйнов И.И. и др. Оценка состояния эндотелиальной функции и ригидности артериальной стенки у больных ревматоидным артритом. Курский научно-практический вестник "Человек и его здоровье". 2013;(4):78-84.
352. Özcan ANŞ, Aslan AN, Ünal Ö, et al. Novel ultrasound-based technique to establish a correlation between disease activity and local carotid stiffness parameters in rheumatoid arthritis. Med Ultrason. 2017;19(3):288-94. doi:10.11152/mu-949.
353. Aslan AN, Şirin Özcan AN, Erten Ş, et al. Assessment of local carotid stiffness in seronegative and seropositive rheumatoid arthritis. Scand Cardiovasc J. 2017;51(5):255-60. doi:10.1080/14017431.2017.1343493.
354. Cioffi G, Viapiana O, Ognibeni F, et al. Clinical profile and outcome of patients with rheumatoid arthritis and abnormally high aortic stiffness. Eur J Prev Cardiol. 2016;23(17):1848-59. doi:10.1177/2047487316649762.
355. Круглый Л.Б., Заирова А.Р., Фомичева О.А. и др. Показатели жесткости артерий у больных ревматоидным артритом и ишемической болезнью сердца. Научно-практическая ревматология. 2017;55(4):382-7. doi:10.14412/1995-4484-2017-382-387.
356. Sacre K, Escoubet B, Pasquet B, et al. Increased arterial stiffness in systemic lupus erythematosus (SLE) patients at low risk for cardiovascular disease: a cross-sectional controlled study. PloS One. 2014;9(4):e94511. doi:10.1371/journal.pone.0094511.
357. Santos MJ, Carmona-Fernandes D, Canhão H, et al. Early vascular alterations in SLE and RA patients–a step towards understanding the associated cardiovascular risk. PloS One. 2012;7(9):e44668. doi:10.1371/journal.pone.0044668.
358. Jurcut C, Caraiola S, Nitescu D, et al. Subclinical vascular disease in patients with systemic lupus erythematosus: the additive deleterious effect of the antiphospholipid syndrome. Jt Bone Spine Rev Rhum. 2012;79(6):628-9. doi:10.1016/j.jbspin.2012.01.014.
359. Parra S, Lopez-Dupla M, Ibarretxe D, et al. Patients With Systemic Lupus Erythema-tosus Show an Increased Arterial Stiffness That is Predicted by IgM Anti-β2-Glycoprotein I and Small Dense HighDensity Lipoprotein Particles. Arthritis Care Res. 2019;71(1):116-25. doi:10.1002/acr.23594.
360. Gerli R, Vaudo G, Bocci EB, et al. Functional impairment of the arterial wall in primary Sjögren’s syndrome: combined action of immunologic and inflammatory factors. Arthritis Care Res (Hoboken). 2010;62:712-8. doi:10.1002/acr.20117.
361. Sezis Demirci M, Karabulut G, Gungor O, et al. Is There an Increased Arterial Stiffness in Patients with Primary Sjögren’s Syndrome? Intern Med. 2016;55(5):455-9. doi:10.2169/internalmedicine.55.3472.
362. Atzeni F, Sarzi-Puttini P, Signorello MC, et al. New parameters for identifying subclinical atherosclerosis in patients with primary Sjögren’s syndrome: a pilot study. Clin Exp Rheumatol. 2014;32(3):361-8. doi:10.1136/annrheumdis-2013-eular.848.
363. Sabio JM, Sánchez‐Berná I, Martinez‐Bordonado J, et al. Prevalence of and Factors Associated With Increased Arterial Stiffness in Patients With Primary Sjögren’s Syndrome. Arthritis Care Res. 2015;67(4):554-62. doi:10.1002/acr.22493.
364. Gyöngyösi M, Pokorny G, Jambrik Z, et al. Cardiac manifestations in primary Sjögren’s syndrome. Ann Rheum Dis. 1996;55(7):450-4. doi:10.1136/ard.55.7.450.
365. Patschan D, Sugiarto N, Henze E, et al. Early endothelial progenitor cells and vascular stiffness in psoriasis and psoriatic arthritis. Eur J Med Res. 2018;23(1):56. doi:10.1186/s40001-018-0352-7.
366. Balta I, Balta S, Demirkol S, et al. Aortic arterial stiffness is a moderate predictor of cardiovascular disease in patients with psoriasis vulgaris. Angiology. 2014;65(1):74-8. doi:10.1177/0003319713485805.
367. Costa L, Caso F, D’Elia L, et al. Psoriatic arthritis is associated with increased arterial stiffness in the absence of known cardiovascular risk factors: a case control study. Clin Rheumatol. 2012;31(4):711-5. doi:10.1007/s10067-011-1892-1.
368. Bai R, Zhang Y, Liu W, et al. The Relationship of Ankylosing Spondylitis and Subclinical Atherosclerosis: A Systemic Review and Meta-Analysis. Angiology. 2019;70(6):492-500. doi:10.1177/0003319718814309.
369. Avram C, Drăgoi RG, Popoviciu H, et al. Association between arterial stiffness, disease activity and functional impairment in ankylosing spondylitis patients: a crosssectional study. Clin Rheumatol. 2016;35(8):2017-22. doi:10.1007/s10067-016-3297-7.
370. Kaplanoglu H, Özişler C. Evaluation of subclinical atherosclerosis using ultrasound radiofrequency data technology in patients diagnosed with ankylosing spondylitis. J Ultra-sound Med Off J Am Inst Ultrasound Med. 2019;38(3):703-11. doi:10.1002/jum.14754.
371. Berg IJ, Semb AG, van der Heijde D, et al. CRP and ASDAS are associated with future elevated arterial stiffness, a risk marker of cardiovascular disease, in patients with ankylosing spondylitis: results after 5-year follow-up. Ann Rheum Dis. 2015;74(8):1562-6. doi:10.1136/annrheumdis-2014-206773.
372. Triantafyllias К, Thiele LE, Mandel A, et al. Arterial Stiffness as a Surrogate Marker of Cardiovascular Disease and Atherosclerosis in Patients with Vasculitides: A Literature Review. Diagnostics. 2023;13:3603. doi:10.3390/diagnostics13243603.
373. Lyon AR, Lopez-Fernandez T, Couch SM, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;23(10):e333-e465. doi:10.1093/eurheartj/ehac244.
374. Васюк Ю. А., Шупенина Е.Ю., Носова А. Г. и др. Вазотоксические эффекты противоопухолевой терапии: обзор современных данных. Рациональная Фармакотерапия в Кардиологии. 2023;19(2):203-8. doi:10.20996/1819-6446-2023-03-03. EDN ANRXKY.
375. Parr SK, Liang J, Schadler KL, et al. Anticancer Therapy–Related Increases in Arterial Stiffness: A Systematic Review and MetaAnalysis. J Am Heart As-soc. 2020;9:e015598. doi:10.1161/JAHA.119.015598.
376. Frye JN, Sutterfield SL, Caldwell JT, et al. Vascular and autonomic changes in adult cancer patients receiving anticancer chemotherapy. J Appl Physiol. 2018;125:198-204. doi:10.1152/japplphysiol.00005.2018.
377. Campia U, Moslehi JJ, Amiri-Kordestani L, et al. Cardio-oncology: vascular and metabolic perspectives: a scientific statement from the American Heart Association. Circulation. 2019;139:e579-e602. doi:10.1161/CIR.0000000000000641.
378. Cao Z, Xu C, Yang H, et al. The role of healthy lifestyle in cancer incidence and temporal transitions to cardiometabolic disease. JACC CardioOncology. 2021;3:663-74. doi:10.1016/j.jaccao.2021.09.016.
379. Lakatta EG. Arterial and cardiac aging: major shareholders in cardiovascular disease enterprises: part III: cellular and molecular clues to heart and arterial aging. Circulation. 2003;107:490-7. doi:10.1161/01.cir.0000048894.99865.02.
380. Donato AJ, Black AD, Jablonski KL, et al. Aging is associated with greater nuclear NF kappa B, reduced I kappa B alpha, and increased expression of proinflammatory cytokines in vascular endothelial cells of healthy humans. Aging Cell. 2008;7:805-12. doi:10.1111/j.1474-9726.2008.00438.x.
381. Moreau KL, Gavin KM, Plum AE, Seals DR. Oxidative stress explains differences in large elastic artery compliance between sedentary and habitually exercising postmenopausal women. Menopause. 2006;13:951-8. doi:10.1097/01.gme.0000243575.09065.48.
382. Visvikis A, Kyvelou SM, Pietri P, et al. Cardiotoxic Profile and Arterial Stiffness of Adjuvant Chemotherapy for Colorectal Cancer. Cancer Manag Res. 2020;12:1175-85. doi:10.2147/CMAR.S223032.
383. McAllister RM, Laughlin MH. Vascular nitric oxide: effects of physical activity, importance for health. Essays Biochem. 2006;42:119-31. doi:10.1042/bse0420119.
384. Wilkinson IB, Franklin SS, Cockcroft JR. Nitric oxide and the regulation of large artery stiffness: from physiology to pharmacology. Hypertension. 2004;44:112-6. doi:10.1161/01.HYP.0000138068.03893.40.
385. Stocker R, Keaney JF Jr.Role of oxidative modifications in atherosclerosis. Physiol Rev. 2004;84:1381-478. doi:10.1152/physrev.00047.2003.
386. Pacher P, Szabo C. Role of peroxynitrite in the pathogenesis of cardiovascular complications of diabetes. Curr Opin Pharmacol. 2006;6:136-41. doi:10.1016/j.coph.2006.01.001.
387. Zieman SJ, Melenovsky V, Kass DA. Mechanisms, pathophysiology, and therapy of arterial stiffness. Arterioscler Thromb Vasc Biol. 2005;25:932-43. doi:10.1161/01.ATV.0000160548.78317.29.
388. Res E, Kyvelou SM, Vlachopoulos C, et al. Metastatic malignancies and the effect on arterial stiffness and blood pressure levels: the possible role of chemotherapy. Onco Targets Ther. 2018:11:6785- 93. doi:10.2147/OTT.S156318.
389. Townsend RR, Wilkinson IB, Schiffrin EL, et al. Recommendations for improving and standardizing vascular research on arterial stiffness: a scientific statement from the American Heart Association. Hypertension. 2015;66:698-722. doi:10.1161/HYP.0000000000000033.
390. Mitchell GF, Hwang SJ, Vasan RS, et al. Arterial stiffness and cardiovascular events: the Framingham Heart Study. Circulation. 2010;121:505-11. doi:10.1161/CIRCULATIONAHA.109.886655.
391. Moreau KL, Donato AJ, Seals DR, et al. Regular exercise, hormone replacement therapy and the age-related decline in carotid arterial compliance in healthy women. Cardiovasc Res. 2003;57:861-8. doi:10.1016/s0008-6363(02)00777-0.
392. DeVan AE, Seals DR. Vascular health in the ageing athlete. Exp Physiol. 2012;97:305-10. doi:10.1113/expphysiol.2011.058792.
393. Plantinga Y, Ghiadoni L, Magagna A, et al. Supplementation with vitamins C and E improves arterial stiffness and endothelial function in essential hypertensive patients. Am J Hypertens. 2007;20:392-7. doi:10.1016/j.amjhyper.2006.09.021.
394. Rammos C, Hendgen-Cotta UB, Sobierajski J, et al. Dietary nitrate reverses vascular dysfunction in older adults with moderately increased cardiovascular risk. J Am Coll Cardiol. 2014;63:1584-5. doi:10.1016/j.jacc.2013.08.691.
395. Herceg-Cavrak V, Ahel V, Batinica M, et al. Increased arterial stiffness in children treated with anthracyclines for malignant disease. Coll Antropol. 2011;35:389-95.
396. Jenei Z, Bardi E, Magyar MT, et al. Anthracycline causes impaired vascular endothelial function and aortic stiffness in long term survivors of childhood cancer. Pathol Oncol Res. 2013;19:375-83. doi:10.1007/s12253-012-9589-6.
397. Васюк Ю.А., Гендлин Г.Е., Емелина Е.И. и др. Согласованное мнение российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Российский кардиологический журнал. 2021;26(9):4703. doi:10.15829/1560-4071-2021-4703.
398. Meyer CC, Calis KA, Burke LB, et al. Symptomatic cardio-toxicity associated with 5-fluorouracil. Pharmacotherapy. 1997;17(4): 729-36.
399. Sara JD, Kaur J, Khodadadi R, et al. 5-fluorouracil and cardiotoxicity: a review. Ther Adv Med Oncol. 2018;10:175883591878014. doi:10.1177/1758835918780140.
400. Прибылова Н.Н., Прибылов С.А., Степченко А.А. и др. Методика измерения жесткости сосудистой стенки в практике кардиологического отделения. Мето¬дические рекомендации. Курск, 2014. 29 с. ISBN: 978-5-7487- 1670-3.
401. Shirai K, Suzuki K, Tsuda S, et al. Comparison of Cardio-Ankle Vascular Index (CAVI) and CAVI0 in Large Healthy and Hypertensive Populations. J.Atheroscler Thromb. 2019;26(7):603-15. doi:10.5551/jat.48314.
402. Макеева Л.М., Емелина Е.И., Быкова А.В. и др. Сравнительный анализ нарушений сердечнососудистой системы у пациентов с хроническим миелолейкозом на фоне лечения ингибиторами тирозинкиназы. Клиническая Онкогематология. 2020;13(1):104-11. doi:10.21320/2500-2139-2020-13-1-104-111.
403. Hadzijusufovic E, Albrecht-Schgoer K, Huber K, et al. Nilotinibinduced vasculopathy: identification of vascular endothelial cells as a primary target site. Leukemia. 2017;31(11):2388-97. doi:10.1038/leu.2017.245.
404. Mizurini DM, Hottz ED, Bozza PT, Monteiro RQ. Fundamentals in Covid-19-Associated Thrombosis: Molecular and Cellular Aspects. Front Cardiovasc Med. 2021;8. doi:10.3389/fcvm.2021.785738.
405. Ackermann M, Verleden SE, Kuehnel M, et al. Pulmonary Vascular Endothelialitis, Thrombosis, and Angiogenesis in Covid-19. New Eng J Med. 2020;383(2):120-8. doi:10.1056/nejmoa2015432.
406. Подзолков В.И., Тарзиманова А.И., Брагина А.Е. и др. Поражение сердечно-сосудистой системы у больных с коронавирусной инфекцией SARS-CoV-2. Часть 1: предикторы развития неблагоприятного прогноза. Рациональная фармакотерапия в кардиологии. 2021;17(6):825- 30. doi:10.20996/1819-6446-2021-11-03.
407. Подзолков В.И., Брагина А.Е., Тарзиманова А.И. и др. Артериальная гипертензия и неблагоприятное течение COVID-19 среди госпитализированных больных: данные когортного исследования из России. Рациональная Фармакотерапия в Кардиологии. 2023;19(1):4-10. doi:10.20996/1819-6446-2023-01-10.
408. Xiong TY, Redwood S, Prendergast B, Chen M. Coronaviruses and the cardiovascular system: acute and long-term implications. Eur Heart J. 2020;41(19):1798-800. doi:10.1093/eurheartj/ehaa231.
409. Szeghy RE, Province VM, Stute NL, et al. Carotid stiffness, intimamedia thickness and aortic augmentation index among adults with SARS-CoV-2. Exp Physiol. 2022;107(7):694-707. doi:10.1113/EP089481.
410. Ratchford SM, Stickford JL, Province VM, et al. Vascular alterations among young adults with SARS-CoV-2. Am J Physiol Heart Circ Physiol. 2021;320(1):H404-H410. doi:10.1152/ajpheart.00897.2020.
411. Schnaubelt S, Oppenauer J, Tihanyi D, et al. Arterial stiffness in acute COVID-19 and potential associations with clinical outcome. J Intern Med. 2021;290(2):437-43. doi:10.1111/joim.13275.
412. Faria D, Moll-Bernardes RJ, Testa L, et al. Sympathetic Neural Over-drive, Aortic Stiffening, Endothelial Dysfunction, and Impaired Exercise Capacity in Severe COVID-19 Survivors: A Mid-Term Study of Cardiovascular Sequelae. Hypertension. 2023;80(2):470-81. doi:10.1161/HYPERTENSIONAHA.122.19958.
413. Stamatelopoulos K, Georgiopoulos G, Baker KF, et al. Pisa COVID-19 Research Group; Newcastle COVID-19 Research Group. Estimated pulse wave velocity improves risk stratification for all-cause mortality in patients with COVID-19. Sci Rep. 2021;11(1):20239. doi:10.1038/s41598-021-99050-0.
414. Kumar N, Kumar S, Kumar A, et al. The COSEVAST Study Outcome: Evidence of COVID-19 Severity Proportionate to Surge in Arterial Stiffness. Indian J Crit Care Med. 2021;25(10):1113-9. doi:10.5005/jp-journals-10071-24000.
415. Rodilla E, López-Carmona MD, Cortes X, et al.; SEMI-COVID-19 Network. Impact of Arterial Stiffness on All-Cause Mortality in Patients Hospitalized With COVID-19 in Spain. Hypertension. 2021;77(3):856-67. doi:10.1161/HYPERTENSIONAHA.120.16563.
416. Aydın E, Kant A, Yilmaz G.Evaluation of the cardio-ankle vascular index in COVID-19 patients. Rev Assoc Med Bras (1992). 2022; 68(1):73-6. doi:10.1590/1806-9282.20210781.
417. Kar M.Vascular Dysfunction and Its Cardiovascular Consequences During and After COVID-19 Infection: A Narrative Review. Vasc Health Risk Manag. 2022;18:105-12. doi:10.2147/VHRM.S355410.
418. Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020;395(10234):1417-8. doi:10.1016/S0140-6736(20)30937-5.
419. Подзолков В.И., Тарзиманова А.И., Брагина А.Е. и др. Влияние терапии спиронолактоном на активность системы матриксных металлопротеиназ у больных с хронической сердечной недостаточностью, перенесших коронавирусную инфекцию SARS-CoV-2. Кардиоваскулярная терапия и профилактика. 2022;21(10):3431. doi:10.15829/1728-8800-2022-3431.
420. Подзолков В.И., Покровская А.Е., Ванина Д.Д., Сафронова Т.А. Взаимосвязь резистина с сосудистой жесткостью и тяжестью течения новой коронавирусной инфекции COVID-19 у пациентов с разным индексом массы тела. Лечебное дело. 2023;(1):72-80. doi:10.24412/2071-5315-2023-12953.
421. Подзолков В.И., Брагина А.Е., Тарзиманова А.И. и др. Взаимосвязь сердечно-лодыжечного сосудистого индекса с маркерами тромбообразования у госпитализированных больных COVID-19. Терапевтический архив. 2023;95(7):548-53. doi:10.26442/00403660.2023.07.202292.
422. Jud P, Gressenberger P, Muster V, et al. Evaluation of Endothelial Dysfunction and Inflammatory Vasculopathy After SARS-CoV-2 Infection-A Cross-Sectional Study. Front Cardiovasc Med. 2021; 8:750887. doi:10.3389/fcvm.2021.750887.
423. Lambadiari V, Mitrakou A, Kountouri A, et al. Association of COVID-19 with impaired endothelial glycocalyx, vascular function and myocardial deformation 4 months after infection. Eur J Heart Fail. 2021;23(11):1916-26. doi:10.1002/ejhf.2326.
424. Szeghy RE, Stute NL, Province VM, et al. Six-month longitudinal tracking of arterial stiffness and blood pressure in young adults following SARS-CoV-2 infection. J Appl Physiol (1985). 2022;132(5):1297-309. doi:10.1152/japplphysiol.00793.2021.
425. Zanoli L, Gaudio A, Mikhailidis DP, et al. Methuselah Study Group. Vascular Dysfunction of COVID-19 Is Partially Reverted in the Long-Term. Circ Res. 2022;130(9):1276-85. doi:10.1161/CIRCRESAHA.121.320460.
426. Ikonomidis I, Lambadiari V, Mitrakou A, et al. Myocardial work and vascular dysfunction are partially improved at 12 months after COVID-19 infection. Eur J Heart Fail. 2022;24(4):727-9. doi:10.1002/ejhf.2451.
427. Олейников В.Э., Авдеева И.В., Полежаева К.Н. и др. Структурно-функциональные свойства артерий у лиц, перенесших новую коронавирусную инфекцию. Кардиоваскулярная терапия и профилактика. 2023;22(5):3541. doi:10.15829/1728-8800-2023-3541.
428. Bruno RM, Spronck B, Hametner B, et al. Covid-19 Effects on ARTErial StIffness and Vascular AgeiNg: CARTESIAN Study Rationale and Protocol. Artery Res. 2020;27(2):59. doi:10.2991/artres.k.201124.001.
429. Namba T, Masaki N, Takase B, Adachi T. Arterial Stiffness Assessed by Cardio-Ankle Vascular Index. Int J Mol Sci. 2019;20(15):3664. doi:10.3390/ijms20153664.
430. Trifonova SS, Gaisenok OV, Sidorenko BA. Application of Methods of Assessment of Vascular Wall Stiffness in Clinical Practice: Capabilities of Cardio-Ankle Vascular Index. Kardiologiia. 2015; 55(4):61-6. doi:10.18565/cardio.2015.4.61-66.
431. Бахолдин И.Б., Милягин В.А., Талов А.В., Тентюков Д.Е. Индекс stelari start — новый перспективный показатель сосудистой индекс stelari start — новый перспективный показатель сосудистой жесткости. Вестник смоленской государственной медицинской академии. 2022;21(3):96-103. doi:10.37903/vsgma.2022.3.11. EDN: EVRYPK.
432. Васютин И.А., Леон К., Сафронова Т.А. и др. Сравнение нового индекса жесткости сосудистой стенки START с индексом CAVI, оценка их значений и корреляций с клиническими показателями. Российский кардиологический журнал. 2023;28(1):5272. doi:10.15829/1560-4071-2023-5272. EDN: IQNVXV.
433. Сумин А.Н., Щеглова А.В., Бахолдин И.Б. Возможности нового показателя START в оценке сосудистой жесткости у здоровых лиц. Артериальная гипертензия. 2023;29(1):38-50. doi:10.18705/1607-419X-2023-29-1-38-50.
434. Сумин А.Н., Щеглова А.В., Барбараш О.Л. Прогностическое значение нового индекса жесткости артерий START у пациентов с ишемической болезнью сердца после коронарного шунтирования. Российский кардиологический журнал. 2024;29(12):5952. doi:10.15829/1560-4071-2024-5952. EDN: XPBYYL.
435. Spronck B, Terentes-Printzios D, Avolio AP, et al.; Association for Research into Arterial Structure and Physiology (ARTERY), the European Society of Hypertension Working Group on Large Arteries, European Cooperation in Science and Technology (COST) Action VascAgeNet, North American Artery Society, ARTERY LATAM, Pulse of Asia, and Society for Arterial Stiffness — Germany-Austria-Switzerland (DeGAG). 2024 Recommendations for Validation of Noninvasive Arterial Pulse Wave Velocity Measurement Devices. Hypertension. 2024;81(1):183-92. doi:10.1161/HYPERTENSIONAHA.123.21618.
Об авторах
В. И. ПодзолковРоссия
Подзолков Валерий Иванович — профессор, д.м.н., зав. кафедрой факультетской терапии 2 ИКМ им. Н. В. Склифосовского
Москва
Т. А. Сафронова
Россия
Сафронова Татьяна Аркадьевна — доцент, к.м.н., доцент кафедры факультетской терапии 2, ИКМ им. Н. В. Склифосовского
Москва
Ю. А. Васюк
Россия
Васюк Юрий Александрович — профессор, д.м.н., зав. кафедрой госпитальной терапии 1
Москва
Ю. В. Котовская
Россия
Котовская Юлия Викторовна — профессор, д.м.н., зам. директора по научной работе ОСП Российский геронтологический научно-клинический центр ФГАОУ ВО "РНИМУ им. Н. И. Пирогова" Минздрава России (Пироговский Университет)
Москва
О. А. Кисляк
Россия
Кисляк Оксана Андреевна — профессор, д.м.н., профессор кафедры факультетской терапии Института клинической медицины
Москва
А. В. Стародубова
Россия
Стародубова Антонина Владимировна — д.м.н., доцент, зам. директора по научной и лечебной работе ФГБУН "Федеральный исследовательский центр питания и биотехнологии"; зав. кафедрой факультетской терапии Института клинической медицины ФГАОУ ВО "РНИМУ им. Н. И. Пирогова" Минздрава России (Пироговский Университет)
Москва
Ф. Ю. Копылов
Россия
Копылов Филипп Юрьевич — профессор, д.м.н., директор Института персонализированной кардиологии Центра "Цифровой биодизайн и персонализированное здравоохранение"
Москва
М. Е. Евсевьева
Россия
Евсевьева Мария Евгеньевна — профессор, д.м.н., зав. кафедрой факультетской терапии ФГБОУ ВО "Ставропольский государственный медицинский университет" Минздрава России, руководитель Центра здоровья и антивозрастной медицины НИО СтГМУ, Заслуженный врач РФ
Ставрополь
А. Н. Сумин
Россия
Сумин Алексей Николаевич — д.м.н., зав. лабораторией коморбидности при сердечно-сосудистых заболеваниях отдела клинической кардиологии
Кемерово
А. И. Тарзиманова
Россия
Тарзиманова Аида Ильгизовна — профессор, д.м.н., профессор кафедры факультетской терапии 2 ИКМ им. Н. В. Склифосовского
Москва
О. Д. Остроумова
Россия
Остроумова Ольга Дмитриевна — профессор, д.м.н., зав. кафедрой терапии и полиморбидной патологии им. акад. М. С. Вовси ФГБОУ ДПО "Российская медицинская академия непрерывного профессионального образования" Минздрава России; профессор кафедры клинической фармакологии и пропедевтики внутренних болезней ФГАОУ ВО "Первый МГМУ им. И. М. Сеченова" Минздрава России (Сеченовский Университет); профессор кафедры терапии, кардиологии и функциональной диагностики с курсом нефрологии ФГБУ ДПО "Центральная государственная медицинская академия Управления делами Президента РФ"
Москва
В. Н. Ларина
Россия
Ларина Вера Николаевна — профессор, д.м.н., зав. кафедрой поликлинической терапии Института клинической медицины
Москва
О. С. Павлова
Беларусь
Павлова Ольга Степановна — доцент, д.м.н., зав. лабораторией артериальной гипертонии, Республиканский научно-практический центр "Кардиология", профессор кафедры кардиологии и внутренних болезней
Минск
С. В. Иванова
Россия
Иванова Светлана Владимировна — доцент, д.м.н., профессор кафедры клинической функциональной диагностики лечебного факультета НОИ клинической медицины им. Н. А. Семашко
Москва
В. С. Чулков
Россия
Чулков Василий Сергеевич — доцент, д.м.н., директор медицинского института, профессор кафедры внутренних болезней
Великий Новгород
А. А. Беставашвили
Россия
Беставашвили Афина Автандиловна — к.м.н., с.н.с. Института персонализированной кардиологии Центра "Цифровой биодизайн и персонализированное здравоохранение"
Москва
А. И. Кочетков
Россия
Кочетков Алексей Иванович — доцент, к.м.н., доцент кафедры терапии и полиморбидной патологии имени академика М. С. Вовси
Москва
Ю. В. Лискова
Россия
Лискова Юлия Владимировна — доцент, д.м.н., профессор кафедры факультетской терапии Института клинической медицины
Москва
А. В. Лузина
Россия
Лузина Александра Вячеславовна — к.м.н., н.с. лаборатории сердечно-сосудистого старения, ОСП Российский геронтологический научно-клинический центр, ФГАОУ ВО "РНИМУ им. Н. И. Пирогова" Минздрава России (Пироговский Университет)
Москва
А. Е. Покровская
Россия
Покровская Анна Евгеньевна — доцент, к.м.н., доцент кафедры факультетской терапии 2, ИКМ им. Н. В. Склифосовского
Москва
О. В. Сергеева
Россия
Сергеева Оксана Владимировна — к.м.н., доцент кафедры факультетской терапии ФГБОУ ВО "Ставропольский государственный медицинский университет" Минздрава России, врач-кардиолог Центра здоровья и антивозрастной медицины НИО СтГМУ
Ставрополь
Е. Ю. Шупенина
Россия
Шупенина Елена Юрьевна — к.м.н., профессор кафедры госпитальной терапии 1
Москва
А. Е. Брагина
Россия
Брагина Анна Евгеньевна — доцент, д.м.н., профессор кафедры факультетской терапии 2 ИКМ им. Н. В. Склифосовского
Москва
Дополнительные файлы
- CAVI является маркером артериальной жесткости от начала аорты до артерий лодыжки.
- Определение CAVI является простым, хорошо стандартизированным, точным и воспроизводимым методом оценки артериальной жесткости, не зависящим от уровня АД во время измерения.
- Изменение образа жизни, модификация и лечение факторов риска (ФР) ССЗ снижают CAVI.
- Пороговое значение 9,0 позволяет прогнозировать у пациентов наличие высокого риска ССС.
Рецензия
Для цитирования:
Подзолков В.И., Сафронова Т.А., Васюк Ю.А., Котовская Ю.В., Кисляк О.А., Стародубова А.В., Копылов Ф.Ю., Евсевьева М.Е., Сумин А.Н., Тарзиманова А.И., Остроумова О.Д., Ларина В.Н., Павлова О.С., Иванова С.В., Чулков В.С., Беставашвили А.А., Кочетков А.И., Лискова Ю.В., Лузина А.В., Покровская А.Е., Сергеева О.В., Шупенина Е.Ю., Брагина А.Е. Диагностика артериальной жесткости с помощью сердечно-лодыжечного сосудистого индекса. Согласованное мнение экспертов. Кардиоваскулярная терапия и профилактика. 2025;24(8):4481. https://doi.org/10.15829/1728-8800-2025-4481. EDN: FDECVC
For citation:
Podzolkov V.I., Safronova T.A., Vasyuk Yu.A., Kotovskaya Yu.V., Kislyak O.A., Starodubova A.V., Kopylov F.Yu., Evsevieva M.E., Sumin A.N., Tarzimanova A.I., Ostroumova O.D., Larina V.N., Pavlova O.S., Ivanova S.V., Chulkov V.S., Bestavashvili A.A., Kochetkov A.I., Liskova Yu.V., Luzina A.V., Pokrovskaya A.E., Sergeeva O.V., Shupenina E.Yu., Bragina A.E. Diagnosis of arterial stiffness using the cardio-ankle vascular index. Expert consensus. Cardiovascular Therapy and Prevention. 2025;24(8):4481. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4481. EDN: FDECVC
JATS XML

























































