Перейти к:
Ассоциация гуморального иммунного статуса и параметров тромбодинамики после вакцинации Гам-КОВИД-Вак и КовиВак
https://doi.org/10.15829/1728-8800-2022-3295
Аннотация
Продолжающаяся пандемия новой коронавирусной инфекции (COVID-19, COronaVIrus Disease 2019) делает крайне актуальным изучение иммуногенности, длительности сохранения иммунного ответа и безопасности имеющихся вакцин.
Цель. В рамках проспективного наблюдательного исследования изучить ассоциации между уровнем IgG к S белку коронавируса SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2) и параметрами тромбодинамики у лиц, вакцинированных против SARS-CoV-2 вакцинами Гам-КОВИД-Вак и КовиВак.
Материал и методы. В исследование включено 137 человек, которые полностью прошли первые 3 визита: 30 человек получили вакцину Гам-КОВИД-Вак, 107 человек — КовиВак. У участников исследования проводился забор венозной крови перед введением I-го и II-го компонентов вакцины, а также через 42 дня со дня введения I-го компонента с целью количественного определения уровня IgG к S белку. На каждом из визитов проводился анализ показателей плазменного гемостаза при помощи теста тромбодинамики.
Результаты. В течение периода наблюдения отмечалась отчетливая динамика нарастания уровня IgG антител (АТ) к S белку в обеих группах. При этом увеличение уровня АТ в динамике было значительно бóльшим в группе лиц, вакцинированных Гам-КОВИД-Вак. По результатам исследования плазменного звена гемостаза корреляционной связи между уровнями IgG АТ на каждом визите и параметрами тромбодинамики выявлено не было.
Заключение. Полученные данные демонстрируют способность обеих вакцин стимулировать выработку АТ к SARS-CoV-2. Однако выраженность иммунного ответа на введение Гам-КОВИД-Вак значительно выше. Отсутствие корреляции между показателями тромбодинамики и уровня специфических АТ говорит о том, что вакцинация против COVID-19 вакцинами Гам-КОВИД-Вак и КовиВак не вызывает изменений плазменного гемостаза и не увеличивает риск тромбообразования.
Ключевые слова
Для цитирования:
Драпкина О.М., Бернс С.А., Горшков А.Ю., Рыжакова Л.Н., Иванова А.А., Емельянов А.В., Воинова С.Н., Каратеев Р.А., Араблинский Н.А., Родионова А.А., Башняк В.С., Покровская М.С. Ассоциация гуморального иммунного статуса и параметров тромбодинамики после вакцинации Гам-КОВИД-Вак и КовиВак. Кардиоваскулярная терапия и профилактика. 2022;21(6):3295. https://doi.org/10.15829/1728-8800-2022-3295
For citation:
Drapkina O.M., Berns S.A., Gorshkov A.Yu., Ryzhakova L.N., Ivanova A.A., Emelyanov A.V., Voinova S.N., Karateev R.A., Arablinskiy N.A., Rodionova A.A., Bashnyak V.S., Pokrovskaya M.S. Association of humoral immunity status and thrombodynamics after vaccination with Gam-COVID-Vac and CoviVac. Cardiovascular Therapy and Prevention. 2022;21(6):3295. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3295
Введение
Более двух лет продолжается пандемия коронавирусной инфекции (COVID-19, COronaVIrus Disease 2019), вызванная вирусом SARS-CoV-2 (Severe Acute Respiratory Syndrome CoronaVirus 2). На текущий момент во всем мире зарегистрировано >460 млн случаев COVID-19, из которых летально закончились >6 млн1. В настоящее время единственным известным способом специфической профилактики COVID-19 является массовая вакцинация населения. В РФ зарегистрированы несколько типов вакцин, различающиеся по механизму действия: векторные (Гам-КОВИД-Вак, Гам-КОВИД-Вак-Лио, Гам-КОВИД-Вак-М, Спутник Лайт), вакцины на основе пептидных антигенов (ЭпиВакКорона и ЭпиВакКорона-Н), а также инактивированная цельновирионная вакцина КовиВак2. В государственном реестре РФ 18 марта 2022г зарегистрирована субъединичная рекомбинантная вакцина Конвасэл3.
Данные литературы свидетельствуют о том, что уровень специфических антител (АТ) IgG к S белку коронавируса SARS-CoV-2 в плазме крови напрямую влияет на эффективность поствакцинального иммунитета. По результатам британского исследования с участием 1575 лиц, вакцинированных векторной вакциной ChAdOx1 nCoV-19, выявлено, что вероятность развития клинически выраженной симптоматической формы COVID-19 достоверно коррелирует с уровнем АТ IgG к S-белку [1]. Уровень АТ измерялся через 28 сут. после введения IIго компонента вакцины. Также выяснилось, что риск развития бессимптомной формы COVID-19 с уровнем АТ в крови не коррелирует. По мнению авторов, четкий уровень АТ, при котором необходима ревакцинация, до сих пор не установлен. В еще одной работе было продемонстрировано, что у лиц >50 лет наблюдается снижение эффективности поствакцинального иммунитета против тяжелых форм COVID-19 на 32% через 6 мес. после введения I-го компонента вакцины [2].
Крайне важны не только данные об эффективности и иммуногенности доступных вакцин, но и тщательная оценка их профиля безопасности. До сих пор в мире активно обсуждается проблема влияния вакцинации на систему гемостаза и риск тромбоэмболических осложнений (ТЭО), что делает необходимыми исследования профиля безопасности отечественных вакцин. В рамках российского, продолжающегося в настоящее время исследования СИРИУС (Состояние Иммунной системы и исходы у лиц, вакциниРованных протИв вирУСа SARS-CoV2), проводилась оценка влияния вакцин КовиВак и Гам-КОВИД-Вак на показатели плазменного гемостаза у вакцинированных лиц, а также оценка иммуногенности и общего профиля безопасности данных вакцин. Было продемонстрировано, что вакцинация КовиВак и Гам-КОВИД-Вак не оказывает статистически значимого влияния на состояние плазменного гемостаза, более того, за время наблюдения не было зарегистрировано ни одного случая артериального или венозного тромбоза и ни одного случая развития серьезных нежелательных явлений. При этом вакцины Гам-КОВИД-Вак и КовиВак продемонстрировали удовлетворительную иммуногенность, более выраженную в группе вакцинированных Гам-КОВИД-Вак [3].
Однако в представленном выше исследовании [3] не оценивалось наличие корреляционной связи между приростом титра АТ и изменениями в показателях плазменного гемостаза после проведенной вакцинации от COVID-19. Настоящее исследование, проведенное в рамках более детального определения эффективности и безопасности использования отечественных вакцин, позволяет в определенной мере ответить на данный вопрос.
Целью настоящего исследования явилось изучение ассоциации гуморального иммунного статуса и параметров тромбодинамики у лиц, вакцинированных Гам-КОВИД-Вак и КовиВак.
Материал и методы
Критерии включения: возраст ≥18 лет; отсутствие противопоказаний к вакцинации; проживание в Москве и Московской области; подписание информированного согласия. Критерии невключения: наличие противопоказаний к вакцинации; перенесенная ранее COVID-19; предшествовавшая вакцинация против вируса SARS-CoV-2; отказ от участия в исследовании.
Исследуемую группу в настоящей работе составили 137 добровольцев, полностью прошедших 3 визита исследования, не имевших признаков острой респираторной вирусной инфекции, прошедших вакцинацию на базе ФГБУ “НМИЦ ТПМ” Минздрава России с использованием вакцин Гам-КОВИД-Вак и КовиВак. Все участники исследования имели возможность выбрать, какой вакциной прививаться, и подписали информированное согласие на участие в исследовании. Всем участникам выполнен анализ крови для определения количественного уровня специфических IgМ и IgG АТ к S белку коронавируса SARS-CoV-2 и анализ системы плазменного гемостаза на Визите 1 (до введения I-го компонента вакцины), на Визите 2 (через 21/14 дней после введения I-го компонента вакцины), и на Визите 3 (через 42 сут. после введения I-го компонента вакцины). Среди 137 добровольцев 107 были вакцинированы КовиВак и 30 — Гам-КОВИД-Вак. Клиническая характеристика участников исследования, получавших различные вакцины против вируса SARS-CoV-2, представлена в таблице 1. Исследуемые группы статистически значимо не различались по демографическим параметрам и наличию хронических заболеваний.
Таблица 1
Клиническая характеристика групп участников исследования
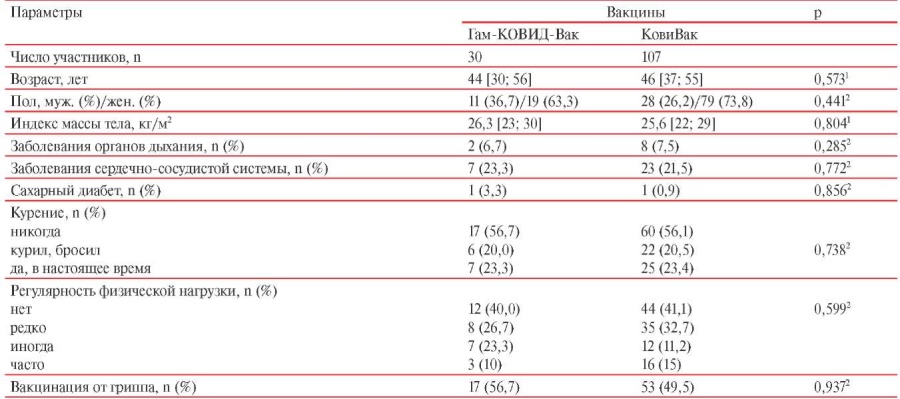
Примечание: данные представлены в виде Me [Q25; Q75]; p — уровень значимости; 1 — критерий Манна-Уитни; 2 — точный критерий Фишера.
В ходе исследования сравнивали уровень IgМ и IgG АТ к S белку после введения вакцин Гам-КОВИД-Вак и КовиВак с помощью иммуноферментного анализа, тест-система “SARS-COV-2 IgG-Вектор” производства ГНЦ “Вектор”. Для исключения развития COVID-19 до введения первой дозы вакцин и при дальнейшем наблюдении использовалось определение IgМ анти-SARSCoV2 АТ, высокий уровень которых отражает острую вирусную инфекцию.
Для контроля параметров плазменного гемостаза применялся метод динамической тромбофотометрии, осуществляемый при помощи диагностической лабораторной системы “Регистратор тромбодинамики Т-2” (“ГемаКор”, Россия). Система использовалась для диагностики нарушений гемостаза путем исследования in vitro пространственно-временной динамики свертывания крови — тромбодинамики. Процесс свертывания инициируется тканевым активатором свертывания крови в приближенных к физиологическим условиям. Предварительно центрифугированные и дозированные образцы плазмы крови помещаются в каналы измерительной кюветы, после чего в каналы кюветы вводится специальная вставка-активатор, на кончике которой нанесен активатор свертывания. При соприкосновении плазмы крови с активатором запускается каскад гемостаза и начинает расти фибриновый сгусток. С помощью цифровой фотокамеры процесс возникновения и роста сгустка регистрируется в режиме последовательной фотосъемки методом темного поля. Полученные изображения позволяют зафиксировать, как меняются размеры, форма и плотность фибринового сгустка на протяжении 30 мин от начала процесса. На основе полученных изображений оцениваются численные параметры пространственновременнóй динамики роста фибринового сгустка, в частности, задержка роста сгустка (Tlag), скорость роста сгустка (V), начальная скорость (Vi) и стационарная скорость роста сгустка (Vst), а также размер сгустка через 30 мин (CS), плотность сгустка (D) и время появления спонтанных сгустков (Tsp).
За время, прошедшее между визитами, участники исследования не контактировали с лицами, зараженными COVID-19. Исследование выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice). Протокол исследования одобрен локальным этическим комитетом учреждения.
В ходе исследования также оценивалась частота развития COVID-19 среди участников исследования и появление любых нежелательных реакций, которые можно было связать с применением вакцин. С этой целью всем участникам исследования был предоставлен специальный опросник, разработанный специалистами ФГБУ “НМИЦ ТПМ” Минздрава России. При опросе добровольцев о наличии нежелательных реакций выделялись следующие симптомы: болезненность и локальные изменения в месте введения препарата, повышение температуры и артериального давления, зуд и покраснение кожи.
Для статистической обработки результатов применяли программу IBM SPSS v. 23. Уровень значимости различий считался достоверным при p<0,05. Переменные представляли в виде медианы (Me) и интерквартильного размаха (Q25; Q75), для долей и частот данные представлены в процентах. Для оценки наличия связи между изменениями в гуморальном иммунном статусе участника исследования (АТ класса G) и результатами теста тромбодинамики после проверки распределения соответствующих переменных на нормальность, был использован критерий линейной корреляции Пирсона; значения r были проверены при помощи t-критерия Стьюдента с дальнейшим сравнением значения t-критерия с критическим значением t-критерия Стьюдента с учетом заданного уровня значимости α и числа степеней свободы (n-2). При pнабл >pожид значение r принималось статистически значимым. Соответственно, при α=0,05, значение pожид для группы Гам-КОВИД-Вак составило 2,049; для группы КовиВак — 1,984. Результаты были оценены по таблице Чеддока, в рамках которой сила корреляционной связи при значении r<0,3 может быть признана слабой.
Результаты
В обеих группах уровень IgM АТ за время участия в исследовании не нарастал, что свидетельствует об отсутствии лабораторных признаков острой COVID-19. За время наблюдения ни у одного из участников не наблюдалось клинических признаков острой респираторной вирусной инфекции.
В группе лиц, вакцинированных Гам-КОВИДВак, отмечалось резкое повышение уровня IgG АТ к S-белку на Визите 2; через 21 сут. медиана уровня IgG АТ составила 251,5 [ 89,2; 540] BAU/мл (BAU — binding antibody units). Таким образом, дельта уровня IgG АТ между Визитом 1 и Визитом 2 составила 96,08 [ 17; 250] BAU/мл (рисунок 1). При контроле на 42 сут. было выявлено фактически удвоение количества IgG АТ, медиана в группе составила 536,5 [ 238,2; 562] BAU/мл, при оценке уровня АТ между Визитом 1 и Визитом 2 также имел место 2-кратный рост дельта уровня IgG АТ — 194,87 [ 26; 453] BAU/мл.
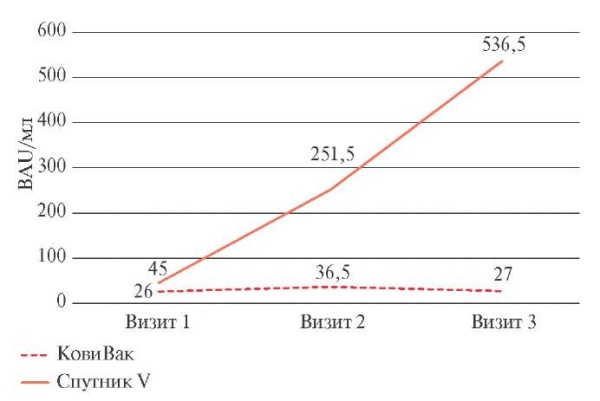
Рис. 1 Изменение уровня IgG АТ к S-белку SARS-CoV-2 у лиц, вакцинированных КовиВак и Гам-КОВИД-Вак (значения точек представлены медианами).
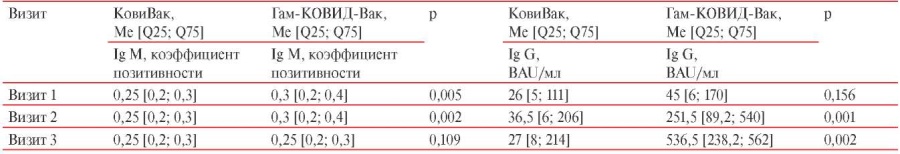
В группе лиц, вакцинированных КовиВак, было достигнуто увеличение уровня IgG АТ у большинства обследованных независимо от пола, возраста и сопутствующих заболеваний (таблица 2). Медиана уровня IgG АТ на Визите 1 составила 26 [ 5; 111] BAU/мл, на Визите 2 — 36,5 [ 6; 206] BAU/ мл. Таким образом, можно наблюдать увеличение уровня IgG АТ, дельта — 22,15 [ 4; 100] BAU/мл, однако на Визите 3, через 42 сут. с момента введения I-го компонента, отмечается снижение уровня IgG АТ (медиана — 27 [ 8; 214] BAU/мл).
Таблица 2
Уровень IgG АТ к S-белку SARS-CoV-2 и IgM АТ у лиц, вакцинированных КовиВак и Гам-КОВИД-Вак
Для получения сопоставимых данных, анализ показателей плазменного гемостаза у вакцинированных лиц был также проведен перед введением I-го компонента вакцины, перед введением II-го компонента и на 42 сут. после введения I-го компонента (таблицы 3 и 4).
Таблица 3
Параметры тромбодинамики у лиц, вакцинированных КовиВак
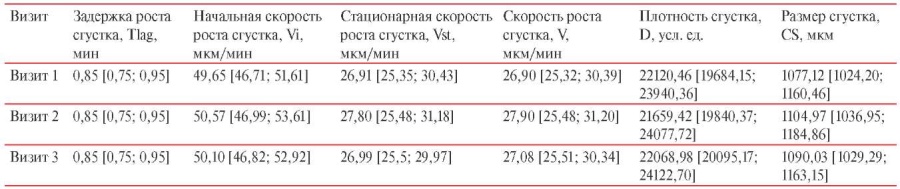
Таблица 4
Параметры тромбодинамики у лиц, вакцинированных Гам-КОВИД-Вак
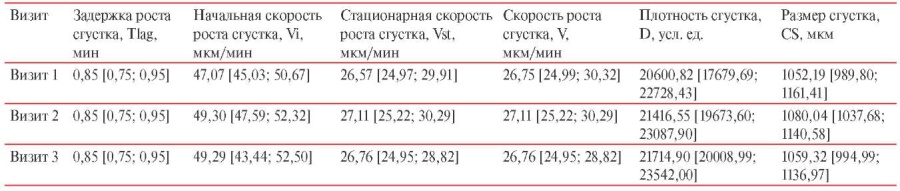
За основной критерий оценки изменения плазменного гемостаза был взят показатель V (средняя скорость роста сгустка на интервале 15-25 мин). По результатам контрольных оценок процесса образования фибринового сгустка плазмы крови у вакцинированных лиц в группе КовиВак значение показателя V на Визите 1 составило 26,90 [ 25,32; 30,39]; на Визитах 2 и 3 — 27,90 [ 25,48; 31,20] и 27,08 [ 25,51; 30,34] мкм/мин, соответственно (таблица 3).
В группе лиц, вакцинированных Гам-КОВИД-Вак, величина данного показателя на Визите 1 была на уровне 26,75 [ 24,99; 30,32]; на Визитах 2 и 3 — 27,11 [ 25,22; 30,29] и 26,76 [ 24,95; 28,82] мкм/мин, соответственно (таблица 4).
Значение V не показывало динамики ни к увеличению, ни к снижению скорости роста в обеих группах вакцинированных лиц, и не выходило за пределы референсных значений (V=20-29 мкм/мин) [4].
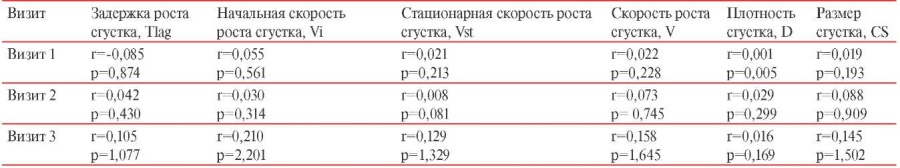
С целью оценки корреляционной связи в первую очередь был определен параметр V как наиболее информативный интегральный показатель отклонений в сторону гипоили гиперкоагуляции, который и был соотнесен с уровнем IgG АТ на каждом из визитов (таблицы 5 и 6) — значимой связи не было выявлено. В ходе расчетов при проверке других параметров тромбодинамики ни для одного из них сила корреляционной связи также не превышала 0,3. Таким образом, по нашим данным, корреляционной связи между уровнями IgG АТ на каждом визите и параметрами тромбодинамики не выявлено.
Таблица 5
Корреляционная связь между уровнем IgG и параметрами тромбодинамики у вакцинированных Гам-КОВИД-Вак
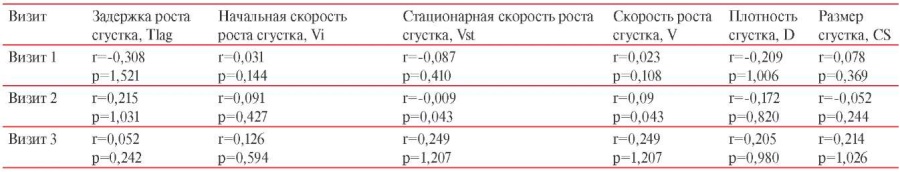
Таблица 6
Корреляционная связь между уровнем IgG и параметрами тромбодинамики у вакцинированных КовиВак
Обсуждение
Пандемия COVID-19 на протяжении последних двух лет остается ведущей медицинской и социальной проблемой. COVID-19 характеризуется высокой заболеваемостью, тяжелым течением, риском развития летального исхода и различных осложнений, существенно влияющих на здоровье и качество жизни. Главным методом предупреждения дальнейшего прогрессирования пандемии является формирование популяционного иммунитета путем всеобщей вакцинации. В настоящее время создан широкий спектр вакцин. По оперативным данным на 24 мая 2022г в России было вакцинировано >87 млн человек.
Одним из главных вопросов, связанных с использованием различных вакцин, является оценка их сравнительной иммуногенности и безопасности. Основными критериями эффективности вакцины следует считать снижение заболеваемости и уменьшение количества летальных исходов, связанных с конкретной инфекцией, при длительном многолетнем наблюдении. Эффективность и безопасность первой в мире отечественной вакцины ГамКОВИД-Вак доказана в масштабных исследованиях [5][6]. Также для сравнения вакцин доступен анализ параметров иммуногенности, в частности, нарастания титра антивирусных АТ и длительности сохранения их высокого уровня в плазме крови. Полученные в ходе настоящего исследования данные позволяют утверждать, что КовиВак и ГамКОВИД-Вак эффективно формируют иммунитет к конкретному антигену. Также в рамках данного исследования у вакцинированных лиц не было выявлено значимых лабораторных изменений плазменного гемостаза по сравнению с исходными показателями.
Полученные данные свидетельствуют о формировании иммунного ответа в обеих группах уже после введения I-го компонента вакцины. Согласно полученным данным, до вакцинации между группами КовиВак и Гам-КОВИД-Вак не было статистически значимых различий в уровне IgG АТ к S-белку SARS-CoV-2. Однако на Визитах 2 и 3 в группе Гам-КОВИД-Вак наблюдался более выраженный рост уровня IgG АТ к S-белку, чем в группе КовиВак. В течение периода наблюдения отмечалась отчетливая динамика нарастания уровня IgG АТ к S белку в обеих группах. При этом увеличение уровня АТ (дельта значений визитов 1-2 и 2-3) было значительно бóльшим в группе лиц, вакцинированных Гам-КОВИД-Вак. Иммуногенность Гам-КОВИД-Вак ранее неоднократно демонстрировалась в российских исследованиях. В работе К. Г. Шаповалова и др. (2021) было показано, что поствакцинальный иммунитет вырабатывается у >90% вакцинированных Гам-КОВИДВак [7].
У инактивированной цельновирионной вакцины КовиВак выработка IgG АТ ниже, чем у векторных и РНК-вакцин; это может быть обусловлено тем, что на вакцину КовиВак вырабатываются АТ, содержащие в себе информацию обо всех белках вируса, и иммунная память формируется на всю структуру вирусного агента, что позволяет даже при небольшом количестве АТ иметь эффективную защиту против этой инфекции4. Также необходимо учитывать, что контроль уровня АТ, проводившийся методом иммуноферментного анализа, не позволяет оценить качество АТ, а определяет лишь их количественное значение. Кроме того, следует принимать во внимание, что в данной работе не изучался клеточный иммунитет.
Настороженность в отношении увеличения риска ТЭО после вакцинации вызвана данными, ранее полученным при исследовании зарубежных вакцин. В связи с сообщениями о тяжелых и даже смертельных тромбоэмболиях среди привитых Oxford-AstraZeneca ChAdOx1-S, вакцинация данной вакциной была приостановлена в нескольких европейских странах. Суммарно было зарегистрировано 30 случаев преимущественно венозных ТЭО среди ~5 млн вакцинированных ChAdOx1-S в Европе. Впоследствии данное решение было пересмотрено в связи с уточнением данных: было выяснено, что число ТЭО у вакцинированных не превышает таковое в общей популяции, а польза вакцинации значительно превосходит возможные риски [8].
Группа экспертов из Великобритании, Норвегии и Германии опубликовала данные о состоянии, которое предложено называть “вакциноиндуцированной иммунной тромботической тромбоцитопенией” (ВИТТ) [9]. Развитие ВИТТ связывают с введением аденовирусных вакцин, причем, чаще всего их первой дозы. В связи с образованием аутоантител, напрямую активирующих тромбоциты, у пациентов с ВИТТ развивается коагулопатия потребления, тромбоцитопения, гипофибриногенемия и повышение уровня D-димера, что влечет за собой повышение риска артериального и венозного тромбоза. Предположительно, развитие ВИТТ обусловлено тем, что векторные вакцины содержат человеческие и неструктурные вирусные белки, против которых могут образоваться функциональные аутоантитела. В Великобритании было зарегистрировано 220 случаев ВИТТ среди вакцинированных первой дозой ChAdOx1-S [9].
При проверке корреляционной связи прироста титра АТ с изменениями параметров тромбодинамики, статистически значимого влияния на показатели гемостаза в течение всех 3 визитов не оказало введение ни вакцины КовиВак, ни Гам-КОВИДВак, что может свидетельствовать об их безопасности в рамках влияния на плазменный гемостаз.
Заключение
Согласно полученным данным, применение вакцины Гам-КОВИД-Вак обеспечивает значительное нарастание уровня поствакцинальных IgG АТ к S-белку SARS-CoV-2 — как после введения I-го, так и после применения II-го компонента препарата. Это может служить косвенным критерием формирования эффективного гуморального иммунитета против COVID-19. При использовании КовиВак такого результата не наблюдалось, но оценивались только количественные показатели иммуноглобулинов. Ни одна из вакцин, участвовавших в исследовании, не влияла отрицательно на процесс плазменного гемостаза и не вызывала ТЭО у вакцинированных. Динамика показателей тромбообразования не была связана с увеличением уровня АТ на фоне введения вакцин.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Оперативные данные. Коронавирус COVID-19: Официальная информация о коронавирусе в России на портале — стопкоронавирус.рф (xn--80aesfpebagmfblc0a.xn--p1ai).
2. Письмо Министерства здравоохранения Российской Федерации от 29 июня 2021г. № 30-4/И/2-9825. Временные методические рекомендации: “Порядок проведения вакцинации взрослого населения против COVID-19”.
3. Государственный реестр лекарственных средств. ЛП-007967. Конвасэл®.
4. “Разработчик “Ковивака” заявил, что вакцина на 98,4% защищает от заражения коронавирусом.” Официальный информационный портал Республики Саха (Якутия). 30 сентября 2021, с. А1. ТААС. TASS. “The developer of Kovivak stated that the vaccine protects 98.4% from coronavirus infection.” The official information portal of the Republic of Sakha (Yakutia). September 30, 2021, p. A1. TAAS.
Список литературы
1. Feng S, Phillips DJ, White T, et al.; Oxford COVID Vaccine Trial Group. Correlates of protection against symptomatic and asymptomatic SARS-CoV-2 infection. Nat Med. 2021;27(11):2032-40. doi:10.1038/s41591-021-01540-1.
2. Feikin D, Higdon MM, Abu-Raddad LJ, et al. Duration of Effectiveness of Vaccines Against SARS-CoV-2 Infection and COVID-19 Disease: Results of a Systematic Review and MetaRegression. Lancet. 2021. doi:10.2139/ssrn.3961378.
3. Драпкина О. М., Бернс С. А., Горшков А. Ю. и др. Параметры тромбодинамики у лиц, вакцинированных против вируса SARS-CoV-2. Профилактическая медицина. 2021;24(12):2430. doi:10.17116/profmed20212412124.
4. Баландина А. Н., Кольцова Е. М., Шибеко А. М. и др. Тромбо динамика: новый подход к диагностике нарушений системы гемостаза. Вопросы гематологии/ онкологии и иммунопатологии в педиатрии. 2018;17(4):114-26. doi:10.24287/1726-1708-2018-17-4-114-126.
5. Nogrady B. Mounting evidence suggests Sputnik COVID vaccine is safe and effective. Nature. 2021;595(7867):339-40. doi:10.1038/d41586-021-01813-2.
6. Logunov DY, Dolzhikova IV, Shcheblyakov DV, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous primeboost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021;397(10275):67181. doi:10.1016/S0140-6736(21)00234-8.
7. Шаповалов К. Г., Степанов А. В., Бурдинская Ж. С. и др. Трехмесячные результаты вакцинации медработников моностационара препаратом “Гам-КОВИД-Вак”. Иммунология. 2021;42(2):125-30. doi:10.33029/0206-49522021-42-2-125-130.
8. Wise J. Covid-19: European countries suspend use of OxfordAstraZeneca vaccine after reports of blood clots. BMJ. 2021;372:n699. doi:10.1136/bmj.n699.
9. Pavord S, Scully M, Hunt BJ, et al. Clinical Features of VaccineInduced Immune Thrombocytopenia and Thrombosis. N Engl J Med. 2021;385(18):1680-9. doi:10.1056/NEJMoa2109908.
Об авторах
О. М. ДрапкинаРоссия
Оксана Михайловна Драпкина — доктор медицинских наук, профессор, академик РАН, директор.
Москва
С. А. Бернс
Россия
Светлана Александровна Бернс— доктор медицинских наук, профессор.
Москва
А. Ю. Горшков
Россия
Александр Юрьевич Горшков — кандидат медицинских наук, зам. директора по научной и амбулаторно-поликлинической работе.
Москва
Л. Н. Рыжакова
Россия
Лидия Николаевна Рыжакова — кандидат медицинских наук, главный врач консультативно-диагностического центра.
Москва
А. А. Иванова
Россия
Анна Александровна Иванова — клинический ординатор.
Москва. Тел.: +7 (926) 214-74-68
А. В. Емельянов
Россия
Александр Владимирович Емельянов — зам. главного врача по организационно-методической работе.
Москва
С. Н. Воинова
Россия
Светлана Николаевна Воинова — зам. главного врача консультативно-диагностического центра по медицинской части.
Москва
и
Р. А. Каратеев
Россия
Роман Андреевич Каратеев — клинический ординатор.
Москва
Н. А. Араблинский
Россия
Никита Александрович Араблинский — клинический ординатор.
Москва
А. А. Родионова
Россия
Алина Андреевна Родионова — студент 5 курса.
Москва
В. С. Башняк
Россия
Владислав Сергеевич Башняк — аспирант отдела фундаментальных и прикладных аспектов ожирения.
Москва
М. С. Покровская
Россия
Мария Сергеевна Покровская — кандидвт биологических наук, ведущий научный сотрудник, руководитель лаборатории “Банк биологического материала”.
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Драпкина О.М., Бернс С.А., Горшков А.Ю., Рыжакова Л.Н., Иванова А.А., Емельянов А.В., Воинова С.Н., Каратеев Р.А., Араблинский Н.А., Родионова А.А., Башняк В.С., Покровская М.С. Ассоциация гуморального иммунного статуса и параметров тромбодинамики после вакцинации Гам-КОВИД-Вак и КовиВак. Кардиоваскулярная терапия и профилактика. 2022;21(6):3295. https://doi.org/10.15829/1728-8800-2022-3295
For citation:
Drapkina O.M., Berns S.A., Gorshkov A.Yu., Ryzhakova L.N., Ivanova A.A., Emelyanov A.V., Voinova S.N., Karateev R.A., Arablinskiy N.A., Rodionova A.A., Bashnyak V.S., Pokrovskaya M.S. Association of humoral immunity status and thrombodynamics after vaccination with Gam-COVID-Vac and CoviVac. Cardiovascular Therapy and Prevention. 2022;21(6):3295. (In Russ.) https://doi.org/10.15829/1728-8800-2022-3295
JATS XML

























































