Перейти к:
Факторы, ассоциированные с дефицитом железа у больных с хронической сердечной недостаточностью
https://doi.org/10.15829/1728-8800-2023-3367
Аннотация
Цель. Установить факторы, ассоциированные с наличием дефицита железа (ДЖ) у больных с хронической сердечной недостаточностью (ХСН).
Материал и методы. Обследовано 294 больных с ХСН II-IV функционального класса по NYHA (New York Heart Association), из которых 213 пациентов имели ДЖ, 81 — без ДЖ. Всем больным проводили клиническое обследование, сбор анамнеза с учетом наличия, длительности и тяжести коморбидных состояний, лекарственный анамнез, эхокардио,0графию, общий анализ крови, определение в сыворотке крови уровня железа, ферритина, трансферрина, насыщения трансферрина железом, растворимых рецепторов трансферрина, гепсидина, эритропоэтина, рутинные лабораторные исследования, определяли наличие и выраженность астении, тревоги, депрессии.
Результаты. Установлено 29 клинических, лабораторных и эхо- кардиографических показателей, имеющих достоверные различия в группах больных с ДЖ и без ДЖ и достоверные корреляции с ДЖ. Определение отношения шансов для данных 29 параметров вы- явило 7 факторов, достоверно ассоциированных с наличием ДЖ у больных с ХСН. С помощью многофакторного логистического регрессионного анализа установлено достоверное совокупное влияние данных факторов на вероятность развития ДЖ.
Заключение. ДЖ у больных с ХСН ассоциирован с возрастом, III-IV функциональным классом ХСН, повышенным уровнем гепсидина, длительностью анамнеза гипертонической болезни и сахарного диабета, анамнезом использования >1 года ингибиторов ангиотензинпревращающего фермента и новых оральных антикоагулянтов.
Ключевые слова
Для цитирования:
Смирнова М.П., Чижов П.А. Факторы, ассоциированные с дефицитом железа у больных с хронической сердечной недостаточностью. Кардиоваскулярная терапия и профилактика. 2023;22(2):3367. https://doi.org/10.15829/1728-8800-2023-3367
For citation:
Smirnova M.P., Chizhov P.A. Factors associated with iron deficiency in heart failure. Cardiovascular Therapy and Prevention. 2023;22(2):3367. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3367
Введение
Хроническая сердечная недостаточность (ХСН) является распространенным осложнением большинства сердечно-сосудистых заболеваний. Частым коморбидным состоянием у больных с ХСН являются анемия и дефицит железа (ДЖ). Последний выявляется у 34-83% пациентов с ХСН [1-4]. Развитию ДЖ у больных ХСН могут способствовать разные факторы: нарушение всасывания железа в желудочно-кишечном тракте из-за нарушений гемодинамики, микрокровотечения, депонирование железа в макрофагах на фоне системного воспаления и повышенного синтеза гепсидина [1][3].
ДЖ значительно снижает качество жизни больных с ХСН, увеличивает частоту госпитализаций и смертность [3][5][6]. Коррекция ДЖ у пациентов с ХСН улучшает функциональные способности больных и качество их жизни и снижает число повторных госпитализаций [5-8].
В большинстве работ, посвященных исследованию обмена железа, у пациентов с ХСН анализируются факторы риска не ДЖ, а его конечной стадии — железодефицитной анемии [9-11]. Что касается ДЖ, то в доступной литературе имеются немногочисленные и противоречивые данные по этому вопросу. В частности, на смешанной группе больных с ХСН с низкой и сохраненной фракцией выброса (ФВ) была показана взаимосвязь ДЖ с наличием анемии, более высоким функциональным классом (ФК) ХСН по классификации Нью-Йоркской ассоциации сердца (NYHA — New York Heart Association), более высоким уровнем N-концевого фрагмента промозгового натрийуретического пептида (NT-proBNP) [4][12][13], более низким средним объемом эритроцитов и женским полом [12][13], фибрилляцией предсердий (ФП) [4]. Однако данные авторы не выявили ассоциации ДЖ с особенностями терапии и активностью воспаления, в то время как в других работах была показана взаимосвязь ДЖ у больных с ХСН с воспалением [11][14-16], приемом антиагрегантов (ААГ) и новых оральных антикоагулянтов (НОАК) [15], а вот связи ДЖ с уровнем NT-proBNP, функциональным классом ХСН NYHA и ФВ левого желудочка установлено не было [17]. Следует подчеркнуть низкую выявляемость анемии и латентного ДЖ в Российской Федерации, что связано с неспецифичностью клинических проявлений этих состояний, образовательными пробелами врачей первичного звена, недостаточным внедрением в клиническую практику таких исследований, как определение уровня сывороточного ферритина [18].
Учитывая недостаточную изученность вопроса и противоречивость имеющихся литературных данных, была определена цель работы — установить факторы, ассоциированные с ДЖ у больных с ХСН.
Материал и методы
Протокол и дизайн исследования одобрены локальным Этическим комитетом. Пациенты подписывали информированное согласие на участие в исследовании.
Критерии включения в исследование: 1) наличие ХСН II-IV ФК (по NYHA), развившейся на фоне ишемической болезни сердца (ИБС) и/или гипертонической болезни (ГБ). Критерии невключения: наличие воспалительных, аутоиммунных, онкологических, тяжелых заболеваний печени, заболеваний желудочно-кишечного тракта, сопровождавшихся кровотечениями и/или мальабсорбцией, прием железосодержащих препаратов. Исследование было кросс-секционным, набор пациентов проведен в период: март 2015г — ноябрь 2019г. Диагноз ХСН устанавливали в соответствии с национальными клиническими рекомендациями [19]. Под наблюдением в терапевтическом отделении находились 294 больных (средний возраст 71,3±0,4 года) с ХСН разного ФК (по NYHA): II ФК — 105 (36%) больных, III ФК — 142 (48%), IV ФК — 47 (16%). Причиной госпитализации явилось ухудшение течения ИБС и/или ГБ и нарастание симптомов ХСН. У 227 (77%) пациентов была диагностирована ХСН с сохраненной ФВ (>50%), у 38 (13%) — ХСН с промежуточной ФВ (40-49%), у 29 (10%) — ХСН с низкой ФВ (<40%) [19]. Все больные получали стандартную терапию ХСН в соответствии с национальными клиническими рекомендациями [19].
У всех включенных в исследование проводили комплексное обследование, включающее клинический осмотр с оценкой шкалы клинического состояния, тест 6-минутной ходьбы, антропометрические данные (рост, вес, индекс массы тела). Кроме того, проводили тщательный сбор анамнеза с учетом наличия, длительности и тяжести наиболее распространенных у больных с ХСН таких коморбидных состояний, как ГБ, ИБС, сахарный диабет 2 типа (СД-2), хроническая болезнь почек (ХБП) [20], ФП, получаемого лечения.
Всем больным проводили эхокардиографию на аппарате GE VIVID-7 (General Electric, США) в одномерном, двухмерном и допплеровском режимах (импульсно-волновом, постоянно-волновом и тканевом) в стандартных позициях по общепринятой методике с определением размеров и объемов желудочков и предсердий, скорости регургитации на клапанах, трансмитральных диастолических потоков [21][22].
У всех больных проводили общий анализ крови с определением эритроцитарных индексов (анализатор МЕК 6500, Япония).
Концентрацию железа в мкмоль/л, трансферрина в г/л, ферритина в мкг/л, С-реактивного белка в мг/л (СРБ) в сыворотке крови определяли высокочувствительным фотометрическим методом по конечной точке (анализатор Sapphire 400, Япония), рассчитывали коэффициент насыщения трансферрина железом в % (КНТЖ).
Иммуноферментным методом на ИФА-ридере Immunochem-2100 определяли уровень NT-proBNP в пг/мл, эритропоэтина в МЕ/мл, растворимых рецепторов трансферрина в нмоль/л, гепсидина в нг/мл (норма от 0 до 25 нг/мл).
ДЖ устанавливали, исходя из рекомендаций Европейского кардиологического общества: ферритин сыворотки крови <100 мкг/л или ферритин в диапазоне 100-299 мкг/л и КНТЖ <20% [23] ДЖ диагностирован у 213 (72%) обследованных больных, из них женщин — 166 (78%), мужчин — 47 (22%), отсутствие ДЖ — у 81 (28%) больного, из которых 54 (67%) — женщины, 27 (33%) — мужчины. В группе больных с ДЖ уровень ферритина составлял 55,0 (32,0; 83,5) мкг/л, КНТЖ — 28,45±13,22%, что достоверно ниже, чем у пациентов без ДЖ: ферритин — 160,5 (133,0; 210,0) мкг/л (p<0,000), КНТЖ — 38,84±11,49% (p<0,000).
Общепринятыми методами определяли в крови концентрацию глюкозы, общего белка, протромбиновый индекс, уровни общего холестерина (ХС), ХС липопротеинов низкой и высокой плотности, триглицеридов, билирубина, концентрацию аланиновой и аспарагиновой трансаминаз.
Для оценки наличия и степени тяжести астении использовали шкалу астении Multidimensional Fatigue Inventory (MFI-20) с оценкой в баллах таких ее проявлений, как общая астения, физическая астения, психическая астения, снижение мотивации, понижение активности, суммарный балл выраженности астении, для определения наличия тревоги и депрессии — госпитальную шкалу тревоги и депрессии HADS (the Hospital Anxiety and Depression Scale) в баллах.
Статистический анализ данных проводили с помощью программ Stata/MP version 14.0 (StataCorp Enhancements, TX 77845, USA) и MedCalc Statistical Software version 18.2.1 (MedCalc Software bvba, Ostend, Belgium; 2018). Нормальность распределения оценивали тестом Шапиро-Уилка. При нормальном распределении для сравнения средних значений двух выборок использовали однофакторный дисперсионный анализ. Данные представлены в виде среднего (М) и стандартного отклонения (SD). При распределении, отличном от нормального, для сравнения результатов в двух группах применяли U-тест Манна-Уитни. Данные представлены в виде медианы (Ме) и интерквартильного размаха (Q25-Q75). Для определения различий качественных признаков использовали критерий χ2. Для оценки наличия связи между разными параметрами рассчитывали коэффициент корреляции гамма (γ). Рассчитывали отношение шансов (ОШ) с определением 95% доверительных интервалов (ДИ). Для проведения системного многомерного моделирования использован множественный логистический регрессионный анализ. За уровень достоверности принят p<0,05.
Результаты
На начальном этапе было проведено несколько сопоставлений, позволяющих предполагать наличие взаимосвязей между какими-либо факторами и ДЖ у больных с ХСН. Для этого сначала проведено сопоставление групп больных с ХСН с ДЖ и без ДЖ по всем исследуемым количественным и качественным показателям. На втором этапе работы были изучены корреляционные связи всех исследованных показателей с наличием ДЖ с определением коэффициента корреляции γ. Далее было проведено сопоставление показателей, имеющих достоверные корреляции с наличием ДЖ, и параметров, по которым были установлены различия в группах больных с ДЖ и без ДЖ.
В таблице 1 представлены клинико-анамнестические данные больных в группах с ДЖ и без ДЖ и корреляции этих показателей с наличием ДЖ. Больные в группе с ДЖ достоверно старше, имеют бóльшую массу тела, больший стаж ГБ и СД-2. Кроме того, достоверно бóльшая часть пациентов с ДЖ имеют ХСН IIб-III стадий, III-IV ФК ХСН, ХБП 3А-3Б стадии, постоянную форму ФП и использовали ингибиторы ангиотензинпревращающего фермента (иАПФ), ААГ и НОАК больше 1 года. Для всех этих клинико-анамнестических показателей, за исключением постоянной формы ФП, установлены также достоверные коэффициенты корреляции γ с ДЖ.
Таблица 1
Клинико-анамнестическая характеристика пациентов с ХСН в группах с наличием и отсутствием ДЖ
Группы Показатели | ДЖ | Без ДЖ | p | Коэффициент корреляции γ с ДЖ | |
n=213 | n=81 | γ | p | ||
Возраст, лет | 72,1±7,3 | 69,3±9,5 | 0,010 | 0,381 | 0,000 |
Вес, кг | 76,9±9,9 | 82,0±10,6 | 0,013 | -0,173 | 0,008 |
ХСН стадия IIБ-III Стражеско-Василенко, n (%) | 123 (58) | 36 (44) | 0,047 | 0,363 | 0,001 |
ХСН III-IV ФК (по NYHA), n (%) | 145 (68) | 44 (54) | 0,042 | 0,358 | 0,001 |
ГБ, n (%) | 200 (94) | 77 (95) | 0,754 | -0,069 | 0,726 |
ГБ, стаж, лет | 12,0±5,6 | 10,5±5,3 | 0,047 | 0,498 | 0,007 |
ИБС: стенокардия, n (%) | 145 (68) | 58 (72) | 0,537 | -0,103 | 0,285 |
ИБС: ПИКС, n (%) | 47 (22) | 10 (12) | 0,059 | 0,328 | 0,006 |
ФП постоянная, n (%) | 53 (25) | 11 (14) | 0,049 | 0,090 | 0,276 |
ФП пароксизмальная, n (%) | 30 (14) | 6 (7) | 0,106 | 0,071 | 0,346 |
СД-2, n (%) | 47 (22) | 24 (30) | 0,080 | 0,025 | 0,767 |
СД-2, стаж, лет | 5,9±3,9 | 4,9±3,2 | 0,043 | 0,469 | 0,003 |
ХБП 3А-3Б, n (%) | 105 (49) | 28 (25) | 0,044 | 0,394 | 0,015 |
Анемия, n (%) | 53 (25) | 13 (16) | 0,114 | 0,314 | 0,011 |
в т.ч. железодефицитная анемия | 22 (10) | 0 | |||
в т.ч. анемия хронического заболевания | 16 (8) | 13 (16) | 0,082 | 0,146 | 0,587 |
в т.ч. сочетание железодефицитной анемии и анемии хронического заболевания | 15 (7) | 0 | |||
иАПФ в анамнезе >1 года, n (%) | 181 (85) | 58 (72%) | 0,025 | 0,423 | 0,002 |
ААГ в анамнезе >1 года, n (%) | 109 (51) | 31 (39) | 0,047 | 0,403 | 0,006 |
НОАК в анамнезе >1 года, n (%) | 83 (39) | 18 (22) | 0,020 | 0,404 | 0,003 |
Примечание: ААГ — антиагреганты, ГБ — гипертоническая болезнь, ДЖ — дефицит железа, иАПФ — ингибиторы ангиотензинпревращающего фермента, ИБС — ишемическая болезнь сердца, НОАК — новые оральные антикоагулянты, ПИКС — постинфарктный кардиосклероз, СД-2 — сахарный диабет 2 типа, ФК — функциональный класс, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность, n — число больных, количественные данные представлены в виде М±SD, NYHA — New York Heart Association (Нью-Йоркская ассоциация сердца).
Сопоставление лабораторных показателей в исследованных группах больных (таблица 2) показало, что достоверные отличия в зависимости от наличия ДЖ, а также достоверные коэффициенты корреляции с ДЖ имеют такие показатели, как уровень железа, концентрация гепсидина, эритропоэтина, триглицеридов, общего ХС, гемоглобина, гематокрит, среднее содержание гемоглобина в эритроците и цветовой показатель.
Таблица 2
Лабораторные показатели в группах больных с ХСН с наличием и отсутствием ДЖ
Группы Показатели | ДЖ | Без ДЖ | p | Коэффициент корреляции γ с ДЖ | |
n=213 | n=81 | γ | p | ||
Железо, | 14,7±6,4 | 19,3±6,2 | 0,000 | -0,246 | 0,000 |
Гепсидин, нг/мл | 26,8 (10,6; 33,2) | 6,9 (3,0; 18,5) | 0,035 | 0,641 | 0,000 |
Эритропоэтин, МЕ/мл | 7,7 (4,9; 15,6) | 4,7 (2,0; 6,9) | 0,024 | 0,451 | 0,001 |
Гемоглобин, г/л | 129,2±16,9 | 137,4±15,1 | 0,000 | -0,294 | 0,000 |
Гематокрит, % | 37,1±4,9 | 39,2±4,9 | 0,002 | -0,246 | 0,000 |
Среднее содержание гемоглобина в эритроците, пг | 29,1±3,1 | 30,2±2,0 | 0,003 | -0,226 | 0,000 |
Цветовой показатель | 0,87±0,09 | 0,90±0,06 | 0,011 | -0,193 | 0,002 |
Триглицериды, ммоль/л | 1,67±0,8 | 2,06±1,2 | 0,001 | -0,403 | 0,005 |
Общий ХС, ммоль/л | 5,2±1,6 | 5,8±1,5 | 0,040 | -0,157 | 0,015 |
Креатинин, мкмоль/л | 90,7±19,5 | 92,0±18,5 | 0,613 | -0,039 | 0,535 |
СКФ, мл/мин/1,73 м² | 64,2±15,3 | 64,8±15,6 | 0,761 | -0,026 | 0,688 |
Примечание: n — число больных, данные представлены в виде М±SD или Me (Q25; Q75), ДЖ — дефицит железа, СКФ — скорость клубочковой фильтрации, ХС — холестерин.
При сравнении показателей эхокардиографии, астении, тревоги и депрессии (таблица 3) в исследованных группах установлено, что достоверные различия в зависимости от наличия ДЖ и достоверные коэффициенты корреляции γ с ДЖ касаются размера правого желудочка, максимальной скорости позднего предсердного наполнения левого желудочка (МК-пикА), всех изученных показателей астении, тревога и депрессия.
Таблица 3
Эхокардиоскопические показатели и выраженность астении, тревоги и депрессии в группах больных с ХСН с наличием и отсутствием ДЖ
Группы Показатели | ДЖ | Без ДЖ | p | Коэффициент корреляции γ с ДЖ | |
n=213 | n=81 | γ | p | ||
Правый желудочек, размер, мм | 28,0 (26,0; 30,9) | 27,0 (24,0; 28,5) | 0,006 | 0,217 | 0,002 |
МК-пикА, м/с | 0,71±0,37 | 0,79±0,29 | 0,034 | -0,440 | 0,006 |
MFI-20 общая астения, балл | 14,0 (12,0; 16,0) | 12,0 (10,0; 16,0) | 0,030 | 0,200 | 0,003 |
MFI-20 физическая астения, балл | 14,0 (12,0; 17,0) | 12,0 (10,0; 14,0) | 0,006 | 0,346 | 0,000 |
MFI-20 пониженная активность, балл | 14,0 (11,0; 16,0) | 12,0 (10,0; 14,0) | 0,014 | 0,347 | 0,000 |
MFI-20 снижение мотивации, балл | 12,0 (10,0; 14,0) | 11,0 (9,0; 13,0) | 0,003 | 0,230 | 0,000 |
MFI-20 психическая астения, балл | 11,0 (8,0; 13,0) | 10,0 (7,0; 12,0) | 0,010 | 0,190 | 0,005 |
MFI-20 сумма, балл | 64,0 (53,0; 74,0) | 59,0 (47,5; 69,0) | 0,004 | 0,418 | 0,000 |
HADS Тревога, балл | 8,0 (5,0; 10,0) | 7,0 (4,0; 8,5) | 0,016 | 0,207 | 0,002 |
HADS Депрессия, балл | 9,0 (6,0; 12,0) | 8,0 (4,0; 10,5) | 0,008 | 0,421 | 0,001 |
Примечание: n — число больных, данные представлены в виде М±SD или Me (Q25; Q75). ДЖ — дефицит железа, МК-пикА — максимальная скорость позднего предсердного наполнения левого желудочка, HADS — The Hospital Anxiety and Depression Scale (госпитальная шкала тревоги и депрессии), MFI-20 — Multidimensional Fatigue Inventory (субъективная шкала оценки астении).
Таким образом, проведенное исследование выявило 29 показателей, по которым имеются достоверные различия в группах с наличием и отсутствием ДЖ и достоверные корреляции с ДЖ, что позволяет предполагать их вероятностную связь с наличием ДЖ у больных с ХСН.
Далее с целью определения факторов, ассоциированных с ДЖ у пациентов с ХСН, были рассчитаны ОШ для 29 выделенных показателей.
Форест-диаграмма распределения ОШ представлена на рисунке 1. На форест-диаграмме показано, что достоверные ОШ имеют такие факторы, как возраст, высокий ФК ХСН, длительность ГБ, СД-2, анамнез использования >1 года иАПФ, НОАК и повышенный уровень гепсидина.
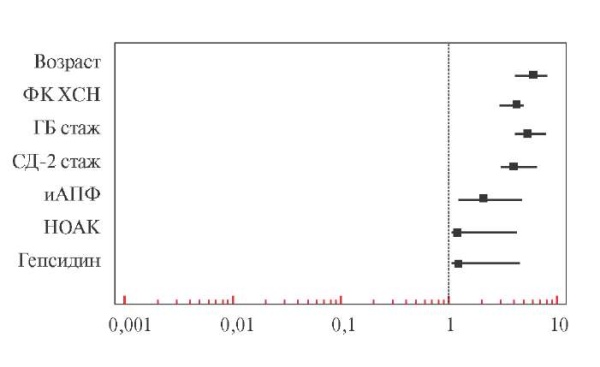
Рис. 1 Форест-диаграмма ОШ для факторов, ассоциированных с ДЖ у больных с ХСН.
Примечание: ГБ — гипертоническая болезнь, иАПФ — ингибиторы ангиотензинпревращающего фермента, НОАК — новые оральные антикоагулянты, СД-2 — сахарный диабет 2 типа, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность.
Для оценки взаимного воздействия различных комбинаций вышеперечисленных факторов, ассоциированных с наличием ДЖ у больных с ХСН, проведено системное многомерное моделирование. При использовании многофакторного логистического регрессионного анализа установлено совокупное влияние выделенных ранее факторов на вероятность развития ДЖ (таблица 4). По результатам данного анализа построена модель логистической регрессии. В качестве результативной переменной выбрана бинарная переменная, отражающая наличие или отсутствие ДЖ, в качестве независимых переменных были выбраны ранее установленные факторы. Модель имеет высокую статистическую значимость: критерий χ2=25,42 при p<0,001.
Таблица 4
Многофакторный анализ для факторов, ассоциированных с наличием ДЖ у пациентов с ХСН
Показатель | Коэффициент уравнения регрессии, B | χ² Вальда | p |
Возраст | -0,04 | 4,95 | 0,027 |
ФК ХСН | 1,51 | 3,39 | 0,041 |
ГБ стаж | 0,77 | 4,37 | 0,037 |
СД стаж | 0,28 | 4,02 | 0,045 |
иАПФ | -2,12 | 5,76 | 0,019 |
НОАК | -2,04 | 4,60 | 0,036 |
Гепсидин | -0,11 | 7,80 | 0,007 |
Примечание: ГБ — гипертоническая болезнь, иАПФ — ингибиторы ангиотензинпревращающего фермента, НОАК — новые оральные антикоагулянты, СД-2 — сахарный диабет 2 типа, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность.
Обсуждение
Оценка ОШ показала, что с наличием ДЖ у больных с ХСН достоверно ассоциированы такие факторы, как возраст, высокий ФК ХСН, повышенный уровень гепсидина, длительность ГБ, СД-2, анамнез использования >1 года иАПФ и НОАК.
Важную роль возраста для развития ДЖ у больных с ХСН ранее отмечали и другие исследователи [4][13][24]. Возможное значение возраста в качестве фактора, способствующего возникновению ДЖ может определяться возрастными атрофическими процессами в слизистой кишечника, нарушающими всасывание железа.
Взаимосвязь ДЖ с повышенным уровнем гепсидина свидетельствует о роли воспаления в возникновении ДЖ у больных с ХСН. При развитии воспаления повышается концентрация гепсидина, что способствует нарушению высвобождения железа в кровь из желудочно-кишечного тракта и депонированию железа в макрофагах [15][16][25].
Ассоциацию ДЖ с тяжестью ХСН отмечали и другие исследователи [4][12-15]. В основе возможного влияния данного фактора на развитие ДЖ могут лежать нарушение питания у больных с тяжелой ХСН, отек слизистой кишечника, синдром мальабсорбции [15][25][26]. Кроме того, необходимо учитывать, что в почках фильтруется и удаляется гепсидин. При почечной недостаточности, которая наблюдается у половины больных с ХСН, особенно при высоких ФК, его концентрация увеличивается, что может способствовать развитию функционального ДЖ [14].
Нами впервые установлена ассоциация длительного стажа ГБ с ДЖ у больных с ХСН. В основе данной ассоциации может лежать то, что ГБ является самой распространенной причиной развития ХСН и в значительной степени определяет тяжесть ХСН [23].
Активацией воспаления и увеличением функционального ДЖ может быть обусловлена ассоциация длительности СД-2 с ДЖ у больных с ХСН. В частности, ранее установлено, что при СД-2 имеет место активация воспаления, о чем свидетельствует достоверное повышение таких маркеров воспаления, как СРБ, интерлейкин-6 [27]. В свою очередь, активация системного воспаления, как указано выше, способствует развитию функционального ДЖ за счет усиления депонирования железа в ретикулоэндотелиальной системе. По данным Klip IT, et al. (2013), СД-2 встречается достоверно чаще у больных с ХСН с наличием ДЖ, по сравнению с больными без ДЖ. В другом исследовании показано, что у женщин ДЖ достоверно связан с наличием СД-2 [17]. Определенное значение для развития ДЖ у больных с СД-2 может иметь микроангиопатия в желудочно-кишечном тракте и снижение всасывания железа [26]. Ранее ни в одном исследовании не было показано ассоциации длительности СД-2 с ДЖ у больных с ХСН.
Длительный прием НОАК может способствовать развитию ДЖ из-за более частых микрокровотечений на их фоне [1][25].
Еще одним фактором, для которого впервые в нашем исследовании была установлена ассоциация с ДЖ у больных с ХСН, является длительное использование иАПФ. Ранее было неоднократно обнаружено, что иАПФ являются фактором риска развития анемии у больных с ХСН [13]. В основе этого лежит снижение продукции эритропоэтина и уменьшение синтеза гемоглобина [25]. Влияние длительного приема иАПФ на развитие ДЖ в определенной степени может быть обусловлено тем, что иАПФ способствуют повышению уровня интерлейкина-12 [28], что приводит к увеличению продукции интерферона-γ и фактора некроза опухолей-α [29].
Интерферон-γ снижает экспрессию переносчика железа ферропортина и ингибирует экспорт железа из макрофагов. Под влиянием фактора некроза опухолей-α активируется накопление и сохранение железа в макрофагах [30]. В конечном итоге, все эти процессы могут вести к возникновению латентного ДЖ.
К сожалению, в реальной клинической практике диагностика ДЖ у больных с ХСН проводится крайне редко. Полученные данные облегчат прогнозирование риска развития ДЖ у больных с ХСН с последующим обязательным назначением определения маркеров ДЖ (уровень ферритина и КНТЖ) с целью установления наличия ДЖ и его коррекции.
Ограничения исследования. Ограничением исследования является относительно небольшое количество включенных пациентов. Личный контакт с каждым больным позволил повысить точность получаемых результатов и компенсировать относительную малочисленность обследуемой группы.
Заключение
Факторами, ассоциированными с ДЖ у больных с ХСН, являются возраст, III-IV ФК ХСН по NYHA, повышенный уровень гепсидина, длительность анамнеза ГБ, длительность СД-2, прием >1 года препаратов групп иАПФ и НОАК.
Профиль больного с ХСН с ДЖ по данным настоящего исследования может быть представлен следующим образом: это пациент с ХСН III-IV ФК в возрасте ≥72,1±7,3 лет, который имеет повышенный уровень гепсидина (>25 нг/мл) и длительный стаж ГБ (≥12,0±5,6 лет) и СД-2 (≥5,9±3,9 лет). Усугубляет возможный ДЖ использование в течение >1 года иАПФ и НОАК.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Kurz K, Lanser L, Seifert M, et al. Anaemia, iron status, and gender predict the outcome in patients with chronic heart failure. ESC Heart Failure. 2020;7:1880-90. doi:10.1002/ehf2.12755.
2. Moliner P, Enjuanes C, Tajes M, et al. Association Between Norepinephrine Levels and Abnormal Iron Status in Patients with Chronic Heart Failure: Is Iron Deficiency More Than a Comorbidity? J Am Heart Assoc. 2019;8(4):e010887. doi:10.1161/JAHA.118.010887.
3. Beattie JM, Khatib R, Phillips CJ, et al. Iron deficiency in 78805 people admitted with heart failure across England: a retrospective cohort study. Open Heart. 2020;7:e001153. doi:10.1136/openhrt-2019-001153.
4. Мареев В.Ю., Беграмбекова Ю. Л., Мареев Ю.В. и др. Распространенность дефицита железа у пациентов с хронической сердечной недостаточностью в Российской Федерации. Данные наблюдательного одномоментного исследования. Кардиология. 2022;62(5):4-8. doi:10.18087/cardio.2022.5.n2083.
5. Jankowska EA, Tkaczyszyn M, Suchocki T, et al. Effects of intravenous iron therapy in iron-deficient patients with systolic heart failure: a meta-analysis of randomized controlled trials. Eur J Heart Fail. 2016;18:786-95. doi:10.1002/ejhf.473.
6. Anker SD, Kirwan BA, van Veldhuisen DJ, et al. Effects of ferric carboxymaltose on hospitalisations and mortality rates in irondeficient heart failure patients: an individual patient data metaanalysis. Eur J Heart Fail. 2018;20:125-33. doi:10.1002/ejhf.823.
7. Мареев Ю.В., Гиляревский С.Р., Беграмбекова Ю. Л. и др. Согласованное мнение экспертов по поводу лечения дефицита железа у стабильных и декомпенсированных больных хронической сердечной недостаточностью. Кардиология. 2021;61(4):73-8. doi:10.18087/cardio.2021.4.n1639.
8. Жиров И.В., Сафронова Н.В., Терещенко С. Н. Коррекция дефицита железа у пациентов после острой декомпенсации: новая цель в лечении сердечной недостаточности. Российский кардиологический журнал. 2022;27(2S):4949. doi:10.15829/1560-4071-2022-4949.
9. Ларина В.Н., Барт Б.Я., Балабанова Э.Л. Анемический синдром у больных с хронической сердечной недостаточностью. Российский кардиологический журнал. 2010;(3):34-40.
10. van der Wal H, van Deursen VM, van der Meer P, et al. Comorbidities in Heart Failure. Handb Exp Pharmacol. 2017;243:35-66. doi:10.1007/164_2017_27.
11. von Haehling S, Ebner N, Evertz R, et al. Iron Deficiency in Heart Failure: An Overview. JACC Heart Fail. 2017;7(1):36-46. doi:10.1016/j.jchf.2018.07.015.
12. Klip IT, Comin-Colet J, Voors AA, et al. Iron deficiency in chronic heart failure: An international pooled analysis. Am Heart J. 2013;165:575-582.e3. doi:10.1016/j.ahj.2013.01.017.
13. Anand IS, Gupta P. Anemia and Iron Deficiency in Heart Failure: Current Concepts and Emerging Therapies. Circulation. 2018;138(1):80-98. doi:10.1161/CIRCULATIONAHA.118.030099.
14. Silverberg D, Wexler D, Schwartz D. Is Correction of Iron Deficiency a New Addition to the Treatment of the Heart Failure? International Journal of Molecular Sciences. 2015;16(12):1405674. doi:10.3390/ijms160614056.
15. Rizzo C, Carbonara R, Ruggieri R, et al. Iron Deficiency: A New Target for Patients with Heart Failure. Front Cardiovasc Med. 2021;8:1-10. doi:10.3389/fcvm.2021.709872.
16. Соломахина Н. И., Находнова Е. С., Ершов В. И. и др. Роль гепсидина в формировании анемии хронических заболеваний и железодефицитной анемии у больных с хронической сердечной недостаточностью в пожилом и старческом возрасте. Кардиология. 2018;58(3):20-7. doi:10.18087/cardio.2018.3.10094.
17. Cohen-Solal A, Damy T, Terbah M, et al. High prevalence of iron deficiency in patients with acute decompensated heart failure. Eur J Heart Failure. 2014;16:984-91. doi:10.1002/ejhf.139.
18. Драпкина О.М., Мартынов А. И., Байда А. П. и др. Резолюция экспертного совета "Актуальные вопросы железодефицита в Российской Федерации". Кардиоваскулярная терапия и профилактика. 2020;19(5):2700. doi:10.15829/1728-8800-2020-2700.
19. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
20. Клинические рекомендации. Хроническая болезнь почек (ХБП). Нефрология. 2021;25(5):10-82. doi:10.24884/1561-6274-2021-25-5-10-82.
21. Nagueh SF, Smiseth OA, Appleton CP, et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016;29(4):277-314. doi:10.1016/j.echo2016.01.011.
22. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Ecocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016;8(1):1-39. e14. doi:10.1016/j.echo.2014.10.003.
23. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur J Heart Fail. 2016;18(8):891-975. doi:10.1093/eurheartj/ehw383.
24. González-Costello J, Comín-Colet J, Lupón J, et al. Importance of iron deficiency in patients with chronic heart failure as a predictor of mortality and hospitalizations: insights from an observational cohort study. BMC Cardiovasc Disord. 2018;18(1):206. doi:10.1186/s12872-018-0942-x.
25. Ватутин Н. Т., Тарадин Г. Г., Канишева И.В. и др. Анемия и железодефицит у больных с хронической сердечной недостаточностью. Кардиология. 2019;59(4S):4-20. doi:10.18087/cardio.2638.
26. Мусина Н. Н., Саприна Т.В., Прохоренко Т. С. и др. Особенности параметров воспаления, феррокинетики и структуры анемического синдрома у пациентов с сахарным диабетом. Профилактическая медицина. 2020;23(6):7280. doi:10.17116/profmed20202306272.
27. Стуклов Н. И. Дефицит железа и анемия у больных хронической сердечной недостаточностью. Рациональная фармакотерапия в кардиологии. 2017;13(5):651-60. doi:10.20996/1819-6446-2017-13-5-651660.
28. Хадарцев А.А., Логаткина А.В., Терехов И.В. и др. Влияние ингибитора ангиотензинпревращающего фермента на концентрацию в плазме крови цитокинов и вазоактивных молекул у больных ишемической болезнью сердца и артериальной гипертонией. Терапевтический архив. 2017;89(12):97-102. doi:10.17116/terarkh2017891297-102.
29. Трошина Е.А. Роль цитокинов в процессах адаптивной интеграции иммунных и нейроэндокринных реакций организма. Проблемы эндокринологии. 2021;67(2):4-9. doi:10.14341/probl12744.
30. Рукавицын О.А., Зенина М. Н., Демихов В.Г. и др. Анемии. 2 издание, переработанное и дополненное. Под редакцией профессора О. А. Рукавицына. Москва: издательская группа ГЭОТАР-Медиа, 2016. с. 250. ISBN: 978-5-9704-3978-4.
Об авторах
М. П. СмирноваРоссия
Смирнова Марина Петровна — кандидат медицинских наук, доцент кафедры факультетской терапии
Ярославль
SPIN-код 4399-0900
П. А. Чижов
Россия
Чижов Петр Александрович — доктор медицинских наук, профессор, зав. кафедрой факультетской терапии
Ярославль
SPIN-код: 6427-4298
Дополнительные файлы
Что известно о предмете исследования?
- Дефицит железа является частой сопутствующей патологией у больных с сердечной недостаточностью.
Что добавляют результаты исследования?
- Установлены факторы риска дефицита железа у больных с сердечной недостаточностью: возраст, III-IV функциональный класс хронической сердечной недостаточности, повышенный уровень гепсидина, длительность анамнеза гипертонической болезни и сахарного диабета 2 типа, прием >1 года препаратов групп новых оральных антикоагулянтов и ингибиторов ангиотензинпревращающего фермента.
Рецензия
Для цитирования:
Смирнова М.П., Чижов П.А. Факторы, ассоциированные с дефицитом железа у больных с хронической сердечной недостаточностью. Кардиоваскулярная терапия и профилактика. 2023;22(2):3367. https://doi.org/10.15829/1728-8800-2023-3367
For citation:
Smirnova M.P., Chizhov P.A. Factors associated with iron deficiency in heart failure. Cardiovascular Therapy and Prevention. 2023;22(2):3367. (In Russ.) https://doi.org/10.15829/1728-8800-2023-3367
JATS XML

























































