Перейти к:
Структурно-функциональное состояние микроциркуляторного русла кожи у мужчин с различными фенотипами артериальной гипертензии низкого и умеренного сердечно-сосудистого риска
https://doi.org/10.15829/1728-8800-2024-4133
EDN: MNBJJE
Аннотация
Цель. Изучить структурно-функциональное состояние микрососудов кожи у мужчин трудоспособного возраста с различными фенотипами артериальной гипертензии (АГ) низкого/умеренного сердечно-сосудистого риска.
Материал и методы. 218 "условно" здоровым мужчинам выполнено обследование "от капилляров до сердца": клинический и биохимический анализ крови, объемная сфигмография, видеокапилляроскопия, лазерная допплеровская флоуметрия в покое и с констрикторной и дилататорной пробами, фотоплетизмография, поток-зависимая вазодилатация плечевой артерии, ультразвуковое исследование сердца и магистральных артерий, суточное мониторирование артериального давления (АД). По результатам суточного мониторирования АД сформировано три группы: группа нормального АД (НАД) — 72 мужчины, группа изолированной диастолической АГ (ИДГ) — 70, группа систолодиастолической АГ (СДГ) — 76.
Результаты. По данным видеокапилляроскопии и лазерной допплеровской флоуметрии достоверных межгрупповых различий на уровне капилляров и прекапиллярных артериол не получено. По данным фотоплетизмографии мужчины с СДГ относительно группы НАД имели бóльший Alp75 (индекс аугментации, нормированный на частоту сердечных сокращений 75 уд./мин) (7,35 vs -5,4%; p<0,001), VA (сосудистый возраст) (49 vs 43 года; p<0,001) и RI (индекс отражения) (38 vs 29,1%; p<0,001), а пациенты с ИДГ — бóльший RI (35,3 vs 29,1%; p<0,001), соответственно.
Заключение. У мужчин с ИДГ и СДГ разрежения капиллярного русла, изменения тонуса, констрикторной и дилататорной активности прекапиллярных артериол в коже нет. Мужчины с ИДГ и СДГ характеризуются бóльшим тонусом гладкомышечных клеток терминальных мышечных артерий и распределительных артериол, а мужчины с СДГ также имеют бóльшую артериальную жесткость.
Ключевые слова
Для цитирования:
Королев А.И., Ососков В.С., Федорович А.А., Чащин М.Г., Дадаева В.А., Стрелкова А.В., Омельяненко К.В., Михайлова М.А., Горшков А.Ю., Драпкина О.М. Структурно-функциональное состояние микроциркуляторного русла кожи у мужчин с различными фенотипами артериальной гипертензии низкого и умеренного сердечно-сосудистого риска. Кардиоваскулярная терапия и профилактика. 2024;23(10):4133. https://doi.org/10.15829/1728-8800-2024-4133. EDN: MNBJJE
For citation:
Korolev A.I., Ososkov V.S., Fedorovich A.A., Chashchin M.G., Dadaeva V.A., Strelkova A.V., Omelyanenko K.V., Mikhailova M.A., Gorshkov A.Y., Drapkina O.M. Structural and functional state of the skin microcirculation in men with different phenotypes of hypertension of low and moderate cardiovascular risk. Cardiovascular Therapy and Prevention. 2024;23(10):4133. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4133. EDN: MNBJJE
Введение
Артериальная гипертензия (АГ) является важнейшей медико-социальной проблемой ввиду большой распространенности и ведущей роли в развитии болезней системы кровообращения [1], которые занимают лидирующие позиции в общей структуре инвалидизации и смертности мужчин трудоспособного возраста в Российской Федерации.
В последнее время большое внимание при изучении патогенеза и клинического течения АГ уделяется изменениям, происходящим на микроциркуляторном уровне. С одной стороны, это обусловлено тем, что микроциркуляторное русло (МЦР) одним из первых вовлекается в патологический процесс и играет одну из ключевых ролей в развитии и поддержании АГ [2-4]. С другой стороны, изменение морфофункционального состояния микрососудов влечет за собой нарушение тканевого гомеостаза, что ассоциировано с прогрессирующим ухудшением функции и изменением структуры органов и тканей [5]. Выявление подобных изменений на стадии функциональных расстройств, когда патология носит обратимый характер, является ключевым в улучшении качества жизни пациентов и снижении риска развития поражения органов-мишеней и ассоциированных клинических состояний.
Среди основных механизмов развития АГ, наряду с повышением вязкости крови, следует назвать увеличение сердечного выброса и/или артериальной жесткости, и/или общего периферического сосудистого сопротивления (ОПСС) [2], бóльшая часть которого формируется на уровне сосудов МЦР и зависит от тонуса и диаметра просвета микрососудов, что обусловлено их структурно-функциональным состоянием [6]. В настоящее время в зависимости от повышения систолического (САД) или диастолического (ДАД) артериального давления (АД) выделяют несколько форм АГ: изолированная систолическая, изолированная диастолическая (ИДГ) и систолодиастолическая АГ (СДГ). При этом считается, что пациенты с изолированной систолической АГ имеют повышенную жесткость артерий и/или высокий сердечный выброс [7], пациенты с ИДГ — высокое ОПСС [8], а пациенты с СДГ — сочетание вышеописанных изменений. Однако, как показывают немногочисленные исследования, данные закономерности наблюдаются далеко не у всех пациентов [8][9]. В связи с этим вопрос о гемодинамическом фенотипе различных форм АГ, который является ключевым в персонализированном подходе к лечению, остается недостаточно изученным.
Результаты ранее проведенного нами комплексного неинвазивного исследования различных звеньев МЦР кожи у мужчин трудоспособного возраста с впервые выявленной АГ продемонстрировали бóльшую скорость распространения пульсовой волны, сосудистую жесткость и тонус гладкомышечных клеток (ГМК) терминальных мышечных артерий и распределительных артериол относительно нормотензивных мужчин [10]. На основании полученных результатов была разработана регрессионная модель, которая на основании данных фотоплетизмографии (ФПГ) и возраста позволяет прогнозировать наличие АГ у мужчин с низким и умеренным сердечно-сосудистым риском (ССР) [11]. Однако в данных исследованиях анализируемая группа была представлена как СДГ, так и ИДГ, что не позволяет ответить на вопрос: какие именно изменения функционального состояния микрососудов характеры для мужчин с различными формами АГ низкого и умеренного ССР?
Основная цель настоящей работы — проведение одномоментного исследования структурно-функционального состояния различных звеньев МЦР кожи у мужчин трудоспособного возраста с различными формами АГ низкого и умеренного ССР.
Материал и методы
Анализируемая группа сформирована в рамках проспективного научного исследования мужского населения г. Москвы "Сердечно-сосудистый континуум". Исследование выполнено в соответствии со стандартами надлежащей клинической практики (GCP) и принципами Хельсинкской декларации. Протокол исследования одобрен локальным этическим комитетом (протокол заседания № 01-01/19 от 12.02.2019г). Все испытуемые дали письменное согласие на участие в исследовании.
В исследование включены 218 мужчин 25-65 лет (44,7±7,9 лет), которые субъективно считали себя здоровыми, не предъявляли никаких жалоб и не принимали регулярную лекарственную терапию.
Дизайн исследования. За сутки до исследования исключались интенсивная физическая нагрузка и прием алкоголя, работа в ночную смену. За 6 ч до начала исследования исключался прием тонизирующих напитков (чай, кофе и др.), курение исключалось минимум за 2 ч до исследования. Комплекс обследований начинали в 9:00 ч утра натощак и проводили в следующей последовательности: 1) осмотр, антропометрия (масса тела, рост, окружность талии (ОТ), окружность бедер (ОБ), расчет индекса массы тела (ИМТ) по формуле Кетле), сбор анамнеза, 3-кратное измерение АД (офисные значения); 2) объемная сфигмография (ОС); 3) видеокапилляроскопия (ВКС) на безымянном пальце левой кисти; 4) лазерная допплеровская флоуметрия (ЛДФ) на среднем пальце левой кисти и левом предплечье; 5) ФПГ на указательном пальце левой кисти; 6) забор венозной крови для лабораторных исследований; 7) ультразвуковое исследование (УЗИ) сердца и магистральных артерий (брахиоцефальные (БЦА) и бедренные (БА) артерии); 8) суточное мониторирование АД (СМАД). Осмотр и все инструментальные методы исследования проводили в лаборатории с постоянно поддерживаемым микроклиматом (температура воздуха +23±1° C; влажность воздуха 40-60%).
Критерии невключения в исследование:
— сердечно-сосудистые и цереброваскулярные заболевания, реваскуляризации в любом сосудистом бассейне в анамнезе;
— офисное САД ≥180 мм рт.ст. и/или ДАД ≥110 мм рт.ст.;
— скорость клубочковой фильтрации <60 мл/мин/ 1,73 м²; повышение уровня печеночных трансаминаз >3 норм; сахарный диабет обоего типа или нарушение толерантности к глюкозе;
— признаки семейной гиперхолестеринемии (в частности, уровень общего холестерина (ХС) >8 ммоль/л или ХС липопротеинов низкой плотности (ХС ЛНП) >4,9 ммоль/л);
— индекс массы миокарда левого желудочка (ЛЖ) >115 г/м²;
— стеноз, недостаточность клапанов сердца умеренной и тяжелой степени;
— систолическая дисфункция миокарда ЛЖ со снижением фракции выброса <50%;
— наличие атеросклеротического поражения БЦА и/или БА >25%.
Исследование микроциркуляции. Капиллярное русло кожи изучали методом компьютерной ВКС [12]. Использовали компьютерный капилляроскоп "Капилляроскан-1" (ООО "Новые Энергетические Технологии", Россия). ВКС выполняли в положении пациента сидя в области ногтевого ложа и тыльной поверхности ногтевой фаланги безымянного пальца левой кисти (рисунок 1 А). Последовательно регистрировали 3 участка ногтевого ложа для дальнейшего построения панорамного снимка (рисунок 1 Б). Оценивали размер перикапиллярной зоны (рисунок 1 В), функциональную плотность капиллярной сети (ФПКС) (рисунок 1 Г), структурную плотность капиллярной сети (СПКС) (рисунок 1 Д) и коэффициент ФПКС/СПКС по ранее описанной методике [13].
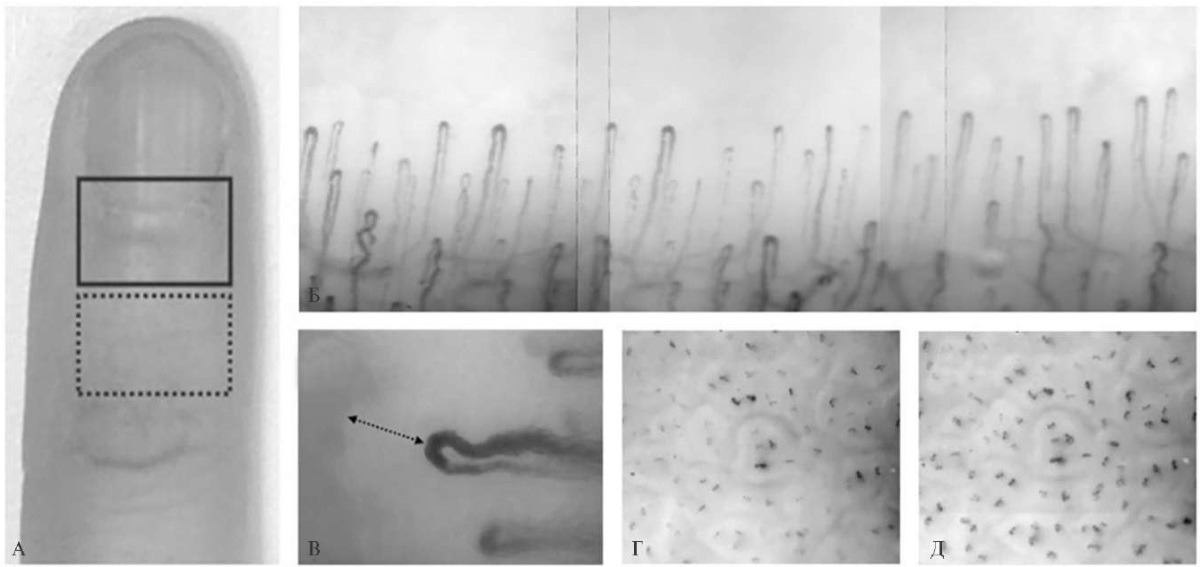
Рис. 1 ВКС: А — области исследования капиллярного русла; Б — панорамный снимок капиллярного русла ногтевого ложа (сформирован из 3-х кадров); В — измерение размера ПЗ; Г — капилляры, функционирующие в состоянии покоя (ФПКС); Д — максимальное количество капилляров (СПКС).
Примечание: ВКС — видеокапилляроскопия, ПЗ — перикапиллярная зона, СПКС — структурная плотность капиллярной сети, ФПКС — функциональная плотность капиллярной сети.
ЛДФ. Характер микроциркуляторного кровотока в коже методом ЛДФ оценивали в положении пациента лежа на спине с приподнятым на 30° головным концом кушетки после 15-мин периода адаптации. Использовали лазерный анализатор ЛАКК-02 (НПП "ЛАЗМА", Россия) в ближней инфракрасной области спектра (длина волны 800 нм). Датчики располагали в области подушечки ногтевой фаланги среднего пальца левой кисти и тыльной поверхности кожи левого предплечья (рисунок 2).
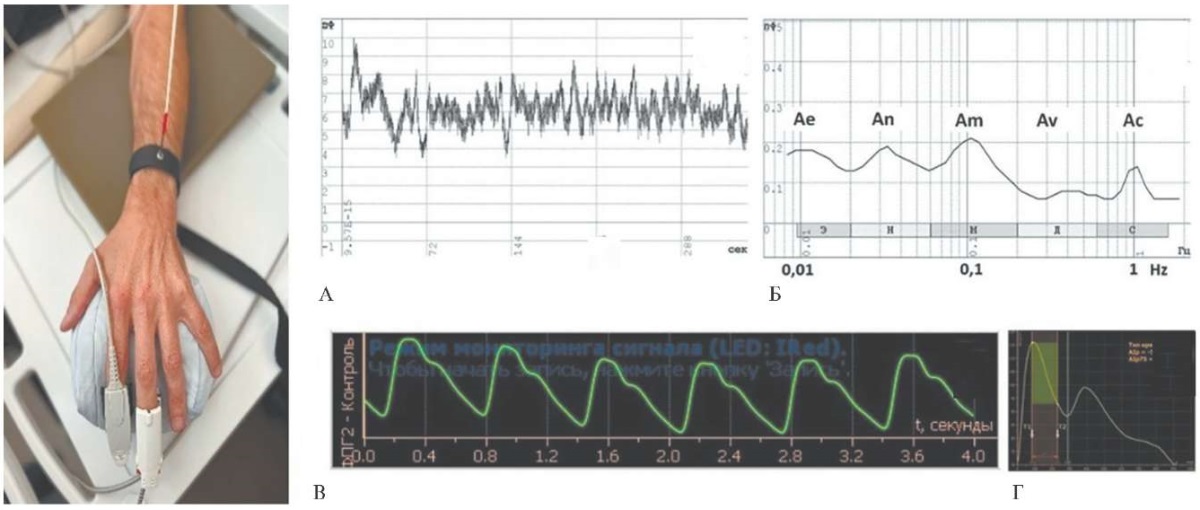
Рис. 2 ЛДФ на среднем пальце и предплечье и ФПГ на указательном пальце: A — ЛДФ-грамма БП; Б — амплитудно-частотный вейвлет анализ колебаний кожной перфузии при БП (логарифмический масштаб); В — фотоплетизмограмма; Г — контурный анализ пульсовой волны.
Примечание: БП — базальная перфузия, ЛДФ — лазерная допплеровская флоуметрия, ФПГ — фотоплетизмография.
Базальную перфузию (БП) регистрировали в течение 10 мин. Исходную ЛДФ-грамму (рисунок 2 А) подвергали амплитудно-частотному вейвлет-преобразованию (рисунок 2 Б). Оценивали уровень перфузии (М), вариабельность тканевого кровотока (σ) и усредненную по времени амплитуду вазомоций регуляторных механизмов по максимальным значениям (Ai) в соответствующих частотных диапазонах: эндотелиальный (Аэ) — 0,0095-0,02 Гц, нейрогенный (Ан) — 0,021-0,052 Гц, миогенный (Ам) — 0,052-0,145 Гц, венулярный (Ав) — 0,145-0,6 Гц и кардиальный (Ас) — 0,6-2,0 Гц [14]. Значения М, σ и Ai представлены в условных перфузионных единицах (пф). Оценивали перфузионный вклад (Аi/М) и вазомоторную эффективность (вклад в модуляцию микрокровотока) каждого регуляторного механизма (Ai/3σ) по ранее описанным методикам [15][16].
После регистрации БП для оценки констрикторной активности прекапиллярных артериол проводили дыхательную пробу (ДП) (рисунок 3 А). Определяли минимальный уровень перфузии (Ммин), время его развития (Т) и степень вазоконстрикции (снижения перфузии) (↓∆М) по ранее описанной методике [13].
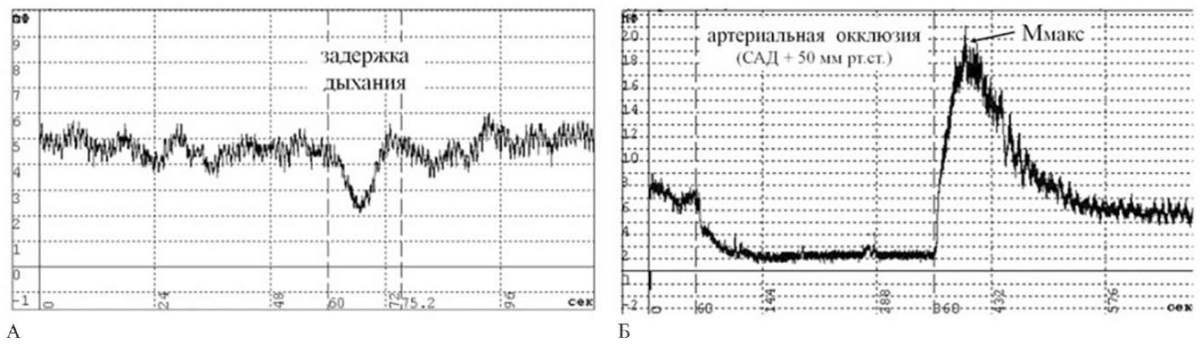
Рис. 3 Функциональные тесты при ЛДФ: А — констрикторная ДП; Б — дилататорная проба с 5-минутной АО.
Примечание: АО — артериальная окклюзия, ДП — дыхательная проба, Ммакс — максимальный уровень тканевой перфузии, САД — систолическое артериальное давление.
После выполнения ДП для оценки вазодилататорной активности микрососудов проводили пробу с 5-мин артериальной окклюзией (АО) (рисунок 3 Б). Оценивали максимальный уровень перфузии (Ммакс), время его достижения (Т) и максимальный прирост перфузии (↑∆М) по ранее описанной методике [13].
ФПГ. Одномоментно с ЛДФ проводили ФПГ программно-аппаратным комплексом "Ангиоскан-01" (ООО "Ангиоскан", Россия) с двумя длинами волн в ближней инфракрасной области спектра (680 и 870 нм), что позволяет фотонам проходить через всю толщу ногтевой фаланги пальца и захватывать более крупные артериолы. Оптический датчик устанавливали на ногтевую фалангу указательного пальца левой кисти (рисунок 2). По результатам контурного анализа пульсовой волны (рисунок 2D) на протяжении 10 мин оценивали следующие параметры: 1) расчетный индекс аугментации в %, корригированный по частоте сердечных сокращений 75 уд./мин (Alp75); 2) сосудистый возраст (VA) (лет); 3) индекс жесткости (SI) — расчетный показатель, отражающий среднюю скорость распространения пульсовой волны в м/с по крупным эластическим сосудам; 4) индекс отражения (RI) — расчетный параметр, характеризующий тонус ГМК терминальных мышечных артерий и распределительных артериол.
Клинический и биохимический анализ крови с определением уровня общего ХС, триглицеридов (ТГ), ХС липопротеинов высокой плотности (ЛВП), мочевой кислоты (МК), С-реактивного белка, глюкозы, фибриногена, ХС ЛНП определяли по ранее описанной методике [10].
ОС. ОС проводили на приборе VaSera-1500N (Fukuda Denshi, Япония). Определяли индекс CAVI (Cardio-Ankle Vascular Index) (сердечно-лодыжечный сосудистый индекс) как среднее значение CAVI справа и слева — показатель жесткости сосудистой стенки магистральных артерий, рассчитываемый по параметру жесткости β с учетом модифицированного уравнения Bramwell-Hill’s, нивелирующего влияние на артериальную жесткость уровня АД в момент исследования, в связи с чем CAVI отражает истинную жесткость сосудистой стенки [17].
Эхокардиография и УЗИ магистральных сосудов. Эхокардиографию в М- и В-режимах и УЗИ магистральных артерий (включая определение поток-зависимой вазодилатации плечевой артерии по методике Целермайера с нижним наложением манжеты) проводили на аппарате экспертного класса Philips IE33 (Нидерланды).
СМАД. СМАД осуществляли в амбулаторных условиях с использованием аппарата BpLab (ООО "Петр Телегин", Россия) после проведения всех этапов обследования (начало мониторинга в 12:00-13:00). Манжету тонометра располагали на левом плече. Интервал измерения АД в активное время суток составлял 20 мин, в ночные часы — 40 мин.
Статистическую обработку данных выполняли с помощью программного пакета JMP Pro 17 ("SAS", США). Проверка количественных показателей на соответствие нормальному распределению осуществлялась с использованием критерия Колмогорова-Смирнова с коррекцией Лиллиефорса. Непрерывные показатели представлялись в виде медианы и квартилей (Ме [ Q25;Q75]), качественные — в виде абсолютных и относительных величин n (%). Значимость различий между тремя независимыми группами по количественным показателям оценивалась с помощью критерия Краскела-Уоллиса, для качественных показателей с помощью критерия χ² Пирсона. Изучение силы связи между количественными показателями выполнялось с помощью непараметрического коэффициента корреляции Спирмена. Уровень статистической значимости был зависимым при значении p<0,05.
Результаты
По результатам СМАД у 146 (70%) мужчин в соответствии с рекомендациями Минздрава России по диагностике и лечению АГ от 2020г была впервые выявлена АГ, и в зависимости от уровня АД по данным СМАД испытуемые были разделены на 3 группы: группу ИДГ составили 70 мужчин, группу с СДГ — 76 мужчин, группу с нормальным уровнем АД (НАД) — 72 мужчины.
Клиническая характеристика анализируемых групп представлена в таблице 1. Мужчины с СДГ имели бóльшие ОТ и ОБ относительно группы НАД, а также бóльшие массу тела и ИМТ относительно других анализируемых групп, что сопровождалось большей частотой ожирения I ст. у первых — 31 (42,1%) vs 8 (11,1%) vs 11 (14,3%) в группе НАД и в группе ИДГ, соответственно (p<0,001). Испытуемые группы СДГ имели наибольший уровень офисного САД и ДАД, а мужчины с ИДГ — более высокий уровень ДАД относительно группы НАД.
Таблица 1
Клиническая характеристика групп испытуемых
|
Параметр, Me [ Q25;Q75] |
НАД (n=72) |
ИДГ (n=70) |
СДГ (n=76) |
p |
|
Возраст (годы) |
43 [ 36; 48] |
45 [ 39; 49] |
47,5 [ 39; 53,25] |
0,031 |
|
Рост (см) |
179 [ 175; 183] |
179 [ 175; 183] |
177,5 [ 172,8; 182,3] |
0,371 |
|
Масса тела (кг) |
80,8 [ 73,5; 88,8] |
85,25 [ 76,62; 97,12] |
90 [ 82; 101,25]* |
0,000 |
|
ИМТ (кг/м²) |
25,4 [ 22,6; 27,9] |
26,4 [ 24,5; 28,5] |
28,8 [ 26,8; 31,5]*# |
<0,001 |
|
ОТ (см) |
91 [ 86; 98] |
96 [ 90; 103] |
103 [ 96,5; 110]* |
<0,001 |
|
ОБ (см) |
103,5 [ 98,8; 107,3] |
103,5 [ 98; 109] |
106 [ 102; 111]* |
0,006 |
|
Курение (%) |
18 (29,03%) |
26 (41,94%) |
27 (40,30%) |
0,838 |
|
Офисное АД и ЧСС |
||||
|
САД (мм рт.ст.) |
120 [ 110; 125,75] |
120 [ 115; 130] |
133 [ 130; 140,5]*# |
<0,001 |
|
ДАД (мм рт.ст.) |
80 [ 70; 80] |
80 [ 80; 90]† |
90 [ 80; 91,25]*# |
<0,001 |
|
ЧСС (уд./мин) |
63 [ 56; 68] |
64,00 [ 60; 68] |
66,5 [ 60; 72,5] |
0,076 |
Примечание: * — СДГ-НАД; # — СДГ-ИДГ; † — ИДГ-НАД (p<0,05); АД — артериальное давление, ДАД — диастолическое АД, ИДГ — изолированная диастолическая артериальная гипертензия, ИМТ — индекс массы тела, Ме — медиана, НАД — нормальное АД, ОТ — окружность талии, ОБ — окружность бедер, САД — систолическое АД, СДГ — систолодиастолическая артериальная гипертензия, ЧСС — частота сердечный сокращений.
По результатам УЗИ сердца и магистральных артерий, ОС (таблица 2) мужчины с СДГ имели бóльшую толщину комплекса интима-медиа (ТИМ) общей сонной артерии и CAVI относительно группы НАД. Наличие атеросклеротического поражения БЦА с максимальным стенозированием просвета сосуда до 25% выявлено у 8 мужчин в группе НАД, у 10 испытуемых в группе ИДГ и у 11 — в группе СДГ, БА — у 6 в группе НАД, у 8 — в группе ИДГ и у 10 — в группе СДГ, соответственно; статистически значимые различия отсутствовали (p>0,05). По результатам пробы Целермайера достоверных межгрупповых различий по степени поток-зависимой вазодилатации плечевой артерии также не выявлено.
Таблица 2
Результаты УЗИ сердца и магистральных артерий, ОС в анализируемых группах
|
Параметр, Me [ Q25;Q75] |
НАД (n=72) |
ИДГ (n=70) |
СДГ (n=76) |
р |
|
Эхокардиография |
||||
|
ЛП (см) |
3,5 [ 3,3; 3,7] |
3,6 [ 3,4; 3,8] |
3,7 [ 3,4; 3,9]* |
0,004 |
|
V ЛП (мл) |
49 [ 42; 57] |
53 [ 45; 60] |
54 [ 47,5; 66]* |
0,005 |
|
КДР ЛЖ (см) |
5 [ 4,8; 5,2] |
5 [ 4,75; 5,2] |
5 [ 4,75; 5,2] |
0,878 |
|
КСР ЛЖ (см) |
2,6 [ 2,5; 2,8] |
2,7 [ 2,5; 3] |
2,7 [ 2,55; 3,1] |
0,192 |
|
КДО ЛЖ (мл) |
109,5 [ 100,3; 121,5] |
114 [ 100,8; 127] |
114 [ 103; 129,5] |
0,522 |
|
КСО ЛЖ (мл) |
37 [ 33,8; 41,3] |
39,5 [ 35,8; 43,3] |
39 [ 32,3; 45,5] |
0,724 |
|
УO ЛЖ (мл) |
75 [ 61; 83,5] |
76 [ 65,8; 82,3] |
75 [ 65; 85,5] |
0,642 |
|
МОК (л/мин) |
4,73 [ 4,16; 5,31] |
4,84 [ 4,46; 5,62] |
5,1 [ 4,35; 5,54] |
0,422 |
|
ФВ ЛЖ (%) |
64 [ 64; 66] |
65 [ 63; 66] |
65 [ 63; 68] |
0,392 |
|
ТМЖП (см) |
1 [ 0,9; 1,1] |
1 [ 1; 1,1] |
1,1 [ 1; 1,2]*# |
<0,001 |
|
ТЗСЛЖ (см) |
0,9 [ 0,9; 0,96] |
0,9 [ 0,9; 1] |
1 [ 0,9; 1]* |
0,0026 |
|
MМ ЛЖ (г) |
156 [ 131; 178] |
170 [ 153; 193]† |
179 [ 153; 198]* |
0,001 |
|
V ПП (мл) |
44 [ 38; 53] |
48 [ 40; 53,25] |
46 [ 38; 57] |
0,186 |
|
СДЛА (мм рт.ст.) |
24 [ 20; 25] |
23 [ 20; 25] |
23 [ 21; 26] |
0,503 |
|
E/A |
1,4 [ 1,20; 1,50] |
1,2 [ 1; 1,4] |
1,1 [ 0,8; 1,4]* |
<0,001 |
|
IVRT (мс) |
70 [ 67; 77] |
70 [ 67; 77,75] |
79 [ 70; 95]*# |
<0,001 |
|
e` (см/с) |
11 [ 10; 13] |
10 [ 9; 11]† |
9 [ 8; 10,75]* |
<0,001 |
|
УЗДС магистральных артерий |
||||
|
ТИМ ОСА ср. (мм) |
0,55 [ 0,5; 0,65] |
0,6 [ 0,5; 0,65] |
0,65 [ 0,55; 0,72]* |
0,007 |
|
ТИМ ОБА ср. (мм) |
0,6 [ 0,5; 0,7] |
0,63 [ 0,5; 0,7] |
0,65 [ 0,5; 0,8] |
0,154 |
|
ПЗВД (%) |
9 [ 6; 11,1] |
8,3 [ 5; 12] |
6,9 [ 4,3; 10,8] |
0,088 |
|
Объемная сфигмография |
||||
|
CAVI (м/с) |
6,65 [ 6,07; 7,3] |
7,05 [ 6,45; 7,52] |
7,12 [ 6,6; 7,75]* |
0,002 |
Примечание: * — СДГ-НАД; # — СДГ-ИДГ; † — ИДГ-НАД (p<0,05); ИДГ — изолированная диастолическая артериальная гипертензия, КДО ЛЖ — конечно-диастолический объем левого желудочка (ЛЖ), КДР ЛЖ — конечно-диастолический размер ЛЖ, КСО ЛЖ — конечно-систолический объем ЛЖ, КСР ЛЖ — конечно-систолический размер ЛЖ, ЛП — левое предсердие, Ме — медиана, ММ ЛЖ — масса миокарда ЛЖ, МОК — минутный объем кровообращения, НАД — нормальное артериальное давление, ОБА — общая бедренная артерия, ОС — объемная сфигмография, ОСА — общая сонная артерия, ПЗВД — поток-зависимая вазодилатация, СДГ — систолодиастолическая артериальная гипертензия, СДЛА — систолическое давление в легочной артерии, ТИМ — толщина комплекса интима-медиа, ТМЖП — толщина межжелудочковой перегородки, ТЗСЛЖ — толщина задней стенки ЛЖ, УО ЛЖ — ударный объем ЛЖ, УЗДС — ультразвуковое дуплексное сканирование, УЗИ — ультразвуковое исследование, ФВ ЛЖ — фракция выброса ЛЖ, CAVI — сердечно-лодыжечный сосудистый индекс, Е/А — соотношение скорости раннего и позднего диастолического потоков митрального клапана, e` — средняя максимальная диастолическая скорость движения фиброзного кольца митрального клапана, IVRT — время изоволюмического расслабления миокарда ЛЖ, V ЛП — объем ЛП, V ПП — объем правого предсердия.
Все показатели эхокардиографии находились в пределах нормативных значений, однако мужчины с СДГ имели больший размер и объем левого предсердия, толщину задней стенки ЛЖ относительно группы НАД, а также наибольшую толщину межжелудочковой перегородки среди анализируемых групп. Пациенты с ИДГ и СДГ имели бóльшую массу миокарда ЛЖ (ММ ЛЖ) относительно группы НАД. Выявлены меньшие показатели диастолической функции ЛЖ у пациентов с ИДГ и СДГ относительно группы НАД, а также бóльшее время изоволюмического расслабления ЛЖ у мужчин с СДГ относительно других групп.
По данным СМАД (рисунок 4) пациенты с ИДГ и СДГ имели бóльший уровень САД и ДАД вне зависимости от времени суток относительно группы НАД.
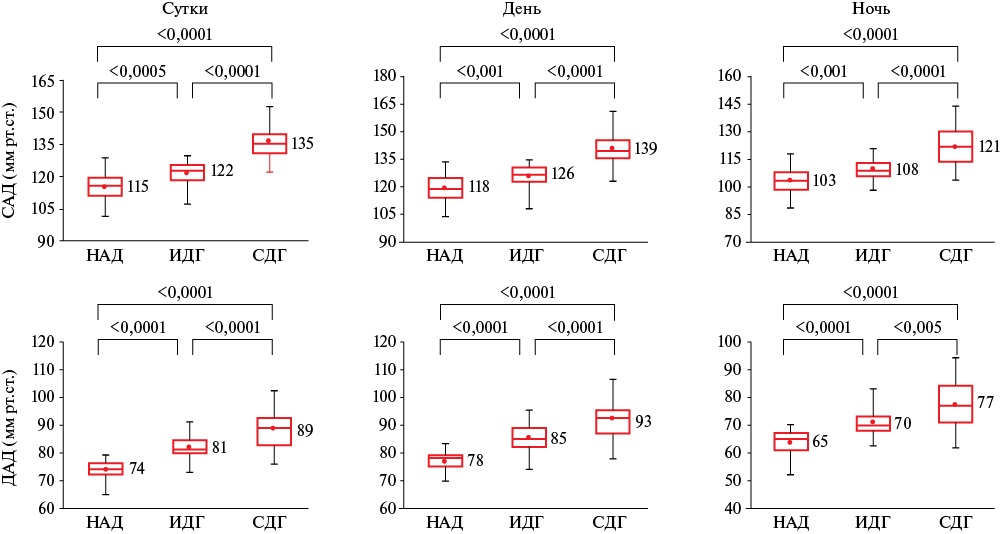
Рис. 4 Результаты СМАД.
Примечание: ДАД — диастолическое артериальное давление, ИДГ — изолированная диастолическая артериальная гипертензия, НАД — нормальное артериальное давление, САД — систолическое артериальное давление, СМАД — суточное мониторирование артериального давления, СДГ — систолодиастолическая артериальная гипертензия.
Все показатели лабораторных анализов крови (таблица 3) находились в пределах референсных значений, за исключением незначительного повышения ХС и ХС ЛНП во всех группах, при этом мужчины с СДГ имели более высокие уровни ХС ЛОНП, ТГ и МК относительно группы НАД.
Таблица 3
Результаты лабораторных методов исследования
|
Параметр, Me [ Q25;Q75] |
НАД (n=72) |
ИДГ (n=70) |
СДГ (n=76) |
р |
|
Эритроциты (10¹²/л) |
4,99 [ 4,76; 5,18] |
4,99 [ 4,75; 5,20] |
4,99 [ 4,83; 5,17] |
0,934 |
|
Гемоглобин (г/л) |
150,5 [ 144; 157] |
155 [ 148; 160,75] |
152 [ 148; 160] |
0,097 |
|
Гематокрит (%) |
43,5 [ 42,3; 45,4] |
44,55 [ 43,2; 46,2] |
44,2 [ 42,55; 46,1] |
0,080 |
|
Лейкоциты (10⁹/л) |
6,15 [ 5,18; 7,2] |
6 [ 5,3; 6,6] |
6,3 [ 5,48; 7,5] |
0,147 |
|
Тромбоциты (10⁹/л) |
218 [ 190; 249,5] |
218 [ 189,3; 239,3] |
209,5 [ 186; 256,3] |
0,833 |
|
ХС общий (ммоль/л) |
5,2 [ 4,78; 5,8] |
5,35 [ 4,8; 5,78] |
5,6 [ 4,8; 6] |
0,173 |
|
ХС ЛВП (ммоль/л) |
1,36 [ 1,19; 1,67] |
1,29 [ 1,1; 1,49] |
1,26 [ 1,05; 1,47] |
0,038 |
|
ХС ЛНП (ммоль/л) |
3,18 [ 2,86; 3,66] |
3,38 [ 2,79; 3,85] |
3,45 [ 2,85; 4] |
0,484 |
|
ТГ (ммоль/л) |
0,99 [ 0,72; 1,33] |
1,15 [ 0,82; 1,67] |
1,42 [ 1,04; 1,9]* |
<0,001 |
|
Общий белок (г/л) |
73 [ 71; 75,75] |
72 [ 69; 75] |
73 [ 70; 77] |
0,377 |
|
Альбумин (г/л) |
46 [ 45; 48] |
46 [ 44,5; 47] |
46 [ 43; 48] |
0,302 |
|
МК (мг/дл) |
5,8 [ 5; 6,4] |
6,1 [ 5,7; 6,8] |
6,2 [ 5,52; 7,2]* |
0,006 |
|
Креатинин (мкмоль/л) |
82 [ 73,75; 87,25] |
82 [ 75,25; 91,00] |
84 [ 76; 93] |
0,386 |
|
Глюкоза (ммоль/л) |
5,7 [ 5,5; 5,98] |
5,65 [ 5,2; 6,11] |
6 [ 5,58; 6,3] |
0,019 |
|
АЛТ (ед/л) |
21 [ 16; 32] |
25 [ 19,25; 31] |
26 [ 18; 34] |
0,052 |
|
АСТ (ед/л) |
19,5 [ 17; 23] |
21 [ 17,25; 24,75] |
21 [ 18; 26] |
0,211 |
|
СРБ (мг/л) |
0,91 [ 0,45; 1,54] |
1,02 [ 0,5; 2,06] |
1,33 [ 0,64; 2,36] |
0,050 |
|
Фибриноген (г/л) |
3,40 [ 3; 3,6] |
3,4 [ 3; 3,7] |
3,5 [ 3,15; 3,8] |
0,547 |
Примечание: * — СДГ-НАД; АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, ИДГ — изолированная диастолическая артериальная гипертензия, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкий плотности, Ме — медиана, МК — мочевая кислота, НАД — нормальное артериальное давление, СДГ — систолодиастолическая артериальная гипертензия, СРБ — С-реактивный белок, ТГ — триглицериды, ХС — холестерин.
Результаты ВКС (рисунок 5) продемонстрировали отсутствие достоверных межгрупповых различий по всем анализируемым параметрам (p>0,05).
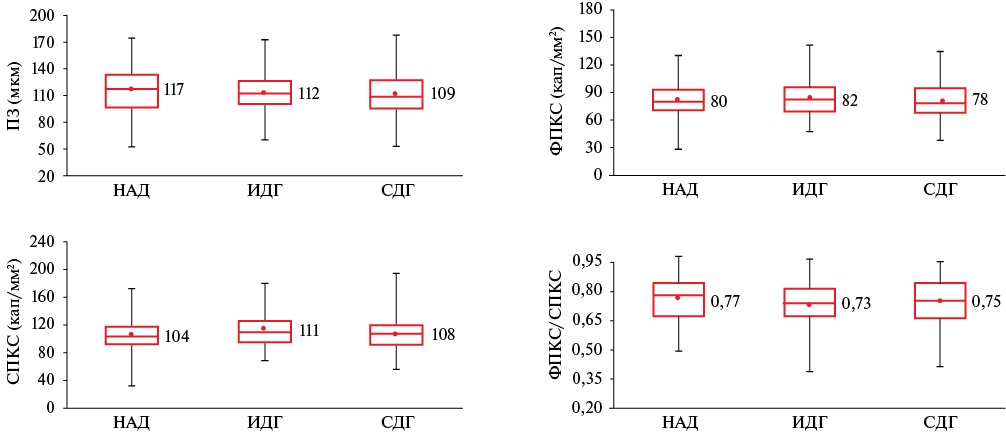
Рис. 5 Результаты ВКС в исследуемых группах.
Примечание: p>0,05; ВКС — видеокапилляроскопия, ИДГ — изолированная диастолическая артериальная гипертензия, НАД — нормальное артериальное давление, ПЗ — перикапиллярная зона, СДГ — систолодиастолическая артериальная гипертензия, СПКС — структурная плотность капиллярной сети, ФПКС — функциональная плотность капиллярной сети.
Результаты ЛДФ на среднем пальце (таблица 4) также продемонстрировали отсутствие достоверных различий между группами по функциональному состоянию микрососудов в покое. По результатам функциональных проб достоверных различий между группами также не выявлено, однако отмечался некоторый тренд (без статистической значимости) к большей степени вазоконстрикции при ДП (↓∆M) (%) у мужчин с СДГ относительно группы НАД.
Таблица 4
Показатели ЛДФ на пальце
|
Параметр, Me [ Q25;Q75] |
НАД (n=72) |
ИДГ (n=70) |
СДГ (n=76) |
р |
|
|
М (PU) |
18,61 [ 16,1; 19,9] |
19,7 [ 15,52; 21] |
18,8 [ 16,13; 20,6] |
0,345 |
|
|
σ (PU) |
2 [ 1,4; 2,54] |
1,75 [ 1,34; 2,48] |
1,66 [ 1,23; 2,23] |
0,112 |
|
|
Эндотелиальный |
Аэ (PU) |
0,99 [ 0,53; 1,27] |
0,76 [ 0,49; 1,23] |
0,79 [ 0,44; 1,20] |
0,248 |
|
Аэ/М (%) |
5,14 [ 3,23; 7,41] |
4,46 [ 2,67; 7,65] |
3,85 [ 2,23; 6,95] |
0,267 |
|
|
Аэ/3σ (%) |
15,24 [ 11,96; 18,11] |
15,21 [ 12,2; 18,60] |
14,52 [ 11,1; 18,76] |
0,807 |
|
|
Нейрогенный |
Ан (PU) |
0,99 [ 0,57; 1,23] |
0,88 [ 0,51; 1,16] |
0,76 [ 0,44; 1,38] |
0,433 |
|
Ан/М (%) |
5,03 [ 3,21; 7,15] |
5,05 [ 2,98; 7,60] |
3,97 [ 2,31; 8,49] |
0,411 |
|
|
Ан/3σ (%) |
14,7 [ 12,29; 17,31] |
15,94 [ 11,91; 19,13] |
15,48 [ 11,94; 19,1] |
0,655 |
|
|
Миогенный |
Ам (PU) |
0,62 [ 0,4; 0,86] |
0,58 [ 0,43; 0,75] |
0,48 [ 0,29; 0,7] |
0,022 |
|
Ам/М (%) |
3,73 [ 2,45; 4,8] |
3,14 [ 2,04; 4,63] |
2,42 [ 1,42; 4,35] |
0,013 |
|
|
Ам/3σ (%) |
11,05 [ 7,83; 13,41] |
10,95 [ 8,88; 13,93] |
9,72 [ 7,37; 12,72] |
0,283 |
|
|
Венулярный |
Ав (PU) |
0,21 [ 0,16; 0,28] |
0,19 [ 0,16; 0,26] |
0,19 [ 0,15; 0,24] |
0,515 |
|
Ав/М (%) |
1,3 [ 0,96; 1,61] |
1,16 0,87; 1,61] |
1,01 [ 0,75; 1,43] |
0,124 |
|
|
Ав/3σ (%) |
3,73 [ 2,86; 4,85] |
3,54 [ 2,74; 5,46] |
4 [ 3,18; 5,16] |
0,392 |
|
|
Кардиальный |
Ас (PU) |
0,87 [ 0,64; 1,07] |
0,8 [ 0,58; 1,17] |
0,89 [ 0,59; 1,2] |
0,968 |
|
Ас/М (%) |
4,75 [ 3,56; 7,12] |
4,35 [ 3,07; 7,72] |
4,6 [ 3,32; 7,23] |
0,842 |
|
|
Ас/3σ (%) |
15,51 [ 9,88; 21,26] |
15,66 [ 12,20; 21,7] |
18,2 [ 12,68; 23,02] |
0,256 |
|
|
Результаты функциональных проб |
|||||
|
ДП |
Ммин. (PU) |
8,97 [ 7,22; 11,32] |
9,55 [ 7,20; 12,71] |
8,4 [ 6,09; 10,94] |
0,347 |
|
T (сек) |
8 [ 7; 9] |
8 [ 7; 9] |
8 [ 7; 9] |
0,551 |
|
|
↓∆M (%) |
47 [ 37,25; 55,75] |
46,5 [ 34; 58,25] |
56 [ 41,5; 61] |
0,033 |
|
|
АО |
Ммакс. (PU) |
21,3 [ 18,08; 23,06] |
21,6 [ 19,04; 23,5] |
21,09 [ 19,7; 22,6] |
0,697 |
|
T (сек) |
27 [ 21; 43,5] |
25,5 [ 20,25; 51,25] |
27,5 [ 18; 36] |
0,510 |
|
|
↑∆M (%) |
115 [ 108; 130,5] |
113 [ 107,75; 125,25] |
110 [ 105,3; 122,8] |
0,137 |
|
Примечание: АО — артериальная окклюзия, ДП — дыхательная проба, ИДГ — изолированная диастолическая артериальная гипертензия, ЛДФ — лазерная допплеровская флоуметрия, М — уровень перфузии, Ме — медиана, Ммакс. — максимальный уровень М, Ммин. — минимальный уровень М, НАД — нормальное артериальное давление, СДГ — систолодиастолическая артериальная гипертензия, Аi — амплитуда механизмов модуляции микрокровотока (э — эндотелиальный, н — нейрогенный, м — миогенный, в — венулярный, с — кардиальный), Ai/M — перфузионная эффективность механизмов модуляции микрокровотока, Ai/3σ — вазомоторная эффективность механизмов модуляции микрокровотока, T — время развития Ммакс./мин, σ — вариабельность тканевого кровотока, ↓∆M — снижение перфузии, ↑∆M — повышение перфузии.
Результаты ЛДФ в коже предплечья (таблица 5) также продемонстрировали отсутствие достоверных межгрупповых различий по функциональному состоянию в покое, констрикторной и дилататорной активности микрососудов. Однако отмечался недостоверный тренд к меньшему приросту уровня тканевой перфузии при АО (↑∆M) (%) у мужчин с СДГ относительно группы НАД (p=0,083).
Таблица 5
Показатели ЛДФ на предплечье
|
Параметр, Me [ Q25;Q75] |
НАД (n=72) |
ИДГ (n=70) |
СДГ (n=76) |
р |
|
|
М (PU) |
3,34 [ 2,7; 4,1] |
3,55 [ 3,05; 4,38] |
3,59 [ 2,99; 4,3] |
0,131 |
|
|
σ (PU) |
0,41 [ 0,32; 0,57] |
0,42 [ 0,31; 0,53] |
0,45 [ 0,38; 0,6] |
0,274 |
|
|
Эндотелиальный |
Аэ (PU) [ Q25;Q75] |
0,13 [ 0,1; 0,22] |
0,17 [ 0,10; 0,23] |
0,16 [ 0,11; 0,24] |
0,357 |
|
Аэ/М (%) |
3,78 [ 2,86; 7,26] |
4,48 [ 2,53; 6,01] |
4,50 [ 2,9; 6,33] |
0,680 |
|
|
Аэ/3σ (%) |
11,36 [ 8,41; 14,48] |
12,42 [ 8,92; 15,35] |
11,67 [ 8,93; 16,15] |
0,459 |
|
|
Нейрогенный |
Ан (PU) |
0,15 [ 0,11; 0,24] |
0,16 [ 0,12; 0,23] |
0,17 [ 0,12; 0,24] |
0,531 |
|
Ан/М (%) |
4,91 [ 3,10; 7,24] |
4,49 [ 2,81; 6,46] |
4,4 [ 3,16; 6,9] |
0,521 |
|
|
Ан/3σ (%) |
12,9 [ 10; 15,69] |
13,26 [ 9,8; 16,87] |
12,54 [ 9,07; 16,67] |
0,948 |
|
|
Миогенный |
Ам (PU) |
0,13 [ 0,1; 0,2] |
0,13 [ 0,1; 0,17] |
0,13 [ 0,09; 0,2] |
0,931 |
|
Ам/М (%) |
4,11 [ 2,72; 6,52] |
3,67 [ 2,38; 4,59] |
3,66 [ 2,41; 5,31] |
0,274 |
|
|
Ам/3σ (%) |
10,71 [ 8,33; 13,75] |
10,54 [ 8,33; 14,29] |
10 [ 7,22; 13,64] |
0,688 |
|
|
Венулярный |
Ав (PU) |
0,07 [ 0,05; 0,1] |
0,07 [ 0,05; 0,11] |
0,07 [ 0,05; 0,12] |
0,586 |
|
Ав/М (%) |
2,14 [ 1,64; 3,08] |
1,80 [ 1,43; 2,91] |
2,01 [ 1,52; 3,06] |
0,182 |
|
|
Ав/3σ (%) |
6,06 [ 4,07; 8,57] |
5,35 [ 4,28; 8,83] |
5,83 [ 4,39; 8,7] |
0,798 |
|
|
Кардиальный |
Ас (PU) |
0,26 [ 0,19; 0,32] |
0,22 [ 0,17; 0,33] |
0,29 [ 0,16; 0,41] |
0,297 |
|
Ас/М (%) |
7,78 [ 6,05; 11,83] |
6,07 [ 4,33; 9,7] |
7,86 [ 5,15; 9,91] |
0,074 |
|
|
Ас/3σ (%) |
21,90 [ 15,79; 25,13] |
20,53 [ 15,13; 25,06] |
20,9 [ 13,33; 29,46] |
0,691 |
|
|
Результаты функциональных проб |
|||||
|
ДП |
Ммин. (PU) |
2,1 [ 1,57; 2,8] |
2,04 [ 1,58; 2,78] |
1,89 [ 1,52; 2,6] |
0,529 |
|
T (сек) |
8 [ 7; 9] |
8 [ 7; 9] |
8 [ 7; 9] |
0,929 |
|
|
↓∆M (%) |
37 [ 22; 49] |
40 [ 29,25; 55] |
46,5 [ 32; 56,5] |
0,031 |
|
|
АО |
Ммакс. (PU) |
9,12 [ 7,67; 10,6] |
8,94 [ 7,78; 10,5] |
9,02 [ 7,79; 10,5] |
0,959 |
|
T (сек) |
15 [ 11; 18,5] |
14 [ 11,75; 19,75] |
15 [ 11; 19,5] |
0,821 |
|
|
↑∆M (%) |
264 [ 219; 339] |
247,5 [ 212,5; 282,5] |
244 [ 203; 289] |
0,044 |
|
Примечание: АО — артериальная окклюзия, ДП — дыхательная проба, ИДГ — изолированная диастолическая артериальная гипертензия, ЛДФ — лазерная допплеровская флоуметрия, М — уровень перфузии, Ме — медиана, Ммакс. — максимальный уровень М, Ммин. — минимальный уровень М, НАД — нормальное артериальное давление, СДГ — систолодиастолическая артериальная гипертензия, Аi — амплитуда механизмов модуляции микрокровотока (э — эндотелиальный, н — нейрогенный, м — миогенный, в — венулярный, с — кардиальный), Ai/M — перфузионная эффективность механизмов модуляции микрокровотока, Ai/3σ — вазомоторная эффективность механизмов модуляции микрокровотока, T — время развития Ммакс./мин, σ — вариабельность тканевого кровотока, ↓∆M — снижение перфузии, ↑∆M — повышение перфузии.
Результаты ФПГ (рисунок 6) продемонстрировали более высокий Alp75, VA, RI у мужчин с СДГ относительно группы НАД. Пациенты с ИДГ продемонстрировали более высокий уровень RI относительно мужчин с НАД.
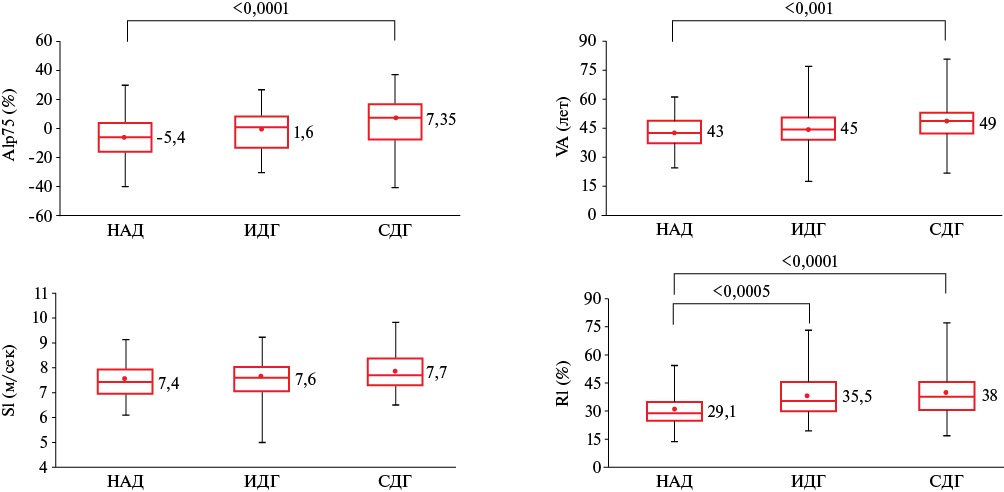
Рис. 6 Результаты ФПГ в анализируемых группах.
Примечание: ИДГ — изолированная диастолическая артериальная гипертензия, НАД — нормальное артериальное давление, СДГ — систолодиастолическая артериальная гипертензия, ФПГ — фотоплетизмография, Alp75 — расчетный индекс аугментации в %, корригированный по частоте сердечных сокращений 75 уд./мин, VA — сосудистый возраст, SI — индекс жесткости, RI — индекс отражения.
Результаты корреляционного анализа между показателями ФПГ и данными СМАД в группах СДГ и ИДГ (таблица 6) продемонстрировали достоверную положительную связь между уровнем ДАД и Alp75, SI и RI в обеих группах. В группе СДГ была также выявлена положительная корреляционная связь ночного уровня САД с Alp75.
Таблица 6
Корреляционные связи показателей ФПГ с данными СМАД в группе СДГ и ИДГ
|
Параметр, Me [ Q25;Q75] |
Alp75 (%) |
VA (лет) |
SI (м/сек) |
RI (%) |
|
|
Группа ИДГ |
|||||
|
САД (мм рт.ст.) |
сутки |
н/д |
н/д |
н/д |
н/д |
|
день |
н/д |
н/д |
н/д |
н/д |
|
|
ночь |
н/д |
н/д |
-0,24* |
н/д |
|
|
ДАД (мм рт.ст.) |
сутки |
0,26* |
н/д |
н/д |
0,25* |
|
день |
0,29** |
н/д |
0,22* |
0,27* |
|
|
ночь |
н/д |
н/д |
н/д |
н/д |
|
|
Группа СДГ |
|||||
|
САД (мм рт.ст.) |
сутки |
н/д |
н/д |
н/д |
н/д |
|
день |
н/д |
н/д |
н/д |
н/д |
|
|
ночь |
0,23* |
н/д |
0,2* |
н/д |
|
|
ДАД (мм рт.ст.) |
сутки |
0,32** |
н/д |
н/д |
0,42** |
|
день |
0,28** |
н/д |
н/д |
0,38** |
|
|
ночь |
0,29** |
н/д |
н/д |
0,36** |
|
Примечание: * — р<0,05; ** — р<0,01; ДАД — диастолическое артериальное давление, ИДГ — изолированная диастолическая артериальная гипертензия, Ме — медиана, н/д — недостоверно, САД — систолическое артериальное давление, СДГ — систолодиастолическая артериальная гипертензия, СМАД — суточное мониторирование артериального давления, ФПГ — фотоплетизмография, Alp75 — расчетный индекс аугментации в %, корригированный по частоте сердечных сокращений 75 уд./мин; VA — сосудистый возраст, SI — индекс жесткости, RI — индекс отражения.
Обсуждение
В настоящей работе впервые выполнено одномоментное комплексное исследование различных звеньев МЦР кожи у мужчин трудоспособного возраста с ИДГ и СДГ низкого и умеренного ССР с помощью 3-х неинвазивных методов: ВКС, ЛДФ и ФПГ.
Изучение капиллярного звена МЦР проводили методом ВКС. Полученные результаты (рисунок 5) свидетельствует об отсутствии разряжения капиллярной сети, скрытой задержки жидкости в интерстициальном пространстве кожи и уменьшения площади обменной поверхности у мужчин с ИДГ и СДГ низкого и умеренного ССР. Полученные данные противоречат результатам ранее проведенных работ, продемонстрировавших уменьшение плотности капиллярной сети у пациентов с СДГ [18-20]. Возможно, отсутствие подобных изменений свидетельствует о раннем этапе патологии, когда капиллярное русло еще не вовлечено в патологический процесс или находится в стадии компенсации для обеспечения метаболических потребностей тканей, а данные изменения могут развиваться по мере прогрессирования патологии. Для подтверждения данной гипотезы требуются дальнейшие проспективные исследования.
Функциональное состояние пре- и посткапиллярного звеньев МЦР изучали методом ЛДФ с применением амплитудно-частотного вейвлет-анализа колебаний микрокровотока в двух областях: в коже подушечки пальца, где ввиду обилия поверхностно расположенных артериоловенулярных анастомозов микрососудистый кровоток носит в основном шунтовую (терморегуляторную) направленность, и в коже предплечья, где артериоловенулярные анастомозы находятся глубже области зондирования при ЛДФ, что обусловливает преимущественно нутритивный характер регистрируемого микрокровотока. Результаты ЛДФ продемонстрировали отсутствие изменения уровня и вариабельности тканевого кровотока, тонуса прекапиллярных артериол и посткапиллярных венул, перфузионной эффективности и вазомоторной активности основных механизмов модуляции микрососудистого кровотока у мужчин с ИДГ и СДГ в исследуемых областях.
Констрикторную активность прекапиллярных артериол изучали при проведении ДП, при которой активация симпатической нервной системы на уровне нейромышечных синапсов вызывает кратковременную констрикцию артериол и снижение уровня тканевой перфузии [21]. Дилататорный резерв микрососудов изучали при проведении пробы с 5-мин. АО, при которой увеличение уровня тканевого кровотока направлено на восстановление тканевого гомеостаза после кратковременного эпизода ишемии. Результаты функциональных проб продемонстрировали отсутствие повышения констрикторной активности и уменьшения дилататорного резерва микрососудов в исследуемых областях кожи у мужчин с ИДГ и СДГ низкого и умеренного ССР.
Таким образом, результаты ЛДФ свидетельствуют об отсутствии изменений функционального состояния и констрикторной/дилататорной активности пре- и посткапиллярного звена МЦР в коже подушечки пальца и предплечья у мужчин с ИДГ и СДГ, что может быть обусловлено несколькими причинами.
Первая заключается непосредственно в самом методе ЛДФ, который имеет ряд существенных ограничений, таких как неравномерность распределения питающих/шунтирующих микрососудов в различных участках кожи и нелинейная зависимость уровня получаемого сигнала от микрососудистого гематокрита [22]. Вторая причина — объектом исследования являются прекапиллярные артериолы, в которых доминирует гуморальный механизм регуляции сосудистого тонуса. Полученные результаты позволяют предположить, что у мужчин с ИДГ и СДГ низкого и умеренного ССР регуляторные механизмы обеспечивают адекватное поступление крови в капиллярное русло и поддерживают необходимый уровень транскапиллярного обмена (компенсация). Состояние прекапиллярных артериол может изменяться по мере прогрессирования патологии и носить индивидуально-типологический характер в зависимости от стадии АГ и принимаемой антигипертензивной терапии [23]. Третья причина может заключаться в том, что основная функция кожи — терморегуляторная, а микрососуды кожи не подвержены барорефлекторной регуляции, в связи с чем МЦР кожи может не отражать в полной мере состояние системной микроциркуляции на первой стадии АГ.
Суммируя совокупность результатов, полученных методами ВКС и ЛДФ, можно сделать вывод, что изучение данных показателей состояния капиллярного, пре- и посткапиллярного звеньев МЦР является малоинформативным у мужчин с СДГ и ИДГ низкого и умеренного ССР.
Функциональное состояние крупных распределительных артериол (до 150 мкм), в которых доминирует нейрогенный механизм регуляции сосудистого тонуса, изучали методом ФПГ на просвет. Результаты ФПГ продемонстрировали более высокий тонус ГМК (RI) терминальных мышечных артерий и распределительных артериол у мужчин с ИДГ и СДГ относительно мужчин с НАД. Это может являться следствием функциональных изменений ГМК при повышении активности симпатической адренергической нервной системы, что можно рассматривать в рамках нейрогенной теории развития АГ Ланга-Мясникова [24]. В то же время, подобные изменения могут быть следствием повышения чувствительности ГМК к тканевым и системным циркулирующим вазоконстрикторным агентам (ангиотензин II, норадреналин и др.) или развития их эутрофического ремоделирования, которое является наиболее ранним специфическим изменением у пациентов с АГ [25]. Увеличение тонуса ГМК обусловливает уменьшение сосудистого просвета, что, в соответствии с законом Пуазейля, приводит к увеличению ОПСС в проксимальных отделах МЦР, вызывая повышение ДАД. Подтверждением этому могут служить выявленные корреляционные связи RI с уровнем ДАД в группах ИДГ и СДГ (таблица 6). Однако полученные в ходе настоящего исследования данные не согласуются с результатами ранее проведенных работ, в которых хоть и отмечалась тенденция к увеличению тонуса ГМК резистивных сосудов у пациентов с АГ относительно лиц с НАД, статистической значимости данные различия не достигали [26][27]. Это может быть обусловлено возможной обратимостью нарушений эластических свойств сосудов и снижением их тонуса на фоне регулярного приема антигипертензивной терапии, а также особенностью изучаемой выборки. Для уточнения причинно-следственных связей между повышением ДАД и увеличением тонуса ГМК терминальных мышечных артерий и распределительных артериол у данной категории пациентов требуются дальнейшие исследования. Кроме того, в данном контексте представляется интересным изучение функционального состояния данных сосудов у пациентов с изолированной систолической АГ.
Результаты ФПГ продемонстрировали бóльшую артериальную жесткость (Alp75) у мужчин с СДГ относительно группы НАД, что согласуется с результатами ранее проведенных исследований [26-28]. Действительно, увеличение артериальной жесткости является характерным изменением сосудов у пациентов с СДГ. Это может быть следствием деградации эластических компонентов (эластин) и увеличения синтеза коллагена ГМК сосудистой стенки, что влечет за собой дезорганизацию внеклеточного матрикса и снижение эластических свойств артерий [7]. В результате увеличивается проведение пульсовой волны в сосуды МЦР, что является основным фактором их повреждения, и, как следствие, нарушения тонких механизмов тканевого гомеостаза и адекватного кровоснабжения органов и тканей. В данном контексте представляются интересными результаты ОС, по данным которой мужчины с СДГ относительно группы НАД имели больший CAVI, что свидетельствует о большей жесткости артерий мышечно-эластического типа у первых, хотя данный показатель не превышал нормативные значения для соответствующих возрастных групп. По данным УЗИ мужчины с СДГ относительно группы НАД имели бóльшую ТИМ сонных артерий, больший размер левого предсердия, бóльшую толщину стенок и ММ ЛЖ, а также меньшие показатели релаксационной способности миокарда ЛЖ. Пациенты с ИДГ характеризовались большей ММ ЛЖ и меньшим e’ (средняя максимальная диастолическая скорость движения фиброзного кольца митрального клапана) по сравнению с мужчинами с НАД. Несмотря на то, что данные показатели не превышали нормативных значений, эти отклонения можно рассматривать в качестве развивающегося субклинического ремоделирования сердечно-сосудистой системы у мужчин с ИДГ и СДГ низкого и умеренного ССР [29]. Результаты ФПГ также продемонстрировали больший сосудистый возраст у мужчин с СДГ относительно группы НАД на фоне сопоставимого возраста, что можно рассматривать в рамках раннего сосудистого старения у мужчин с СДГ.
Таким образом, мужчины с ИДГ низкого и умеренного ССР по данным ФПГ характеризуются бóльшим тонусом ГМК (RI) терминальных мышечных артерий и распределительных артериол кожи, что может свидетельствовать о более высоком ОПСС в качестве основного механизма развития ИДГ.
Мужчины с СДГ имели более высокие значения ИМТ, ОТ, ОБ, а также чаще страдали ожирением I ст. относительно мужчин с НАД. Результаты корреляционного анализа продемонстрировали положительную связь данных показателей с уровнем САД и ДАД в группе СДГ, что подтверждает значимую роль избыточной массы тела и ожирения в увеличении риска развития АГ у мужчин [30][31]. На этом фоне мужчины с СДГ имели больший уровень ТГ, ХС ЛНП и МК относительно группы НАД, что в целом можно рассматривать в рамках развития метаболических сдвигов у первых. Достоверных корреляций данных показателей крови со структурно-функциональным состоянием терминальных мышечных артерий и распределительных артериол и уровнем АД по данным СМАД в группе СДГ не выявлено (что, вероятно, обусловлено незначительным повышением уровней ТГ, ХС ЛНП и МК). В то же время, результаты эпидемиологических и клинических исследований демонстрируют ассоциацию повышенного уровня МК с развитием АГ [32][33], а в экспериментальных исследованиях показана способность МК усиливать окислительный стресс и экспрессию ангиотензина II в эндотелиальных клетках сосудов, способствуя развитию эндотелиальной дисфункции, вазоконстрикции и пролиферации ГМК [34].
Ограничения исследования. Ограничением данной работы является отсутствие изучения уровня циркулирующих вазоактивных биологических агентов, концентрация и чувствительность к которым структурных элементов МЦР может быть изменена у мужчин с ИДГ и СДГ низкого и умеренного ССР, что требует дальнейших исследований.
Заключение
По данным ВКС и ЛДФ изменений на уровне капиллярного русла и функционального состояния прекапиллярных артериол кожи не выявлено, что может свидетельствовать о малой информативности данных методов на начальных стадиях развития АГ.
Мужчины с ИДГ низкого и умеренного ССР по данным ФПГ характеризуются бóльшим тонусом ГМК (RI) терминальных мышечных артерий и распределительных артериол кожи, что может свидетельствовать о более высоком ОПСС в качестве основного механизма развития ИДГ.
Мужчины с СДГ низкого и умеренного ССР по данным объемной сфигмографии имеют бóльшую жесткость магистральных артерий (CAVI), а по данным ФПГ имеют бóльшую сосудистую жесткость (Alp75) и более высокий тонус ГМК (RI) терминальных мышечных артерий и распределительных артериол кожи, что может свидетельствовать о сочетании увеличения ОПСС и артериальной жесткости в качестве патофизиологических механизмов развития СДГ.
Отношения и деятельность. Работа выполнена в рамках Государственного задания Минздрава России № 124013100904-7 "Разработка метода бесконтактного определения уровня артериального давления по данным видеоплетизмографии веб камерой кожи лица".
Список литературы
1. Balanova YuA, Shalnova SA, Imaeva AE, et al. Prevalence, Awareness, Treatment and Control of Hypertension in Russian Federation (Data of Observational ESSERF-2 Study). Rational Pharmacotherapy in Cardiology. 2019;15(4):450-66. (In Russ.) doi:10.20996/1819-6446-2019-15-4-450-466.
2. Kushakovsky MS. Essential hypertension (hypertension). The causes, mechanisms, clinical features, treatment. St. Petersburg, Foliant publishing house, 2002. 414 p. 5 publication, significantly expanded and revised. (In Russ.) ISBN: 5-93929-045-0.
3. Makolkin VI, Podzolkov VI, Pablov VI, et al. Microcirculation in arterial hypertension. Kardiologiia. 2003;43(5):60-7. (In Russ.)
4. Frohlich ED, Ventura H. Pathophysiology: disease mechanisms. Hypertension. 2009:1-14.
5. Makolkin VI. Microcirculation and target organ damage in arterial hypertension. Kardiologiia. 2006;2:83-5. (In Russ.)
6. Laurent S, Boutouyrie P. The Structural Factor of Hypertension: Large and Small Artery Alterations. Circ Res. 2015;116(6):1007-21. doi:10.1161/CIRCRESAHA.116.303596.
7. Podolinny GI, Chirita IL. Muscular and elastic vessels as members of pathogenesis in arterial hypertension. Bulletin of the Pridnestrovian University. Series: Medical, biological and chemical sciences. 2016; 2(53):47-51. (In Russ.) EDN XBVMMP.
8. Romero CA, Alfie J, Galarza C, et al. Hemodynamic circulatory patterns in young patients with predominantly diastolic hypertension. J Am Soc Hypertens. 2013;7(2):157-62. doi:10016/j.jash.2013.01.001.
9. Westerhof N, Lankhaar JW, Westerhof BE. The arterial Windkessel. Med Biol Eng Comput. 2009;47(2):131-41. doi:10.1007/s11517-008-0359-2.
10. Korolev AI, Fedorovich AA, Gorshkov AY, et al. Structural and functional state of various parts of skin microcirculation at an early stage of hypertension in working-age men. Microvasc Res. 2023: 145;104440. doi:10.1016/j.mvr.2022.104440.
11. Korolev AI, Fedorovich AA, Gorshkov AYu, et al. Photoplethysmography factors associated with undiagnosed hypertension in men with low and moderate cardiovascular risk. Cardiovascular Therapy and Prevention. 2023;22(7):3649. (In Russ.) doi:10.15829/1728-8800-2023-3649. EDN JJRXGL.
12. Kozlov VI. Capillaroscopy in clinical practice: monograph. M: Practical medicine. 2015. 232 p. (In Russ.) ISBN: 978-5-98811-342-3.
13. Korolev AI, Fedorovich AA, Gorshkov AYu, et al. Upper limbs skin microvascular characteristics in healthy men of working age. Russian Journal of Preventive Medicine. 2021;24(7):60-9. (In Russ.) doi:10.17116/profmed20212407160.
14. Stefanovska A, Bracic M, Kvernmo HD. Wavelet analysis of oscillations in peripheral blood circulation measured by Doppler technique. IEEE Trans Biomed Eng. 1999;46(10):1230-9. doi:10.1109/10/790500.
15. Fedorovich AA. The functional state of regulatory mechanisms of the microcirculatory blood flow in normal conditions and in arterial hypertension according to laser Doppler flowmetry. Regional blood circulation and microcirculation. 2010;9(1):49-60. (In Russ.) doi:10.24884/1682-6655-2010-9-1-49-60.
16. Mordvinova EV, Oschepkova EV, Fedorovich AA, et al. 2014. The functional state of microcirculatory vessels in patients with arterial hypertension I-II degree with different degrees of cardiovascular risk. Systemic Hypertension. 2014;11(2):29-35. (In Russ.) doi:10.26442/2075-082X_11.2.29-35.
17. Rogoza AN. Non-invasive methods for determining the rigidity of the main arteries. Functional Diagnostics. 2007;3:17-32. (In Russ.)
18. Prasad A, Dunnill GS, Mortimer PS, et al. Capillary rarefaction in the forearm skin in essential hypertension. J Hypertens. 1995; 13:265-8. PMID:7615958.
19. Antonios TF, Singer DR, Markandu ND, et al. Structural skin capillary rarefaction in essential hypertension. Hypertension. 1999;33: 998-1001. doi:10.1161/01.hyp.33.4.998.
20. Serné EH, Gans RO, ter Maaten JC, et al. Impaired skin capillary recruitment in essential hypertension is caused by both functional and structural capillary rarefaction. Hypertension. 2001;38:238-42. doi:10.1161/01.hyp.38.2.238.
21. Krupatkin AI. Blood flow oscillations — new diagnostic language in microvascular research. Regional blood circulation and microcirculation. 2014;13(1):83-99. (In Russ.) doi:10.24884/1682-6655-2014-13-1-83-99.
22. Jung F, Leithäuser B, Landgraf H, et al. Laser Doppler flux measurement for the assessment of cutaneous microcirculation-critical remarks. Clin Hemorheol Microcirc. 2013;55(4):411-6. doi:10.3233/CH-131778.
23. Vasilyev AP, Streltsova NN, Sekisova MA, et al. Functional characteristics of microcirculation and their prognostic value in patients with arterial hypertension. Cardiovascular Therapy and Prevention. 2011;10(5):14-9. (In Russ.) doi:1728-8800-2011-5-14-19.
24. Shlyakhto EV, Conrady AΟ. Causes and consequences of sympathetic overactivity in hypertension. Arterial Hypertension. 2003; 9(3):81-8. (In Russ.) doi:10.18705/1607-419X-2003-9-3-81-88.
25. Park JB, Schiffrin EL. Small artery remodeling is the most prevalent (earliest?) form of target organ damage in mild essential hypertension. J Hypertens. 2001;19:921-30. doi:10.1097/00004872-200105000-00013.
26. Ivanov SV, Ryabikov AN, Malyutina SK. Arterial stiffness and pulse wave reflection in association with arterial hypertension. Bulletin of Siberian Branch of Russian Academy of Medical Sciences. 2008;28(3):9-12. (In Russ.)
27. Tuktarov AM, Kazanceva TS, Filippov AE, et al. The Relationship of Modifiable Risk Factors with Indicators of Arterial Stiffness and Vascular Age in Patients with Arterial Hypertension. Rational Pharmacotherapy in Cardiology. 2021;17(1):42-8. (In Russ.) doi:10.20996/1819-6446-2021-02-12.
28. Milyagin VA, Filichkin DE, Shpynev KV, et al. Contour analysis of central and peripheral pulse wave in healthy people and in hypertensive patients. Arterial Hypertension. 2009;15(1):78-85. (In Russ.) doi:10.18705/1607-419X-2009-15-1-78-85.
29. Semeniago EF, Salivonchik DP. Arterial hypertension: a path from unchanged transmitral bloodstream to dysfunction. Health and Ecology Issues. 2020;(3):27-35. (In Russ.) doi:10.51523/2708-6011.2020-17-3-4.
30. Netchessova TA. Obesity and hypertension. Medical practice: scientific and practical therapeutic journal. 2021;2(77):49-52. (In Russ) EDN OROXIR.
31. Kim MS, Kim WJ, Khera AV, et al. Association between adiposity and cardiovascular outcomes: an umbrella review and meta-analysis of observational and Mendelian randomization studies. Eur Heart J. 2021;42(34):3388-403. doi:10.1093/eurheartj/ehab454.
32. Kratzer JT, Lanaspa MA, Murphy MN, et al. Evolutionary history and metabolic insights of ancient mammalian uricases. Proc Natl Acad Sci USA. 2014;111:3763-8. doi:10.1073/pnas.1320393111.
33. Kuwabara M. Hyperuricemia, Cardiovascular Disease, and Hypertension. Pulse (Basel). 2016;3:242-52. doi:10.1159/000443769.
34. Yu MA, Sánchez-Lozada LG, Johnson RJ, et al. Oxidative stress with an activation of the renin–angiotensin system in human vascular endothelial cells as a novel mechanism of uric acid-induced endothelial dysfunction. J Hypertens. 2010;28:1234-42.
Об авторах
А. И. КоролевРоссия
Королев Андрей Игоревич — к.м.н., м.н.с. лаборатории микроциркуляции и регионарного кровообращения отдела фундаментальных и прикладных аспектов ожирения, врач-кардиолог.
Москва
В. С. Ососков
Россия
М.н.с.
Москва
А. А. Федорович
Россия
Федорович Андрей Александрович — к.м.н., с.н.с лаборатории микроциркуляции и регионарного кровообращения отдела фундаментальных и прикладных аспектов ожирения ФГБУ «НМИЦ ТПМ» Минздрава России; с.н.с. лаборатории вегетативной регуляции сердечно-сосудистой системы.
Москва
М. Г. Чащин
Россия
Чащин Михаил Георгиевич — к.м.н., руководитель липидной клиники КДЦ.
Москва
В. А. Дадаева
Россия
Дадаева Валида Арсланалиевна — к.м.н., н.с. отдела фундаментальных и прикладных аспектов ожирения.
Москва
А. В. Стрелкова
Россия
Стрелкова Анна Владиславовна — м.н.с. лаборатории микроциркуляции и регионарного кровообращения отдела фундаментальных и прикладных аспектов ожирения.
Москва
К. В. Омельяненко
Россия
Омельяненко Ксения Витальевна — лаборант-исследователь отдела фундаментальных и прикладных аспектов ожирения.
Москва
М. А. Михайлова
Россия
Михайлова Мария Александровна — н.с. отдела фундаментальных и прикладных аспектов ожирения.
Москва
А. Ю. Горшков
Россия
Горшков Александр Юрьевич — к.м.н., зав. лабораторией микроциркуляции и регионарного кровообращения отдела фундаментальных и прикладных аспектов ожирения, зам. директора по научной и амбулаторно-поликлинической работе.
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — д.м.н., профессор, академик РАН, директор.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Изменения микроциркуляторного русла являются одним из основных механизмов развития артериальной гипертензии (АГ).
Что добавляют результаты исследования?
- Данные фотоплетизмографии демонстрируют больший тонус гладкомышечных клеток терминальных мышечных артерий и распределительных артериол у мужчин с изолированной диастолической АГ, что свидетельствует о повышении общего периферического сосудистого сопротивления в качестве механизма развития изолированной диастолической АГ.
- Мужчины с систолодиастолической АГ характеризуются большей артериальной жесткостью и тонусом гладкомышечных клеток данных сосудов, что свидетельствует о сочетании увеличения общего периферического сосудистого сопротивления и артериальной жесткости в качестве механизма развития систолодиастолической АГ.
Рецензия
Для цитирования:
Королев А.И., Ососков В.С., Федорович А.А., Чащин М.Г., Дадаева В.А., Стрелкова А.В., Омельяненко К.В., Михайлова М.А., Горшков А.Ю., Драпкина О.М. Структурно-функциональное состояние микроциркуляторного русла кожи у мужчин с различными фенотипами артериальной гипертензии низкого и умеренного сердечно-сосудистого риска. Кардиоваскулярная терапия и профилактика. 2024;23(10):4133. https://doi.org/10.15829/1728-8800-2024-4133. EDN: MNBJJE
For citation:
Korolev A.I., Ososkov V.S., Fedorovich A.A., Chashchin M.G., Dadaeva V.A., Strelkova A.V., Omelyanenko K.V., Mikhailova M.A., Gorshkov A.Y., Drapkina O.M. Structural and functional state of the skin microcirculation in men with different phenotypes of hypertension of low and moderate cardiovascular risk. Cardiovascular Therapy and Prevention. 2024;23(10):4133. (In Russ.) https://doi.org/10.15829/1728-8800-2024-4133. EDN: MNBJJE
JATS XML

























































