Перейти к:
Успешное лечение электрического шторма у пациента с тяжёлой хронической сердечной недостаточностью: клинический случай
https://doi.org/10.15829/1728-8800-2025-4423
EDN: XPGTKG
Аннотация
Электрический шторм (ЭШ) — это потенциально жизнеугрожающее состояние, частота которого возрастает с увеличением числа пациентов с имплантируемыми кардиовертерами-дефибрилляторами. Одной из частых причин его развития является ишемическая болезнь сердца. Купирование ЭШ — сложная задача, требующая участия мультидисциплинарной команды. В настоящем клиническом случае описано успешное лечение ЭШ у пациента с хронической сердечной недостаточностью ишемического генеза с фракцией выброса левого желудочка 19%, обширными рубцовыми изменениями миокарда и хронической аневризмой верхушки левого желудочка. У пациента развились множественные (до 25/сут.) эпизоды гемодинамически стабильных, симптомных, мономорфных желудочковых тахикардий, ассоциированных с рубцом миокарда.
Ключевые слова
Для цитирования:
Филиппов К.Г., Яковицкая О.К., Крупичка К.С., Абдуллаев А.М. Успешное лечение электрического шторма у пациента с тяжёлой хронической сердечной недостаточностью: клинический случай. Кардиоваскулярная терапия и профилактика. 2025;24(6):4423. https://doi.org/10.15829/1728-8800-2025-4423. EDN: XPGTKG
For citation:
Filippov K.G., Yakovitskaya O.K., Krupichka K.S., Abdullaev A.M. Successful treatment of electrical storm in a patient with severe heart failure: a case report. Cardiovascular Therapy and Prevention. 2025;24(6):4423. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4423. EDN: XPGTKG
Введение
Электрический шторм (ЭШ) — это ≥3 эпизодов устойчивых желудочковых аритмий, происходящих в течение 24 ч с интервалом не <5 мин, для купирования которых требуется вмешательство: функционирование имплантируемого кардиовертера-дефибриллятора (ИКД) или наружная дефибрилляция [1]. Частота данного состояния увеличивается с ростом числа имплантаций ИКД и может достигать 30% случаев среди пациентов, получивших устройство в качестве вторичной профилактики внезапной сердечной смерти [2].
Наличие ЭШ связано со значительно более низкой 5-летней выживаемостью — около 30 vs 99% в группе без ЭШ в анамнезе. При этом установлена достоверная связь между риском смерти и клинико-инструментальными показателями: фракцией выброса (ФВ) левого желудочка (ЛЖ), конечно-диастолическим и конечно-систолическим размерами ЛЖ, степенью митральной недостаточности и количеством шоковых терапий в год [3].
Патофизиологический механизм включает наличие субстрата аритмии (рубцовые поражения миокарда вследствие ишемической болезни сердца, кардиомиопатии, нарушения проводящей системы сердца или каналопатии), провоцирующие факторы (кардиальные и экстракардиальные), а также повышение активности симпатической нервной системы. Именно на эти составляющие направлен диагностический поиск у пациентов с ЭШ.
Ведение ЭШ направлено на подтверждение адекватности работы ИКД, прерывание жизнеугрожающего состояния и его профилактику. Для оценки адекватности работы ИКД используются программаторы, с помощью которых оцениваются: статистика аритмий, адекватность функции, срок службы прибора; настраиваются зоны детекции и терапии (для антитахикардитической стимуляции (ATС) и шоковой терапии), устанавливают более длительное время для обнаружения аритмии в случае ее гемодинамической стабильности и дискриминаторы для исключения немотивированных срабатываний ИКД.
Для прерывания ЭШ используется антиаритмическая терапия, выбор которой основан на субстрате ЭШ: при рубец-зависимых аритмиях, нарушениях инотропной функции препаратом выбора является амиодарон, реже — его сочетание с лидокаином. Для профилактики ЭШ применяются β-адреноблокаторы, амиодарон или их комбинация [4].
В случае рефрактерности ЭШ к медикаментозному лечению и отсутствии обратимых причин рассматривается ускоренное проведение катетерной аблации аритмогенного очага, что в подобных случаях является жизнеспасающим шагом. В ускоренной аблации нуждаются до 40% пациентов с ЭШ, подавление жизнеугрожающих аритмий на ранней стадии позволяет предотвратить ухудшение гемодинамических показателей, прогрессирование сердечной недостаточности и, как следствие, должно способствовать улучшению показателей выживаемости [5].
Клинический случай демонстрирует возможности по ведению пациентов с рефрактерным ЭШ.
Описание клинического случая
Пациент С., 59 лет был переведен в отделение реанимации и интенсивной терапии ФГБУ "НМИЦ ТПМ" Минздрава России с жалобами на приступы учащенного сердцебиения, продолжительностью до 5 мин, сопровождающиеся слабостью и потемнением в глазах, на неоднократные срабатывания ИКД, что ощущалось интенсивными ударами в груди, а также на одышку при небольшой физической нагрузке, купирующуюся в покое (рисунок 1).
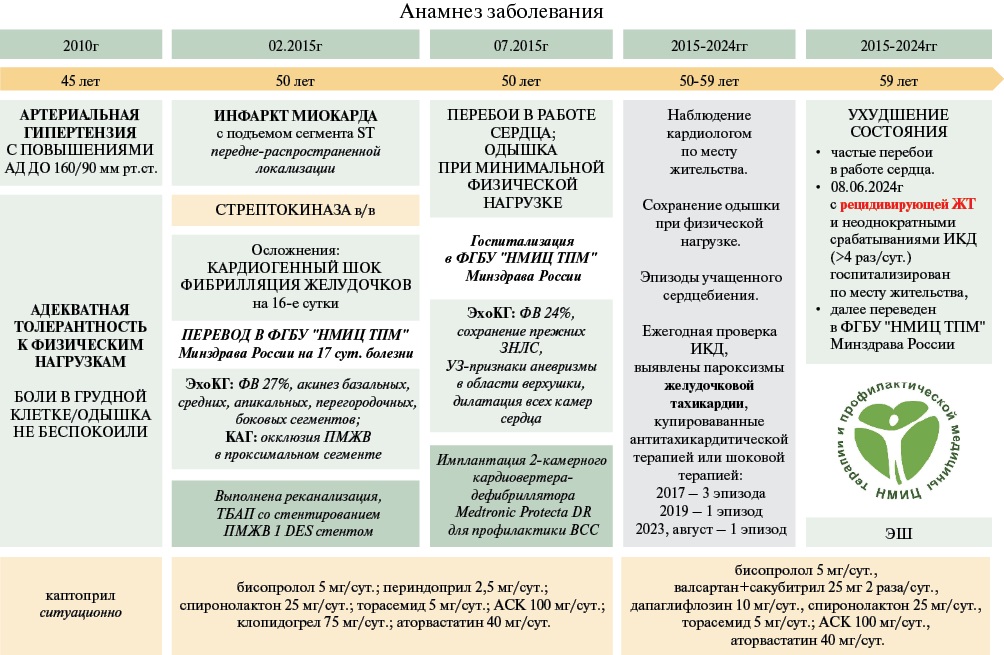
Рис. 1 Временная шкала.
Примечание: АД — артериальное давление АСК — ацетилсалициловая кислота, в/в — внутривенно, ВСС — внезапная сердечная смерть, ЖТ — желудочковая тахикардия, ЗНЛС — зоны нарушения локальной сократимости, ИКД — имплантируемый кардиовертер-дефибриллятор, КАГ — коронароангиография, ТБАП — транслюминальная баллонная ангиопластика, ФВ — фракция выброса, ФН — физическая нагрузка, ЭхоКГ — эхокардиография, DES — стент с лекарственным покрытием.
В анамнезе у пациента перенесённый инфаркт миокарда с подъемом сегмента ST передне-распространенной локализации от 2015г; проведена тромболитическая терапия стрептокиназой, инфаркт миокарда осложнился кардиогенным шоком, после стабилизации гемодинамических параметров, на 16-е сут. — фибрилляция желудочков, проведены успешные реанимационные мероприятия. По эхокардиографии (ЭхоКГ) описывалась сниженная ФВ ЛЖ, акинез базальных, средних, апикальных перегородочных, боковых сегментов. Тогда же пациент в экстренном порядке был переведен в НМИЦ ТПМ, где проведена коронароангиография, выявлена окклюзия в проксимальной трети передней межжелудочковой ветви (ПМЖВ), проведена реканализация с ангиопластикой и стентированием стентом с лекарственным покрытием, был выписан на антиагрегантной терапии, болезнь-модифицирующей терапии. Через полгода пациент был повторно госпитализирован с жалобами на одышку при небольшой физической нагрузке, перебои в работе сердца. По ЭхоКГ сохранялась сниженная ФВ (24%), отмечались прежние зоны нарушений локальной сократимости, а также наличие хронической аневризмы в области верхушки ЛЖ. Пациенту с хронической сердечной недостаточностью (ХСН) со сниженной ФВ ЛЖ III функционального класса по NYHA (New York Heart Association, Нью-Йоркская ассоциация сердца) и с фибрилляцией желудочков в анамнезе в качестве вторичной профилактики внезапной сердечной смерти был имплантирован 2-камерный ИКД. В дальнейшем пациент наблюдался у кардиолога по месту жительства, проводилась регулярная проверка устройства, желудочковые аритмии были зарегистрированы в 2017, 2019, 2023гг, купировались с помощью АТС, антиаритмическая терапия не назначалась.
Ухудшение произошло в июне 2024г, когда пациент отметил частые эпизоды учащенного сердцебиения, сопровождающиеся потемнением в глазах, 8 июня пациент отметил неоднократные срабатывания ИКД (>4 раз/сут.), что ощущалось сильными ударами в грудной клетке, был госпитализирован по месту жительства с дальнейшим переводом в ФГБУ "НМИЦ ТПМ" Минздрава России.
Семейный анамнез пациента не отягощен, вредные привычки: длительное курение, эпизодическое потребление алкоголя. Пациент нормостенического телосложения с индексом массы тела — 29,4 кг/м².
При осмотре: пациент в состоянии тревоги, наблюдается пастозность голеней и стоп, в остальном без особенностей. Температура тела нормальная. При обследовании сердечно-сосудистой системы: смещение левой границы относительной тупости сердца на 1 см от среднеключичной линии, при аускультации тоны сердца глухие, аритмичные (за счет экстрасистол), артериальное давление 100/60 мм рт.ст.
По лабораторным данным значимых отклонений не выявлено, тиреотропный гормон в норме, N-концевой промозговой натрийуретический пептид — 962 пг/мл, электролиты без изменений. Показатели липидного профиля на целевых значениях. Для исключения острой ишемии миокарда, как причины возникновения рецидивирующей желудочковой тахикардии (ЖТ), исследован высокочувствительный тропонин I в динамике, значения не были повышены. На электрокардиограмме (ЭКГ) регистрировался синусовый ритм с частотой сердечных сокращений 54 уд./мин, электрическая ось резко отклонена влево, патологические зубцы Q в I, aVL отведениях, одиночные желудочковая экстрасистолия, наджелудочковая экстрасистолия, QTc — 423 мс. Неоднократно (не <25 раз/сут.) на кардиомониторе и ЭКГ (рисунок 2) регистрировались эпизоды мономорфной ЖТ длительностью до 12 мин, купирующиеся самостоятельно, либо применением АТС ИКД. Эпизоды были гемодинамически стабильными. По ЭхоКГ (рисунок 3): выраженное расширение всех камер сердца, ФВ ЛЖ 19%, межжелудочковая перегородка истончена до 3 мм на всём протяжении, дискинез верхушки ЛЖ, акинез базальных и средних перегородочных сегментов, гипокинез средних переднего, переднебокового и нижнего сегментов, базального сегмента передней стенки, повышение систолического давления в легочной артерии до 60 мм рт.ст.
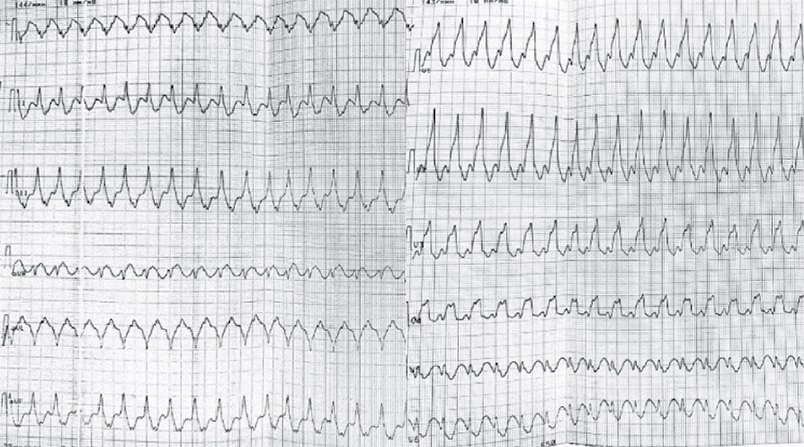
Рис. 2 Эпизод мономорфной желудочковой тахикардии.
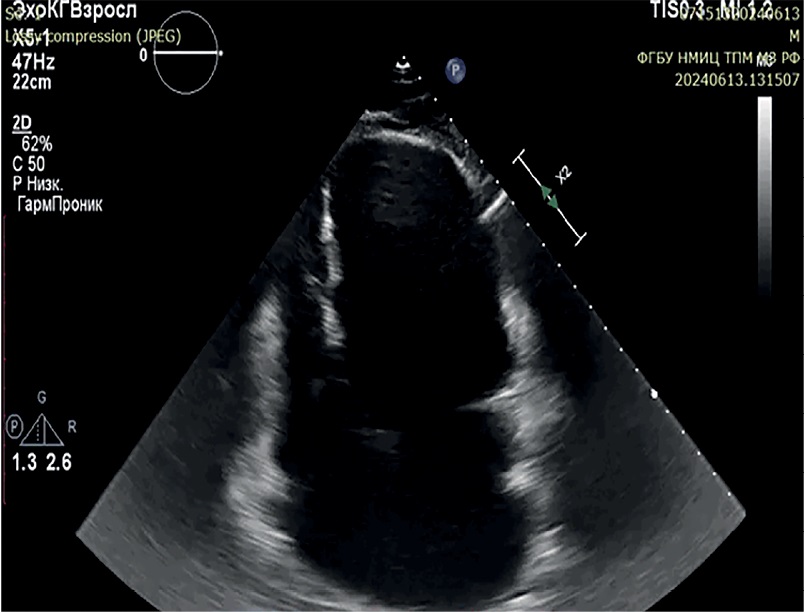
Рис. 3 Эхокардиограмма. 4-камерная апикальная позиция. Дилатация камер сердца, истончение межжелудочковой перегородки, признаки аневризмы верхушки ЛЖ.
С момента поступления пациента проводились последовательные мероприятия по купированию ЭШ: проведена проверка функционирования ИКД, подтвержден ЭШ, функция адекватна, заряд батареи достаточен, было установлено более длительное время для обнаружения ЖТ (некоторые эпизоды купировались самостоятельно и не требовали вмешательства). Проводился поиск и устранялись провоцирующие факторы (исключены: электролитные нарушения, дисфункция щитовидной железы, воспалительные и лихорадочные состояния), для исключения ишемии миокарда проведена коронароангиография, выявлен рестеноз стентированного участка ПМЖВ до 90%, в связи с чем проведена баллонная ангиопластика баллоном с лекарственным покрытием. Проводилась антиаритмическая терапия амиодароном по насыщающей схеме с оценкой безопасности по ЭКГ.
К сожалению, несмотря на проведённые мероприятия, купировать электрическую нестабильность миокарда не удалось, в связи с чем решался вопрос о необходимости проведения ускоренной катетерной аблации аритмогенного очага. Периоперативный риск по развитию острой гемодинамической декомпенсации при проведении катетерной аблации очага аритмии оценивается по шкале "PAINESD", которая включает следующие параметры: заболевания легких (P); возраст >60 лет (A); ишемическую кардиомиопатию (I); III или IV функциональный класс по NYHA (N); ФВ ЛЖ <25% (E); развитие ЭШ (S); сахарный диабет (D), при этом каждому параметру присваивается определенное количество баллов. Пациент был отнесен к группе высокого риска осложнений и смерти при проведении катетерной аблации аритмогенного очага [6]. После коллегиального обсуждения случая мультидисциплинарной командой (состоящей из кардиологов, аритмологов, сердечно-сосудистых хирургов, анестезиологов и реаниматологов), после обсуждения с пациентом рисков фатальных осложнений и получения согласия на операцию было решено провести эндокардиальное электрофизиологическое исследование (ЭФИ) сердца с построением вольтажной карты. Был выявлен обширный участок низкоамплитудной активности (рисунок 4), соответствующий постинфарктному рубцу, аневризме верхушки ЛЖ, выделено 7 каналов со входом возбуждения и регистрацией в месте входа фракционированной активности, проведены радиочастотные воздействия с закрытием данных каналов (De-channeling), при контрольной стимуляции запуска ЖТ не отмечалось. В послеоперационном периоде пароксизмы ЖТ также не регистрировались. ЭШ был купирован. Была продолжена антиаритмическая терапия с целью профилактики ЭШ. Пациент выписан на терапии: амиодарон 200 мг/сут., метопролола сукцинат 50 мг/сут., валсартан+сакубитрил 50 мг 2 раза/сут. с последующей титрацией, дапаглифлозин 10 мг/сут., спиронолактон 50 мг/сут., фуросемид 20 мг/сут., ацетилсалициловая кислота 100 мг/сут., клопидогрел 75 мг/сут. (в течение 6 мес.), аторвастатин 40 мг/сут., рабепразол 20 мг/сут.
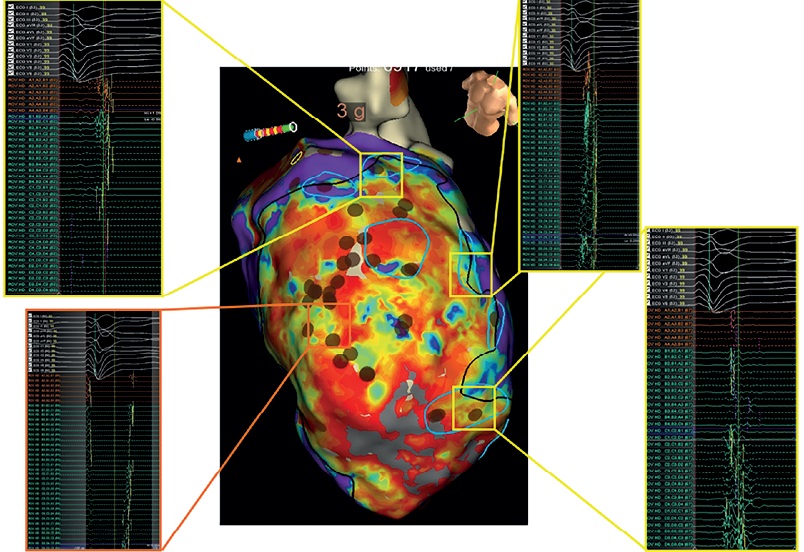
Рис. 4 Электроанатомическая карта ЛЖ.
Примечание: цветное изображение доступно в электронной версии журнала.
Клинический диагноз:
Основное заболевание: Ишемическая болезнь сердца. Постинфарктный кардиосклероз (передне-распространенный инфаркт миокарда от 21.02.2015). Системный тромболизис стрептокиназой 21.02.2015. Операция баллонная ангиопластика со стентированием ПМЖВ 19.03.2015. Рестеноз стента. Операция баллонной ангиопластики рестеноза стента ПМЖВ 14.06.2024.
Фоновые заболевания: Атеросклероз аорты, коронарных артерий. Гиперлипидемия 2А типа. Гипертоническая болезнь III стадии, достигнуты целевые уровни артериального давления, риск сердечно-сосудистых осложнений 4.
Осложнения основного заболевания: Хроническая аневризма верхушки ЛЖ. ХСН со сниженной ФВ ЛЖ (19%) IIA стадии, III функциональный класс по NYHA. Легочная гипертензия. Нарушения ритма сердца: пароксизмальная ЖТ. Операция первичной имплантации 2-амерного ИКД Medtronic Protecta DR, 07.2015г. ЭШ. Операция эндокардиального ЭФИ и радиочастотная аблация эктопического очага 19.06.2024г.
Сопутствующие заболевания: хронический бронхит вне обострения, хронический гастродуоденит.
Исход
После выписки пациент отмечает значительное улучшение самочувствия, эпизоды нарушений ритма не регистрировались. Учитывая сохранение выраженной систолической дисфункции, III функциональный класс по NYHA на фоне оптимальной терапии, а также перенесённый эпизод ЭШ, пациент был консультирован кардиологом-трансплантологом НМИЦ ТИО им. Шумакова и включён в лист ожидания трансплантации сердца.
Обсуждение
Представленный клинический случай подчёркивает важность раннего и последовательного ведения пациентов с ЭШ. У пациентов с рефрактерным течением, несмотря на оптимальную медикаментозную терапию, эндокардиальное ЭФИ и аблация аритмогенного очага позволяют достигнуть контроля ритма и рассматривать трансплантацию как этап дальнейшего ведения при терминальной ХСН.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Лебедев Д. С., Михайлов Е. Н., Неминущий Н. М. и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4600. doi:10.15829/1560-4071-2021-4600.
2. Exner DV, Pinski SL, Wyse DG, et al. Electrical storm presages non-sudden death: the antiarrhythmics versus implantable defibrillators (AVID) trial. Circulation. 2001;103(16):2066-71. doi:10.1161/01.cir.103.16.2066.
3. Осадчий А. М., Лебедева В. К., Курникова Е. А. и др. Электрический шторм: клинические предикторы и факторы риска у пациентов с имплантированными кардиовертерами-дефибрилляторами. Вестник аритмологии. 2014;78:31-5.
4. Lenarczyk R, Priori SG, Camm AJ, et al. Management of patients with an electrical storm or clustered ventricular arrhythmias: a clinical consensus statement of the EHRA, HRS, APHRS and LAHRS. Europace. 2024;26(4):1-36. doi:10.1093/europace/euae049.
5. Татарский Р. Б., Михайлов Е. Н., Лебедева В. К. и др. Экстренная катетерная аблация электрического шторма у больных с имплантированными кардиовертерами-дефибрилляторами. Российский кардиологический журнал. 2015;(11):57-62. doi:10.15829/1560-4071-2015-11-57-62.
6. Muser D, Liang JJ, Hayashi T, et al. Identifying risk and management of acute haemodynamic decompensation during catheter ablation of ventricular tachycardia. Arrhythm Electrophysiol Rev. 2018;7(4):282-7. doi:10.15420/aer.2018.36.3.
Об авторах
К. Г. ФилипповРоссия
Константин Георгиевич Филиппов — ординатор.
Москва
О. К. Яковицкая
Россия
Ольга Климентовна Яковицкая — к.м.н., врач анестезиолог-реаниматолог, зав. отделением реанимации и интенсивной терапии, ассистент кафедры кардиологии с курсом аритмологии и интервенционных методов диагностики и лечения.
Москва
К. С. Крупичка
Россия
Кристина Сергеевна Крупичка — врач-кардиолог, зав. отделением неотложной кардиологии.
Москва
А. М. Абдуллаев
Россия
Аслан Мурадович Абдуллаев — врач кардиолог-аритмолог.
Москва
Дополнительные файлы
- Лечение электрического шторма направлено на устранение патофизиологических механизмов его развития.
- Основные этапы включают диагностику, купирование и профилактику повторных эпизодов электрического шторма, а также решение ключевых задач у пациентов с терминальной стадией хронической сердечной недостаточности.
Рецензия
Для цитирования:
Филиппов К.Г., Яковицкая О.К., Крупичка К.С., Абдуллаев А.М. Успешное лечение электрического шторма у пациента с тяжёлой хронической сердечной недостаточностью: клинический случай. Кардиоваскулярная терапия и профилактика. 2025;24(6):4423. https://doi.org/10.15829/1728-8800-2025-4423. EDN: XPGTKG
For citation:
Filippov K.G., Yakovitskaya O.K., Krupichka K.S., Abdullaev A.M. Successful treatment of electrical storm in a patient with severe heart failure: a case report. Cardiovascular Therapy and Prevention. 2025;24(6):4423. (In Russ.) https://doi.org/10.15829/1728-8800-2025-4423. EDN: XPGTKG
JATS XML

























































