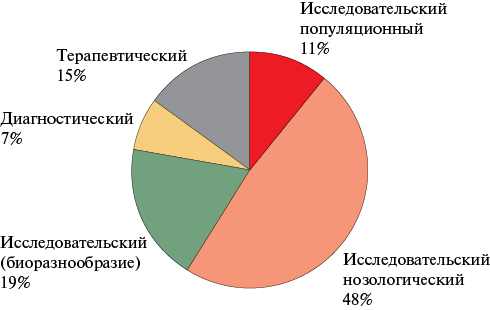
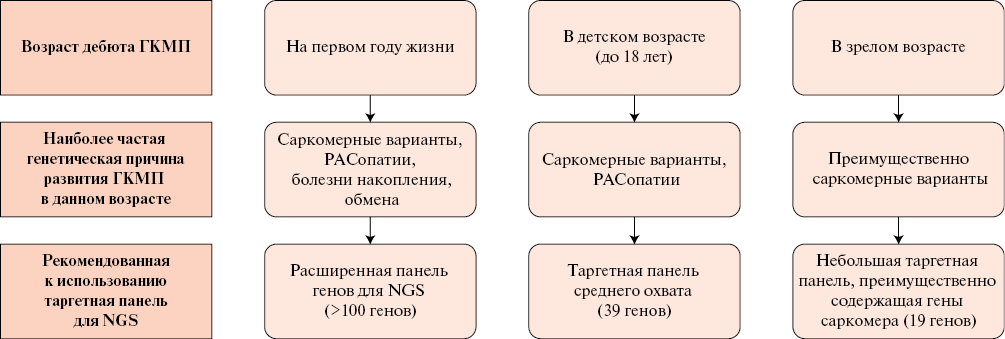
ПЕРЕДОВАЯ СТАТЬЯ
Что известно о предмете исследования?
- Комплексный подход к управлению и стандартизация являются эффективными инструментами поддержания стабильной работы биобанка и обеспечения качества биоматериала.
- Международными и российскими экспертами создана нормативная база, позволяющая стандартизировать и гармонизировать деятельность биобанков и повысить качество биоматериала для научных исследований и биомедицинских разработок.
Что добавляют результаты исследования?
- Впервые в России проведено исследование, направленное на изучение степени внедрения международных стандартов биобанкирования в деятельность российских биобанков. Представлены результаты опроса, включающие данные о стандартизации операционной деятельности, внедрении процедур контроля качества образцов и управления рисками. Проведена оценка степени заинтересованности специалистов и готовности российских биобанков к сертификации по стандартам ISO 9001 и ISO 20387.
Цель. Проведение оценки степени внедрения международных стандартов биобанкирования в деятельность российских биобанков — членов НАСБИО (Национальной ассоциации биобанков и специалистов по биобанкированию), а также готовности и заинтересованности специалистов в сертификации и аккредитации российских биобанков.
Материал и методы. Для оценки уровня стандартизации деятельности российских биобанков в июне 2025г была разработана анкета, включающая четыре блока вопросов, посвященных стандартизации процесса биобанкирования, внедрению систем менеджмента качества и перспективам сертификации. Анкетирование проводилось с июля по август 2025г среди представителей российских биобанков — членов НАСБИО. Для анализа результатов анкетирования применялись методы описательной статистики.
Результаты. В анкетировании приняли участие представители 20 организаций. Все участники опроса письменно подтвердили свое согласие на обработку персональных данных. Большинство участников опроса представляло биобанки, созданные на базе государственных научно-медицинских учреждений. Результаты опроса показали, что в российских биобанках применяются и активно внедряются обязательные процедуры управления качеством. При этом лишь четыре биобанка сертифицированы по стандарту Международной организации по стандартизации (ISO — International organization of standardization) 9001. Отмечена высокая заинтересованность специалистов в получении сертификатов соответствия ISO 20387.
Заключение. Результаты опроса показали, что российские специалисты в области биобанкирования в целом демонстрируют приверженность качеству и заинтересованность в стандартизации деятельности биобанков. Отсутствие в России четкого юридического поля в отношении исследовательских биобанков образцов человека и аккредитованных органов по проведению сертификации биобанков по стандарту ISO 20387 остаются ограничивающими факторами для обмена коллекциями и их совместного использования в научных исследованиях и разработках.
ОРИГИНАЛЬНЫЕ СТАТЬИ
Что известно о предмете исследования?
- Гестационный сахарный диабет (ГСД) ассоциирован с метаболическими, иммунными и гемореологическими нарушениями, влияющими на рост и развитие плода.
- Стандартные методы диагностики ГСД, такие как глюкозотолерантный тест, не всегда позволяют предсказать негативные перинатальные исходы, включая макросомию.
Что добавляют результаты исследования?
- Найдены выраженные изменения метаболома в крови матери, пуповинной крови и амниотической жидкости при беременности, осложненной ГСД, — снижение концентрации аминокислот, важных для регуляции обменных процессов и воспалительных реакций — триптофана и γ-аминомасляной кислоты, для белкового синтеза — лизина и метионина и накопление аминокислот с разветвленной цепью, усиливающих инсулинорезистентность.
- Биобанкирование материала с первого триместра до родов позволит оценить возможность использования данных метаболитов в качестве ранних маркеров макросомии и диабетической фетопатии.
Цель. Поиск новых маркеров с применением омиксных технологий для использования в качестве предикторов аномалий роста и развития плода при гестационном сахарном диабете (ГСД).
Материал и методы. Долгосрочной целью работы является создание уникальной биологической коллекции образцов, на базе которой можно оценивать риск развития диабетической фетопатии (ДФ) и других негативных перинатальных исходов, выявляя ранние доклинические маркеры. Для реализации данной цели на первом этапе были запланированы следующие исследования: формирование референсной коллекции биоматериала от женщин с известным перинатальным исходом и ее последующий комплексный анализ для идентификации ключевых маркеров. Проведение комплексных экспериментов с использованием генетического, иммунологического и масс-спектрометрического подходов позволяет всесторонне оценить молекулярные механизмы патогенеза ГСД и выявить взаимодополняющие биомаркеры. C целью выполнения исследований была сформирована коллекция образцов плазмы крови беременных в первом триместре, рожениц, амниотической жидкости, плазмы крови пуповинного остатка. Полученные образцы биоматериала замораживали и хранили при температуре не >-80 оС. Из коллекции в настоящее исследование была включена выборка из 100 рожениц в возрасте 18-45 лет, в сроке беременности 34 нед. 1 день — 41 нед. 6 дней из групп с ГСД и без него. Проведен иммуноферментный анализ образцов на ряд регуляторных протеинов, эмбриотропных антител, молекулярно-генетический анализ полиморфизма генов гемостаза, масс-спектрометрический анализ аминокислот.
Результаты. В результате сравнительного анализа выявлено, что беременные с ГСД чаще имели полиморфизм гена фибриногена FGB 455 G/A (р=0,008), профиль аутоиммунных антител был изменен соответственно супрафизиологическому апоптозу и инсулинорезистентности. При отсутствии макросомии плода в плазме матери с ГСД выявлен более низкий уровень тканевого активатора плазминогена (р=0,001). Основными находками масс-спектрометрического анализа аминокислот в крови рожениц с ГСД были более низкие концентрации триптофана (р=0,025) и γ-аминомасляной кислоты p=0,023). В амниотической жидкости и пуповинной крови при ГСД выявлены сниженные концентрации аминокислот, ответственных за синтез белка — лизина и метионина, и повышение концентрации аминокислот, ассоциированных с макросомией.
Заключение. Результаты исследования подтверждают наличие метаболических, иммунных и гемореологических нарушений при ГСД у матери, ассоциированных с нарушением аминокислотного состава пуповинной крови и амниотической жидкости при макросомии новорожденного. Выявленные различия метаболома можно рассматривать как потенциальные маркеры для выявления риска негативных перинатальных исходов.
Цель. Продемонстрировать пути создания и перспективы применения биомедицинских ресурсных коллекций биоматериала пациентов детского возраста, а также возможности их дифференцированного использования в клинических и научных целях в условиях многопрофильного стационара на базе научно-исследовательского центра федерального уровня.
Материал и методы. В работу был включен биоматериал пациентов детского возраста, а также их родственников первой линии родства, забанкированный в период с 2016 по 2025гг в рамках реализации научных проектов НМИЦ им. В. А. Алмазова Минздрава России в области клинической генетики и педиатрии. Выделенная из образцов цельной крови и сухих пятен крови дезоксирибонуклеиновая кислота (ДНК) использовалась для генетического тестирования с применением современных методов молекулярно-генетической диагностики.
Результаты. Возможности применения биоресурсных коллекций биоматериала пациентов детского возраста продемонстрированы на примере семейных случаев редких моногенных заболеваний, для которых ранее собранный биоматериал биобанка был использован для постановки диагноза и определения тактики дальнейшего наблюдения членов семьи, определения рисков для будущего потомства, углубления знаний по ведению пациентов с конкретным наследственным синдромом. В дополнение — возможность предполагать наличие новых фенотипов, ассоциированных с известным геном, и наоборот, раскрывать связь новых генов с известным фенотипом продемонстрирована на примерах семейных заболеваний, где биоматериал биобанка обеспечил возможность проведения сегрегационного анализа. На примере биоматериала когорт пациентов с определенной патологией проиллюстрирована возможность создания новых диагностических алгоритмов и лабораторных тест-систем, дифференцированного подхода к выбору таргетной генетической панели для диагностики, а также выявления новых клинико-генетических особенностей заболевания. Показана возможность определения мутации основателя на примере патологии, выявленной в конкретной этнической группе с потенциальной возможностью описания времени ее возникновения и особенностей географического распространения.
Заключение. Создание биоресурсных коллекций, полученных от детского контингента, является сложной, но крайне важной, клинически необходимой и перспективной научной задачей. Ее реализация способствует проведению трансляционных научно-исследовательских работ как для усовершенствования методов диагностики, понимания патогенеза, особенностей течения заболеваний детского возраста, влияния факторов окружающей среды на их формирование, поиска новых генетических причин развития наследственной патологии и описания новых фенотипов, ассоциированных с известными генами, выявления предикторов тяжести течения и прогноза, так и в долгосрочной перспективе — для поиска новых терапевтических подходов и понимания механизмов развития заболеваний у взрослых.
Что известно о предмете исследования?
- Биоресурсные коллекции в сочетании с клиническими, демографическими, лабораторными и инструментальными данными являются эффективным инструментом для изучения факторов риска и выявления особенностей патофизиологических механизмов прогрессирования и развития неблагоприятных исходов сердечно-сосудистых заболеваний.
- Пациенты в возрасте >80 лет представляют группу высокого риска развития осложнений после острого коронарного синдрома (ОКС). Выявление пожилых пациентов с секреторным фенотипом, ассоциированным с неблагоприятными сердечно-сосудистыми событиями после ОКС, является актуальным.
Что добавляют результаты исследования?
- С использованием биоресурсной коллекции исследована экспрессия цитокинов, хемокинов и факторов роста у пациентов с ОКС в возрасте >80 лет и установлена их взаимосвязь с развитием неблагоприятных исходов.
- Полученные результаты позволяют выделить приоритетные группы пациентов, различающихся по уровню биомаркеров в постинфарктном периоде, и в дальнейшем разработать подходы, направленные на снижение риска осложнений и неблагоприятных исходов у пожилых пациентов с ОКС.
Цель. С использованием биоресурсной коллекции исследовать экспрессию цитокинов, хемокинов и факторов роста у пациентов с инфарктом миокарда (ИМ) >80 лет и установить их взаимосвязь с развитием неблагоприятных исходов.
Материал и методы. В ретроспективное исследование включены 59 пациентов >80 лет с острым коронарным синдромом (ОКС). Анализировались клинико-демографические данные, лабораторные показатели, динамика биомаркеров при поступлении в стационар и 7 сут. Оценивались 30-дневные исходы. В зависимости от исходов пациенты были разделены на группы: группа 1 (n=11) – пациенты, умершие в течение 30 дней после ОКС, группа 2 (n=48) – остальные пациенты.
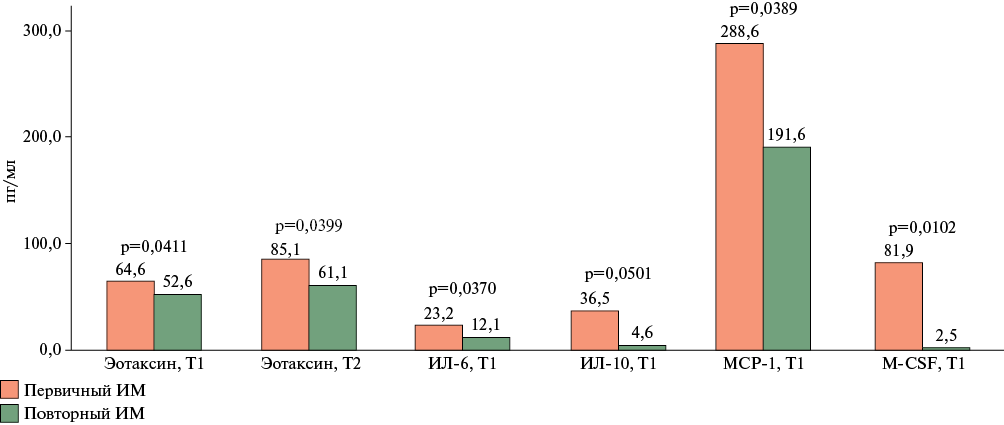
Результаты. Динамическое наблюдение в общей группе показало значимое снижение сывороточных уровней интерлейкинов (ИЛ)-6, ИЛ-8, гранулоцитарного колониестимулирующего фактора на 7 сут. после ОКС, а содержание эотаксина, напротив, увеличивалось. Выявлены ассоциации провоспалительных цитокинов с показателями клинических шкал стратификации риска. В группе с летальным исходом отмечены более высокие уровни ИЛ-10, ИЛ-15, фактора некроза опухоли альфа, моноцитарного хемотаксического белка 1, гранулоцитарного колониестимулирующего фактора, макрофагального колониестимулирующего фактора и N-концевого промозгового натрийуретического пептида на 7 сут. ОКС. Сочетание N-концевого промозгового натрийуретического пептида >1000 пг/мл и ИЛ-15 >25 пг/мл на 7 сут. обладает наибольшей прогностической ценностью для оценки прогноза смерти пациентов в течение 30 сут. после ОКС с чувствительностью 83,3% и специфичностью 90,6% (площадь под ROC-кривой=0,87).
Заключение. С использованием биоресурсной коллекции и мультиплексной технологии исследована экспрессия цитокинов, хемокинов и факторов роста у пациентов с ИМ >80 лет. Разработана модель, позволяющая прогнозировать развитие неблагоприятных событий у лиц с ИМ.
Ключевые слова: острый коронарный синдром, инфаркт миокарда, пожилые пациенты, старческий возраст, цитокины, хемокины, факторы роста, биоресурсная коллекция.
Что известно о предмете исследования?
- Доказана связь ДНК-маркеров с тяжестью заболевания COVID-19 (COrona VIrus Disease 2019). Их частоты различны у народов мира: смертность от COVID-19 может отличаться в два раза из-за разной частоты ДНК-маркеров.
Что добавляют результаты исследования?
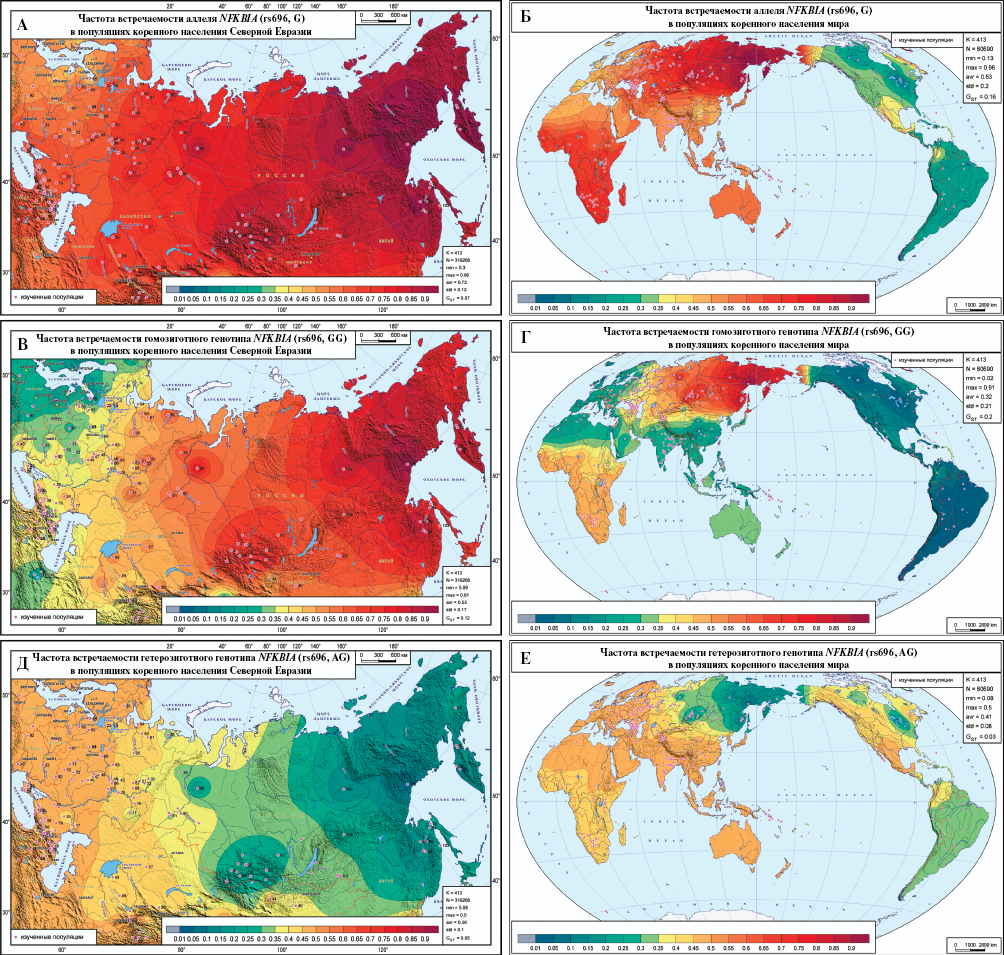
- Геногеографические карты указывают регионы России и мира, для которых ДНК-маркеры генов NFKBIA, TLR3 и TMPRSS2 являются рисковыми при тяжелом течении COVID-19. Коренное народонаселение Северной Евразии отличается наибольшим генетическим разнообразием среди всех регионов мира. При этом оно гармонично вписано в Евразийский генофонд, а Дальний Восток России является переходной зоной к генофонду коренного населения Северной Америки.
Цель. Изучить геногеографию SNP-маркеров, связанных с тяжелым течением COVID-19 (COrona VIrus Disease 2019), и выявить закономерности их распределения в коренном народонаселении России и мира. Частота генетических полиморфизмов, ассоциированных с осложнениями при COVID-19, неодинакова в разных этнических группах.
Материал и методы. На основе коллекций Биобанка ФГБУ "НМИЦ ТПМ" Минздрава России и Биобанка Северной Евразии определены частоты аллелей и генотипов генов NFKBIA, TLR3, TMPRSS2, ассоциированных с осложнениями при COVID-19. В анализ включены собственные данные (4207 образцов 186 популяций 97 этносов из России и сопредельных стран) и данные из публикаций (3070 образцов из 227 популяций мира). Данные изучены биоинформатическими, статистическими и картографическими методами.
Результаты. Выявлена высокая частота "рисковой" гомозиготы GG маркера NFKBIA (rs696) в популяциях России (0,55) с трендом ее роста с запада на восток в максимально широком диапазоне: от 0,08 у ижоры на северо-западе до 0,92 у эвенов Дальнего Востока. Для населения России характерны высокие значения частот альтернативных гомозигот полиморфизмов TLR3 (rs3775291) и TMPRSS2 (rs2070788), не связанных с риском осложнений при COVID-19. Коренное народонаселение Северной Евразии отличается наибольшим генетическим разнообразием среди всех регионов мира. При этом оно гармонично вписано в генофонд Евразийского континента, а Дальний Восток России является переходной зоной к генофонду коренного населения Северной Америки.
Заключение. Исследование геногеографической изменчивости позволяет выявить регионы России и мира, для которых анализируемые ДНК-маркеры в наибольшей степени являются рисковыми при тяжелом течении COVID-19.
Что известно о предмете исследования?
- Генетические вариации в генах врождённого иммунитета, включая TLR-рецепторы, а также в генах, регулирующих интерфероновый ответ и воспаление, могут определять тяжесть COVID-19 (COrona VIrus Disease 2019). Полиморфизмы могут влиять на чувствительность рецепторов к вирусной рибонуклеиновой кислоте, активацию NF-κB и синтез цитокинов. Популяционные различия в частотах аллелей ограничивают возможность трансляции зарубежных данных на российскую выборку.
Что добавляют результаты исследования?
- Генотип AA TLR7 ассоциирован с более тяжёлым течением COVID-19, что согласуется с его ролью в распознавании вирусной рибонуклеиновой кислоты. Обнаружены генотип-генотип взаимодействия, вероятно связанные с модуляцией NF-κB-зависимых путей при сочетаниях вариантов генов TERT с TLR7 и TLR3. Данные подчёркивают важность локальных биобанков для уточнения молекулярно-генетических детерминант тяжёлого течения инфекции.
Цель. Анализ частоты встречаемости четырех полиморфизмов генов MUC5B rs35705950, TERT rs2736100, TLR3 rs3775290 и TLR7 rs179008 в популяции, а также их возможную ассоциацию с тяжестью течения и исходом заболевания COVID-19 (COrona VIrus Disease 2019, коронавирусная инфекция 2019г).
Материал и методы. В исследовании использовались образцы крови 4783 пациентов с диагнозом COVID-19 из биобанка СПб ГБУЗ "Городская больница № 40". Все пациенты подписали информированное добровольное согласие на участие в исследовании. Генотипирование проведено методом полимеразной цепной реакции в режиме реального времени, статистический анализ включал точный критерий Фишера и множественную регрессию.
Результаты. Частоты полиморфизмов сопоставимы с базой gnomAD (Genome Aggregation Database). Среди всех полиморфизмов только генотип AA гена TLR7 показал статистически значимую ассоциацию с тяжелым течением COVID-19. Дополнительно выявлены два потенциально значимых взаимодействия генотипов: TERT AA + TLR7 T у мужчин и TERT CC + TLR3 CT у женщин.
Заключение. Результаты подчеркивают ценность локальных биобанков для изучения популяционных особенностей распределения аллелей и выявления генетических факторов, влияющих на течение инфекционных заболеваний.
Что известно о предмете исследования?
- Использование материалов банка сывороток крови позволяет проводить широкомасштабные научные исследования в области эпидемиологии инфекционных болезней, в т.ч. изучение популяционного иммунитета.
Что добавляют результаты исследования?
- Установлено, что хранение образцов сывороток крови в течение 6 лет при температуре -70 оС оказало незначительное влияние на уровень иммуноглобулинов IgG, тогда как хранение при температуре -20 оС в течение 6 мес. в значительной степени исказило результаты исследования, привело к появлению ложноположительных образцов и 2-кратному увеличению среднего уровня антител в выборке.
- Показано, что чем выше был уровень антител в образцах при первичном исследовании, тем более он снизился при повторном исследовании, что, однако, не изменило интерпретацию результатов исследования.
Цель. Изучить влияние температурных режимов хранения (-20 и -70 оC) и длительности экспозиции (6 мес. и 6 лет) на сохранность и стабильность специфических антител класса IgG к HBs-антигену вируса гепатита В (анти-HBs IgG) в образцах сывороток крови, хранящихся в биобанке.
Материал и методы. Проведено экспериментальное исследование 180 образцов сыворотки крови. Уровень анти-HBs IgG определяли методом иммуноферментного анализа (ИФА) с использованием тест-систем ЗАО "Вектор-Бест" (Россия) в нативных образцах и после хранения в соответствии с двумя сценариями: 1) хранение при -20 и -70 оС в течение 6 мес.; 2) хранение при -70 оС в течение 6 мес. и 6 лет. Статистический анализ проводили с использованием непараметрических методов (критерий Уилкоксона, медиана, интерквартильный размах, коэффициент корреляции Спирмена).
Результаты. В исследовании по первому сценарию установлено, что хранение при -20 оС в течение 6 мес. привело к почти 2-кратному увеличению медианного уровня анти-HBs IgG (с 35,5 (7,8-76,8) до 65,3 (26,0-105,0) МЕ/мл) и появлению 9 ложноположительных результатов. В исследовании по второму сценарию хранение при -70 оС в течение 6 мес. сопровождалось незначительным снижением уровня антител (с 72,5 (27,9-132,0) до 49,3 (4,0-98,4) МЕ/мл) без ложных результатов, а после 6 лет хранения при -70 оС отмечено дальнейшее их снижение до 33,3 (6,15-88,4) МЕ/мл, 2 образца стали ложноотрицательными. Выявлена сильная корреляция между уровнем антител в нативных образцах и после хранения (p=0,97-0,99; p<0,05).
Заключение. Долгосрочное (до 6 лет) хранение образцов сыворотки крови при температуре -70 оС является надежным и не вносит критических искажений в результаты популяционных серологических исследований распространенности анти-HBs IgG. Хранение при -20 оС допустимо лишь краткосрочно, т.к. уже через 6 мес. приводит к появлению ложноположительных результатов и завышению среднего уровня антител, что делает его непригодным для биобанкирования.
Что известно о предмете исследования?
- Протокол последовательной ферментативной обработки семенников крысы позволяет выделить фракции основных клеток семенника: клетки Лейдига, мезенхимные стромальные клетки, перитубулярные миоидные клетки, клетки Сертоли и сперматогониальные стволовые клетки, специфичные по классическим маркерам.
Что добавляют результаты исследования?
- Использование клеток Лейдига без пассирования позволяет сохранить фенотип и функциональную активность максимально сходными с in vivo.
- При заморозке клетки Лейдига сохраняют морфологию, жизнеспособность, уровень секреции тестостерона, а также способность отвечать на регенераторные стимулы.
Цель. Создание охарактеризованных по фенотипам и функциональной активности коллекций клеток семенников крыс для определения оптимальных условий их использования в моделях оценки специфической активности лекарственных препаратов, направленных на восстановление сперматогенеза.
Материал и методы. Для выделения разных типов клеток из семенников крысы использовали последовательную ферментативную обработку тканей семенников. Иммуноцитохимический анализ выделенных культур клеток проводили на канонические и неканонические маркеры. Измерение уровня секреции тестостерона клетками Лейдига на 2, 4 и 7 день культивирования осуществляли методом иммуноферментного анализа. Разработанная модель для оценки биологической активности лекарственных препаратов на клетках Лейдига была валидирована в соответствии с требованиями Решения Коллегии ЕЭК от 17 июля 2018г № 113.
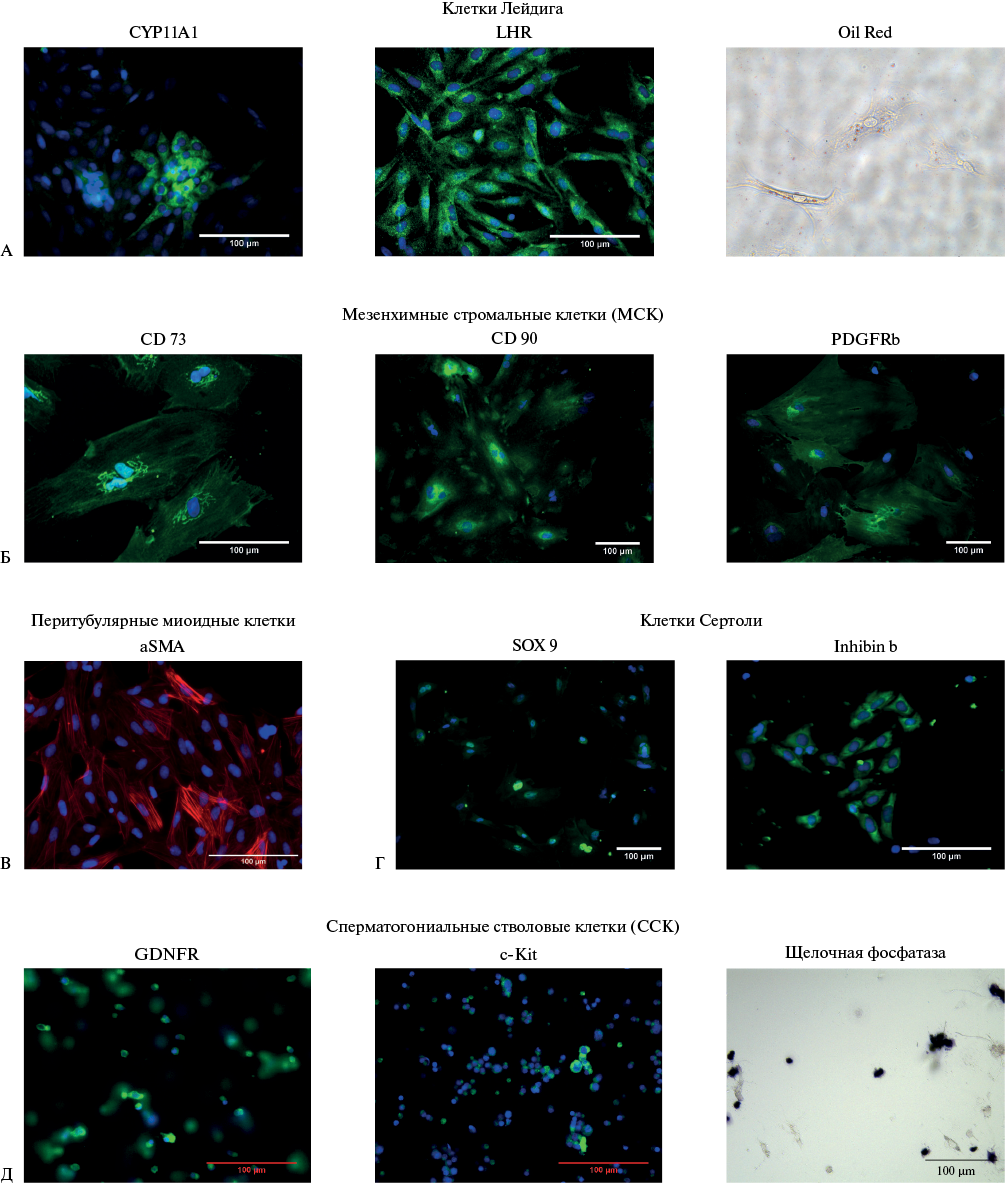
Результаты. Были получены из семенников крыс и охарактеризованы следующие культуры клеток: клетки Лейдига, экспрессирующие специфические маркеры CYP11A1 и LHR, резидентные мезенхимные стромальные/стволовые клетки, экспрессирующие маркеры CD73, CD90 и PDGFRb, клетки Сертоли, экспрессирующие маркеры inhibin beta B и Sox9, сперматогониальные стволовые клетки, экспрессирующие маркеры GDNFR, c-kit и щелочную фосфатазу, перитубулярные миоидные клетки, экспрессирующие αSMA. Было показано, что клетки Лейдига при выделении в культуру начинали экспрессировать винкулин, а при длительном культивировании и пассировании приобретали маркеры Sox9 и виментин. Также было установлено, что клетки Лейдига в культурe в течение недели резко снижают способность секретировать тестостерон. С учетом этих данных была оптимизирована и валидирована разработанная нами ранее in vitro модель оценки специфической активности лекарственных препаратов для восстановления сперматогенеза.
Заключение. Использованные подходы позволяют сформировать охарактеризованные коллекции клеток разного типа, выделенных из семенников лабораторных животных. Однако при выделении из ткани за счёт потери специфического микроокружения со временем культивирования могут измениться фенотипические и функциональные свойства клеток, что стоит учитывать при создании и дальнейшем использовании клеточных коллекций. Было проведено исследование фенотипа клеток семенников, а также секреторной активности клеток Лейдига. На основании этого разработан метод оценки специфической активности in vitro и оптимальная стратегия биобанкирования.
Что известно о предмете исследования?
- Нейроонкологические биобанки необходимы для развития персонализированной медицины.
- Циркулирующие микроРНК (малые некодирующие молекулы рибонуклеиновой кислоты) являются перспективными неинвазивными маркерами первичных опухолей головного мозга.
Что добавляют результаты исследования?
- Используя материал биобанка образцов плазмы крови пациентов с опухолями головного мозга, провели отбор и валидацию биологических маркеров опухолевого процесса (циркулирующие микроРНК).
- Уровень экспрессии miR-128-3p, miR-194-5p, miR-19b-3p, miR-363-3p достоверно дифференцировал исследуемые и контрольную группы.
Цель. Оценить уровень циркулирующих микроРНК (малых некодирующих молекул рибонуклеиновой кислоты), выявленных ранее как дифференциально экспрессирующиеся в NGS (Next Generation Sequencing)-профилях различных типов опухолей головного мозга, с использованием валидационной когорты, сформированной на базе низкотемпературного банка биологических образцов.
Материал и методы. Биоархивирование плазмы крови проводили от пациентов, получавших лечение по поводу опухолей головного мозга на базе ФГБУ "НМИЦ онкологии" Минздрава России в период с апреля 2018г по декабрь 2024г. Методом полимеразной цепной реакции с предварительной обратной транскрипцией (ОТ-ПЦР) был определен уровень 10 микроРНК в образцах плазмы 40 человек. Лица, вошедшие в исследование, были разделены на 5 групп по 8 человек: с диагнозом глиобластома, астроцитома, олигодендроглиома, доброкачественная менингиома, а также условно-здоровые доноры. В исследуемых группах пациентов было 17 женщин и 15 мужчин, медиана возраста составила 52,5 лет. В контрольной группе: 7 женщин и 1 мужчина, медиана возраста — 53 года.
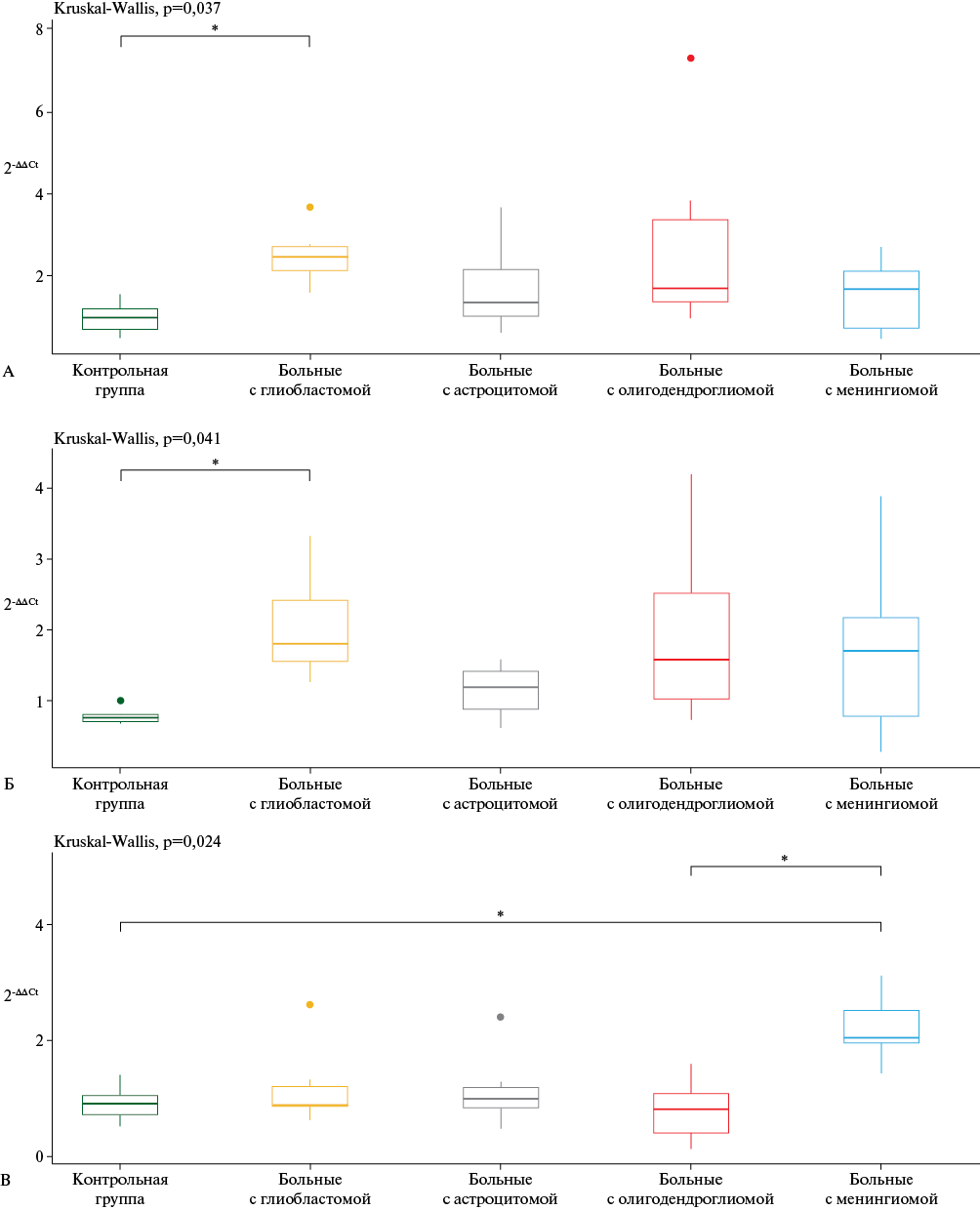
Результаты. В плазме крови были определены уровни miR-30c-5p, miR-128-3p, miR-186-5p, miR-194-5p, miR-484, miR-19b-3p, miR-431-5p, miR-3168, let-7c-5p, miR-363-3p, отобранных по данным NGS-исследования 58 образцов плазмы крови (Гвалдин, 2024). В итоге, на валидационной когорте было выявлено разнонаправленное изменение экспрессии четырех микроРНК (miR-128-3p, miR-194-5p, miR-19b-3p, miR-363-3p), обнаруженное в исследуемых группах.
Заключение. Дифференциальная экспрессия циркулирующих miR-128-3p, miR-194-5p, miR-19b-3p, miR-363-3p ассоциирована с онкогенезом опухолей головного мозга и может быть использована для их диагностики.
Что известно о предмете исследования?
- Секвенирование следующего поколения обеспечивает высокую чувствительность и специфичность, а также возможность количественного определения и обнаружения новых малых некодирующих молекул рибонуклеиновой кислоты (микроРНК).
- Приготовление библиотек для секвенирования микроРНК может значительно влиять на получаемые результаты, в т.ч. на покрытие и спектр детектируемых микроРНК.
Что добавляют результаты исследования?
- При использовании в исследовании биообразцов с низким содержанием микроРНК оптимизация протокола приготовления библиотек для секвенирования может значительно улучшить получаемые результаты.
Цель. Оптимизировать протокол приготовления библиотек для секвенирования микроРНК (малые некодирующие молекулы рибонуклеиновой кислоты) на основе коммерческого набора QIAseq miRNA UDI Library Kit для повышения качества получаемых данных.
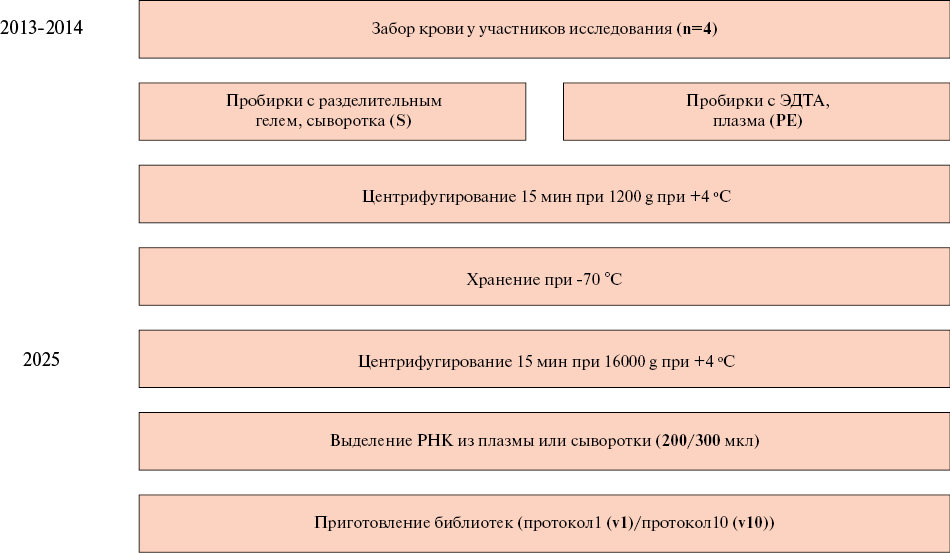
Материал и методы. Образцы плазмы и сыворотки крови четырех участников исследования были отобраны из коллекции биобанка ФГБУ "НМИЦ ТПМ" Минздрава России. Выделение рибонуклеиновой кислоты (РНК) проводилось для каждого образца параллельно из 200 и 300 мкл. Из каждого образца РНК с помощью набора QIAseq miRNA UDI Library Kit были приготовлены две библиотеки для секвенирования по двум вариантам протокола производителя: для 1 нг РНК с уменьшенным числом циклов амплификации и для 10 нг РНК. Секвенирование проводилось на NextSeq 550.
Результаты. При сравнении групп образцов, приготовленных с использованием разных версий протокола, статистически значимо различались показатели тегов на млн прочтений (TPM, tags per million reads) на образец по генам человека (версия ENCODE v47) и по генам микроРНК (p<0,001).
Заключение. Показано, что при использовании биообразцов плазмы и сыворотки крови основным параметром, влияющим на более высокие показатели секвенирования микроРНК, является уменьшение количества циклов полимеразной цепной реакции при приготовлении библиотек.
Что известно о предмете исследования?
- Качество выделения дезоксирибонуклеиновой и рибонуклеиновой кислот критически зависит от метода и типа биоматериала. После смерти животного нуклеиновые кислоты (НК) деградируют с разной скоростью в разных тканях.
- Существует множество коммерческих наборов для выделения НК, различающихся по принципу работы (магнитные частицы, спин-колонки) и эффективности.
Что добавляют результаты исследования?
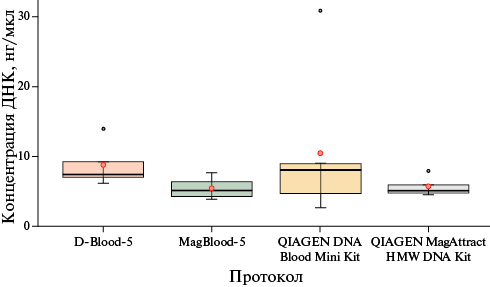
- Прямое сравнение 10 наборов на одном материале выявило лидеров: для крови — колоночные наборы от производителей Qiagen (Германия) и Биолабмикс (Россия), для тканей — наборы GM Tissue (Биолабмикс, Россия) (максимальный выход) и QIAamp DNA Mini Kit (Qiagen, Германия) (стабильность при автолизе).
- 24-часовой постмортальный интервал серьезно снижает количество и качество НК во всех тканях, кроме семенников. Наибольшая деградация рибонуклеиновой кислоты обнаружена в почках и мышцах.
Цель. Провести сравнительный анализ эффективности коммерческих наборов для выделения дезоксирибонуклеиновой кислоты (ДНК) из крови и тканей, а также рибонуклеиновой кислоты (РНК) из тканей мышей, и оценить влияние постмортального интервала (ПМИ) на качество и количество извлекаемых нуклеиновых кислот (НК).
Материал и методы. Использовали образцы крови и тканей (мозг, сердце, печень, почки, легкие, мышцы, семенники) 12 мышей линии Balb/C. Забор материала проводили сразу (0 ч) и через 24 ч после эвтаназии. Для выделения ДНК протестировали 10 коммерческих наборов (российских и зарубежных), для выделения РНК — набор RNeasy Mini Kit (Qiagen, Германия). Контроль качества включал измерение концентрации (флуориметрия), чистоты (спектрофотометрия) и целостности (электрофорез) НК.
Результаты. Наборы на основе спин-колонок (QIAamp DNA Blood Mini Kit, Qiagen, США, D-Blood-5) показали наивысший выход ДНК из крови. Для тканей наибольший выход ДНК обеспечили наборы на магнитных частицах (GM Tissue, Tissue M), но колоночный метод (QIAamp DNA Mini Kit, Qiagen, Германия) дал лучшие показатели чистоты и стабильности при увеличении ПМИ. Увеличение ПМИ до 24 ч привело к значительному снижению концентрации и целостности как ДНК, так и РНК во всех тканях, кроме семенников. Наиболее выраженная деградация РНК (падение индекса RIN (RNA integrity number, степень деградации РНК) до 2,5-2,8) наблюдалась в почках и мышцах.
Заключение. Эффективность выделения НК существенно зависит от типа набора, биоматериала и ПМИ. Выбор оптимального метода должен основываться на этих факторах. Полученные данные критически важны для планирования преаналитического этапа исследований.
Что известно о предмете исследования?
- В настоящее время малые некодирующие молекулы рибонуклеиновой кислоты (микроРНК) активно изучаются в качестве возможных биомаркеров различных заболеваний.
- Воспроизводимость результатов затруднена из-за различий в методах обработки биоматериала, типах образцов и отсутствия стандартизированных протоколов.
Что добавляют результаты исследования?
- Показано, что длительное хранение биообразцов может влиять на профиль циркулирующих микроРНК плазмы крови.
- Циркулирующие микроРНК более стабильны при хранении в плазме, чем в водном растворе.
Цель. Оценить влияние длительного хранения биобанкированных образцов плазмы крови на профиль циркулирующих малых некодирующих молекул рибонуклеиновой кислоты (микроРНК).
Материал и методы. В исследование были включены парные аликвоты плазмы крови 10 пациентов из коллекции биобанка ФГБУ "НМИЦ ТПМ" Минздрава России. Контрольную группу составили образцы микроРНК, выделенные через 1,5 года после получения плазмы и хранившиеся далее в водном растворе 3,5 года. В группе с длительным хранением плазмы микроРНК была выделена из второй аликвоты плазмы через 5 лет. Все образцы хранились при -70 оС. Секвенирование было выполнено для обеих групп одновременно на платформе NextSeq 550 (Illumina, США) по протоколу High Output 1×75 п.н.
Результаты. Анализ главных компонент на основании данных об уровне экспрессии генов микроРНК человека (версия ENCODE v47) показал разнородность изучаемых групп. В группе с длительным хранением плазмы по сравнению с контролем было выявлено статистически значимое снижение концентрации и размера библиотек, а также более чем двукратное повышение уровня экспрессии для 31 микроРНК.
Заключение. Циркулирующие микроРНК показали более высокую стабильность при хранении в плазме крови, чем в водном растворе. Полученные результаты указывают на необходимость учета времени хранения выделенной микроРНК наряду с другими преаналитическими факторами для повышения воспроизводимости исследований микроРНК.
Что известно о предмете исследования?
- Биобанкирование стало неотъемлемой частью современных медицинских и биологических исследований.
- Уровень осведомленности студентов медицинских вузов и ординаторов о принципах работы биобанков сегодня невысок, что не позволяет использовать их возможности в научной и клинической практике в полной мере.
Что добавляют результаты исследования?
- Формирование устойчивого интереса студентов медицинских вузов и ординаторов к прохождению модулей по биобанкированию, создание мотивационной базы, организация краткосрочных модулей как оптимального формата обучения обеспечивают определенный уровень погружения обучающихся в работу биобанков.
- Внедрение модулей по биобанкированию в образование студентов медицинских вузов и ординаторов повышает эффективность их профессиональной подготовки и способствует реализации научного потенциала обучающихся на основе использования биобанка как материальной, так и информационной базы.
Цель. Рассмотреть специфику внедрения образовательных модулей по биобанкированию на основе опыта проведения циклов ротации в лабораториях ФГБУ "НМИЦ эндокринологии им. акад. И. И. Дедова" Минздрава России для ординаторов 1 и 2 года обучения по специальностям "Эндокринология" и "Детская эндокринология", а также по результатам проведения дополнительного внеурочного модуля по биобанкированию на базе РНИМУ им. Н. И. Пирогова.
Материал и методы. Проведено ретроспективное исследование на двух базах. В ФГБУ "НМИЦ эндокринологии им. акад. И. И. Дедова" проанализированы результаты прохождения модуля "Биобанк" в рамках лабораторной ротации 75 ординаторов 1-2 года обучения (специальность "Эндокринология", "Детская эндокринология") за 2023-2025гг. На базе ФГАОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России изучены мотивация и результаты обучения 19 студентов 1 курса, выбравших дополнительный модуль "Основы биобанкирования". Использовались методы опроса, анализа проектных работ и статистические методы обработки аналитических данных.
Результаты. Установлен низкий исходный уровень осведомленности о биобанкировании в обеих группах. После прохождения модуля 100% участников сформировали нейтральное или позитивное отношение к биобанкированию. Выявлены ключевые мотивационные факторы: для ординаторов — карьерные перспективы (34,7% тех, кто прошли модуль, поступили в аспирантуру) и получение дополнительных баллов; для студентов — личный интерес к новым технологиям (89%) и возможность экскурсии в действующий биобанк. Краткосрочный модульный формат показал высокую эффективность для начального погружения в тему.
Заключение. Внедрение краткосрочных образовательных модулей по биобанкированию является эффективным инструментом повышения осведомленности и формирования позитивного отношения к биобанкам будущих медицинских специалистов. Успех внедрения зависит от учета специфики целевой аудитории: для ординаторов акцент должен быть на практическую и карьерную составляющую, для студентов — на инновационность и междисциплинарность. Полученные данные обосновывают необходимость дальнейшей интеграции основ биобанкирования в программы непрерывного медицинского образования.
ОБЗОР ЛИТЕРАТУРЫ
Что известно о предмете исследования?
- Трансплантация фекальной микробиоты — эффективный и безопасный метод лечения заболеваний, связанных с дисбиозом кишечника. Терапевтический банк фекальной микробиоты (БФМ) необходим для внедрения этой технологии.
Что добавляют результаты исследования?
- В обзоре литературы приведено обоснование целесообразности создания национальной сети БФМ с учетом мировой и российской нормативно-правовой практики, существующих ресурсов здравоохранения при участии профильных общественных организаций. Широкое региональное разнообразие микробиома позволяет рассчитывать на выявление "супердоноров", внедрение персонализированной трансплантации фекальной микробиоты на основе поддержки принятия врачебных решений. Внедрение сети БФМ увеличивает возможности метагеномной регуляции здоровья человека в Российской Федерации.
Трансплантация фекальной микробиоты (ТФМ) — эффективный и безопасный метод лечения рецидивирующей инфекции, вызванной Clostridioides difficile находит все более широкое применение для лечения заболеваний, патогенетически связанных с дисбиозом кишечника. Мировые потребности в данном методе лечения покрыты лишь на 10%. Растущая популярность метода делает необходимым создание терапевтических банков фекальной микробиоты (БФМ), поскольку они обеспечивают доступность тщательно проверенных фекальных суспензий, полученных от здоровых доноров. В обзорной статье анализируются подходы к созданию БФМ с учетом законодательной базы Российской Федерации (РФ), сопоставленной с нормативами, действующими в странах Северной Америки, Европы, Азиатско-Тихоокеанского региона. Рассматриваются 4 нормативно-правовых стратегии применительно к ТФМ, определяющие перспективы биобанкирования: 1) лекарственное средство; 2) биологический препарат; 3) субстанция человеческого происхождения; 4) медицинская практика. Аргументирована целесообразность внедрения в РФ подхода, практикуемого в Китайской народной республике (ТФМ как медицинская практика) и в Европейском Союзе (ТФМ — как применение субстанции человеческого происхождения). Формированию сети БФМ будет способствовать внедрение в национальном масштабе стандартизированной технологии сбора, процессинга донорского материала, хранения и выдачи препарата для ТФМ. Региональные БФМ могут быть развернуты на базе лечебно-научных учреждений, а также производственных аптек. Клинико-лабораторное профилирование донора и реципиента, включая метагеномный анализ, в национальной базе данных позволит создать систему поддержки принятия врачебных решений, повысить эффективность и безопасность ТФМ для коррекции широкого круга патологии, включая экстраинтестинальные процессы. Развитие системы БФМ на национальном уровне потребует координации усилий профильных общественных организаций (при ведущей роли НАСБИО — Национальная ассоциация биобанков и специалистов по биобанкированию) и федеральных органов исполнительной власти, среди которых Федеральное медико-биологическое агентство располагает наибольшим опытом применения ТФМ и необходимой нормативной базой. Неоспоримым преимуществом развертывания российской национальной сети БФМ является широкое региональное разнообразие микробиома, что позволяет рассчитывать на выявление "супердоноров" в комплексе с внедрением персонализированной ТФМ. Созданы предпосылки к ускоренному продвижению в области метагеномной регуляции здоровья человека, и сеть БФМ — один из инструментов реализации национальной прорывной технологии.
ISSN 2619-0125 (Online)